Comparison of non-contrast magnetic resonance perfusion and phase-contrast angiography for the quantitative assessment of cerebral blood flow: a prospective cross-sectional study
- Autores: Popov V.V.1,2, Stankevich Y.A.1,2, Bogomyakova O.B.1,2, Tulupov A.A.1,2
-
Afiliações:
- International Tomography Institute, Siberian Branch of the Russian Academy of Sciences
- Novosibirsk State University
- Edição: Volume 6, Nº 2 (2025)
- Páginas: 203-213
- Seção: Original Study Articles
- ##submission.dateSubmitted##: 03.10.2024
- ##submission.dateAccepted##: 23.12.2024
- ##submission.datePublished##: 08.07.2025
- URL: https://jdigitaldiagnostics.com/DD/article/view/636690
- DOI: https://doi.org/10.17816/DD636690
- EDN: https://elibrary.ru/MHMUYW
- ID: 636690
Citar
Texto integral
Resumo
BACKGROUND: The validation of quantitative cerebral blood flow assessment using non-contrast magnetic resonance imaging remains unresolved. The optimal approach involves applying a method based on a different physiological model to enhance the reliability of the obtained data.
AIM: To verify the results of quantitative cerebral tissue blood flow assessment using non-contrast MRI against quantitative 2D phase-contrast angiography in healthy adults.
METHODS: The prospective study enrolled healthy adults (aged 18–75 years). Cerebral perfusion was assessed using non-contrast magnetic resonance imaging, while macrovascular blood flow was measured in the vertebral and internal carotid arteries using quantitative 2D phase-contrast angiography. Brain volume and relative mass were evaluated based on T1-weighted image segmentation. Macrovascular blood flow values were converted into tissue perfusion metrics through mathematical adjustment accounting for brain mass.
RESULTS: In the study 80 adults were examined using both methods. Non-contrast magnetic resonance imaging revealed mean perfusion values of 17.88 ± 2.39 mL/100g/min in white matter and 42.06 ± 7.13 mL/100g/min in gray matter, with total cerebral perfusion at 59.63 ± 8.56 mL/100g/min. Total cerebral perfusion calculated from phase-contrast angiography and arterial blood flow velocity was 58.96 ± 8.16 mL/s. A strong positive correlation was found between total cerebral perfusion values derived from non-contrast magnetic-resonance and phase-contrast angiography (r = 0.892; p < 0.001).
CONCLUSION: A strong positive correlation was demonstrated between cerebral perfusion values obtained via non-contrast magnetic resonance imaging and phase-contrast angiography, despite their reliance on distinct physiological models.
Texto integral
ОБОСНОВАНИЕ
Маркирование артериальных спинов (Arterial Spin Labeling, ASL) является бесконтрастным методом перфузионной магнитно-резонансной томографии (МРТ), который позволяет количественно определять и визуализировать церебральный кровоток (Cerebral Blood Flow, CBF). Преимущества метода — неинвазивность и отсутствие необходимости в контрастировании, что особенно важно для динамического наблюдения [1, 2]. В числе недостатков метода — низкое пространственное разрешение, длительность сканирования (около 5 мин), зависимость от однородности магнитного поля, состояния сердечно-сосудистой системы пациента, а также чувствительность к артефактам, обусловленным движениями и наличием металлоконструкций [3, 4]. Количественная оценка требует дополнительной постобработки данных. На основании современных исследований [1, 5] мы предложили алгоритм для расчёта параметров перфузии головного мозга [6].
Бесконтрастную перфузионную МРТ широко используют в диагностике ишемических поражений головного мозга [7, 8], демиелинизирующих заболеваний [9], новообразований [10], эпилепсии [11], мигрени [12], гидроцефалии [13]. Однако современные перфузионные контрастные и бесконтрастные последовательности основаны на схожих физиологических моделях оценки тканевой перфузии и свойствах экзо- и эндогенных контрастных агентов. Это может приводить к ошибкам, связанным с одинаковыми принципами сбора и интерпретации данных [14]. Результаты перфузионных методов в значительной степени зависят от технических и методологических параметров измерения. Особенности постобработки, а также отсутствие возможности определения количественных значений непосредственно на томографе у некоторых производителей обусловливают необходимость верификации получаемых параметров. Одним из следствий этих ограничений является широкий диапазон значений нормальной перфузии в сером (от 40 до 60 мл/100г/мин) и белом веществе (15–20 мл/100г/мин) головного мозга по данным различных исследований [1, 15].
Среди неинвазивных методов оценки церебрального кровотока заслуживает внимание подход, основанный на расчёте магистрального кровотока с последующим математическим преобразованием. 2D фазово-контрастная ангиография (ФКА) обеспечивает количественное измерение кровотока в целевых сосудах с подбором параметров пиковой скорости. Её преимущество заключается в быстром получении данных (менее 4 мин) и простоте постобработки, что обусловило широкое применение метода для количественной оценки магистрального кровотока [16, 17], а также в кардиоваскулярной МРТ [18, 19]. Измерение скорости потока с помощью ФКА проводят по данным градиентов фазового кодирования, а достоверность получаемых результатов продемонстрирована в модельном эксперименте. Последовательность ФКА основана на другой физиологической модели, отличной от ASL, что позволяет верифицировать количественные оценки перфузии путём измерения скоростных показателей магистрального кровотока с учётом объёмно-весовых характеристик головного мозга [20].
ЦЕЛЬ
Верифицировать количественную оценку церебрального кровотока методом ASL-МРТ по данным 2D ФКА у здоровых взрослых.
МЕТОДЫ
Дизайн исследования
Проведено одноцентровое проспективное одномоментное исследование.
Условия проведения
Работа выполнена в лаборатории функциональной нейровизуализации Международного томографического центра Сибирского отделения Российской академии наук (Новосибирск, Россия). Набор добровольцев, соответствующих критериям включения, осуществляли с июня 2023 по август 2024 г.
Критерии соответствия
Критерии включения:
- возраст от 18 до 75 лет;
- отсутствие объёмно-очаговой патологии головного мозга по данным структурной МРТ (допускали наличие единичных хронических дисциркуляторных очагов);
- отсутствие гемодинамически значимых стенозов магистральных артерий шеи по данным 3D времяпролётной магнитно-резонансной ангиографии (TOF-MRA);
- отсутствие клинических симптомов и неврологического дефицита;
- отсутствие острых сосудистых событий в анамнезе, включая гипертонические кризы, ишемические/ геморрагические инсульты, внутричерепные кровоизлияния, травматические проявления.
Критерии невключения: визуализируемые немногочисленные/множественные очаги и/или объёмная патология по данным рутинного протокола.
Критерии исключения: технически неудовлетворительные результаты визуализации и количественной оценки церебральной перфузии и магистрального кровотока (включая этапы постобработки данных).
Бесконтрастная перфузионная магнитно-резонансная томография
Для проведения исследования использовали магнитно-резонансный томограф с напряжённостью магнитного поля 3,0 Тл Ingenia® (Phillips, Нидерланды), применяя рутинный протокол сканирования [T1-взвешенное изображение (ВИ), T2-ВИ, трёхмерное инверсионновосстановленное изображение с подавлением сигнала от жидкости (3D-FLAIR), TOF-MRA] для оценки структурной морфологии головного мозга. Интерпретация полученных данных каждого пациента выполнена однократно двумя квалифицированными врачами-рентгенологами (стаж работы в области нейрорадиологии более 10 лет), имевшими доступ ко всей клинической информации, предусмотренной протоколом исследования (жалобы, анамнез, результаты рутинной МРТ).
Для оценки церебральной тканевой перфузии выполнена последовательность псевдонепрерывное ASL (pCASL) со следующими характеристиками:
- поле зрения (Field of View, FOV) — 240×240×99 мм;
- время повторения (Time Repetition, TR) — 4550 мс;
- время эхо (Time Echo, TE) — 16 мс;
- длительность мечения (Labeling Duration, LD) — 1800 мс;
- задержка после мечения (Postlabeling Delay, PLD) — 1800 мс.
Область визуализации ориентирована в аксиальной проекции по длинной оси мозолистого тела с захватом больших полушарий головного мозга. Область маркирования установлена параллельно предыдущей, перпендикулярно ходу шейных сегментов магистральных артерий, на расстоянии 90 мм от нижнего края FOV с учётом индивидуальных анатомических особенностей сосудов пациента по данным 3D TOF-MRA. Построение карт церебральной перфузии осуществляли в программе FSL® (BASIL, Великобритания) на основе загруженных нативных изображений путём субтракции контрольных и меченных кадров с учётом параметров сканирования. Затем выполняли калибровку по протонной плотности (TR и TE — 4550 и 13 мс соответственно) и реслайсинг полученных изображений с программной коррекцией движений. Последним этапом проведена автоматическая частичная объёмная коррекция границ серого и белого вещества головного мозга по данным Т1-ВИ для сегментации и подсчёта его перфузии. Результатом обработки стала карта церебральной перфузии и количественные показатели церебрального кровотока (Cerebral Blood Flow ASL, CBF-ASL) [6]. Усреднение значений выполнено по вокселям отдельно для белого и серого вещества в пределах одного среза для каждого пациента.
2D фазово-контрастная ангиография
Исследование проведено с использованием магнитно-резонансного томографа с напряжённостью магнитного поля 3,0 Тл Ingenia® (Phillips, Нидерланды). Для оценки магистрального церебрального кровотока выполнена последовательность ФКА со следующими характеристиками:
- FOV — 150×101 мм;
- TR — 9,1 мс;
- TE — 5,4 мс;
- количество накоплений сигнала (Number of Signal Acquisitions, NSA) — 2;
- кодировка скорости потока (Velocity Encoding, VE) — 100 см/с;
- ретроспективная кардиосинхронизация в 15 фазах.
Область сканирования ориентирована перпендикулярно ходу шейных сегментов внутренних сонных (СI-сегменты по Bouthillier) и позвоночных артерий (VII-сегменты). Обработку проводили в программном обеспечении производителя томографа путём ручного выделения области интереса вдоль границы внутреннего контура сосудов с получением значений объёмной скорости кровотока (мл/с) в просвете позвоночных и внутренних сонных артерий.
Для оценки объёма и массы головного мозга выполнена трёхмерная T1-взвешенная последовательность с использованием технологии Turbo Field Echo (3D T1-TFE) со следующими параметрами:
- FOV — 250×250 мм;
- TR — 7,6 мс;
- TE — 3,7 мс;
- воксель — 1×1×2 мм;
- NSA — 2.
Путём сегментации и нормализации Т1-ВИ (3D T1-TFE) проведена оценка объёма и массы головного мозга в программе FSLanat® (BASIL, Великобритания) с учётом физиологической константы плотности мозга (1,045 г/см3) [28, 29]. Для расчёта общей церебральной перфузии по данным ФКА (CBF-ФКА) мы предлагаем следующую формулу, основанную на математическом преобразовании значений объёмной скорости кровотока (мл/с) с учётом константы плотности (г/см3) мозга:
,
где 6000 — коэффициент перевода из мл/г/с в мл/100г/мин; ICAr, ICAl — значения объёмной скорости потока в правой и левой внутренней сонной артерии, мл/с; VAr, VAl — значения объёмной скорости потока в правой и левой позвоночной артерии, мл/с; 1,045 — физиологическая плотность мозга, г/см3; V — объём головного мозга по данным сегментации, мм3.
Целевой показатель исследования
Верификация количественной оценки церебрального тканевого кровотока методом ASL проведена путём сравнения значений перфузии, полученных с использованием pCASL, с результатами, рассчитанными на основе объёмной скорости кровотока, измеренной с помощью ФКА.
Анализ чувствительности
Выполнен анализ чувствительности разницы значений перфузионного кровотока, определённого по данным ASL и ФКА, к факторам возраста, пола, объёма мозга.
Этическая экспертиза
Проведение исследования одобрено локальным этическим комитетом Международного томографического центра Сибирского отделения Российской академии наук (протокол № 37 от 22.04.2024). От пациентов получали письменное информированное добровольное согласие на участие в исследовании.
Статистический анализ
Принципы расчёта размера выборки: размер выборки при планировании исследования не рассчитывали.
Методы статистического анализа данных. Анализ данных выполнен с использованием пакета статистических программ STATISTICA®, версия 10.0 (StatSoft Inc., Соединённые Штаты Америки). Характер распределения значений количественных показателей определяли с помощью критерия Колмогорова–Смирнова и Шапиро–Уилка (по двум критериям соответственно — pCASL: p >0,2; ФКА: p >0,2), а также построением нормальных вероятностных графиков (значения располагались вдоль теоретической нормальной прямой) и гистограмм. Результаты представлены в виде M±SD, где M — среднее арифметическое, SD — стандартное отклонение. Для сравнения количественных показателей в группах применяли t-критерий Стьюдента для парных (связанных) групп, для анализа связей — корреляционный анализ с расчётом коэффициента корреляции Пирсона (r). Для анализа чувствительности и оценки ассоциации факторов пол, возраст и объём мозга (независимые переменные) с разницей значений церебральной перфузии CBF-ASL и CBF-ФКА (зависимая переменная) использовали метод многофакторной линейной регрессии. Статистически значимыми считали различия и связи при p <0,05.
РЕЗУЛЬТАТЫ
Формирование выборки исследования
Для плановой диспансеризации обратились 86 человек, после приглашения в исследование они согласились и подписали информированное добровольное согласие на участие. На основании результатов структурной МРТ и TOF-MRA включены в исследование 83 человека (три участника исключены по причине обнаружения разнокалиберных хронических дисциркуляторных очагов в структуре больших полушарий головного мозга). Обследование с применением ASL и ФКА прошли 80 человек, технически неудовлетворительными признаны результаты постобработки данных церебральной и магистральной перфузии у трёх участников. Таким образом, анализ данных в соответствии с запланированной целью исследования выполнен для 80 человек. Средний возраст участников исследования — 38,7±16,5 года (женщины — 50%).
Основные результаты исследования
Значения церебральной перфузии по данным ASL составили:
- белое вещество головного мозга — 17,8±2,3 мл/100г/мин;
- серое вещество — 42,1±7,1 мл/100г/мин;
- общая перфузия (CBF-ASL) — 59,6±8,6 мл/100г/мин.
По данным ФКА значения объёмной скорости потока:
- в правых и левых внутренних сонных артериях составили 3,8±0,7 и 3,7±0,8 мл/с соответственно (p=0,497);
- в правых и левых позвоночных артериях — 1,5±0,6 и 1,6±0,6 мл/с соответственно (p=0,487).
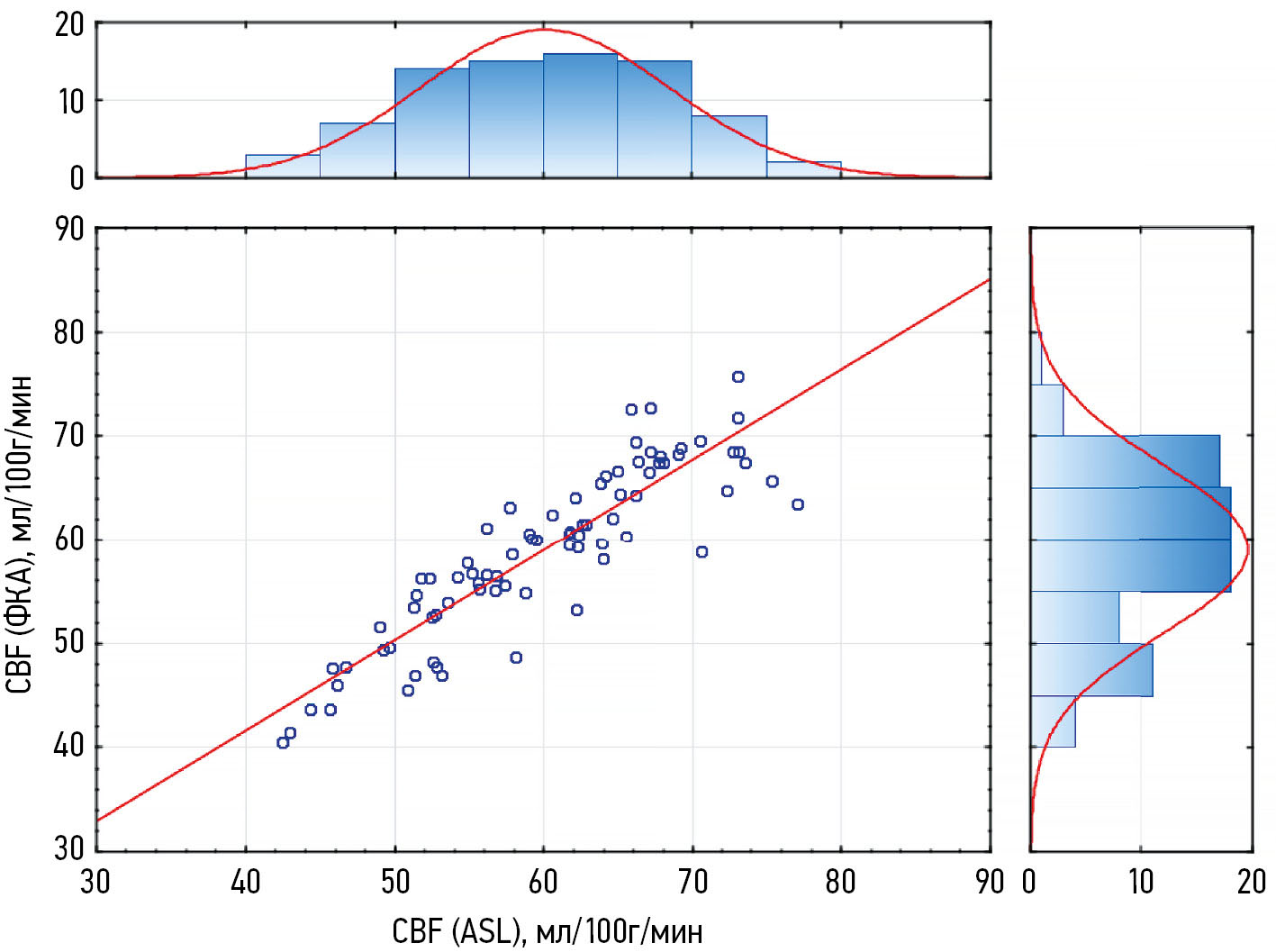
Путём сегментации Т1-ВИ получены значения объёма — 1070,9±103,0 cм3 и массы вещества головного мозга — 1119,1±107,7 г. С учётом показателей массы мозга по данным объёмного кровотока во внутренних сонных и позвоночных артериях вычислено скорректированное значение перфузии головного мозга (CBF-ФКА), которое составило 59,0±8,2 мл/100г/мин. По данным корреляционного анализа определена сильная положительная корреляция между значениями CBF-ASL и CBF-ФКА (рис. 1).
Рис. 1. Корреляция показателей общей церебральной перфузии по данным бесконтрастной перфузионной магнитно-резонансной томографии и фазово-контрастной ангиографии (r=0,839, p <0,001). Гистограммы сверху и справа — распределение количества наблюдений значений церебральной перфузии CBF-ASL и CBF-ФКА соответственно. ФКА — фазово-контрастная ангиография; ASL (Arterial Spin Labeling) — маркирование артериальных спинов; CBF (Cerebral Blood Flow) — общая церебральная перфузия.
Анализ чувствительности
Разность показателей CBF-ASL и CBF-ФКА составила 1,2 мл/100г/мин (95% ДИ: 0,87–1,61) (рис. 2). Выявлена статистически значимая отрицательная корреляция разности показателей CBF-ASL и CBF-ФКА с возрастом (c малой величиной эффекта R2=0,09; рис. 3) и положительная с объёмом головного мозга (R2=0,09; рис. 4). Сравнение разницы значений CBF-ASL и CBF-ФКА в группах разного пола не выявило статистически значимых различий [t (158)=−1,20, p=0,230]. Проверка равенства дисперсий (F=58,60, p <0,001) подтвердила гетерогенность, что учтено в анализе. По данным многофакторной линейной регрессии большая разница между показателями церебральной перфузии CBF-ASL и CBF-ФКА ассоциирована с женским полом (p=0,014) и увеличенным объёмом головного мозга (p=0,016), тогда как влияние возраста статистически незначимое (p=0,347).
Рис. 2. Распределение разности значений церебральной перфузии по данным бесконтрастной перфузионной магнитно-резонансной томографии и фазово-контрастной ангиографии. ФКА — фазово-контрастная ангиография; ASL (Arterial Spin Labeling) — маркирование артериальных спинов; CBF (Cerebral Blood Flow) — общая церебральная перфузия.
Рис. 3. Корреляция возраста и разности значений церебральной перфузии по данным бесконтрастной перфузионной магнитно-резонансной томографии и фазово-контрастной ангиографии (r=−0,300, p=0,007). ФКА — фазово-контрастная ангиография; ASL (Arterial Spin Labeling) — маркирование артериальных спинов; CBF (Cerebral Blood Flow) — общая церебральная перфузия.
Рис. 4. Корреляция объёма головного мозга и разности значений церебральной перфузии по данным бесконтрастной перфузионной магнитно-резонансной томографии и фазово-контрастной ангиографии (r=0,300, p=0,007). ФКА — фазово-контрастная ангиография; ASL (Arterial Spin Labeling) — маркирование артериальных спинов; CBF (Cerebral Blood Flow) — общая церебральная перфузия.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Установлена сильная положительная корреляция между значениями церебрального тканевого кровотока, полученными посредством измерения перфузии с помощью бесконтрастной перфузионной МРТ и вычисленными на основе прямого измерения объёмной скорости кровотока в просвете магистральных брахицефальных артерий методом количественной ФКА с учётом индивидуального объёма и константы плотности мозга.
Обсуждение основного результата исследования
Бесконтрастная магнитно-резонансная перфузия является ценным неинвазивным методом, позволяющим трактовать состояние микроциркуляторного русла. Несмотря на сложность получения и интерпретации количественных показателей, метод ASL можно успешно применять для диагностики различных патологических состояний [21], обеспечивая сопоставимую точностью с контрастными магнитно-резонансными и компьютерно-томографическими перфузионными исследованиями [22, 23]. Существующие кинетические и математические модели инвазивных перфузионных методов диагностики, применяемых для верификации данных ASL, основаны на аналогичных алгоритмах обработки, включающих последовательное вычитание нативных и постконтрастных изображений с последующим построением качественных или количественных перфузионных карт. В связи с этим подтверждение результатов ASL с использованием альтернативного методологического подхода, основанного на другой физиологической модели оценки тканевой перфузии, является актуальной задачей [24, 25]. Кроме этого, необходимо проводить калибровку метода ASL в контрольной группе для учёта его технических аспектов и вариабельности [26]. Именно поэтому в настоящем исследовании для верификации данных ASL выбрана и проанализирована отличная от предыдущих модель расчёта перфузии, основанная на прижизненной оценке объёмно-весовых показателей головного мозга путём сегментации Т1-ВИ и расчёта объёмной скорости кровотока в магистральных артериях шеи методом ФКА. Его считают надёжным для оценки кровотока, а следовательно — состояния сердечно-сосудистой системы и ликвородинамики [33], позволяя получать достоверные качественные и количественные результаты [34], подтверждённые в том числе и модельными экспериментами [35, 36].
В зарубежной литературе [37, 38] представлено лишь несколько исследовательских работ, где параллельно изучали результаты количественной оценки перфузии головного мозга с применением методов ASL и ФКА.
В нашем исследовании выявлена сильная положительная корреляция между показателями перфузии, полученными с использованием различных методологических последовательностей, что подтверждает надёжность результатов и обосновывает целесообразность применения ранее разработанного алгоритма оценки перфузии головного мозга [6] в клинической практике и научных исследованиях. Кроме того, продемонстрирована возможность использования количественной ФКА для косвенной характеристики кровоснабжения головного мозга.
Анализ устойчивости полученных данных выявил зависимость расхождения между оценками церебральной тканевой перфузии, выполненными разными методами, от объёма головного мозга. Это может быть связано с парциальным объёмным эффектом ASL в отдельных структурах [39], а также с неодинаковой чувствительностью используемых методов к васкуляризации разных объёмов головного мозга [40]. Кроме того, многофакторный анализ показал, что пол участников ассоциирован со степенью несоответствия между количественными оценками церебральной перфузии: у мужчин меньшая разница между значениями CBF-ASL и CBF-ФКА, что может быть связано как с половыми особенностями ангиоархитектоники головного мозга [41], так и с методическими аспектами измерений [42]. Связь между возрастом и различиями в оценке церебральной тканевой перфузии не подтвердили при учёте объёма головного мозга, что свидетельствует об опосредованном влиянии через анатомические возрастные изменения [43], что подчёркивает необходимость контроля вмешивающихся факторов.
Ограничения исследования
Ограничения, связанные с методом контроля
Исследователи отмечают, что бесконтрастная оценка перфузии по данным ФКА является экспериментальной областью из-за трудностей в расчёте объёма, плотности и массы мозга человека, на которые приходится определённый объём кровотока в секунду [44]. Кроме того, возникают сложности при дальнейшей интерпретации регионарных значений CBF, поскольку распределение кровотока по конкретным областям головного мозга неравномерное как по времени, так и по объёму, а микроциркуляторные модельные взаимодействия пока продолжают изучать.
Ограничения, связанные с выборкой исследования
Настоящее исследование имеет определённые ограничения в отношении применения полученных количественных показателей мозговой перфузии. Выборка не является представительной, поэтому её невозможно экстраполировать на генеральную совокупность. Ограничением также является отсутствие в выборке участников в возрасте 30–40 лет, что связано с техническими особенностями набора исследуемых из числа сотрудников и преподавателей учреждения. Это также может влиять на интерпретацию возрастных изменений перфузии и ограничивает экстраполяцию результатов на средневозрастную популяцию.
Ограничения, связанные с методами измерения
Надёжность результатов, полученных при сегментации Т1-ВИ для оценки объёмно-весовых показателей головного мозга, определяется используемыми алгоритмами предобработки, методами обработки, а также применяемым значением константы плотности мозга. Высокая вариабельность между методами указывает на снижение точности количественных оценок.
Ограничения, связанные с интерпретацией
Интерпретация результатов отдельных участников выполнена только одним специалистом. Кроме того, они информированы о результатах, полученных обоими методами.
ЗАКЛЮЧЕНИЕ
Установлена положительная сильная корреляционная связь между показателями церебральной перфузии, полученными методом ASL, и расчётными значениями, основанными на объёмной скорости магистрального кровотока по данным ФКА. Учитывая, что применяемые методы основаны на различных физиологических моделях, полученные результаты уточняют значения перфузии головного мозга, приблизив их к истинным, и открывают возможность выбора подхода в зависимости от клинической ситуации, доступности оборудования или предпочтений исследователя.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Вклад авторов. В.В. Попов — проведение магнитно-резонансной томографии, интерпретация данных исследования, написание и редактирование текста рукописи; Ю.А. Станкевич — расшифровка томограмм с формированием заключений, интерпретация данных исследования, написание и редактирование текста рукописи; О.Б. Богомякова — расшифровка томограмм с формированием заключений, интерпретация данных исследования, редактирование текста рукописи; А.А. Тулупов — интерпретация данных исследования, редактирование текста рукописи. Все авторы одобрили рукопись (версию для публикации), а также согласились нести ответственность за все аспекты настоящей работы, гарантируя надлежащее рассмотрение и решение вопросов, связанных с точностью и добросовестностью любой её части.
Этическая экспертиза. Проведение исследования одобрено локальным этическим комитетом Международного томографического центра Сибирского отделения Российской академии наук (протокол № 37 от 22.04.2024). Все пациенты подписали форму письменного информированного добровольного согласия на участие в исследовании.
Источники финансирования. Исследование проведено при финансовой поддержке Минобрнауки России (государственное задание: 1023110800234-5-3.2.25;3.1.4;3.2.12, «Изучение процессов постинсультной структурно-функциональной реорганизации головного мозга современными методами нейровизуализации») на основании конкурса по созданию молодёжной лаборатории (ответственный исполнитель: Международный томографический Центр Сибирское отделение Российской академии наук).
Раскрытие интересов. Авторы заявляют об отсутствии отношений, деятельности и интересов за последние три года, связанных с третьими лицами (коммерческими и некоммерческими), интересы которых могут быть затронуты содержанием статьи.
Оригинальность. В настоящей работе использованы данные (результаты оценки церебрального кровотока по методу ASL) 20 человек, впервые полученные и проанализированные как характеристики контрольной группы в нашем ранее опубликованном исследовании (Попов В.В. и соавт., 2024; https://doi.org/10.18699/SSMJ20240622).
Доступ к данным. Редакционная политика в отношении совместного использования данных к настоящей работе не применима.
Генеративный искусственный интеллект. При создании настоящей статьи технологии генеративного искусственного интеллекта не использовали.
Рассмотрение и рецензирование. Настоящая работа подана в журнал в инициативном порядке и рассмотрена в соответствии с процедурой fast-track. В рецензировании участвовали два внешних рецензента и научный редактор издания.
ADDITIONAL INFORMATION
Author contributions: V.V. Popov: magnetic resonance imaging, data interpretation, writing—original draft, writing—review & editing; Yu.A. Stankevich: image reading and report generation, data interpretation, writing— original draft, writing—review & editing; O.B. Bogomyakova: image reading and report generation, data interpretation, writing—review & editing; A.A. Tulupov: data interpretation, writing— review & editing. All the authors approved the version of the manuscript to be published and agreed to be accountable for all aspects of the work, ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Ethics approval: The study was approved by the Local Ethics Committee of the International Tomography Center, Siberian Branch of the Russian Academy of Sciences (Protocol No. 37 dated April 22, 2024). All patients provided written informed consent to participate in the study.
Funding sources: The study was supported by the Ministry of Science and Higher Education of the Russian Federation (State Assignment No. 1023110800234-5-3.2.25; 3.1.4; 3.2.12, Investigation of Post-Stroke Structural and Functional Brain Reorganization Using Advanced Neuroimaging Methods) as part of a grant competition for the establishment of a youth laboratory. The responsible institution is the International Tomography Center, Siberian Branch of the Russian Academy of Sciences.
Disclosure of interests: The authors have no relationships, activities, or interests for the last three years related to for-profit or not-for-profit third parties whose interests may be affected by the content of the article.
Statement of originality: This study includes ASL-based cerebral blood flow data from 20 individuals, which were originally obtained and analyzed as control group characteristics in our previously published work (Popov V.V. et al., 2024; https://doi.org/10.18699/SSMJ20240622).
Data availability statement: The editorial policy regarding data sharing does not apply to this work.
Generative AI: No generative artificial intelligence technologies were used to prepare this article.
Provenance and peer review: This paper was submitted unsolicited and reviewed following the fast-track procedure. The peer review process involved two external reviewers and the in-house science editor.
Sobre autores
Vladimir Popov
International Tomography Institute, Siberian Branch of the Russian Academy of Sciences; Novosibirsk State University
Autor responsável pela correspondência
Email: popov.v@tomo.nsc.ru
ORCID ID: 0000-0003-3082-2315
Código SPIN: 5473-0707
MD
Rússia, 3a Institutskaya st, unit 1, Novosibirsk, 630090; NovosibirskYuliya Stankevich
International Tomography Institute, Siberian Branch of the Russian Academy of Sciences; Novosibirsk State University
Email: stankevich@tomo.nsc.ru
ORCID ID: 0000-0002-7959-5160
Código SPIN: 6668-5010
MD, Cand. Sci (Medicine)
Rússia, 3a Institutskaya st, unit 1, Novosibirsk, 630090; NovosibirskOlga Bogomyakova
International Tomography Institute, Siberian Branch of the Russian Academy of Sciences; Novosibirsk State University
Email: bogom_o@tomo.nsc.ru
ORCID ID: 0000-0002-8880-100X
Código SPIN: 9172-6975
MD, Cand. Sci (Medicine)
Rússia, 3a Institutskaya st, unit 1, Novosibirsk, 630090; NovosibirskAndrey Tulupov
International Tomography Institute, Siberian Branch of the Russian Academy of Sciences; Novosibirsk State University
Email: taa@tomo.nsc.ru
ORCID ID: 0000-0002-1277-4113
Código SPIN: 6630-8720
MD, Dr. Sci (Medicine), Professor, Corresponding Member of the Russian Academy of Sciences
Rússia, 3a Institutskaya st, unit 1, Novosibirsk, 630090; NovosibirskBibliografia
- Clement P, Petr J, Dijsselhof MBJ, et al. A Beginner's guide to arterial spin labeling (ASL) image processing. Frontiers in Radiology. 2022;2:929533. doi: 10.3389/fradi.2022.929533 EDN: XFALAS
- Alsop DC, Detre JA, Golay X, et al. Recommended implementation of arterial spin-labeled perfusion MRI for clinical applications: A consensus of the ISMRM perfusion study group and the European consortium for ASL in dementia. Magnetic Resonance in Medicine. 2014;73(1):102–116. doi: 10.1002/mrm.25197
- Taso M, Alsop DC. Arterial spin labeling perfusion imaging. Magnetic Resonance Imaging Clinics of North America. 2024;32(1):63–72. doi: 10.1016/j.mric.2023.08.005EDN: CHWZYK
- Bambach S, Smith M, Morris PP, et al. Arterial spin labeling applications in pediatric and adult neurologic disorders. Journal of Magnetic Resonance Imaging. 2020;55(3):698–719. doi: 10.1002/jmri.27438 EDN: ROGQRS
- Grade M, Hernandez Tamames JA, Pizzini FB, et al. A neuroradiologist’s guide to arterial spin labeling MRI in clinical practice. Neuroradiology. 2015;57(12):1181–1202. doi: 10.1007/s00234-015-1571-z EDN: RHMHQB
- Stankevich YuA, Popov VV, Vasilkiv LM, Tulupov AA. Dynamic assessment of cerebral perfusion blood flow in the early post-stroke period according to non-contrast MRI data. Complex Issues of Cardiovascular Diseases. 2024;13(1):28–35. doi: 10.17802/2306-1278-2024-13-1-28-35 EDN: YAUMMJ
- Yu S, Ma SJ, Liebeskind DS, et al. ASPECTS-based reperfusion status on arterial spin labeling is associated with clinical outcome in acute ischemic stroke patients. Journal of Cerebral Blood Flow & Metabolism. 2017;38(3):382–392. doi: 10.1177/0271678X17697339
- Lyu J, Duan Q, Xiao S, et al. Arterial spin labeling-based MRI estimation of penumbral tissue in acute ischemic stroke. Journal of Magnetic Resonance Imaging. 2022;57(4):1241–1247. doi: 10.1002/jmri.28364 EDN: GRHNQP
- de la Peña MJ, Peña IC, García PG, et al. Early perfusion changes in multiple sclerosis patients as assessed by MRI using arterial spin labeling. Acta Radiol Open. 2019;8(12):2058460119894214. doi: 10.1177/2058460119894214
- Teunissen WHT, Lavrova A, van den Bent M, et al. Arterial spin labelling MRI for brain tumour surveillance: do we really need cerebral blood flow maps? European Radiology. 2023;33(11):8005–8013. doi: 10.1007/s00330-023-10099-z EDN: RCZRAW
- Ngo A, Royer J, Rodriguez-Cruces R, et al. Associations of cerebral blood flow patterns with gray and white matter structure in patients with temporal lobe epilepsy. Neurology. 2024;103(3):e209528. doi: 10.1212/wnl.0000000000209528 EDN: SYGUCB
- Russo A, Silvestro M, Tessitore A, et al. Arterial spin labeling MRI applied to migraine: current insights and future perspectives. The Journal of Headache and Pain. 2023;24(1):71. doi: 10.1186/s10194-023-01597-y EDN: THDPOT
- Xiao Y, Chen S, Zhang Z, et al. Three-dimensional pseudocontinuous arterial spin labeling with dual postlabeling delay for reflecting cerebral blood flow regulation in patients with hydrocephalus: a retrospective cross-sectional study. Quantitative Imaging in Medicine and Surgery. 2024;14(8):5861–5876. doi: 10.21037/qims-24-151 EDN: LISIGE
- Kamphuis ME, Greuter MJW, Slart RHJA, Slump CH. Quantitative imaging: systematic review of perfusion/flow phantoms. European Radiology Experimental. 2020;4(1):15. doi: 10.1186/s41747-019-0133-2 EDN: DTOLUK
- Alisch JSR, Khattar N, Kim RW, et al. Sex and age-related differences in cerebral blood flow investigated using pseudo-continuous arterial spin labeling magnetic resonance imaging. Aging. 2021;13(4):4911–4925. doi: 10.18632/aging.202673 EDN: SGOKGS
- Stankevich Y, Rezakova M, Bogomyakova O, et al. Hemodynamic effects of pathological tortuosity of the internal carotid arteries based on MRI and ultrasound studies. Applied Magnetic Resonance. 2015;46(10):1109–1120. doi: 10.1007/s00723-015-0708-x EDN: UZZHGV
- Stankevich Y, Rezakova M, Olga B, et al. Hemodynamic effects of the carotid abnormalities courses by MRI and ultrasound. Journal of Cardiovascular Magnetic Resonance. 2015;17:P415. doi: 10.1186/1532-429X-17-S1-P415 EDN: UFUKFJ
- Daftari Besheli L, Ahmed A, Hamam O, et al. Arterial spin labeling technique and clinical applications of the intracranial compartment in stroke and stroke mimics - a case-based review. The Neuroradiology Journal. 2022;35(4):437–453. doi: 10.1177/19714009221098806 EDN: KSTCGN
- Azarine A, Garçon P, Stansal A, et al. Four-dimensional flow MRI: principles and cardiovascular applications. RadioGraphics. 2019;39(3):632–648. doi: 10.1148/rg.2019180091
- Boiko AV, Akulov AE, Chupakhin AP, et al. Measurement of viscous flow velocity and flow visualization using two magnetic resonance imagers. Journal of Applied Mechanics and Technical Physics. 2017;58(2):209–213. doi: 10.1134/S0021894417020031EDN: XMXAKZ
- Iutaka T, de Freitas MB, Omar SS, et al. Arterial spin labeling: techniques, clinical applications, and interpretation. Radiographics. 2023;43(1):e220088. doi: 10.1148/rg.220088
- Fantini S, Sassaroli A, Tgavalekos KT, Kornbluth J. Cerebral blood flow and autoregulation: current measurement techniques and prospects for noninvasive optical methods. Neurophotonics. 2016;3(3):031411. doi: 10.1117/1.NPh.3.3.031411
- James JC, Richter D, Tomaske L, et al. Usefulness of computed tomographic perfusion imaging for appropriate diagnosis of acute cerebral vessel occlusion in case of anatomic variations of the circle of Willis. Neurointervention. 2021;16(2):190–193. doi: 10.5469/neuroint.2021.00136 EDN: GDFJES
- Cianfoni A, Colosimo C, Basile M, et al. Brain perfusion CT: principles, technique and clinical applications. La radiologia medica. 2007;112(8):1225–1243. doi: 10.1007/s11547-007-0219-4 EDN: KEWFNT
- Jahng GH, Li KL, Ostergaard L, Calamante F. Perfusion magnetic resonance imaging: a comprehensive update on principles and techniques. Korean Journal of Radiology. 2014;15(5):554. doi: 10.3348/kjr.2014.15.5.554
- Paschoal AM, Woods JG, Pinto J, et al. Reproducibility of arterial spin labeling cerebral blood flow image processing: A report of the ISMRM open science initiative for perfusion imaging (OSIPI) and the ASL MRI challenge. Magnetic Resonance in Medicine. 2024;92(2):836–852. doi: 10.1002/mrm.30081 EDN: QADEOD
- Lee J, Kim HJ. Normal aging induces changes in the brain and neurodegeneration progress: review of the structural, biochemical, metabolic, cellular, and molecular changes. Frontiers in Aging Neuroscience. 2022;14:931536. doi: 10.3389/fnagi.2022.931536 EDN: ZTIDFA
- Hartmann P, Ramseier A, Gudat F, et al. Das Normgewicht des Gehirns beim Erwachsenen in Abhängigkeit von Alter, Geschlecht, Körpergröße und Gewicht. Der Pathologe. 1994;15(3):165–170. doi: 10.1007/s002920050040
- MacDonald ME, Pike GB. MRI of healthy brain aging: A review. NMR in Biomedicine. 2021;34(9):e4564. doi: 10.1002/nbm.4564 EDN: WBJKOS
- Zeinali R, Keshtkar A, Zamani A, Gharehaghaji N. Brain volume estimation enhancement by morphological image processing tools. J Biomed Phys Eng. 2017;7(4):379–388.
- Liu S, Meng T, Russo C, et al. Brain volumetric and fractal analysis of synthetic MRI: A comparative study with conventional 3D T1-weighted images. European Journal of Radiology. 2021;141:109782. doi: 10.1016/j.ejrad.2021.109782 EDN: PFSYZT
- Ota Y, Shah G. Imaging of normal brain aging. Neuroimaging Clinics of North America. 2022;32(3):683–698. doi: 10.1016/j.nic.2022.04.010 EDN: IUITDD
- Nayak KS, Nielsen JF, Bernstein MA, et al. Cardiovascular magnetic resonance phase contrast imaging. Journal of Cardiovascular Magnetic Resonance. 2015;17(1):71. doi: 10.1186/s12968-015-0172-7 EDN: UWNBHL
- Tulupov AA, Korostyshevskaya AM, Savelov AA, et al. Magnetic resonance in the evaluation of circulation and mass transfer in human. Russian Chemical Bulletin. 2021;70(12):2266–2277. doi: 10.1007/s11172-021-3344-7 EDN: SWEVMB
- Wymer DT, Patel KP, Burke WF, Bhatia VK. Phase-contrast MRI: physics, techniques, and clinical applications. RadioGraphics. 2020;40(1):122–140. doi: 10.1148/rg.2020190039 EDN: VAJUKH
- Stankevich YA, Bogomyakova OB, Vasil'kiv LM, Tulupov AA. Features of changes in the hemodynamic characteristics of the main and tissue blood flow in the pathological tortuosity of the internal carotid arteries according to phase-contrast and perfusion magnetic resonance imaging. Clinical Physiology of Circulation. 2019;16(3):217–227. doi: 10.24022/1814-6910-2019-16-3-217-227 EDN: NADGSR
- Han H, Lin Z, Soldan A, et al. Longitudinal Changes in Global Cerebral Blood Flow in Cognitively Normal Older Adults: A Phase-Contrast MRI Study. Journal of Magnetic Resonance Imaging. 2022;56(5):1538–1545. doi: 10.1002/jmri.28133 EDN: DFFVIK
- Taneja K, Liu P, Xu C, et al. Quantitative Cerebrovascular Reactivity in Normal Aging: Comparison Between Phase-Contrast and Arterial Spin Labeling MRI. Front Neurol. 2020; 31(11):758. doi: 10.3389/fneur.2020.00758 EDN: PICWDT
- Chappell M, McConnell F, Golay X, et al. Partial volume correction in arterial spin labeling perfusion MRI: A method to disentangle anatomy from physiology or an analysis step too far? Neuroimage. 2021; 238:118236. doi: 10.1016/j.neuroimage.2021.118236 EDN: SEJXBB
- Zhao M, Mezue M, Segerdahl A, et al. A systematic study of the sensitivity of partial volume correction methods for the quantification of perfusion from pseudo-continuous arterial spin labeling MRI. Neuroimage. 2017;162:384–397. doi: 10.1016/j.neuroimage.2017.08.072
- Muer J, Didier K, Wannebo B, et al. Sex differences in gray matter, white matter, and regional brain perfusion in young, healthy adults. Am J Physiol Heart Circ Physiol. 2024;327(4):847-858. doi: 10.1152/ajpheart.00341.2024.
- Su F, Peng Sh. Range and variability of CBF in young adults: PC-MRI and ASL studies. Int J Imaging Syst Technol. 2024; 34(2):e22986. doi: 10.1002/ima.22986 EDN: APMFSR
- Hu J, Craig M, Knight S, et al. Regional changes in cerebral perfusion with age when accounting for changes in gray-matter volume. Magn Reson Med. 2025;93(4):1807-1820. doi: 10.1002/mrm.30376 EDN: MLWUSN
- Khan MA, Liu J, Tarumi T, et al. Measurement of cerebral blood flow using phase contrast magnetic resonance imaging and duplex ultrasonography. Journal of Cerebral Blood Flow & Metabolism. 2016;37(2):541–549. doi: 10.1177/0271678X16631149
Arquivos suplementares