Опыт применения машинного обучения для оптимизации процессов заместительной почечной терапии: обзор
- Авторы: Лакман И.А.1, Черненко О.В.2, Шкель О.А.2, Девяткова Г.И.3, Тимирьянова В.М.1, Загидуллин Н.Ш.4
-
Учреждения:
- Уфимский университет науки и технологи
- Лаборатория гемодиализа
- Пермский государственный медицинский университет имени академика Е.А. Вагнера
- Башкирский государственный медицинский университет
- Выпуск: Том 6, № 3 (2025)
- Страницы: 497-509
- Раздел: Обзоры
- Статья получена: 22.05.2025
- Статья одобрена: 05.08.2025
- Статья опубликована: 12.09.2025
- URL: https://jdigitaldiagnostics.com/DD/article/view/680034
- DOI: https://doi.org/10.17816/DD680034
- EDN: https://elibrary.ru/GHAYAK
- ID: 680034
Цитировать
Полный текст
Аннотация
Статья посвящена обзору существующих исследований по использованию инструментов машинного обучения для оптимизации процессов заместительной почечной терапии.
Поиск литературных источников проводили с помощью поисковых систем eLibrary и PubMed, а также базы данных Scopus. Отбор метаинформации выполнялся по полям TITLE и ABSTRACT по запросам: artificial intelligence AND (dialys* OR hemodialys*); machine learning AND (dialys* OR hemodialys*). Запросы выстраивали с учётом возможности использования различных словоформ ключевых понятий. Период публикации не ограничивали. В результате первичного поиска отобрано 669 полнотекстовых статей. В дальнейшем три эксперта (два врача-нефролога и специалист в области машинного обучения) независимо провели ручной отбор. Принципы отбора статей: использование алгоритмов машинного обучения; направленность на решение конкретной задачи, связанной с оптимизацией диализной терапии; наличие модели, разработанной специально для пациентов, находящихся на диализе, а не являющейся сопутствующей при решении других клинических задач.
Анализ публикаций показал, что наиболее распространённой задачей в диализе, решаемой инструментами машинного обучения, является прогноз адекватности программы диализного лечения. Под адекватностью диализа, как правило, понимают эффективность удаления продуктов азотистого обмена. Косвенным же признаком её недостаточности может являться возникновение осложнений после процедур, риск которых и пытаются предсказать модели искусственного интеллекта. Их также используют для подбора терапии при ренальной анемии и нарушениях фосфорно-кальциевого обмена, поскольку в этих случаях необходимо учитывать множество факторов, в том числе их динамику. Значительное числи исследований с применением машинного обучения посвящено прогнозированию выживаемости пациентов, находящихся на диализе, а также определению оптимального времени начала заместительной почечной терапии при хронической болезни почек. Критический анализ публикаций позволил выявить определённые проблемы: малые выборки, недостаточный тестовый контроль как на этапе предварительной подготовки, так и при анализе результатов, а также низкая воспроизводимость многих исследований. Наибольший интерес представляют публикации, описывающие опыт внедрения в клиническую практику систем, разработанных на основе алгоритмов машинного обучения и апробированных на разных популяциях пациентов.
Ключевые слова
Полный текст
ВВЕДЕНИЕ
Искусственный интеллект (ИИ), как одна из современных научных технологий, за последнее десятилетие получил широкое распространение в медицине, в частности в нефрологии. Существует обширная обзорная нарративная публикация, посвящённая использованию инструментов ИИ в нефрологии [1], а также обзор применения технологий ИИ в нефропатологии, в частности нейросетевых алгоритмов для выявления онкологических заболеваний почек [2]. Кроме того, опубликованы более специализированные обзоры, посвящённые использованию моделей машинного обучения (МО) как одного из направлений ИИ в диализе [3], а также отдельно — в перитонеальном диализе [4]. В перечисленных работах систематизируют применяемые технологии ИИ и описывают задачи, которые они решают в нефрологии, однако без анализа качества их реализации и эффективности применения. Тем не менее для оценки практической значимости предлагаемых решений необходимо учитывать достигнутые метрики качества моделей МО и характеристики исходных данных, на которых они обучались. Важным фактором успешности внедрения медицинских систем на основе ИИ является тип используемых данных: объективные показатели, полученные при наблюдении за пациентами на диализе, или субъективные данные, собранные посредством экспертных опросов. В последнем случае особое значение приобретает проблема согласованности экспертных мнений, что должно быть чётко отражено в описании исследования.
В связи с этим необходим критический анализ существующих исследований по применению инструментов глубокого и машинного обучений к задачам, возникающим в медицинском сопровождении пациентов с терминальной стадией хронической болезни почек, находящихся на заместительной почечной терапии (ЗПТ).
Методология поиска данных
Мы провели поиск научных публикаций в информационно-аналитических поисковых системах eLibrary и PubMed, а также в базе данных Scopus. Отбор метаинформации выполнялся по полям TITLE и ABSTRACT по запросам: artificial intelligence AND (dialys* OR hemodialys*); machine learning AND (dialys* OR hemodialys*). В информационно-аналитической поисковой системе eLibrary дополнительно запрос выполнялся на русском языке: диализ (гемодиализ), машинное обучение (искусственный интеллект, ИИ). Запросы формулировали таким образом, чтобы учитывать различные словоформы ключевых понятий. Период публикации не ограничивали.
Поскольку найденных полнотекстовых публикаций было много (n=669), то три независимых эксперта (два врача-нефролога и специалист в области ИИ в здравоохранении) провели ручной отбор. При отборе статей эксперты придерживались принципов:
- наличие алгоритмов МО;
- решение конкретной задачи, связанной с оптимизацией диализной терапии;
- модель разработана специально для пациентов, находящихся на диализе, а не как сопутствующее решение других клинических задач;
- оригинальные исследования, а не систематические обзоры и метаанализы.
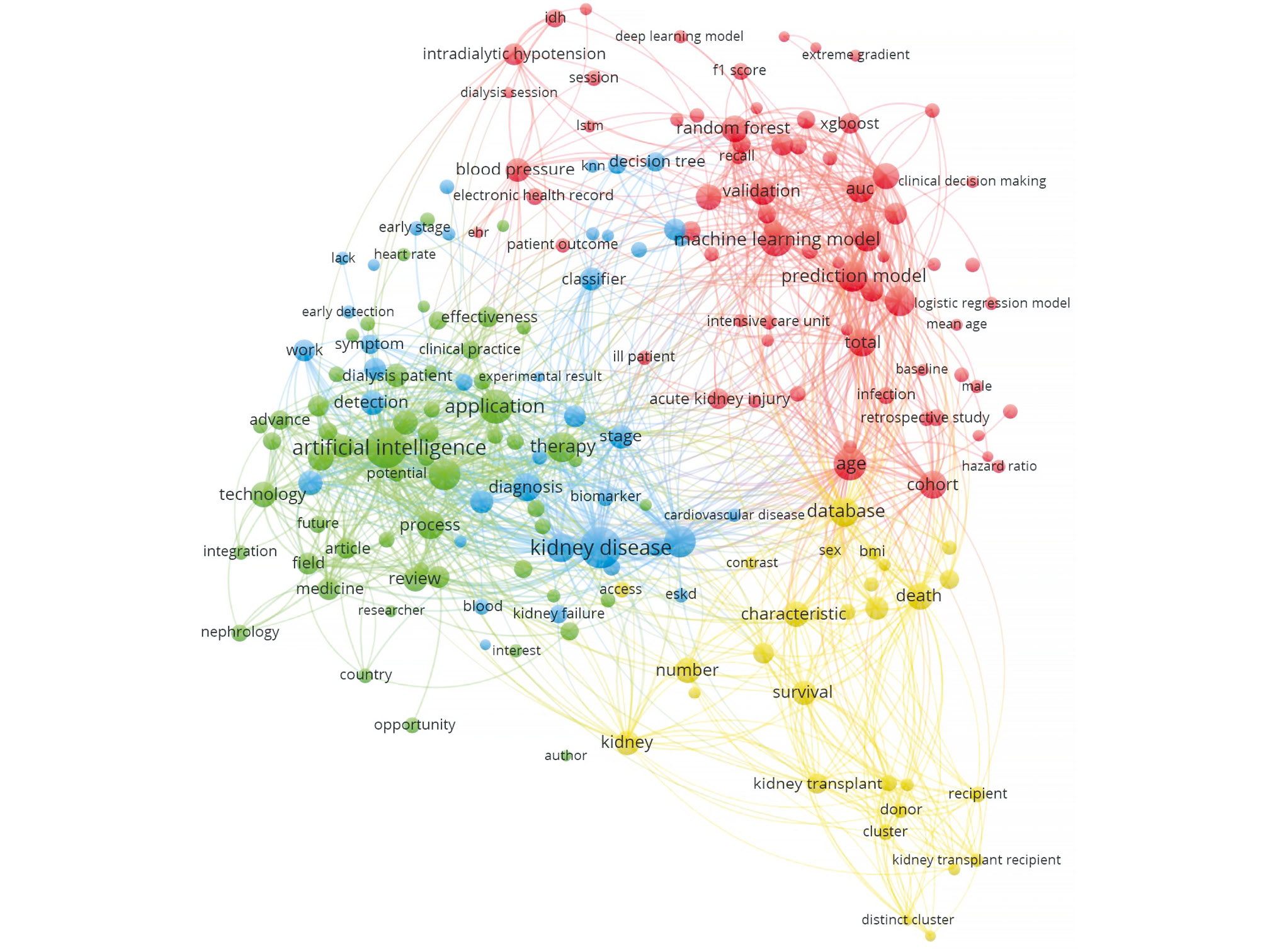
На рис. 1 представлена схема отбора публикаций для обзора, на рис. 2 — сетевая диаграмма ключевых слов отобранных публикаций. В итоге было отобрано 34 публикации для анализа.
Рис. 1. Схема отбора публикаций.
Рис. 2. Сетевая диаграмма ключевых слов отобранных публикаций.
При анализе отобранных статей оценивали:
- постановку задачи;
- применяемые алгоритмы МО;
- исходные данные для обучения моделей;
- качественные характеристики (метрики) получаемых решений.
При обзоре публикаций по каждой из решаемых задач для оптимизации процессов ЗПТ использовали хронологический порядок. Для отбора и анализа публикаций использовали среду R (библиотеки «pubmedR», «openxlsx», «rscopus», «rcrossref», «roadoi», «bibliometrix», «bibliometrixData») и приложение VOSviewer1.
На основе анализа отобранных публикаций мы подготовили Приложение 1, в котором отражены размер выборки и основные демографические характеристики пациентов, указана целевая переменная, соответствующая задаче, решаемой с помощью алгоритма МО, дизайн исследования, информация о предоставлении данных и кода в открытых источниках, используемые алгоритмы МО и достигнутые в результате метрики качества.
ПРОГНОЗИРОВАНИЕ СВОЕВРЕМЕННОГО НАЧАЛА ДИАЛИЗНОЙ ТЕРАПИИ
Одной из задач диализа, решаемых методами МО, является прогнозирование периода начала ЗПТ у пациентов с хронической болезнью почек. Так, W. Penar и соавт. [5] рассматривали возможность применения классификационных моделей МО для прогнозирования своевременного начала диализной терапии. В качестве инструментов решения авторы использовали байесовские классификаторы, нейронные сети и нечёткие множества, лучшие результаты показали модели «деревьев решений» с пруннингом маловесных веток. Классификаторы обучали на 185 записях, размеченных экспертами-нефрологами. Совокупность факторов включала 13 признаков. При этом объём выборки был недостаточным для качественного обучения классификационных моделей. Кроме того, в статье отсутствует информация о верификации данных объективными инструментами: указано лишь, что исходную разметку выполняли эксперты, однако их число не уточняли. В свою очередь, O. Fielding и соавт. [6] провели исследование с использованием данных о здоровье 109 028 пациентов. Авторы разработали модель МО, предназначенную для выявления пациентов, у которых в ближайшее время возникнет необходимость в начале ЗПТ, включая диализ или трансплантацию почки. Модель, обученная на объективных данных (объективность обеспечивали известностью исхода для пациентов в виде фактического назначения ЗПТ), позволяли еженедельно оценивать риски для каждого пациента и направлять врачу уведомление при превышении порогового уровня риска. Создание таких условий для своевременного начала диализной терапии привело к увеличению доли пациентов, начавших диализ вовремя, до 54%, что почти в 3 раза превышает средний показатель по стране до внедрения модели ИИ. Однако воспроизводимость данного исследования вызывает серьёзные сомнения, поскольку авторы не указали сколько данных использовали для обучения, сколько для тестирования точности алгоритмов, какие признаки отбирали в качестве предикторов.
Поскольку решение о начале диализной терапии основывается преимущественно на снижении скорости клубочковой фильтрации (СКФ), то J. Okita и соавт. [7] для оценки своевременности начала ЗПТ используют модели, прогнозирующие динамику СКФ у конкретного пациента. Авторы использовали множество алгоритмов, но лучший результат показала модель на основе регрессии с использованием оператора наименьшего абсолютного сжатия отбора (Least Absolute Shrinkage and Selection Operator, LASSO-регрессия). K.C. Leung и соавт. [8] прогнозировали время начала ЗПТ на основе применения комбинации нейросетевых моделей: свёрточной нейронной сети (Convolutional Neurl Network, CNN), рекуррентной нейронной сети с долгой краткосрочной памятью (Long Short-Term Memory, LSTM) и искусственной нейронной сети (Atrificial Neural Network, ANN). Для оценки адекватности разработанных моделей авторы сравнивали их точность с результатами, получаемыми в случае применения уравнения риска почечной недостаточности (Kidney Failure Risk Equation, KFRE). Согласно полученным данным, предложенный подход продемонстрировал более высокую точность прогнозирования времени начала ЗПТ по сравнению с традиционным методом.
ПРОГНОЗИРОВАНИЕ АДЕКВАТНОСТИ ДИАЛИЗНОГО ЛЕЧЕНИЯ
Одной из самых распространённых задач применения методов ИИ в диализе является прогнозирование адекватности программы диализного лечения. Под адекватностью, как правило, подразумевают степень эффективности удаления продуктов азотистого обмена. Наибольшее распространение в этих исследованиях получили модели на основе нейронных сетей [9–15]. Они демонстрирует возможность применения алгоритмов нейронных сетей различной архитектуры для оценки адекватности программы гемодиализа, в частности для прогнозирования равновесной концентрации мочевины у соответствующих пациентов [13]. Показано, что по параметрам чувствительности (доля корректно предсказанных неадекватных программ диализа) и специфичности (доля корректно предсказанных адекватных программ диализа) модели нейронных сетей могут превосходить как результаты, полученные экспертами-нефрологами, так и эффективность логистической регрессии [14]. При этом установлено, что объём выборки пациентов существенно влияет на качество обучения нейронной сети при оценке адекватности программы диализа [15], что представляет одну из ключевых проблем данного направления. Так, J.Y. Guh и соавт. [9] в 1998 году предприняли одну из первых попыток применить искусственные нейронные сети для прогнозирования уравновешенной концентрации азота мочевины в крови после диализа — отношения постдиализной к преддиализной концентрации мочевины. Кроме того, оценивали коэффициент очищения Kt/V по мочевине, представленный в виде эквилибрированного показателя (eKt/V60), учитывающего так называемый «отскок» мочевины [16]. Под уравновешенными значениями авторы подразумевали показатели, рассчитанные на основе концентрации мочевины в крови через 60 мин после завершения процедуры диализа. J.Y. Guh и соавт. [9] обосновывали, что использование нейронных сетей для прогнозирования концентрации азота мочевины в крови предпочтительнее формального кинетического моделирования. Однако исследование выполняли на небольшой выборке из 74 пациентов, разделённой на обучающую (40 пациентов, использовали для настройки гиперпараметров нейронной сети) и тестовую (34 пациента, применяли для проверки моделей). На валидационном этапе результаты нейросетевой модели сопоставляли с расчётами по формулам кинетического моделирования Смайя и Даугирдаса. Авторы показали, что у пациентов с выраженным эффектом «отскока» мочевины (до 30% случаев, характеризующихся повышением концентрации мочевины в течение 60 мин после завершения сеанса диализа) формула Смайя давала меньшую точность, чем предложенная нейросетевая модель, тогда как формула Даугирдаса обеспечивала сопоставимые результаты. Однако выводы авторов нельзя считать полностью обоснованными из-за небольшой обучающей выборки. В 2003 году E.A. Fernández и соавт. [10] рассматривали возможность прогнозирования показателя Kt/V после процедуры диализа на выборке из 52 пациентов, разделённой на обучающую (80%) и тестовую (20%) группы. Анализировали два варианта профиля концентрации мочевины в диализате: в первую половину процедуры и за весь её период. Прогнозируемые значения сравнивали с объективной концентрацией мочевины, определяемой с помощью аппарата её мониторинга. Средняя ошибка предсказания составила 5,6%, при использовании полной процедуры и 6,8% — при учёте только её половины. Основным ограничением исследования являлся небольшой объём выборки, не позволяющий утверждать об устойчивости полученных результатов. Аналогичную задачу пытались решить A.T. Azar и соавт. [11] в 2011 году. Авторы разработали модель нейронной сети для прогнозирования уравновешенной концентрации мочевины в крови через 60 мин после завершения гемодиализа, что позволяло в относительных величинах оценить выраженность эффекта «отскока» мочевины. Для обучения нейронной сети использовали данные 156 пациентов из отделения диализа. По результатам работы модель на основе нейронной сети обеспечила наибольшую близость к истинным средним значениям процента «отскока» мочевины. Однако отсутствие проверки на независимых выборках ограничивает достоверность и практическую применимость результатов.
Следует отметить, что одним из критериев адекватности процедуры диализа считают отсутствие осложнений после её проведения, таких как повышение или понижение артериального давления, отдышка. Контроль артериального давления в клинической практике проведения диализа осуществляют за счёт правильного подбора параметров процедуры (длительность сеанса, тип диализа, площадь мембраны и т. п.), что позволяет поддерживать оптимальную «сухую» массу тела пациента. Одним из наиболее значимых неблагоприятных исходов диализа, указывающих на неадекватный подбор параметров процедуры, является интрадиализная гипотензия. Использование технологий ИИ открывает возможность индивидуального выбора параметров (например, время сеанса, скорость ультрафильтрации и др.), что позволяет снизить риск её возникновения. Так, в 2022 году M. Othman и соавт. [17] создали модель МО для раннего прогнозирования постдиализных осложнений. Авторы обучали её с использованием данных 6000 сеансов гемодиализа. В свою очередь, применение градиентного бустинга позволило достичь точности 97% на валидационной (тестовой) выборке. Однако исследование не является воспроизводимым, поскольку авторы заявляют об использовании 50 признаках, но в статье их не приводят. В исследовании J. Yang и соавт. [18], проведённом в 2024 году и посвящённом оценке адекватности перитонеального диализа, авторы прогнозировали развитие осложнений, связанных с отказом от него в пользу гемодиализа. Они создали модель на основе алгоритма CatBoost, обученную на данных 824 пациентов, что обеспечило высокую точность прогноза. В качестве существенного ограничения исследования рассматривали выбор комбинированной конечной точки — отказ от перитонеального диализа или смерть пациента в течение 24 ч, однако данные события могут обусловливать разные предикторы риска. C. Barbieri и соавт. [19] решали более комплексную задачу: прогнозирование профиля систолического артериального давления и частоты сердечных сокращений, массы тела после диализа, а также Kt/V для каждого сеанса гемодиализа. В качестве признаков рассматривали 60 переменных, включающих характеристики пациентов, динамику физиологических реакций, результаты предыдущих сеансов диализа и предписанное значение дозы диализа (Kt/V). Для обучения и тестирования использовали 80% из 766 тыс. записей сеансов диализа (70 и 10% — для обучения и тестирования соответственно), оставшиеся 20% использовали для постпроверки модели после её доработки. В качестве инструмента моделирования использовали нейронные сети с прямой связью. Предварительные результаты показывают, что, несмотря на высокоточное прогнозирование достигнутой массы тела после диализа и значения Kt/V, моделирование минимального систолического артериального давления и частоты сердечных сокращений оказалось более сложным.
ПРОГНОЗИРОВАНИЕ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ АНЕМИИ
ИИ также используют для оптимизации терапии ренальной анемии, что обусловлено необходимостью учёта большого числа факторов, включая их динамическое наблюдение [20]. В работе M.E. Brier и соавт. [21] представлен краткий обзор возможностей применения алгоритмов МО для прогнозирования последствий вторичной анемии у пациентов с хронической болезнью почек. Решению задачи регрессии для прогнозирования достижения целевой концентрации гемоглобина у пациентов, находящихся на ЗПТ, посвящена работа J.M. Martínez-Martínez и соавт. [22]. Авторы использовали клинические и лабораторные данные диализных пациентов из Италии и Испании, включающие назначенные процедуры и показатели, отслеженные в динамике, извлечённые из клинической информационной системы управления диализными центрами EuCliD (Fresenius MedicalCare). В качестве предикторов для прогнозирования концентрации гемоглобина учитывали:
- возраст пациента;
- концентрацию мочевины в плазме до и после диализа;
- концентрацию гемоглобина за предыдущие 4 мес.;
- концентрацию ферритина;
- индекс насыщения трансферрина;
- концентрацию альбумина в плазме;
- концентрацию C-реактивного белка в плазме;
- концентрацию фосфора;
- количество лейкоцитов;
- количество нейтрофилов;
- OcmKtv (Kt/V, определяемое системой онлайн-контроля клиренса аппарата диализа);
- средний кровоток (отношение объёма крови к эффективному времени диализа);
- общий объём обработанной крови;
- общий объём инфузии;
- накопленную дозу эритропоэтина, назначенную для лечения анемии.
Использование четырёх предыдущих значений концентрации гемоглобина обусловлено продолжительностью жизни эритроцитов (100–120 дней). Для обеспечения устойчивого прогноза применяли технологию кроссвалидации с разделением выборки на группы для обучения и тестирования — 66 и 34% соответственно. Средняя абсолютная ошибка предсказания (Mean Absolute Error, МАЕ) варьировала от 0,665 до 0,713 г/л. В дальнейшем C. Barbieri и соавт. [23] применяли нейронные сети с прямой связью для прогнозирования ответа диализных пациентов на терапию эритропоэтинами, включая дарбэпоэтин α, и препаратами железа. В качестве ключевых предикторов использовали показатели пациента и характеристики назначаемых препаратов: рост и «сухая» масса тела пациента, концентрации гемоглобина, ферритина и альбумина, OcmKtV, а также количество лейкоцитов в крови. Отбор переменных осуществляли на основе экспертного мнения врачей и влияния признаков на метрики качества прогнозов моделей МО. Их обучали на данных наблюдательного ретроспективного исследования с обязательным условием:
- внутривенное введение дарбэпоэтина α и препаратов железа (сахароза железа или глюконата железа);
- наличие результатов значений концентрации гемоглобина за три предшествующих месяца.
Гиперпараметры нейронной сети оптимизировали по минимизации МАЕ между фактическими и предсказанными значениями концентрации гемоглобина у пациента. Наилучшие результаты показала модель с архитектурой нейронной сети с двумя скрытыми слоями по восемь нейронов в каждом. Достигнутые результаты прогноза варьировали от 90 до 93%.
J.D. Martín-Guerrero и соавт. [24] с использованием метода опорных векторов разработали модель для подбора персональной дозы эритропоэтина для лечения вторичной анемии у диализных пациентов. В качестве признаков для её обучения использовали такие признаки, как:
- возраст;
- масса тела;
- концентрация ферритина;
- концентрация гемоглобина;
- гематокрит (%);
- доза железа при внутривенном введении (мг/мес.);
- количество введений;
- изоформа и доза эритропоэтина (МЕ/нед.).
Оптимальные параметры среднеквадратичной ошибки (Root Mean Square Error, RMSE) прогноза достигнуты при использовании алгоритма опорных векторов с гауссовой радиальной базисной функцией в качестве ядра, причём подбор вида ядра был одним из гиперпараметров. В 2009 году авторы пересмотрели модель подбора оптимальной дозы эритропоэтинов, применив более современные на тот момент методы МО — алгоритмы обучения с подкреплением [25]. В отличие от предыдущей работы, авторы решали задачу не только как прогнозирование концентрации гемоглобина в зависимости от приёма эритропоэтинов, но и подбор индивидуального лечения на основе анализа ретроспективных данных (6 мес.). Использование алгоритма Q-обучения с таблицей агрегации состояний и нейросетевых алгоритмов с многоуровневым перцептроном в качестве аппроксиматора функции позволило увеличить на 25% долю пациентов, достигших целевого диапазона гемоглобина (115–125 мг/мл) в конце анализируемого периода, по сравнению с применением существующих протоколов в нефрологии.
C. Barbieri и соавт. [26] в 2016 году предложили нейросетевую систему поддержки принятия решений при назначении противоанемической терапии диализным пациентам, ставшую основой программы Anemia Control Model (ACM), разработанной Fresenius Medical Care. Модель учитывает историю назначений, реакцию пациента и демографические данные, она интегрирована в медицинскую информационную систему и её используют врачи-нефрологи в рутинной практике. Результаты данного исследования мы не анализировали в Приложении 1, поскольку в статье не описаны методики разработки интеллектуальных алгоритмов, а приведены результаты их тестирования в реальной клинической практике. Тестирование показало, что использование ACM увеличивает долю пациентов в целевом диапазоне (100–120 мг/мл) на 6% и снижает дозу дарбэпоэтина α на 27%. Похожее исследование проводили в 2008 году A.E. Gaweda и соавт. [27] в США. Авторы изучали возможности технологий ИИ в отношении определения оптимальной дозы эритропоэтинов для поддержания целевой концентрации гемоглобина у пациента с учётом его персональных данных, включая результаты лабораторно-клинических исследований и демографических характеристик. Авторы из университета Луисвилля (Кентукки) создали модель прогнозного управления на основе искусственных нейронных сетей для предсказания ответа на лечение эритропоэтинами через изменения концентрации гемоглобина. Для обучения использовали данные 186 пациентов, длительно получающих ЗПТ, а для тестирования — данные 60 пациентов. Сравнение результатов применения модели прогнозного управления с результатами, достигнутыми с использованием стандартных протоколов лечения анемии у диализных пациентов, показало сопоставимую эффективность в достижении целевых концентраций гемоглобина.
Российские учёные О.В. Черненко и соавт. [28] оценивали эффективность антианемической терапии у диализных пациентов с использованием методов МО. Разработанное решение, основанное на 54 признаков (лабораторно-клинических, демографических и функциональных), включая данные за предшествующие 6 мес., позволяет не только определить эффективность назначенной терапии, но и предсказать риск её избыточности. Для обучения моделей использовали 9000 размеченных примеров терапии. В тестовой выборке средневзвешенные показатели чувствительности и специфичности превысили 97%. По данным предварительных внутренних клинических испытаний в 2025 году, точность предсказаний достигла 95% при сопоставлении с заключениями врачей-экспертов.
В 2019 году S. Rogg и соавт. [29] предложили нелинейную прогностическую модель для расчёта персональных доз эритропоэтинов у пациентов на постоянном диализе. Однако практическая реализация данного подхода затруднена, поскольку он предполагает непрерывное введение препаратов эпоэтина α с использованием специальной помпы. T. Ohara и соавт. [30] в 2021 году разработали систему AISACS (Artificial-Intelligence-Supported Anemia Control System) для контроля анемии, основанную на алгоритмах ИИ, применяющих многоклассовую поэтапную классификацию при подборе терапии эритропоэтинами. Авторы заявляют о высокой точности (92–98%) корректного выбора терапии, однако результаты клинических испытаний не приведены. В 2024 году C. Kang и соавт. [31] предложили решение на основе объединения рекуррентной нейронной сети с механизмом внимания, что позволило одновременно прогнозировать концентрацию гемоглобина и выявлять необходимость трансфузии эритроцитов. Для обучения модели авторы использовали данные пациентов за предыдущие 4 мес.
Тем не менее существуют публикации, которые не содержат подробного описания разработки и тестирования моделей. Так, на отечественном рынке медицинских информационных систем для диализных центров существует система Maximus с модулем прогнозирования вероятности анемии [32], однако отсутствуют данные её тестирования и валидации.
ПРОГНОЗИРОВАНИЕ ЭФФЕКТИВНОСТИ ТЕРАПИИ ПО ВОССТАНОВЛЕНИЮ ФОСФОРНО-КАЛЬЦИЕВОГО ОБМЕНА
Ещё одним осложнением хронической болезни почек 5Д является нарушение фосфорно-кальциевого обмена, которое без соответствующего лечения ухудшает качество жизни пациентов [33]. Однако исследований, посвящённых применению средств ИИ к решению подобной проблемы, существенно меньше. Так, Y.F. Wang и соавт. [34] с помощью нейронной сети прогнозировали концентрацию интактного паратиреоидного гормона (норма: 150–300 нг/л) у диализных пациентов с нарушениями фосфорно-кальциевого обмена. В качестве предикторов рассматривали:
- возраст;
- наличие сахарного диабета;
- гипертонию;
- биохимические показатели крови — концентрации гемоглобина, альбумина и кальция.
Модель продемонстрировала удовлетворительные характеристики, площадь под кривой рабочей характеристики приёмника (Area Under the Receiver Operating Characteristic Curve, ROC-AUC) составила 0,83. Кроме того, существует исследование, посвящённое прогнозированию концентрации интактного паратиреоидного гормона в плазме у пациентов с уремией, находящихся на непрерывном амбулаторном перитонеальном диализе [35]. Целью исследования было снижение риска неадекватного назначения фосфатсвязывающих препаратов и витамина D, что также имеет экономическую значимость. Другой подход продемонстрирован в исследовании J. Li и соавт. [36], где авторы использовали логистическую многофакторную регрессию для создания модели, обученной на данных за 8-летний период по 106 760 пациентам, получавшим гемодиализ. Модель классифицировала концентрацию паратиреоидного гормона в плазме крови как «норма» или «ненорма» и выявляла закономерности: высокие концентрации интактного паратиреоидного гормона коррелируют с гиперфосфатемией и гиперфосфатаземией, тогда как очень низкие, так и чрезмерно высокие концентрации паратиреоидного гормона ассоциированы с гиперкальциемией. В исследовании, проведённом в 2023 году, S.L. Mumtaz и соавт. [37] применяли методы анализа временных рядов (нейронные сети, линейную регрессия, «деревья решений») для прогнозирования концентрации электролитов (например, кальция, фосфора и др.) у диализных пациентов. Однако в работе не проведён детальный анализ природы временных процессов, что огранивает корректность выбора и применимости моделей прогнозирования.
ПРОГНОЗИРОВАНИЕ ВЫЖИВАЕМОСТИ ПАЦИЕНТОВ, НАХОДЯЩИХСЯ НА ДИАЛИЗЕ
Большое количество исследований посвящено применению инструментов ИИ для прогнозирования выживаемости пациентов, находящихся на диализе [38–42]. Однако подобрать оптимальную модель оценки риска смерти у диализных пациентов достаточно сложно, поскольку на их выживаемость влияет множество взаимосвязанных факторов, включая данные, которые не всегда доступны в клинической практике. Так, H. Zhang и соавт. [38] для её прогнозирования применяли искусственные нейронные сети с предварительной обработкой данных. В качестве предикторов учитывали демографические и клинические параметры (возраст, пол, рост, массу тела, индекс массы тела, СКФ, длительность нахождения на диализе, наличие осложнений, приём антигипертензивных и гиполипидемических препаратов, наличие сердечно-сосудистых заболеваний, хронических заболеваний печени и др.) Модель обучали на выборке из 5617 записей пациентов с продолжительностью наблюдения от менее одного месяца до почти 5 лет. Модель показала высокие показатели эффективности: ROC-AUC — 0,97 и специфичность — 99,7%. Однако чувствительность составила только 73,2%, что свидетельствует о лучшей прогностической способности предсказывать выживаемость, чем смертность. Дополнительно следует учитывать возможное переобучение, поскольку метрики рассчитаны на всей ретроспективной выборке.
В 2019 году O. Akbilgic и соавт. [39] анализировали данные 27 615 американских пациентов с прогнозированием выживаемости через 30, 90, 180 и 365 дней после начала диализа. Для построения модели использовали 49 клинических признаков, а в качестве алгоритма — «случайный лес». Достигнутые значения ROC-AUC составили 0,7185 [95% доверительный интервал (ДИ) 0,6994–0,7377] для 30-дневного прогноза, 0,7446 (95% ДИ 0,7346–0,7546) — для 90-дневного, 0,7504 (95% ДИ 0,7425–0,7583) — для 180-дневного и 0,7488 (95% ДИ 0,7421–0,7554) — для годового. Наибольшую точность наблюдали при прогнозе полугодовой выживаемости.
S. Mezzatesta и соавт. [40] создавали модель для прогнозирования смертности и сердечно-сосудистых событий у пациентов на диализе на основе итальянского и американского регистров. Для моделирования использовали метод опорных векторов с нелинейным ядром в виде радиальной базисной функции с подбором гиперпараметров с помощью технологии сетки поиска (GridSearch). Модель продемонстрировала высокую точность при предсказании ишемической болезни сердца в течение 2,5 года (95,25% в итальянском наборе данных и 92,15% в американском). Однако адекватной модели для прогнозирования смертности не получено.
В 2018 году Z. Khitan и соавт. [41] проанализировали данные системы USRDS (United States Renal Data System) для пациентов в течение первых шести месяцев ЗПТ. К концу периода умерло более 67 тыс. пациентов, тогда как около 330 тыс. продолжили лечение. В качестве контрольных переменных выступали возраст, пол, наличие сопутствующих заболеваний и связанных с ним состояний, тогда как в качестве предикторов риска смерти диализных пациентов — концентрации сывороточного альбумина и креатинина, а также индекс массы тела. Наилучшую точность предсказания получили при использовании логистической регрессии и алгоритма «случайного леса».
Пандемия COVID-19 внесла существенные изменения в выживаемость пациентов, находящихся на диализе. Так, A.M. Guinsburg и соавт. [42] для прогнозирования краткосрочной и долгосрочной смертности у этой категории пациентов применяли метод градиентного бустинга. Набор признаков практически совпал с теми, которые использовали для прогнозирования популяционной выживаемости при COVID-19.
АНАЛИЗ ВОЗМОЖНОСТЕЙ ПРИМЕНЕНИЯ ТЕХНОЛОГИЙ ИСКУССТВЕННОГО ИНТЕЛЛЕКТА В ДИАЛИЗЕ
Проведённый отбор публикаций по теме применения ИИ и МО в диализе показал устойчивый рост интереса к данному направлению в последние годы (рис. 3).
Рис. 3. Динамика публикаций по теме: a — искусственный интеллект; b — машинное обучение.
Сетевой граф по ключевым словам отобранных статей (см. рис. 2) демонстрирует чёткое формирование кластеров вокруг терминов «artificial intelligence», «kidney disease», «prediction model», «characteristics», что отражает основные фокусы проводимых исследований. Детальный анализ показал, что за последние три года заметно выросло число публикаций, в которых описывают и сравнивают несколько алгоритмов МО. Однако такие публикации часто лишены обоснованного выбора факторов для построения моделей и клинически аргументированного дизайна исследования. Таким образом, несмотря на количественный рост публикаций, их клиническая ценность для нефрологов сохранена на прежнем уровне.
Рост интереса к применению инструментов МО в диализе во многом объясняется возможностью сбора больших массивов данных: процедуры проводят каждые три дня, что формирует значительные объёмы наблюдения. В то же время именно этим фактором можно объяснить снижение качества публикаций с клинической точки зрения.
Серьёзной проблемой является отсутствие воспроизведения: ни в одном из проанализированных исследований не предоставлены исходные данные или программный код. Анализ мощности выборок показал, что в 8 (25%) исследованиях количество пациентов было менее 100 чел., в 12 (37,5%) — менее 400 чел. Следует отметить, что в некоторых исследованиях (3–9,4%) указывали не число пациентов, а количество процедур диализа. Крупные выборки в основном характерны для работ, посвящённых выживаемости, где используют информацию национальных баз электронных медицинских карт. После 2018 года чаще отмечены исследования с выборками более 1000 пациентов, что связано с доступностью машиночитаемых данных. В большинстве случаев исследования опираются на ретроспективный анализ. Исключение составили работы по прогнозированию «отскока» мочевины, где наблюдают проспективный дизайн. В 75% публикаций (n=24) проводили валидацию результатов моделирования на независимой выборке, а в одном случае использовали кросс-валидацию.
Наибольшая доля публикаций посвящена прогнозированию адекватности проведения диализа и рисков возникновения тяжёлых осложнений. Существенная часть работ связана с лечением анемии и нарушения фосфорно-кальциевого обмена у пациентов с хронической болезнью почек в терминальной стадии, что можно объяснить высокой вариативностью подбора назначений. Кроме того, часть моделей ИИ, направленных на контроль анемии, уже внедрены в практику диализных центров. В свою очередь, модели ИИ для прогнозирования выживаемости пациентов обладают ограничениями: они позволяют определить вероятность наступления осложнения или смерти в фиксированные сроки, но не дают ответа на вопрос о вероятном времени наступления неблагоприятного события. Это снижает их ценность с точки зрения планирования клинических мероприятий.
Наиболее популярными являются алгоритмы, решающие задачи классификации или регрессии (искусственные нейронные сети, метод опорных векторов, бустинги, «случайный лес»). Применение алгоритмов рекомендательных систем, алгоритмов мэтчинга, анализа выживаемости (Survival Analysis), обучения с подкреплением или по подобию практически не встречается. Однако именно они обеспечивают бóльшую интерпретируемость и лучше подходят для медицины, поскольку сохраняют объяснимость выводов, в отличии от моделей «чёрного ящика» (например, искусственных нейронных сетей).
В динамике отмечено совершенствование применяемых подходов: расширяется перечень учитываемых факторов, строже формируются выборки, больше внимания уделяют дизайну исследований. Кроме того, развитие технологий ИИ, включая методов МО, способствует получению более точных результатов. По отдельным направлениям уже получены положительные эффекты внедрения моделей МО [6, 25], а также их успешной интеграции в медицинскую информационную систему [26]. Тем не менее требуется критический подход к публикуемым данным, поскольку идёт процесс поиска и апробации инструментов [8, 14, 24, 37].
Особый интерес представляют исследования, описывающие опыт практического применения систем на основе технологий ИИ в разных популяциях [19, 22, 23, 40]. Однако необходимо учитывать. что все они профинансированы крупными производителями диализного оборудования, что может оказывать влияние на интерпретацию результатов.
ЗАКЛЮЧЕНИЕ
Проведённый анализ современных исследований, посвящённых применению алгоритмов МО для решения задач, возникающих в диализной практике, позволяет определить перспективные направления развития данного подхода в нефрологии. Данный нарративный обзор является полезным для формирования методологических основ разработки медицинской информационной системы, позволяющей комплексно рассматривать проблемы качества жизни диализных пациентов за счёт применения алгоритмов МО к решению различных задач, возникающих при назначении ЗПТ. Однако их использование можно рассматривать как обоснованную альтернативу существующим клиническим рекомендациям только при наличии данных независимых клинических испытаний, доказывающих эффективность и безопасность моделей МО.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Приложение 1. Основные характеристики исследований. doi: 10.17816/DD680034-4374725
Вклад авторов. О.В. Черненко — концепция работы, написание и редактирование текста рукописи; И.А. Лакман — сбор и анализ литературных данных, подготовка и написание текста рукописи, подготовка графических материалов; О.А. Шкель, Г.И. Девяткова — отбор литературных данных, подготовка и написание текста рукописи; В.М. Тимирьянова — разработка алгоритмов для автоматического поиска источников, формирование сетевого графика, подготовка графических материалов; Н.Ш. Загидуллин — написание и редактирование текста рукописи. Все авторы одобрили рукопись (версию для публикации), а также согласились нести ответственность за все аспекты работы, гарантируя надлежащее рассмотрение и решение вопросов, связанных с точностью и добросовестностью любой её части.
Этическая экспертиза. Неприменимо.
Источники финансирования. Работа проведена при поддержке Российского научного фонда (грант РНФ № 25-18-20135).
Раскрытие интересов. Авторы заявляют об отсутствии отношений, деятельности и интересов за последние три года, связанных с третьими лицами (коммерческими и некоммерческими), интересы которых могут быть затронуты содержанием статьи.
Оригинальность. При создании настоящей работы авторы не использовали ранее опубликованные сведения (текст, иллюстрации, данные).
Доступ к данным. Все данные, полученные в настоящей работе, доступны в статье и в приложении 1.
Генеративный искусственный интеллект. При создании настоящей статьи технологии генеративного искусственного интеллекта не использовали.
Рассмотрение и рецензирование. Настоящая работа подана в журнал в инициативном порядке и рассмотрена в соответствии с процедурой fast-track. В рецензировании участвовали три внешних рецензента.
ADDITIONAL INFORMATION
Supplement 1: Main characteristics of the studies. doi: 10.17816/DD680034-4374726
Author contributions: O.V. Chernenko: conceptualization, writing—original draft, writing—review & editing; I.A. Lakman: investigation, writing—original draft, visualization; O.A. Shkel, G.I. Devyatkova: investigation, writing—original draft; V.M. Timiryanova: software, methodology, visualization; N.Sh. Zagidullin: writing—original draft, writing—review & editing. All the authors approved the version of the manuscript to be published and agreed to be accountable for all aspects of the work, ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Ethics approval: Not applicable.
Funding sources: The work was supported by the Russian Science Foundation (Grant No. 25-18-20135).
Disclosure of interests: The authors have no relationships, activities, or interests for the last three years related to for-profit or not-for-profit third parties whose interests may be affected by the content of the article.
Statement of originality: No previously obtained or published material (text, images, or data) was used in this work.
Data availability statement: All data obtained in this work are available in the article and Supplement 1.
Generative AI: No generative artificial intelligence technologies were used to prepare this article.
Provenance and peer-review: This article was submitted unsolicited and reviewed following the fast-track procedure. The peer review process involved three external reviewers.
1 VOSviewer [Internet]. В: VOSviewer, 2009–2025. Режим доступа: https://www.vosviewer.com/ Дата обращения: 12.01.2025.
Об авторах
Ирина Александровна Лакман
Уфимский университет науки и технологи
Автор, ответственный за переписку.
Email: Lackmania@mail.ru
ORCID iD: 0000-0001-9876-9202
SPIN-код: 4521-9097
канд. техн. наук, доцент
Россия, УфаОлег Валерианович Черненко
Лаборатория гемодиализа
Email: och@dializrb.ru
ORCID iD: 0000-0001-7907-806X
SPIN-код: 7107-5842
канд. мед. наук
Россия, УфаОксана Александровна Шкель
Лаборатория гемодиализа
Email: zamdir@dializrb.ru
ORCID iD: 0009-0005-1320-0946
SPIN-код: 7902-9175
Россия, Уфа
Галина Ивановна Девяткова
Пермский государственный медицинский университет имени академика Е.А. Вагнера
Email: gidev@mail.ru
ORCID iD: 0000-0002-2318-9390
SPIN-код: 1789-5960
д-р мед. наук, профессор
Россия, ПермьВенера Маратовна Тимирьянова
Уфимский университет науки и технологи
Email: 79174073127@mail.ru
ORCID iD: 0000-0002-1004-0722
SPIN-код: 1449-1716
д-р экон. наук, доцент
Россия, УфаНауфаль Шамилевич Загидуллин
Башкирский государственный медицинский университет
Email: znaufal@mail.ru
ORCID iD: 0000-0003-2386-6707
SPIN-код: 5910-1156
д-р мед. наук, профессор
Россия, УфаСписок литературы
- Yuan Q, Zhang H, Deng T, et al. Role of Artificial Intelligence in Kidney Disease. International Journal of Medical Sciences. 2020;17(7):970–984. doi: 10.7150/ijms.42078 EDN: VQWLAN
- Becker JU, Mayerich D, Padmanabhan M, et al. Artificial Intelligence and Machine Learning in Nephropathology. Kidney International. 2020;98(1):65–75. doi: 10.1016/j.kint.2020.02.027 EDN: ULADJY
- Hueso M, Vellido A, Montero N, et al. Artificial Intelligence for the Artificial Kidney: Pointers to the Future of a Personalized Hemodialysis Therapy. Kidney Diseases. 2018;4(1):1–9. doi: 10.1159/000486394
- Mushtaq MM, Mushtaq M, Ali H, et al. Artificial Intelligence and Machine Learning in Peritoneal Dialysis: A Systematic Review of Clinical Outcomes and Predictive Modeling. International Urology and Nephrology. 2024;56(12):3857–3867. doi: 10.1007/s11255-024-04144-z EDN: CYTYJR
- Penar W, Wozniak M. Machine Learning Methods for Dialysis Therapy Decision Problem — Comparative Study. In: Proceedings of the 4th International Conference on Computer Recognition Systems CORES '05. Heidelberg: Springer-Verlag; 2005. P. 653–659. doi: 10.1007/3-540-32390-2_77
- Fielding O, Kipers C , Son J.H. Using Machine Learning to Predict Optimal Renal Replacement Therapy Starts in Patients With Advanced Renal Function Loss. In: Proceedings of the American Society of Nephrology. Kidney Week. San Diego; 2018. Available from: https://www.asn-online.org/education/kidneyweek/2018/program-abstract.aspx?controlId=3022574
- Okita J, Nakata T, Uchida H, et al. Development and Validation of a Machine Learning Model to Predict Time to Renal Replacement Therapy in Patients With Chronic Kidney Disease. BMC Nephrology. 2024;25(1):101. doi: 10.1186/s12882-024-03527-9 EDN: YARZVX
- Leung KC, Ng WWS, Siu YP, et al. Deep Learning Algorithms for Predicting Renal Replacement Therapy Initiation in CKD Patients: A Retrospective Cohort Study. BMC Nephrology. 2024;25(1):95. doi: 10.1186/s12882-024-03538-6 EDN: QZWPEO
- Guh JY, Yang CY, Yang JM, et al. Prediction of Equilibrated Postdialysis BUN by an Artificial Neural Network in High-Efficiency Hemodialysis. American Journal of Kidney Diseases. 1998;31(4):638–646. doi: 10.1053/ajkd.1998.v31.pm9531180
- Fernández EA, Valtuille R, Willshaw P, Perazzo CA. Dialysate–side Urea Kinetics. Neural Network Predicts Dialysis Dose During Dialysis. Medical & Biological Engineering & Computing. 2003;41(4):392–396. doi: 10.1007/BF02348080
- Azar AT, Wahba KM. Artificial Neural Network for Prediction of Equilibrated Dialysis Dose Without Intradialytic Sample. Saudi Journal of Kidney Diseases and Transplantation. 2011;22(4):705–711. Available from: https://pubmed.ncbi.nlm.nih.gov/21743214/
- Azar AT. Neuro-Fuzzy Applications in Dialysis Systems. In: Azar A, editors. Modeling and Control of Dialysis Systems. Studies in Computational Intelligence. Berlin, Heidelberg: Springer; 2013. P. 1223–1274. ISBN: 978-3-642-27558-6 doi: 10.1007/978-3-642-27558-6_10
- Fernández EA, Valtuille R, Balzarini M. Artificial Neural Networks Applications in Dialysis. In: Azar A, editors. Modeling and Control of Dialysis Systems. Studies in Computational Intelligence. Berlin, Heidelberg: Springer; 2013. P. 1145–1179. ISBN: 978-3-642-27558-6 doi: 10.1007/978-3-642-27558-6_8
- Gabutti L, Vadilonga D, Mombelli G, et al. Artificial Neural Networks Improve the Prediction of Kt/V, Follow-up Dietary Protein Intake and Hypotension Risk in Haemodialysis Patients. Nephrology Dialysis Transplantation. 2004;19(5):1204–1211. doi: 10.1093/ndt/gfh084 EDN: IXOONR
- Gabutti L, Burnier M, Mombelli G, et al. Usefulness of Artificial Neural Networks to Predict Follow-up Dietary Protein Intake in Hemodialysis Patients. Kidney International. 2004;66(1):399–407. doi: 10.1111/j.1523-1755.2004.00744.x EDN: FPAFUJ
- Strokov GA, Gurevich KY, Ilyin AP, et al. Treatment of Patients With Chronic Kidney Disease Stage 5 (CKD 5) by Hemodialysis and Hemodiafiltration. Clinical Guidelines. Nephrology (Saint-Petersburg). 2017;21(3):92–111. doi: 10.24884/1561-6274-2017-3-92-111 EDN: WODSTU
- Othman M, Elbasha AM, Naga YS, Moussa ND. Early Prediction of Hemodialysis Complications Employing Ensemble Techniques. BioMedical Engineering OnLine. 2022;21(1):1–15. doi: 10.1186/s12938-022-01044-0 EDN: IRJASB
- Yang J, Wan J, Feng L, et al. Machine Learning Algorithms for the Prediction of Adverse Prognosis in Patients Undergoing Peritoneal Dialysis. BMC Medical Informatics and Decision Making. 2024;24(1):8. doi: 10.1186/s12911-023-02412-z EDN: GIGFBK
- Barbieri C, Cattinelli I, Neri L, et al. Development of an Artificial Intelligence Model to Guide the Management of Blood Pressure, Fluid Volume, and Dialysis Dose in End-Stage Kidney Disease Patients: Proof of Concept and First Clinical Assessment. Kidney Diseases. 2018;5(1):28–33. doi: 10.1159/000493479
- Lankhorst CE, Wish JB. Anemia in Renal Disease: Diagnosis and Management. Blood Reviews. 2010;24(1):39–47. doi: 10.1016/j.blre.2009.09.001
- Brier ME, Gaweda AE. Artificial Intelligence for Optimal Anemia Management in End-Stage Renal Disease. Kidney International. 2016;90(2):259–261. doi: 10.1016/j.kint.2016.05.018
- Martínez-Martínez JM, Escandell-Montero P, Barbieri C, et al. Prediction of the Hemoglobin Level in Hemodialysis Patients Using Machine Learning Techniques. Computer Methods and Programs in Biomedicine. 2014;117(2):208–217. doi: 10.1016/j.cmpb.2014.07.001
- Barbieri C, Mari F, Stopper A, et al. A New Machine Learning Approach for Predicting the Response to Anemia Treatment in a Large Cohort of End Stage Renal Disease Patients Undergoing Dialysis. Computers in Biology and Medicine. 2015;61:56–61. doi: 10.1016/j.compbiomed.2015.03.019
- Martín-Guerrero JD, Camps-Valls G, Soria-Olivas E, et al. Dosage Individualization of Erythropoietin Using a Profile-Dependent Support Vector Regression. IEEE Transactions on Biomedical Engineering. 2003;50(10):1136–1142. doi: 10.1109/TBME.2003.816084
- Martín-Guerrero JD, Gomez F, Soria-Olivas E, et al. A Reinforcement Learning Approach for Individualizing Erythropoietin Dosages in Hemodialysis Patients. Expert Systems with Applications. 2009;36(6):9737–9742. doi: 10.1016/j.eswa.2009.02.041
- Barbieri C, Molina M, Ponce P, et al. An International Observational Study Suggests that Artificial Intelligence for Clinical Decision Support Optimizes Anemia Management in Hemodialysis Patients. Kidney International. 2016;90(2):422–429. doi: 10.1016/j.kint.2016.03.036
- Gaweda AE, Jacobs AA, Aronoff GR, Brier ME. Model Predictive Control of Erythropoietin Administration in the Anemia of ESRD. American Journal of Kidney Diseases. 2008;51(1):71–79. doi: 10.1053/j.ajkd.2007.10.003
- Chernenko OV, Lakman IA, Shkel OA, et al. Artificial Intelligence Algorithms for Dialysis Patients' Therapies Efficiency Evaluation. Healthcare Management: News. Views. Education. Bulletin of VSHOUZ. 2021;7(2):103–115. doi: 10.33029/2411-8621-2021-7-2-103-115 EDN: HRLLOC
- Rogg S, Fuertinger DH, Volkwein S, et al. Optimal EPO Dosing in Hemodialysis Patients Using a non-Linear Model Predictive Control Approach. Journal of Mathematical Biology. 2019;79(6-7):2281–2313. doi: 10.1007/s00285-019-01429-1 EDN: ZNNPIK
- Ohara T, Ikeda H, Sugitani Y, et al. Artificial Intelligence Supported Anemia Control System (AISACS) to Prevent Anemia in Maintenance Hemodialysis Patients. International Journal of Medical Sciences. 2021;18(8):1831–1839. doi: 10.7150/ijms.53298 EDN: CZSDSG
- Kang C, Han J, Son S, et al. Optimizing Anemia Management Using Artificial Intelligence for Patients Undergoing Hemodialysis. Scientific Reports. 2024;14(1):26739. doi: 10.1038/s41598-024-75995-w EDN: IURIXQ
- Zinovev DA, Novitskiy VO, Malkoch AV. Application of a Neural Network Machine Learning Method to Complication Diseases Treatment in Hemodialysis Patients. Medical Doctor and IT. 2019;(2):29–37. EDN: IZZSBI
- Fukagawa M, Kido R, Komaba H, et al. Abnormal Mineral Metabolism and Mortality in Hemodialysis Patients With Secondary Hyperparathyroidism: Evidence From Marginal Structural Models Used to Adjust for Time-Dependent Confounding. American Journal of Kidney Diseases. 2014;63(6):979–987. doi: 10.1053/j.ajkd.2013.08.011
- Wang YF, Hu TM, Wu CC, et al. Prediction of Target Range of Intact Parathyroid Hormone in Hemodialysis Patients With Artificial Neural Network. Computer Methods and Programs in Biomedicine. 2006;83(2):111–119. doi: 10.1016/j.cmpb.2006.06.001
- Chiu JS, Lin WT, Li YC, Wang YF. Neural Network Modeling to Predict Intact Parathyroid Hormone in Uremic Patients on Continuous Ambulatory Peritoneal Dialysis. Journal of Nuclear Medicine. 2005;18(3):135–141. doi: 10.6332/ANMS.1803.002
- Li J, Molnar MZ, Zaritsky JJ, et al. Correlates of Parathyroid Hormone Concentration in Hemodialysis Patients. Nephrology Dialysis Transplantation. 2013;28(6):1516–1525. doi: 10.1093/ndt/gfs598
- Mumtaz SL, Shamayleh A, Alshraideh H, Guella A. Improvement of Dialysis Dosing Using Big Data Analytics. Healthcare Informatics Research. 2023;29(2):174–185. doi: 10.4258/hir.2023.29.2.174 EDN: ILRVIA
- Zhang H, Hung CL, Chu WCC, et al. Chronic Kidney Disease Survival Prediction with Artificial Neural Networks. In: 2018 IEEE International Conference on Bioinformatics and Biomedicine (BIBM). Madrid: IEEE; 2018. P. 1351–1356. doi: 10.1109/BIBM.2018.8621294
- Akbilgic O, Obi Y, Potukuchi PK, et al. Machine Learning to Identify Dialysis Patients at High Death Risk. Kidney International Reports. 2019;4(9):1219–1229. doi: 10.1016/j.ekir.2019.06.009
- Mezzatesta S, Torino C, Meo PD, et al. A Machine Learning-Based Approach for Predicting the Outbreak of Cardiovascular Diseases in Patients on Dialysis. Computer Methods and Programs in Biomedicine. 2019;177:9–15. doi: 10.1016/j.cmpb.2019.05.005
- Khitan Z, Jacob AD, Balentine C, et al. Predicting Adverse Outcomes in End Stage Renal Disease: Machine Learning Applied to the United States Renal Data System. Marshall Journal of Medicine. 2018;4(4):75. doi: 10.18590/mjm.2018.vol4.iss4.8
- Guinsburg AM, Jiao Y, Bessone MID, et al. Predictors of Shorter- and Longer-Term Mortality After COVID-19 Presentation Among Dialysis Patients: Parallel Use of Machine Learning Models in Latin and North American Countries. BMC Nephrology. 2022;23(1):1–23. doi: 10.1186/s12882-022-02961-x EDN: MDPQNG
Дополнительные файлы