Электрокардиографические феномены при COVID-19: анализ теле-ЭКГ-исследований IT-центра ЭКГ г. Москвы
- Авторы: Таскина В.Ю.1, Демкина А.Е.1, Газашвили Т.М.2, Шкода А.С.2, Владзимирский А.В.3,4, Морозов С.П.1
-
Учреждения:
- Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения города Москвы
- Городская клиническая больница № 67 имени Л.А. Ворохобова Департамента здравоохранения города Москвы
- Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения г. Москвы
- Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
- Выпуск: Том 2, № 3 (2021)
- Страницы: 235-248
- Раздел: Оригинальные исследования
- Статья получена: 21.06.2021
- Статья одобрена: 21.09.2021
- Статья опубликована: 15.10.2021
- URL: https://jdigitaldiagnostics.com/DD/article/view/71885
- DOI: https://doi.org/10.17816/DD71885
- ID: 71885
Цитировать
Аннотация
Обоснование. При новой коронавирусной инфекции (COVID-19) наряду с доминирующим поражением органов дыхания в патологический процесс вовлекается сердечно-сосудистая система. Однако в доступной литературе аналитические оценки электрокардиографических (ЭКГ) феноменов опираются лишь на результаты исследований небольших выборок и описания единичных клинических случаев, что определяет актуальность проведения более масштабных исследований для уточнения характера и распространённости ЭКГ-изменений у лиц с подтверждённой коронавирусной инфекцией.
Цель ― структуризация изменений ЭКГ у пациентов с COVID-19, представляющих неселективную популяцию жителей г. Москвы.
Материалы и методы. Проведён ретроспективный анализ электрокардиографических исследований, выполненных у 42 799 пациентов с верифицированным диагнозом COVID-19 в период с 10.03.2020 по 10.03.2021. Все включённые в исследование лица проходили стационарное лечение в клинических больницах г. Москвы, подключённых к IT-центру ЭКГ. Регистрация ЭКГ производилась в 12 стандартных отведениях, после чего путём интернет-соединения информация передавалась на сервер IT-центра ЭКГ с целью формулировки соответствующих заключений.
Результаты. Изменения ЭКГ обнаружены у 54% пациентов. Наиболее частыми аритмиями были наджелудочковая экстрасистолия и фибрилляция предсердий ― у 12,6 и 12,0% пациентов соответственно. Признаки перегрузки правых отделов сердца выявлены у 12,5% больных, из них в 1,13% случаев ― ЭКГ-паттерн тромбоэмболии лёгочной артерии. Инфарктоподобные изменения на ЭКГ имели место у 4,5% субъектов, в том числе 3 случая паттерна Бругада. Частота встречаемости изменений ST-T составила 2,2% от числа всех исследований. ЭКГ с удлинённым интервалом QT и QTc зарегистрирована у 540 (1,26%) пациентов. Отмечены единичные случаи фибрилляции желудочков, синдрома Фредерика и АВ-блокады различной степени.
Заключение. На основе проведённого анализа получено представление о частоте встречаемости электрокардиографических феноменов у больных COVID-19. Подтверждена высокая инцидентность фибрилляции предсердий ― фактора риска тромбоэмболических осложнений. Одновременно установлена значительная распространённость ЭКГ-паттернов перегрузки правых отделов сердца, часть из которых ассоциирована с тромбоэмболией лёгочной артерии. Другие наблюдаемые изменения ЭКГ характеризовались значительно меньшей распространённостью, что, однако, не снижает их клинического значения. Собранный материал в перспективе может служить оптимизации тактики ведения пациентов при коронавирусной инфекции.
Ключевые слова
Полный текст
ОБОСНОВАНИЕ
Первый случай заражения новой коронавирусной инфекцией, вызванной вирусом SARS-CoV-2, был зарегистрирован в декабре 2019 года в г. Ухане китайской провинции Хубэй. Заболевание получило название COVID-19. Дальнейшее распространение вируса стало молниеносным, и уже в марте 2020 года Всемирная организация здравоохранения объявила о начале пандемии COVID-19.
По сообщению Z. Wu и J.M. McGoogan [1], общий коэффициент летальности от подтверждённого COVID-19 составляет 2,3%, однако он значительно (на 5,6–10,5%) увеличивается среди лиц с сопутствующими заболеваниями и достигает 49% у пациентов, находящихся в критическом состоянии. Клинические проявления заболевания разнообразны и варьируют от бессимптомной формы инфекции до полиорганной недостаточности, приводящей к смерти. Большинство сообщений сконцентрировано на поражении респираторного тракта, поскольку именно верхние дыхательные пути являются входными воротами инфекции, а вовлечение в патологический процесс лёгких является доминирующим клиническим проявлением COVID-19, включая острый респираторный дистресс-синдром. Однако у пациентов с новой коронавирусной инфекцией отмечается и развитие сердечно-сосудистых осложнений [2, 3], в генезе которых можно выделить три причинных фактора:
- наличие сердечно-сосудистых заболеваний в анамнезе;
- повреждение миокарда инфекционным агентом;
- кардиотоксический эффект назначаемых для лечения COVID-19 лекарственных препаратов, которые могут оказывать сопутствующее влияние на проводящую систему сердца.
Сердечно-сосудистые осложнения при электрокардиографическом исследовании (ЭКГ) проявляются признаками ишемии, миокардита, возникновением паттерна Бругада, различными видами аритмий (в том числе фатальными), тромбоэмболическими осложнениями, а также удлинением интервала QT и QTc и его проаритмогенным значением [3–5]. Такое поражение миокарда чревато негативными исходами заболевания, пролонгированием периода реконвалесценции и отягощением прогноза [2, 6–9], поэтому крайне важно, чтобы клинический специалист обращал внимание и распознавал ЭКГ-изменения, свойственные COVID-19.
В мировой и отечественной литературе благодаря опубликованным результатам клинических исследований в небольших выборках и анализам единичных клинических случаев уже накоплены данные о различных видах ЭКГ-феноменов при коронавирусной инфекции [2, 4, 7, 8], однако пока не представлено систематизации изменений ЭКГ по частоте встречаемости на основе более масштабных наблюдений, что является актуальным для определения тактики ведения пациентов и определения прогноза.
Цель исследования ― структуризация изменений ЭКГ у пациентов с COVID-19, представляющих неселективную популяцию жителей г. Москвы.
МЕТОДЫ
Дизайн исследования
В обсервационное ретроспективное исследование включили 42 799 пациентов, проходивших стационарное лечение по поводу новой коронавирусной инфекции в медицинских организациях г. Москвы в период с 10 марта 2020 года по 10 марта 2021 года. Использованы заключения ЭКГ-исследований, полученные из телемедицинской системы регистрации и дистанционного анализа ЭКГ (теле-ЭКГ система) компании «АТЕС МЕДИКА» (Россия). Заключения ЭКГ из теле-ЭКГ системы также поступали в Единую медицинскую информационно-аналитическую систему (ЕМИАС) г. Москвы.
Критерии соответствия
Критерии включения: лица в возрасте старше 18 лет с клинически и лабораторно верифицированным диагнозом новой коронавирусной инфекции, установленным в соответствии с Временными методическими рекомендациями по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19) Министерства здравоохранения Российской Федерации (на основании положительного результата ПЦР-диагностики и/или наличия критериев вирусной пневмонии по данным компьютерной томографии).
Критерии исключения: возраст пациентов младше 18 лет; отсутствие данных заключения ЭКГ в теле-ЭКГ системе и/или электронной истории болезни.
Условия проведения
Пациенты находились на стационарном лечении в ГБУЗ «Городская клиническая больница № 40 Департамента здравоохранения города Москвы», клинических отделениях, пульмонологическом центре и резервном госпитале ГБУЗ «Городская клиническая больница № 67 имени Л.А. Ворохобова Департамента здравоохранения города Москвы».
На базе ГБУЗ «Городская клиническая больница № 67 имени Л.А. Ворохобова Департамента здравоохранения города Москвы» был создан дистанционный центр электрокардиографии (IT-центр ЭКГ). В соответствии с методическими рекомендациями по централизации описаний электрокардиографических исследований в теле-ЭКГ системе IT-центра ЭКГ происходило аккумулирование всех электрокардиограмм, записанных в указанных выше лечебных учреждениях, с целью дальнейшего их описания и передачи заключения в электронную историю болезни [10]. По данным С.П. Морозова и соавт. [11], такой подход к централизации аналитической обработки регистрируемых ЭКГ является адекватным и позволяет оптимизировать материальные и временные затраты, что приобретает особую актуальность в условиях повышенной нагрузки на систему здравоохранения в период пандемии COVID-19.
Продолжительность исследования
Настоящее ретроспективное исследование проведено в период с апреля по июнь 2021 года на основании данных ЭКГ-заключений больных коронавирусной инфекцией, проходивших стационарный этап лечения в течение года (с 10 марта 2020 года по 10 марта 2021 года).
Описание медицинского вмешательства
Регистрация ЭКГ производилась всем пациентам при поступлении в стационар, затем в зависимости от клинической ситуации, а также при наличии исходных изменений на ЭКГ каждые 3 дня.
Основной исход исследования
Основным исходом в данном исследовании являлось заключение электрокардиограммы, зарегистрированной у пациентов с верифицированным диагнозом COVID-19, проходивших стационарное лечение в клинических отделениях и структурных подразделениях медицинских организаций, сотрудничающих с IT-центром ЭКГ. Оценивали следующие параметры ЭКГ.
- Нарушения ритма и проводимости. Градацию наджелудочковых и желудочковых нарушений ритма проводили по общепринятым критериям. Длительность интервала QT рассчитывали автоматически в программе «АТЕС МЕДИКА» (Россия) с учётом дисперсии в 12 отведениях. При расчёте данных интервалов усреднённый комплекс QRST каждого отведения накладывали на каждое последующее. Интервал QT определяли между самой ранней точкой деполяризации желудочков и последней точкой окончания зубца T. Проводили также коррекцию данных по частоте сердечных сокращений для получения значения интервала QTc по формуле Базетта. Пороговые значения скорректированного интервала QT (QTc) составляли 450 мс для мужчин и 460 мс для женщин.
- Морфологические аномалии (изменения ST-T). Сегмент ST измеряли от точки J через 60–80 мс. К критериям патологии ST-T были отнесены косонисходящая и/или горизонтальная депрессия сегмента ST ≥0,05 мВ, а также элевация сегмента ST ≥0,10 мВ в отведениях от конечностей и V5–6 и/или >0,25 мВ в V1–3 с максимумом в V2. К аномалиям зубца Т были отнесены изменения его формы и полярности согласно общепринятым критериям. Вторичные изменения ST-T, вызванные преждевременным возбуждением желудочков, блокадой внутрижелудочковой проводимости и ритмом стимуляции желудочков, не учитывали.
- Перегрузка и увеличение правых отделов сердца. При оценке данных параметров опирались на стандартные критерии увеличения правого предсердия и правого желудочка, а также наличие маркера острого лёгочного сердца и тромбоэмболии лёгочной артерии, отражающихся на ЭКГ появлением паттерна SIQIIITIII, а также его сочетания с инверсией волны Т в правых грудных отведениях, преходящей блокадой правой ножки пучка Гиса, P-pulmonale, депрессией сегмента ST в левых грудных отведениях.
Анализ в подгруппах
Выборкой для данного исследования служила неселективная популяция жителей г. Москвы, проходивших госпитальный этап лечения новой коронавирусной инфекции. Формирование выборки было произведено без учёта возрастных градаций, сопутствующей патологии, тяжести клинического состояния, данных лабораторных методов обследования и длительности пребывания в условиях стационара. Ретроспективно пациенты были разделены на 2 подгруппы в зависимости от наличия или отсутствия ЭКГ-синдромов.
Выделение дополнительных подгрупп не предусмотрено целью и задачами исследования.
Методы регистрации исходов
ЭКГ регистрировалась в 12 стандартных отведениях цифровыми электрокардиографами EASY ECG компании «АТЕС МЕДИКА» (Россия), оснащёнными модулями для дистанционной передачи данных, а также функцией автоматической расшифровки ЭКГ с измерениями основных параметров ЭКГ, таких как длительность зубцов и интервалов, вольтажных характеристик, и последующим формированием предварительного заключения. При подключении электрокардиографа к ноутбуку или планшету происходила визуализация зарегистрированных записей ЭКГ с показом автоматического анализа. Далее с использованием интернет-соединения зарегистрированная ЭКГ передавалась на сервер IT-центра ЭКГ, где уже врачи функциональной диагностики проводили проверку автоматического анализа ЭКГ, формулировали окончательное заключение. После этого заключение ЭКГ передавалось в электронную историю болезни пациента.
Этическая экспертиза
Проведение исследования одобрено независимым этическим комитетом Московского регионального отделения Российского общества радиологов и рентгенологов, протокол № 5/2021 от 20.05.2021.
Статистический анализ
В статистический анализ были включены данные всех субъектов исследования, разделённых на 2 подгруппы по признаку или отсутствию признака патологического феномена ЭКГ. Для каждой подгруппы приведена описательная статистика базовых характеристик с указанием следующих параметров: число непропущенных значений (N); минимальное значение (Min); максимальное значение (Max); арифметическое среднее (M); стандартное отклонение (SD); 95% доверительный интервал (ДИ) для среднего; медиана (Me).
Сравнение данных между подгруппами проведено с помощью t-теста. Для межгруппового сравнения категориальных базовых характеристик применяли критерий хи-квадрат либо точный тест Фишера (если ожидаемая частота в какой-либо из ячеек была менее 5). Уровнем статистической значимости (р) было принято значение 0,05 (двустороннее). Все статистические параметры были рассчитаны с помощью программного обеспечения Stata 14.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
В настоящее исследование включено 42 799 пациентов с клинически и лабораторно верифицированной новой коронавирусной инфекцией.
При первичном анализе заключений ЭКГ, зарегистрированных у данных субъектов, было отобрано 47 292 записи с диагностированным ЭКГ-феноменом либо с отсутствием такового. При последующей оценке из анализа данных были исключены снятые в динамике ЭКГ, по заключениям которых не было изменения предшествующего электрокардиографического диагноза (n=3927), также были исключены дуплицированные записи пациентов (n=563) и заключения с неполными данными (n=3). Таким образом, исключение 4493 записей ЭКГ в результате анализа исходного материала позволило достичь количественного соответствия заключений ЭКГ пациентам, т.е. для каждого субъекта исследования было учтено одно из заключений с ведущим электрокардиографическим диагнозом. Количество зарегистрированных первичных ЭКГ-заключений составило 34 510, повторных ― 8289.
В исследование были включены лица в возрасте от 23 до 98 лет. Средний возраст пациентов с отсутствием патологических изменений на ЭКГ составил 52,0±14,5 года, а пациентов с наличием разного рода патологических ЭКГ-синдромов ― 69,6±15,7 года (p <0,0001); табл. 1.
Таблица 1. Описательная статистика возрастной структуры выборки
Параметр | Нормальная ЭКГ | Патологическая ЭКГ | Суммарно |
N | 19 686 | 23 113 | 42 799 |
Mean | 52,0 | 69,6 | 61,7 |
SD | 14,5 | 15,7 | 17,5 |
95% ДИ | (47,7; 56,4) | (65,4; 73,9) | (58,2; 65,2) |
Min | 23 | 30 | 23 |
Max | 77 | 98 | 98 |
Med | 55 | 71 | 62 |
P (t-test) | <0,0001 | - | |
В исследовании превалировали пациенты женского пола (52%), статистически значимых различий между подгруппами по этому показателю не выявлено (табл. 2).
Таблица 2. Распределение обследованных субъектов по половому признаку
Пол | Нормальная ЭКГ | Патологическая ЭКГ | Суммарно | p-value |
Женский | 9626 (48,9%) | 12 629 (54,6%) | 22 255 (52,0%) | 0,299 |
Мужской | 10 060 (51,1%) | 10 484 (45,4%) | 20 544 (48,0%) |
Основные результаты исследования
Патологические феномены ЭКГ были зарегистрированы у 54% (n=23 113) субъектов исследования. Процентное соотношение ЭКГ-феноменов было рассчитано по общему количеству пациентов.
Наиболее частыми нарушениями ритма сердца и проводимости явились наджелудочковая экстрасистолия и фибрилляция предсердий, выявленные соответственно у 12,6 и 12,0% обследованных больных. Распространённость синусовой тахикардии составила 7,13%.
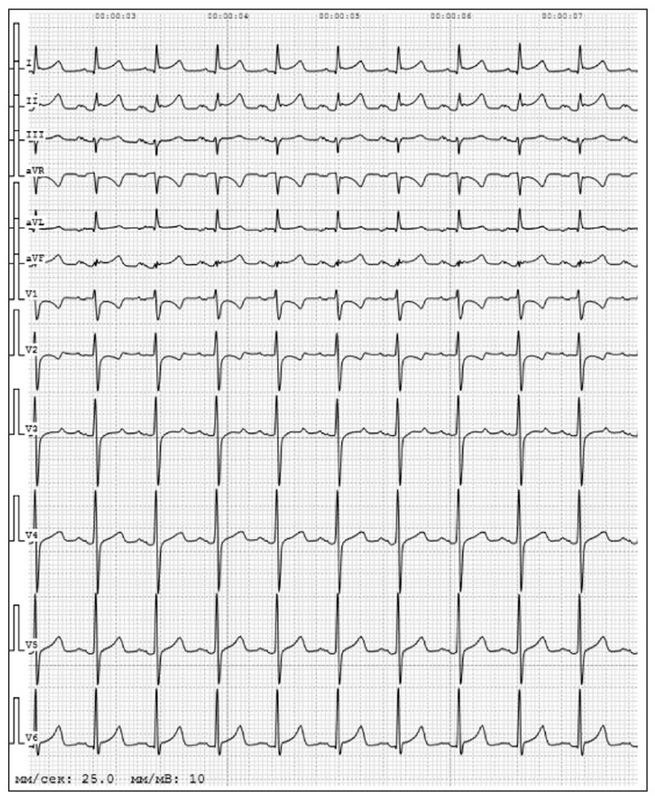
Признаки перегрузки правых отделов сердца зарегистрированы у 12,5% пациентов. На перегрузку правых отделов сердца указывали ЭКГ-признаки увеличения правого предсердия и желудочка, диастолического и систолического напряжения миокарда правого желудочка, лёгочной гипертензии, а также паттерны SIQIIITIII, свидетельствующие о развитии тромбоэмболии лёгочной артерии. В настоящем исследовании ЭКГ-паттерн тромбоэмболии лёгочной артерии был выявлен у 485 пациентов. Один из примеров ЭКГ-паттерна SIQIIITIII представлен на рис. 1.
Рис. 1. ЭКГ-паттерн SIQIIITIII. Мужчина, 81 год. Диагноз: коронавирусная инфекция COVID-19, ПЦР-. Внебольничная двусторонняя полисегментарная пневмония. По данным компьютерной томографии поражение легочной ткани около 80 %. ЭКГ 02.02.21: АВ-блокада 1 степени, АВ-блокада 2 степени 2 типа (2:1, 3:1), 61 уд / мин. Отклонение электрической оси сердца влево. Тип SIQ IIITIII, элевация ST, отрицательный Т в II, III, AVF, V1-V5
Инфарктоподобные изменения обнаружены у 4,5% больных, из них 3 случая паттерна Бругада (рис. 2).
Рис. 2. ЭКГ-паттерн синдрома Бругада. Пациент, мужчина, 67 лет. Диагноз: Коронавирусная инфекция COVID-19, положительная реакция теста полимеразной цепной реакции. Внебольничная двусторонняя полисегментарная пневмония. По данным компьютерной томографии: поражение лёгочной ткани около 75%. По данным ЭКГ от 22.05.2020: Миграция водителя ритма по предсердиям. Одиночная наджелудочковая экстрасистолия. 51 уд./мин. Нормальное положение электрической оси сердца. Блокада правой ножки пучка Гиса. Гипертрофия левого желудочка. Элевация ST II, III, AVF, V1–V5.
В 0,5% случаев выявлены признаки острой ишемии миокарда. Частота встречаемости острых тканевых нарушений, проявляемых на ЭКГ изменениями ST-T, составила 2,2%. На рис. 3 представлен случай возникновения изменений сегмента ST и зубца Т.
ЭКГ с удлинённым интервалом QT и QTc встретилась у 540 пациентов, что составило 1,26% от числа всех обследованных субъектов. Все эти лица получали терапию азитромицином и гидроксихлорохином.
Рис. 3. Изменения сегмента ST и зубца Т. Пациент, женщина, 74 года. Диагноз: Коронавирусная инфекция COVID-19, положительная реакция теста полимеразной цепной реакции. Внебольничная двусторонняя полисегментарная пневмония. По данным компьютерной томографии: поражение лёгочной ткани около 25% слева, 50% справа. По данным ЭКГ от 25.02.2021: Синусовая тахикардия, 111 уд./мин. Отклонение электрической оси сердца влево. Элевация ST I, II, AVL, AVF, депрессия ST в AVR, V1.
За указанный период исследования были зафиксированы единичные случаи фибрилляции желудочков, синдрома Фредерика и АВ-блокады различной степени (табл. 3).
Таблица 3. Структура ЭКГ-феноменов при COVID-19
ЭКГ-феномен | Пациенты (n=42 799) | |
Абс. | % | |
Наджелудочковая экстрасистолия | 5401 | 12,6 |
Тахиаритмии: | ||
• фибрилляция предсердий | 5142 | 12,0 |
• синусовая тахикардия | 3050 | 7,13 |
• желудочковая тахикардия | 3 | 0,007 |
Брадиаритмии: | ||
• атриовентрикулярная блокада (различной степени) | 19 | 0,04 |
• синусовая брадикардия | 7 | 0,016 |
Изменения ST-T | 924 | 2,2 |
Бругадоподобные изменения | 3 | 0,007 |
Паттерн SIQIIITIII | 485 | 1,13 |
Инфарктоподобные изменения | 1941 | 4,5 |
Острая ишемия миокарда | 214 | 0,5 |
Перегрузка правых отделов | 5338 | 12,5 |
QT-QTc удлинением | 540 | 1,26 |
Другие изменения ЭКГ (фибрилляция желудочков, синдром Фредерика и др.) | 46 | 0,11 |
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Сердечно-сосудистые осложнения свойственны пациентам с верифицированной новой коронавирусной инфекцией COVID-19 и находят отражения на изменённых электрокардиограммах. ЭКГ-феномены обнаружены у 54% пациентов. Наиболее частыми аритмиями явились наджелудочковая экстрасистолия и фибрилляция предсердий, выявленные у 12,6 и 12,0% пациентов соответственно. Признаки перегрузки правых отделов сердца проявлялись у 12,5% больных, из них у 1,13% (485 пациентов) ― ЭКГ-паттерн тромбоэмболии лёгочной артерии. Инфарктоподобные изменения на ЭКГ имели место в 4,5% случаев, в 3 из них ― паттерн Бругада. Частота встречаемости изменений ST-T составила 2,2% от числа всех наблюдавшихся больных. ЭКГ с удлинённым интервалом QT и QTc зарегистрирована у 540 пациентов (1,26%).
Наблюдались единичные случаи фибрилляции желудочков, синдрома Фредерика и АВ-блокады различной степени.
Обсуждение основного результата исследования
Проведённый анализ ЭКГ-исследований показал, что изменения ЭКГ при коронавирусной инфекции являются частыми и встречаются более чем у половины (54%) госпитализированных пациентов с подтверждённым COVID-19. Полученные данные коррелируют с общемировой статистикой распространённости сердечно-сосудистых осложнений при коронавирусной инфекции и находят подтверждение в работах многих авторов [9, 12–14]. Одной из причин распространённости сердечно-сосудистых осложнений при COVID-19 является непосредственно патогенез заболевания. Для развития инфекционного процесса необходимо связывание вирусного поверхностного белка с рецептором ангиотензинпревращающего фермента 2 (АПФ2). Рецепторы АПФ2, расположенные на мембранах пневмоцитов II типа, также широко экспрессируются в сердце и эндотелии сосудов, в том числе коронарном русле. Таким образом, происходит непосредственное повреждение миокарда вирусом. Развитие сердечно-сосудистых осложнений может быть вторичным по отношению к молекулярной мимикрии и развивается при активации иммунных реакций по типу «цитокинового шторма», усугубляясь гипоксией на фоне дыхательной недостаточности [6]. У пациентов с ранее существовавшими заболеваниями сердечно-сосудистой системы при инфицировании SARS-CoV-2 происходит усугубление основного заболевания, даже ранее хорошо контролируемого лекарственной терапией, за счёт развития лёгочной гипертензии, нарушения иммунной регуляции и непосредственного влияния вирусного агента, что в конечном итоге приводит к более тяжёлому течению COVID-19, в том числе пролонгированию госпитального этапа терапии, увеличению риска смерти и перевода в отделение интенсивной терапии [2, 6, 12, 15]. Становится очевидной связь между COVID-19 и сердечно-сосудистыми заболеваниями, при этом уже существующие патологии усугубляют течение инфекционного заболевания, а SARS-CoV-2 способствует или вызывает острые сердечно-сосудистые события [6].
Систематизация ЭКГ-феноменов у пациентов с новой коронавирусной инфекцией на основе большого массива данных позволила выявить и структурировать по частоте встречаемости различные электрокардиографические изменения, свойственные нарушениям ритма и проводимости, миокардиту, ишемии, перегрузке правых отделов сердца, в том числе тромбоэмболии лёгочной артерии, а также кардиотоксическому влиянию лекарственных препаратов группы производных 4-аминохинолина.
Наиболее распространённым ЭКГ-феноменом у пациентов с COVID-19 являлась наджелудочковая экстрасистолия (НЖЭ). В общей клинической практике НЖЭ является одной из самых встречаемых аритмий вне зависимости от гендерных и возрастных признаков. Развитию НЖЭ способствует наличие сердечно-сосудистых, эндокринных, бронхолёгочных заболеваний и других расстройств, приводящих к вовлечению в патологический процесс сердечно-сосудистой системы. Стоит также отметить, что и на фоне относительного здоровья пациента НЖЭ может возникнуть при воздействии стрессового фактора или при физической нагрузке, из-за применения медикаментозной терапии, курения и употребления кофеина. Прямое или опосредованное воздействие вирусного агента SARS-CoV-2 на миокард, метаболические нарушения, вызванные коронавирусной инфекцией, способствуют возникновению НЖЭ. Другие авторы также указывают на то, что НЖЭ является наиболее распространённой аритмией у пациентов с COVID-19 [2, 6, 9, 12].
Фибрилляция предсердий среди тахиаритмий в структуре ЭКГ-феноменов заняла лидирующую позицию и была зафиксирована у 12% пациентов с подтверждённой коронавирусной инфекцией. Следует сказать, что в общей популяции частота возникновения фибрилляции предсердий варьирует в пределах 1–2% [16]. Возникновение фибрилляции предсердий при вирусном процессе тесно связано с патофизиологическими механизмами аритмии, для запуска которой необходимы триггер и субстрат для её поддержания [16]. В контексте коронавирусной инфекции триггером для запуска аритмии могут стать системная воспалительная реакция, лихорадка, ковидиндуцированная гипоксемия [12, 14, 17]. Как показали результаты нашего исследования, средний возраст пациентов с патологическими изменениями ЭКГ составлял 69,6±15,7 года, что для возникновения фибрилляции предсердий является фактором риска, поскольку, согласно многочисленным клиническим исследованиям, вероятность развития фибрилляции предсердий повышается у лиц старше 40 лет. Возраст также является одним из 15 ключевых факторов при стратификации риска развития тромбоэмболических осложнений [16]. Стоит отметить, что при увеличении возраста повышается частота сопутствующей сердечно-сосудистой и эндокринной патологии, которая также вносит вклад в развитие фибрилляции предсердий. В ряде исследований авторы пришли к выводу, что наличие фибрилляции предсердий у пациентов с коронавирусной пневмонией значительно ухудшает прогноз заболевания [9, 13, 17, 18]. Так, Y. Wang и соавт. [18] проанализировали клинические особенности у 319 пациентов c тяжёлым и крайне тяжёлым течением COVID-19. Среди крайне тяжёлых пациентов превалировали лица мужского пола, тогда как среди субъектов с тяжёлым течением болезни преобладали женщины (p <0,05). Доля лиц с инсультом в группе больных в критическом состоянии была значительно выше, чем в группе с тяжёлым течением заболевания (p <0,05). Частота повышенных уровней кардиоспецифичного тропонина I (cTnI), натрийуретического пептида (NT-proBNP), D-димера, С-реактивного белка и гипокальциемии была выше у пациентов в критическом состоянии, чем у лиц с тяжёлым течением заболевания (р <0,001). Анализ с помощью многофакторной модели логистической регрессии показал, что повышенный уровень NT-proBNP и возраст были независимыми предикторами развития фибрилляции предсердий, которая в свою очередь являлась независимым фактором риска госпитальной смерти (OR=3,857; 95% ДИ 1,506–9,879) и применения искусственной вентиляции лёгких (OR=4,701; 95% ДИ 1,864–11,856) [18]. Опираясь на результаты исследований, указывающих на увеличение риска тромбоэмболических осложнений и смерти при тяжёлом течении коронавирусной инфекции, можно сделать вывод о необходимости тщательного подбора антикоагулянтной терапии пациентам с COVID-19 и сопутствующей фибрилляцией предсердий для уравновешивания риска тромбоэмболии и возможных кровотечений.
Синусовая тахикардия также является достаточно распространённым ЭКГ-синдромом при коронавирусной инфекции. По нашим наблюдениям, в общем контингенте больных с коронавирусной инфекцией частота синусовой тахикардии составила 7,13%. В исследовании D. Wang и соавт. [19], включавшем 138 пациентов, проходивших стационарное лечение по поводу COVID-19, тахикардия была выявлена в 17% случаев, при этом у лиц с тяжёлым течением заболевания и у находившихся в отделении интенсивной терапии частота аритмии достигала 44,4%, тогда как у других госпитализированных не превышала 6,9%. Развитие синусовой тахикардии негативно влияет на клиническое течение и прогноз заболевания. По сообщению Y. Wang и соавт. [18], синусовая тахикардия явилась независимым фактором риска госпитальной летальности (OR=6,545; 95% ДИ 3,166–13,531; p <0,001) и перевода пациентов на искусственную вентиляцию лёгких (OR = 4,804; 95% ДИ 2,322–9,941; p <0,001). Следует также помнить, что при длительно существующей тахикардии возможно снижение функционального резерва левого желудочка сердца в виде ослабления его насосной функции, вследствие чего возрастает риск развития тахииндуцированной кардиомиопатии.
Брадиаритмии были распространены в значительно меньшей степени. Так, из 23 113 субъектов с коронавирусной инфекцией и зарегистрированными нарушениями ЭКГ синусовая брадикардия была обнаружена лишь в 7 случаях, а атриовентрикулярные блокады различной степени ― в 19.
В проведённом исследовании перегрузка правых отделов сердца подтверждалась наличием признаков гипертрофии правого предсердия и желудочка, диастолического и систолического напряжения миокарда правого желудочка, лёгочной гипертензии, а также паттернов тромбоэмболии лёгочной артерии. Признаки перегрузки правых отделов были зафиксированы у 12,5% наблюдавшихся пациентов с COVID-19. Самым распространённым отображением избыточной нагрузки правых отделов сердца явилась их диастолическая перегрузка в виде блокады правой ножки пучка Гиса, преимущественно неполной формы. В исследовании Г.В. Рябыкиной [7], посвящённом изучению признаков электрокардиографического правожелудочкового стресса у больных COVID-19, при анализе 150 ЭКГ также было обнаружено, что к наиболее частым признакам нарушения функционирования правых отделов сердца относятся неполная блокада правой ножки пучка Гиса (42,6%), правопредсердная фаза зубца Р (41,3%), ЭКГ типа SIQIIITIII (33,3%) и признаки гипертрофии правого желудочка, в основном в виде увеличения зубца SV5–6 (14,7%). Особого внимания на фоне изменений правых отделов сердца заслуживала регистрация паттерна SIQIIITIII как маркера острого лёгочного сердца и развития тромбоэмболии лёгочной артерии. По данным литературы, регистрация SIQIIITIII, полной блокады правой ножки пучка Гиса, элевации ST в грудных отведениях V1–4 связана с высоким риском смерти [20]. Данный ЭКГ-паттерн был зарегистрирован у 485 пациентов, у которых впоследствии была подтверждена тромбоэмболия лёгочной артерии. Таким образом, учитывая острое поражение лёгочной ткани и существующий гиперкоагуляционный синдром, свойственный COVID-19, при регистрации ЭКГ-паттернов вовлечения в патологический процесс правых отделов сердца должна быть в первую очередь исключена острая тромбоэмболия лёгочной артерии.
Заслуживают внимания выявленные на ЭКГ маркеры острого повреждения миокарда и инфарктоподобные изменения. Развитие миокардита на фоне коронавирусной инфекции ― явление, по данным литературы, распространённое, патогенез которого связан с активным иммунным ответом на поражённый вирусом миокард [2, 3, 6, 8, 19, 20]. Острое повреждение миокарда коррелирует с высоким риском госпитальной летальности. Так, S. Shi и соавт. [2] в результате анализа клинических, лабораторных и инструментальных данных 416 госпитализированных пациентов с подтверждённой коронавирусной инфекцией выявили, что у лиц с признаками повреждения миокарда внутрибольничная летальность выше, чем у больных без данных признаков ― 51,2 против 4,5% (р <0,001). Пациенты с повреждением миокарда в сравнении с больными без такого осложнения имели более высокий риск смерти как в течение времени от начала симптомов (OR=4,26; 95% ДИ 1,92–9,49), так и от момента поступления до конечной точки (OR=3,41; 95% ДИ 1,62–7,16) [2].
К ЭКГ-признакам развившегося миокардита относят снижение амплитуды зубцов в отведениях от конечностей, элевацию сегмента ST, преобладающую в нижних и боковых отведениях, депрессию сегмента ST с инверсией зубца Т в отведениях V1 и aVR [20]. В проведённом нами исследовании подобные паттерны ST-T были зарегистрированы у 2,2% пациентов. Стоит также отметить, что на фоне миокардита могут развиваться жизнеугрожающие аритмии, блокады ножек пучка Гиса, удлинение интервала QT и инфарктоподобные изменения [3, 6, 20].
Отдельно следует остановиться на бругадоподобных изменениях ЭКГ, к которым относятся псевдоблокада правой ножки пучка Гиса и персистирующий подъём сегмента ST в отведениях V1–2 [7]. В анализируемом материале выявлено 3 подобных случая. Истинный синдром Бругада является генетическим заболеванием, при котором повышен риск развития фатальных аритмий и внезапной смерти. У пациентов с COVID-19 существующие длительная лихорадка, нарушение обмена веществ, вирусное поражение миокарда могут приводить к появлению на ЭКГ паттернов, схожих с картиной синдрома Бругада, однако в отличие от истинного синдрома Бругада данные нарушения являются преходящими и исчезают при улучшении общей картины заболевания. Тем не менее бругадоподобные изменения ЭКГ значительно затрудняют диагностическую и клиническую тактику, поскольку часто сочетаются с болями в грудной клетке, имитируя острый инфаркт миокарда [4, 20]. В генезе острой ишемии миокарда при коронавирусной инфекции основная роль отводится тромбозу коронарных артерий на фоне гиперактивации каскада коагуляции [6, 7], поэтому для дифференциальной диагностики важен анамнез пациента, а также данные коронароангиографии и исследования лабораторных маркеров повреждения миокарда. В проведённом исследовании ЭКГ-паттерны острой ишемии были выявлены у 0,5% пациентов.
Удлинение интервала QT и QTc среди возможных причин развития жизнеугрожающих аритмий было зарегистрировано у 1,26% больных, госпитализированных по поводу COVID-19. Следует отметить, что пациенты off label получали противомалярийные препараты, такие как хлорохин и гидроксихлорохин, а также антибиотик группы макролидов азитромицин. Известно, что указанные противомалярийные препараты обладают проаритмогенным эффектом за счёт прямого воздействия на клеточный трансмембранный потенциал, что на ЭКГ выражается удлинением интервала QT и QTс, вследствие чего возможно развитие пируэтной желудочковой тахикардии [5, 7, 20]. Применение макролидов также связано с удлинением интервала QT и несёт риск развития пируэтной желудочковой тахикардии, особенно в сочетании с сопутствующими брадикардией, гипокалиемией, гипомагниемией [20]. Учитывая данные особенности фармакологических эффектов при применении вышеперечисленных препаратов, всем получающим их пациентам может быть рекомендован постоянный мониторинг интервала QT для своевременной коррекции медикаментозной терапии и предотвращения развития жизнеугрожающих аритмий.
Ограничения исследования
Исследование имело определённые ограничения.
Материалом настоящего исследования служила неселективная выборка пациентов с подтверждённой коронавирусной инфекцией COVID-19 без учёта сопутствующей патологии, тяжести клинического состояния, данных лабораторных и других инструментальных методов обследования, длительности пребывания в условиях стационара. Такой подход к определению выборки является релевантным в контексте цели настоящего исследования и позволяет провести первичную структуризацию изменений ЭКГ на популяции жителей г. Москвы. Однако вопрос стратификации риска смерти, времени до полного восстановления, а также риска перевода пациентов в отделение интенсивной терапии представляет широкий практический интерес, и исследование с выделением субгрупп пациентов для вышеобозначенного анализа планируется в дальнейшем.
Следует также отметить, что при ранжировании ЭКГ-феноменов среди тахиаритмий фибрилляция предсердий была учтена как единая нозология, без дифференциации её форм. Выявленные изменения ЭКГ, свойственные перегрузке правых отделов сердца, миокардиту, коронарной болезни сердца, зачастую недостаточно специфичны и требуют верификации с помощью лабораторных тестов и инструментальных методов диагностики.
ЗАКЛЮЧЕНИЕ
На основе проведённого анализа получено представление о частоте встречаемости электрокардиографических феноменов у больных COVID-19. Подтверждена высокая инцидентность фибрилляции предсердий, которая является фактором риска тромбоэмболических осложнений, в особенности у пожилых лиц, при активации системы гемостаза на фоне коронавирусной инфекции. Одновременно установлена значительная распространённость ЭКГ-паттернов перегрузки правых отделов сердца, часть из которых ассоциирована с тромбоэмболией лёгочной артерии и может быть связана также с ковидиндуцированным поражением лёгочной ткани. Остальные встречавшиеся изменения ЭКГ характеризовались значительно меньшей распространённостью, что, однако, не снижает их клинического значения с учётом той опасности, которую они могут представлять для здоровья и качества жизни пациентов.
Электрокардиография остаётся наиболее удобным и доступным методом оценки патологии сердечно-сосудистой системы у пациентов с COVID-19, что объясняется технической простотой и низкой себестоимостью электрокардиографических исследований, а также возможностью удалённой оценки получаемых результатов.
Собранный материал в перспективе может служить оптимизации тактики ведения пациентов при коронавирусной инфекции.
ДОПОЛНИТЕЛЬНО
Источник финансирования. Статья подготовлена при поддержке Департамента здравоохранения города Москвы в рамках Программы «Научное обеспечение столичного здравоохранения» на 2020–2022 гг. (№ ЕГИСУ: АААА-А20-120071090050-1).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. А.Е. Демкина, В.Ю. Таскина, Т.М. Газашвили, А.В. Владзимирский, С.П. Морозов ― концепция и дизайн исследования; В.Ю. Таскина ― подбор литературных источников, написание текста; Т.М. Газашвили ― сбор и обработка материала; А.Е. Демкина, Т.М. Газашвили, А.В. Владзимирский, С.П. Морозов, А.С. Шкода ― редактирование текста. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Funding source. This article was prepared with support of Moscow Healthcare Department as a part of Program “Scientific Support of the Capital's Healthcare” for 2020–2022 (Unified State Information System for Accounting of Research, Development, and Technological Works No: EGISU: АААА-А20-120071090050-1.
Competing interests. The authors declare no obvious and potential conflicts of interest related to the publication of this article.
Authors’ contributions. A.E. Demkina, V.Y. Taskina, T.M. Gazashvili, A.V. Vladzymyrskyy, S.P. Morozov ― study concept and design; V.Y. Taskina ― literature search, manuscript writing; T.M. Gazashvili ― collection and processing of material; A.E. Demkina, T.M. Gazashvili, A.V. Vladzymyrskyy, S.P. Morozov, A.S. Shkoda ― manuscript review. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
Об авторах
Варвара Юрьевна Таскина
Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения города Москвы
Email: varvara.taskina@gmail.com
ORCID iD: 0000-0003-4452-7667
SPIN-код: 6314-8190
кандидат медицинских наук, научный сотрудник сектора научных проектов по телемедицине
Россия, 127051, Москва, ул. Петровка, д.24, стр.1Александра Евгеньевна Демкина
Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения города Москвы
Email: a.demkina@npcmr.ru
ORCID iD: 0000-0001-8004-9725
SPIN-код: 4657-5501
кандидат медицинских наук, начальник сектора научных проектов по телемедицине
Россия, 127051, Москва, ул. Петровка, д.24, стр.1Тамара Михайловна Газашвили
Городская клиническая больница № 67 имени Л.А. Ворохобова Департамента здравоохранения города Москвы
Email: tamaradoc24@gmail.com
ORCID iD: 0000-0002-5875-9699
SPIN-код: 4208-2303
руководитель центра инструментальной диагностики
Россия, 123423, Москва, ул. Саляма Адиля, д. 2/44Андрей Сергеевич Шкода
Городская клиническая больница № 67 имени Л.А. Ворохобова Департамента здравоохранения города Москвы
Email: a.shkoda@67gkb.ru
ORCID iD: 0000-0002-9783-1796
SPIN-код: 4520-2141
доктор медицинских наук, профессор, главный врач
Россия, 123423, Москва, ул. Саляма Адиля, д. 2/44Антон Вячеславович Владзимирский
Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения г. Москвы; Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Автор, ответственный за переписку.
Email: a.vladzimirsky@npcmr.ru
ORCID iD: 0000-0002-2990-7736
SPIN-код: 3602-7120
доктор медицинских наук, заместитель директора по науке; профессор кафедры информационных и интернет-технологий
Россия, 127051, Москва, ул.Петровка, д.24, стр.1; 119991, Москва, ул. Трубецкая, д. 8, стр. 2Сергей Павлович Морозов
Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения города Москвы
Email: morozov@npcmr.ru
ORCID iD: 0000-0001-6545-6170
SPIN-код: 8542-1720
доктор медицинских наук, профессор, директор
Россия, 127051, Москва, ул. Петровка, д.24, стр.1Список литературы
- Wu Z., McGoogan J.M. Characteristics of and important lessons from the Coronavirus Disease 2019 (COVID-19) outbreak in China: Summary of a Report of 72314 cases from the Chinese Center for Disease Control and Prevention//JAMA. 2020. Vol. 323, N 13. P. 1239–1242. doi: 10.1001/jama.2020.2648
- Shi S., Qin M., Shen B., et al. Association of cardiac injury with mortality in hospitalized patients with COVID-19 in Wuhan, China//JAMA Cardiol. 2020. Vol. 5, N 7. P. 802–810. doi: 10.1001/jamacardio.2020.0950
- Madjid M., Safavi-Naeini P., Solomon S.D., Vardeny O. Potential effects of coronaviruses on the cardiovascular system: a review//JAMA Cardiol. 2020. Vol. 5, N 7. P. 831–840. doi: 10.1001/jamacardio.2020.1286
- Vidovich M.I. Transient Brugada-like ECG pattern in a patient with coronavirus disease 2019 (COVID-19)//JACC Case Rep. 2020. Vol. 2, N 9. P. 1245–1249. doi: 10.1016/j.jaccas.2020.04.007
- Gérard A., Romani S., Fresse A., et al. "Off-label" use of hydroxychloroquine, azithromycin, lopinavir-ritonavir and chloroquine in COVID-19: A survey of cardiac adverse drug reactions by the French Network of Pharmacovigilance Centers//Therapie. 2020. Vol. 75, N 4. P. 371–379. doi: 10.1016/j.therap.2020.05.002
- Mai F., Del Pinto R., Ferri C. COVID-19 and cardiovascular diseases//J Cardiol. 2020. Vol. 76, N 5. P. 453–458. doi: 10.1016/j.jjcc.2020.07.013
- Рябыкина Г.В. Изменения электрокардиограммы при инфекции COVID-19//Кардиология. 2020. Т. 60, № 8. С. 16–22. doi: 10.18087/cardio.2020.8.n1192
- Потешкина Н.Г., Лысенко М.А., Ковалевская Е.А., и др. Кардиальное повреждение у пациентов с коронавирусной инфекцией COVID-19//Артериальная гипертензия. 2020. Т. 26, № 3. С. 277–287. doi: 10.18705/1607-419X-2020-26-3-277-287
- Lanza G.A., De Vita A., Ravenna S.E., et al. Electrocardiographic findings at presentation and clinical outcome in patients with SARS-CoV-2 infection//Europace. 2021. Vol. 23, N 1. Р. 123–129. doi: 10.1093/europace/euaa245
- Морозов С.П., Владзимирский А.В., Демкина А.Е., и др. Централизация описаний электрокардиографических исследований в первичном звене здравоохранения: методические рекомендации. Серия «Лучшие практики лучевой и инструментальной диагностики». Вып. 62. Москва: ГБУЗ «НПКЦ ДиТ ДЗМ», 2020. 24 с.
- Морозов С.П., Владзимирский А.В., Сименюра С.С., и др. Эффективность централизации электрокардиографических исследований в первичном звене здравоохранения//Креативная кардиология. 2020. Т. 14, № 1. С. 16–23. doi: 10.24022/1997-3187-2020-14-1-16-23
- Li Y., Liu T., Tse G., et al. Electrocardiograhic characteristics in patients with coronavirus infection: A single-center observational study//Ann Noninvasive Electrocardiol. 2020. Vol. 25, N 6. P. e12805. doi: 10.1111/anec.12805
- Bertini M., Ferrari R., Guardigli G., et al. Electrocardiographic features of 431 consecutive, critically ill COVID-19 patients: an insight into the mechanisms of cardiac involvement//EP Europace. 2020. Vol. 22, N 12. P. 1848–1854. doi: 10.1093/europace/euaa258
- Angeli F., Spanevello A., De Ponti R., et al. Electrocardiographic features of patients with COVID-19 pneumonia//Eur J Intern Med. 2020. Vol. 78. P. 101–106. doi: 10.1016/j.ejim.2020.06.015
- Demkina A.E., Morozov S.P., Vladzymyrskyy A.V., et al. Risk factors for outcomes of COVID-19 patients: an observational study of 795 572 patients in Russia//medRxiv. 2020. P. 2020.11.02.20224253. doi: 10.1101/2020.11.02.20224253
- Фибрилляция и трепетание предсердий. Клинические рекомендации (утв. Министерством здравоохранения Российской Федерации). 2020. Режим доступа: https://scardio.ru/content/Guidelines/2020/Clinic_rekom_FP_TP.pdf. Дата обращения: 21.05.2021.
- Hu Y.F, Cheng W.H., Hung Y., et al. Management of atrial fibrillation in COVID-19 Pandemic//Circ J. 2020. Vol. 84, N 10. P. 1679–1685. doi: 10.1253/circj.CJ-20-0566
- Wang Y., Chen L., Wang J., et al. Electrocardiogram analysis of patients with different types of COVID-19//Ann Noninvasive Electrocardiol. 2020. Vol. 25, N 6. P. e12806. doi: 10.1111/anec.12806
- Wang D., Hu B., Hu C., et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China//JAMA. 2020. Vol. 323, N 11. P. 1061–1069. doi: 10.1001/jama.2020.1585 [published correction appears in JAMA. 2021. Vol. 325, N 11. P. 1113. doi: 10.1001/jama.2021.2336]
- Шляхто Е.В., Пармон Е.В., Бернгардт Э.Р., Жабина Е.С. Особенности электрокардиографических изменений при некоронарогенных синдромах у пациентов с COVID-19//Российский кардиологический журнал. 2020. Т. 25, № 7. С. 194–200. doi: 10.15829/1560-4071-2020-4019.
Дополнительные файлы