Радиотераностика приходит на помощь
- Авторы: Румянцев П.О.1
-
Учреждения:
- Международный медицинский центр "СОГАЗ МЕДИЦИНА"
- Выпуск: Том 2, № 3 (2021)
- Страницы: 410-416
- Раздел: Редакционные статьи
- Статья получена: 13.08.2021
- Статья одобрена: 24.08.2021
- Статья опубликована: 15.10.2021
- URL: https://jdigitaldiagnostics.com/DD/article/view/77959
- DOI: https://doi.org/10.17816/DD77959
- ID: 77959
Цитировать
Аннотация
Ситуация с пандемией COVID-19 не уменьшила интереса к радиотераностике, скорее, наоборот, запрос на визуализацию патологических процессов с помощью кросс-секционных и гибридных томографических исследований (рентеновской и магнитно-резонансной, однофотонной эмиссионной, позитронно-эмиссионной) только усилился. Фактически за последние 15 мес в мире наблюдается экспоненциальный рост инвестиций в новые радиофармацевтические препараты для радиотераностики. По мере выяснения молекулярных механизмов регуляции и исполнения метаболических процессов, расширяется перечень антител и лигандов, меченных «медицинскими» радиоактивными изотопами. Также расширяется спектр диагностических и лечебных радиоактивных изотопов, что в конечном итоге развивает ассортимент и доступность радиотераностики в центрах ядерной медицины во всем мире. Для развития радиотераностики необходимо объединение усилий физиков, радиофармацевтов, химиков, биологов, врачей и математиков. Использование и совершенствование персонализированной дозиметрии для планирования радионуклидной терапии также является приоритетным направлением. Международный фонд Oncidium, например, помогает в информационном плане и обмену опытом, а международное диагностическое исследование NOBLE позволяет повысить доступность и снизить стоимость PSMA-рецепторной сцинтиграфии. В целях интенсификации интеграционного обновления ядерной медицины создана ассоциация развития тераностики.
Ключевые слова
Полный текст
ВВЕДЕНИЕ
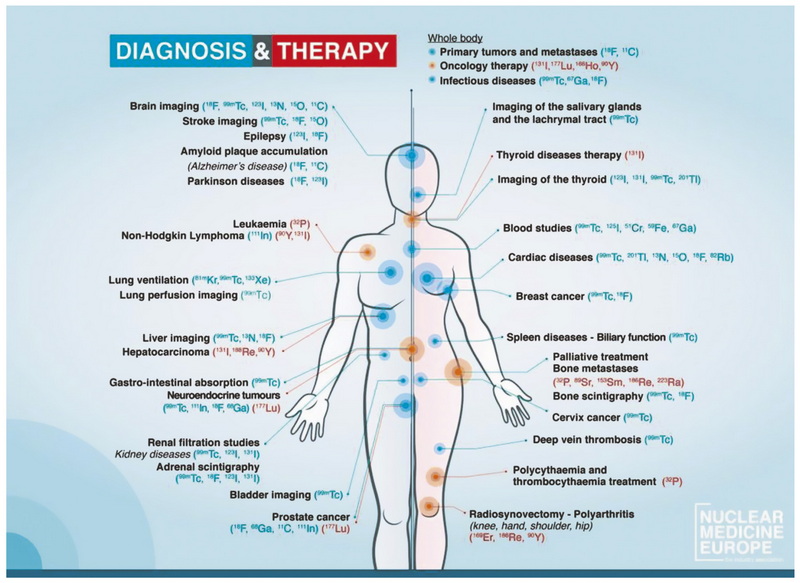
Недавние исследования и достижения в области ядерной медицины показали ведущую роль радиотераностики в онкологии. Каким бы термином ни определялось это перспективное направление ― радиотераностика, тераностика, радиотаргетная терапия, радиолигандная терапия, пептид-рецепторная терапия, радионуклидная терапия ― это новый вектор развития ядерной медицины, а именно диагностики и лечения злокачественных опухолей с помощью радиоактивных изотопов (рисунок).
Рис. Радиоактивные изотопы для диагностики и лечения различных заболеваний.
Ситуация с пандемией COVID-19 не уменьшила интереса к радиотераностике, а наоборот, запрос на визуализацию патологических процессов с помощью ультразвука, томографических исследований (компьютерного, магнитно-резонансного, однофотонного эмиссионного компьютерного, позитронно-эмиссионного) и гибридных методов только усилился. Фактически за последние 15 мес в мире наблюдается экспоненциальный рост инвестиций в новые радиофармацевтические лекарственные препараты (РФЛП) для радиотераностики. Данный тренд обусловлен не только наличием доступных средств у ищущих перспективные направления инвесторов, но также осознанием огромного потенциала роста рынка меченных радиоактивными изотопами молекул для терапии. Растущие инвестиции в радиотераностику основаны на успехах в данной области в течение последних 10 лет. Если оценивать прирост денежного капитала в данную отрасль в абсолютных величинах, то, например, рынок ядерной медицины 2019 года составлял 4,1 млрд долларов, а к 2024-му ожидается увеличение показателя до 5,2 млрд долларов при среднегодовом темпе роста в течение 5 лет на уровне 4,7% в год1. Ключевые игроки видят растущие доходы от терапевтических средств определённо более выдающимися, чем от диагностических. Повышенное внимание к радионуклидным технологиям в последние 20 лет сравнимо с ростом интереса к иммунотерапии рака в 1980–2000 гг.: в то время фармацевтическая индустрия предпочитала наблюдать эволюцию технологий через стартапы и разработки небольших компаний, большая часть из которых разорились, а оставшиеся довели технологии до совершенства, получив многомиллиардные прибыли.
Спектр радиотерапевтических препаратов на сегодня превышает 300 наименований и давно перекрыл перечень диагностических РФЛП, которые требуют гораздо меньших финансовых вложений. В течение последних 50 лет радиофармацевтическая индустрия в мире не располагала бюджетом для разработки подобных препаратов в государственных ведомствах. Только «традиционные» фармацевтические компании имели достаточный капитал и инфраструктуру для разработки и доведения радиофармпрепарата до рынка. В дополнение к своим огромным финансовым ресурсам они имеют доступ к целевой аудитории ― врачам (онкологам, радиологам, эндокринологам и др.). Фармкомпании Bayer (Германия) и Novartis (Швейцария) начали заниматься этим направлением первыми, выведя на рынок свои терапевтические РФЛП (223Ra-Xofigo и 177Lu-Lutathera соответственно) ограниченными дженерическими патентами и по этой причине не достигшими (во всяком случае до сих пор) уровня блокбастера (продаж на сумму более 1 млрд долларов в год). Тем не менее следующее поколение терапевтических РФЛП, например глутамат металлокарбоксипептидаза II (glutamate carboxypeptidase II, или prostate-specific membrane antigen, PSMA), будет базироваться на запатентованных наименованиях. Первый радиолиганд ― 177Lu-PSMA-617 при раке простаты (Novartis) ― ожидает выведения на мировой рынок в следующем году. Помимо компании Novartis, активно инвестирующей в новые радиотерапевтические препараты (например, на основе FAPI ― ингибитора протеина фибробластной активности для радионуклидной терапии большого числа злокачественных новообразований или CXCR4 ― рецептора хемокина-4, используемого при миеломной болезни, лимфомах, альдостероме, раке пищевода, глиобластоме), заметен нарастающий интерес к отрасли по всему миру со стороны компаний iTheranostics (Швейцария) Sofie Biosciences (США), Aktis Oncology (США), коллабораций Astellas (Япония) и Actinium Pharma (США), Jubilant (Индия) и Sofie Biosciences (США), Lantheus и Noria Therapeutics (США), Bracco Blue Earth Diagnostics (Италия) и Scintomics (Германия), Fusion Pharma (Канада) и Ipsen (Франция) и совсем недавно образованного консорциума EZAG и Pentixapharm (Германия) и др. Ежегодно на рынке радиофармацевтики появляются новые имена, например образованные в 2020 году компании Abscint (Бельгия), Abdera Therapeutics (Канада), Precirix (Бельгия), RayzeBio (США) и др.
Все эти компании очень молоды и возникли на стыке ядерной медицины, радиофармацевтики и медицинской физики. Компания Telix Pharmaceutical (Австралия) разрабатывает новейшие радиотераностики при раке предстательной железы (iPSMA, J591), глиобластоме, раке почке, раке мочевого пузыря и раке яичников, комбинируя в своём продуктовом портфеле РФЛП на основе меченных 177Lu пептидов и моноклональных антител в сочетании с 177Lu и 131I.
Современные подходы в лечении нейроэндокринных опухолей и рака предстательной железы представлены не только радиотергетной терапией в монорежиме, т.е. одним РФЛП в течение всех курсов, но и применением «тандемных» радиофармпрепаратов, комбинированием одинаковых молекул оснований с различными радиоизотопными метками. Примером такой работы является последовательное применение 177Lu-PSMA-617 и 225Ас-PSMA-617. Одной из первых компаний, специализирующейся на мечении лигандов альфа-излучателем 225Ас, стала Fusion Pharmaceuticals, образованная в 2014 г. Профилем компании Precision Molecular Inc. (США), созданной в 2019 г., является радиотаргетная терапия рака предстательной железы и других злокачественных новообразований с применением 177Lu и 225Ас. Начиная с 2020 г. над созданием и внедрением радиотераностиков для терапии нейроэндокринных опухолей и рака предстательной железы на основе РФЛП с 177Lu активно трудятся компании Point Biopharma (США) и RayzeBio, ориентированная на аналогичные лиганды, меченные 225Ac.
В настоящее время более 60 радиотераностиков, нацеленных более чем на 20 злокачественных опухолей, находятся на разных стадиях клинических исследований, из них 6 ― на III фазе. Из первых 27 наименований РФЛП (9 для нейроэндокринных опухолей и 18 для рака предстательной железы) только единичные, а именно наиболее эффективные и безопасные выйдут на медицинский рынок.
Дальнейшее развитие радиотераностики, особенно в комбинации с уже имеющимися методами противоопухолевой терапии, существенно расширит спектр онкологических заболеваний с высоким положительным ответом на лечение. В онкологии радиотераностика может оказаться альтернативой операции (как в случае с радиойодтерапией тиреотоксикоза) или адъювантным (как при раке щитовидной железы) методом лечения вкупе с хирургией и гормонотерапией, а в других случаях в сочетании с дистанционной лучевой терапией, химиотерапией, таргетными препаратами.
Таблица. Концепция радиотераностики рака предстательной железы
Этап | Диагностика (молекулярная визуализация) | Операция | Дозиметрия | Радионуклидная терапия | Динамическое наблюдение | ||
Цель | Стадия опухоли, экспрессия рецепторов PSMA в клетках опухоли, контроль эффективности лечения | Интраоперационная радионавигация | Радиокинетика, планирование радионуклидной терапии | Лечение | Выявление и локализация рецидива опухоли | ||
Метод визуализации | ОФЭКТ/КТ | ПЭТ/КТ или ПЭТ/МРТ | Гамма-зонд | ОФЭКТ | ОФЭКТ** | ОФЭКТ/КТ, ПЭТ/КТ, ПЭТ/МРТ | |
РФЛП | 99mTc-HYNIC-PSMA | 68Ga-PSMA-11* | 99mTc-HYNIC-PSMA, 99mTc-наноколлоид | 177Lu-PSMA (617, I&T, J591) | 99mTc-HYNIC-PSMA, 68Ga-PSMA-11*, 18F-PSMA-1007 | ||
18F-PSMA-1007 | |||||||
Дополнительные методы | ТРУЗИ, МСКТ/МРТ, пункция, ОС, ПСА | ||||||
Примечание. * Более предпочтителен (тераностическая пара с 177Lu-PSMA); ** посттерапевтическая сцинтиграфия всего тела (ОФЭКТ всем, ОФЭКТ/КТ по показаниям). ОФЭКТ ― однофотонная эмиссионная компьютерная томография; КТ ― компьютерная томография; МРТ ― магнитно-резонансная томография; ПЭТ ― позитронная эмиссионная томография; ТРУЗИ ― трансректальное ультразвуковое исследование; МСКТ ― мультиспиральная компьютерная томография; ОС ― остеосцинтиграфия; ПСА ― простатспецифичный антиген.
По мере накопления доказательной клинической базы будут уточняться показания к применению радиоактивных изотопов в третьей, второй и первой линиях противоопухолевой терапии. Концепция радиотераностики генерирует большой интерес к персонализированной медицине, при которой пациент лечится не по общему стандарту, а по индивидуальному плану, где с помощью специфических радиотераностиков определяются объекты и механизмы лечения (таблица). Но это ― всё ещё цель, для достижения которой предстоит решить массу логистических и регуляторных вопросов, что позволит обеспечить финансовые инвестиции фармацевтических компаний и частных инвесторов в перспективное направление персонализированной медицины. Кроме того, предстоит большая информационная и методическая работа с врачами, «неядерными» физиками, химиками, а также общественным мнением.
УСКОРЯЮЩЕЕСЯ РАЗВИТИЕ РАДИОТЕРАНОСТИКИ В МИРЕ
В целях широкого информирования населения и специалистов по вопросам радиотераностики в 2011 г. создан и функционирует глобально по всему миру международный некоммерческий фонд Oncidium2 (штаб-квартира находится в Бельгии). Приоритетной миссией фонда является продвижение и ускорение развития радиотераностики в онкологии, повышение её доступности для онкологических пациентов по всему миру путём обновления информации о работе центров, и мы надеемся, что и в Российской Федерации число таких центров также будет расти.
Информационный раздел на сайте непрерывно обновляется информацией о новых радиофармпрепаратах, доказательной базе их доклинических и клинических испытаний и практического применения, механизмах действия, эффективности и безопасности, комбинациях с другими технологиями диагностики и лечения онкологических заболеваний. Например, инициирован регистр Noble (NOBLE Registry) ― проект международного сотрудничества, который открывает пациентам с раком предстательной железы доступ к однофотонной эмиссионной компьютерной томографии (ОФЭКТ), а лучше к ОФЭКТ, совмещённой с компьютерной томографией (КТ) и PSMA вне зависимости от места их жительства и финансовой ситуации, в частности когда позитронно-эмиссионная томография (ПЭТ) с PSMA недоступна. Простота и удобство (генератор технеция всегда под рукой) исследования ОФЭКТ/КТ с PSMA гораздо выше, чем ПЭТ/КТ, а стоимость ― существенно ниже, при этом возможно виртуальное цифровое совмещение, если ОФЭКТ выполнено не в гибридном режиме с КТ. В рамках проекта NOBLE Registry проводится сопоставление результатов ОФЭКТ/КТ и ПЭТ/КТ с PSMA, уточняются параметры точности, преимуществ и ограничений, показаний к назначению. Однако фонд не может решать все проблемы в одиночку, и ему на помощь пришли 18 экспертов в области ядерной медицины и радиотераностики из 11 стран мира, среди которых есть и представители Российской Федерации ― П.О. Румянцев и Е.В. Каргапольцева. Научный совет фонда Oncidium и управляющий комитет NOBLE Registry состоят из авторитетных лидеров в области ядерной медицины, и для меня большая честь входить в их состав. Научный совет обеспечивает международную коммуникацию и совершенствование радиотераностики с учётом разработки новых радиофармпрепаратов и технологий молекулярной визуализации следующего поколения (Next Generation Imaging, NGI).
В 2021 г. в Российской Федерации зарегистрирована Ассоциация развития тераностики[3].
В связи с тем, что радиотераностика предоставляет возможность обновления подходов к персонализированной диагностике, лечению и реабилитации онкологических пациентов, закономерно появление множества организационных, методических, экономических и регуляторных вопросов. По мнению зарубежных коллег, стоимость сеанса радионуклидной терапии нового поколения на одного пациента будет варьировать в диапазоне 15–50 тыс. долларов США, и это без учёта стоимости дианостического обследования с использованием ОФЭКТ и/или ПЭТ, необходимых для дозиметрического планирования и контроля лечения.
Токсичность и частота применения радионуклидной терапии значительно ниже, чем при химиотерапии или дистанционной лучевой терапии, но зачастую врачам, не имеющим представления и опыта работы с данной областью медицины, такая информация неизвестна. Как показывает клиническая практика, пациент имеет максимальную комплаентность при высоком соотношении польза/удобство варианта лечения.
ЗАКЛЮЧЕНИЕ
В этой связи «ядерные» онкологи значительно усиливают потенциал мультидисциплинарных команд в передовых клиниках всего мира. У пациентов с начальными стадиями опухоли врачи могут улучшить результаты лечения путём увеличения дозы облучения, параллельно улучшая качество жизни за счёт минимизации дозы на окружающие ткани. При поздних стадиях врачи могут улучшать качество жизни, как правило, через регрессию (не излечение), стабилизацию опухоли или паллиативную помощь, снижая дозу на неопухолевые ткани. Использование и совершенствование персонализированной дозиметрии для планирования радионуклидной терапии является приоритетным направлением, обеспечивающим подведение оптимальной дозы к опухолевой ткани и минимизацию эффекта влияния ионизирующего излучения на нормальные ткани для эффективного и безопасного лечения каждого пациента.
ДОПОЛНИТЕЛЬНО
Источник финансирования. Автор заявляет об отсутствии внешнего финансирования при проведении поисково-аналитической работы и подготовке статьи.
Конфликт интересов. Автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад автора. Автор подтверждает соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Funding source. The authors declare that there is no external funding for the exploration and analysis work.
Competing interests. The authors declare no obvious and potential conflicts of interest related to the publication of this article.
Author’s contribution. The author made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
1 Nuclear Medicine/Radiopharmaceuticals Market by Type [Diagnostic (SPECT ― Technetium, PET ― F-18), Therapeutic (Beta Emitters ― I-131, Alpha Emitters, Brachytherapy ― Y-90)], Application (Oncology, Cardiology), Procedures ― Global Forecast to 2026. Режим доступа: https://www.marketsandmarkets.com/Market-Reports/radiopharmaceuticals-market-417.html. Дата обращения: 10.07.2021.
2 Oncidium. Официальный сайт: https://www.oncidiumfoundation.org.
3 Ассоциация развития тераностики. Официальный сайт: http://theranostics.pro
Об авторах
Павел Олегович Румянцев
Международный медицинский центр "СОГАЗ МЕДИЦИНА"
Автор, ответственный за переписку.
Email: pavelrum@gmail.com
ORCID iD: 0000-0002-7721-634X
SPIN-код: 7085-7976
ResearcherId: C-6647-2012
Заместитель главного врача, Главный онколог–радиолог
Россия, 191186, Санкт-Петербург, Финляндский проспект 4 лит АСписок литературы
Дополнительные файлы