Comparison of the diagnostic accuracy of whole-body diffusion-weighted imaging and 18F-prostate-specific membrane antigen-1007 positron emission tomography combined with computed tomography for detecting bone metastases in prostate cancer
- Authors: Gelezhe P.B.1,2, Reshetnikov R.V.1, Blokhin I.A.1, Kodenko M.R.1
-
Affiliations:
- Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
- European Medical Center
- Issue: Vol 6, No 2 (2025)
- Pages: 239-250
- Section: Original Study Articles
- Submitted: 10.06.2024
- Accepted: 06.12.2024
- Published: 08.07.2025
- URL: https://jdigitaldiagnostics.com/DD/article/view/633391
- DOI: https://doi.org/10.17816/DD633391
- EDN: https://elibrary.ru/QXLAWR
- ID: 633391
Cite item
Full Text
Abstract
BACKGROUND: The increasing availability of 18F-prostate-specific membrane antigen-1007 (18F-PSMA-1007) for prostate cancer staging highlighted its advantages, particularly its higher spatial resolution compared to analogs. Moreover, accumulating scientific data indicate an increase in false-positive findings, predominantly in bones, which may lead to unwarranted upstaging of the disease. Diffusion-weighted imaging may be used for the early detection of bone metastases.
AIM: This study aimed to assess and compare the diagnostic accuracy of whole-body 18F-PSMA-1007 positron emission tomography combined with computed tomography and whole-body and pelvic bone diffusion-weighted imaging in patients with prostate cancer.
METHODS: A retrospective single-center selective study was conducted. The imaging results of 119 patients with prostate cancer were divided into two groups: group 1 comprised 40 pairs of 18F-PSMA-1007 positron emission tomography combined with computed tomography and whole-body diffusion-weighted magnetic resonance imaging scans, and group 2 included 79 pairs of similar studies, with magnetic resonance imaging performed only for the pelvic bones. The diagnostic studies were performed at an inter-study interval ≤14 days. The metastatic bone lesions detected in different anatomical regions was counted using data from 18F-PSMA-1007 positron emission tomography combined with computed tomography and magnetic resonance imaging. Lesions were considered true positives if confirmed by additional magnetic resonance imaging pulse sequences and/or follow-up observation.
RESULTS: Whole-body diffusion-weighted imaging demonstrated higher specificity (58.1%) for detecting bone metastases than 18F-PSMA-1007 positron emission tomography combined with computed tomography (51.06%). However, its sensitivity was lower: 93.22% versus 97.55%.
CONCLUSION: Despite its advantages, 18F-PSMA-1007 positron emission tomography combined with computed tomography shows a high rate of false-positive bone findings. These are most commonly noted in the ribs, vertebrae, and pelvic bones. Suspicious bone lesions should be further evaluated to avoid unjustified disease upstaging. Thus, whole-body magnetic resonance imaging with diffusion-weighted sequences and selective fat signal suppression can be used.
Full Text
ОБОСНОВАНИЕ
Позитронно-эмиссионную томографию, совмещённую с компьютерной томографией (ПЭТ/КТ) и основанной на использовании радиофармпрепаратов (РФП), связывающихся с простатоспецифичным мембранным антигеном (ПСМА), всё более широко применяют в клинической практике для стадирования рака предстательной железы. ПЭТ/КТ стала методом выбора в диагностике его биохимического рецидива [1, 2]. В некоторых клинических исследованиях доказано преимущество ПЭТ/КТ с РФП, способными связываться с ПСМА, в локализации биохимического рецидива по сравнению с магнитно-резонансной томографией (МРТ), КТ и РФП, мечеными холином [3, 4]. Кроме того, применение ПСМА позволяет повысить точность первичного стадирования рака предстательной железы среднего и высокого риска [5].
В Соединённых Штатах Америки (США) и странах Европы наиболее распространённым изотопом, применяющимся для создания РФП на основе ПСМА, является галлий-68. В частности, в США 68Ga-ПСМА-11 был первым РФП для ПЭТ, который одобрили для использования у пациентов с раком предстательной железы [6]. Развитие радиофармацевтики привело к широкому распространению лигандов 18F-ПСМА, в частности 18F-ПСМА-1007.
Основными техническими преимуществами лигандов 18F-ПСМА по сравнению 68Ga-ПСМА являются более длительный период полураспада (110 против 68 мин), а также возможность их получения с помощью циклотронной продукции. Более низкая энергия позитронной эмиссии 18F-ПСМА по сравнению с 68Ga-ПСМА (0,6 по сравнению с 2,3 МэВ) является причиной повышенного пространственного разрешения при сканировании фантомов [7]. Дополнительным преимуществом 18F-ПСМА-1007 можно назвать низкую фоновую активность РФП в мочевыводящих путях [8].
Однако с накоплением опыта использования 18F-ПСМА-1007 стали появляться сведения о более высокой частоте ложноположительных находок в костях [9], что может приводить к необоснованному завышению стадии заболевания и, как следствие, к неадекватному выбору тактики лечения.
Несколько десятилетий назад в диагностической практике начали применять МРТ, к ключевым преимуществам которой относят превосходную мягкотканную контрастность и отсутствие лучевой нагрузки.
Диффузионно-взвешенные изображения (ДВИ) — это один из режимов МРТ, основанный на регистации микроскопических движений воды на клеточном уровне. Он позволяет получать как количественные (например, измеряемый коэффициент диффузии), так и качественные данные (интенсивность сигнала), что используют для дифференциальной диагностики доброкачественных и злокачественных новообразований [10].
Сначала ДВИ использовали для оценки заболеваний головного мозга, в частности выявления зоны ишемического инфаркта на основании ограничения диффузии. В конце 90-х годов некоторые технические усовершенствования, такие как создание режима ДВИ с подавлением фонового сигнала (Diffusion-Weighted Imaging with Background Suppression, DWIBS), позволили расширить область применения ДВИ для диагностики экстракраниальных патологических процессов. Ключевой особенностью DWIBS стала быстрая визуализация всего тела без задержки дыхания, что открыло перспективы для стадирования онкологических заболеваний [10].
Однако DWIBS в моно-режиме не является самодостаточной методикой по причине низкой разрешающей способности. Основное преимущество DWIBS — обнаружение патологического очага на основе его высокой интенсивности сигнала при высоких значениях b-фактора [11]. Для точной анатомической локализации выявленного патологического очага ДВИ всего тела обязательно дополняют базовыми импульсными последовательностями, включая Т1-взвешенные изображения (ВИ), инверсию– восстановление спинового эха (Short Tau Inversion Recovery, STIR), а также некоторые другие [12].
В настоящее время ДВИ применяют для визуализации метастатического процесса. Злокачественные опухоли, как правило, демонстрируют повышение сигнала на ДВИ по сравнению с доброкачественными процессами. Причиной ограничения диффузии тканями опухоли может быть бóльшее количество клеток на единицу объёма и, как следствие, меньшие межклеточные промежутки. К преимуществам ДВИ всего тела следует отнести небольшое время сбора данных (около 20 мин), отсутствие ионизирующего излучения и необходимости внутривенного контрастного усиления. Кроме того, режим ДВИ является уточняющей импульсной последовательностью при исследованиях всего тела в онкологии, в частности для диагностики отдалённых метастазов [13].
ЦЕЛЬ
Оценка диагностической точности ПЭТ/КТ всего тела с 18F-ПСМА-1007 в сравнении с ДВИ всего тела и костей малого таза у пациентов с раком предстательной железы.
МЕТОДЫ
Дизайн исследования
Проведено ретроспективное одноцентровое выборочное исследование.
Критерии соответствия
Критерии включения:
- наличие заболевания (рак предстательной железы) с признаками биохимического рецидива;
- наличие мультипараметрической МРТ предстательной железы;
- наличие МРТ всего тела с ДВИ;
- наличие ПЭТ/КТ с 18F-ПСМА-1007 всего тела;
- соблюдение временного интервала между МРТ и ПЭТ не более 14 дней.
Критерии невключения: отсутствие одного или нескольких клинических маркёров, соответствующих диагнозу рака предстательной железы.
Критерии исключения: выраженные артефакты ДВИ малого таза, всего тела, ПЭТ/КТ с 18F-ПСМА-1007 всего тела, не позволяющие адекватно оценить исследование.
Условия проведения
Набор пациентов, которым выполняли ПЭТ/КТ с 18F-ПСМА-1007, МРТ всего тела в режиме ДВИ и предстательной железы, осуществляли на базе частного медицинского учреждения АО «Европейский медицинский центр».
Продолжительность исследования
Для проведения исследования отобраны записи электронных историй болезни за период с 01.01.2023 по 01.06.2023.
Описание медицинского вмешательства
На первом этапе исследования сформированы два набора данных:
- ПЭТ/КТ с 18F-ПСМА-1007 и ДВИ всего тела;
- ПЭТ/КТ с 18F-ПСМА-1007 и ДВИ костей таза.
Исследования выполненны при соблюдении временного интервала между МРТ и ПЭТ не более 14 дней.
Вторым этапом осуществляли подсчёт количества выявленных метастатических очагов костей в различных анатомических областях по данным ПЭТ с 18F-ПСМА-1007 и МРТ.
ПЭТ/КТ с 18F-ПСМА-1007 выполняли на томографе Biograph® mCT (Siemens Healthineers, Германия). Зона сканирования включала область от «макушки до пяток». Активность вводимого РФП определяли из расчёта 3,0–4,0 МБк на 1 кг массы тела, поэтому средняя активность составляла 250–350 МБк. После введения РФП пациенты находились в состоянии покоя в течение 60 мин. Им проводили пероральную гидратацию в объёме 500 мл воды. Продолжительность сканирования одного аксиального окна видения (области, соответствующей положению пациента на столе томографа, также известной как «кровать») составляла 3 мин.
Сомнительными и положительными по данным ПЭТ считают очаги, соответствующие критериям PSMA-RADS-31, PSMA-RADS-42, PSMA-RADS-53 [14]. Истинно положительными считают очаги, подтверждённые с помощью дополнительных импульсных последовательностях МРТ, в частности:
- аксиальные Т1-ВИ в фазе и противофазе, Т2-ВИ HASTE4 и сагиттальные Т1-ВИ позвоночного столба для набора данных МРТ всего тела;
- аксиальные Т1-ВИ в фазе и противофазе, Т2-ВИ HASTE4, данные Т1-ВИ с динамическим контрастным усилением для набора данных МРТ таза [15].
Для сканирования применяли подключаемую головную катушку, две гибкие катушки для тела, а также спинальную катушку. Общая продолжительность сканирования зависела от антропометрических данных пациента, но не превышала 50 мин. Протоколы сканирования МРТ предстательной железы и всего тела с ДВИ представлены в табл. 1.
Таблица 1. Протоколы сканирования магнитно-резонансной томографии предстательной железы и всего тела с диффузионно-взвешенными изображениями
Импульсная последовательность | Ориентация срезов | TE/TR, мс | Область обзора, мм | Толщина среза, мм / перекрытие, % |
Мультипараметрическая магнитно-резонансная томография предстательной железы | ||||
Т2-взвешенное изображение TSE | Сагиттальная | 120/3800 | 250×250 | 3/0,3 |
Т2-взвешенное изображение TSE | Аксиальная | 110/3938 | 180×180 | 2,5/0 |
Диффузионно-взвешенное изображение SS-EPI | Аксиальная | 87/2425 | 160×160 | 3/0,3 |
Диффузионно-взвешенное изображение SS-EPI | Аксиальная | 59/5400 | 200×200 | 3/0 |
Т2-взвешенное изображение TSE | Корональная | 110/2500 | 160×160 | 2,5/0 |
Т1-взвешенное изображение с динамическим контрастным усилением, временное разрешение 15 с | Аксиальная | 2,3/4,6 | 250×250 | 3/0 |
Т1-взвешенное изображение после контрастного усиления | Аксиальная | 1,3/2,3 | 400×350 | 4/0 |
Магнитно-резонансная томография всего тела с диффузионно-взвешенными изображениями | ||||
Диффузионно-взвешенное изображение SS-EPI | Аксиальная | 76/15 600 | 380×285 | 5/0 |
Т1-взвешенное изображение TSE | Сагиттальная | 12/630 | 340×340 | 4/0 |
Т2-взвешенное изображение HASTE | Аксиальная | 91/1400 | 385×313 | 6/0 |
Т1- взвешенное изображение VIBE DIXON | Аксиальная | 6,69/2,39–4,77 | 380×309 | 4/ |
Т2- взвешенное изображение TIRM | Аксиальная | 86/7200 | 230×201 | 5/0 |
Примечание. TSE (Turbo Spin Echo) ― турбоспин-эхо; SS-EPI (Single-Shot Echo Planar Imaging) ― однокадровая эхопланарная визуализаия; HASTE (Half-Fourier Acquisition Single-shot Turbo Spin Echo) — быстрая последовательность, которая позволяет получать всё изображение за один радиочастотный импульс); VIBE DIXON (Volumetric Interpolated Breath-hold Examination) — объёмная градиентная последовательность с жироподавлением методом Dixon; TIRM (Turbo Inversion Recovery Magnitude) — инверсно-восстановительная последовательность с подавлением сигнала от жира; TE (Echo Time) — время эхо; TR (Repetition Time) — время повторения. | ||||
Основной исход исследования
Выявление метастатических поражений костей по данным ПЭТ/КТ с 18F-ПСМА-1007, а также по результатам диффузионно-взвешенной визуализации всего тела и костей малого таза с последующей верификацией с использованием дополнительных импульсных последовательностей МРТ.
Анализ в группах
Все результаты исследований пациентов разделены на две группы:
- 1-я группа — данные ПЭТ/КТ с 18F-ПСМА-1007 и МРТ с ДВИ всего тела;
- 2-я группа — данные ПЭТ/КТ с 18F-ПСМА-1007 и МРТ с ДВИ костей таза.
Методы регистрации исходов
Информацию о количестве выявленных очагов вносили в таблицу с указанием анатомической локализации. Разделение по анатомическим областям предусматривало отдельный подсчёт количества метастазов в костях черепа, лопатках, рёбрах, тазовых костях и позвонках. При этом оценку количества метастазов в костях таза проводили отдельно для выборок с результатами МРТ всего тела и таза.
Каждый выявленный очаг по данным ПЭТ/КТ с 18F-ПСМА-1007, МРТ с ДВИ всего тела и костей таза сопоставляли с референс-тестом — изображениями МРТ, полученными с использованием дополнительных импульсных последовательностей. К истинно положительным относили только очаги, соответствующие диагностическим критериям метастатического поражения по данным дополнительных импульсных последовательностей МРТ, включая селективное подавление сигнала от жировой ткани (Т1-ВИ в фазе и противофазе), позволяющее надёжно дифференцировать метастатический очаг и зону реконверсии красного костного мозга [16, 17].
Этическая экспертиза
Проведение исследования одобрено независимым этическим комитетом Государственного бюджетного учреждения здравоохранения города Москвы «Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения города Москвы» (протокол заседания № 10/2023 от 21.12.2023).
Статистический анализ
Принципы расчёта размера выборки
В связи с отсутствием достаточных данных, позволяющих делать точные прогнозы относительно ожидаемых эффектов, при расчёте размера выборки мы ориентировались на средний ожидаемый размер эффекта, равный 0,5 [18]. Согласно номограмме Альтмана, при данном значении эффекта, уровне статистической значимости 0,05 и мощности 0,8 необходимый размер выборки составляет 120 пациентов [19].
Методы статистического анализа данных
Для оценки диагностической точности подходов рассчитывали значения чувствительности и специфичности.
- Чувствительность (Se) оценивали как долю истинно положительных результатов:
, (1)
где ТР — количество истинно положительных результатов; FN — количество ложноотрицательных результатов.
- Специфичность (Sp) оценивали как долю истинно отрицательных результатов:
, (2)
где TN — количество истинно отрицательных результатов; FP — количество ложноположительных результатов.
За количество истинно положительных результатов принимали число очагов в исследуемой анатомической области, подтверждённых по данным дополнительных импульсных последовательностей МРТ. Количество истинно отрицательных результатов оценивали как число пациентов с отсутствием находок в исследуемой анатомической области по результатам индекс- и референс-теста. В случае, если число очагов в исследуемой анатомической области, найденных по результатам индекс-теста, превышало аналогичный показатель для референс-теста, разницу между этими числами принимали за количество ложноположительных результатов. В обратном случае разницу принимали за количество ложноотрицательных результатов. Значения чувствительности и специфичности каждого индекс-теста для каждой области скелета даны с указанием 95% доверительных интервалов (ДИ). Общие значения чувствительности и специфичности каждого индекс-теста представлены как средние значения и размах. Сравнение между и индекс- и референс-тестами проводили с помощью критерия МакНемара.
Все вычисления выполняли в программной среде R 4.2.15 [20].
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Проанализировали результаты исследований 119 пациентов:
- 1-я группа — 40 пар данных ПЭТ/КТ 18F-ПСМА-1007 и МРТ с ДВИ всего тела;
- 2-я группа — 79 пар данных ПЭТ/КТ 18F-ПСМА-1007 и МРТ с ДВИ костей таза.
Общее количество выявленных метастатических очагов в 1-й группе, подтверждённых дополнительными импульсными последовательностями, продемонстрированы в табл. 2.
Таблица 2. Количество метастатических очагов скелета, выявленных в 1-й группе
Анатомическая область | ПЭТ/КТ с 18F-ПСМА-1007, n | ДВИ всего тела, n | Очаги, подтверждённые другими импульсными последовательностями МРТ, n |
Череп | 53 | 50 | 35 |
Лопатки | 59 | 55 | 46 |
Рёбра | 240 | 218 | 167 |
Позвонки | 225 | 220 | 176 |
Таз | 135 | 131 | 114 |
Конечности | 22 | 29 | 20 |
Примечание. ПЭТ/КТ — позитронно-эмиссионная томография, совмещённая с компьютерной томографией; ПСМА — простатоспецифичный мембранный антиген; ДВИ — диффузионно-взвешенное изображение; МРТ — магнитно-резонансная томография. | |||
Общее количество выявленных метастатических очагов во 2-й группе, подтверждённых дополнительными импульсными последовательностями, представлены в табл. 3. Помимо метастатического поражения скелета, во 2-й группе у 31 пациента выявлены признаки рецидива рака предстательной железы в области везикоуретрального анастомоза, у 59 пациентов — признаки метастатического поражения тазовых лимфатических узлов. В 1-й группе признаки рецидива в области везикоуретрального анастомоза установлены у 17 пациентов, метастатического поражения забрюшинных и тазовых лимфатических узлов — у 28 пациентов.
Таблица 3. Количество метастатических очагов, выявленных во 2-й группе
Анатомическая область | ПЭТ/КТ с 18F-ПСМА-1007, n | ДВИ всего тела, n | Очаги, подтверждённые другими импульсными последовательностями МРТ, n |
Таз | 118 | 80 | 79 |
Конечности | 30 | 18 | 18 |
Примечание. ПЭТ/КТ — позитронно-эмиссионная томография, совмещённая с компьютерной томографией; ПСМА — простатоспецифичный мембранный антиген; ДВИ — диффузионно-взвешенное изображение; МРТ — магнитно-резонансная томография. | |||
Основные результаты исследования
Распределение метастатических очагов по анатомическим областям в процентном соотношении составило:
- в костях черепа — 12,5%;
- в позвоночнике — 42,5%;
- в рёбрах — 27,5%;
- в лопатках — 17,5%;
- в костях таза — 42,5%;
- в конечностях — 17,5%.
Наивысшие показателями чувствительности и специфичности при использовании ДВИ всего тела составили 93,22 (95% ДИ 87,67–97,81) и 58,10% (95% ДИ 31,54–74,62) соответственно. Для ПЭТ/КТ всего тела с 18F-ПСМА-1007 наилучшие значения чувствительности и специфичности составили 97,55 (95% ДИ 95,13–100,00) и 51,06% (95% ДИ 20,35–76,59) соответственно. Расчёт диагностических показателей для отдельных анатомических локализаций представлен в табл. 4. Во 2-й группе показатели чувствительности обоих методов достигли 100%, тогда как специфичность составляла для ПЭТ/КТ всего тела с 18F-ПСМА-1007 и ДВИ костей таза — 85,18 и 100% соответственно (табл. 5).
Таблица 4. Показатели диагностической точности в 1-й группе
Анатомическая область | ПЭТ/КТ с 18F-ПСМА-1007 | ДВИ всего тела | χ2 | p | ||
Se, % (95% ДИ) | Sp, % (95% ДИ) | Se, % (95% ДИ) | Sp, % (95% ДИ) | |||
Череп | 100 (90,11–100) | 64 (50,14–75,86) | 100 (90,11–100) | 69,39 (55,47–80,48) | 0,129 | 0,720 |
Лопатки | 100 (91,62–100) | 63,83 (49,54–76,03) | 91,3 (71,68–96,57) | 71,11 (56,63–82,27) | 0,800 | 0,372 |
Рёбра | 98,74 (95,53–99,65) | 19,42 (12,94–28,1) | 98,74 (95,53–99,65) | 31,46 (22,75–41,7) | 3,645 | 0,057 |
Позвонки | 95,93 (91,84–98,01) | 20 (12,51–30,41) | 95,93 (91,84–98,01) | 27,63 (18,84–38,58) | 0,275 | 0,601 |
Таз | 96,36 (91,02–98,58) | 38,3 (25,79–52,57) | 96,36 (91,02–98,58) | 46,81 (33,33–60,77) | 0,444 | 0,505 |
Конечности | 94,44 (74,24–99,01) | 85,29 (69,87–93,55) | 94,44 (74,24–99,01) | 72,09 (57,31–83,25) | 4,455 | 0,035 |
Примечание. ПЭТ/КТ — позитронно-эмиссионная томография, совмещённая с компьютерной томографией; ПСМА — простатоспецифичный мембранный антиген; ДВИ — диффузионно-взвешенное изображение; Se — чувствительность; Sp — специфичность; ДИ — доверительный интервал; χ2 — критерий МакНемара. | ||||||
Таблица 5. Показатели диагностической точности во 2-й группе
Анатомическая область | ПЭТ/КТ с 18F-ПСМА-1007 | ДВИ всего тела | χ2 | p | ||
Se, % (95% ДИ) | Sp, % (95% ДИ) | Se, % (95% ДИ) | Sp, % (95% ДИ) | |||
Таз | 98,73 (93,17–99,78) | 52,94 (42,43–63,19) | 100 (95,36–100) | 98,28 (90,86–99,69) | 35,103 | <0,001 |
Конечности | 100 (82,41–100) | 85,19 (75,87–91,32) | 100 (82,41–100) | 100 (95–100) | 11,000 | <0,001 |
Примечание. ПЭТ/КТ — позитронно-эмиссионная томография, совмещённая с компьютерной томографией; ПСМА — простатоспецифичный мембранный антиген; ДВИ — диффузионно-взвешенное изображение; Se — чувствительность; Sp — специфичность; ДИ — доверительный интервал; χ2 — критерий МакНемара. | ||||||
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Основным результатом нашего исследования является установление сравнительно низкой специфичности как ПЭТ/КТ с 18F-ПСМА-1007, так и ДВИ всего тела при выявлении метастатического поражения скелета. В свою очередь, ДВИ костей таза, полученные с помощью мультипараметрической МРТ предстательной железы, продемонстрировали более высокую специфичностью. Наибольшие значения специфичности при выявлении метастазов в черепе, лопатках и бедренных костях достигнуты при использовании ДВИ всего тела.
Обсуждение основного результата исследования
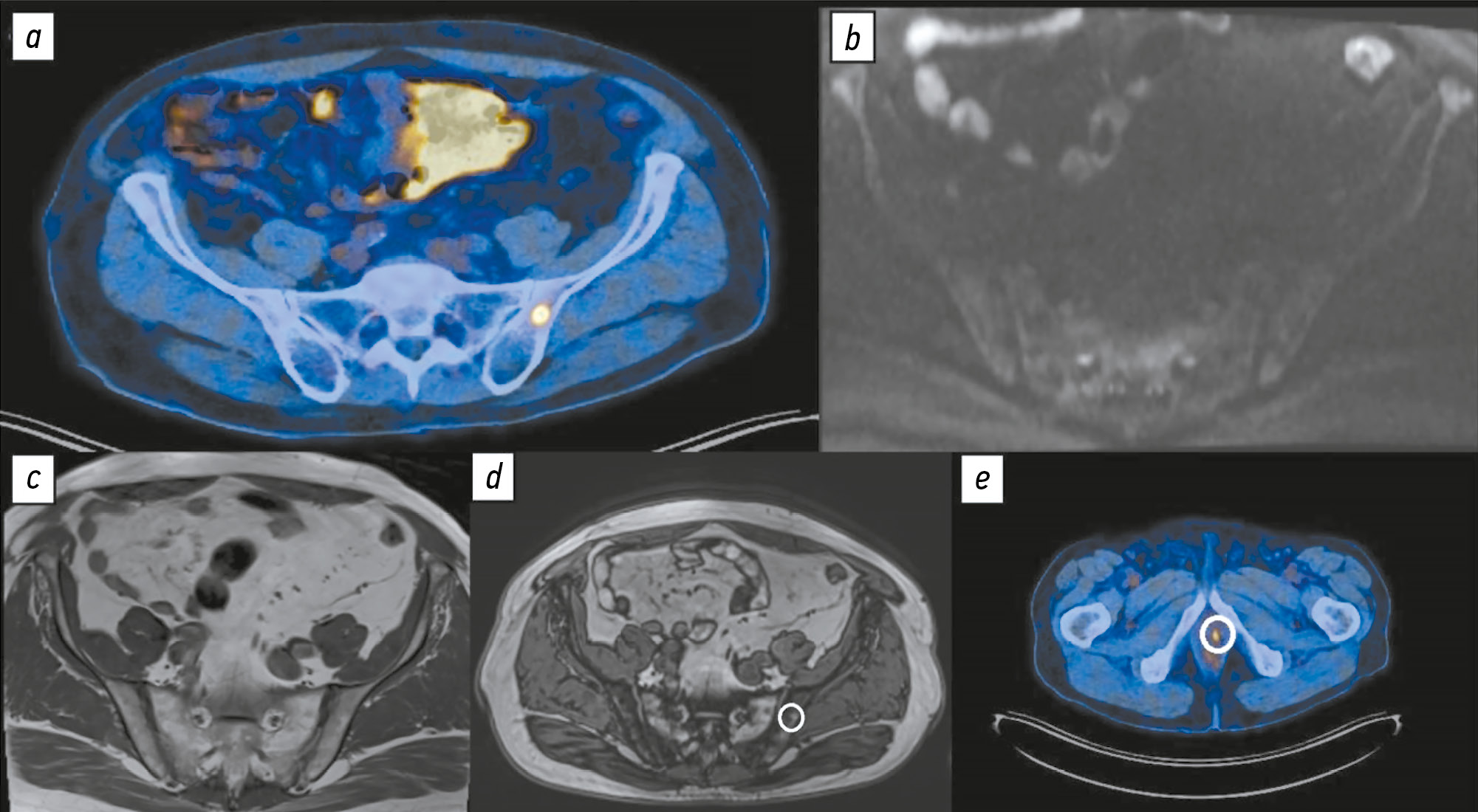
Полученные результаты свидетельствуют о низкой специфичности ПЭТ/КТ с 18F-ПСМА-1007 и ДВИ всего тела для выявления метастатического поражения костей, что подтверждено актуальными клиническими исследованиями, в частности многоцентровыми. Так, H. Grünig и соавт. [21] сообщают, что у 51,4% пациентов, проходивших ПЭТ/КТ с 18F-ПСМА-1007, обнаруживают очаги гиперфиксации в костях, клиническая интерпретация которых затруднена из-за их неопределённой природы. В одной из первых опубликованных работ, посвящённых сравнению диагностической точности ПЭТ/КТ с 18F-ПСМА-1007 и 68Ga-ПСМА-11, обнаружены значительные различия в частоте ложноположительных находок в скелете — 48 и 14,7% соответственно. Данный феномен традиционно объясняют более продолжительным периодом полураспада 18F по сравнению с 68Ga, что приводит к повышению пространственного разрешения и лучшему соотношению сигнала и шума [9]. Иммуногистохимический анализ показал наличие ПСМА не только в ткани предстательной железы, но и в очагах воспаления и неоангиогенеза [22]. Кроме того, РФП на основе ПСМА способны связываться и с доброкачественными процессами в костной ткани (рис. 1), такими как островки гиперплазии красного костного мозга, часто выявляемые в рёбрах [23], а также в гемангиомах тел позвонков [24]. Интерпретация магнитно-резонансной семиотики типичных гемангиом тел позвонков не вызывает затруднений и позволяет их дифференцировать от метастазов рака предстательной железы, однако «атипичные» гемангиомы зачастую требуют гистологической верификации [25]. Точный механизм фиксации РФП на основе ПСМА в доброкачественных структурах костной ткани остаётся неясным.
Рис. 1. Пациент А 56 лет со смешанной нейроэндокринной карциномой предстательной железы T3aN1Mx, Глисон 8 (4+4). Состояние после радикальной простатэктомии. Повышение содержания общего простатоспецифичного антигена сыворотки крови до 1,87 нг/мл. Рецидив опухоли в области везикоуретерального анастомоза: а ― изображение позитронно-эмиссионной компьютерной томографии в аксиальной плоскости: в теле левой подвздошной кости выявлен очаг гиперфиксации радиофармацевтического препарата, подозрительный в отношении метастатического процесса; b и с ― по данным диффузионно-взвешенного (b) и Т1-взвешенного изображений без жироподавления (с) очаговых изменений левой подвздошной кости не выявлено; d — по данным Т1-взвешенного изображения с селективным жироподавлением в области очага гиперфиксации радиофармацевтического препарат выявлена зона выпадения сигнала, соответствующая реконверсии красного костного мозга, патологических инфильтратов костного мозга не выявлено; e — очаг гиперфиксации по данным позитронно-эмиссионной компьютерной томографии с 18F-простатоспецифичным мембранным антигеном-1007 в области везикоуретрального анастомоза.
Серьёзной проблемой, с которой сталкивается врач-рентгенолог при интерпретации ДВИ костей, является ограничение диффузии в таких доброкачественных структурах, как очаги реконверсии красного костного мозга. Дифференциальная диагностика таких очагов возможна с использованием импульсных последовательностей с селективным жироподавлением (Т1-ВИ по методу Dixon) [26, 27]. Дегенеративные изменения позвоночника также нередко сопровождаются признаками ограничения диффузии (рис. 2). Применение импульсных последовательностей с селективным жироподавлением позволяет надёжно дифференцировать метастазы и узлы Шморля [28].
Рис. 2. Пациент Б 77 лет с аденокарциномой предстательной железы T4N2M0, Глисон 8 (4+4). Состояние после комплексного лечения, нескольких линий гормональной терапии, химиотерапии, лучевой терапии предстательной железы, зон регионарных лимфатических узлов. Повышение содержания общего простатоспецифичного антигена сыворотки крови до 0,4 нг/мл. Пример ложноположительного результата: а ― изображение позитронно-эмиссионной компьютерной томографии с 18F-простатоспецифичным мембранным антигеном-1007 в аксиальной плоскости: в правой дужке LV позвонка отмечен очаг гиперфиксации радиофармацевтического препарата, подозрительный в отношении метастатического процесса; b и с ― диффузионно-взвешенное (b) и Т2-взвешенное изображение магнитно-резонансной томографии (с): признаки артрита правого дугоотростчатого сочленения LV-SI в виде внутрисуставного выпота, умеренного трабекулярного отёка смежных суставных поверхностей.
Применение МРТ всего тела с ДВИ распространено для первичного стадирования онкологических заболеваний с высоким риском метастатического поражения костей, к которым относят рак предстательной железы. Согласно данным, представленным в работе N.A. Hottat и соавт. [29], диагностическая точность выявления метастатического поражения скелета достигает 92%. В отношении диагностики костных метастазов рака предстательной железы ДВИ всего тела не уступает ПЭТ/КТ с 18F-холином и значительно превосходит остеосцинтиграфию [30]. Аналогичные результаты, свидетельствующие о сопоставимой диагностической точности ПЭТ/КТ с 68Ga-ПСМА и МРТ всего тела, показаны в метаанализе F. Liu и соавт. [31]. Кроме того, в мировой литературе накоплены убедительные данные о возможности применения только ДВИ всего тела для диагностики костных метастазов [32]. Так, в исследовании W. Sun и соавт. [33], проведённом на выборке пациентов с различными онкологическими заболеваниями, чувствительность, а также положительная и отрицательная прогностическая ценность ДВИ всего тела не уступали аналогичным показателям при ПЭТ/КТ с 18F-фтордезоксиглюкозой. При этом измеряемый коэффициент диффузии доброкачественных костных очагов был статистически значимо выше, чем у метастазов. Широко распространено использование комбинации быстрых импульсных последовательностей, не требующих задержки дыхания и введения контрастного препарата, для стадирования опухолевого процесса во всём теле. Как правило, используют сочетание Т1-ВИ, STIR и ДВИ. В исследовании A. Larbi и соавт. [34], посвящённом сравнению возможных комбинаций импульсных последовательностей МРТ для диагностики метастазов костей при раке предстательной железы, показано, что сочетания Т1-ВИ и ДВИ, Т1-ВИ и STIR не уступают друг другу по информативности.
Выявленное в нашей работе статистически значимое (p <0,001) расхождение показателей диагностической точности ПЭТ/КТ с 18F-ПСМА-1007 всего тела и ДВИ костей таза, вероятно, обусловлено применением более широкого поля обзора при получении ДВИ костей малого таза (см. табл. 1). По данным S. Park и соавт. [27], ДВИ малого таза позволила статистически значимо дифференцировать метастазы костей таза при раке предстательной железы от доброкачественных очагов.
Ограничения исследования
При отсутствии неинвазивного «золотого стандарта» для сравниваемых диагностических методов затруднительно исключить влияние оценки конкордантных находок на результаты анализа [21, 35, 36]. Следует подчеркнуть, что мультипараметрическая МРТ также не является методом выбора для выявления метастатического поражения скелета, поэтому использование других её импульсных последовательностей в качестве референсного метода для оценки диагностической точности ПЭТ/КТ с 18F-ПСМА-1007 и ДВИ является существенным ограничением исследования. По техническим причинам выполнение гистологической верификации всех выявленных метастатических очагов невозможно. Однако подход, который мы использовали, распространён в мировой исследовательской практике. Так, в исследованиях M.T. Freitag и соавт. [37] и B. Chen и соавт. [35] оценивали конкордантность выявленных находок.
Ретроспективный дизайн исследования предполагал отбор пациентов исключительно с подтверждённым диагнозом рака предстательной железы, поэтому распределение нормы и патологии в выборке не соответствовало реальному распределению в популяции. Анализ МРТ с ДВИ всего тела для уточнения характера выявленных подозрительных находок с помощью ПЭТ/КТ с 18F-ПСМА-1007 не позволял исключить предвзятость рентгенолога в отношении оценок выявленных очагов.
ЗАКЛЮЧЕНИЕ
Несмотря на известные преимущества, ПЭТ/КТ с 18F-ПСМА-1007 демонстрирует высокую частоту ложноположительных находок в костной ткани, преимущественно в рёбрах, позвонках, костях таза. ДВИ не могут выступать в качестве единственного уточняющего метода в случае сомнительных результатов ПЭТ/КТ с 18F-ПСМА-1007. Для предотвращения необоснованного повышения стадии заболевания рекомендовано выполнять мультипараметрическую МРТ всего тела.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Вклад авторов. П.Б. Гележе, Р.В. Решетников — концепция исследования, анализ данных, написание и редактирование текста рукописи; И.А. Блохин, М.Р. Коденко — анализ данных, написание и редактирование текста рукописи. Все авторы одобрили рукопись (версию для публикации), а также согласились нести ответственность за все аспекты работы, гарантируя надлежащее рассмотрение и решение вопросов, связанных с точностью и добросовестностью любой её части.
Этическая экспертиза. Проведение исследования одобрено независимым этическим комитетом Государственного бюджетного учреждения здравоохранения города Москвы «Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения города Москвы» (протокол заседания № 10/2023 от 21.12.2023).
Согласие на публикацию. Все пациенты подписывали добровольное информированное согласие, содержащее пункт о возможности публикации анонимизированных данных, включая диагностические изображения, в научных целях.
Источник финансирования. Данная статья подготовлена авторским коллективом в рамках научно-исследовательской работы «Оппортунистический скрининг социально значимых и иных распространённых заболеваний», (ЕГИСУ: № 123031400009-1) в соответствии с Приказом от 21.12.2022 № 1196 «Об утверждении государственных заданий, финансовое обеспечение которых осуществляется за счёт средств бюджета города Москвы государственным бюджетным (автономным) учреждениям подведомственным Департаменту здравоохранения города Москвы, на 2023 год и плановый период 2024 и 2025 годов» Департамента здравоохранения города Москвы.
Раскрытие интересов. Авторы заявляют об отсутствии отношений, деятельности и интересов за последние три года, связанных с третьими лицами (коммерческими и некоммерческими), интересы которых могут быть затронуты содержанием статьи.
Оригинальность. При создании настоящей работы авторы не использовали ранее опубликованные сведения (текст, иллюстрации, данные).
Доступ к данным. Редакционная политика в отношении совместного использования данных к настоящей работе не применима.
Генеративный искусственный интеллект. При создании настоящей статьи технологии генеративного искусственного интеллекта не использовали.
Рассмотрение и рецензирование. Настоящая работа подана в журнал в инициативном порядке и рассмотрена по обычной процедуре. В рецензировании участвовали один внешний рецензент, два член редакционной коллегии и научный редактор издания.
ADDITIONAL INFORMATION
Author contributions: P.B. Gelezhe, R.V. Reshetnikov: conceptualization, formal analysis, writing—original draft, writing—review & editing; I.A. Blokhin, M.R. Kodenko: formal analysis, writing—original draft, writing—review & editing. All the authors approved the version of the manuscript to be published and agreed to be accountable for all aspects of the work, ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Ethics approval: The study was approved by the Independent Ethics Committee of State Budget-Funded Health Care Institution of the City of Moscow Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies of the Moscow Health Care Department (Meeting Minutes No. 10/2023 dated December 21, 2023).
Consent for publication: All patients signed a written informed consent form that included a clause on the possible publication of anonymized data, including diagnostic images, for scientific purposes.
Funding sources: This article is part of the research project Opportunistic Screening for Socially Significant and Other Common Diseases (Unified State Information Accounting System No. 123031400009-1), in accordance with Order No. 1196 dated December 21, 2022, On Approval of State Assignments Funded by the Budget of the City of Moscow for State Budgetary (Autonomous) Institutions Under the Jurisdiction of the Moscow City Health Department for 2023 and the Planned Period of 2024–2025, issued by the Moscow City Health Department.
Disclosure of interests: The authors have no relationships, activities, or interests for the last three years related to for-profit or not-for-profit third parties whose interests may be affected by the content of the article.
Statement of originality: No previously published material (text, images, or data) was used in this work.
Data availability statement: The editorial policy regarding data sharing does not apply to this work.
Generative AI: No generative artificial intelligence technologies were used to prepare this article.
Provenance and peer review: This paper was submitted unsolicited and reviewed following the standard procedure. The peer review process involved an external reviewer, two members of the editorial board, and the in-house science editor.
1 PSMA-RADS-3 (Prostate Specific Membrane Antigen Reporting and Data System 3) — сомнительная злокачественность, требующая дальнейшей оценки, в соответствии с системой стандартизации описания результатов визуализации с использованием радиофармпрепаратов.
2 PSMA-RADS-4 (Prostate Specific Membrane Antigen Reporting and Data System 4) — высокая вероятность злокачественности в соответствии с системой стандартизации описания результатов визуализации с использованием радиофармпрепаратов.
3 PSMA-RADS-5 (Prostate Specific Membrane Antigen Reporting and Data System 5) — очень высокая вероятность злокачественности, клинически значимый рак крайне вероятен в соответствии с системой стандартизации описания результатов визуализации с использованием радиофармпрепаратов.
4 HASTE (Half-Fourier Acquisition Single-shot Turbo Spin Echo) — быстрая последовательность, которая позволяет получать всё изображение за один радиочастотный импульс.
5 R 4.2.1 [Internet]. R: The R Project for Statistical Computing; 2022– . Режим доступа: https://www.r-project.org/ Дата обращения: 10.04.2024.
About the authors
Pavel B. Gelezhe
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies; European Medical Center
Author for correspondence.
Email: gelezhe.pavel@gmail.com
ORCID iD: 0000-0003-1072-2202
SPIN-code: 4841-3234
MD, Cand. Sci. (Medicine)
Russian Federation, Moscow; MoscowRoman V. Reshetnikov
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
Email: ReshetnikovRV1@zdrav.mos.ru
ORCID iD: 0000-0002-9661-0254
SPIN-code: 8592-0558
Cand. Sci. (Physics and Mathematics)
Russian Federation, MoscowIvan A. Blokhin
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
Email: BlokhinIA@zdrav.mos.ru
ORCID iD: 0000-0002-2681-9378
SPIN-code: 3306-1387
Russian Federation, Moscow
Maria R. Kodenko
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
Email: KodenkoM@zdrav.mos.ru
ORCID iD: 0000-0002-0166-3768
SPIN-code: 5789-0319
Cand. Sci. (Engineering)
Russian Federation, MoscowReferences
- Petersen LJ, Zacho HD. PSMA PET for primary lymph node staging of intermediate and high-risk prostate cancer: an expedited systematic review. Cancer Imaging. 2020;20(1):1–8. doi: 10.1186/s40644-020-0290-9 EDN: EWACNH
- Wondergem M, van der Zant FM, Broos WAM, Knol RJJ. Clinical impact of PSMA PET in biochemically recurrent prostate cancer; a review of the literature. Tijdschrift voor Urologie. 2020;10(6-7):109–121. doi: 10.1007/s13629-020-00296-6 EDN: XRLHSC
- Hofman MS, Lawrentschuk N, Francis RJ, et al. Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study. The Lancet. 2020;395(10231):1208–1216. doi: 10.1016/s0140-6736(20)30314-7 EDN: IDQIFB
- Treglia G, Annunziata S, Pizzuto DA, et al. Detection rate of 18F-Labeled PSMA PET/CT in biochemical recurrent prostate cancer: a systematic review and a meta-analysis. Cancers. 2019;11(5):710. doi: 10.3390/cancers11050710
- Donswijk ML, van Leeuwen PJ, Vegt E, et al. Clinical impact of PSMA PET/CT in primary prostate cancer compared to conventional nodal and distant staging: a retrospective single center study. BMC Cancer. 2020;20(1):1–10. doi: 10.1186/s12885-020-07192-7 EDN: QXMNJG
- The FDA approves PSMAtargeted drug for PET imaging in men with prostate cancer. BJU International. 2021;127(3):267–268. doi: 10.1111/bju.15361
- Caribé PRRV, Koole M, D'Asseler Y, et al. NEMA NU 2-2007 performance characteristics of GE Signa integrated PET/MR for different PET isotopes. EJNMMI Physics. 2019;1(6):11. doi: 10.1186/s40658-019-0247-x
- Giesel FL, Hadaschik B, Cardinale J, et al. F-18 labelled PSMA-1007: biodistribution, radiation dosimetry and histopathological validation of tumor lesions in prostate cancer patients. European Journal of Nuclear Medicine and Molecular Imaging. 2016;44(4):678–688. doi: 10.1007/s00259-016-3573-4 EDN: RQYCMY
- Kroenke M, Mirzoyan L, Horn T, et al. Matched-pair comparison of 68Ga-PSMA-11 and 18F-rhPSMA-7 PET/CT in patients with primary and biochemical recurrence of prostate cancer: frequency of non–tumor-related uptake and tumor positivity. Journal of Nuclear Medicine. 2020;62(8):1082–1088. doi: 10.2967/jnumed.120.251447 EDN: EQTOAN
- Kwee TC, Takahara T, Ochiai R, et al. Diffusion-weighted whole-body imaging with background body signal suppression (DWIBS): features and potential applications in oncology. European Radiology. 2008;18(9):1937–1952. doi: 10.1007/s00330-008-0968-z EDN: BJSYMC
- Parker C, Tunariu N, Tovey H, et al. Radium-223 in metastatic castration-resistant prostate cancer: whole-body diffusion-weighted magnetic resonance imaging scanning to assess response. JNCI Cancer Spectrum. 2023;7(6):pkad077. doi: 10.1093/jncics/pkad077 EDN: AZWTFB
- Dresen RC, De Vuysere S, De Keyzer F, et al. Whole-body diffusion-weighted MRI for operability assessment in patients with colorectal cancer and peritoneal metastases. Cancer Imaging. 2019;19(1):1–10. doi: 10.1186/s40644-018-0187-z EDN: IEYSWA
- Yamamoto S, Yoshida S, Ishii C, et al. Metastatic diffusion volume based on apparent diffusion coefficient as a prognostic factor in castration-resistant prostate cancer. Journal of Magnetic Resonance Imaging. 2021;54(2):401–408. doi: 10.1002/jmri.27596 EDN: SFBRHR
- Rowe SP, Pienta KJ, Pomper MG, Gorin MA. PSMA-RADS Version 1.0: a step towards standardizing the interpretation and reporting of PSMA–targeted PET imaging studies. European Urology. 2018;73(4):485–487. doi: 10.1016/j.eururo.2017.10.027
- Vasilev YA, Omelyanskaya OV, Vladzymyrskyy AV, et al. Comparison of multiparametric and biparametric magnetic resonance imaging protocols for prostate cancer diagnosis by radiologists with different experience. Digital Diagnostics. 2023;4(4):455–466. doi: 10.17816/dd322816 EDN: PVEPWX
- Disler DG, McCauley TR, Ratner LM, et al. In-phase and out-of-phase MR imaging of bone marrow: prediction of neoplasia based on the detection of coexistent fat and water. American Journal of Roentgenology. 1997;169(5):1439–1447. doi: 10.2214/ajr.169.5.9353477
- Suh CH, Yun SJ, Jin W, et al. Diagnostic Performance of in-phase and opposed-phase chemical-shift imaging for differentiating benign and malignant vertebral marrow lesions: a meta-analysis. American Journal of Roentgenology. 2018;211(4):W188–W197. doi: 10.2214/AJR.17.19306
- Halpern SD. The continuing unethical conduct of underpowered clinical trials. JAMA. 2002;288(3):358–362. doi: 10.1001/jama.288.3.358
- Altman DG. Statistics and ethics in medical research: III How large a sample? BMJ. 1980;281(6251):1336–1338. doi: 10.1136/bmj.281.6251.1336
- Blokhin IA, Kodenko MR, Shumskaya YuF, et al. Hypothesis testing using R. Digital Diagnostics. 2023;4(2):238–247. doi: 10.17816/DD121368 EDN: OEKDAG
- Grünig H, Maurer A, Thali Y, et al. Focal unspecific bone uptake on [18F]-PSMA-1007 PET: a multicenter retrospective evaluation of the distribution, frequency, and quantitative parameters of a potential pitfall in prostate cancer imaging. European Journal of Nuclear Medicine and Molecular Imaging. 2021;48(13):4483–4494. doi: 10.1007/s00259-021-05424-x
- Silver DA, Pellicer I, Fair WR, et al. Prostate-specific membrane antigen expression in normal and malignant human tissues. Clin Cancer Res. 1997:3(1):81–85.
- Plouznikoff N, Garcia C, Artigas C, et al. Heterogeneity of 68Ga-PSMA PET/CT uptake in fibrous dysplasia. Clinical Nuclear Medicine. 2019;44(10):e593–e594. doi: 10.1097/RLU.0000000000002609
- Gossili F, Lyngby CG, Løgager V, Zacho HD. Intense PSMA uptake in a vertebral hemangioma mimicking a solitary bone metastasis in the primary staging of prostate cancer via 68Ga-PSMA PET/CT. Diagnostics. 2023;13(10):1730. doi: 10.3390/diagnostics13101730 EDN: HQPGMR
- Hoyle JM, Layfield LJ, Crim J. The lipid-poor hemangioma: an investigation into the behavior of the “atypical” hemangioma. Skeletal Radiology. 2020;49:93–100. doi: 10.1007/s00256-019-03257-2
- Liao Z, Liu G, Ming B, et al. Evaluating prostate cancer bone metastasis using accelerated whole-body isotropic 3D T1-weighted Dixon MRI with compressed SENSE: a feasibility study. European Radiology. 2023;33(3):1719–1728. doi: 10.1007/s00330-022-09181-9
- Park S, Park JG, Jun S, et al. Differentiation of bone metastases from prostate cancer and benign red marrow depositions of the pelvic bone with multiparametric MRI. Magnetic Resonance Imaging. 2020;73:118–124. doi: 10.1016/j.mri.2020.08.019 EDN: CTHKSL
- Lee JH, Park S. Differentiation of schmorl nodes from bone metastases of the spine: use of apparent diffusion coefficient derived from DWI and fat fraction derived from a Dixon sequence. American Journal of Roentgenology. 2019;213(5):W228–W235. doi: 10.2214/AJR.18.21003
- Hottat NA, Badr DA, Ben Ghanem M, et al. Assessment of whole-body MRI including diffusion-weighted sequences in the initial staging of breast cancer patients at high risk of metastases in comparison with PET-CT: a prospective cohort study. European Radiology. 2023;34(1):165–178. doi: 10.1007/s00330-023-10060-0 EDN: MRFKMJ
- Johnston EW, Latifoltojar A, Sidhu HS, et al. Multiparametric whole-body 3.0-T MRI in newly diagnosed intermediate- and high-risk prostate cancer: diagnostic accuracy and interobserver agreement for nodal and metastatic staging. European Radiology. 2018;29(6):3159–3169. doi: 10.1007/s00330-018-5813-4 EDN: DEXLFX
- Liu F, Dong J, Shen Y, et al. Comparison of PET/CT and MRI in the diagnosis of bone metastasis in prostate cancer patients: a network analysis of diagnostic studies. Frontiers in Oncology. 2021;11(APR):736654. doi: 10.3389/fonc.2021.736654 EDN: TKTQOV
- Nakanishi K, Tanaka J, Nakaya Y, et al. Whole-body MRI: detecting bone metastases from prostate cancer. Japanese Journal of Radiology. 2021;40(3):229–244. doi: 10.1007/s11604-021-01205-6 EDN: QZBDSB
- Sun W, Li M, Gu Y, et al. Diagnostic value of whole-body DWI with background body suppression plus calculation of apparent diffusion coefficient at 3 T Versus 18F-FDG PET/CT for detection of bone metastases. American Journal of Roentgenology. 2020;214(2):446–454. doi: 10.2214/ajr.19.21656 EDN: BJRCLP
- Larbi A, Omoumi P, Pasoglou V, et al. Whole-body MRI to assess bone involvement in prostate cancer and multiple myeloma: comparison of the diagnostic accuracies of the T1, short tau inversion recovery (STIR), and high b-values diffusion-weighted imaging (DWI) sequences. European Radiology. 2018;29(8):4503–4513. doi: 10.1007/s00330-018-5796-1 EDN: CEOKNS
- Chen B, Wei P, Macapinlac HA, Lu Y. Comparison of 18F-Fluciclovine PET/CT and 99mTc-MDP bone scan in detection of bone metastasis in prostate cancer. Nuclear Medicine Communications. 2019;40(9):940–946. doi: 10.1097/MNM.0000000000001051 EDN: ZRPGWP
- Gelezhe P.B. Comprehensive diagnostics of breast cancer using magnetic resonance imaging and positron emission tomography with 18F-fluorodeoxyglucose, combined with computed tomography [dissertation]. Moscow; 2020. Available from: https://www.elibrary.ru/item.asp?id=54413422 EDN: UGEBZO
- Freitag MT, Radtke JP, Hadaschik BA, et al. Comparison of hybrid 68Ga-PSMA PET/MRI and 68Ga-PSMA PET/CT in the evaluation of lymph node and bone metastases of prostate cancer. European Journal of Nuclear Medicine and Molecular Imaging. 2015;43(1):70–83. doi: 10.1007/s00259-015-3206-3 EDN: HXYHGT
Supplementary files