Сравнительная роль методов лучевой диагностики при биохимическом рецидиве рака предстательной железы
- Авторы: Ростовцева Т.М.1,2, Долгушин М.Б.1, Каралкина М.А.1, Короид О.А.3, Синицын В.Е.2
-
Учреждения:
- Федеральный центр мозга и нейротехнологий
- Московский государственный университет имени М.В. Ломоносова
- «Медицина и ядерные технологии»
- Выпуск: Том 6, № 1 (2025)
- Страницы: 46-62
- Раздел: Обзоры
- Статья получена: 17.06.2024
- Статья одобрена: 24.10.2024
- Статья опубликована: 25.03.2025
- URL: https://jdigitaldiagnostics.com/DD/article/view/633487
- DOI: https://doi.org/10.17816/DD633487
- ID: 633487
Цитировать
Полный текст
Аннотация
Биохимический рецидив рака предстательной железы возникает приблизительно в 25–50% случаев среди пациентов после его радикального лечения, как после радикальной простатэктомии, так и после лучевой терапии. Однако клиническое течение и прогноз заболевания у разных пациентов с биохимическим рецидивом рака предстательной железы существенно отличаются и зависят от целого ряда факторов. В связи с этим оптимальный алгоритм диагностики и лечения пациентов с биохимическим рецидивом рака предстательной железы до настоящего времени является предметом научных споров. Причиной биохимического рецидива рака предстательной железы может быть как локальный рецидив, так и метастатическая диссеминация, а также сочетание этих процессов. В последние годы подходы к диагностике и лечению пациентов с биохимическим рецидивом рака предстательной железы претерпели существенные изменения в связи с внедрением в клиническую практику более точных методов диагностики. В статье представлен обзор литературных данных о современных возможностях методов лучевой и радионуклидной диагностики при визуализации местного рецидива и метастазов рака предстательной железы у пациентов с биохимическим рецидивом.
Полный текст
ВВЕДЕНИЕ
Рак предстательной железы (РПЖ) занимает первое место в структуре онкологической заболеваемости мужского населения в России и третье — среди причин смерти от онкологических заболеваний, что составляет 17 и 8,9% соответственно. Кроме того, в течение последних десяти лет показатели заболеваемости и смертности продолжают расти [1]. Изменение содержания простатоспецифичного антигена (ПСА) в сыворотке крови считают одним из ключевых показателей мониторинга состояния пациентов после проведённого лечения. У 25–50% пациентов с РПЖ после радикальной простатэктомии или лучевой терапии возникает биохимический рецидив, риск которого сохраняется более 10 лет [2]. В дальнейшем при отсутствии лечения клинические проявления возникают у 24–34% пациентов. Следует отметить, что время от появления биохимических маркёров рецидива до клинических проявлений составляет 5–8 лет, а летальность от РПЖ в течение 15 лет достигает 6% [3–7].
Под биохимическим рецидивом РПЖ у пациентов после радикальной простатэктомии понимают повышение содержания ПСА выше 0,2 нг/мл, при этом его минимальная концентрация, коррелирующая с риском метастазирования, составляет 0,4 нг/мл [8]. В группе пациентов после лучевой терапии биохимическим рецидивом считают увеличение содержания ПСА более чем на 2 нг/мл от минимальной концентрации после лечения (RTOG-ASTRO критерий Phoenix) [9]. Среди пациентов, которым выполнено лечение менее инвазивными методами, такими как высокоинтенсивный сфокусированный ультразвук и криотерапия, также возможно возникновение биохимического рецидива, однако его чёткие границы для данных групп пациентов до настоящего времени не установлены [10].
Наличие биохимического рецидива не считают прямым отражением таких показателей, как смертность от РПЖ или общая смертность. По мнению ряда авторов, он может значительно опережать клинические проявления — в среднем на 8 лет в группе пациентов после радикальной простатэктомии и на 7 лет — после лучевой терапии [11, 12].
Биохимический рецидив РПЖ возможно обусловлен локальным метастатическим поражением лимфатических узлов, костей или других органов, а также сочетанием этих процессов. С клинической точки зрения вероятность метастатического поражения как причины биохимического рецидива выше у пациентов с высокоагрессивными опухолями (≥8 баллов по шкале Глисона), с инвазией семенных пузырьков и метастатическим поражением тазовых лимфатических узлов, а также при его раннем возникновении — в первые 6 месяцев после простатэктомии или в течение первого года после дистанционной лучевой терапии. Напротив, локальный рецидив с большей вероятностью обусловливает биохимический у пациентов с менее агрессивными опухолями (<8 баллов по шкале Глисона), без инвазии семенных пузырьков, но при наличии опухолевой инвазии капсулы предстательной железы или положительного края резекции, а также при отсроченном возникновении биохимического рецидива — через год и более после лучевой терапии или через 3 года и более после радикальной простатэктомии [13, 14]. Время удвоения концентрации ПСА менее 12 месяцев у пациентов после радикальной простатэктомии и менее 18 месяцев — после лучевой терапии относят к высокому риску прогрессирования заболевания. Время её удвоения менее 3 месяцев ассоциируется с быстрым началом клинических проявлений вне зависимости от времени возникновения биохимического рецидива [15, 16]. В свою очередь, период от радикальной простатэктомии до возникновения биохимического рецидива РПЖ коррелирует с его смертностью в группе пациентов высокого риска, но не влияет на смертность в группе пациентов низкого риска [15].
Резюмируя вышеизложенное, пациенты из группы высокого риска имеют высокий риск метастазирования и смерти от РПЖ. Среди критериев данной группы выделяют:
- опухоль 8–10 баллов по шкале Глисона или с инвазией семенных пузырьков, или с метастатическим поражением лимфатических узлов;
- время удвоения содержания ПСА менее 3 месяцев или возникновение биохимического рецидива в первые 6 месяцев после радикальной простатэктомии и в первый год после лучевой терапии.
Такие пациенты нуждаются в более раннем начале лечения [8, 17, 18]. Напротив, к группе низкого риска относят пациентов:
- с опухолями менее 8 баллов по шкале Глисона;
- с временем удвоения концентрации ПСА более 1 года после радикальной простатэктомии и более 18 месяцев после лучевой терапии [19].
К «идеальным» кандидатам для активного наблюдения относят пациентов:
- пожилого возраста — старше 80 лет;
- с опухолями 6–7 баллов по шкале Глисона или 1–2 прогностической группы по классификации ISUP (Международного общества урологических патологов);
- с возникновением биохимического рецидива в отдалённом периоде наблюдения — более 5 лет;
- с длительным временем удвоения концентрации ПСА — более 12 месяцев, которая на момент его возникновения составляет <0,5 нг/мл;
- с наличием сопутствующих заболеваний и риска смерти от них [20].
ПОДХОДЫ К ЛЕЧЕНИЮ
В соответствии с рекомендациями Европейской ассоциации урологов (ЕАУ) от 2020 года варианты лечения рецидива РПЖ у пациентов после радикальной простатэктомии включают в себя «спасительную» лучевую терапию на область ложа удалённой предстательной железы либо за его пределами, постоянную или интермиттирующую гормональную терапию и наблюдение [19]. Эффективность «спасительной» лучевой терапии напрямую зависит от наличия или отсутствия у пациента отдалённых метастазов, поэтому она выше в тех случаях, когда лечение начинают раньше на фоне низкой концентрации ПСА [21–23].
Значительное количество выполненных в последнее десятилетие научных исследований подтверждает целесообразность раннего начала «спасительной» лучевой терапии у пациентов с биохимическим рецидивом РПЖ после радикальной простатэктомии. По данным исследования S.A. Boorjian и соавт. [24], опубликованного в 2009 году, её раннее назначение пациентам с биохимическим рецидивом после радикальной простатэктомии позволяет снизить риск системной прогрессии на 75%. По результатам клинического исследования RADICALS-RT, выполненного в 2020 году, безрецидивная пятилетняя выживаемость пациентов с биохимическим рецидивом, которым проводили «спасительную» лучевую терапию при содержании ПСА 0,1–0,2 нг/мл, составила 88% [25]. B.J. Stish и соавт. [21] отметили, что в случае если лечение пациентов с биохимическим рецидивом начали до достижения содержания ПСА 0,5 нг/мл, то пяти- и десятилетняя безрецидивная выживаемость достигает 60 и 40% соответственно. В исследовании T. Wiegel и соавт. [26], опубликованном в 2008 году, начало «спасительной» лучевой терапии пациентам с биохимическим рецидивом РПЖ при низкой концентрации ПСА (в среднем 0,33 нг/мл) позволило достигнуть в 60% случаев его не определения в течение последующих 40 месяцев наблюдения. D.J. Trock и соавт. [27] утверждают, что среди пациентов с биохимическим или локальным рецидивом РПЖ и временем удвоения концентрации ПСА менее 6 месяцев отмечено троекратное увеличение опухоль-специфической выживаемости в группе пациентов, получавших «спасительную» лучевую терапию, по сравнению с пациентами без данного лечения в течение 6 лет наблюдения после возникновения биохимического рецидива. Кроме того, назначение лучевой терапии через 2 года и более после возникновения биохимического рецидива не оказало влияния на опухоль-специфическую выживаемость.
В соответствии с рекомендациями ЕАУ при биохимическом рецидиве РПЖ после радикальной простатэктомии «спасительную» лучевую терапию необходимо назначить пациентам из группы высокого риска (опухоли ≥8 баллов по шкале Глисона или время удвоения содержания ПСА <1 года) при концентрации ПСА >0,4 нг/мл. В группе пациентов с низким риском (опухоли <8 баллов по шкале Глисона и время удвоения содержания ПСА >1 года) одной из применяемых стратегий остаётся активное наблюдение [16].
После лучевой терапии варианты лечения пациентов с биохимическим рецидивом РПЖ включают в себя радикальную простатэктомию, криотерапию, постоянную или интермиттирующую гормональную терапию, высокоинтенсивную фокусированную ультразвуковую абляцию и наблюдение [28]. Таким образом, некоторым пациентам возможно выполнить радикальное лечение [19], перед планированием которого важно точно локализовать опухолевый очаг и метастазы.
Оптимальное время начала лечения, выбор его метода для пациентов с биохимическим рецидивом РПЖ после радикальной простатэктомии и лучевой терапии остаются предметом научных споров. С одной стороны, существует необходимость отсрочить клиническую прогрессию у этой группы пациентов, с другой стороны — риск назначения необоснованного лечения пациентам с её отсутствием в дальнейшем. Адъювантную терапию после радикальной простатэктомии и локальную лучевую терапию после дистанционной применяют у пациентов с высоким риском локального рецидива и прогрессирования, но не рекомендуют пациентам с низким риском, что связано с побочными эффектами лучевой и гормональной терапии [16].
ДИАГНОСТИКА
Эффективность лечения рецидива РПЖ выше в случае начала лечения при низком содержании ПСА — менее 0,5 нг/мл [21–23]. Адекватное планирование тактики лечения, в свою очередь, возможно при детальной локализации опухолевых очагов, а также при точной оценке распространённости опухолевого поражения на максимально доступной ранней стадии РПЖ. При концентрации ПСА менее 1 нг/мл чувствительность таких традиционно применяемых методов диагностики, как ультразвуковое исследование (УЗИ), мультиспиральная компьютерная томография (МСКТ), магнитно-резонансная томография (МРТ) и позитронно-эмиссионная томография (ПЭТ) с 11С-холином и 18F-метил-холином, низкая [29].
По результатам метаанализа 23 исследований, выполненного S. Abuzallouf и соавт. [30] в 2004 году, остеосцинтиграфия позволяет выявлять костные метастазы у 2,3% пациентов с концентрацией ПСА менее 10 нг/мл, у 5,3% — 10–20 нг/мл и у 16,2% — 20–59 нг/мл. Кроме того, МСКТ позволяет идентифицировать костные метастазы у 6,4% пациентов с РПЖ, не распространяющимся за пределы капсулы, и у 49,5% — с местно-распространённым процессом. В исследовании G.J. O’Sullivan и соавт. [31], опубликованном в 2015 году, чувствительность и специфичность МСКТ в отношении выявления костных метастазов у пациентов с РПЖ составили 56 и 74% соответственно.
Чувствительность МСКТ в диагностике его локального рецидива и метастатического поражения лимфатических узлов низкая:
- локального рецидива — не превышает 14% [32];
- метастатического поражения лимфатических узлов при концентрации ПСА более 25 нг/мл —10% [33];
- микрометастазов в лимфатических узлах — не превышает 1% [19].
По данным S. Abuzallouf и соавт. [30], чувствительность, специфичность, положительная прогностическая значимость и отрицательная МСКТ в диагностике метастатического поражения лимфатических узлов у пациентов с РПЖ составила 16, 100, 85 и 100% соответственно.
Чувствительность ПЭТ с 11С- и 18F-холином существенно зависит от концентрации ПСА. B.J. Krauze и соавт. [34] обнаружили опухолевые очаги в 36% случаев у пациентов с его содержанием менее 1 нг/мл, в 43% — менее 2 нг/мл, в 73% — более 3 нг/мл. Кроме того, короткий период полураспада 11С-холина, составляющий 20 минут, считают дополнительным ограничивающим фактором применения этой методики, помимо низкой специфичности лиганда.
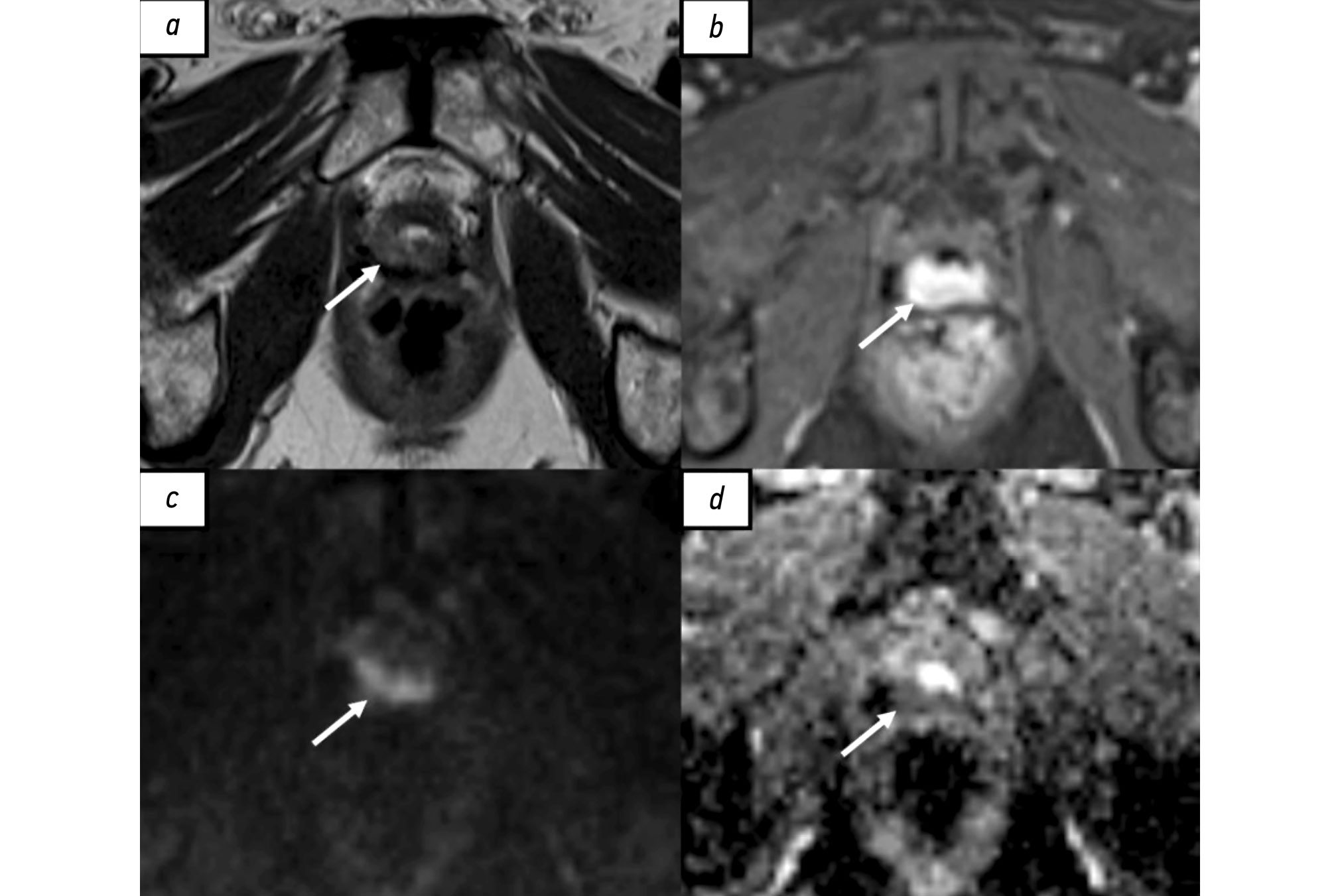
МРТ наиболее широко применяют в диагностике местного рецидива РПЖ. Общепринятой специализированной шкалы оценки наличия локального рецидива, по аналогии со шкалой PI-RADS (Prostate imaging reporting and data system), до настоящего времени не создано. В большинстве исследованиях используют протокол сканирования, аналогичный мультипараметрической МРТ (мпМРТ), применяемый для первичной диагностики РПЖ [35]. Радикальная простатэктомия подразумевает тотальное удаление предстательной железы, семенных пузырьков и, в ряде случаев, тазовую лимфодиссекцию. При проведении МРТ пациентам после радикального хирургического лечения предстательную железу и семенные пузырьки не визуализируют, однако определяют везикоуретральный анастомоз между низведённым мочевым пузырём и экстрапростатической частью уретры. В его зоне в норме определяют фиброзную ткань, гипоинтенсивную на всех импульсных последовательностях, не имеющую признаков рестрикции диффузии и раннего накопления контрастного вещества. У некоторых пациентов визуализируют резидуальные семенные пузырьки, расположенные в типичных местах, с наличием или отсутствием фиброзных изменений [36]. Характерный участок локального рецидива имеет вид мягкотканного образования с промежуточной интенсивностью сигнала на Т2-взвешенных изображениях (ВИ), с признаками рестрикции диффузии и раннего накопления контрастного вещества (рис. 1). Таким образом, сигнальные характеристики локального рецидива РПЖ схожи с аналогичными характеристиками первичной опухоли [37]. Интерпретация диффузионно-взвешенных изображений иногда затруднена в связи с наличием артефактов от шовного материала. Сочетанный анализ Т2-ВИ, динамических постконтрастных и диффузионно-взвешенных изображений позволяет с большей уверенностью отличить местный рецидив от воспалительных изменений и резидуальной ткани предстательной железы, а также фиброзной и грануляционной [38].
Рис. 1. Рецидив рака предстательной железы в области везикоуретрального анастомоза у пациента после радикальной простатэктомии по результатам магнитно-резонансной томографии, собственное наблюдение: a — Т2-взвешенное изображение в аксиальной плоскости. Зона промежуточной интенсивности магнитно-резонансного сигнала в области везикоуретрального анастомоза по задней поверхности (стрелка); b — Т1-взвешенное изображение с жироподавлением в аксиальной плоскости. Зона накопления контрастного вещества в области везикоуретрального анастомоза по задней поверхности (стрелка). c — диффузионно-взвешенное изображение в аксиальной плоскости, d — карта измеряемого коэффициента диффузии. Зона рестрикции диффузии в области везикоуретрального анастомоза по задней поверхности (стрелки).
По данным ряда авторов, в большинстве случаев локальный рецидив визуализируют в перианастомотической области, реже — в ретровезикальном пространстве, в области шейки мочевого пузыря в проекции семенных пузырьков [39–41]. P. Dirix и соавт. [41] выявили локальный рецидив РПЖ в 50% случаев в перианастомотической области, в 40% — в ложе семенных пузырьков, в 9% — в ретровезикальном пространстве. Чувствительность МРТ в отношении диагностики его локального рецидива у пациентов после радикальной простатэктомии достигает 85–90% в тех случаях, когда концентрация ПСА превышает 1 нг/мл, а объём опухоли — более 1 мл либо у пациентов с пальпируемым образованием [42, 43]. Однако при более низком содержании ПСА, требующем лечение, успехи применения МРТ не так ощутимы. Так, по данным P. Dirix и соавт. [41], мпМРТ позволила выявить локальный рецидив у 25% пациентов с биохимическим рецидивом, при этом средняя концентрация ПСА составила 0,3 нг/мл среди всех обследованных пациентов и 1,4 нг/мл — с выявленными патологическими изменениями по результатам МРТ. D. Buergy и соавт. [44] не обнаружили локальный рецидив у пациентов с концентрацией ПСА менее 0,3 нг/мл при проведении мпМРТ, выполненной на томографе с напряжённостью магнитного поля 3 Тл. Следует отметить, что в дальнейшем у данных пациентов отмечен положительный ответ опухоли на лучевую терапию в виде уменьшения содержания ПСА. В исследовании D. Hernandes и соавт. [37], опубликованном в 2015 году, при ретроспективном анализе результатов мпМРТ пациентов с биохимическим рецидивом после радикальной простатэктомии и средним содержанием ПСА 0,38 нг/мл местный рецидив выявлен в 38% случаев. V. Sharma и соавт. [45] утверждают, что отсутствие признаков локального рецидива по данным мпМРТ у пациентов с биохимическим рецидивом РПЖ после радикальной простатэктомии — самостоятельный отрицательный предиктор эффективности лучевой терапии в дополнение к номограмме Stephenson, основанной на данных лечения 1881 пациента с РПЖ.
Диагностика метастатического поражения лимфатических узлов с помощью МСКТ и МРТ основана на выявлении признаков их увеличения, изменения формы, контуров и структуры. По данным исследования A.M. Hövels и соавт. [46], чувствительность данных методов в отношении диагностики метастатического поражения лимфатических узлов у пациентов с РПЖ составила 42 и 39% соответственно, их специфичность — 82%. Чувствительность диффузионной МРТ всего тела в диагностике его метастазов превышает чувствительность остеосцинтиграфии, даже выполненной в сочетании с МСКТ органов грудной клетки, брюшной полости и малого таза [47]. Её точность в выявлении метастатического поражения лёгких и костей сопоставима с ПЭТ с 11С-холином [48].
мпМРТ всего тела подразумевает сочетание анатомических и не менее двух функциональных магнитнорезонансных импульсных последовательностей. Протокол сканирования традиционно включает в себя импульсную последовательность T1 Dixon — Т1-ВИ, импульсную последовательность STIR (Short tau inversion recovery — инверсия–восстановление спинового эха) — Т2-ВИ, диффузионно-взвешенную последовательность с различными b-факторами, картами измеряемого коэффициента диффузии (ADC) и в некоторых случаях картами фракций жира (FF maps), динамическим контрастированием и магнитно-резонансной спектроскопией. Несмотря на большую чувствительность мпМРТ всего тела в диагностике локального рецидива, костных и висцеральных метастазов по сравнению с диффузионно-взвешенной, сохраняются трудности при её использовании в отношении выявления метастатического поражения лимфатических узлов (рис. 2) [49, 50].
Рис. 2. Множественные метастазы в костях у пациента с аденокарциномой предстательной железы (Глисон 3+4), собственное наблюдение: a — позитронно-эмиссионная томография с 18F-простатоспецифичным мембранным антигеном-1007; b — инвертированное диффузно-взвешенное изображение всего тела.
Чувствительность УЗИ в диагностике местного рецидива РПЖ низкая, что, в свою очередь, обусловливает невысокую чувствительность в данной группе биопсии области везикоуретрального анастомоза, выполненной в сопровождении ультразвуковой навигации — от 40 до 70% у пациентов с концентрацией ПСА более 1 нг/мл и не более 45% — при его содержании менее 1 нг/мл [51].
Резюмируя вышеизложенное, у значительного количества пациентов с биохимическим рецидивом РПЖ и низким содержанием ПСА с помощью традиционно применяемых методов диагностики установить его причину не удаётся.
Внедрение в клиническую практику ПЭТ с лигандами простатоспецифичного мембранного антигена (ПСМА) привело к существенным изменениям в диагностике и лечении пациентов с биохимическим рецидивом РПЖ.
ПСМА представляет собой трансмембранный гликопротеин, выделенный из клеток РПЖ в 1987 году. Его низкую экспрессию определяют в мембранах нормальных эпителиальных клеток предстательной железы и её гиперплазированной ткани. Экспрессия ПСМА повышена на мембранах клеток РПЖ в 90% случаев [52] и наиболее выражена при его агрессивном кастрационно-резистентном типе, местном рецидиве и метастазах (рис. 3). Кроме того, повышение его экспрессии периодически наблюдают в эндотелии солидных опухолей других локализаций, ассоциированных с неоангиогенезом [53].
Рис. 3. Результаты совмещённой позитронно-эмиссионной и магнитно-резонансной томографии c 18F-простатоспецифичным мембранным антигеном-1007 всего тела, собственное наблюдение: a, b — опухоль предстательной железы с субтотальным вовлечением её правой половины с распространением на левые отделы (стрелки); c — гиперэкспрессия 18F-простатоспецифичного мембранного антигена-1007 в метастазе рака предстательной железы в подвздошном лимфатическом узле (стрелка).
Среди радиофармацевтических лекарственных препаратов (РФЛП), тропных к клеткам РПЖ, наиболее широко применяют препараты, меченные галлием (68Ga) и фтором (18F). В 2020–2021 гг. управление по санитарному надзору за качеством пищевых продуктов и медикаментов Соединённых Штатов Америки (FDA) одобрило препараты 68Ga-ПСМА-11 (68Ga-гозетотид) и 18F-пифлуфоластат, в 2023 году — препарат 18F-флотуфоластат. Данные препараты продемонстрировали схожие диагностические показатели на третьей стадии испытаний. Кроме того, существует целый ряд альтернативных РФЛП, таких как 18F-ПСМА-1007, 18F-флуорин (18F-CTT1057), 68Ga-ПСМА-R2, ПСМА, меченный медью (64Cu-SAR-bisPSMA), которые проходят стадию испытаний. Не выявлено явных диагностических преимуществ какого-либо из перечисленных препаратов по сравнению с другими, за исключением 64Cu-SAR-bisPSMA [54–58]. Дозиметрические показатели ПЭТ всего тела с 68Ga-ПСМА-11 и 18F-пифлуфоластатом не имеют существенных отличий (при вводимой дозе 370 мБк — 4,4 и 4,3 мЗв соответственно) и в целом соответствуют таковым для ПЭТ всего тела с 18F-фтордезоксиглюкозой. Во время клинических испытаний обоих препаратов не зарегистрировано клинически значимых побочных эффектов, отмечены изменения показателей артериального давления и частоты сердечных сокращений, не требующие медикаментозной коррекции [59]. Период полураспада 18F превышает период полураспада 68Ga — 110 и 68 минут соответственно, а также 18F обладает меньшим пробегом позитрона и большим их выходом. Кроме того, РФЛП на основе 18F преимущественно выводятся через печень, в отличие от препаратов на основе 68Ga, экскретируемых почками [60]. Всё вышеперечисленное объясняет более высокое пространственное разрешение и меньшее количество артефактов от мочевого пузыря при использовании ПСМА, меченного 18F [61–63]. В случаях, когда ПЭТ с ПСМА выполняют перед планируемой ПСМА-таргетной радионуклидной терапией препаратами лютеция (177Lu) и актиния (225Aс), следует учитывать, что критерии активности его экспрессии метастазами РПЖ, являющиеся предикторами эффективности лечения, разработаны только для 68Ga [64].
Чувствительность и специфичность ПЭТ с лигандами ПСМА в значительной степени превышает аналогичные показатели других методов. В исследовании W. Fendler и соавт. [65], опубликованном в 2019 году, частота выявления опухолевого поражения с помощью ПЭТ с 68Ga-ПСМА-11 у пациентов с биохимическим рецидивом РПЖ составила 38% при концентрации ПСА менее 0,5 нг/мл, 57% — от 0,5 до 1 нг/мл, 85% — от 1 до 2 нг/мл, 86% — от 2 до 5 нг/мл и 97% — более 5 нг/мл. У пациентов с более высоким содержанием ПСА чаще выявляют множественные и экстрапельвикально расположенные опухолевые очаги. В группе пациентов с концентрацией ПСА менее 0,5 нг/мл размещение опухолевых очагов вне малого таза выявлено приблизительно в 1/3 случаев. Схожие результаты получены в работах L. Boreta и соавт. [66] и J. Calais и соавт. [67], опубликованных в 2019 и 2018 гг. соответственно, в которых среднее содержание ПСА у включённых в исследование пациентов составило 0,4 и 0,48 нг/мл соответственно. В этих исследованиях с помощью ПЭТ с 68Ga-ПСМА-11 выявили рецидив в 53 и 49%. Кроме того, в 38 и 20% случаев соответственно опухолевый очаг располагался вне ложа удалённой предстательной железы и, следовательно, вне планируемой зоны облучения, что привело к изменению тактики лечения. Наибольшая доля экстрапростатических опухолевых очагов обнаружена в мезоректальных лимфатических узлах (23%) и костях (44%). М.В. Игнатова и соавт. [68] использовали ПЭТ, совмещённую с КТ (ПЭТ/КТ), с 68Ga-ПСМА, что позволило обнаружить рецидив РПЖ в 36% случаев при содержании ПСА менее 0,2 нг/мл, в 69% — 0,2–0,4 нг/мл, в 84% — 0,4–0,6 нг/мл и в 88% — 0,6–0,8 нг/мл. По данным L. Sawicki и соавт. [69], чувствительность ПЭТ/КТ с лигандами ПСМА в диагностике его метастазов превышает чувствительность диффузионновзвешенной МРТ всего тела в 4,3 раза. Н.А. Мещерякова и соавт. [70] утверждают, что применение ПЭТ/КТ с 18F-ПСМА-1007 позволило выявить структурный рецидив у 77,8% пациентов с биохимическим рецидивом РПЖ и отсутствием патологических изменений по данным ПЭТ/КТ c 18F-холином.
В случае его биохимического рецидива после дистанционной лучевой терапии основной задачей диагностики является выявление пациентов, которым необходимо проведение «спасительного» лечения: радикальная простатэктомия, криотерапия, брахитерапия или применение высокоинтенсивного сфокусированного ультразвука [71]. Среди данных пациентов для определения локального рецидива перед биопсией высокой чувствительностью обладают и мпМРТ органов малого таза, и гибридная ПЭТ с лигандами ПСМА [72]. Протокол сканирования МРТ в большинстве случаев аналогичен протоколу мпМРТ, применяемому для первичного выявления РПЖ. При согласующихся результатах МРТ и ПЭТ с лигандами ПСМА вероятность наличия локального рецидива превышает 97%, что в дальнейшем может позволить избежать выполнения биопсии этим пациентам [73].
Чувствительность однофотонной эмиссионной компьютерной томографии (ОФЭКТ) с ПСМА, меченным технецием (99mTc — 99mTc-ПСМА), по данным ряда авторов, уступает ПЭТ/КТ в диагностике локального рецидива и метастазов РПЖ. Так, в исследовании B. Albalooshi и соавт. [74], опубликованном в 2020 году, пациентам с данной патологией в течение двух месяцев выполняли ПЭТ/КТ с 68Ga-ПСМА-11 и ОФЭКТ с 99mTc-ПСМА. Следует отметить, что применение ПЭТ/КТ позволило выявить вдвое больше очагов патологической экспрессии ПСМА. I. Lawal и соавт. [75] не обнаружили более 70% очагов патологической экспрессии ПСМА с помощью ОФЭКТ с 99mTc-ПСМА, выявленные у аналогичных пациентов с помощью ПЭТ/КТ с 68Ga-ПСМА-11, в том числе более 80% патологически изменённых лимфатических узлов диаметром менее 10 мм. Тем не менее ОФЭКТ с 99mTc-ПСМА считают более дешёвой и доступной альтернативой ПЭТ/КТ с лигандами ПСМА. Кроме того, данный метод применяют для планирования лучевой терапии и радионуклидного лечения при невозможности выполнения ПЭТ.
Внедрение в клиническую практику более чувствительных методов диагностики рецидива РПЖ приводит к изменению тактики лечения до 70% случаев у обследованных пациентов [43, 76], в основном подходы к лечению модифицируют в сторону более агрессивных методов, но также — применения таргетной, метастаз-направленной терапии [20]. Такая модификация подходов к лечению позволила достичь увеличения безрецидивного периода [77], выживаемости [78], а также отсрочить применение андроген-депривационной терапии и таким образом улучшить качество жизни пациентов [79].
ПЭТ/КТ и ПЭТ, совмещённая с МРТ (ПЭТ/МРТ), в целом обладают схожими диагностическими показателями в диагностике как первичного РПЖ [80], с тем отличием, что ПЭТ/МРТ позволяет более точно оценить экстракапсулярную инвазию и опухолевое поражение семенных пузырьков [80, 81], так и в диагностике метастатического поражения лимфатических узлов, костных и висцеральных метастазов, а также местного рецидива [82–84].
Несмотря на сходство, эти два гибридных метода визуализации также имеют ряд отличий. Так, лучевая нагрузка при ПЭТ/МРТ до 80% ниже в сравнении с ПЭТ/КТ и составляет около 5 мЗв, однако время сканирования, напротив, существенно больше — для исследования всего тела необходимо около 45 минут [80]. При рассматриваемом комбинированном методе сбор данных ПЭТ и МРТ происходит одновременно, в отличие от последовательного — при ПЭТ/КТ. Гибридный метод ПЭТ/МРТ сочетает в себе детализированную анатомическую визуализацию мягких тканей и в особенности структур малого таза, получаемую с помощью Т2- и Т1-ВИ. Чувствительность диффузионновзвешенных изображений и специфичность ПЭТ с лигандами ПСМА позволяет одновременно оценивать структурные изменения, диффузионные характеристики, васкуляризацию и экспрессию ПСМА в зоне патологических изменений. Возможность такого комплексного анализа считают преимуществом и при оценке костных изменений, особенно при низкой чувствительности МСКТ в отношении выявления костных метастазов у пациентов с биохимическим рецидивом и содержанием ПСА менее 5 нг/мл. Детализация изменений в лёгких при ПЭТ/МРТ, несомненно, уступает ПЭТ/КТ. Одним из основных ограничений метода ПЭТ/МРТ является менее точная коррекция поглощения, что усложняет оценку динамики экспрессии ПСМА в зонах патологических трансформаций при сравнении с ПЭТ/КТ и требует выполнения ряда математических вычислений для адекватной трактовки изменений количественных показателей стандартизированного уровня захвата (SUV).
В исследовании N. Guberina и соавт. [85], опубликованном в 2020 году, 93 пациентам с биохимическим рецидивом РПЖ после радикальной простатэктомии выполнены ПЭТ/КТ и ПЭТ/МРТ с 68Ga-ПСМА-11. ПЭТ/МРТ осуществлена сразу после исследования МСКТ. Средняя концентрация ПСА в группе обследованных пациентов составил 1,64 нг/мл (0,59–4,7 нг/мл). В результате с помощью ПЭТ/МРТ диагностировано 148 из 150 очагов патологической экспрессии ПСМА, выявленных на ПЭТ/КТ (за исключением двух лимфатических узлов), и 11 дополнительных очагов (5 изменённых лимфатических узлов и 6 участков локального рецидива). При этом разница в чувствительности этих гибридных методов обусловлена различиями в чувствительности их ПЭТ-компонентов, а совсем не различиями между КТ и МРТ. Большую (98,8 против 93,2%) чувствительность метода ПЭТ/МРТ в этом исследовании возможно объяснить наличием силы Лоренца, воздействующей на позитрон в условиях магнитного поля высокой напряжённости и заставляющей его двигаться по спирали, результатом этого является уменьшение расстояния между точкой испускания позитрона и аннигиляции, что сопровождается улучшением пространственного разрешения (рис. 4) [86]. Схожие результаты получены в исследовании S. Lutje и соавт. [87], опубликованном в 2017 году, где у 25 пациентов с биохимическим рецидивом с помощью ПЭТ/МРТ с 68Ga-HBED-CC-ПСМА выявлено 14 очагов локального и 23 патологически изменённых лимфатических узла. Кроме того, ПЭТ/КТ с 68Ga-HBED-CC-ПСМА у этих же пациентов позволила обнаружить также 14 участков местного рецидива, 20 ПЭТ-позитивных лимфатических узлов, не отмечено разницы чувствительности методов в выявлении костных метастазов. В двух исследованиях выявлено, что большая чувствительность ПЭТ/МРТ с 68Ga-ПСМА-11 в сравнении с ПЭТ/КТ с аналогичным РФЛП (67,9 и 64,2% соответственно) в диагностике местного рецидива по данным анализа исследований 53 пациентов с биохимическим рецидивом РПЖ обусловлена вкладом МРТ-компонента за счёт более чёткой детализации структур малого таза, что позволило выявить опухолевую ткань на фоне артефактов от мочевого пузыря [83, 88].
Рис. 4. Результаты совмещённой позитронно-эмиссионной и компьютерной томографии с 68Ga-простатоспецифичным мембранным антигеном (a, b, c) и совмещённой позитронно-эмиссионной и магнитно-резонансной томографии с 18F-простатоспецифичным мембранным антигеном-1007 (d, e, f) пациента с рецидивом рака предстательной железы после радикальной простатэктомии, собственное наблюдение: a, d — локальный рецидив в области везикоуретрального анастомоза слева (стрелки); b, c — повышенная экспрессия простатоспецифичного мембранного антигена в неувеличенном левом внутреннем подвздошном лимфатическом узле; c — отсутствие визуализации повышения экспрессии простатоспецифичного мембранного антигена (стрелка); f — визуализация повышения экспрессии простатоспецифичного мембранного антигена (стрелка).
Внедрение в клиническую практику гибридных методов, таких как ПЭТ/КТ и ПЭТ/МРТ с лигандами ПСМА, для диагностики рецидива РПЖ также отражено в клинических рекомендациях. В частности, в последней редакции клинических рекомендаций ЕАУ от 2021 года [89] необходимо применять ПЭТ/КТ или ПЭТ/МРТ с лигандами ПСМА пациентам с его биохимическим рецидивом из группы высокого риска, а в последних редакциях рекомендаций Национальной всеобщей онкологической сети (National Comprehensive Cancer Network — NCCN) от 2024 года [90] и Европейского общества онкологов (European Society of Medical Oncology — ESMO) от 2022 года [91] — в группах пациентов высокого и умеренного риска. В клинических рекомендациях NCCN отмечено, что чувствительность и специфичность ПЭТ с лигандами ПСМА в диагностике микрометастазов РПЖ значительно превышает аналогичные показатели традиционно применяемых диагностических методов, таких как КТ и МРТ. В связи с этим выполнение данных исследований перед ПЭТ/КТ или ПЭТ/МРТ с лигандами ПСМА или в дополнение к этому — не является обязательным ни при первичном его стадировании, ни при биохимическом рецидиве [90].
Отдельно надо отметить, что доля ложноположительных результатов при ПЭТ с лигандами ПСМА может достигать 10% [92]. Известны примеры повышения экспрессии ПСМА при опухолях желудка, толстой кишки, почек, щитовидной и молочной желёз, а также в участках воспаления, например при остеомиелите, в зонах консолидирующих переломов. Кроме того, зафиксирована его гиперэкспрессия в некоторых доброкачественных образованиях, таких как гемангиома и фиброзная дисплазия (рис. 5) [53].
Рис. 5. Результаты совмещённой позитронно-эмиссионной и магнитно-резонансной томографии с 18F-простатоспецифичным мембранным антигеном-1007 всего тела, собственное наблюдение: гиперэкспрессия 18F-простатоспецифичного мембранного антигена-1007 в папиллярном раке щитовидной железы и его метастазах в шейных лимфатических узлах (стрелки) у пациента с аденокарциномой предстательной железы (случайная находка); a — наконечником стрелки отмечена подковообразная почка (случайная находка).
В исследовании M. Chen и соавт. [93], опубликованном в 2020 году, проведён ретроспективный анализ результатов ПЭТ/КТ с 68Ga-ПСМА-11 62 пациентов с РПЖ и обнаруженным солитарным экстрапростатическим очагом гиперэкспрессии 68Ga-PSMA-11 в ребре, максимальное значение SUV (SUVmax) в среднем составило 3,02. У 61 из 62 пациентов (98,4%) после лечения не зарегистрировано биохимического рецидива. Кроме того, отсутствовали признаки роста очагов у пациентов, которым выполняли исследование в динамике. В трёх случаях осуществляли биопсию очагов в ребрах: в двух — результаты гистологического исследования показали доброкачественные изменения, а в одном — неопределённый результат. У 11 пациентов (17,7%) зона гиперэкспрессии ПСМА соответствовала консолидированным переломам. Следует отметить, что один очаг (1,6%) при первичной диагностике интерпретирован как доброкачественный, однако в дальнейшем он увеличился и у пациента отметили появление новых остеосклеротических очагов. В 69,4% случаев значение SUVmax в доброкачественных очагах превышало аналогичный показатель в злокачественном очаге, который, в свою очередь, составил 2,21. В связи с этим при интерпретации данных ПЭТ важно сопоставлять их с результатами МРТ или МСКТ, а также ранее выполненных диагностических исследований. В то же время небольшая доля опухолей предстательной железы не демонстрирует повышенной экспрессии ПСМА, поэтому важна сочетанная интерпретация результатов ПЭТ с данными мпМРТ [88, 94].
Для стандартизации интерпретации результатов ПЭТ/КТ и ПЭТ/МРТ с лигандами ПСМА предложено несколько оценочных шкал. Из них наиболее широко применяют разработанные в 2018 году шкалу PROMISE (Prostate cancer molecular imaging standardized evaluation) [80], представляющую собой модифицированную для молекулярных изображений классификацию TNM (miTNM), и шкалу PSMA-RADS [95] — аналог шкалы PI-RADS. Шкалу PROMISE возможно использовать как при первичной диагностике РПЖ, так и у пациентов с биохимическим рецидивом. Выраженность экспрессии ПСМА (miPSMA expression score) в этой шкале оценивают по среднему стандартизированному показателю SUV (SUVmean) от 0 до 3 баллов:
- 0 баллов соответствует экспрессии ПСМА ниже пула крови;
- 1 балл — выше пула крови, но ниже паренхимы печени;
- 2 балла — выше паренхимы печени, но ниже, чем в слюнных железах;
- 3 балла — уровню экспрессии выше, чем в слюнных железах.
Для РФЛП, характеризующихся преимущественным выведением через гепатобилиарную систему, таких как 18F-ПСМА-1007, в качестве референса вместо паренхимы печени предлагают использовать паренхиму селезёнки. В дальнейшем результат экспрессии ПСМА оценивают совместно с данными МРТ или КТ — наличие опухоли в предстательной железе и её распространённость; наличие мягкотканного очага в ложе удалённой железы; структурные изменения в лимфатических узлах и костях. Определяют финальный результат ПЭТ/КТ или ПЭТ/МРТ: положительный, отрицательный либо сомнительный. Классификация miTNM приближена к TNM с тем отличием, что для отдалённых метастазов добавлены критерии унифокального, олигометастатического, диссеминированного поражения и диффузного поражения костного мозга. Шкала PSMA-RADS по аналогии со шкалой PI-RADS — пятибалльная:
- 1 и 2 балла — доброкачественные изменения;
- 3 балла — неопределённого характера, требующие наблюдения в динамике или биопсию;
- 4 и 5 баллов — злокачественные изменения.
Авторы рекомендуют использовать шкалу PSMA-RADS с целью оценки вероятности наличия метастазов РПЖ, но не для очагов в структуре самой предстательной железы — необходимо ориентироваться на шкалу PI-RADS и данные биопсии. В заключение выносят итоговую категорию miTNM, а также значение для каждого опухолевого очага, если очагов менее пяти [96].
ЗАКЛЮЧЕНИЕ
Биохимический рецидив РПЖ встречается в 25–50% случаев среди пациентов после радикального лечения, тем не менее он оказывает влияние на опухоль-специфическую выживаемость только у тех пациентов, которые имеют факторы риска. Традиционные методы визуализации позволяют выявить как локальный его рецидив, так и отдалённые метастазы, однако чувствительность методов диагностики напрямую зависит от концентрации ПСА.
Диагностические показатели гибридных методов визуализации, таких как ПЭТ/КТ и ПЭТ/МРТ с лигандами ПСМА, значительно превышают аналогичные показатели всех других имеющихся методов лучевой диагностики. Применение данных методик позволяет выявить на ранних стадиях локальный рецидив, регионарные и отдалённые метастазы РПЖ. Их применение имеет первостепенное значение у пациентов с его биохимическим рецидивом после радикальной простатэктомии в сочетании с высоким риском рецидива и прогрессирования, лечение которых начинают при низком содержании ПСА, когда выявить локальный рецидив и метастазы традиционными диагностическими методами и с помощью биопсии часто невозможно.
Визуализация локального рецидива, регионарных и отдалённых метастазов РПЖ с помощью гибридных методов ПЭТ/КТ и ПЭТ/МРТ с лигандами ПСМА до начала «спасительной» лучевой терапии позволяет скорректировать зону облучения, а также осуществлять таргетную метастаз-направленную терапию у пациентов с олигометастатическим поражением либо системную терапию у пациентов с полиметастатическим поражением. Такой подход к диагностике и лечению обеспечивает увеличение безрецидивной, опухоль-специфической и общей выживаемости, а также улучшение качества жизни пациентов.
мпМРТ органов малого таза обладает высокой чувствительностью и специфичностью в отношении выявления локального рецидива РПЖ после лучевой терапии и его локализации перед биопсией. Применение гибридных методов ПЭТ/МРТ или ПЭТ/КТ в сочетании с мпМРТ при согласующихся результатах ПЭТ и МРТ в дальнейшем может позволить избежать применения биопсии в этой группе пациентов.
Пациентам, которым после лучевой терапии возможно выполнение радикального лечения, перед его началом важно исключить наличие метастазов. Кроме того, среди пациентов с биохимическим рецидивом после лучевой терапии с высоким риском рецидива и прогрессирования важно выявить — с олигометастатическим поражением, поскольку им необходимо проведение метастаз-направленной стереотаксической лучевой терапии. Эти задачи наиболее эффективно возможно осуществить с использованием гибридных методов ПЭТ/КТ и ПЭТ/МРТ с лигандами ПСМА.
Диагностические показатели ПЭТ/КТ и ПЭТ/МРТ с лигандами ПСМА не имеют существенных отличий в диагностике костных и висцеральных метастазов РПЖ, но чувствительность ПЭТ/МРТ несколько выше в диагностике локального рецидива и метастазов в регионарных лимфатических узлах. Однако, учитывая небольшое количество научных публикаций, в которых проведено сопоставление рассматриваемых диагностических методов, и небольшую выборку пациентов в большинстве опубликованных исследований, этот вопрос требует дальнейшего изучения.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении поисково-аналитической работы.
Раскрытие интересов. Авторы декларируют отсутствие отношений, деятельности и интересов (личных, профессиональных или финансовых), связанных с третьими лицами (коммерческими, некоммерческими, частными), интересы которых в свою очередь могут быть затронуты содержанием рукописи.
Вклад авторов. Т.М. Ростовцева — сбор и обработка литературных данных, анализ полученных данных, написание текста рукописи; М.Б. Долгушин — концепция работы, обсуждение и утверждение итогового варианта рукописи; М.А. Каралкина — сбор и обработка литературных данных; О.А. Короид — анализ литературных данных, обсуждение и утверждение итогового варианта рукописи; В.Е. Синицын — концепция работы, обсуждение и утверждение итогового варианта рукописи. Все авторы одобрили рукопись (версию для публикации), а также согласились нести ответственность за все аспекты работы и гарантировали, что вопросы, связанные с точностью или добросовестностью любой части работы, будут должным образом рассмотрены и решены.
ADDITIONAL INFORMATION
Funding source. This article was not supported by any external sources of funding.
Disclosure of interests. The authors declare that they have no relationships, activities or interests (personal, professional or financial) with third parties (commercial, non-commercial, private) whose interests may be affected by the content of the article, as well as no other relationships, activities or interests over the past three years that must be reported.
Authors’ contribution. T.M. Rostovtseva: collection and processing of literary data, analysis of the obtained data, writing the manuscript; M.B. Dolgushin: concept of the work, discussion and approval the final version of the manuscript; M.A. Karalkina: collection and processing of literary data; O.A. Koroid: analysis of literary data, discussion and approval the final version of the manuscript; V.E. Sinitsyn: concept of the work, discussion and approval the final version of the manuscript. Thereby, all authors provided approval of the version to be published and agree to be accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Об авторах
Татьяна Михайловна Ростовцева
Федеральный центр мозга и нейротехнологий; Московский государственный университет имени М.В. Ломоносова
Email: rostovtsevat@mail.ru
ORCID iD: 0000-0001-6541-179X
SPIN-код: 5840-7590
Россия, Москва; Москва
Михаил Борисович Долгушин
Федеральный центр мозга и нейротехнологий
Email: dolgushin.m@fccps.ru
ORCID iD: 0000-0003-3930-5998
SPIN-код: 6388-9644
д-р мед. наук, профессор, академик РАН
Россия, МоскваМария Алексеевна Каралкина
Федеральный центр мозга и нейротехнологий
Email: karalkina.m@fccps.ru
ORCID iD: 0000-0002-9267-3602
SPIN-код: 9812-0420
канд. мед. наук
Россия, МоскваОльга Анатольевна Короид
«Медицина и ядерные технологии»
Email: olga_koroid@mail.ru
ORCID iD: 0009-0004-6494-8017
SPIN-код: 1400-5957
канд. мед. наук
Россия, МоскваВалентин Евгеньевич Синицын
Московский государственный университет имени М.В. Ломоносова
Автор, ответственный за переписку.
Email: vsini@mail.ru
ORCID iD: 0000-0002-5649-2193
SPIN-код: 8449-6590
д-р мед. наук, профессор
Россия, МоскваСписок литературы
- Kaprin AD, Starinsky VV, Shakhzadova AO, editors. Malignant neoplasms in Russia in 2021 (morbidity and mortality). Moscow: P. Herzen MORI — the branch of the FSBI NMRRC of the Ministry of Health of the Russian Federation, 2022. (In Russ).
- Suardi N, Porter CR, Reuther AM, et al. A nomogram predicting long-term biochemical recurrence after radical prostatectomy. Cancer. 2008;112(6):1254–1263. doi: 10.1002/cncr.23293
- Cookson MS, Aus G, Burnett AL, et al. Variation in the definition of biochemical recurrence in patients treated for localized prostate cancer: the American Urological Association prostate guidelines for localized prostate cancer update panel report and recommendations for a standard in the reporting of surgical outcomes. J Urol. 2007;177(2):540–545. doi: 10.1016/j.juro.2006.10.097
- Bianco FJ Jr, Scardino PT, Eastham JA. Radical prostatectomy: long-term cancer control and recovery of sexual and urinary function ("trifecta"). Urology. 2005;66 Suppl. 5:83–94. doi: 10.1016/j.urology.2005.06.116
- Eggener SE, Scardino PT, Walsh PC, et al. Predicting 15-year prostate cancer specific mortality after radical prostatectomy. J Urol. 2011;185(3):869–875. doi: 10.1016/j.juro.2010.10.057
- Bolla M, van Poppel H, Tombal B, et al.; European Organisation for Research and Treatment of Cancer, Radiation Oncology and Genito-Urinary Groups. Postoperative radiotherapy after radical prostatectomy for high-risk prostate cancer: long-term results of a randomised controlled trial (EORTC trial 22911). Lancet. 2012;380(9858): 2018–2027. doi: 10.1016/S0140-6736(12)61253-7
- Freedland SJ, Humphreys EB, Mangold LA, et al. Risk of prostate cancer-specific mortality following biochemical recurrence after radical prostatectomy. JAMA. 2005;294(4): 433–439. doi: 10.1001/jama.294.4.433
- Van den Broeck T, van den Bergh RCN, Arfi N, et al. Prognostic value of biochemical recurrence following treatment with curative intent for prostate cancer: a systematic review. Eur Urol. 2019;75(6):967–987. doi: 10.1016/j.eururo.2018.10.011 EDN: QVRVNR
- Roach M 3rd, Hanks G, Thames H Jr, et al. Defining biochemical failure following radiotherapy with or without hormonal therapy in men with clinically localized prostate cancer: recommendations of the RTOG-ASTRO Phoenix Consensus Conference. Int J Radiat Oncol Biol Phys. 2006;65(4):965–974. doi: 10.1016/j.ijrobp.2006.04.029
- Roberts WB, Han M. Clinical significance and treatment of biochemical recurrence after definitive therapy for localized prostate cancer. Surg Oncol. 2009;18(3):268–274. doi: 10.1016/j.suronc.2009.02.004
- Pound CR, Partin AW, Eisenberger MA, et al. Natural history of progression after PSA elevation following radical prostatectomy. JAMA. 1999;281(17):1591–1597. doi: 10.1001/jama.281.17.1591
- Zagars GK, Pollack A. Kinetics of serum prostate-specific antigen after external beam radiation for clinically localized prostate cancer. Radiother Oncol. 1997;44(3):213–221. doi: 10.1016/s0167-8140(97)00123-0 EDN: AIKIJT
- Jhaveri FM, Klein EA. How to explore the patient with a rising PSA after radical prostatectomy: defining local versus systemic failure. Semin Urol Oncol. 1999;17(3):130–134.
- Yossepowitch O, Briganti A, Eastham JA, et al. Positive surgical margins after radical prostatectomy: a systematic review and contemporary update. European urology. 2014;65(2):303–313. doi: 10.1016/j.eururo.2013.07.039
- Patel A, Dorey F, Franklin J, deKernion JB. Recurrence patterns after radical retropubic prostatectomy: clinical usefulness of prostate specific antigen doubling times and log slope prostate specific antigen. The Journal of urology. 1997;158(4):1441–1445. doi: 10.1016/s0022-5347(01)64238-1
- Mottet N, Bellmunt J, Bolla M, et al. EAU-ESTRO-SIOG Guidelines on Prostate Cancer. Part 1: Screening, Diagnosis, and Local Treatment with Curative Intent. Eur Urol. 2017;71(4):618–629. doi: 10.1016/j.eururo.2016.08.003 EDN: YUXBLF
- Tilki D, Preisser F, Graefen M, et al. External validation of the European Association of Urology biochemical recurrence risk groups to predict metastasis and mortality after radical prostatectomy in a European cohort. Eur Urol. 2019;75(6):896–900. doi: 10.1016/j.eururo.2019.03.016
- Morgan TM, Boorjian SA, Buyyounouski MK, et al. Salvage therapy for prostate cancer: AUA/ASTRO/SUO guideline part I: introduction and treatment decision-making at the time of suspected biochemical recurrence after radical prostatectomy. J Urol. 2024;211(4):509–517. doi: 10.1097/JU.0000000000003892 EDN: ONOLYZ
- Mottet N, van den Bergh RCN, Briers E, et al. EAU-EANM-ESTRO-ESUR-SIOG guidelines on prostate cancer-2020 update. Part 1: screening, diagnosis, and local treatment with curative intent. Eur Urol. 2021;79(2):243–262. doi: 10.1016/j.eururo.2020.09.042 EDN: ESJJKR
- Zaorsky NG, Calais J, Fanti S, et al. Salvage therapy for prostate cancer after radical prostatectomy. Nat Rev Urol. 2021;18(11):643–668. doi: 10.1038/s41585-021-00497-7 EDN: CIPPVD
- Stish BJ, Pisansky TM, Harmsen WS, et al. Improved metastasis-free and survival outcomes with early salvage radiotherapy in men with detectable prostate-specific antigen after prostatectomy for prostate cancer. Journal of clinical oncology. 2016;34(32):3864–3871. doi: 10.1200/JCO.2016.68.3425
- Abugharib A, Jackson WC, Tumati V, et al. Very early salvage radiotherapy improves distant metastasis-free survival. The Journal of urology. 2017;197(3 Pt 1):662–668. doi: 10.1016/j.juro.2016.08.106
- Pisansky TM, Agrawal S, Hamstra DA, et al. Salvage radiation therapy dose response for biochemical failure of prostate cancer after prostatectomy — A multi-institutional observational study. International journal of radiation oncology, biology, physics. 2016;96(5):1046–1053. doi: 10.1016/j.ijrobp.2016.08.043
- Boorjian SA, Karnes RJ, Crispen PL, et al. Radiation therapy after radical prostatectomy: impact on metastasis and survival. J Urol. 2009;182(6):2708–2714. doi: 10.1016/j.juro.2009.08.027
- Parker CC, Clarke NW, Cook AD, et al. Timing of radiotherapy after radical prostatectomy (RADICALS-RT): a randomised, controlled phase 3 trial. Lancet. 2020;396(10260):1413–1421. doi: 10.1016/S0140-6736(20)31553-1 EDN: WJNRRN
- Wiegel T, Lohm G, Bottke D, et al. Achieving an undetectable PSA after radiotherapy for biochemical progression after radical prostatectomy is an independent predictor of biochemical outcome-results of a retrospective study. Int J Radiat Oncol Biol Phys. 2009;73(4):1009–1016. doi: 10.1016/j.ijrobp.2008.06.1922
- Trock BJ, Han M, Freedland SJ, et al. Prostate cancer-specific survival following salvage radiotherapy vs observation in men with biochemical recurrence after radical prostatectomy. JAMA. 2008;299(23):2760–2769. doi: 10.1001/jama.299.23.2760 EDN: MLCBHB
- Valle LF, Lehrer EJ, Markovic D, et al. A systematic review and meta-analysis of local salvage therapies after radiotherapy for prostate cancer (MASTER). Eur Urol. 2021;80(3)280–292. doi: 10.1016/j.eururo.2020.11.010 EDN: EZFEBO
- Beresford MJ, Gillatt D, Benson RJ, Ajithkumar T. A systematic review of the role of imaging before salvage radiotherapy for post-prostatectomy biochemical recurrence. Clin Oncol (R Coll Radiol). 2010. Vol. 22, N. 1. P. 46–55. doi: 10.1016/j.clon.2009.10.015
- Abuzallouf S, Dayes I, Lukka H. Baseline staging of newly diagnosed prostate cancer: a summary of the literature. J Urol. 2004;171(6 Pt 1):2122–2127. doi: 10.1097/01.ju.0000123981.03084.06
- O'Sullivan GJ, Carty FL, Cronin CG. Imaging of bone metastasis: an update. World J Radiol. 2015;7(8):202–211. doi: 10.4329/wjr.v7.i8.202
- Kane CJ, Amling CL, Johnstone PA, et al. Limited value of bone scintigraphy and computed tomography in assessing biochemical failure after radical prostatectomy. Urology. 2003;61(3):607–611. doi: 10.1016/s0090-4295(02)02411-1
- Gabriele D, Collura D, Oderda M, et al. Is there still a role for computed tomography and bone scintigraphy in prostate cancer staging? An analysis from the EUREKA-1 database. World J Urol. 2016;34(4):517–523. doi: 10.1007/s00345-015-1669-2 EDN: WUPIZJ
- Krause BJ, Souvatzoglou M, Tuncel M, et al. The detection rate of [11C]Choline-PET/CT depends on the serum PSA-value in patients with biochemical recurrence of prostate cancer. Eur J Nucl Med Mol Imaging. 2008;35(1):18–23. doi: 10.1007/s00259-007-0581-4 EDN: DRDVCM
- Turkbey B, Rosenkrantz AB, Haider MA, et al. Prostate imaging reporting and data system version 2.1: 2019 update of prostate imaging reporting and data system version 2. Eur Urol. 2019;76(3):340–351. doi: 10.1016/j.eururo.2019.02.033
- Cirillo S, Petracchini M, Scotti L, et al. Endorectal magnetic resonance imaging at 1.5 Tesla to assess local recurrence following radical prostatectomy using T2-weighted and contrast-enhanced imaging. Eur Radiol. 2009;19(3):761–769. doi: 10.1007/s00330-008-1174-8 EDN: ZGZGFV
- Hernandez D, Salas D, Giménez D, et al. Pelvic MRI findings in relapsed prostate cancer after radical prostatectomy. Radiat Oncol. 2015;10:262. doi: 10.1186/s13014-015-0574-6 EDN: XDYQIJ
- Kwon T, Kim JK, Lee C, et al. Discrimination of local recurrence after radical prostatectomy: value of diffusion-weighted magnetic resonance imaging. Prostate Int. 2018;6(1):12–17. doi: 10.1016/j.prnil.2017.05.002 EDN: YCZHET
- Panebianco V, Barchetti F, Sciarra A, et al. Prostate cancer recurrence after radical prostatectomy: the role of 3-T diffusion imaging in multi-parametric magnetic resonance imaging. Eur Radiol. 2013;23(6):1745–1752. doi: 10.1007/s00330-013-2768-3 EDN: WABISI
- Breen WG, Stish BJ, Harmsen WS, et al. The prognostic value, sensitivity, and specificity of multiparametric magnetic resonance imaging before salvage radiotherapy for prostate cancer. Radiother Oncol. 2021;161:9–15. doi: 10.1016/j.radonc.2021.05.015 EDN: AXVJZF
- Dirix P, van Walle L, Deckers F, et al. Proposal for magnetic resonance imaging-guided salvage radiotherapy for prostate cancer. Acta Oncol. 2017;56(1):27–32. doi: 10.1080/0284186X.2016.1223342 EDN: YWOCNJ
- Renard-Penna R, Zhang-Yin J, Montagne S, et al. Targeting local recurrence after surgery with MRI imaging for prostate cancer in the setting of salvage radiation therapy. Front Oncol. 2022;12:775387. doi: 10.3389/fonc.2022.775387 EDN: FQGODQ
- Hofman MS, Lawrentschuk N, Francis RJ, et al.; proPSMA Study Group Collaborators. Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study. Lancet. 2020;395(10231):1208–1216. doi: 10.1016/S0140-6736(20)30314-7 EDN: IDQIFB
- Buergy D, Sertdemir M, Weidner A, et al. Detection of local recurrence with 3-Tesla MRI after radical prostatectomy: a useful method for radiation treatment planning? In Vivo. 2018;32(1):125–131. doi: 10.21873/invivo.11214 EDN: YEIKJV
- Sharma V, Nehra A, Colicchia M, et al. Multiparametric magnetic resonance imaging is an independent predictor of salvage radiotherapy outcomes after radical prostatectomy. Eur Urol. 2018;73(6):879–887. doi: 10.1016/j.eururo.2017.11.012
- Hövels AM, Heesakkers RA, Adang EM, et al. The diagnostic accuracy of CT and MRI in the staging of pelvic lymph nodes in patients with prostate cancer: a meta-analysis. Clin Radiol. 2008;63(4):387–395. doi: 10.1016/j.crad.2007.05.022
- Toussi A, Stewart-Merrill SB, Boorjian SA, et al. Standardizing the definition of biochemical recurrence after radical prostatectomy-what prostate specific antigen cut point best predicts a durable increase and subsequent systemic progression? J Urol. 2016;195(6):1754–1759. doi: 10.1016/j.juro.2015.12.075 EDN: WPXQUN
- Luboldt W, Küfer R, Blumstein N, et al. Prostate carcinoma: diffusion-weighted imaging as potential alternative to conventional MR and 11C-choline PET/CT for detection of bone metastases. Radiology. 2008;249(3):1017–1025. doi: 10.1148/radiol.2492080038
- Van Nieuwenhove S, Van Damme J, Padhani AR, et al. Whole-body magnetic resonance imaging for prostate cancer assessment: current status and future directions. J Magn Reson Imaging. 2022;55(3):653–680. doi: 10.1002/jmri.27485
- Nakanishi K, Tanaka J, Nakaya Y, et al. Whole-body MRI: detecting bone metastases from prostate cancer. Jpn J Radiol. 2022;40(3):229–244. doi: 10.1007/s11604-021-01205-6 EDN: QZBDSB
- Deliveliotis C, Manousakas T, Chrisofos M, et al. Diagnostic efficacy of transrectal ultrasound-guided biopsy of the prostatic fossa in patients with rising PSA following radical prostatectomy. World J Urol. 2007;25(3):309–313. doi: 10.1007/s00345-007-0167-6 EDN: JCMCNS
- Maurer T, Gschwend JE, Rauscher I, et al. Diagnostic efficacy of (68)Gallium-PSMA positron emission tomography compared to conventional imaging for lymph node staging of 130 consecutive patients with intermediate to high risk prostate cancer. J Urol. 2016;195(5):1436–1443. doi: 10.1016/j.juro.2015.12.025
- de Galiza Barbosa F, Queiroz MA, Nunes RF, et al. Nonprostatic diseases on PSMA PET imaging: a spectrum of benign and malignant findings. Cancer Imaging. 2020;20(1):23. doi: 10.1186/s40644-020-00300-7 EDN: TKHPXT
- Jadvar H, Calais J, Fanti S, et al. Appropriate Use Criteria for Prostate-Specific Membrane Antigen PET Imaging. J Nucl Med. 2022;63(1):59–68. doi: 10.2967/jnumed.121.263262 EDN: PBEQSJ
- Rahbar K, Weckesser M, Ahmadzadehfar H, et al. Advantage of 18F-PSMA-1007 over 68Ga-PSMA-11 PET imaging for differentiation of local recurrence vs. urinary tracer excretion. Eur J Nucl Med Mol Imaging. 2018;45(6):1076–1077. doi: 10.1007/s00259-018-3952-0 EDN: SGKOZF
- Behr SC, Aggarwal R, Van Brocklin HF, et al. Phase I study of CTT1057, an 18F-labeled imaging agent with phosphoramidate core targeting prostate-specific membrane antigen in prostate cancer. J Nucl Med. 2019;60(7):910–916. doi: 10.2967/jnumed.118.220715 2018
- Duan H, Song H, Davidzon GA, et al. Prospective comparison of 68Ga-NeoB and 68Ga-PSMA-R2 PET/MRI in patients with biochemically recurrent prostate cancer. J Nucl Med. 2024;65(6):897–903. doi: 10.2967/jnumed.123.267017 EDN: GUNGVG
- PROPELLER trial results – SAR-bisPSMA safe, well tolerated and efficacious in the detection of prostate cancer; [about 3 screens]. In: Clarity Pharmaceuticals [Internet]. Eveleigh: National Innovation Centre, 2023–2024 [cited 2024 Dec 19]. Available from: https://www.claritypharmaceuticals.com/news/propeller_results/
- Nielsen JB, Zacho HD, Haberkorn U, et al. A comprehensive safety evaluation of 68Ga-Labeled ligand prostate-specific membrane antigen 11 PET/CT in prostate cancer: the results of 2 rospective, multicenter trials. Clin Nucl Med. 2017;42(7):520–524. doi: 10.1097/RLU.0000000000001681
- Sanchez-Crespo A. Comparison of Gallium-68 and Fluorine-18 imaging characteristics in positron emission tomography. Appl Radiat Isot. 2013;76:55–62. doi: 10.1016/j.apradiso.2012.06.034
- Dietlein M, Kobe C, Kuhnert G, et al. Comparison of [(18)F]DCFPyL and [(68)Ga]Ga-PSMA-HBED-CC for PSMA-PET imaging in patients with relapsed prostate cancer. Mol Imaging Biol. 2015;17(4):575–584. doi: 10.1007/s11307-015-0866-0 EDN: NUSIQH
- Dietlein F, Kobe C, Neubauer S, et al. PSA-Stratified Performance of 18F- and 68Ga-PSMA PET in patients with biochemical recurrence of prostate cancer. J Nucl Med. 2017;58(6):947–952. doi: 10.2967/jnumed.116.185538
- Kim JH, Lee JS, Kim JS, et al. Physical performance comparison of Ga-68 and F-18 in small animal PET system. J Nucl Med. 2010;51:1423.
- Rohith G. VISION trial: 177Lu-PSMA-617 for progressive metastatic castration-resistant prostate cancer. Indian J Urol. 2021;37(4):372–373. doi: 10.4103/iju.iju_292_21 EDN: YAFNKB
- Fendler WP, Calais J, Eiber M, et al. Assessment of 68Ga-PSMA-11 PET accuracy in localizing recurrent prostate cancer: a prospective single-arm clinical trial. JAMA Oncol. 2019;5(6):856–863. doi: 10.1001/jamaoncol.2019.0096
- Boreta L, Gadzinski AJ, Wu SY, et al. Location of recurrence by Gallium-68 PSMA-11 PET scan in prostate cancer patients eligible for salvage radiotherapy. Urology. 2019;129:165–171. doi: 10.1016/j.urology.2018.12.055
- Calais J, Czernin J, Cao M, et al. 68Ga-PSMA-11 PET/CT mapping of prostate cancer biochemical recurrence after radical prostatectomy in 270 patients with a PSA level of less than 1.0 ng/mL: impact on salvage radiotherapy planning. J Nucl Med. 2018;59(2):230–237. doi: 10.2967/jnumed.117.201749
- Ignatova MV, Tlostanova MS, Stranzhevsky AA. The first experience of performing combined positronemission with computed tomography with prostate-specific membrane antigen labeled with gallium-68 in patients with minimal level of prostate-specific antigen after radical prostatectomy. Problems in oncology. 2018;64(4):508–514. doi: 10.37469/0507-3758-2018-64-4-508-514 EDN: YMJZRB
- Sawicki LM, Kirchner J, Buddensieck C, et al. Prospective comparison of whole-body MRI and 68Ga-PSMA PET/CT for the detection of biochemical recurrence of prostate cancer after radical prostatectomy. Eur J Nucl Med Mol Imaging. 2019;46(7):1542–1550. doi: 10.1007/s00259-019-04308-5 EDN: OQFCIB
- Meshcheriakova NA, Dolgushin MB, Pronin AI, et al. 18F-PSMA-1007 and 18F-fluorocholine PET/CT in prostate cancer progression diagnostics. First comparative experience. Cancer Urology. 2019;15(3):70–76. doi: 10.17650/1726-9776-2019-15-3-70-76 EDN: ZZTJTZ
- Rouvière O, Vitry T, Lyonnet D. Imaging of prostate cancer local recurrences: why and how? Eur Radiol. 2010;20(5):1254–1266. doi: 10.1007/s00330-009-1647-4
- Liu W, Fakir H, Randhawa G, et al. Defining radio-recurrent intra-prostatic target volumes using PSMA-targeted PET/CT and multi-parametric MRI. Clin Transl Radiat Oncol. 2021;32:41–47. doi: 10.1016/j.ctro.2021.11.006 EDN: NBASST
- Rasing M, van Son M, Moerland M, et al. Value of targeted biopsies and combined PSMA PET/CT and mp-MRI imaging in locally recurrent prostate cancer after primary radiotherapy. Cancers (Basel). 2022;14(3):781. doi: 10.3390/cancers14030781 EDN: POUONH
- Albalooshi B, Al Sharhan M, Bagheri F, et al. Direct comparison of 99mTc-PSMA SPECT/CT and 68Ga-PSMA PET/CT in patients with prostate cancer. Asia Ocean J Nucl Med Biol. 2020;8(1):1–7. doi: 10.22038/aojnmb.2019.43943.1293
- Lawal IO, Ankrah AO, Mokgoro NP, et al. Diagnostic sensitivity of Tc-99m HYNIC PSMA SPECT/CT in prostate carcinoma: a comparative analysis with Ga-68 PSMA PET/CT. Prostate. 2017;77(11):1205–1212. doi: 10.1002/pros.23379
- De Bari B, Mazzola R, Aiello D, et al. Could 68-Ga PSMA PET/CT become a new tool in the decision-making strategy of prostate cancer patients with biochemical recurrence of PSA after radical prostatectomy? A preliminary, monocentric series. Radiol med. 2018;123(9):719–725. doi: 10.1007/s11547-018-0890-7 EDN: UOCNNY
- Meijer D, Eppinga WSC, Mohede RM, et al. Prostate-specific membrane antigen positron emission tomography/computed tomography is associated with improved oncological outcome in men treated with salvage radiation therapy for biochemically recurrent prostate cancer. Eur Urol Oncol. 2022;5(2):146–152. doi: 10.1016/j.euo.2022.01.001 EDN: EJCJZQ
- Steuber T, Jilg C, Tennstedt P, et al. Standard of care versus metastases-directed therapy for PET-detected nodal oligorecurrent prostate cancer following multimodality treatment: a multi-institutional case-control study. Eur Urol Focus. 2019;5(6):1007–1013. doi: 10.1016/j.euf.2018.02.015 EDN: GGXATS
- Ost P, Reynders D, Decaestecker K, et al. Surveillance or metastasis-directed therapy for oligometastatic prostate cancer recurrence: a prospective, randomized, multicenter phase II trial. J Clin Oncol. 2018;36(5):446–453. doi: 10.1200/JCO.2017.75.4853 EDN: YFTYOT
- Domachevsky L, Bernstine H, Goldberg N, et al. Early 68GA-PSMA PET/MRI acquisition: assessment of lesion detectability and PET metrics in patients with prostate cancer undergoing same-day late PET/CT. Clin Radiol. 2017;72(11):944–950. doi: 10.1016/j.crad.2017.06.116
- Muehlematter UJ, Burger IA, Becker AS, et al. Diagnostic accuracy of multiparametric MRI versus 68Ga-PSMA-11 PET–MRI for extracapsular extension and seminal vesicle invasion in patients with prostate cancer. Radiology. 2019;293(2):350–358. doi: 10.1148/radiol.2019190687 EDN: KWPAPG
- Rauscher I, Maurer T, Beer AJ, et al. Value of 68Ga-PSMA HBED-CC PET for the assessment of lymph node metastases in prostate cancer patients with biochemical recurrence: comparison with histopathology after salvage lymphadenectomy. J Nucl Med. 2016;57(11):1713–1719. doi: 10.2967/jnumed.116.173492
- Freitag MT, Radtke JP, Hadaschik BA, et al. Comparison of hybrid (68)Ga-PSMA PET–MRI and (68)Ga-PSMA PET–CT in the evaluation of lymph node and bone metastases of prostate cancer. Eur J Nucl Med Mol Imaging. 2016;43(1):70–83. doi: 10.1007/s00259-015-3206-3
- Domachevsky L, Bernstine H, Goldberg N, et al. Comparison between pelvic PSMA-PET/MR and whole-body PSMA-PET/CT for the initial evaluation of prostate cancer: a proof of concept study. Eur Radiol. 2020;30(1):328–336. doi: 10.1007/s00330-019-06353-y EDN: KMSBPG
- Guberina N, Hetkamp P, Ruebben H, et al. Whole-Body Integrated [68Ga]PSMA-11-PET/MR imaging in patients with recurrent prostate cancer: comparison with whole-body PET/CT as the standard of reference. Mol Imaging Biol. 2020;22(3):788–796. doi: 10.1007/s11307-019-01424-4 EDN: JFXPCT
- Hammer BE, Christensen NL, Heil BG Use of a magnetic field to increase the spatial resolution of positron emission tomography. Med Phys. 1994;21(12):1917–1920. doi: 10.1118/1.597178
- Lütje S, Cohnen J, Gomez B, et al. Integrated 68Ga-HBED-CC-PSMA-PET/MRI in patients with suspected recurrent prostate cancer. Nuklearmedizin. 2017;56(3):73–81. doi: 10.3413/Nukmed-0850-16-09 EDN: YHZYJI
- Glemser PA, Rotkopf LT, Ziener CH. et al. Hybrid imaging with [68Ga]PSMA-11 PET-CT and PET-MRI in biochemically recurrent prostate cancer. Cancer Imaging. 2022;22(1):53. doi: 10.1186/s40644-022-00489-9 EDN: RWPVCM
- Cornford P, van den Bergh RCN, Briers E, et al. EAU-EANM-ESTRO-ESUR-SIOG Guidelines on prostate cancer. Part II-2020 update: treatment of relapsing and metastatic prostate cancer. Eur Urol. 2021;79(2):263–282. doi: 10.1016/j.eururo.2020.09.046 EDN: DIYUWG
- Schaeffer EM, Srinivas S, Adra N, et al. NCCN Guidelines® Insights: Prostate Cancer, Version 3.2024. J Natl Compr Canc Netw. 2024;22(3):140–150. doi: 10.6004/jnccn.2024.0019 EDN: FGJHUU
- Kanesvaran R, Castro E, Wong A, et al. Pan-Asian adapted ESMO Clinical Practice Guidelines for the diagnosis, treatment and follow-up of patients with prostate cancer. ESMO Open. 2022;7(4):100518. doi: 10.1016/j.esmoop.2022.100518 EDN: XMNZIQ
- Fendler WP, Calais J, Eiber M, et al. False positive PSMA PET for tumor remnants in the irradiated prostate and other interpretation pitfalls in a prospective multi-center trial. Eur J Nucl Med Mol Imaging. 2021;48(2):501–508. doi: 10.1007/s00259-020-04945-1 EDN: LCAVNA
- Chen MY, Franklin A, Yaxley J, et al. Solitary rib lesions showing prostate-specific membrane antigen (PSMA) uptake in pre-treatment staging 68 Ga-PSMA-11 positron emission tomography scans for men with prostate cancer: benign or malignant? BJU Int. 2020;126(3):396–401. doi: 10.1111/bju.15152 EDN: ZWDNWL
- Hofman MS, Hicks RJ, Maurer T, Eiber M. Prostate-specific membrane antigen PET: clinical utility in prostate cancer, normal patterns, pearls, and pitfalls. Radiographics. 2018;38(1):200–217. doi: 10.1148/rg.2018170108 EDN: VDZCOY
- Eiber M, Herrmann K, Calais J, et al. Prostate cancer molecular imaging standardized evaluation (PROMISE): proposed miTNM classification for the interpretation of PSMA-ligand PET/CT. J Nucl Med. 2018;59(3):469–478. doi: 10.2967/jnumed.117.198119 EDN: YHZFXV
- Rowe SP, Pienta KJ, Pomper MG, Gorin MA. Proposal for a structured reporting system for prostate-specific membrane antigen-targeted PET imaging: PSMA-RADS Version 1.0. J Nucl Med. 2018;59(30):479–485. doi: 10.2967/jnumed.117.195255
Дополнительные файлы