Role of myocardial strain parameters in assessing indications for pulmonary valve replacement in children after tetralogy of Fallot repair: a cross-sectional study
- Authors: Kabdullina A.M.1, Sinitsyn V.E.2, Rakhimzhanova R.I.1, Dautov T.B.3, Abdrakhmanova Z.S.1, Saduakassova A.B.4
-
Affiliations:
- Astana Medical University
- Lomonosov Moscow State University
- University Medical Center
- Medical Center Hospital of the President’s Affairs Administration of the Republic of Kazakhstan
- Issue: Vol 6, No 3 (2025)
- Pages: 440-451
- Section: Original Study Articles
- Submitted: 05.10.2024
- Accepted: 21.05.2025
- Published: 13.10.2025
- URL: https://jdigitaldiagnostics.com/DD/article/view/636743
- DOI: https://doi.org/10.17816/DD636743
- EDN: https://elibrary.ru/HBLRJV
- ID: 636743
Cite item
Full Text
Abstract
BACKGROUND: Radical repair of tetralogy of Fallot significantly improves patients’ survival and quality of life. However, in the long-term postoperative period, most patients develop progressive pulmonary valve insufficiency. Pulmonary regurgitation gradually increases the volume load on the right ventricle, causing dilation, impaired systolic and diastolic function, and higher risk of arrhythmias and sudden cardiac death. In turn, pulmonary valve replacement decreases afterload and improves myocardial function. Nevertheless, the optimal timing of valve replacement in asymptomatic patients after tetralogy of Fallot repair remains unclear.
AIM: This study aimed to evaluate myocardial strain parameters as potential criteria for determining the need for pulmonary valve replacement.
METHODS: This single-center retrospective (medical record-based) cross-sectional study included data from patients treated at the departments of Cardiothoracic Surgery and Cardiology within the National Research Cardiac Surgery Center (Astana, Kazakhstan). Cardiac magnetic resonance imaging was performed between December 2011 and June 2020 in patients who had undergone radical tetralogy of Fallot repair. Because a threshold value of right ventricular end-diastolic volume (RVEDV) between 150 and 170 mL/m2 indicates a need for pulmonary valve replacement in asymptomatic patients, the sample was divided into two groups based on RVEDV: group 1, RVEDV <150 mL/m2, and group 2, RVEDV ≥150 mL/m2. The prognostic value of myocardial strain parameters in decision-making for timely pulmonary valve replacement was assessed.
RESULTS: The study included 69 patients aged 3–18 years (11 ± 4 years) who had undergone radical tetralogy of Fallot repair. Circumferential strain in the basal anteroseptal segment of the left ventricle significantly differed between groups 1 (n = 52) and 2 (n = 17): −23.2 ± 5.8% vs −16.7 ± 8.4% (p = 0.003). Moreover, in the basal inferior segment of the left ventricle, significant differences were observed: −10.8 ± 5.2% in group 1 and −7.8 ± 6.8% in group 2 (p = 0.014). The right ventricular end-systolic volume in group 1 was approximately twice as low as in group 2: 56.9 ± 19.1 vs 103.9 ± 111.9 mL/m2 (p < 0.001).
CONCLUSION: The findings indicate the diagnostic value of myocardial strain parameters and their potential as additional criteria for evaluating indications for pulmonary valve replacement.
Full Text
ОБОСНОВАНИЕ
Тетрада Фалло — наиболее распространённый цианотический врождённый порок сердца, характеризующийся четырьмя основными признаками: дефектом межжелудочковой перегородки, обструкцией выводного отдела правого желудочка (ПЖ), гипертрофией миокарда ПЖ и декстрапозицией аорты [1].
В середине XX века только 20% детей с врождёнными пороками сердца доживали до взрослого возраста. В настоящее время, благодаря достижениям детской кардиохирургии, смертность существенно снизилась, а большинство пациентов с тетрадой Фалло доживают до 60 лет [2, 3]. Однако у растущих детей, перенёсших радикальную коррекцию порока, сохраняется риск поздних осложнений, включая развитие сердечной недостаточности, стеноз лёгочной артерии, инфекционный эндокардит, задержка роста и развития, необходимость повторных вмешательств и возникновение аритмий [4]. Хирургическое лечение тетрады Фалло направлено на устранение стеноза выводного отдела ПЖ и закрытие дефекта межжелудочковой перегородки. При наличии выраженной гипоплазии кольца клапана лёгочной артерии необходимо выполнение массивной инфундибулэктомии и трансаннулярной пластики, которая приводит к развитию выраженной лёгочной регургитации [5]. Она вызывает хроническую объёмную перегрузке ПЖ, что приводит к его прогрессирующей дилатации и дисфункции. В дальнейшем это сопровождается развитием предсердных и желудочковых аритмий, а также повышает риск синдрома внезапной сердечной смерти [5–11].
Эффективным методом лечения лёгочной недостаточности у пациентов после радикальной коррекции тетрады Фалло является своевременная замена клапана лёгочной артерии биопротезом или кондуитом, что способствует ремоделированию и улучшению функции ПЖ сердца [12, 13]. К установленным показаниям к замене клапана лёгочной артерии относят наличие аритмий, снижение толерантности к физической нагрузке, ухудшение функционального класса Нью-Йоркской Ассоциации Сердца (NYHA), стеноз лёгочной артерии тяжёлой степени, а также прогрессирующая трикуспидальная регургитация в сочетании с умеренной и тяжёлой лёгочной регургитацией [14]. Однако оптимальное время для замены клапана у бессимптомных пациентов является дискуссионным вопросом [15–18].
Магнитно-резонансная томография (МРТ) сердца является «золотым стандартом» визуализации и оценки объёма и функции ПЖ у пациентов с корригированной тетрадой Фалло [19–21]. Пороговые значения для конечного диастолического объёма (КДО) ПЖ в диапазоне 150–170 мл/м2 рассматривают в качестве показания к замене клапана лёгочной артерии при бессимптомном течении [12, 17, 22] и их считают наиболее надёжным единственным предиктором необходимости операции.
Тем не менее существуют нерешённые вопросы, касающиеся определения оптимальных сроков замены клапана лёгочной артерии у пациентов после радикальной коррекции тетрады Фалло при отсутствии клинических симптомов. Кроме того, отсутствуют исследования, посвящённые оценке контрактильной и релаксационной функции миокарда обоих желудочков сердца у детей младшего возраста после операции по коррекции тетрады Фалло, с использованием МРТ в качестве инструмента для прогнозирования необходимости замены клапана лёгочной артерии.
ЦЕЛЬ
Оценить показатели деформации миокарда (Strain) в качестве критерия для обоснования необходимости замены клапана лёгочной артерии.
МЕТОДЫ
Дизайн исследования
Проведено одноцентровое ретроспективное (с анализом медицинской документации) одномоментное выборочное исследование.
Условия проведения
В исследование включали данные пациентов, проходивших лечение в отделениях кардиоторакальной хирургии и кардиологии Национального научного кардиохирургического центра в Астане (Казахстан). МРТ сердца выполняли после хирургической коррекции тетрады Фалло в период с декабря 2011 г. по июнь 2020 г.
Критерии соответствия
Критерии включения:
- дети в возрасте 3–18 лет после радикальной коррекции тетрады Фалло;
- наличие результатов МРТ сердца, лабораторного анализа крови [определение кардиомаркёра N-концевого пропептида мозгового натрийуретического гормона (NT-proBNP)] и эхокардиографии (ЭхоКГ) (градиент давления между ПЖ и лёгочной артерией).
Критерии исключения:
- высокая концентрация креатинина;
- пациенты старше 18 лет с тетрадой Фалло, не подвергавшейся коррекции.
Продолжительность исследования
Анализ данных проводили в период с октября 2011 г. по декабрь 2020 г.
Магнитно-резонансная томография сердца
MPТ сердца проводили на сверхпроводящем магнитнорезонансном томографе Magnetom Avanto® (Siemens Healthcare, Германия) с напряжённостью поля 1,5 Тл, в базовой комплектации. Сканирование осуществляли при обязательной проспективной синхронизации с электрокардиографией и дыханием с использованием гимпульсной последовательности Spin Echo для оценки анатомии. У грудных и детей до трёх лет исследование проводили натощак с использованием внутривенного наркоза по стандартной методике, принятой в Национальном научном кардиохирургическом центре, под наблюдением врача-анестезиолога. Срезы ориентировали в трёх стандартных плоскостях (поперечной аксиальной, сагиттальной и фронтальной), в плоскостях аналогичных 4- и 2-камерным проекциям в ЭхоКГ, а также в косых плоскостях в соответствии с зонами интереса, если того требовали задачи исследования.
Определение тяжести сердечной недостаточности
У пациентов определяли концентрацию NT-proBNP в крови с помощью иммуноферментного анализа или методов хемилюминесцентного иммуноанализа. Он является биомаркёром, используемым для диагностики и оценки тяжести сердечной недостаточности. Проводили ЭхоКГ с целью установления градиента давления между ПЖ и лёгочной артерией.
Основной исход исследования
Определение прогностической значимости показателей деформации миокарда при принятии решения о своевременной замене клапана лёгочной артерии.
Методы регистрации исхода исследования
Feature-tracking (Strain)1 выполняли с использованием программного обеспечения Segment CMR® (Lund, Швеция). Для анализа выбирали базальные, средние и апикальные короткоосевые срезы левого желудочка (ЛЖ) и ПЖ, а также 4-камерный срез. С помощью инструмента перемотки определяли моменты конечной диастолы и конечной систолы, после чего вручную обводили контуры эндокарда и эпикарда. Пиковую глобальную циркулярную деформацию ЛЖ и ПЖ рассчитывали как средневзвешенное значение (по количеству сегментов) пиковой циркулярной деформации базального, среднего и апикального отделов. Для оценки продольной деформации ЛЖ контуры эндокарда и эпикарда дополнительно строили на 2- и 4-камерных проекциях. Пиковую глобальную продольную деформацию ЛЖ и ПЖ определяли по 4-камерной проекции. Результаты экспортированы в документ Word, где записаны пиковые значения глобальной циркулярной и продольной деформации.
Анализ в группах
Поскольку пороговые значения КДО ПЖ от 150 до 170 мл/м2 рассматривают как показание к замене клапана лёгочной артерии у пациентов с бессимптомным течением заболевания [12, 17, 22], исследуемая выборка разделена на две группы в зависимости от его величины:
- 1-я группа — пациенты с КДО ПЖ <150 мл/м2;
- 2-я группа — с КДО ПЖ ≥150 мл/м2.
Этическая экспертиза
Исследование одобрено этическим комитетом Национального исследовательского кардиохирургического центра (разрешение № 01-92/2021 от 22.04.2021). Все пацинеты и их законные представители подписали добровольное информированное согласие на участие в исследовании до начала исследования.
Статистический анализ
Размер выборки предварительно не рассчитывали.
Статистический анализ выполняли с использованием пакета STATA® 16.2 (StataCorp, США). Для описания характеристик участников использовали описательную статистику. Большинство переменных были непрерывными, поэтому результаты представлены в виде M±SD, где M — среднее значение, а SD — стандартное отклонение. Категориальные переменные представлены в виде абсолютного числа наблюдений и их процентного соотношения. Для анализа непрерывных переменных между группами применяли t-критерий Стьюдента или U-критерий Манна–Уитни зависимости от выполнения условий параметрического теста. Для категориальной переменной «пол» использовали точный критерий Фишера, поскольку в таблице сопряжённости 2×2 для групп, разделённых в зависимости от КДО ПЖ, не выполнены условия применения критерия χ2. Критический уровень значимости при p=0,05.
РЕЗУЛЬТАТЫ
Характеристики выборки
В исследование включены 69 пациентов в возрасте от 3 до 18 лет (11±4 года), ранее перенёсших радикальную коррекцию тетрады Фалло. Среди участников 24 (35%) были девочки, а 45 (65%) — мальчики (табл. 1). В исследуемой выборке 52 пациента (75%) имели КДО ПЖ <150 мл/м2, и они составили 1-ю группу, тогда как 17 пациентов (25%) с КДО ПЖ ≥150 мл/м2 — 2-ю группу. Средние показатели КДО ПЖ статистически значимо различались в зависимости от пола: 116,8±26,9 и 137,2±20,9 мл/м2 у девочек и мальчиков соответственно (p=0,001).
Таблица 1. Характеристики выборки (n=69) | |
Характеристика | Значение |
Возраст, лет | 11±4 |
Градиент давление между правым желудочком и лёгочной артерией, мм рт. ст. | 19,7±13,7 |
Концентрация N-концевого пропептида мозгового натрийуретического гормона, пг/мл | 186±196,2 |
Конечный диастолический объём правого желудочка, мл/м2 | 130,1±24,9 |
Конечный диастолический объём правого желудочка <150 мл/м2, n (%) | 52 (75) |
Конечный диастолический объём правого желудочка ≥150 мл/м2, n (%) | 17 (25) |
Конечный систолический объём правого желудочка, мл/м2 | 68,5±60,3 |
Фракция выброса правого желудочка, % | 52,5±7,4 |
Конечный диастолический объём левого желудочка, мл/м2 | 72,9±14,5 |
Конечный систолический объём левого желудочка, мл/м2 | 28±8,3 |
Фракция выброса левого желудочка, % | 62,2±5,7 |
Примечание. Количественные данные представлены в виде M±SD, где M — среднее значение, а SD — стандартное отклонение. | |
Сравнение основных характеристик пациентов в зависимости от значения КДО ПЖ представлено в табл. 2. Несмотря на отсутствие статистически значимых различий в распределении по полу, во 2-й группе отмечена меньшая доля женщин (18%) по сравнению с мужчинами (82%). Конечный систолический объём (КСО) ПЖ в 1-й группе был примерно в два раза ниже в сравнении со 2-й группой, р <0,001 (см. табл. 2).
Таблица 2. Сравнительный анализ основных характеристик пациентов в группах в зависимотси от конечного диастолического объёма правого желудочка | |||
Характеристика | 1-я группа, n=52 | 2-я группа, n=17 | p |
Возраст, лет | 11±3 | 10±4 | 0,518 |
Пол (женский/мужской), n (%) | 21 (40)/31 (50) | 3 (18)/14 (82) | 0,075 |
Градиент давление между правым желудочком и лёгочной артерией, мм рт. ст. | 18,5±12,5 | 23,5±16,6 | 0,379 |
Концентрация N-концевого пропептида мозгового натрийуретического гормона, пг/мл | 174,1±195,2 | 222,7±200,7 | 0,201 |
Конечный систолический объём правого желудочка, мл/м2 | 56,9±19,1 | 103,9±111,9 | <0,001 |
Фракция выброса правого желудочка, % | 52,5±7,5 | 52,2±7,4 | 0,839 |
Конечный диастолический объём левого желудочка, мл/м2 | 72,1±16,1 | 75,3±7,7 | 0,129 |
Конечный систолический объём левого желудочка, мл/м2 | 27,9±8,9 | 28,1±5,9 | 0,626 |
Фракция выброса левого желудочка, % | 62,1±5,5 | 62,5±6,2 | 0,829 |
Примечание. Количественные данные представлены в виде M±SD, где M — среднее значение, а SD — стандартное отклонение. | |||
Концентрация NT-proBNP была несколько выше во 2-й группе, однако статистически значимых различий между группами не выявлено (см. табл. 2 и 3). Это может свидетельствовать о том, что увеличение объёма ПЖ у этих пациентов не сопровождается значимым повышением нагрузки на сердце либо концентрация этого биомаркёра варьирует в зависимости от индивидуальных особенностей пациентов. Пол и градиент давления между ПЖ и лёгочной артерией не имели статистически значимых различий. Фракции выброса ПЖ и ЛЖ оставались сохранными и не имели статистически значимых межгрупповых различий (см. табл. 2).
Таблица 3. Сравнение параметров деформации правого желудочка в группах в зависимости от его конечного диастолического объёма | |||
Область правого желудочка | 1-я группа, n=52 | 2-я группа, n=17 | p |
Глобальная циркулярная деформация, % | −17,1±3,8 | −16,9±3,9 | 0,728 |
Глобальная продольная деформация, % | −17,5±3,2 | −17,9±3,9 | 0,268 |
Циркулярная деформация, % | |||
Боковая стенка | −18,2±3,9 | −18,1±4,1 | 0,722 |
Перегородочная часть | −17,7±4,1 | −17,2±3,7 | 0,813 |
Продольная деформация, % | |||
Боковая стенка | −20,4±3,5 | −20,5±4,1 | 0,728 |
Перегородочная часть | −15,4±3,2 | −16,1±4,3 | 0,573 |
Примечание. Количественные данные представлены в виде M±SD, где M — среднее значение, а SD — стандартное отклонение. | |||
Основные результаты исследования
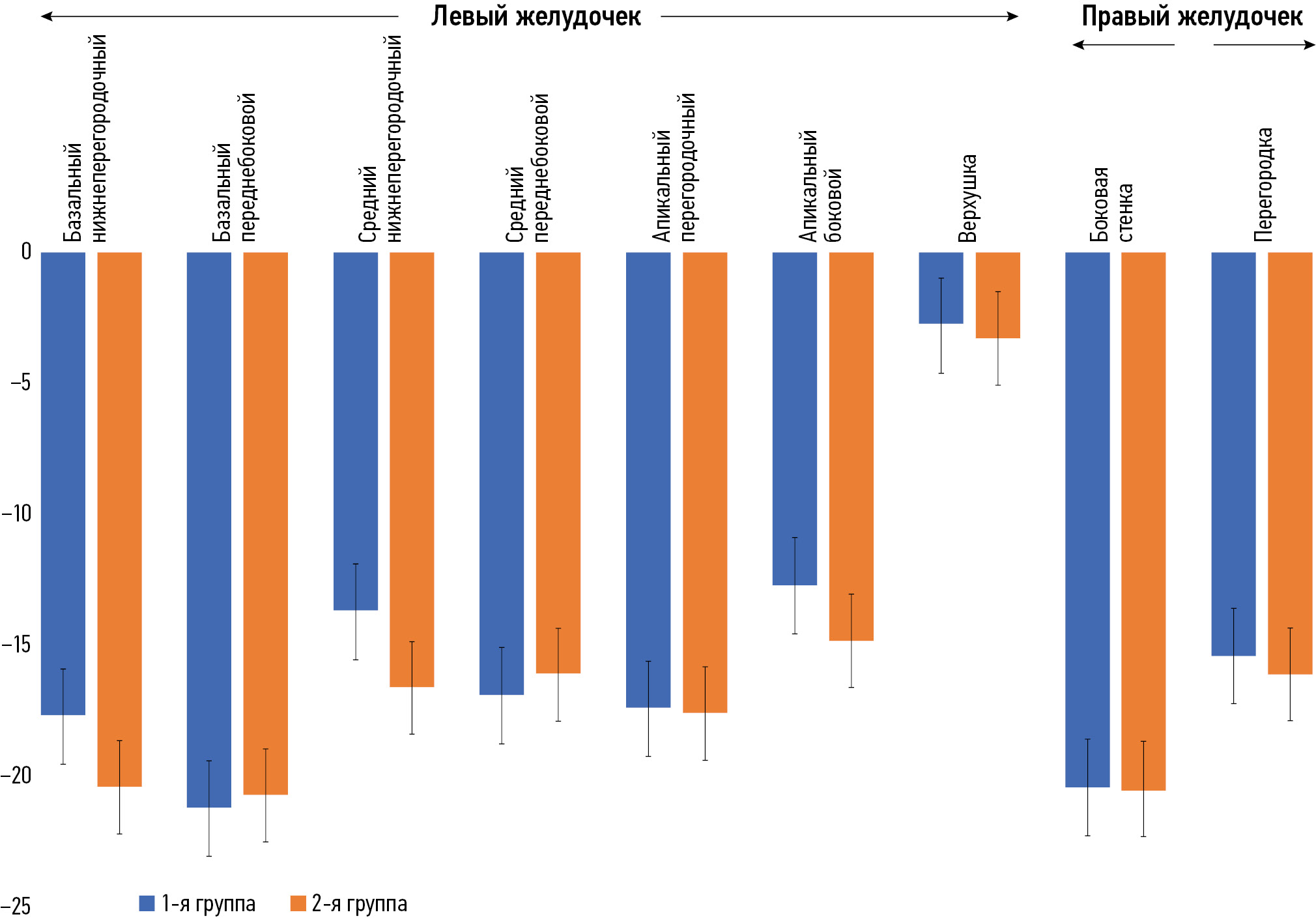
Сравнительная характеристика показателей деформации ЛЖ в группах в зависимости от КДО ПЖ представлена в табл. 4. Циркулярная деформация в базальном переднеперегородочном сегменте ЛЖ имела статистически значимые различия между группами (р=0,003). Кроме того, статистически значимые изменения зафиксированы в базальном нижнем сегменте ЛЖ (p=0,014).
Таблица 4. Сравнение показателей деформации левого желудочка в группах в зависимотси от конечного диастолического объёма правого желудочка | |||
Область левого желудочка | 1-я группа, n=52 | 2-я группа, n=17 | p |
Пиковая глобальная циркулярная деформация, % | −21,2±3,5 | −20,6±1,5 | 0,326 |
Глобальная продольная деформация, % | −14,1±3,5 | −14,9±3,7 | 0,531 |
Циркулярная деформация, % | |||
Базальные сегменты | |||
Передний | −24,2±7,7 | −25,1±4,8 | 0,411 |
Переднеперегородочный | −23,2±5,8 | −16,7±8,4 | 0,003 |
Нижнеперегородочный | −22,1±6,8 | −24,8±6,3 | 0,101 |
Нижний | −10,8±5,2 | −7,8±6,8 | 0,014 |
Нижнебоковой | −20,4±4,7 | −21,2±4,2 | 0,384 |
Переднебоковой | −23,6±5,8 | −23,8±2,9 | 0,733 |
Все базальные сегменты | −20,7±2,9 | −9,8±1,6 | 0,159 |
Средние сегменты | |||
Передний | −20,6±7,2 | −20,1±5,9 | 0,950 |
Переднеперегородочный | −26,6±5,4 | −23,5±6,2 | 0,144 |
Нижнеперегородочный | −24,6±5,4 | −23,5±5,1 | 0,671 |
Нижний | −8,7±5,4 | −6,6±4,3 | 0,139 |
Нижнебоковой | −22,1±5,3 | −22,3±3,9 | 0,734 |
Переднебоковой | −20,3±5,4 | −20,3±5,4 | 0,906 |
Все средние сегменты | −20,5±3,5 | −19,4±1,8 | 0,101 |
Апикальные сегменты | |||
Передний | −19,3±7,1 | −18,7±5,1 | 0,686 |
Перегородочный | −30,4±6,7 | −30,9±5,3 | 0,797 |
Нижний | −15,5±7,2 | −14,8±5,5 | 0,587 |
Боковой | −24,6±6,6 | −26,1±5,8 | 0,256 |
Все апикальные сегменты | −22,4±5,5 | −22,6±3,5 | 0,967 |
Продольная деформация, % | |||
Базальные сегменты | |||
Нижнеперегородочный | −17,7±8,1 | −20,4±9,8 | 0,407 |
Переднебоковой | −21,2±8,3 | −20,7±7,2 | 0,972 |
Средние сегменты | |||
Нижнеперегородочный | −13,7±8,1 | −16,6±9,2 | 0,268 |
Переднебоковой | −16,9±7,9 | −16,1±6,1 | 0,901 |
Апикальные сегменты | |||
Перегородочный | −17,4±8,1 | −17,6±4,8 | 0,873 |
Боковой | −12,7±5,5 | −14,8±6,2 | 0,228 |
Верхушка | −2,79±7,8 | −3,31±7,1 | 0,895 |
Примечание. Количественные данные представлены в виде M±SD, где M — среднее значение, а SD — стандартное отклонение. | |||
Существует общая тенденция, согласно которой абсолютные значения сегментарных циркулярных деформаций во 2-й группе выше, чем в 1-й группе (рис. 1). Однако циркулярная деформация миокарда в базальном нижнебоковом сегменте ЛЖ показывает обратное. Что касается сегментных продольных деформаций, то между группами нет определённой закономерности (рис. 2).
Рис. 1. Циркулярная деформация обоих желудочков.
Рис. 2. Продольная деформация обоих желудочков.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
У пациентов с КДО ПЖ ≥150 мл/м2 отмечали более высокие значения КСО ПЖ, а также выраженные изменения циркулярной деформации ЛЖ, что можно рассматривать как дополнительный критерий при принятии решения о выполнении операции по замене клапана лёгочной артерии. Полученные результаты подчёркивают клиническую значимость комплексной оценки как объёмных, так и деформационных параметров сердца при диагностике и выборе оптимальной тактики лечения.
Обсуждение основного результата исследования
A. Kempny и соавт. [23] использовали метод МРТ с анализом деформации миокарда для оценки его бивентрикулярной функции у 28 пациентов после хирургического лечения тетрады Фалло (средний возраст 40,4±13,3 года) в сравнении с группой из 25 здоровых людей. Полученные значения деформации сравнили с результатами ЭхоКГ с отслеживанием спеклов (Speckle Tracking Echocardiography) и определением границ эндокарда (Simple Endocardial Border Delineation). Авторы выявили статистически значимую прямую зависимость между показателями глобальной деформации ПЖ и ЛЖ.
Современные исследования подтверждают, что оценка параметров деформации миокарда, позволяет выявлять ранние признаки его повреждения до снижения фракции выброса [24, 25]. Кроме того, клиническая применимость Feature-tracking (Strain)1 продемонстрирована при различных сердечно-сосудистых заболеваниях [26–28]. Показано, что оценка напряжения миокарда ЛЖ с использованием данного метода является чувствительным предиктором его доклинической дисфункции [29, 30].
На показатели деформации миокарда влияют как пол, так и возраст, тем не менее значения циркулярной и продольной деформации от −17 до −20%, а также радиальной деформации более 25–30% считают соответствующими нормальному диапазону [31]. У пациентов с корригированной тетрадой Фалло улучшение показателей глобальной циркулярной и продольной деформации ЛЖ зарегистрировано в течение 6 мес. после транскатетерной имплантации пульмонального клапана [32]. Более того, глобальная продольная деформация ПЖ продемонстрировала связь с клинически значимыми параметрами, включая толерантность к физической нагрузке и потребление кислорода [23]. Эти результаты дополнительно подтверждены в крупном проспективном исследовании, включавшем 372 пациента с корригированной тетрадой Фалло, в котором глобальная циркулярная деформация ЛЖ и глобальная продольная деформация ПЖ независимо предсказывали летальные исходы, внезапную сердечную смерть или документированную желудочковую тахикардию [33, 34]. Кроме того, T.J. Moon и соавт. [35] в исследовании типа случай–контроль (n=16) показали, что продольная деформация как ПЖ, так и ЛЖ, а также циркулярная деформация являются предикторами желудочковой тахикардии и внезапной сердечной смерти. Подобные результаты получены у 15 пациентов после паллиативного вмешательства по Фонтену: показатели глобальной циркулярной и продольной деформации единственного желудочка коррелировали с функциональным классом NYHA и пиковым потреблением кислорода при кардиопульмональном нагрузочном тесте [36]. Замена клапана лёгочной артерии способствует улучшению функции миокарда у пациентов с тетрадой Фалло, в частности за счёт уменьшения объёмов ПЖ [15]. Однако существуют данные, свидетельствующие о том, что, несмотря на функциональное улучшение, показатели деформации ПЖ продолжают ухудшаться со временем по сравнению с пациентами, не подвергавшимися замене клапана лёгочной артерии [37].
У пациентов с тетрадой Фалло, у которых наблюдали неблагоприятные исходы, значения всех параметров деформации миокарда были статистически значимо ниже, чем у пациентов без таковых, при этом нарушение продольной деформации обоих желудочков демонстрировало наиболее тесную связь с неблагоприятными клиническими исходами [35].
Параметры деформации миокарда (Strain) отражают степень изменения формы сердечной мышцы в процессе её сокращения и расслабления. Они являются важным инструментом для детальной оценки функции сердца, позволяя выявлять субклинические нарушения миокарда, которые могут оставаться незаметными при стандартной оценке фракции выброса.
Различают следующие два вида деформации миокарда. Продольная деформация (Longitudinal Strain, LS): отражает укорочение мышечных волокон вдоль длинной оси сердца — от основания к верхушке. У здорового миокарда глобальная продольная деформация имеет отрицательные значения, что связано с физиологическим сокращением и уменьшением длины. Снижение продольной деформации является ранним маркёром дисфункции миокарда и его можно наблюдать при кардиомиопатиях и сердечной недостаточности. Положительные значения рассматривают как признак патологических изменений (например, дилатации). У пациентов с тетрадой Фалло повышенная нагрузка на ПЖ нередко приводит к нарушению его продольной функции, поэтому показатели продольной деформации могут отражать степень адаптационной перестройки миокарда. Циркулярная деформация (Circumferential Strain, CS): характеризует укорочение миокарда по окружности сердца. Показатель является ключевым для оценки сократительной функции ЛЖ в поперечном сечении и информативен при гипертрофии, фиброзе или других структурных изменениях. Положительные изменения циркулярной деформации могут свидетельствовать о компенсаторной гипертрофии при повышенной нагрузке. У пациентов с тетрадой Фалло данный параметр служить индикатором адаптации ПЖ к постнагрузке после хирургической коррекции [24].
Параметры деформации миокарда позволяют оценивать функциональное состояние не только ЛЖ, но и ПЖ, что особенно важно для пациентов с тетрадой Фалло, поскольку у них часто возникает необходимость в динамическом контроле за функцией ПЖ после коррекции дефекта [35].
Использование оценки деформации миокарда даёт возможность выявлять субклинические признаки дисфункции, которые могут предшествовать снижению фракции выброса и другим стандартным показателям. Это делает метод особенно ценным для ранней диагностики и своевременного планирования вмешательств [24]. Например, ухудшение продольной деформации ПЖ можно рассматривать в качестве раннего маркёра развивающейся правожелудочковой недостаточности ещё до появления симптомов [35].
Кроме того, оценка параметров деформации имеет практическое значение для определения показаний к повторным хирургическим вмешательствам, например к замене клапана лёгочной артерии. Прогрессирующее ухудшение параметров деформации можно рассматривать как предиктор необходимости коррекции, направленной на предотвращение дальнейшего прогрессирования сердечной недостаточности [35].
Оценка деформации с использованием Feature-tracking (Strain)1 обладает потенциалом повышения точности стратификации риска и прогнозирования сердечно-сосудистых событий у пациентов с системными заболеваниями ещё до появления клинически значимой сердечной дисфункции. Особенно ценным данный метод является в случаях, когда миокардиальная дисфункция субклиническая и остаётся недоступной для выявления традиционными методами визуализации. Следует учитывать, что пациенты с системными заболеваниями, в отличие от пациентов с установленной сердечно-сосудистой патологией, реже подвергаются регулярной кардиовизуализации, в то время как поражение сердца у них может приводить к тяжёлым неблагопритяным исходам. Именно поэтому значимость современных методов визуализации сердца может быть недооценена в этой группе пациентов [38].
Ограничения исследования
При планировании и проведении исследования размер выборки для достижения требуемой статистической мощности результатов не рассчитывали. В связи с этим полученная в исследовании выборка участников не может считаться в достаточной степени репрезентативной, что не позволяет экстраполировать полученные результаты и их интерпретацию на генеральную совокупность аналогичных пациентов за пределами исследования.
Отсутствие корреляционной связи между значениями КДО ПЖ и показателями его деформации может быть обусловлено недостаточным количеством анализируемых данных. Требуется дальнейшее исследование с бóльшим количеством пациентов.
ЗАКЛЮЧЕНИЕ
Проведённый анализ данных МРТ 69 пациентов показал статистически значимые различия показателей КДО ПЖ в зависимости от пола, а также между группами пациентов со значением менее и более 150 мл/м2. Кроме того, у пациентов с меньшим КДО ПЖ отмечали меньший КСО, что имеет потенциальное клиническое значение для оценки функции ПЖ.
В настоящем исследовании мы выявили статистически значимые изменения параметров деформации миокарда (Strain) у детей после коррекции тетрады Фалло в зависимости от величины КДО ПЖ. В частности, статистически значимые различия циркулярной деформации базальных сегментов ЛЖ указывают на влияние дилатации ПЖ на его сократительную функцию. Полученные результаты подчёркивают диагностическую ценность параметров деформации (Strain) и их потенциал в качестве дополнительного критерия при оценке показаний к замене клапана лёгочной артерии. Таким образом, включение анализа миокардиальной деформации на основе данных МРТ в клиническую практику может повысить точность принятия решений и оптимизировать тактику ведения пациентов после радикальной коррекции тетрады Фалло.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Вклад авторов. А.М. Кабдуллина — концепция и дизайн исследования, статистическая обработка данных, написание черновика рукописи, подготовка графических материалов; Р.И. Рахимжанова, Т.Б. Даутов, Ж.С. Абдрахманова — концепция и дизайн исследования; А.Б. Садуакасова — сбор и анализ данных, интерпретация результатов; В.Е. Синицин — редактирование окончательного варианта рукописи. Все авторы одобрили рукопись (версию для публикации), а также согласились нести ответственность за все аспекты работы, гарантируя надлежащее рассмотрение и решение вопросов, связанных с точностью и добросовестностью любой её части.
Благодарности. Авторы выражают благодарность руководителю Национального научного кардиохирургического центра, д.м.н., профессору Ю.В. Пя за предоставленную возможность выполнить данную работу.
Этическая экспертиза. Исследование одобрено этическим комитетом Национального исследовательского кардиохирургического центра (разрешение № 01-92/2021 от 22.04.2021). Все пацинеты и их законные представители подписали добровольное информированное согласие на участие в исследовании до начала исследования.
Источники финансирования. Отсутствуют.
Раскрытие интересов. Авторы заявляют об отсутствии отношений, деятельности и интересов за последние три года, связанных с третьими лицами (коммерческими и некоммерческими), интересы которых могут быть затронуты содержанием статьи.
Оригинальность. При создании настоящей работы авторы не использовали ранее опубликованные сведения.
Доступ к данным. Редакционная политика в отношении совместного использования данных к настоящей работе не применима.
Генеративный искусственный интеллект. При создании настоящей статьи технологии генеративного искусственного интеллекта не использовали.
Рассмотрение и рецензирование. Настоящая работа подана в журнал в инициативном порядке и рассмотрена по обычной процедуре. В рецензировании участвовали один внешний рецензент, два члена редакционной коллегии и научный редактор издания.
ADDITIONAL INFORMATION
Author contributions: A.M. Kabdullina, R.I. Rakhimzhanova, T.B. Dautov, Zh.S. Abdrakhmanova: conceptualization, methodology; A.M. Kabdullina: formal analysis, data curation, visualization, writing—original draft; A.B. Saduakassova: investigation, formal analysis; V.E. Sinitsyn: writing—review & editing. All the authors approved the final version of the manuscript for publication and agreed to be accountable for all aspects of the work, ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Acknowledgments: The authors express their gratitude to Professor Yuriy V. Pya, Dr. Sci. (Medicine), Head of the National Research Cardiac Surgery Center, for providing the opportunity to carry out this work.
Ethics approval: The study was approved by the Ethics Committee of the National Research Cardiac Surgery Center (approval No. 01-92/2021 dated April 22, 2021). All patients and their legal representatives provided written informed consent prior to participation in the study.
Funding sources: No funding.
Disclosure of interests: The authors have no relationships, activities, or interests for the last three years related to for-profit or not-for-profit third parties whose interests may be affected by the content of the article.
Statement of originality: No previously published material was used in this study or article.
Data availability statement: The editorial policy regarding data sharing does not apply to this work.
Generative AI: No generative artificial intelligence technologies were used to prepare this article.
Provenance and peer-review: This article was submitted unsolicited and reviewed following the standard procedure. The peer review process involved one external reviewer, two members of the Editorial Board, and the in-house science editor.
1 Feature-tracking (Strain) — метод анализа деформации миокарда с использованием стандартных изображений магнитно-резонансной томографии сердца.
About the authors
Azhar M. Kabdullina
Astana Medical University
Author for correspondence.
Email: azharazh@mail.ru
ORCID iD: 0000-0003-0521-5484
SPIN-code: 4169-1761
MD
Kazakhstan, AstanaValentin E. Sinitsyn
Lomonosov Moscow State University
Email: vsini@mail.ru
ORCID iD: 0000-0002-5649-2193
SPIN-code: 8449-6590
MD, Dr. Sci. (Medicine), Professor
Russian Federation, MoscowRaushan I. Rakhimzhanova
Astana Medical University
Email: rakhimzhanova01@rambler.ru
ORCID iD: 0000-0002-3490-6324
MD, Dr. Sci. (Med.), Professor
Kazakhstan, AstanaTairkhan B. Dautov
University Medical Center
Email: tairkhan.dautov@mail.ru
ORCID iD: 0000-0002-5267-0108
SPIN-code: 8632-6605
MD, Dr. Sci. (Medicine), Professor
Kazakhstan, AstanaZhanar S. Abdrakhmanova
Astana Medical University
Email: zhanna-ayan74@mail.ru
ORCID iD: 0000-0002-1890-0862
MD, Dr. Sci. (Medicine), Professor
Kazakhstan, AstanaAigul B. Saduakassova
Medical Center Hospital of the President’s Affairs Administration of the Republic of Kazakhstan
Email: sadik.a@mail.ru
ORCID iD: 0000-0001-7089-5696
MD, Dr. Sci. (Medicine)
Kazakhstan, AstanaReferences
- Siripornpitak S, Goo HW. CT and MRI for Repaired Complex Adult Congenital Heart Diseases. Korean Journal of Radiology. 2021;22(3):308–323. doi: 10.3348/kjr.2020.0895 EDN: JMYZCQ
- Hsu DT. Chronic Heart Failure in Congenital Heart Disease. In: Shaddy RE, Wernovsky G, editors. Pediatric Heart Failure. Boca Raton: CRC Press; 2005. P. 567–588. ISBN: 978-042-907-48-37 doi: 10.1201/b14181
- van der Ven JPG, van den Bosch E, Bogers AJCC, Helbing WA. Current Outcomes and Treatment of Tetralogy of Fallot. F1000Research. 2019;8:1530. doi: 10.12688/f1000research.17174.1 EDN: RJAMCE
- Karamlou T, McCrindle BW, Williams WG. Surgery Insight: Late Complications Following Repair of Tetralogy of Fallot and Related Surgical Strategies for Management. Nature Clinical Practice Cardiovascular Medicine. 2006;3(11):611–622. doi: 10.1038/ncpcardio0682
- Omelchenko AYu, Gorbatykh YuN, Soinov IA, et al. Hemodynamic Parameters and Right Ventricular Function After Radical Correction of Fallot’s Tetrad. Perm Medical Journal. 2016;33(3):6–17. doi: 10.17816/pmj3336-17 EDN: WCDFLB
- Bove T, Vandekerckhove K, Devos D, et al. Functional Analysis of the Anatomical Right Ventricular Components: Should Assessment of Right Ventricular Function After Repair of Tetralogy of Fallot be refined? European Journal of Cardio-Thoracic Surgery. 2013;45(2):e6–e12. doi: 10.1093/ejcts/ezt505
- Kim YY, Ruckdeschel E. Approach to Residual Pulmonary Valve Dysfunction in Adults With Repaired Tetralogy of Fallot. Heart. 2016;102(19):1520–1526. doi: 10.1136/heartjnl-2015-309067
- Singh GK, Greenberg SB, Yap YS, et al. Right Ventricular Function and Exercise Performance Late After Primary Repair of Tetralogy of Fallot With the Transannular Patch in Infancy. The American Journal of Cardiology. 1998;81(11):1378–1382. doi: 10.1016/S0002-9149(98)00171-4
- Schamberger MS, Hurwitz RA. Course of Right and Left Ventricular Function in Patients With Pulmonary Insufficiency After Repair of Tetralogy of Fallot. Pediatr Cardiol. 2000;21(3):244–248. doi: 10.1007/s002460010050
- Kondo C, Nakazawa M, Kusakabe K, Momma K. Left Ventricular Dysfunction on Exercise Long Term After Total Repair of Tetralogy of Fallot. Circulation. 1995;92(9):250–255. doi: 10.1161/01.CIR.92.9.250
- Alipour Symakani RS, van Genuchten WJ, Zandbergen LM, et al. The Right Ventricle in Tetralogy of Fallot: Adaptation to Sequential Loading. Frontiers in Pediatrics. 2023;11:1098248. doi: 10.3389/fped.2023.1098248 EDN: PSERJF
- Oosterhof T, van Straten A, Vliegen HW, et al. Preoperative Thresholds for Pulmonary Valve Replacement in Patients With Corrected Tetralogy of Fallot Using Cardiovascular Magnetic Resonance. Circulation. 2007;116(5):545–551. doi: 10.1161/CIRCULATIONAHA.106.659664
- Lee C, Kim YM, Lee CH, et al. Outcomes of Pulmonary Valve Replacement in 170 Patients With Chronic Pulmonary Regurgitation After Relief of Right Ventricular Outflow Tract Obstruction. Journal of the American College of Cardiology. 2012;60(11):1005–1014. doi: 10.1016/j.jacc.2012.03.077
- Villafañe J, Feinstein JA, Jenkins KJ, et al. Hot Topics in Tetralogy of Fallot. Journal of the American College of Cardiology. 2013;62(23):2155–2166. doi: 10.1016/j.jacc.2013.07.100
- Holmes KW. Timing of Pulmonary Valve Replacement in Tetralogy of Fallot Using Cardiac Magnetic Resonance Imaging. Journal of the American College of Cardiology. 2012;60(11):1015–1017. doi: 10.1016/j.jacc.2012.05.026
- Balzer D. Pulmonary Valve Replacement for Tetralogy of Fallot. Methodist DeBakey Cardiovascular Journal. 2019;15(2):122–132. doi: 10.14797/mdcj-15-2-122
- Toro KD, Soriano BD, Buddhe S. Right Ventricular Global Longitudinal Strain in Repaired Tetralogy of Fallot. Echocardiography. 2016;33(10):1557–1562. doi: 10.1111/echo.13302
- Murphy JG, Gersh BJ, Mair DD, et al. Long-Term Outcome in Patients Undergoing Surgical Repair of Tetralogy of Fallot. New England Journal of Medicine. 1993;329(9):593–599. doi: 10.1056/NEJM199308263290901
- Kilner PJ, Geva T, Kaemmerer H, et al. Recommendations for Cardiovascular Magnetic Resonance in Adults With Congenital Heart Disease From the Respective Working Groups of the European Society of Cardiology. European Heart Journal. 2010;31(7):794–805. doi: 10.1093/eurheartj/ehp586
- Wald RM, Haber I, Wald R, et al. Effects of Regional Dysfunction and Late Gadolinium Enhancement on Global Right Ventricular Function and Exercise Capacity in Patients With Repaired Tetralogy of Fallot. Circulation. 2009;119(10):1370–1377. doi: 10.1161/CIRCULATIONAHA.108.816546
- Fratz S, Chung T, Greil GF, et al. Guidelines and Protocols for Cardiovascular Magnetic Resonance in Children and Adults With Congenital Heart Disease: SCMR Expert Consensus Group on Congenital Heart Disease. Journal of Cardiovascular Magnetic Resonance. 2013;15(1):51. doi: 10.1186/1532-429x-15-51 EDN: QGIITW
- Alvarez-Fuente M, Garrido-Lestache E, Fernandez-Pineda L, et al. Timing of Pulmonary Valve Replacement: How Much Can the Right Ventricle Dilate Before it Looses Its Remodeling Potential? Pediatric Cardiology. 2015;37(3):601–605. doi: 10.1007/s00246-015-1320-4 EDN: DKVMWI
- Kempny A, Fernández-Jiménez R, Orwat S, et al. Quantification of Biventricular Myocardial Function Using Cardiac Magnetic Resonance Feature Tracking, Endocardial Border Delineation and Echocardiographic Speckle Tracking in Patients With Repaired Tetralogy of Fallot and Healthy Controls. Journal of Cardiovascular Magnetic Resonance. 2012;14(1):25. doi: 10.1186/1532-429X-14-32 EDN: UPVGOB
- Smiseth OA, Torp H, Opdahl A, et al. Myocardial Strain Imaging: How Useful is it in Clinical Decision Making? European Heart Journal. 2015;37(15):1196–1207. doi: 10.1093/eurheartj/ehv529
- Li VW, Yu CK, So EK, et al. Ventricular Myocardial Deformation Imaging of Patients with Repaired Tetralogy of Fallot. Journal of the American Society of Echocardiography. 2020;33(7):788–801. doi: 10.1016/j.echo.2020.03.017 EDN: VIEMFR
- Buss SJ, Breuninger K, Lehrke S, et al. Assessment of Myocardial Deformation With Cardiac Magnetic Resonance Strain Imaging Improves Risk Stratification in Patients With Dilated Cardiomyopathy. European Heart Journal — Cardiovascular Imaging. 2014;16(3):307–315. doi: 10.1093/ehjci/jeu181
- Padiyath A, Gribben P, Abraham JR, et al. Echocardiography and Cardiac Magnetic Resonance-Based Feature Tracking in the Assessment of Myocardial Mechanics in Tetralogy of Fallot: An Intermodality Comparison. Echocardiography. 2012;30(2):203–210. doi: 10.1111/echo.12016
- Schuster A, Paul M, Bettencourt N, et al. Cardiovascular Magnetic Resonance Myocardial Feature Tracking for Quantitative Viability Assessment in Ischemic Cardiomyopathy. International Journal of Cardiology. 2013;166(2):413–420. doi: 10.1016/j.ijcard.2011.10.137
- Jafari F, Safaei AM, Hosseini L, et al. The Role of Cardiac Magnetic Resonance Imaging in the Detection and Monitoring of Cardiotoxicity in Patients With Breast Cancer After Treatment: A Comprehensive Review. Heart Failure Reviews. 2020;26(3):679–697. doi: 10.1007/s10741-020-10028-y EDN: ZZGCYR
- Rezaeian N, Mohtasham MA, Khaleel AJ, et al. Comparison of Global Strain Values of Myocardium in Beta-Thalassemia Major Patients With Iron Load Using Specific Feature Tracking in Cardiac Magnetic Resonance Imaging. The International Journal of Cardiovascular Imaging. 2020;36(7):1343–1349. doi: 10.1007/s10554-020-01835-3 EDN: RILEMT
- Muser D, Castro SA, Santangeli P, Nucifora G. Clinical applications of feature-tracking cardiac magnetic resonance imaging. World Journal of Cardiology. 2018;10(11):210–221. doi: 10.4330/wjc.v10.i11.210
- Harrild DM, Marcus E, Hasan B, et al. Impact of Transcatheter Pulmonary Valve Replacement on Biventricular Strain and Synchrony Assessed by Cardiac Magnetic Resonance Feature Tracking. Circulation: Cardiovascular Interventions. 2013;6(6):680–687. doi: 10.1161/CIRCINTERVENTIONS.113.000690
- Orwat S, Diller GP, Kempny A, et al; for the German Competence Network for Congenital Heart Defects Investigators. Myocardial Deformation Parameters Predict Outcome in Patients With Repaired Tetralogy of Fallot. Heart. 2015;102(3):209–215. doi: 10.1136/heartjnl-2015-308569
- Hagdorn QAJ, Vos JDL, Beurskens NEG, et al. CMR Feature Tracking Left Ventricular Strain-Rate Predicts Ventricular Tachyarrhythmia, but not Deterioration of Ventricular Function in Patients With Repaired Tetralogy of Fallot. International Journal of Cardiology. 2019;295:1–6. doi: 10.1016/j.ijcard.2019.07.097
- Moon TJ, Choueiter N, Geva T, et al. Relation of Biventricular Strain and Dyssynchrony in Repaired Tetralogy of Fallot Measured by Cardiac Magnetic Resonance to Death and Sustained Ventricular Tachycardia. The American Journal of Cardiology. 2015;115(5):676–680. doi: 10.1016/j.amjcard.2014.12.024
- Kutty S, Rangamani S, Venkataraman J, et al. Reduced Global Longitudinal And Radial Strain With Normal Left Ventricular Ejection Fraction Late After Effective Repair of Aortic Coarctation - a CMR Feature Tracking Study. Journal of Cardiovascular Magnetic Resonance. 2012;14(S1):О59. doi: 10.1186/1532-429X-14-S1-O59
- Monti CB, Secchi F, Capra D, et al. Right Ventricular Strain in Repaired Tetralogy of Fallot With Regards to Pulmonary Valve Replacement. European Journal of Radiology. 2020;131:109235. doi: 10.1016/j.ejrad.2020.109235 EDN: HICZNU
- Pezeshki PS, Ghorashi SM, Houshmand G, et al. Feature Tracking Cardiac Magnetic Resonance Imaging to Assess Cardiac Manifestations of Systemic Diseases. Heart Failure Reviews. 2023;28(5):1189–1199. doi: 10.1007/s10741-023-10321-6 EDN: ZGNHLM