Diagnosis of thoracic aortic aneurysms and pathological pulmonary trunk dilation using chest computed tomography and artificial intelligence: modern approaches and prospects (a review)
- Authors: Solovev A.V.1,2, Sinitsyn V.E.1,3, Vladzymyrskyy A.V.1, Pamova A.P.1
-
Affiliations:
- Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
- Morozov Children's Municipal Clinical Hospital
- Lomonosov Moscow State University
- Issue: Vol 6, No 2 (2025)
- Pages: 286-301
- Section: Reviews
- Submitted: 07.11.2024
- Accepted: 20.02.2025
- Published: 08.07.2025
- URL: https://jdigitaldiagnostics.com/DD/article/view/641679
- DOI: https://doi.org/10.17816/DD641679
- EDN: https://elibrary.ru/QHBRWF
- ID: 641679
Cite item
Full Text
Abstract
Early diagnosis of thoracic aortic aneurysms and pathological pulmonary trunk dilation is crucial to prevent severe complications, including vascular wall rupture and acute right ventricular failure, and reduce cardiovascular mortality. This review examines contemporary imaging approaches for these conditions, focusing on computed tomography as the gold standard modality. Emphasis was placed on the implementation of artificial intelligence technologies, which enable automatic segmentation of vascular structures, measurement of their diameter, and opportunistic screening, allowing early detection of asymptomatic conditions without additional diagnostic procedures, thereby reducing radiologist workload and improving medical care quality. The study comprehensively analyzed the Moscow Experiment, wherein the application of artificial intelligence in medical image analysis showed high sensitivity, reproducibility, and reduced reporting time. Despite these significant advantages, the need for expert supervision of artificial intelligence-generated results to ensure diagnostic accuracy and reliability is emphasized. Moreover, the review highlights the importance of adapting algorithms to different scanning protocols and population-specific features. Additionally, the importance of interdisciplinary collaboration among cardiologists, radiologists, data scientists, and software developers for the effective integration into routine clinical practice is pointed out. Therefore, the review outlines the potential of artificial intelligence technologies to enhance diagnostic quality and underscores the need for further clinical research and standardization of methods for successful integration into daily practice.
Full Text
ВВЕДЕНИЕ
Согласно данным Всемирной организации здравоохранения, сердечно-сосудистые заболевания (ССЗ) и обусловленные ими осложнения являются одной из ведущих причин смерти в мире1. Ежегодно на их долю приходится 17,9 млн случаев смерти [1].
Эти заболевания представляют значительную социальную проблему в сфере здравоохранения и остаются актуальными в современном обществе. ССЗ связаны с высокими экономическими затратами, потерей трудоспособности населения и повышенным риском летального исхода для пациентов [2]. Среди ССЗ существенное значение имеют патологии аорты и лёгочной артерии. Смертность, обусловленная данными заболеваниями, неуклонно возрастает. Согласно прогнозу, к 2030 году ожидают увеличение данного показателя на 42%. В свою очередь, среди болезней сосудов важную роль играют аневризмы аорты и лёгочная гипертензия [3].
Аневризмы характеризуются локальным патологическим расширением просвета аорты, превышающим её нормальный диаметр в 1,5 раза [4]. В качестве диагностических критериев также используют абсолютные пороговые значения: диаметр для восходящего отдела грудной аорты — ≥50 мм, для нисходящего отдела аорты — ≥40 мм [5]. Нередко они протекают бессимптомно и их выявляют случайно при проведении инструментальной визуализации. Из-за внезапности осложнений и высокой летальности при их разрыве аневризмы называют «тихими убийцами» [4].
Их диагностику часто осуществляют только на поздних стадиях, когда аневризма достигает критических размеров и возникают осложнения, такие как расслоение аорты или разрыв её стенки. Научные исследования показывают, что осложнения, вызванные аневризмами аорты, имеют очень тяжёлые последствия и приводят к летальному исходу в 94–100% случаев при отсутствии лечения, требующего значительных ресурсов со стороны здравоохранения [6, 7].
Кроме того, играют важную роль и представляют значимую проблему для здравоохранения заболевания, приводящие к развитию лёгочной гипертензии. Она сопровождается патологическим расширением ствола лёгочной артерии и её ветвей, может быть обусловлена различными заболеваниями, такими как первичная лёгочная гипертензия, хроническая постэмболическая лёгочная гипертензия, хронические болезни лёгких и сердечная недостаточность [8]. При отсутствии своевременной диагностики и лечения лёгочная гипертензия неизбежно прогрессирует, что приводит к развитию правожелудочковой недостаточности и повышает риск летального исхода. Смерть наступает из-за таких осложнений, как тромбоэмболия, острая сердечная недостаточность и аритмии [9, 10].
Своевременное выявление аневризм грудного отдела аорты и патологического расширения лёгочного ствола является чрезвычайно важным этапом, обеспечивающим проведение полноценной диагностики и выбор оптимального лечения, что положительно сказывается на клиническом прогнозе. Это позволяет осуществить необходимое лечение до того, как заболевание достигнет критической стадии, что существенно снижает риск тяжёлых осложнений и летального исхода. Внедрение современных методов ранней диагностики болезней аорты и лёгочной артерии, таких как компьютерная томография (КТ) с автоматическим анализом изображений с помощью технологий искусственного интеллекта (ИИ) в рамках оппортунистического скрининга, открывает новые перспективы для последующего применения специализированных методов диагностики, в частности компьютерно-томографической ангиографии (КТ-ангиография), и лечения.
МЕТОДОЛОГИЯ ПОИСКА ДАННЫХ
Для проведения научного обзора отобраны статьи из поисковых систем PubMed и Google Scholar, а также базы данных Scopus, опубликованные в период с 1983 по 2024 год на русском и английском языках. Поиск проводили с использованием следующих ключевых слов: «aneurysm of the thoracic aorta», «pulmonary artery dilatation», «computed tomography», «artificial intelligence in radiology» и «early diagnosis of cardiovascular diseases». Рассматривали оригинальные исследования, обзоры и метаанализы, связанные с диагностикой аневризм грудного отдела аорты и патологического расширения лёгочного ствола с использованием КТ и технологий ИИ. Исключали статьи, опубликованные в нерецензируемых журналах, а также работы, описывающие исследования с участием животных. Общее количество найденных источников составило 538, из которых в окончательный обзор вошла 121 публикация.
АНЕВРИЗМА АОРТЫ
Согласно статистическим данным, в период с 1990 по 2019 год уровень смертности от аневризм аорты во всём мире увеличился на 81,6% — с 94 968 до 172 427 случаев. Заболевание преимущественно поражает мужчин [11–13]. В России распространённость аневризмы восходящего отдела грудной аорты варьирует от 0,16 до 1,06% случаев [14]. Так, анализ данных аутопсий в Городской клинической больнице № 15 имени О.М. Филатова за 1991–2001 гг. показал, что аневризму грудного отдела аорты выявили в 0,8% случаев [15]. В 2020 году в Соединённых Штатах Америки (США) более 6 тыс. чел. умерли от аневризмы аорты [16]. В свою очередь, заболеваемость аневризмами грудной аорты составляет примерно 10 случаев на 100 тыс. чел. в год, при этом частота её разрыва — около 1,6 случая на 100 тыс. чел. [17]. Среди осложнений этого заболевания различают расслоение и разрыв аорты — 3,7 и 3,6% соответственно [18]. В Гонконге (Китай) среди пациентов с артериальной гипертензией аневризму грудной аорты диагностируют в 7,5% случаев [19]. Ежегодно в этом крупном городе регистрируют более 1900 госпитализаций и около 350 летальных исходов, связанных с аневризмой и расслоением аорты. При этом отмечают устойчивую тенденцию к росту заболеваемости [20].
Региональные различия подчёркивают необходимость глобального анализа, поскольку данные из других стран свидетельствуют о значимости аневризмы грудной аорты как медико-социальной проблемы во всём мире. Так, в Канаде наблюдали увеличение распространённости заболевания с 3,5 до 7,6 на 100 тыс. чел. в период с 2002 по 2014 год [21]. В странах Западной Европы аневризма грудной аорты занимает второе место по распространённости среди заболеваний аорты после атеросклероза [5, 22]. В Южной Корее данную патологию диагностируют у 36,5% мужчин с артериальной гипертензией [23]. В Японии аневризму грудной аорты выявили у 6,5% обследованных [24]. В Иране частота аневризм с диаметром более 45 мм составляет 1,2% [25].
Вариабельность статистических данных по аневризме аорты может быть связана с применением различных методов диагностики, таких как КТ, ультразвуковое исследование, магнитно-резонансная томография (МРТ), отличающихся по точности и чувствительности, а также с различиями в протоколах исследования и стандартах отчётности, применяемых в разных странах. Кроме того, на размер аорты влияет раса пациента и его этническая принадлежность [26].
Значение раннего выявления аневризм грудной аорты
У пациентов с аневризмой грудной аорты часто встречают другие ССЗ и сопутствующие патологии. Её раннее выявление позволяет оптимизировать ведение этих пациентов и выполнять своевременное хирургическое лечение. Плановая операция при аневризме грудной аорты значительно повышает шансы пациентов на выживаемость и даёт возможность достичь ожидаемой продолжительности жизни, сопоставимой с таковой у здоровых людей того же возраста. Пятилетняя выживаемость после планового оперативного вмешательства при аневризме аорты составляет около 85%, тогда как при экстренных операциях она снижается до 37% [20, 27]. В норме максимальный диаметр грудной аорты составляет до 40 мм для восходящего отдела и её дуги, а также до 30 мм для нисходящего отдела. Хирургическое вмешательство при аневризме восходящей аорты показано пациентам с диаметром ≥50 мм, страдающим от синдрома Марфана (при наличии дополнительных факторов риска этот показатель снижен до ≥45 мм). В других случаях пороговый диаметр составляет ≥55 мм. Аналогичные рекомендации действуют в отношении аневризмы дуги и нисходящей аорты (≥55 мм) [5]. Кроме того, при диаметре грудной аорты, превышающем 6 см, риск опасных для жизни осложнений становится практически неизбежным. При этом скорость роста её аневризмы может составлять 0,1–0,3 см в год [28].
Среди основных методов диагностики аневризмы грудной аорты выделяют следующие (табл. 1):
- обзорная рентгенография грудной полости [29, 30];
- трансторакальная эхокардиография [31–42];
- чреспищеводная эхокардиография [34, 37, 42];
- КТ [3, 16, 33, 43–53];
- МРТ [3, 54–62];
- позитронно-эмиссионная томография [63–67];
- прямая аортография [5, 59, 68–71].
Таблица 1. Методы диагностики аневризм грудной аорты
Преимущества | Ограничения | Визуализация |
Обзорная рентгенография грудной полости | ||
· простота выполнения; · доступность | · низкая специфичность; · обнаружение аневризм в 30–40% случаев; · ограниченные данные о размерах и форме аорты | · аномалии контуров и размеров аорты; · расширение тени средостения; · смещение трахеи |
Трансторакальная эхокардиография | ||
· неинвазивный метод; · отсутствие лучевой нагрузки; · доступность и низкая стоимость; · визуализация в реальном времени | · зависимость от навыков оператора; · ограниченная визуализация частей аорты (дуга и нисходящий отдел); · чувствительность — 55–60%; · трудности визуализации при ожирении или деформации грудной клетки | · стенки и просвет аорты; · восходящая аорта; · корень аорты; · частично дуга аорты |
Чреспищеводная эхокардиография | ||
· полуинвазивный метод; · более точная визуализация корня и дуги аорты; · преимущество у пациентов с ограничениями для трансторакальной эхокардиографии | · зависимость от навыков оператора; · возможна недооценка размеров аорты; · полуинвазивность может быть менее комфортной для пациента; · риск повреждения пищевода | · стенки и просвет аорты; · корень аорты; · дуга аорты; · восходящая аорта |
Компьютерная томография | ||
· высокое пространственное разрешение; · высокая скорость; · возможность построения трёхмерных реконструкций; · «золотой стандарт» диагностики аневризм аорты | · ионизирующее излучение; · риск нарушения функции почек при использовании контрастного вещества; · аллергические реакции на контрастное вещество; · вероятность артефактов от движений или металлических имплантов | · детализированная оценка диаметра, стенок и просвета аорты; · размеры и расположение аневризмы; · оценка окружающих структур; · выявление осложнений (расслоение, тромбоз) |
Магнитно-резонансная томография | ||
· отсутствие ионизирующего излучения; · высокое мягкотканное разрешение; · возможность построения трёхмерных реконструкций; · без контрастных препаратов | · более длительное время выполнения; · ограничения при наличии металлических имплантов; · меньшая доступность по сравнению с компьютерной томографией | · детализированная структура стенок и просвета аорты; · выявление интрамуральных гематом, тромбов; · детальная оценка анатомии аорты и её взаимоотношений с окружающими структурами |
Позитронно-эмиссионная томография | ||
· выявление воспалительных процессов и инфекций стенок аорты; · возможность комбинирования с компьютерной томографией для улучшенной диагностики | · высокая стоимость; · ограниченное применение в рутинной практике; · невысокое пространственное разрешение | · метаболическая активность в стенках аорты; · выявление воспалений, инфекции или злокачественных процессов |
Прямая аортография | ||
· точные изображения просвета аорты; · оценка функциональных характеристик клапанов и левого желудочка; · возможность проведения лечебных эндоваскулярных манипуляций | · инвазивный метод с риском осложнений; · не видны стенки аорты | · оценка просвета и диаметра аорты; · функциональное состояние аортального клапана и левого желудочка |
Предикторы риска развития острых аортальных событий
Установлено, что диаметр аорты зависит от возраста, пола, массы тела и роста, с наибольшей корреляцией с возрастом. Наблюдают увеличение диаметра с возрастом на всех уровнях грудной аорты, поэтому его нужно учитывать при определении нормального значения. Пол влияет только на диаметр нисходящей аорты, при этом средняя разница составляет 1,99 мм, что не рассматривают как клинически значимую. Индекс массы тела также значим на большинстве уровней аорты: на каждую его единицу приходится среднее увеличение диаметра на 0,27 мм. Это требует корректировки с учётом индивидуальных антропометрических характеристик [72].
Для более точной диагностики расширения аорты и выявления риска развития аневризм предложили использовать индекс размера аорты (Aortic Size Index, ASI), учитывающий её диаметр и площадь поверхности тела (Body Surface Area, BSA). Он продемонстрировал более высокую прогностическую ценность в отношении неблагоприятных событий по сравнению с максимальным диаметром аорты. В 2006 году R.R. Davies и соавт. [73] предложили использовать индекс размера аорты для нормализации её диаметра по площади поверхности тела. Согласно данным, пациентов с индексом размера аорты <2,75 см/м2 классифицировали как имеющие низкий риск развития осложнений, тогда как его значения, превышающие 4,25 см/м2, указывали на необходимость хирургического вмешательства. Однако метод имеет ограничения, поскольку площадь поверхности тела и его масса меняются с возрастом и не всегда отражают физиологию аорты. Именно поэтому нужны более надёжные показатели для оценки степени её расширения [74].
Соотношение площади поперечного сечения аорты к её высоте предложили использовать для оценки риска острых аортальных событий у пациентов с генетическими заболеваниями аорты, но этот параметр имеет ограничения. Исследования показали, что пациенты с низким индексом имели сниженную долгосрочную выживаемость, однако при использовании общей смертности вместо острых аортальных событий его прогностическая значимость не доказана. В связи с этим он не получил широкого применения [74].
Кроме того, для оценки риска острых аортальных событий важно учитывать длину восходящей аорты. Установлено, что длина аорты увеличивается с возрастом независимо от площади поверхности тела, при этом возрастает её извитость, которую можно оценить с помощью индекса извитости аорты [74].
Комбинированная оценка диаметра и длины аорты с расчётом её объёма демонстрирует более высокую чувствительность в прогнозировании острых аортальных событий по сравнению с использованием только одного параметра. Волюметрический анализ аорты — количественный метод оценки, обладающий высокой информативностью на этапах предоперационной подготовки и послеоперационного наблюдения. Данный параметр позволяет выявлять значимые изменения, которые можно пропустить при традиционной оценке аорты по диаметру. Исследования показали, что увеличение её объёма является чувствительным предиктором осложнений после эндоваскулярных вмешательств на ней. Именно поэтому его анализ может стать важным инструментом для мониторинга состояния аорты и прогнозирования, однако подтверждение ценности требует дальнейших исследований [74].
Таким образом, важными показателями для оценки риска острых аортальных событий являются диаметр, длина и объём аорты, которые учитывают конституциональные особенности пациента. Комбинированные методы измерения, такие как волюметрия, обеспечивают более высокую чувствительность и точность в прогнозировании рисков и мониторинге состояния аорты, что способствует своевременной диагностике и лечению [74].
ПАТОЛОГИЧЕСКОЕ РАСШИРЕНИЕ ЛЁГОЧНОГО СТВОЛА
Лёгочная гипертензия затрагивает около 1% мирового населения, при этом её распространённость достигает 10% у лиц старше 65 лет. В числе основных причин развития лёгочной гипертензии — заболевания сердца и лёгких [75]. В Великобритании частота лёгочной гипертензии составляет 97 случаев на 1 млн населения, в свою очередь, мужчины страдают в 8 раз чаще, чем женщины. В США смертность от данной патологии варьирует от 4,5 до 12,3 случаев на 100 тыс. чел. Наиболее распространёнными причинами лёгочной гипертензии являются заболевания, поражающие левые отделы сердца, а также патологические процессы лёгких, сопровождающиеся гипоксией [9]. В Западной Австралии зарегистрировали 326 случаев лёгочной гипертензии на 100 тыс. населения, из которых 250 связаны с болезнями левых отделов сердца, а 37 — с заболеваниями лёгких [76].
В России распространённость лёгочной артериальной гипертензии составляет 15–60 случаев на 1 млн чел., при этом заболеваемость достигает 10 случаев на 1 млн чел. [11, 77]. По данным А.Ф. Алиева и соавт. [78], у 189 из 511 пациентов с COVID-19 выявлено расширение лёгочного ствола (≥29 мм). В исследовании с участием 7 164 пациентов с хронической обструктивной болезнью лёгких распространённость лёгочной гипертензии среди лиц с респираторными симптомами составила 21,8%, тогда как в общей выборке — 15,3% [79, 80].
Методы раннего выявления лёгочной гипертензии
Для диагностики лёгочной гипертензии важна совместная работа мультидисциплинарной команды специалистов, включая кардиологов, рентгенологов и пульмонологов [9].
При ранних стадиях лёгочной гипертензии симптомы могут быть минимальными и появляться только при физической нагрузке, что затрудняет раннюю диагностику. Одышку и утомляемость возможно ошибочно принять за признаки других менее серьёзных состояний. По мере прогрессирования заболевания клинические проявления становятся более выраженными [9].
Лёгочная гипертензия — одна из основных причин дилатации лёгочного ствола. С увеличением применения методов неинвазивной визуализации возрастает вероятность случайного обнаружения расширения лёгочной артерии. Раннее выявление лёгочной гипертензии имеет важное значение для начала специфического лечения и улучшения прогноза пациентов. Тем не менее растущая осведомлённость о лёгочной гипертензии не всегда сопровождается своевременной диагностикой, что обусловлено сходством симптомов с проявлениями других, более распространённых респираторных или сердечно-сосудистых заболеваний [81–84].
Среди методов диагностики расширения лёгочного ствола как признака лёгочной гипертензии выделяют следующие (табл. 2):
- эхокардиография [9, 35, 36, 85];
- рентгенография грудной клетки [9, 85, 86];
- КТ [9, 85–88];
- МРТ [9, 85, 86];
- катетеризация правых отделов сердца [9, 86].
Таблица 2. Методы диагностики расширения лёгочного ствола
Преимущества | Ограничения | Визуализация |
Эхокардиография (трансторакальная эхокардиография) | ||
· неинвазивный метод; · оценка систолического давления в лёгочной артерии; · визуализация структур и оценка функции сердца; · безопасность и доступность | · зависимость от навыков оператора | · максимальная скорость трикуспидальной регургитации; · размеры камер сердца; · гипертрофия миокарда правого желудочка; · дефекты межпредсердной перегородки и другие врождённые пороки; · аномальный лёгочный венозный возврат; · диастолическая функция желудочков |
Рентгенография грудной клетки | ||
· доступность и простота выполнения; · возможность выявления кардиомегалии и расширения лёгочных артерий; · оценка возможных причин лёгочной гипертензии (например, интерстициальные болезни лёгких) | · низкая специфичность; · ограниченная точность; · может не показать наличие лёгочной гипертензии на ранних стадиях | · кардиомегалия (увеличение правых отделов сердца); · расширение центральных лёгочных артерий |
Компьютерная томография | ||
· высокое пространственное разрешение; · высокая скорость; · возможность построения трёхмерных реконструкций | · ионизирующее облучение; · необходимость введения контрастного вещества | · оценка лёгочной сосудистой системы и паренхимы лёгких; · тромбы, утолщение стенок сосудов; · гипертрофия и дилатация правого желудочка |
Магнитно-резонансная томография | ||
· отсутствие ионизирующего излучения; · высокое мягкотканное разрешение; · точная оценка объёма и массы правого желудочка; · фазово-контрастная магнитно-резонансная томография для оценки кровотока в лёгочной артерии | · меньшая доступность по сравнению с компьютерной томографией; · длительное время выполнения; · противопоказания у части пациентов | · структурные и функциональные изменения правого желудочка; · гипертрофия и дилатация правого желудочка; · скорость кровотока в лёгочных артериях; · аномалии сосудов (тромбы, изменения стенок) |
Катетеризация правых отделов сердца | ||
· «золотой стандарт» диагностики лёгочной гипертензии; · прямая оценка давления в лёгочной артерии и правом желудочке; · оценка лёгочного сосудистого сопротивления | · инвазивный метод; · риск осложнений | · прямое измерение давления в правом предсердии и желудочке, а также в стволе лёгочной артерии |
Особенности диагностики расширения лёгочного ствола с помощью компьютерной томографии
Одним из ключевых диагностических признаков лёгочной гипертензии по данным КТ является расширение лёгочного ствола. Согласно исследованиям, диаметр лёгочного ствола более 29 мм с высокой точностью указывает на её наличие и демонстрирует положительную прогностическую ценность на уровне 97% при выявлении данного заболевания [87, 88]. Увеличение диаметра лёгочной артерии свыше 29 мм по данным КТ рассматривают как важный биомаркёр лёгочной гипертензии, ассоциированный с повышением лёгочного сосудистого сопротивления [8, 89, 90]. Однако в обновлённых рекомендациях Европейского кардиологического и Европейского респираторного общества (European Society of Cardiology/European Respiratory Society, ESC/ERS), опубликованных в 2022 году, пересмотрены критерии, указывающие на наличие лёгочной гипертензии: по данным КТ диаметр лёгочной артерии, равный 30 мм и более, рассматривают как диагностически значимый. Кроме того, в октябре 2024 г. Министерство здравоохранения Российской Федерации обновило клинические рекомендации, где также указан этот диаметр, но при этом важно учитывать, что необходимо сочетание трёх параметров, которые можно измерить полноценно только при исследованиях с контрастным усилением:
- диаметр лёгочной артерии — ≥30 мм;
- толщина передней стенки правого желудочка — ≥6 мм;
- отношение размеров правого и левого желудочка — ≥1 [9, 86].
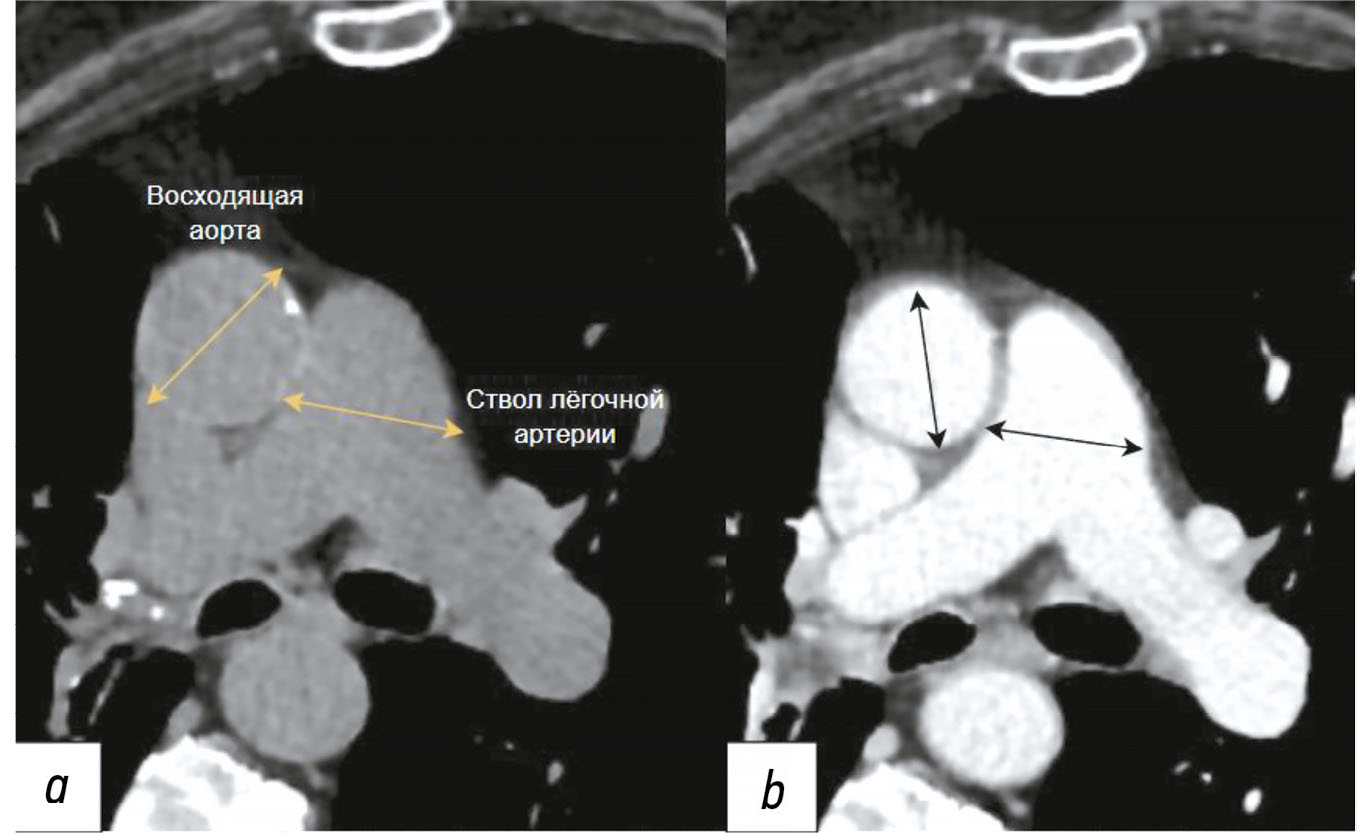
Существует статистически значимая связь между соотношением диаметра лёгочного ствола к диаметру восходящей аорты и повышенным риском смерти, независимо от наличия ишемической болезни сердца. Предложено выполнять измерение соотношения между максимальными диаметрами ствола лёгочной артерии и восходящим отделом грудной аорты. Нормальное значение индекса составляет ≤1, в свою очередь, его величина >1 указывает на расширение ствола лёгочной артерии. Согласно рекомендациям ESC/ERS от 2022 года и клиническим рекомендациям Министерства здравоохранения Российской Федерации от 2024 года, пороговое значение индекса пересмотрено с 1 на 0,9 [9, 86]. Данное соотношение может способствовать клинической оценке и прогнозированию течения лёгочной гипертензии [90–94]. Пример измерения диаметра аорты и лёгочной артерии по данным КТ показан на рис 1.
Рис. 1. Пример измерения соотношений ствола лёгочной артерии и восходящей аорты. На аксиальном срезе изображений компьютерной томографии на уровне бифуркации лёгочной артерии проведено измерение диаметров лёгочной артерии и восходящей аорты. Использовали компьютерный штангенциркуль, который фиксировал наибольший диаметр сосудов по вертикали от длинной оси главной лёгочной артерии: a — с применением контрастного усиления; b — без его применения.
Лёгочный ствол обычно измеряют в месте его раздвоения перпендикулярно длинной оси на аксиальном срезе, на этом же уровне определяют диаметр всходящей аорты при расчёте их соотношения [90]. Лучевые биомаркёры, такие как диаметр лёгочного ствола и вторичные признаки сердечной недостаточности, в частности расширение нижней полой вены, плевральный выпот и уплотнение лёгочной ткани по типу «матового стекла», также являются важными для определения лёгочной гипертензии. Отношение диаметров лёгочного ствола к восходящей аорте, превышающее 1, обладает специфичностью 92% в отношении выявления повышенного среднего артериального давления более 20 мм рт. ст. [88].
В дополнение к традиционным методам диагностики применение четырёхмерной фазово-контрастной МРТ предоставляет врачам возможность неинвазивного исследования характеристик кровотока в аорте и лёгочной артерии. Данный метод становится всё более доступным благодаря улучшению технологий и созданию программного обеспечения для обработки данных. Он позволяет неинвазивно визуализировать особенности кровотока и измерять параметры кровообращения в аорте и лёгочной артерии. Четырёхмерная фазово-контрастная МРТ помогает лучше понять механизмы развития аневризм, например у пациентов с двустворчатым аортальным клапаном. Однако для широкого применения этой технологии в клинической практике необходима стандартизация методики и её доступность [3, 95].
ОППОРТУНИСТИЧЕСКИЙ СКРИНИНГ
Оппортунистический скрининг — анализ результатов исследований, выполненных по иным показаниям. Такой подход позволяет выявить не только целевую патологию, но и дополнительные факторы риска и состояния, которые могут потенциально привести к серьёзным осложнениям, без необходимости проведения дополнительных исследований той же анатомической зоны. Данный подход снижает лучевую нагрузку на пациентов и оптимизирует процесс диагностики [96, 97].
Примером такого подхода является использование данных КТ грудной клетки и брюшной полости для оппортунистического скрининга аневризм аорты. Достижение его высокой эффективности требует охвата большого числа пациентов, поскольку сложно выделить конкретную группу риска для данной патологии [41].
С помощью технологий ИИ при оппортунистическом скрининге можно анализировать специфические признаки заболевания (биомаркёры) по данным КТ автоматически при оценке аорты и ствола лёгочной артерии [98].
Среди таких биомаркёров выделяют:
- дилатацию восходящей аорты от 40 до 49 мм, которая ассоциирована с развитием аневризмы;
- расширение лёгочного ствола от 29 мм, что может указывать на развитие лёгочной гипертензии [97, 99].
Применение технологий ИИ для выявления таких биомаркёров может способствовать снижению числа диагностических ошибок [88].
Кроме того, визуализационные биомаркёры после проверки можно использовать для оценки эффективности терапии, а также в качестве конечной точки в клинических исследованиях. Их применение способствует повышению производительности и поддерживает реализацию персонализированного подхода к лечению ССЗ, включая лёгочную гипертензию [88].
Искусственный интеллект и его роль в оппортунистическом скрининге по данным компьютерной томографии
С момента введения термина «искусственный интеллект» в 1956 году, технологии ИИ получили широкое распространение и нашли применение во многих сферах жизни, включая медицинскую практику. В медицине, благодаря росту вычислительных мощностей и увеличению количества цифровых рентгенологических изображений, ИИ помогает облегчить рутинную работу врачей, улучшая визуализацию патологий и ускоряя процесс диагностики [100]. Например, в России во время пандемии COVID-19 разработали систему ИИ для выявления признаков пневмонии по данным КТ [101].
Интеграция ИИ в медицинскую визуализацию значительно изменила диагностику ССЗ. Методы глубокого обучения, используемые в системах ИИ, значительно повысили точность и эффективность интерпретации изображений [1]. Использование технологий ИИ в сочетании с методами лучевой диагностики позволяет проводить более комплексный анализ структур и функций сердечно-сосудистой системы. Они помогают в сегментации, классификации заболеваний, прогнозировании рисков и поддержке клинических решений, что подчёркивает их значимость в борьбе с ССЗ [102, 103].
На основе данных КТ возможен оппортунистический скрининг, позволяющий выявлять дополнительные патологии других органов без необходимости повторных исследований. Такой подход доказал свою эффективность при выявлении остеопороза по результатам КТ среди населения Москвы. В период пандемии COVID-19 провели более 90 тыс. КТ грудной клетки, что позволило выявить признаки остеопороза у более 29 тыс. пациентов посредством использования ИИ, основанного на нейронных сетях [95, 104].
Системы ИИ применяли для ранней диагностики расширения аорты и лёгочного ствола. Так, O.M Mets и соавт. [105] рассматривают возможность использования неконтрастной КТ в скрининговых программах для раннего выявления расширения аорты. Это позволит своевременно проводить методы превентивной хирургии, направленной на предотвращение разрыва аневризмы, и спасать жизнь пациентов. Включение КТ грудной аорты в комплексные скрининговые исследования, позволяющие оценивать состояние лёгких, коронарный кальций и плотность костной ткани позвонков, значительно расширит диагностические возможности и повысит эффективность профилактических мероприятий.
Начало активного развития ИИ наблюдали во время пандемии COVID-19, что подтверждает наличие первых исследования по его применению. Например, при анализе данных КТ с помощью ИИ выявлено влияние COVID-19 на биомеханические свойства восходящей аорты. Исследование в Ухане продемонстрировало, что у более 50% из 38 взрослых пациентов с COVID-19 обнаружили увеличение диаметра восходящей аорты, что сопровождалось сильным воспалением и повреждением сердца. У детей с COVID-19 и мультисистемным воспалительным синдромом отмечено снижение показателей напряжения и растяжимости восходящего отдела аорты [106–108]. Эти результаты подчёркивают важность своевременного выявления пациентов с высоким риском и необходимость учёта этих данных в постковидном периоде.
Согласно исследованию A.E.M. Eltorai и соавт. [109], возможно проводить оппортунистический скрининг посредством КТ при оказании первичной медико-санитарной помощи, поскольку полученные данные способствуют обнаружению патологий, а также снижению заболеваемости и смертности. Однако авторы высказали опасения в отношении использования технологий ИИ для автоматического выявления изменений по данным КТ. Они подчеркнули, что отклонения, выявленные с помощью ИИ, должен обязательно проверять врач-рентгенолог, что поможет минимизировать возможные ошибки и повысить доверие к этой технологии. В этом опросе принял участие 71 врач, при этом 74,6% из них осведомлены о концепции ИИ, тем не менее только 8,5% использовали его в своей практике и лишь 4,2% знакомы с оппортунистическим скринингом с помощью КТ. Для успешного внедрения технологий ИИ и оппортунистического скрининга с использованием КТ врачи подчёркивают необходимость дополнительного обучения и информационной поддержки [109].
Учитывая большой объём накопленных данных КТ, оппортунистический скрининг с применением технологий ИИ может способствовать раннему выявлению расширения аорты и аневризм среди населения2 [97].
Одной из ключевых сфер применения ИИ является автоматизация обработки изображений КТ, которая предоставляет несколько значительных преимуществ. Во-первых, ИИ позволяет проводить ретроспективный анализ больших объёмов данных, что значительно ускоряет диагностический процесс. Во-вторых, он обеспечивает воспроизводимость и точность измерений, что снижает уровень неопределённости для медицинских экспертов. Таким образом, ИИ становится важным инструментом для рентгенологов, обеспечивая более точную и эффективную диагностику [110].
Эти результаты подчёркивают важность дальнейших исследований в области внедрения технологий ИИ в клиническую практику с целью диагностики заболеваний, особенно в ситуациях, требующих высокой точности и скорости анализа. Так, M. Mori и соавт. [111] проанализировали 5662 результата КТ органов грудной клетки и случайно выявили дилатацию аорты в 2,1% случаев, включая 3,2 и 0,9% у мужчин и женщин соответственно, преимущественно у пациентов старше 50 лет. Эти данные подтверждают необходимость проведения скрининга дилатации грудного отдела аорты и аневризмы у мужчин старше 50 лет. Тем не менее женщин также следует учитывать, поскольку среди пациенток, перенёсших операцию по причине аневризмы грудной аорты, наблюдают высокий уровень смертности. Кроме того, у них отмечают более быстрое её развитие и повышенный риск расслоения аорты по сравнению с мужчинами [112], что также продемонстрировано в исследовании K. Cheung и соавт. [113]. Полученные данные подтверждают целесообразность применения метода оппортунистического скрининга.
Точность измерений диаметра аорты является важным аспектом диагностики, однако она может значительно варьировать между различными рентгенологами. Это создаёт дополнительный риск получения ошибочных заключений. Так, N.S. Cayne и соавт. [114] выявили среднюю разницу в 4 мм при измерении максимального диаметра аорты по данным КТ. Именно поэтому для точной диагнос-тики необходимо сравнивать идентичные изображения и проводить измерения лично [114, 115]. В свою очередь, Z. Sedghi Gamechi и соавт. [116] полагают, что измерять аорту вручную трудоёмко, а результат зависит от наблюдателя, поэтому автоматизированное сегментирование и анализ диаметра предпочтительны как в скрининге, так и в клинической практике. Автоматическая сегментация аорты при неконтрастной КТ сложна из-за отсутствия контраста между кровотоком и окружающими тканями, в отличие от КТ-ангиографии, где уже существуют автоматические решения. Однако в рамках Московского эксперимента с помощью ИИ можно выполнять разметку сосуда по данным, полученным при проведении КТ без контрастного усиления [102].
Кроме того, C.B. Monti и соавт. [117] оценили эффективность коммерческой платформы программных решений на основе ИИ [AI-Rad Companion® (Siemens Healthineers, Германия)] при анализе 250 снимков КТ грудной клетки (без контрастного усиления) и КТ-ангиографии при различных патологиях. Результаты показали, что система способна с высокой точностью измерять диаметр грудной аорты, при этом полученные значения сопоставимы с результатами, полученными врачами-экспертами. Анализ по методу Блэнда–Альтмана выявил отклонение в 1,5 мм между измерениями системы и врачей-экспертов. Несмотря на это небольшое отклонение, оно указывает на необходимость присутствия человека для проверки и интерпретации данных, чтобы обеспечить максимальную точность и надёжность медицинской диагностики.
Подтверждая вышеописанные выводы, I.I. Hamelink и соавт. [118] провели исследование с участием 240 пациентов и выявили, что автоматизированные измерения диаметра грудной аорты с помощью технологий ИИ по данным низкодозированной неконтрастной КТ сопоставимы с результатами ручной оценки. Анализ по методу Блэнда–Альтмана не выявил систематических ошибок, а среднее расхождение между измерениями составило около 2 мм.
Полученные результаты также подтверждены исследованием M. Pradella и соавт. [16]. Авторы отметили, что использование программы The DL-prototype AI-Rad Companion® (Siemens Healthineers, Германия) с технологиями ИИ на выборке изображений КТ грудной клетки с контрастированием и без него демонстрирует высокую точность в оценке диаметра грудной аорты. Согласно заключениям рентгенологов, система ИИ корректор определила наличие или отсутствие дилатации грудной аорты в 17 691 случае (97%), включая 452 ранее невыявленных случая дилатации, кроме того, результаты не зависели от использования контраста. Таким образом, ИИ помог обнаружить пропущенные дилатации в 2,6% случаев (452 из 17 691). Эти результаты подтверждают его ценность в качестве вспомогательного инструмента для повышения качества и эффективности рентгенологических описаний.
J. Kim и соавт. [119] рассмотрели использование модели глубокого обучения на базе архитектуры 3D U-Net для автоматической сегментации лёгочных артерий на снимках КТ. Данный подход позволил создать трёхмерные реконструкции и провести количественный анализ изменений структуры этих артерий при хронической тромбоэмболической лёгочной гипертензии и лёгочной артериальной гипертензии.
Кроме того, отмечено исследование, в котором осуществляли сегментацию сердца с сосудами, что позволяет проводить комплексную диагностику сердечно-сосудистой системы. Так, K. Dwivedi и соавт. [88] применяли ИИ для анализа сердца и крупных сосудов по данным КТ с целью фенотипирования лёгочной гипертензии. Авторы выявили, что модели, основанные на архитектуре U-Net, позволяют достигать значения коэффициента Дайса, приближающегося к 0,9, что соответствует или даже превосходит качество ручной сегментации, выполненной опытными радиологами. Данные методы не только упрощают процесс разметки, но и предоставляют возможность автоматически выявлять и оценивать различные патологии, связанные с лёгочной гипертензией, в том числе за счёт применения текстурному анализа и методов классификации, ориентированных на точное прогнозирование течения заболевания.
МОСКОВСКИЙ ЭКСПЕРИМЕНТ
С 2020 года в Москве реализуют крупнейшее в мире исследование по применению технологий ИИ для анализа медицинских изображений в рамках проекта по использованию инновационных технологий компьютерного зрения в системе здравоохранения города2 [102, 103]. В 2022 году провели более 647 тыс. КТ грудной клетки, а в 2023 году — более 470 тыс. Эти данные предоставляют возможности для оппортунистического скрининга патологического расширения грудной аорты и лёгочного ствола [97].
Тем не менее систематический (организованный) скрининг аневризм и дилатаций грудной аорты отсутствует [111]. Пример работы системы ИИ в рамках Московского эксперимента продемонстрирован на рис. 2.
Рис. 2. Пример работы российского сервиса на основе искусственного интеллекта: a — зелёными (норма) линиями указан диаметр восходящего и нисходящего отдела грудной аорты, а также лёгочного ствола. В красном квадрате выделен (с указанием размера и объёма) лёгочный лимфатический узел; b — жёлтой линией (дилатация) указан диаметр восходящей аорты, оранжевой (патологическое расширение) — диаметр лёгочного ствола, отсутствие измерений нисходящей аорты свидетельствует о некорректной работе системы искусственного интеллекта. Оранжевым контуром выделено подозрение на уплотнение лёгочной ткани (пневмония), жёлтым контуром — гидроторакс.
ЗАКЛЮЧЕНИЕ
Ранняя диагностика аневризм грудного отдела аорты и патологического расширения лёгочного ствола имеет решающее значение для предотвращения серьёзных осложнений. При отсутствии своевременного лечения такие состояния могут привести к расслоению или разрыву аорты, что нередко приводит к летальному исходу. Лёгочная гипертензия также представляет серьёзную угрозу: без адекватной терапии она прогрессирует до правожелудочковой сердечной недостаточности, сопровождающейся риском смерти вследствие тромбоэмболии, аритмии или отёка лёгких. Кроме того, дилатация грудной аорты и патологическое расширение лёгочного ствола являются ключевыми биомаркёрами, указывающими на наличие этих патологий. Раннее выявление таких предикторов позволяет начать лечение на стадиях, когда оно наиболее эффективно, тем самым снижая заболеваемость и смертность.
ИИ играет важную роль в повышении эффективности диагностических и мониторинговых мероприятий. Его применение способствует увеличению точности и воспроизводимости измерений, в том числе при динамическом наблюдении за пациентом, снижает вероятность ошибок, обусловленных человеческим фактором, и ускоряет обработку медицинских данных. ИИ обеспечивает более точный и объективный контроль за динамикой заболевания, что имеет ключевое значение для выбора оптимальной стратегии лечения.
Интеграция технологий ИИ в процесс диагностики в сочетании с применением оппортунистического скрининга значительно повышает точность и эффективность анализа изображений КТ, снижая нагрузку на врачей и уменьшая вероятность ошибок. Развитие и их интеграция в клиническую практику обладают значительным потенциалом для повышения качества диагностики и снижения смертности от ССЗ. Тем не менее некоторые эксперты подчёркивают необходимость обязательного контроля результатов работы ИИ со стороны врача.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Вклад авторов. А.В. Соловьёв, А.В. Владзимирский — концепция работы, написание и редактирование текста рукописи; В.Е. Синицын — концепция работы, финальное редактирование текста рукописи; А.П. Памова — редактирование текста рукописи, консультативная поддержка. Все авторы одобрили рукопись (версию для публикации), а также согласились нести ответственность за все аспекты работы, гарантируя надлежащее рассмотрение и решение вопросов, связанных с точностью и добросовестностью любой её части.
Этическая экспертиза. Неприменимо.
Источник финансирования. Данная статья подготовлена авторским коллективом в рамках научно-исследовательской работы «Оппортунистический скрининг социально значимых и иных распространённых заболеваний» (в Единой государственной информационной системе учёта: № 123031400009-1) в соответствии с приказом Департамента здравоохранения города Москвы от 21.12.2022 № 1196 «Об утверждении государственных заданий, финансовое обеспечение которых осуществляется за счёт средств бюджета города Москвы, государственным бюджетным (автономным) учреждениям, подведомственным Департаменту здравоохранения города Москвы, на 2023 год и плановый период 2024 и 2025 годов».
Раскрытие интересов. Авторы заявляют об отсутствии отношений, деятельности и интересов за последние три года, связанных с третьими лицами (коммерческими и некоммерческими), интересы которых могут быть затронуты содержанием статьи.
Оригинальность. При создании настоящей работы авторы не использовали ранее опубликованные сведения (текст, иллюстрации, данные).
Доступ к данным. Редакционная политика в отношении совместного использования данных к настоящей работе не применима.
Генеративный искусственный интеллект. При создании настоящей статьи технологии генеративного искусственного интеллекта не использовали.
Рассмотрение и рецензирование. Настоящая работа подана в журнал в инициативном порядке и рассмотрена по обычной процедуре. В рецензировании участвовали три внешних рецензента и научный редактор издания.
ADDITIONAL INFORMATION
Author contributions: A.V. Solovev, A.V. Vladzymyrskyy: conceptualization, writing—original draft, writing—review & editing; V.E. Sinitsyn: conceptualization, writing—review & editing (final revisions); A.P. Pamova: writing—review & editing, consultation support. All the authors approved the version of the manuscript to be published and agreed to be accountable for all aspects of the work, ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Ethics approval: Not applicable.
Funding sources: This article was part of the research project Opportunistic Screening for Socially Significant and Other Common Diseases (Unified State Information Accounting System No. 123031400009-1), in accordance with Order No. 1196 dated December 21, 2022, On Approval of State Assignments Funded by the Budget of the City of Moscow for State Budgetary (Autonomous) Institutions Under the Jurisdiction of the Moscow City Health Department for 2023 and the Planned Period of 2024–2025, issued by the Moscow City Health Department.
Disclosure of interests: The authors have no relationships, activities, or interests for the last three years related to for-profit or not-for-profit third parties whose interests may be affected by the content of the article.
Statement of originality: No previously published material (text, images, or data) was used in this work.
Data availability statement: The editorial policy regarding data sharing does not apply to this work.
Generative AI: No generative artificial intelligence technologies were used to prepare this article.
Provenance and peer review: This paper was submitted unsolicited and reviewed following the standard procedure. The peer review process involved three external reviewers and the in-house science editor.
1 The top 10 causes of death; [около 12 страниц]. В: World Health Organization [Internet]. Geneva: World Health Organization; 2024–2024. Режим доступа: https://www.who.int/ru/news-room/fact-sheets/detail/the-top-10-causes-of-death Дата обращения: 12.05.2024.
2 Свидетельство о государственной регистрации базы данных № 2023621254/ 18.04.2023. Бюл. №. 4. Владзимирский А.В., Андрейченко А.Е., Соловьёв А.В., и др. MosMedData: КТ с отсутствием и наличием признаков расширения лёгочного ствола. Режим доступа: https://www.elibrary.ru/item.asp?edn=dbiddw Дата обращения: 12.05.2024.
About the authors
Alexander V. Solovev
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies; Morozov Children's Municipal Clinical Hospital
Author for correspondence.
Email: atlantis.92@mail.ru
ORCID iD: 0000-0003-4485-2638
SPIN-code: 9654-4005
MD
Russian Federation, Moscow; MoscowValentin E. Sinitsyn
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies; Lomonosov Moscow State University
Email: vsini@mail.ru
ORCID iD: 0000-0002-5649-2193
SPIN-code: 8449-6590
MD, Dr. Sci. (Medicine), Professor
Russian Federation, Moscow; MoscowAnton V. Vladzymyrskyy
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
Email: VladzimirskijAV@zdrav.mos.ru
ORCID iD: 0000-0002-2990-7736
SPIN-code: 3602-7120
MD, Dr. Sci. (Medicine)
Russian Federation, MoscowAnastasia P. Pamova
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
Email: PamovaAP@zdrav.mos.ru
ORCID iD: 0000-0002-0041-3281
SPIN-code: 5146-4355
MD, Cand. Sci. (Medicine)
Russian Federation, MoscowReferences
- Wang X, Zhu H. Artificial intelligence in image-based cardiovascular disease analysis: a comprehensive survey and future outlook. Journal of Latex Class Files. 2024;14(8):1–22. doi: 10.48550/arXiv.2402.03394
- Nagibina YuV, Zakharova LA. Life quality, medical and social characteristics of coronary heart disease patients. Russian Journal of Cardiology. 2017;22(3):155–159. doi: 10.15829/1560-4071-2017-3-155-159 EDN: YHOFDL
- Czerny M, Grabenwöger M, Berger T, et al. EACTS/STS guidelines for diagnosing and treating acute and chronic syndromes of the aortic organ. The Annals of Thoracic Surgery. 2024;118(1):5–115. doi: 10.1016/j.athoracsur.2024.01.021 EDN: XLPIEC
- Chernina VYu, Blohin IA, Nikolaev AE, et al. Tactics of incidentaloma management. Section 3. Thyroid gland, pituitary gland, vessels and mediastinum: methodical recommendations. Moscow: Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies; 2019. (In Russ.) [cited 2024 May 12]. Available from: https://niioz.ru/upload/iblock/62c/62ceeb66d4528c831ddf40ea3f918d01.pdf
- Erbel R, Aboyans V, Boileau C, et al.; ESC Committee for Practice Guidelines. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European. Eur. Heart J. 2014;35(41):2873–2926. doi: 10.1093/eurheartj/ehu281
- Gouveia E Melo R, Silva Duarte G, Lopes A, et al. Incidence and prevalence of thoracic aortic aneurysms: a systematic review and meta-analysis of population-based studies. Semin. Thorac. Cardiovasc. Surg. 2022;34(1):1–16. doi: 10.1053/j.semtcvs.2021.02.029
- Abugov SA, Averina TB, Akchurin RS, et al. Clinical guidelines. guidelines for the diagnosis and treatment of aortic diseases (2017). Russian Journal Of Cardiology And Cardiovascular Surgery. 2018;11(1):7–67. EDN: YPAKRP
- Galiè N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. European Respiratory Journal. 2015;46(4):903–975. doi: 10.1183/13993003.01032-2015 EDN: XYRISJ
- Humbert M, Kovacs G, Hoeper MM, et al; the ESC/ERS scientific document group. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. European Respiratory Journal. 2022;61(1):2200879. doi: 10.1183/13993003.00879-2022 EDN: DMBOSS
- Chazova IE, Martynyuk TV, Valieva ZS, et al. Eurasian clinical guidelines on diagnosis and treatment of pulmonary hypertension. Eurasian heart journal. 2020;(1):78–122. doi: 10.38109/2225-1685-2020-1-78-122 EDN: YOTXVT
- Sampson UKA, Norman PE, Fowkes FGR, et al. Global and regional burden of aortic dissection and aneurysms: mortality trends in 21 world regions, 1990 to 2010. Global Heart. 2014;9(1):171–180. doi: 10.1016/j.gheart.2013.12.010 EDN: SPJFQB
- Sampson UKA, Norman PE, Fowkes FGR, et al. Estimation of global and regional incidence and prevalence of abdominal aortic aneurysms 1990 to 2010. Global Heart. 2014;9(1):159–170. doi: 10.1016/j.gheart.2013.12.009 EDN: SPKAKV
- Krafcik BM, Stone DH, Cai M, et al. Changes in global mortality from aortic aneurysm. Journal of Vascular Surgery. 2024;80(1):81–88.e1. doi: 10.1016/j.jvs.2024.02.025 EDN: ZUUPKL
- Irtyuga OB, Voronkina IV, Smagina LV, et al. Тhe frequency to detect of ascending aorta aneurysms and the mechanism of its development according register of the аlmazov federal heart, blood and endocrinology centre. Almazov Federal Heart, Blood And Endocrinology Centre Bulletin. 2011;(5):73–78. EDN: OWGHOB
- Kuznechevsky F.V., Osipov A.Kh., Evsikov E.M., Abramov I.S., Otarova S.M. Prevalence and clinical features of aorta aneurysm; and dissections: 10-year results of consequent autopsies made at O.M. Filatov City Clinical Hospital №15. Russian Journal of Cardiology. 2004;9(6):5–13. EDN: ISVRYL
- Pradella M, Achermann R, Sperl JI, et al. Performance of a deep learning tool to detect missed aortic dilatation in a large chest CT cohort. Frontiers in Cardiovascular Medicine. 2022;9:972512. doi: 10.3389/fcvm.2022.972512 EDN: NWYDJQ
- Lavall D, Schäfers HJ, Böhm M, Laufs U. Aneurysms of the ascending aorta. Deutsches Ärzteblatt international. 2012;109(13):227–233. doi: 10.3238/arztebl.2012.0227
- Elefteriades JA. Natural history of thoracic aortic aneurysms: indications for surgery, and surgical versus nonsurgical risks. The Annals of Thoracic Surgery. 2002;74(5):S1877–S1880. doi: 10.1016/S0003-4975(02)04147-4
- Wong RHL, Yang F, Fujikawa T, et al. Pocket-size mobile echocardiographic screening of thoracic aortic aneurysms in hypertensive patients. The Annals of Thoracic Surgery. 2021;111(5):1554–1559. doi: 10.1016/j.athoracsur.2020.07.018 EDN: IRQRDZ
- Lum RTW, Ho JYK, Chow SCY, et al. Screening for thoracic aortic aneurysm. Journal of the Hong Kong College of Cardiology. 2024;31(4). doi: 10.55503/2790-6744.1538 EDN: YKXGBT
- McClure RS, Brogly SB, Lajkosz K, et al. Epidemiology and management of thoracic aortic dissections and thoracic aortic aneurysms in Ontario, Canada: A population-based study. The Journal of Thoracic and Cardiovascular Surgery. 2018;155(6):2254–2264.e4. doi: 10.1016/j.jtcvs.2017.11.105
- Olsson C, Thelin S, Ståhle E, et al. Thoracic aortic aneurysm and dissection. Circulation. 2006;114(24):2611–2618. doi: 10.1161/CIRCULATIONAHA.106.630400
- Cho IJ, Jang SY, Chang HJ, et al. Aortic Aneurysm screening in a high-risk population: a non-contrast computed tomography study in korean males with hypertension. Korean Circulation Journal. 2014;44(3):162–169. doi: 10.4070/kcj.2014.44.3.162
- Kato K, Oguri M, Kato N, et al. Assessment of genetic risk factors for thoracic aortic aneurysm in hypertensive patients. American Journal of Hypertension. 2008;21(9):1023–1027. doi: 10.1038/ajh.2008.229
- Mehrabi Nasab E, Athari SS. The prevalence of thoracic aorta aneurysm as an important cardiovascular disease in the general population. Journal of Cardiothoracic Surgery. 2022;17(1):1–6. doi: 10.1186/s13019-022-01767-0 EDN: QOWOWT
- Vandroux D, Aboyans V, Houehanou YC, et al; TAHES study investigators. Normal values of proximal aorta diameters in healthy Sub Saharan Africans: The TAHES study. Echocardiography. 2022;39(4):576–583. doi: 10.1111/echo.15331 EDN: TGBSWV
- Clouse WD, Hallett, Jr JW, Schaff HV, et al. Improved prognosis of thoracic aortic aneurysms. JAMA. 1998;280(22):1926–1929. doi: 10.1001/jama.280.22.1926
- Elefteriades JA. Thoracic aortic aneurysm: reading ttable he enemy’s playbook. World Journal of Surgery. 2008;32(3):366–374. doi: 10.1007/s00268-007-9398-3 EDN: EAAZYC
- Miller WT. Thoracic aortic aneurysms: plain film findings. Seminars in Roentgenology. 2001;36(4):288–294. doi: 10.1053/sroe.2001.26937
- von Kodolitsch Y, Nienaber CA, Dieckmann C, et al. Chest radiography for the diagnosis of acute aortic syndrome. The American Journal of Medicine. 2004;116(2):73–77. doi: 10.1016/j.amjmed.2003.08.030
- Flachskampf FA, Badano L, Daniel WG, et al; for the European Association of Echocardiography; endorsed by the Echo Committee of the European Association of Cardiothoracic Anaesthesiologists. Recommendations for transoesophageal echocardiography: update 2010. European Journal of Echocardiography. 2010;11(7):557–576. doi: 10.1093/ejechocard/jeq057
- le Polain de Waroux JB, Pouleur AC, Goffinet C, et al. Functional anatomy of aortic regurgitation: accuracy, prediction of surgical repairability, and outcome implications of transesophageal echocardiography. Circulation. 2007;116(Suppl. 11):I264–I269. doi: 10.1161/CIRCULATIONAHA.106.680074
- Kallianos KG, Burris NS. Imaging thoracic aortic aneurysm. Radiologic Clinics of North America. 2020;58(4):721–731. doi: 10.1016/j.rcl.2020.02.009 EDN: CAUYQG
- Lau C, Feldman DN, Girardi LN, Kim LK. Imaging for surveillance and operative management for endovascular aortic aneurysm repairs. Journal of Thoracic Disease. 2017;9(S4):S309–S316. doi: 10.21037/jtd.2017.03.89
- Chiu KWH, Ling L, Tripathi V, et al. Ultrasound measurement for abdominal aortic aneurysm screening: a direct comparison of the three leading methods. European Journal of Vascular and Endovascular Surgery. 2014;47(4):367–373. doi: 10.1016/j.ejvs.2013.12.026
- Manning BJ, Kristmundsson T, Sonesson B, Resch T. Abdominal aortic aneurysm diameter: a comparison of ultrasound measurements with those from standard and three-dimensional computed tomography reconstruction. Journal of Vascular Surgery. 2009;50(2):263–268. doi: 10.1016/j.jvs.2009.02.243
- Lansac E, Di Centa I, Raoux F, et al. A lesional classification to standardize surgical management of aortic insufficiency towards valve repair. European Journal of Cardio-Thoracic Surgery. 2008;33(5):872–878. doi: 10.1016/j.ejcts.2007.12.033
- Rybakova MK, Alehin MN, Mitkov VV. Practical guide to ultrasound diagnostics. Echocardiography. Moscow: Vidar-M; 2008. (In Russ.) ISBN: 978-5-88429-118-8 [cited 2024 May 12]. Available from: http://vidar.ru/BookImg/001-020_Rybakova.pdf
- Roelandt JR, Bruining N, Bom N. Perspectives in cardiac ultrasound. Przeglad Lekarski. 2002;59(8):557–561.
- Gavrilenkov VI, Kuznecov AA, Perlej VE, et al. Echocardiographic assessment of normal aortic valve biomechanics. Ultrasound And Functional Diagnostics. 2003;(2):89–96. (In Russ.)
- Claridge R, Arnold S, Morrison N, van Rij AM. Measuring abdominal aortic diameters in routine abdominal computed tomography scans and implications for abdominal aortic aneurysm screening. Journal of Vascular Surgery. 2017;65(6):1637–1642. doi: 10.1016/j.jvs.2016.11.044
- Hall T, Shah P, Wahi S. The role of transesophageal echocardiography in aortic valve preserving procedures. Indian Heart Journal. 2014;66(3):327–333. doi: 10.1016/j.ihj.2014.05.001
- Downing SW, Sperling JS, Mirvis SE, et al. Experience with spiral computed tomography as the sole diagnostic method for traumatic aortic rupture. The Annals of Thoracic Surgery. 2001;72(2):495–502. doi: 10.1016/S0003-4975(01)02827-2
- Rémy-Jardin M, Bonnel F, Masson P, et al. Outil optimal de dépistage en pathologie thoracique: radiographie ou scanner? J Radiol. 2001;82(9 Pt 2):1108–1118. (In French)
- Ellis JD, Mayo JR. Computed tomography evaluation of traumatic rupture of the thoracic aorta: an outcome study. Can Assoc Radiol J. 2007;58(1):22–26.
- Szymczyk K, Polguj M, Szymczyk E, et al. Assessment of aortic valve in regard to its anatomical variants morphology in 2053 patients using 64-slice CT retrospective coronary angiography. BMC Cardiovascular Disorders. 2016;16(1):1–9. doi: 10.1186/s12872-016-0261-z EDN: RPMNFG
- Lee HY, Kim SM, Lee KS, et al. Quantification of Aortic Valve Calcifications Detected During Lung Cancer-Screening CT Helps Stratify Subjects Necessitating Echocardiography for Aortic Stenosis Diagnosis. Medicine. 2016;95(19):e3710. doi: 10.1097/MD.0000000000003710
- Belov YuV, Kertes MI, Bogopolskaya OM, et al. Strategy and tactics of instrumental examination of patients with thoracic and thoracoabdominal aortic aneurysm. Angiology and Vascular Surgery. Journal Named After Academician A.V. Pokrovsky. 2005;11(4):33–51. EDN: PFRPXT
- Tops LF, Wood DA, Delgado V, et al. Noninvasive evaluation of the aortic root with multislice computed tomography. JACC: Cardiovascular Imaging. 2008;1(3):321–330. doi: 10.1016/j.jcmg.2007.12.006
- Weinreb JC, Rodby RA, Yee J, et al. Use of intravenous gadolinium-based contrast media in patients with kidney disease: consensus statements from the American College of Radiology and the National Kidney Foundation. Radiology. 2021;298(1):28–35. doi: 10.1148/radiol.2020202903 EDN: WZBRMI
- Hagan PG, Nienaber CA, Isselbacher EM, et al. The International Registry of Acute Aortic Dissection (IRAD). JAMA. 2000;283(7):897–903. doi: 10.1001/jama.283.7.897
- Bokeria LA, Malashenkov AL, Makarenko VN, et al. Spiral computed tomographyin aortic aneurysm diagnostics. Annals of the Russian Academy of Medical Sciences. 2005;(4):25–31. EDN: HRXFHZ
- Prozorov SA, Belozerov GE, Dubrov EYa, et al. diagnostic radiology of multiple aortic aneurysms. Medical Visualization. 2005;(3):83–87. EDN: TGLBBB
- Sommer T, Fehske W, Holzknecht N, et al. Aortic dissection: a comparative study of diagnosis with spiral CT, multiplanar transesophageal echocardiography, and MR imaging. Radiology. 1996;199(2):347–352. doi: 10.1148/radiology.199.2.8668776
- Kapustin AJ, Litt HI. Diagnostic imaging for aortic dissection. Seminars in Thoracic and Cardiovascular Surgery. 2005;17(3):214–223. doi: 10.1053/j.semtcvs.2005.06.006
- Tsai TT, Nienaber CA, Eagle KA. Acute aortic syndromes. Circulation. 2005;112(24):3802–3813. doi: 10.1161/CIRCULATIONAHA.105.534198
- Cigarroa JE, Isselbacher EM, DeSanctis RW, Eagle KA. Diagnostic imaging in the evaluation of suspected aortic dissection — old standards and new directions. New England Journal of Medicine. 1993;328(1):35–43. doi: 10.1056/NEJM199301073280107
- Tyutin LA, Yakovleva EK. Magnetic resonance angiography: development stages, diagnostic potential and limitations. Medical Visualization. 2013;(2):29–40. EDN: RBJGKL
- François CJ, Carr JC. MRI of the thoracic aorta. Magnetic Resonance Imaging Clinics Of North America. 2007;15(4):639–651. doi: 10.1016/j.mric.2007.08.011
- Nienaber CA. The role of imaging in acute aortic syndromes. European Heart Journal — Cardiovascular Imaging. 2012;14(1):15–23. doi: 10.1093/ehjci/jes215
- Litmanovich D, Bankier AA, Cantin L, et al. CT and MRI in Diseases of the Aorta. American Journal of Roentgenology. 2009;193(4):928–940. doi: 10.2214/AJR.08.2166
- Barker AJ, Markl M, Bürk J, et al. Bicuspid Aortic Valve Is Associated With Altered Wall Shear Stress in the Ascending Aorta. Circulation: Cardiovascular Imaging. 2012;5(4):457–466. doi: 10.1161/CIRCIMAGING.112.973370
- Blockmans D, Ceuninck L, Vanderschueren S, et al. Repetitive 18F-fluorodeoxyglucose positron emission tomography in giant cell arteritis: a prospective study of 35 patients. Arthritis Care & Research. 2006;55(1):131–137. doi: 10.1002/art.21699
- Walter MA, Melzer RA, Schindler C, et al. The value of [18F]FDG-PET in the diagnosis of large-vessel vasculitis and the assessment of activity and extent of disease. European Journal of Nuclear Medicine and Molecular Imaging. 2005;32(6):674–681. doi: 10.1007/s00259-004-1757-9 EDN: QAVZJE
- Kuehl H, Eggebrecht H, Boes T, et al. Detection of inflammation in patients with acute aortic syndrome: comparison of FDG-PET/CT imaging and serological markers of inflammation. Heart. 2008;94(11):1472–1477. doi: 10.1136/hrt.2007.127282
- Tokuda Y, Oshima H, Araki Y, et al. Detection of thoracic aortic prosthetic graft infection with 18F-fluorodeoxyglucose positron emission tomography/computed tomography. European Journal of Cardio-Thoracic Surgery. 2013;43(6):1183–1187. doi: 10.1093/ejcts/ezs693
- Fiorucci B, Banafsche R, Jerkku T, et al. Das thorakale Aortenaneurysma — Diagnostik und Behandlungsstrategien. Deutsche medizinische Wochenschrift (1946). 2019;144(3):146–151. (In German) doi: 10.1055/a-0648-0207
- Feldman L. Digital Subtraction Angiography of the Chest. Clinics in Chest Medicine. 1984;5(2):313–328. doi: 10.1016/S0272-5231(21)00254-9
- Rauber K, Kollath J. Die Diagnose der Aortenruptur durch digitale Subtraktionsangiographie (DSA). RoFo: Fortschritte auf dem Gebiete der Rontgenstrahlen und der Nuklearmedizin. 1983;139(2):167–170. (In German) doi: 10.1055/s-2008-1055864
- Lambelin M, Janssens L, Haenen L. Iatrogenic ascending aorta dissection during diagnostic coronary angiography: rare but life-threatening. Case Reports in Cardiology. 2014;2014:1–3. doi: 10.1155/2014/809398
- Carpenter SW, Kodolitsch YV, Debus ES, et al. Acute aortic syndromes: definition, prognosis and treatment options. The Journal of Cardiovascular Surgery. 2014;55(2 Suppl 1):133–144.
- Hannuksela M, Lundqvist S, Carlberg B. Thoracic aorta — dilated or not? Scandinavian Cardiovascular Journal. 2006;40(3):175–178. doi: 10.1080/14017430600565999
- Davies RR, Gallo A, Coady MA, et al. Novel measurement of relative aortic size predicts rupture of thoracic aortic aneurysms. The Annals of Thoracic Surgery. 2006;81(1):169–177. doi: 10.1016/j.athoracsur.2005.06.026
- Girardi LN, Lau C, Gambardella I. Aortic dimensions as predictors of adverse events. The Journal of Thoracic and Cardiovascular Surgery. 2021;161(4):1193–1197. doi: 10.1016/j.jtcvs.2020.06.137 EDN: GNERDK
- Hoeper MM, Humbert M, Souza R, et al. A global view of pulmonary hypertension. The Lancet Respiratory Medicine. 2016;4(4):306–322. doi: 10.1016/S2213-2600(15)00543-3 EDN: WUFYUX
- Naing P, Kangaharan N, Scalia GM, et al. Pulmonary hypertension in remote and disadvantaged population: overcoming unique challenges for improved outcomes. Internal Medicine Journal. 2022;53(1):12–20. doi: 10.1111/imj.15860 EDN: YNYRXI
- Martynjuk TV. Pulmonary hypertension: diagnosis and treatment. Moscow: Publishing House “Medical Information Agency”; 2018. (In Russ.) EDN: UXDPPX
- Aliev AF, Kudryavtsev ND, Petraikin AV, et al. Changing of pulmonary artery diameter in accordance with severity of COVID-19 (assessment based on non-contrast computer tomography). Digital Diagnostics. 2021;2(3):249–260. doi: 10.17816/DD76726 EDN: VTMKCJ
- Chuchalin A, Khaltaev N, Antonov N, et al. Chronic respiratory diseases and risk factors in 12 regions of the Russian Federation. International Journal of Chronic Obstructive Pulmonary Disease. 2014;9:963–974. doi: 10.2147/COPD.S67283 EDN: UEYOFH
- Avdeev SN, Ajsanov ZR, Belevskij AS, et al; Russian Respiratory Society. Clinical guidelines: chronic obstructive pulmonary disease. 2nd ed, revised and supplemented. Moscow: Atmosfera; 2007. (In Russ.) EDN: QLPFTN
- Galiè N, Simonneau G. The fifth world symposium on pulmonary hypertension. Journal of the American College of Cardiology. 2013;62(25):D1–D3. doi: 10.1016/j.jacc.2013.10.030 EDN: YEGEFV
- Badesch DB, Raskob GE, Elliott CG, et al. Pulmonary arterial hypertension. Chest. 2010;137(2):376–387. doi: 10.1378/chest.09-1140
- Hoeper MM, Bogaard HJ, Condliffe R, et al. Definitions and diagnosis of pulmonary hypertension. Journal of the American College of Cardiology. 2013;62(25):D42–D50. doi: 10.1016/j.jacc.2013.10.032
- Brown LM, Chen H, Halpern S, et al. Delay in recognition of pulmonary arterial hypertension. Chest. 2011;140(1):19–26. doi: 10.1378/chest.10-1166
- Tonelli AR, Ascha M, Renapurkar RD. A review of imaging modalities in pulmonary hypertension. Annals of Thoracic Medicine. 2017;12(2):61–73. doi: 10.4103/1817-1737.203742 EDN: YDBKBN
- Avdeev SN, Barbarash OL, Valieva ZS, et al. 2024 Clinical practice guidelines for Pulmonary hypertension, including chronic thromboembolic pulmonary hypertension. Russian Journal of Cardiology. 2024;29(11):170–250. doi: 10.15829/1560-4071-2024-6161 EDN: MYEOVA
- Zouk AN, Gulati S, Xing D, et al. Pulmonary artery enlargement is associated with pulmonary hypertension and decreased survival in severe cystic fibrosis: a cohort study. PLOS ONE. 2020;15(2):e0229173. doi: 10.1371/journal.pone.0229173 EDN: FJNDMS
- Dwivedi K, Sharkey M, Condliffe R, et al. Pulmonary hypertension in association with lung disease: quantitative CT and artificial intelligence to the rescue? State-of-the-Art Review. Diagnostics. 2021;11(4):679. doi: 10.3390/diagnostics11040679 EDN: QCTQAF
- Truong QA, Massaro JM, Rogers IS, et al. Reference values for normal pulmonary artery dimensions by noncontrast cardiac computed tomography. Circulation: Cardiovascular Imaging. 2012;5(1):147–154. doi: 10.1161/CIRCIMAGING.111.968610
- Lewis G, Hoey ET, Reynolds JH, et al. Multi-detector CT assessment in pulmonary hypertension: techniques, systematic approach to interpretation and key findings. Quantitative imaging in Medicine and Surgery. 2015;5(3):423–432. doi: 10.3978/j.issn.2223-4292.2015.01.05
- Nakanishi R, Rana JS, Shalev A, et al. mortality risk as a function of the ratio of pulmonary trunk to ascending aorta diameter in patients with suspected coronary artery disease. The American Journal of Cardiology. 2013;111(9):1259–1263. doi: 10.1016/j.amjcard.2013.01.266
- Lee SH, Kim YJ, Lee HJ, et al. Comparison of CT-determined pulmonary artery diameter, aortic diameter, and their ratio in healthy and diverse clinical conditions. PLOS ONE. 2015;10(5):e0126646. doi: 10.1371/journal.pone.0126646
- Raju SN, Pandey NN, Sharma A, et al. Pulmonary Arterial Dilatation: Imaging Evaluation Using Multidetector Computed Tomography. Indian Journal of Radiology and Imaging. 2021;31(2):409–420. doi: 10.1055/s-0041-1734225 EDN: NEUMWO
- Spagnolo P, Cozzi A, Foà RA, et al. CT-derived pulmonary vascular metrics and clinical outcome in COVID-19 patients. Quantitative Imaging in Medicine and Surgery. 2020;10(6):1325–1333. doi: 10.21037/QIMS-20-546 EDN: WIOGYX
- Markl M, Hope MD. 4D flow imaging—state of the art. Annals of Cardiothoracic Surgery. 2022;11(4):468–469. doi: 10.21037/acs-2021-bav-15 EDN: YIIRBV
- Law M. “Opportunistic” screening. Journal of Medical Screening. 1994;1(4):208. doi: 10.1177/096914139400100403
- Solovev AV, Vasilev YuA, Sinitsyn VE, et al. Improving aortic aneurysm detection with artificial intelligence based on chest computed tomography data. Digital Diagnostics. 2024;5(1):29–40. doi: 10.17816/DD569388 EDN: CZNZYP
- Vasan RS. Biomarkers of cardiovascular disease. Circulation. 2006;113(19):2335–2362. doi: 10.1161/CIRCULATIONAHA.104.482570 EDN: MFJKKD
- Urbanowicz T, Rajewska-Tabor J, Olasińska-Wiśniewska A, et al. Demographical and clinical factors predictive for aortic dilatation. When should we be concerned about the size? Reviews in Cardiovascular Medicine. 2024;25(5):150. doi: 10.31083/j.rcm2505150 EDN: DIDZNL
- Mintz Y, Brodie R. Introduction to artificial intelligence in medicine. Minimally Invasive Therapy & Allied Technologies. 2019;28(2):73–81. doi: 10.1080/13645706.2019.1575882 EDN: EWABMW
- Goncharov M, Pisov M, Shevtsov A, et al. CT-Based COVID-19 triage: deep multitask learning improves joint identification and severity quantification. Medical Image Analysis. 2021;71:102054. doi: 10.1016/j.media.2021.102054 EDN: RAHCWT
- Vladzymyrsky AV, Vasilev YuA, Arzamasov KM, et al. Computer vision in radiation diagnostics: the first stage of the Moscow experiment. 2nd ed. Moscow: Izdatel'skie resheniya; 2023 (In Russ.) ISBN: 978-5-0059-3043-9 EDN: FOYLXK
- Vasilev YA, Bobrovskaya TM, Arzamasov KM, et al. Medical datasets for machine learning: fundamental principles of standartization and systematization. Manager Zdravookhranenia. 2023;(4):28–41. doi: 10.21045/1811-0185-2023-4-28-41 EDN: EPGAMD
- Petraikin AV, Artyukova ZR, Nisovtsova LA, et al. Analysis of the effectiveness of implementing screening of osteoporosis. Manager Zdravoochranenia. 2021;(2):31–39. doi: 10.21045/1811-0185-2021-2-31-39 EDN: AVDSIW
- Mets OM, de Jong PA, Prokop M. Computed tomographic screening for lung cancer. JAMA. 2012;308(14):1433–1434. doi: 10.1001/jama.2012.12656
- Patel K, Zafar MA, Ziganshin BA, Elefteriades JA. Diabetes mellitus: is it protective against aneurysm? A narrative review. Cardiology. 2018;141(2):107–122. doi: 10.1159/000490373 EDN: IODHHA
- Song L, Zhao S, Wang L, et al. Cardiovascular changes in patients with COVID-19 from Wuhan, China. Frontiers in Cardiovascular Medicine. 2020;7:566484. doi: 10.3389/fcvm.2020.00150 EDN: UNZBRV
- Ostberg N, Zafar M, Ziganshin B, Elefteriades J. The genetics of thoracic aortic aneurysms and dissection: a clinical perspective. Biomolecules. 2020;10(2):182. doi: 10.3390/biom10020182 EDN: XHXLLH
- Eltorai AEM, McKinney SE, Rockenbach MABC, et al. Primary care provider perspectives on the value of opportunistic CT screening. Clinical Imaging. 2024;112:110210. doi: 10.1016/j.clinimag.2024.110210 EDN: MZTJJQ
- Kodenko MR, Vasilev YA, Vladzymyrskyy AV, et al. Diagnostic accuracy of AI for opportunistic screening of abdominal aortic aneurysm in CT: a systematic review and narrative synthesis. Diagnostics. 2022;12(12):3197. doi: 10.3390/diagnostics12123197 EDN: ERWYPX
- Mori M, Bin Mahmood SU, Yousef S, et al. Prevalence of incidentally identified thoracic aortic dilations: insights for screening criteria. Canadian Journal of Cardiology. 2019;35(7):892–898. doi: 10.1016/j.cjca.2019.03.023 EDN: PLXTIZ
- Jiang H, Xu H, Xu Z. Sex-related differences in outcome of thoracic aortic surgery. Journal of Cardiothoracic Surgery. 2024;19(1):1–7. doi: 10.1186/s13019-024-02735-6 EDN: RRSAZK
- Cheung K, Boodhwani M, Chan KL, et al. Thoracic aortic aneurysm growth: role of sex and aneurysm etiology. Journal of the American Heart Association. 2017;6(2):e003792. doi: 10.1161/JAHA.116.003792
- Cayne NS, Veith FJ, Lipsitz EC, et al. Variability of maximal aortic aneurysm diameter measurements on CT scan: significance and methods to minimize. Journal of Vascular Surgery. 2004;39(4):811–815. doi: 10.1016/j.jvs.2003.11.042
- Isselbacher EM. Thoracic and abdominal aortic aneurysms. Circulation. 2005;111(6):816–828. doi: 10.1161/01.CIR.0000154569.08857.7A
- Sedghi Gamechi Z, Bons LR, Giordano M, et al. Automated 3D segmentation and diameter measurement of the thoracic aorta on non-contrast enhanced CT. European Radiology. 2019;29(9):4613–4623. doi: 10.1007/s00330-018-5931-z EDN: TKMBPK
- Monti CB, van Assen M, Stillman AE, et al. Evaluating the performance of a convolutional neural network algorithm for measuring thoracic aortic diameters in a heterogeneous population. Radiology: Artificial Intelligence. 2022;4(2):e210196. doi: 10.1148/ryai.210196 EDN: TJLGGM
- Hamelink II, de Heide EEJ, Pelgrim GJGJ, et al. Validation of an AI-based algorithm for measurement of the thoracic aortic diameter in low-dose chest CT. European Journal of Radiology. 2023;167:111067. doi: 10.1016/j.ejrad.2023.111067
- Kim J, Gupta D, LeComte M, et al. Abstract 17842: 3D visualization and quantitative assessment of the pulmonary arteries on CT using deep learning segmentation. Circulation. 2023;148(Suppl. 1). doi: 10.1161/circ.148.suppl_1.17842 EDN: WREUEP
Supplementary files