Role of chest MRI for the diagnosis of malignant pulmonary nodules: a systematic review and a meta-analysis
- Authors: Vasilev Y.A.1,2, Panina O.Y.1,2,3, Grik E.A.3, Akhmad K.S.1, Vasileva Y.N.3
-
Affiliations:
- Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies of Moscow Health Care
- City Clinical Oncological Hospital No. 1
- Moscow State University of Medicine and Dentistry named after A.I. Evdokimov
- Issue: Vol 2, No 3 (2021)
- Pages: 301-312
- Section: Systematic reviews
- Submitted: 07.05.2021
- Accepted: 04.07.2021
- Published: 15.10.2021
- URL: https://jdigitaldiagnostics.com/DD/article/view/70306
- DOI: https://doi.org/10.17816/DD70306
- ID: 70306
Cite item
Abstract
AIM: To evaluate the ability of magnetic resonance imaging (MRI) of the chest to detect malignant pulmonary nodules compared to compute tomography (CT).
MATERIALS AND METHODS: We searched the following databases with the final date of search on April 7th, 2021: PubMed, Google Scholar. We selected studies according to the inclusion and exclusion criteria that assessed the detection of malignant lung nodules by MRI and CT and included information about sensitivity and specificity. Method of the analysis and data grouping was chosen with regard to statistical heterogeneity of the studies included in the analysis. We used the χ2 test and I2 statistic to evaluate the heterogeneity.
RESULTS: We selected 168 articles for the systematic review from the PubMed and Google Scholar databases. We included 21 studies on 1,188 patients in the meta-analysis and revealed statistically significant heterogeneity (р<0,00001 for χ2 test; I2=99%) for sensitivity and specificity. Hence, we used a random-effect model for further analysis. As a result, values of sensitivity for detection of pulmonary nodules with MRI of 70.4%–100%, specificity ― from 60.6% to 100%.
CONCLUSIONS: Thus, MRI has sufficient sensitivity and specificity for detecting malignant pulmonary nodules primarily discovered with CT.
Keywords
Full Text
BACKGROUND
The solitary pulmonary nodule (SPN) is a single, delimited, rounded lesion with a diameter of <3 cm [1, 2]. SPN is completely surrounded by unchanged pulmonary tissue and is unrelated to atelectasis, the root of the lung, or mediastinum. This mass could be caused by benign processes such as hamartoma, infectious lesions, granulomatous inflammation, or malignant processes (primary lung cancer, metastatic disease, or lymphoma). Malignancy of nodules is assumed until proven otherwise [2].
Currently, computed tomography (CT) is the gold standard for assessing SPN and monitoring patients who are at risk of cancer [3]. CT, despite its many advantages, has a major disadvantage: high radiation exposure, which certainly increases in dynamic monitoring. With the development and improvement of hardware and software, the search for new alternative visualization methods becomes evident. Over the last two decades, research into the potential use of magnetic resonance imaging (MRI) for the diagnosis of chest diseases has resulted in a separate research area devoted to SPN detection by MRI. The advantage of MRI is the lack of ionizing radiation exposure and the optional quantitative assessment of the revealed changes even without the use of contrast agents.
The aim of the study was to compare the capabilities of chest MRI to standard CT for detecting malignant SPN.
METHODS
This work was designed according to the PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) standard [4].
Study type
Inclusion criteria:
- (I) Prospective case-control studies, retrospective case-control studies, prospective cohort studies, and retrospective cohort studies;
- (II) Studies that included a description of the use of MRI to detect malignant SPN;
- (III) CT as the reference method; and
- (IV) Availability of sensitivity and specificity data.
Exclusion criteria:
- (I) The full text of the paper was not available.
- (II) The study did not involve humans.
- (III) The study involved children.
- (IV) Case reports, case series studies, systematic reviews, and meta-analyses.
- (V) Combination of positron emission tomography (PET) and CT (PET/CT) or PET and MRI (PET/MRI); contrast-enhanced studies.
- (VI) Involvement of patients with pulmonary tuberculosis and other inflammatory lung diseases.
Participants
Patients over 18 years of age.
The review excluded patients for whom diagnostic data could not be obtained using standard reference methods (standard chest CT).
Interventions
Studies that assessed the ability of MRI and standard CT to detect SPN suspicious for malignancy.
Results
Primary results: numerical values of lung MRI sensitivity and specificity to assess the detection of malignant SPN.
Secondary results: identification of the most optimal MR pulse sequences.
Sources of information
The databases PubMed and Google Scholar were searched until April 7, 2021.
Search
Since PubMed takes approximately a month to assign the term MeSH to a published paper, two types of queries were used in the PubMed database, that is, MeSH library terms and keywords to search among recent articles:
“Magnetic Resonance imaging” [Mesh] or “MRI” and “Computed tomography” or “CT” and “Lung neoplasms” [Mesh] or “Solitary Pulmonary Nodule” [Mesh] and “Sensitivity” and “Specificity”;
“Lung MRI” or “chest MRI” and “Computed tomography” or “CT” and “lung cancer” or “Solitary Pulmonary Nodule”.
The query “MRI, CT, lung cancer, specificity, sensitivity” was used to search in the Google Scholar database.
Data collection and data items
Using the Google Spreadsheet service, a data extraction table was created. The authors had simultaneous and unrestricted access to the document. The following data was extracted from the selected papers by two researchers (O.Yu. Panina and Ye.A. Grik): title of the article, journal (or service for posting preprints), publication date, DOI, MRI protocol, MRI magnetic induction value, types of lesions revealed, sensitivity, specificity, and standard deviation for MRI and CT. After calculating the sensitivity and specificity indicators for each pulse sequence (PS) separately, the most effective values were included in the meta-analysis.
Three other researchers (E.S. Akhmad, Yu.N. Vasilyeva, and Yu.A. Vasilyev) verified the extracted data. All disagreements were resolved through discussion among the authors.
Risk of bias in selected studies
The authors used the QUADAS-2 (Quality Assessment of Diagnostic Accuracy Studies) checklist [5], which is recommended by the Agency for Healthcare Research and Quality (Cochrane Collaboration, US) for systematic reviews. Each of the selected papers was assessed based on four domains: patient selection, index test, reference test, and patient flow. For a detailed description of each domain and the judgment of the criteria used, see the Cochrane Handbook for Systematic Reviews of Interventions [6].
Statistical analysis
The selection of method for analyzing and grouping sensitivity and specificity data (random- or fixed-effects model) was performed according to the results of the study heterogeneity assessment. The χ2 criterion and I2 heterogeneity index were used to assess the statistical heterogeneity of the studies included in the meta-analysis. In the studies, statistically significant heterogeneity corresponds to p <0.10 in the χ2 criterion and I >40%. Moreover, meta-analysis was performed using the RevMan 5.4.1 software package.
RESULTS
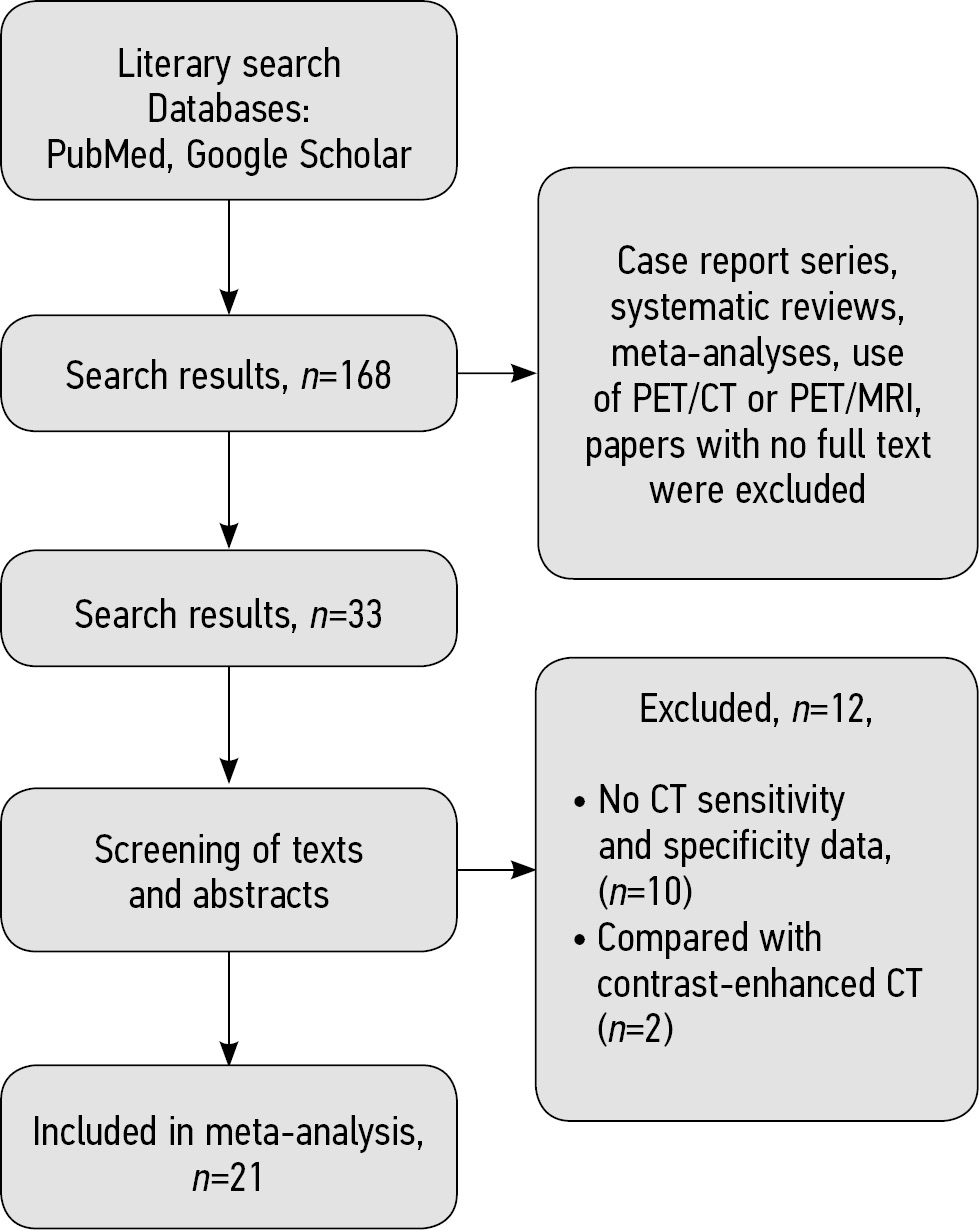
Based on search results in the PubMed and Google Scholar databases, 168 selected papers were imported into the Mendeley Reference Manager software library. Following a second check for inclusion and exclusion criteria and text review, 33 papers remained (Fig. 1).
Fig. 1. Flow diagram
A text review of the remaining 33 papers [7–38] revealed that two studies performed contrast-enhanced CT [23, 24], which is not an appropriate type of intervention. Furthermore, the sensitivity and specificity data for CT were completely absent in ten papers [20–22, 25–29, 31, 32], so these studies were excluded. The meta-analysis included papers in which a low-dose CT was used as a control study [9, 10, 16] rather than an exclusion criterion. Thus, the meta-analysis included 21 studies (see Fig. 1).
The selected studies included 1188 patients and contained information on lung MRI and CT scans. Sensitivity data for MRI and CT were presented in all papers; however, specificity rates were not reported in three articles [8, 16, 30]. The majority of the studies were performed on tomographs with magnetic field induction of 1.5 T (Table. 1).
Table 1. Characteristics of studies included in the meta-analysis
No. | Studies | Year | Magnetic field induction, T | MRI model and manufacturer | MRI PS |
1 | Both [7] | 2005 | 1,5 | Magnetom Vision, Siemens | VIBE, HASTE, T2TSE |
2 | Bruegel [8] | 2007 | 1,5 | Magnetom Sonata, Siemens | STIR |
3 | Chang [19] | 2015 | 1,5 | Intera Achieva, Philips | SS-TSE-HF |
4 | Cieszanowski [30] | 2016 | 1,5 | Magnetom Avanto, Siemens | T2TSE, T2-STIR, T2-HASTE |
5 | Dewes [33] | 2016 | 3,0 | Magnetom Prisma, Siemens | CAIPIRINHA-VIBE |
6 | Fatihoğlu [34] | 2019 | 1,5 | Magnetom Aera, Siemens | DWI (ADC) |
7 | Heye [35] | 2012 | 1,5 | Avanto, Siemens | VIBE, HASTE |
8 | Huang [39] | 2020 | 1,5 | Magnetom Aera, Siemens | UTE free-breathing |
9 | Koo [36] | 2019 | 3,0 | Magnetom Skyra, Siemens | T2FSE |
10 | Koyama [37] | 2008 | 1,5 | Intera, Philips | STIR |
11 | Koyama [38] | 2015 | 1,5 | Achieva, Philips | DWI (ADC) |
12 | Meier-Schroers [9] | 2016 | 1,5 | Ingenia, Philips | T2FSE |
13 | Meier-Schroers [10] | 2019 | 1,5 | Ingenia, Philips | T2STIR |
14 | Ohno [11] | 2017 | 3,0 | Vantage Titan, Canon Medical Systme | UTE |
15 | Regier [12] | 2011 | 1,5 | Achieva, Philips | DWI (ADC) |
16 | Satoh [13] | 2008 | 1,5 | Intera NovoDual, Philips | DWI (ADC) |
17 | Schaefer [14] | 2006 | 1,0 | Magnetom Expert, Siemens | PDWI |
18 | Schroeder [15] | 2005 | 1,5 | Magnetom Sonata, Siemens | HASTE |
19 | Sommer [16] | 2014 | 1,5 | Magnetom Avanto, Siemens | HASTE |
20 | Vogt [17] | 2004 | 1,5 | Magnetom Sonata, Siemens | HASTE |
21 | Yi [18] | 2007 | 3,0 | Achieva, Philips | T1WI 3D TFE* |
Note. MRI PS: pulse sequences of magnetic resonance imaging
Risk of bias
Eleven studies adequately reported the index test and reference test data [7, 8, 10–13, 15–18, 33]. The primary sources of errors were the index test (MRI) and its interpretation (Fig. 2). Some studies lacked complete data to assess the risk of bias, for example, whether the index test results were interpreted without knowing the results of the reference test, or whether interpretation of the reference test was impossible without knowing the results of the index test. Moreover, the risk of bias was characteristic of studies that were more likely to be published if an effect was found as opposed to those that did not. However, participants in all studies met the protocol criteria for this review.
Fig. 2. Histogram of the risk of bias
The meta-analysis revealed statistically significant heterogeneity (p <0.00001) using the χ2 criterion and the heterogeneity index (I2=99%) for sensitivity and specificity. In this case, the random-effects method was used to analyze the data.
Diagnostic accuracy of chest MRI
In each of the 21 studies, MRI was compared to the reference method. Sensitivity for MRI ranged from 70.4% to 100%, while the specificity ranged from 60.6% to 100% (Fig. 3). The mean MRI sensitivity was 88.3%, while the mean MRI specificity was 71.3%. In studies where the standard deviation parameters for sensitivity and specificity were not specified, the calculation was performed by estimating the values of the indicators [40].
Fig. 3. Forest plot of grouped data for specificity (a) and sensitivity (b) [40]
Note. SMD: standardized mean difference; CI: confidence interval
Table 2 shows the characteristics that were included in the meta-analysis of studies with the highest sensitivity and specificity values for MRI, which are comparable to CT.
DISCUSSION
The results of this meta-analysis show that MRI has lower mean specificity and sensitivity when compared to CT. In the majority of studies included in the meta-analysis, the sensitivity and specificity of chest CT for detecting SPN was 100%. Since CT was used as a reference test, only three studies had lower rates. For chest MRI, 5 of the 21 studies had 100% sensitivity, and only 2 studies had 100% sensitivity and specificity.
When the results of the meta-analysis were examined, high sensitivity rates were observed in studies that calculated overall sensitivity and specificity rates for the entire MR protocol rather than separately for each PS (see Table 2). This phenomenon demonstrates the peculiarity of the meta-analysis for MRI as a method in which the signal characteristics are assessed in conjunction with the scanning protocol. These examples may indicate a lack of research into MRI capabilities in the differential diagnosis of SPN, the need for studies of current PS, and the careful tuning of routine PS on a tomograph. This approach will allow for greater MRI efficiency in detecting SPN and studying their characteristics, which is especially important in lung cancer diagnosis.
Table 2. Characteristics of studies with the highest sensitivity and specificity values
No. | Author, year of study | Sensitivity (general index) | Specificity (general index) | MRI PS | Magnetic field induction, T |
1 | Both, 2005 [7] | 100 | 100 | VIBE, HASTE, T2TSE | 1,5 |
2 | Cieszanowski, 2016 [30] | 100 | - | T2TSE, T2-STIR, T2-HASTE | 1,5 |
3 | Meier-Schroers, 2016 [9] | 100 | 100 | T2FSE | 1,5 |
4 | Regier, 2011 [12] | 97 | 92,3 | DWI (ADC) | 1,5 |
5 | Heye, 2012 [35] | 100 | 100 | VIBE, HASTE | 1,5 |
6 | Schaefer, 2006 [14] | 100 | 75 | PDWI | 1,5 |
Note. MRI PS: pulse sequences of magnetic resonance imaging
Lung cancer continues to be the leading cause of death worldwide, including in the Russian Federation, and it is a serious social and economic problem [41, 42]. The presence of cancer among detected SPN ranges from 10% to 70% [2]. In some countries, low-dose CT is performed in high-risk groups as part of screening. Currently, the coverage of the screening program remains low, and the criteria for inclusion of patients are limited to ensure its economic viability. Thus, many patients will still be diagnosed after the onset of symptoms, rather than at an early stage of disease development and at a high cost of misdiagnosis [41]. Furthermore, radiologists and clinicians continue to face difficulties in monitoring and managing ambiguous SPN. Accordingly, only a comprehensive approach is always used for diagnosis, patient routing, and selection of optimal management and treatment strategies [43].
This meta-analysis revealed an alternative approach for assessing SPN that are suspicious for cancer. In addition, the emphasis was on standard studies that did not make use of contrast enhancement.
Limitations
There were several limitations to this study. For various reasons, the meta-analysis included data with lesions larger than 6 mm. First, nodule sizes greater than 6 mm are the most common in selected studies; second, nodules smaller than 6 mm have a fairly low risk of malignancy according to recent data from Fleischner Society [3]. In addition, the meta-analysis did not compare MRI with histologic data, which could be considered a limitation of the study.
CONCLUSIONS
MRI has the sensitivity and specificity needed for additional diagnosis of SPN that are suspicious for malignancy and revealed by CT. The mean MRI sensitivity was 88.3%, while the mean MRI specificity was 71.3%.
MRI is a non-ionizing imaging method that can be used as an additional technique in the evaluation of various PS while resolving controversial cases.
Further research into the most efficient PS, the feasibility of contrast enhancement, and new technological solutions for high-quality diagnostics of SPN is necessary.
ADDITIONAL INFORMATION
Funding source. The study had no sponsorship.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. Yury A. Vasilev — research concept, writing the manuscript, analysis and expert assessment of research results; Оlga Yu. Panina — research concept, search for publications, processing of the results, writing the manuscript; Evgeniia A. Grik — search for publications, processing of the results, Kate A. Akhmad — processing of the results, systematization and final editing of the review; Yulia N. Vasileva — analysis and expert assessment of research results, systematization and final editing of the review. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
About the authors
Yuriy A. Vasilev
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies of Moscow Health Care; City Clinical Oncological Hospital No. 1
Email: dr.vasilev@me.com
ORCID iD: 0000-0002-0208-5218
SPIN-code: 4458-5608
MD, Cand. Sci. (Med)
Russian Federation, 24/1 Petrovka str., 127051, Moscow; MoscowOlga Y. Panina
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies of Moscow Health Care; City Clinical Oncological Hospital No. 1; Moscow State University of Medicine and Dentistry named after A.I. Evdokimov
Email: o.panina@npcmr.ru
ORCID iD: 0000-0002-8684-775X
SPIN-code: 5504-8136
Scopus Author ID: 57219837311
Junior Scientist Researcher
Russian Federation, 24/1 Petrovka str., 127051, Moscow; Moscow; 20, p. 1, Delegatskaya str., Moscow, 127473Evgeniia A. Grik
Moscow State University of Medicine and Dentistry named after A.I. Evdokimov
Email: evgeniyagrik@gmail.com
ORCID iD: 0000-0002-7908-3982
SPIN-code: 5558-7307
MD
Russian Federation, 20/1, Delegatskaya str., Moscow, 127473Kate S. Akhmad
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies of Moscow Health Care
Email: e.ahmad@npcmr.ru
ORCID iD: 0000-0002-8235-9361
SPIN-code: 5891-4384
Russian Federation, 24/1, Petrovka street,127051 Moscow
Yulia N. Vasileva
Moscow State University of Medicine and Dentistry named after A.I. Evdokimov
Author for correspondence.
Email: drugya@yandex.ru
ORCID iD: 0000-0003-4955-2749
SPIN-code: 9777-2067
MD, Cand. Sci. (Med.)
Russian Federation, 20/1, Delegatskaya str., Moscow, 127473References
- Ost D, Fein AM, Feinsilver SH. Clinical practice. The solitary pulmonary nodule. N Engl J Med. 2003;348(25):2535–2542. doi: 10.1056/NEJMcp012290
- Nasim F, Ost DE. Management of the solitary pulmonary nodule. Curr Opin Pulm Med. 2019;25(4):344–353. doi: 10.1097/MCP.0000000000000586
- MacMahon H, Naidich DP, Goo JM, et al. Guidelines for management of incidental pulmonary nodules detected on CT images: From the Fleischner Society 2017. Radiology. 2017;284(1):228–243. doi: 10.1148/radiol.2017161659
- Liberati A, Altman DG, Tetzlaff J, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: Explanation and elaboration. PLoS Med. 2009;6(7):e1000100. doi: 10.1371/journal.pmed.1000100
- Whiting PF, Rutjes AW, Westwood ME, et al. Quadas-2: A revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011;155(8):529–536. doi: 10.7326/0003-4819-155-8-201110180-00009
- Higgins JP, Thomas J, Chandler J, et al. Cochrane handbook for systematic reviews of interventions. John Wiley & Sons, Hoboken; 2019. doi: 10.1002/9781119536604
- Both M, Schultze J, Reuter M, et al. Fast T1- and T2-weighted pulmonary MR-imaging in patients with bronchial carcinoma. Eur J Radiol. 2005;53(3):478–488. doi: 10.1016/j.ejrad.2004.05.007
- Bruegel M, Gaa J, Woertler K, et al. MRI of the lung: Value of different turbo spin-echo, single-shot turbo spin-echo, and 3D gradient-echo pulse sequences for the detection of pulmonary metastases. J Magn Reson Imaging. 2007;25(1):73–81. doi: 10.1002/jmri.20824
- Meier-Schroers M, Kukuk G, Homsi R, et al. MRI of the lung using the PROPELLER technique: Artifact reduction, better image quality and improved nodule detection. Eur J Radiol. 2016;85(4): 707–713. doi: 10.1016/j.ejrad.2015.12.016
- Meier-Schroers M, Homsi R, Schild HH, Thomas D. Lung cancer screening with MRI: characterization of nodules with different non-enhanced MRI sequences. Acta Radiol. 2019;60(2):168–176. doi: 10.1177/0284185118778870
- Ohno Y, Koyama H, Yoshikawa T, et al. Standard-, reduced-, and nodose thin-section radiologic examinations: Comparison of capability for nodule detection and nodule type assessment in patients suspected of having pulmonary nodules. Radiology. 2017;284(2):562–573. doi: 10.1148/radiol.2017161037
- Regier M, Schwarz D, Henes FO, et al. Diffusion-weighted MR-imaging for the detection of pulmonary nodules at 1.5 Tesla: Intraindividual comparison with multidetector computed tomography. J Med Imaging Radiat Oncol. 2011;55(3):266–274. doi: 10.1111/j.1754-9485.2011.02263.x
- Satoh S, Kitazume Y, Ohdama S, et al. Can malignant and benign pulmonary nodules be differentiated with diffusion-weighted MRI? Am J Roentgenol. 2008;191(2):464–470. doi: 10.2214/AJR.07.3133
- Schaefer JF, Schneider V, Vollmar J, et al. Solitary pulmonary nodules: Association between signal characteristics in dynamic contrast enhanced MRI and tumor angiogenesis. Lung Cancer. 2006;53(1):39–49. doi: 10.1016/j.lungcan.2006.03.010
- Schroeder T, Ruehm SG, Debatin JF, et al. Detection of pulmonary nodules using a 2D HASTE MR sequence: comparison with MDCT. Am J Roentgenol. 2005;185(4):979–984. doi: 10.2214/AJR.04.0814
- Sommer G, Tremper J, Koenigkam-Santos M, et al. Lung nodule detection in a high-risk population: Comparison of magnetic resonance imaging and low-dose computed tomography. Eur J Radiol. 2014;83(3):600–605. doi: 10.1016/j.ejrad.2013.11.012
- Vogt FM, Herborn CU, Hunold P, et al. HASTE MRI versus chest radiography in the detection of pulmonary nodules: comparison with MDCT. Am J Roentgenol. 2004;183(1):71–78. doi: 10.2214/ajr.183.1.1830071
- Yi CA, Jeon TY, Lee KS, et al. 3-T MRI: usefulness for evaluating primary lung cancer and small nodules in lobes not containing primary tumors. Am J Roentgenol. 2007;189(2):386–392. doi: 10.2214/AJR.07.2082
- Chang S, Hong SR, Kim YJ, et al. Usefulness of thin-section single-shot turbo spin echo with half-fourier acquisition in evaluation of local invasion of lung cancer. J Magn Reson Imaging. 2015;41(3):747–754. doi: 10.1002/jmri.24587
- Schaefer JF, Vollmar J, Schick F, et al. Solitary pulmonary nodules: Dynamic contrast-enhanced MR imaging ― Perfusion differences in malignant and benign lesions. Radiology. 2004;232(2):544–553. doi: 10.1148/radiol.2322030515
- Kono R, Fujimoto K, Terasaki H, et al. Dynamic MRI of solitary pulmonary nodules: comparison of enhancement patterns of malignant and benign small peripheral lung lesions. Am J Roentgenol. 2007;188(1):26–36. doi: 10.2214/AJR.05.1446
- Feng H, Shi G, Liu H, et al. Free-breathing radial volumetric interpolated breath-hold examination sequence and dynamic contrast-enhanced MRI combined with diffusion-weighted imaging for assessment of solitary pulmonary nodules. Magn Reson Imaging. 2021;75:100–106. doi: 10.1016/j.mri.2020.10.009
- Kim JH, Kim HJ, Lee KH, et al. Solitary pulmonary nodules: A comparative study evaluated with contrast-enhanced dynamic MR imaging and CT. J Comput Assist Tomogr. 2004;28(6):766–775. doi: 10.1097/00004728-200411000-00007
- Ohno Y, Nishio M, Koyama H, et al. Solitary pulmonary nodules: Comparison of dynamic first-pass contrast-enhanced perfusion area-detector CT, dynamic first-pass contrast-enhanced MR imaging, and FDG PET/CT. Radiology. 2015;274(2):563–575. doi: 10.1148/radiol.14132289
- Heye T, Sommer G, Miedinger D, et al. Ultrafast 3D balanced steady-state free precession MRI of the lung: Assessment of anatomic details in comparison to low-dose CT. J Magn Reson Imaging. 2015;42(3):602–609. doi: 10.1002/jmri.24836
- Akata S, Kajiwara N, Park J, et al. Evaluation of chest wall invasion by lung cancer using respiratory dynamic MRI. J Med Imaging Radiat Oncol. 2008;52(1):36–39. doi: 10.1111/j.1440-1673.2007.01908.x
- Hittmair K, Eckersberger F, Klepetko W, et al. Evaluation of solitary pulmonary nodules with dynamic contrast-enhanced MR imaging-a promising technique? Magn Reson Imaging. 1995;13(7):923–933. doi: 10.1016/0730-725x(95)02010-q
- Alper F, Kurt AT, Aydin Y, et al. The role of dynamic magnetic resonance imaging in the evaluation of pulmonary nodules and masses. Med Princ Pract. 2013;22(1):80–86. doi: 10.1159/000339475
- Frericks BB, Meyer BC, Martus P, et al. MRI of the thorax during whole-body MRI: Evaluation of different MR sequences and comparison to thoracic multidetector computed tomography (MDCT). J Magn Reson Imaging. 2008;27(3):538–545. doi: 10.1002/jmri.21218
- Cieszanowski A, Lisowska A, Dabrowska M, et al. MR imaging of pulmonary nodules: Detection rate and accuracy of size estimation in comparison to computed tomography. PLoS One. 2016;11(6):e0156272. doi: 10.1371/journal.pone.0156272
- Ohno Y, Hatabu H, Takenaka D, et al. Solitary pulmonary nodules: Potential role of dynamic MR imaging in management ― Initial experience. Radiology. 2002;224(2):503–511. doi: 10.1148/radiol.2242010992
- Zou Y, Zhang M, Wang Q, et al. Quantitative investigation of solitary pulmonary nodules: dynamic contrast-enhanced MRI and histopathologic analysis. Am J Roentgenol. 2008;191(1):252–259. doi: 10.2214/AJR.07.2284
- Dewes P, Frellesen C, Al-Butmeh F, et al. Comparative evaluation of non-contrast CAIPIRINHA-VIBE 3T-MRI and multidetector CT for detection of pulmonary nodules: In vivo evaluation of diagnostic accuracy and image quality. Eur J Radiol. 2016;85(1):193–198. doi: 10.1016/j.ejrad.2015.11.020
- Fatihoglu E, Biri S, Aydın S, et al. MRI in evaluation of solitary pulmonary nodules. Turkish Thorac J. 2019;20(2):90–96. doi: 10.5152/TurkThoracJ.2018.18049
- Heye T, Ley S, Heussel CP, et al. Detection and size of pulmonary lesions: How accurate is MRI? A prospective comparison of CT and MRI. Acta Radiol. 2012;53(2):153–160. doi: 10.1258/ar.2011.110445
- Koo CW, Lu A, Takahashi EA, et al. Can MRI contribute to pulmonary nodule analysis? J Magn Reson Imaging. 2019;49(7): e256–e264. doi: 10.1002/jmri.26587
- Koyama H, Ohno Y, Kono A, et al. Quantitative and qualitative assessment of non-contrast-enhanced pulmonary MR imaging for management of pulmonary nodules in 161 subjects. Eur Radiol. 2008;18(10):2120–2131. doi: 10.1007/s00330-008-1001-2
- Koyama H, Ohno Y, Seki S, et al. Value of diffusion-weighted MR imaging using various parameters for assessment and characterization of solitary pulmonary nodules. Eur J Radiol. 2015;84(3):509–515. doi: 10.1016/j.ejrad.2014.11.024
- Huang YS, Niisato E, Su MY, et al. Detecting small pulmonary nodules with spiral ultrashort echo time sequences in 1.5 T MRI. MAGMA. 2021;34(3):399–409. doi: 10.1007/s10334-020-00885-x
- Ying GS, Maguire MG, Glynn RJ,et al. Calculating sensitivity, specificity, and predictive values for correlated eye data. Investig Ophthalmol Vis Sci. 2020;61(11):29. doi: 10.1167/iovs.61.11.29
- Bradley SH, Kennedy MP, Neal RD. Recognising lung cancer in primary care. Adv Ther. 2019;36(1):19–30. doi: 10.1007/s12325-018-0843-5
- Nikolаev E, Gombolevskiy V, Gonchar AP, et al. Incidental findings during lung cancer screening by low-dose computed tomography. Tuberc Lung Dis. 2018;96(11):60–67. doi: 10.21292/2075-1230-2018-96-11-60-67
- Loverdos K, Fotiadis A, Kontogianni C, et al. Lung nodules: A comprehensive review on current approach and management. Ann Thorac Med. 2019;14(4):226–238. doi: 10.4103/atm.ATM_110_19
Supplementary files