Modern capabilities of artificial intelligence technologies in cardiovascular imaging
- Авторлар: Islamgulov A.K.1, Bogdanova A.S.2, Sufiiarov D.I.1, Chernyavskaya A.V.2, Bairakaeva E.R.1, Maksimova A.A.1, Nemychnikov N.V.1, Bikieva D.R.1, Shakhmaeva A.I.1, Burdina L.A.3, Bolekhan A.V.3, Akimov E.I.4, Shurakova Z.Z.1
-
Мекемелер:
- Bashkir State Medical University
- Kuban State Medical University
- Pskov State University
- Tula State University
- Шығарылым: Том 6, № 1 (2025)
- Беттер: 116-129
- Бөлім: Reviews
- ##submission.dateSubmitted##: 02.11.2024
- ##submission.dateAccepted##: 23.12.2024
- ##submission.datePublished##: 25.03.2025
- URL: https://jdigitaldiagnostics.com/DD/article/view/640895
- DOI: https://doi.org/10.17816/DD640895
- ID: 640895
Дәйексөз келтіру
Толық мәтін
Аннотация
Cardiovascular diseases are the leading cause of disability and mortality worldwide. The emergence of new technologies and integration of artificial intelligence with machine learning have broadened opportunities for doctors to improve the effectiveness of diagnostic and therapeutic measures. The development of artificial intelligence technologies, particularly in the fields of machine and deep learning, is rapidly attracting the interest of clinicians in creating novel, integrated, reliable, and efficient diagnostic methods to provide medical care. Cardiologists use various imaging-based diagnostic techniques, which provide more extensive quantitative data about patients.
This review summarizes current literature on the application of artificial intelligence technologies in diagnosing cardiovascular diseases and identifies knowledge gaps that require further research. Machine and deep learning methods are widely used and have shown promising results in cardiology. Convolutional neural networks have been used to measure cardiac function parameters from echocardiography results. Deep learning algorithms provide more accurate identification of stenosis and calcification in coronary arteries and characterization of plaques in cardiac CT scans. Convolutional neural networks have been employed for tasks such as automatic segmentation of heart chambers and structures, tissue property determination, and perfusion analysis using magnetic resonance imaging results. As artificial intelligence technologies, particularly machine learning, continue to develop, their integration opens up new possibilities.
Thus, artificial intelligence technologies are of great interest in healthcare, as they enable the rapid analysis of large amounts of data, demonstrating high effectiveness. artificial intelligence can provide additional assistance to specialists, contributing to enhanced workflow efficiency and improved medical care.
Негізгі сөздер
Толық мәтін
ВВЕДЕНИЕ
Сердечно-сосудистые заболевания (ССЗ) являются основной причиной инвалидизации и смертности во всём мире [1]. Их диагностика и лечение основаны на данных, полученных из историй болезни, а также результатов физикального обследования пациента, лабораторных исследований, инвазивных и неинвазивных методов визуализации. Появление новых технологий, внедрение искусственного интеллекта (ИИ) и машинного обучения (МО) открыли перед врачами возможности повышения эффективности диагностических и терапевтических мероприятий [2]. Наличие большого объёма данных, извлечённых из электронных медицинских карт, мобильных медицинских устройств и результатов визуализации, обеспечивает быстрое развитие алгоритмов ИИ в медицине. Кардиология — одна из немногих медицинских специальностей, в которой технологии ИИ изучали систематически [3].
ИИ включает в себя системы, действующие подобно человеческому интеллекту и обучающие принятию решений. Отмечают рост заинтересованности данной темой с 1950 года, когда A.M. Turing [4] начал думать над вопросом: могут ли компьютеры мыслить? Уже в 1955 году J. McCarthy и соавт. [5] впервые использовали словосочетание «искусственный интеллект». Он позволяет разрабатывать методы, предоставляющие компьютерам возможность принимать участие в таких процессах, как обучение и рассуждение. Многие методы данной технологии построены на основе алгоритмов МО, которые включают в себя различные процессы, обеспечивающие адаптацию параметров при решении той или иной задачи на основе обучающих данных [6]. Следует отметить, что системы ИИ могут принимать наилучшее из возможных решений.
Экспоненциальное развитие технологий ИИ, преимущественно в областях МО и глубокого обучения (ГО), стремительно привлекает интерес клиницистов к созданию новых интегрированных, надёжных и эффективных методов диагностики с целью оказания медицинской помощи. ГО — значительный шаг вперёд относительно решений проблем, связанных с накоплением, обработкой и дифференцировкой больших объёмов данных. На протяжении многих лет медицинское сообщество не могло решить существующие проблемы. Однако ГО отлично помогает выявлять сложные структуры в высокоразмерных данных и его возможно применять во многих областях науки [7]. Кроме того, системы ГО обучаемы и способны работать на основе исходных данных, например чисел, текста или даже их комбинаций [8].
Кардиологи используют большой спектр диагностических мероприятий, основанных на визуализации, что открывает им доступ к более обширным количественным сведениям о пациентах по сравнению со многими другими специалистами. Несмотря на некоторые потенциальные трудности, очевидно, что одним из лучших способов принятия решений, основанных на информационных данных, считают применение методов, ассоциированных с ИИ. Он требует тесного взаимодействия между учёными из области медицины и математиками, врачами, а также специалистами в области организации здравоохранения. В данный момент эффективность технологий ИИ оценивают в нескольких областях кардиологии — от систем поддержки принятия решений до обработки и последующей интерпретации изображений. Всё чаще предлагают новаторские идеи и практические методы, связанные с диагностикой и терапией ССЗ, основанные на технологиях ИИ, что открывает новые перспективы для развития кардиологии [9].
Такие методы визуализации, как эхокардиография (ЭхоКГ), магнитно-резонансная томография (МРТ) сердца и компьютерная томография (КТ), считают одними из ключевых диагностических инструментов, применяемых в кардиологии. Их использование позволяет получить подробную информацию о структуре и функции сердца, что помогает врачам выявлять различные нарушения и диагностировать ССЗ [10].
В последние годы с целью повышения точности диагностики и лечения ССЗ в кардиологии всё чаще применяют технологии ИИ. Использование алгоритмов ИИ, позволяющих проводить анализ изображений, обеспечивает быстрое и точное выявление патологий, а задействование прогностических моделей даёт возможность анализировать большие объёмы данных для выявления закономерностей и определения вероятности развития различных событий. Системы поддержки принятия решений, основанные на алгоритмах ИИ, могут помочь врачам в определении тактики лечения, а портативные устройства способствовать мониторингу состояния сердца, выявляя ранние признаки ССЗ. Непрерывное развитие и внедрение технологий ИИ в кардиологическую практику позволит добиться значительных успехов в диагностике и лечении ССЗ, что в итоге приведёт к улучшению качества жизни пациентов.
Однако несмотря на очевидный потенциал, применение технологий ИИ в современной клинической практике всё ещё ограничено, что делает актуальным дальнейшие исследования в данной области.
МЕТОДИКА ОТБОРА ДАННЫХ
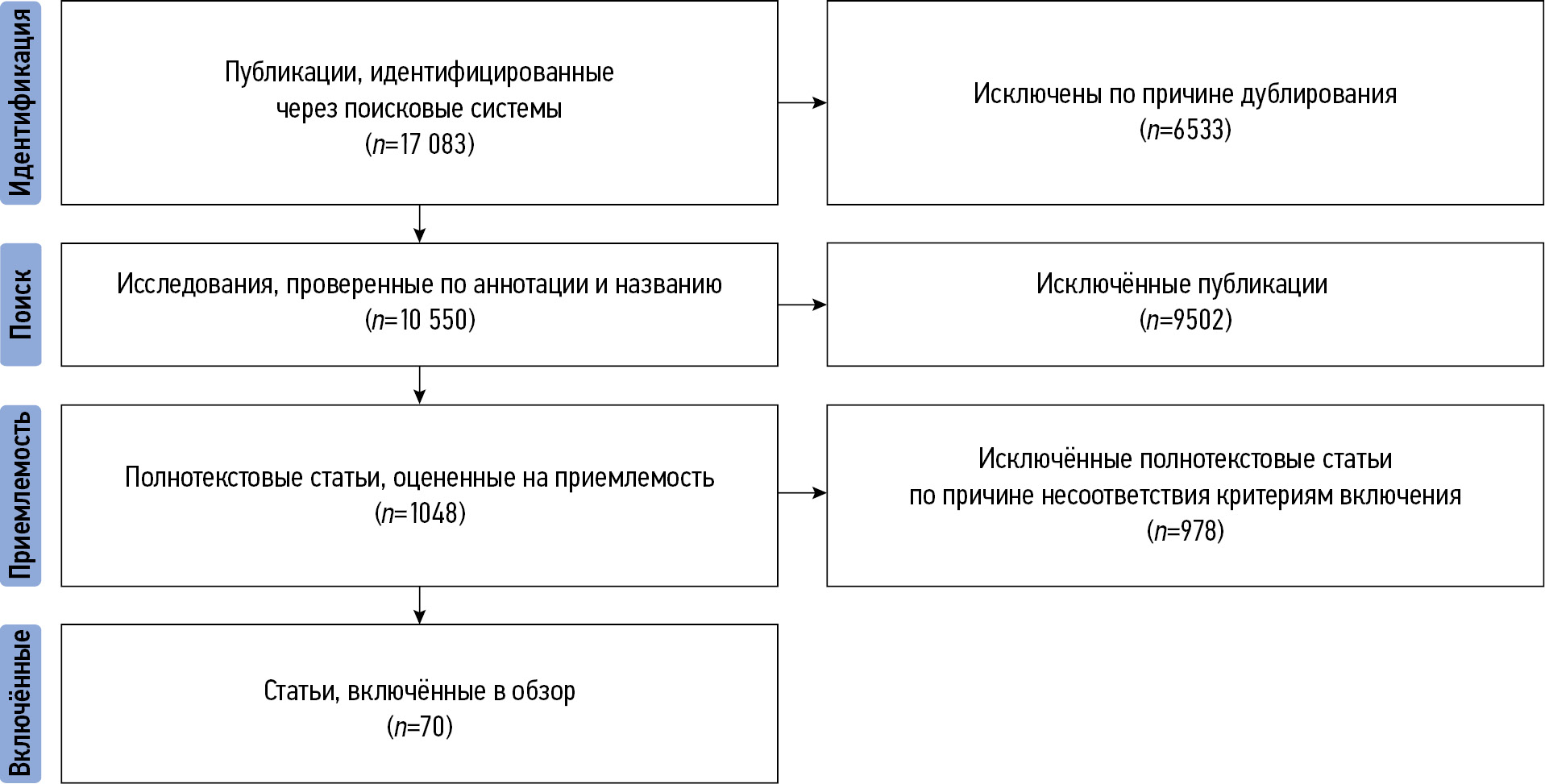
Мы провели поиск публикаций с помощью таких поисковых систем, как PubMed, Google Scholar и eLibrary. Отбирались статьи, опубликованные как на русском, так и на английском языках. Поиск осуществляли с использованием следующих ключевых слов на русском и английском языках: «искусственный интеллект и визуализация сердечно-сосудистой системы», «машинное обучение и сердечно-сосудистые заболевания», «глубокое обучение и сердечно-сосудистые заболевания», «визуализация сердечно-сосудистой системы», «artificial intelligence and cardiac imaging», «machine learning and cardiac imaging», «deep learning and cardiac imaging», «cardiac imaging». Все работы опубликованы в период с 1950 по 2024 год. При необходимости мы проводили дополнительный поиск иной релевантной литературы, касающейся клиникопрогностического значения применения технологий ИИ, а также трудностей, с которыми можно столкнуться при их использовании. Мы независимо друг от друга провели анализ заголовков и аннотаций статей, после чего извлекли полный текст релевантных исследований. В процессе подготовки обзора использован следующий алгоритм для отбора источников: до его начала исключали дубликаты; в процессе поиска мы анализировали названия и аннотации отобранных статей, проверяя их соответствие теме обзора и наличие полного текста (исключали тезисы, статьи и публикации, не имеющие полного текста); полнотекстовые рукописи оценивали на соответствие критериям включения.
В итоге в настоящий обзор включено 70 публикаций. Алгоритм отбора продемонстрирован на рис. 1.
Рис. 1. Алгоритм отбора первоисточников.
ИСКУССТВЕННЫЙ ИНТЕЛЛЕКТ В ВИЗУАЛИЗАЦИИ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
Кардиология — одна из областей медицины, где методы МО и ГО получили широкое распространение, а также продемонстрировали многообещающие результаты [3]. ИИ охватывает обширный спектр вычислительных технологий, позволяющих компьютерам решать задачи, которые обычно требуют человеческого интеллекта [11]. МО включает в себя алгоритмы, способные обучаться и принимать решения на основе имеющихся данных. В контексте визуализации сердечно-сосудистой системы данные технологии применяют в интерпретации результатов различных методов исследования, включая ЭхоКГ, КТ, МРТ и ядерную визуализацию [11].
ГО — это вид МО, использующий нейронные сети и получивший значительное распространение в медицинской визуализации благодаря своей способности автоматически изучать существующие данные, анализировать допущенные ошибки и делать более точные прогнозы [12]. Свёрточные нейронные сети (СНС) — один из видов архитектуры ГО, наиболее подходящий для анализа изображений. Они состоят из множества уровней, которые могут автоматически выделять необходимые признаки на медицинских изображениях, что делает данную технологию высокоэффективной в классификации, сегментации и обнаружении различных элементов [13].
СНС успешно задействованы при измерении параметров сердечной функции по результатам ЭхоКГ [13]. Алгоритмы ГО способствовали более точному выявлению стеноза и кальцификации коронарных артерий, а также определению характеристик бляшек по данным КТ сердца [14]. СНС применяли для решения таких задач, как автоматическая сегментация изображений структур сердца, определение свойств тканей и анализ перфузии по результатам МРТ [13].
Несмотря на то, что ГО привлекло значительное внимание, другие алгоритмы МО также играют немаловажную роль в визуализации сердечно-сосудистой системы. Метод опорных векторов применяют при классификации изображений и задач, а также стратификации риска [15]. Метод «случайного леса» (random forest) показал высокую эффективность в выборе значимых признаков и прогнозировании сердечно-сосудистых событий на основе биомаркёров, полученных в результате визуализации [16]. Алгоритм кластеризации, такой как метод k-средних, применяли для выявления типичных патологических признаков на медицинских изображениях [17]. Методы обучения без обратной связи и контроля, в частности генеративно-состязательные сети, продемонстрировали значительный потенциал в цветокоррекции изображений, улучшении их разрешения и создании синтетических данных, которые можно использовать в визуализации сердечно-сосудистой системы [18]. Такие подходы могут способствовать улучшению качества изображений, снижению дозы облучения и решению проблемы нехватки данных при разработке моделей МО.
Технологии ИИ активно применяют для автоматической сегментации и контроля качества медицинских изображений. Эти алгоритмы способны автоматически выделять области интереса, что упрощает анализ и интерпретацию данных. Кроме того, их используют для анализа сократительной способности миокарда и кровотока в коронарных артериях, позволяя более точно оценивать состояние сердечно-сосудистой системы [13].
Метод ГО задействован при анализе кальцификации сосудов по данным КТ. В рамках регистра CONFIRM проанализировано 13 054 результата КТ коронарных артерий (КТ-коронарография) пациентов с использованием алгоритмов МО, которые учитывали как клинические переменные, так и показатель кальцификации коронарных артерий по данным КТ-коронарографии. Это позволило с высокой точностью оценить вероятность обструктивной ишемической болезни сердца (ИБС) [19]. Исследования показали, что алгоритмы МО способны более эффективно выявлять её обструктивные формы по данным КТ-коронарографии по сравнению с визуальной оценкой врача-рентгенолога [3].
Алгоритмы МО, основанные на радиомикроскопии, возможно использовать для идентификации коронарных поражений [20]. Эффективность выявления различных особенностей атеросклеротических бляшек, микрокальцификаций и воспаления сосудов с помощью КТ-коронарографии выше при использовании радиомикроскопических платформ МО, чем при визуальной интерпретации врачом [21, 22].
По мере развития технологий ИИ, в частности МО, их интеграция открывает новые возможности. Несмотря на то что данные технологии демонстрируют большие перспективы в повышении точности и эффективности диагностики, для обеспечения их безопасного использования необходимо провести тщательную валидацию, а также учесть нормативные и этические аспекты.
РОЛЬ ИСКУССТВЕННОГО ИНТЕЛЛЕКТА В ТРАНСТОРАКАЛЬНОЙ ЭХОКАРДИОГРАФИИ
В связи с высокой распространённостью сердечной недостаточности (СН) среди населения повышается потребность в использовании такого метода диагностики, как ЭхоКГ, которую считают ключевой в оценке функциональной активности сердца [23]. Нехватка высококвалифицированных специалистов приводит к задержкам в диагностике и лечении, что влечёт за собой снижение качества жизни пациентов [24]. Технологии ИИ могут сыграть важную роль в решении вопросов, связанных с вариативностью получения и интерпретацией изображений медицинскими работниками [25]. ЭхоКГ позволяет оценить размер камер, движение стенок, функцию клапанов и, что особенно важно, фракцию выброса (ФВ) левого желудочка. Применение МО продемонстрировало точность оценки ФВ, сопоставимую с точностью, достигаемой врачами. [26, 27]. Интеграция технологий ИИ показала перспективные результаты, способствуя сокращению времени получения и обработки изображений для определения объёма левого желудочка и ФВ на 77% [28]. Они могут повысить эффективность и точность ЭхоКГ, что позволит улучшить качество оказания медицинской помощи пациентам в условиях постоянного роста заболеваемости ССЗ.
Одним из первых случаев применения технологий ИИ в интерпретации результатов ЭхоКГ стала оценка объёма и функции левого желудочка. Они способны улучшить качество полученных изображений, что помогает в их дальнейшей обработке. В 2015 году C. Knackstedt и соавт. [29] применили алгоритм МО с целью оценки ФВ и продольной деформации левого желудочка. Результаты показали, что среднее время анализа данных каждого пациента составило 8±1 с, а точность достигала 92,1%. Спустя год S. Narula и соавт. [30] исследовали диагностическую ценность МО в интерпретации результатов ЭхоКГ со спекл-трекингом с целью проведения автоматизированной дифференциальной диагностики гипертрофической кардиомиопатии и гипертрофии, наблюдаемой у спортсменов. В группе, состоящей из 77 спортсменов и 62 пациентов с гипертрофической кардиомиопатией, чувствительность и специфичность в рамках дифференциальной диагностики составила 87 и 82% соответственно.
J. Zhang и соавт. [31] с помощью 14 035 эхокардиограмм (продолжительность исследования 10 лет) обучили модель СНС решению ряда задач, в числе которых идентификация точек обзора, сегментация камер сердца, расчёт их объёма, массы, ФВ левого желудочка и автоматическое определение продольной деформации с помощью спекл-трекинга. Результаты измерений сопоставимы, а иногда и превосходили показатели, полученные вручную. Наконец, разработаны модели СНС для диагностики гипертрофической кардиомиопатии, сердечного амилоидоза и лёгочной гипертензии, продемонстрировавшие высокую эффективность [31].
Стоит отметить, что некоторые технологии ИИ могут способствовать оценке клапанных поражений сердца. Так, применение метода опорных векторов в рамках диагностики митральной регургитации обладает чувствительностью 99,38%, а его специфичность достигает 99,63% [32]. В частности, при нормальном состоянии митрального клапана, лёгкой, умеренной и тяжёлой митральной регургитации зарегистрирована точность 99,52, 99,38, 99,31 и 99,59% соответственно. Эффективность диагностики аортального стеноза с помощью алгоритмов ИИ оценивали в рамках исследования D. Playford и соавт. [33]. Авторы использовали для анализа данные 530 871 эхокардиограммы пациентов со средним сроком наблюдения 4,1 года: мужчины — 171 571; женщины — 158 404. Установлено, что ИИ в 95,3% случаев способен правильно определить высокоградиентный аортальный стеноз, в то время как применение уравнения непрерывности выявляло его только в 73,9% случаев. ИИ продемонстрировал эффективность как при нормальной, так и при нарушенной систолической функции левого желудочка.
Одним из недавних его достижений в интерпретации результатов ЭхоКГ является разработка алгоритма ГО на основе видеоматериалов, который превзошёл врачей в оценке ФВ и паттернов кардиомиопатии, а также сегментации левого желудочка [34]. Расхождение в результатах, полученных с помощью данного алгоритма, эквивалентны или даже меньше, чем при оценке сердечной функции кардиологами. Это подтверждает высокую точность и надёжность алгоритма. Кроме того, применение технологий ИИ ассоциировано с более быстрым проведением процедуры, что позволяет оптимизировать рабочие процессы и снижать время ожидания для пациентов. Всё это приводит к улучшению качества медицинской помощи. EchoNet-Dynamic — это алгоритм ГО, использующий трёхмерные СНС с архитектурой R2+1D. В качестве входных данных алгоритм использует видеоматериал эхокардиограмм из 32 кадров, в которых ИИ сначала определяет временную характеристику изображения (по размерам желудочка) с помощью его сегментирования, а затем и пространственную. Для обучения авторы использовали более 10 тыс. видеофайлов. Данная модель является одной из наиболее успешных среди тех, которые способны на основе видеозаписей эхокардиограмм производить измерение показателя ФВ и других параметров, не уступая опытным специалистам. Применение таких технологических решений может способствовать более точному их измерению с оптимизацией затрат времени, что улучшит диагностику многих ССЗ [34].
Использование СНС демонстрирует высокую точность при сегментации левого желудочка, определении показателя ФВ и анализе деформации миокарда желудочков [35]. Подобные автоматизированные подходы позволяют сэкономить время и повысить качество результатов. Системы на основе алгоритмов МО эффективны в отношении обнаружения и классификации клапанных заболеваний сердца и имеют точность, сравнимую с данными, полученными опытными специалистами [35]. Кроме того, модели ИИ обучены выявлять закономерности, связанные с кардиомиопатиями, что может способствовать ранней диагностике и стратификации риска [3].
ИСКУССТВЕННЫЙ ИНТЕЛЛЕКТ И МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ СЕРДЦА
МРТ сердца — это метод визуализации, используемый для диагностики ССЗ. Она позволяет оценить морфологию сердца, его функцию, перфузию и количественно измерить объём интерстициальной ткани миокарда. Данный метод рекомендуют пациентам, имеющим неинформативные данные ЭхоКГ, для оценки анатомических особенностей и функционального состояния сердца, систолической и диастолической дисфункции [36]. МРТ сердца широко применяют в диагностике кардиомиопатий, врождённых и приобретённых пороков сердца, поражений перикарда, ИБС, а также опухолей сердца. Эти задачи требуют получения изображений, имеющих высокое временное и пространственное разрешение, что приводит к увеличению длительности исследования. Интеграция МО может привести к повышению эффективности исследования и точности интерпретации данных. Наиболее важные задачи, решаемые с помощью ГО, — построение изображения, его сегментация и контроль качества [37].
Несмотря на то что МРТ сердца выполняют с высоким разрешением, интерпретация её результатов врачом может сопровождаться ошибками и требовать много времени. С целью автоматизированного получения информации из изображений МРТ применяли методологию ГО [38]. Автоматизированную двухмерную СНС использовали для приёма данных МРТ в качестве исходного материала. Она изучала особенности томограмм с помощью СНС, объединяла их и проводила сегментацию по пикселям [38]. В рамках исследования проводили сравнение точности определения объёмов камер левого желудочка, массы и ФВ у 110 пациентов. Выявлено, что точность СНС сравнима с опытным специалистом, однако производительность при использовании ИИ выше в 186 раз [39]. В другом исследовании применяли МО для выявления диагностических признаков лёгочной артериальной гипертензии по результатам МРТ. Алгоритм способен осуществлять её дифференциальную диагностику с более высокой точностью, чем при ручном измерении. Кроме того, диагностика с использованием МО занимала меньше времени (в пределах 10 с) и имела меньшую вариабельность [40].
N.A. Farrag и соавт. [41] разработали полностью автоматизированный алгоритм для сегментации сердца, способный охватывать область от верхушки до основания и работать во всех фазах сердечной деятельности. Алгоритм автоматической сегментации также изучали O. Bernard и соавт. [42], они смогли достичь коэффициента сходства по Дайсу ≥0,95 по сравнению с ручным измерением. A.S. Fahmy и соавт. [43, 44] представили СНС, способную автоматически определять массу левого желудочка и объём рубца с помощью методики отсроченного накопления гадолиния у пациентов с гипертрофической кардиомиопатией.
W. Bai и соавт. [38] обучили 16-слойную СНС автоматическому анализу изображений МРТ на основе данных 4875 пациентов из Великобритании. Эффективность метода оценивали с помощью коэффициента Дайса и определения:
- конечного диастолического объёма (КДО) и конечного систолический объёма (КСО) левого желудочка, а также его массы;
- КДО и КСО правого желудочка.
При анализе изображений МРТ 600 пациентов данный алгоритм продемонстрировал высокую эффективность сегментации:
- левого и правого желудочка — коэффициент Дайса 0,94 и 0,90 соответственно;
- левого и правого предсердия по длинной оси — коэффициент Дайса 0,93 и 0,96 соответственно.
Результаты использования СНС в анализе изображений МРТ демонстрируют, что их показатели сопоставимы с данными, полученными опытными специалистами [38]. Стоит отметить, что СНС способна с высокой точностью выполнить сегментацию в случае, если обучающие данные получены с помощью одного и того же аппарата МРТ, однако его эффективность снижается, если изображения получены с помощью различных аппаратов. C. Chen и соавт. [45] разработали двухмерную СНС, использовавшую базу данных, содержащую результаты исследований 3975 пациентов. В их работе для стабилизации и улучшения скорости обучения после каждого скрытого конволюционного слоя применяли пакетную нормализацию. Результаты показали, что предложенный метод достиг более высокой общей точности сегментации при меньшей дисперсии по сравнению с данными, полученным в других исследованиях [38, 45].
Постконтрастные изображения МРТ с целью оценки отсроченного контрастирования миокарда (позднее накопление гадолиния) предоставляют возможность определить его состояние. Важным примером является связь между наличием и протяжённостью очагов позднего накопления гадолиния и неблагоприятными исходами у пациентов с гипертрофической кардиомиопатией [46]. Однако проведение данной процедуры имеет ряд ограничений, поскольку её следует с осторожностью применять у пациентов с тяжёлой почечной недостаточностью или аллергией на контрастное вещество, содержащее гадолиний [47]. В недавнем рандомизированном контролируемом исследовании, включавшем 1348 пациентов с гипертрофической кардиомиопатией, использовали новую технологию проведения МРТ с ГО, названную виртуальным нативным усилением (ВНУ). Она позволила получить изображения, идентичные стандартным — полученным при проведении отсроченного контрастирования гадолинием, но без использования контрастного вещества [48]. Алгоритм ГО обрабатывал и усиливал сигналы нативных T1-карт (T1 релаксация тканей) и синусоидальных изображений (последовательности изображений в различных фазах сердечной деятельности). Каждый поток имел архитектуру U-сети кодер–декодер. Кодер вычислял характеристики изображения, от мелких до грубых, и создавал многомасштабные снимки, которые декодер объединял для получения окончательных данных. Карты признаков из U-сетей объединяли и вводили в следующую СНС для получения итогового изображение. Модель обучали с помощью генеративно-состязательных сетей. В ходе сравнения авторы определили, что качество изображения, полученного с помощью ВНУ, выше, чем при проведении МРТ с отсроченным контрастированием гадолинием. Данные методы показали высокую эффективность в отношении визуально-пространственного распределения и количественной оценки поражения миокарда. Они схожи, однако технология ВНУ не требует внутривенного введения контрастного вещества, поэтому её можно проводить повторно для подтверждения результатов исследования. Это делает данную технологию привлекательной для клинического применения, позволяя расширить возможности МРТ относительно диагностики других патологий в будущем [48].
Применение технологий ИИ в интерпретации результатов МРТ сердца направлено на совершенствование процесса получения, оптимизации и анализа изображений [38]. Методы ГО можно использовать для автоматической сегментации сердца, что способствует более быстрой и качественной оценке сердечной функции [49]. Помимо этого, алгоритмы ИИ способны оценивать кровоток, выявляя ишемию, а также состояние тканей, что позволяет определять фиброз [50]. Внедрение технологий ИИ в процесс анализа и расшифровки результатов МРТ может способствовать мониторингу кардиомиопатий, воспалительных заболеваний сердца и ИБС.
ПРИМЕНЕНИЕ ИСКУССТВЕННОГО ИНТЕЛЛЕКТА В РАМКАХ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ СЕРДЦА И КОРОНАРНЫХ АРТЕРИЙ
КТ — один из наиболее развивающихся методов инструментальной диагностики, связанных с получением и анализом изображений. Технологии ИИ помогают интерпретировать результаты КТ с целью диагностики различных патологий, в частности миокарда, клапанов сердца и коронарных артерий [50]. Они способны улучшать качество изображений и проводить их автоматический анализ, включая оценку выраженности кальцификации коронарных артерий.
Оценка риска развития ИБС является фундаментальным аспектом в снижении числа сердечно-сосудистых событий в будущем. Традиционные модели прогнозирования связаны с определёнными ограничениями, включая различия между когортами и отсутствие важных переменных. Внедрение технологий МО в клиническую практику предоставляет надёжные инструменты прогнозирования, способные с высокой точностью предсказывать развитие ИБС [52]. КТ-коронарография — это малоинвазивное исследование, позволяющее оценить проходимость коронарных артерий. Применение технологий ИИ предоставляет возможность качественной и количественной оценки атеросклероза и определения степени стеноза [53]. Методы МО применяют в КТ-коронарографии для получения изображений высокого качества, определения паттернов патологии, повышая точность диагностических мероприятий и способствуя более качественной стратификации риска. С целью сравнения стратификации рисков проведено исследование 8844 пациентов с последующим анализом ROC-кривой и вычислением значения площади под характеристической кривой (AUC) [54]. При среднем сроке наблюдения 4,6±1,5 года показатель AUC имел более высокое значение при использовании МО. Его также применяли для оценки выраженности кальцификации коронарных артерий у 13 054 пациентов с установленной ИБС или подозрением на неё [19]. Выявлено, что технология МО позволила увеличить выявляемость ИБС примерно на 9%. В подгруппе с пациентами до 65 лет данный показатель увеличился до 17% [19]. D. Han и соавт. [55] изучали стратификацию риска с помощью МО в здоровой популяции из 85 945 участников, где алгоритм ИИ использовали для прогнозирования умеренного (кальцификация коронарных артерий >100) и высокого риска (кальцификация коронарных артерий >400) развития ИБС. Результаты исследования показали, что умеренный и высокий риск ИБС отмечен в 8,4 и 2,4% случаев соответственно. Применение алгоритмов МО превосходит обычную шкалу прогнозирования как при умеренном, так и при высоком риске развития ИБС, что говорит о большей эффективности использования данных технологий.
В исследовании M. Motwani и соавт. [56], длительность которого составила 5 лет, изучали эффективность применения алгоритмов МО в интерпретации результатов КТ-коронарографии 10 030 пациентов с подозрением на ИБС. КТ-коронарографию провели всем пациентам в соответствии с клиническими показаниями. МО реализовывало автоматический выбор признаков путём ранжирования информации, построение модели с помощью алгоритма, использующего логистическую регрессию LogitBoost и кросс-валидацию на протяжении всего процесса. Первичным результатом данной работы считали оценку смертности от всех причин. За пятилетний период наблюдения умерло 745 пациентов. Использование технологий МО с целью комплексной оценки предикторов позволило более эффективно оценить пятилетнюю смертность от всех причин, что подтверждает более высокое значение AUC.
Технологии ИИ также можно применять в рамках диагностики острого коронарного синдрома [53]. Большинство его случаев обусловлено нестабильными и необструктивными атеросклеротическими бляшками. Имеющиеся в настоящее время неинвазивные диагностические методы, выявляющие стеноз коронарной артерии или стресс-индуцированную ишемию миокарда, не способны определить данные патологические изменения. Установлено, что воспаление сосудов вызывает образование и разрыв атеросклеротических бляшек, приводя к развитию острого коронарного синдрома. Такой показатель, как индекс плотности периваскулярной жировой ткани (FAI), измеряющийся в единицах рентгеновской плотности Хаунсфилда (HU), позволяет интерпретировать данные с учётом возраста и пола, что повышает их клиническую значимость. Он не только помогает в оценке выраженности коронарного воспаления, но и в прогнозировании риска, принимая во внимание факторы риска и распределение бляшек в коронарных артериях [57].
Прогностическая ценность индекса FAI изучена в исследовании с участием 1872 пациентов, прошедших КТ-коронарографию [58]. В рамках работы проводили определение FAI трёх коронарных артерий. Данный показатель вокруг левой передней нисходящей и проксимального участка правой коронарной артерии ассоциировался с ростом смертности от всех причин. Для него определили значение, которое составило −70,1 HU. Превышение данного значение сопровождается резким ростом сердечной смертности. Данное исследование позволило предположить, что определение индекса FAI может обеспечить повышение эффективности прогнозирования кардиологического риска. Применение данной технологии способствует раннему лечению пациентов с нестабильными атеросклеротическими бляшками на фоне отсутствия клинических проявлений ИБС, потенциально снижая риск развития инфаркта миокарда у представителей данной группы.
Технологии ИИ продемонстрировали отличные результаты в анализе изображений и оценке рисков. Алгоритмы ГО способны оценивать кальцификацию коронарных артерий в автоматизированном режиме, что обеспечивает быструю и точную диагностику данного состояния [59]. Помимо этого, технологии ИИ помогают в стратификации риска ИБС. Так, автоматическая оценка миокарда левого желудочка, основанная на алгоритмах ИИ, с использованием однократного сканирования при проведении КТ-коронарографии в состоянии покоя может быть эффективным инструментом для выявления пациентов с функционально значимым стенозом коронарных артерий без оценки их анатомии. Этот подход способен снизить количество инвазивных измерений фракционного резерва кровотока, оптимизируя диагностический процесс и минимизируя риски для пациентов [60]. Такие алгоритмы могут автоматически сегментировать изображения коронарных артерий, идентифицируя бляшки и оценивая их состав, что может сократить время, необходимое для интерпретации изображений и повысить эффективность диагностики. Кроме того, существуют модели ИИ, способные, основываясь на снимках, давать характеристику ткани миокарда, прогнозируя неблагоприятные исходы [20]. Применение технологий ИИ открывает перспективы для персонализированной оценки рисков и планирования лечения.
R.W. van Hamersvelt и соавт. [61] с помощью результатов КТ-коронарографии оценили степень стеноза коронарных артерий с целью выявления пациентов со стресс-индуцированной ишемией. В данном исследовании использовали несколько методов ИИ: на первом этапе СНС сегментировала изображения миокарда левого желудочка, затем с помощью метода опорных векторов пациенты разделены на группу с наличием и отсутствием функционально значимого стеноза коронарных артерий. Применение данного метода ассоциировано с улучшением диагностической точности (AUC=0,76). Чувствительность и специфичность составили 84,6 и 48,4% cсоответственно.
B.M. Kelm и соавт. [62] применили алгоритм МО для автоматической идентификации и классификации стенозов коронарных артерий. Метод «случайного леса» задействовали на 229 изображениях. Модель обеспечила точную идентификацию стеноза и оценку площади поперечного сечения просвета при среднем времени обработки 1,8 с на случай. M. Zreik и соавт. [63] обучили СНС точному обнаружению атеросклеротических бляшек в коронарных артериях, определению их состава и наличия обструкции. Для обнаружения и определения характеристик коронарной бляшки разработанный метод показал точность 0,77, однако в отношении выявления стеноза и оценки его анатомической значимости точность составила 0,80.
ОГРАНИЧЕНИЯ СУЩЕСТВУЮЩИХ ИССЛЕДОВАНИЙ И ДАЛЬНЕЙШИЕ ПЕРСПЕКТИВЫ
Эффективность моделей ИИ в значительной степени зависит от качества и стандарта обучающих данных. Использование различных протоколов получения изображений и вариативность калибровки могут создать проблемы в процессе обработки и интерпретации результатов [64]. Кроме того, отсутствие стандартов маркировки, работы с шумами и артефактами снижает точность алгоритмов ИИ. В связи с этим важное значение имеет создание мультиинституциональных баз данных и разработка протоколов визуализации [65].
Многие модели ИИ, в частности ГО, функционируют без ведома пользователя, основываясь лишь на алгоритме и обучающих данных, что не позволяет специалистам понять на чём базируются их результаты, приводя к скептицизму и нежеланию внедрять их в клиническую практику. С целью решения данной проблемы разрабатывают объяснимые методы ИИ, такие как анализ важности признаков и байесовские сети [66].
Интеграция технологий ИИ затрагивает важные нормативные и этические вопросы, касающиеся права на сохранность данных. Необходимо разработать механизмы, способные обеспечить безопасную и эффективную работу его алгоритмов. Важно отметить, что вопрос ответственности за дефекты работы ИИ, связанные с диагностикой пациента, остаётся открытым. Этот аспект поднимает множество юридических и этических вопросов, включая то, кто будет нести ответственность в случае ошибки — разработчик алгоритма, медицинское учреждение, использующее технологию, или сам врач, принимающий окончательное решение на основе результатов диагностики. Сложность заключается в том, что ИИ может принимать решения на основе больших объёмов данных, что делает их трудными для анализа и объяснения. Именно поэтому необходимо дальнейшее обсуждение и разработка нормативных актов, способствующих ясности в вопросах ответственности и обеспечивающих безопасность пациентов при использовании технологий ИИ в медицине [67].
ЗАКЛЮЧЕНИЕ
Технологии ИИ представляют большой интерес в сфере здравоохранения, поскольку они предоставляют возможность анализировать обширные объёмы информации в короткие сроки, демонстрируя высокую эффективность. В рамках кардиологической практики и визуализации сердечно-сосудистой системы данные технологии показали хорошие результаты. Учитывая, что продуктивность технологий ИИ зависит от качества используемых данных, важно сосредоточить своё внимание на решении вопросов более масштабного обмена данными с учётом этических норм. ИИ способен прогнозировать возможные исходы, тем не менее полную автоматизацию данного метода обеспечить невозможно, поскольку персонализированные параметры каждого пациента существенно отличаются.
Технологии ИИ могут предоставлять дополнительную помощь специалистам, способствуя повышению эффективности рабочего процесса и оказания медицинской помощи. Алгоритмы, используемые ИИ, должны пройти тщательные проспективные клинические исследования, прежде чем будут внедрены в повседневную кардиологическую практику.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении поисково-аналитической работы.
Раскрытие интересов. Авторы заявляют об отсутствии отношений, деятельности и интересов (личных, профессиональных или финансовых), связанных с третьими лицами (коммерческими, некоммерческими, частными), интересы которых могут быть затронуты содержанием статьи, а также иных отношений, деятельности и интересов за последние три года, о которых необходимо сообщить.
Вклад авторов. А.Х. Исламгулов, А.С. Богданова, Д.И. Суфияров, А.В. Чернявская — концепция работы, согласование финальной версии рукописи; Е.Р. Байракаева, А.А. Максимова, Н.В. Немычников, Д.Р. Бикиева, А.И. Шахмаева, Л.А. Бурдина, А.В. Болехан, Е.И. Акимов, З.З. Шуракова ― сбор и анализ литературных данных, написание и редактирование текста рукописи. Все авторы одобрили рукопись (версию для публикации), а также согласились нести ответственность за все аспекты работы и гарантировали, что вопросы, связанные с точностью или добросовестностью любой части работы, будут должным образом рассмотрены и решены.
ADDITIONAL INFORMATION
Funding source. This article was not supported by any external sources of funding.
Disclosure of interests. The authors declare that they have no relationships, activities or interests (personal, professional or financial) with third parties (commercial, non-commercial, private) whose interests may be affected by the content of the article, as well as no other relationships, activities or interests over the past three years that must be reported.
Authors’ contribution. A.Kh. Islamgulov, A.S. Bogdanova, D.I. Sufiyarov, A.V. Chernyavskaya: concept of the work, coordination of the final version of the manuscript; E.R. Bayrakaeva, A.A. Maksimova, N.V. Nemychnikov, D.R. Bikieva, A.I. Shakhmayeva, L.A. Burdina, A.V. Bolekhan, E.I. Akimov, Z.Z. Shurakova: collection and analysis of literature data, writing and editing the article. Thereby, all authors provided approval of the version to be published and agree to be accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Авторлар туралы
Almaz Islamgulov
Bashkir State Medical University
Хат алмасуға жауапты Автор.
Email: aslmaz2000@rambler.ru
ORCID iD: 0000-0003-0567-7515
SPIN-код: 8701-3486
Ресей, Ufa
Alina Bogdanova
Kuban State Medical University
Email: balinochka25@gmail.com
ORCID iD: 0009-0004-9333-5164
Ресей, Krasnodar
Damir Sufiiarov
Bashkir State Medical University
Email: damur_5@mail.ru
ORCID iD: 0009-0004-3516-6307
SPIN-код: 3311-2947
Ресей, Ufa
Alina Chernyavskaya
Kuban State Medical University
Email: alinaxxx909@gmail.com
ORCID iD: 0009-0007-8071-1150
Ресей, Krasnodar
Elena Bairakaeva
Bashkir State Medical University
Email: bairakaeva_0@mail.ru
ORCID iD: 0009-0004-7683-5781
Ресей, Ufa
Anastasia Maksimova
Bashkir State Medical University
Email: antasiamks@gmail.com
ORCID iD: 0009-0003-4115-2887
Ресей, Ufa
Nikita Nemychnikov
Bashkir State Medical University
Email: nikita.nemychnikov2001@gmail.com
ORCID iD: 0009-0001-8841-3373
Ресей, Ufa
Diana Bikieva
Bashkir State Medical University
Email: bikieva.dina@mail.ru
ORCID iD: 0009-0006-5453-5686
SPIN-код: 7078-7424
Ресей, Ufa
Alsu Shakhmaeva
Bashkir State Medical University
Email: shakhmaeva02@mail.ru
ORCID iD: 0009-0002-8805-9172
Ресей, Ufa
Lyubov Burdina
Pskov State University
Email: lubovburdina19@gmail.com
ORCID iD: 0009-0004-9199-2515
Ресей, Pskov
Aleksandr Bolekhan
Pskov State University
Email: sasha-x500@mail.ru
ORCID iD: 0009-0009-3458-2858
Ресей, Pskov
Egor Akimov
Tula State University
Email: egor.akimov.2001@mail.ru
ORCID iD: 0009-0002-2504-5363
Ресей, Tula
Zilya Shurakova
Bashkir State Medical University
Email: divaeva.zilya@mail.ru
ORCID iD: 0009-0007-9625-9787
Ресей, Ufa
Әдебиет тізімі
- Kosolapov VP, Yarmonova MV. The analysis of high cardiovascular morbidity and mortality in the adult population as a medical and social problem and the search for ways to solve it. Ural Medical Journal. 2021;20(1):58–64. doi: 10.52420/2071-5943-2021-20-1-58-64 EDN: HCWKUA
- Yeo KK. Artificial intelligence in cardiology: did it take off? Russian Journal for Personalized Medicine. 2023;2(6):16–22. doi: 10.18705/2782-3806-2022-2-6-16-22 EDN: UIENOT
- Xu B, Kocyigit D, Grimm R, et al. Applications of artificial intelligence in multimodality cardiovascular imaging: a state-of-the-art review. Progress in Cardiovascular Diseases. 2020;63(3):367–376. doi: 10.1016/j.pcad.2020.03.003
- Turing AM. I.–Computing machinery and intelligence. Mind. 1950;LIX(236):433–460. doi: 10.1093/mind/LIX.236.433
- McCarthy J, Minsky ML, Rochester N, Shannon CE. A proposal for the dartmouth summer research project on artificial intelligence. AI Mag. 1955;27(4):12. doi: 10.1609/aimag.v27i4.1904
- Komkov AA, Mazaev VP, Ryazanova SV, et al. First study of the RuPatient health information system with optical character recognition of medical records based on machine learning. Cardiovascular Therapy and Prevention. 2022;20(8):91–96. doi: 10.15829/1728-8800-2021-3080 EDN: VOUGRB
- LeCun Y, Bengio Y, Hinton G. Deep learning. Nature. 2015;521:436–444. doi: 10.1038/nature14539
- Gritskov IO, Govorov AV, Vasiliev AO, et al. Data Science – deep learning of neural networks and their application in healthcare. City Healthcare. 2021;2(2):109–115. doi: 10.47619/2713-2617.zm.2021.v2i2;109-115 EDN: SGWBPD
- Vardas PE, Asselbergs FW, van Smeden M, Friedman P. The year in cardiovascular medicine 2021: digital health and innovation. Eur Heart J. 2022;43(4):271–279. doi: 10.1093/eurheartj/ehab874 EDN: CCJAGO
- Maltseva AN, Kop’eva KV, Mochula AV, et al. Association of impaired myocardial flow reserve with risk factors for cardiovascular diseases in patients with nonobstructive coronary artery disease. Russian Journal of Cardiology. 2023;28(2):50–59. (In Russ.) doi: 10.15829/1560-4071-2023-5158 EDN: FNSYNE
- Topol EJ. High-performance medicine: the convergence of human and artificial intelligence. Nat Med. 2019;25(1):44–56. doi: 10.1038/s41591-018-0300-7 EDN: OQSRZW
- Donahue J, Hendricks LA, Rohrbach M, et al. Long-term recurrent convolutional networks for visual recognition and description. IEEE Trans Pattern Anal Mach Intell. 2017;39(4):677–691. doi: 10.1109/TPAMI.2016.2599174
- Sarvamangala DR, Kulkarni RV. Convolutional neural networks in medical image understanding: a survey. Evol Intell. 2022;15(1):1–22. doi: 10.1007/s12065-020-00540-3 EDN: GOCYDD
- Zeleznik R, Foldyna B, Eslami P, et al. Deep convolutional neural networks to predict cardiovascular risk from computed tomography. Nat Commun. 2021;12(1):1–9. doi: 10.1038/s41467-021-20966-2 EDN: KYJQRH
- Amini M, Pursamimi M, Hajianfar G, et al. Machine learning-based diagnosis and risk classification of coronary artery disease using myocardial perfusion imaging SPECT: a radiomics study. Sci Rep. 2023;13(1):14920. doi: 10.1038/s41598-023-42142-w EDN: HGXHIT
- Ambale-Venkatesh B, Yang X, Wu CO, et al. Cardiovascular event prediction by machine learning: the multi-ethnic study of atherosclerosis. Circ Res. 2017;121(9):1092–1101. doi: 10.1161/CIRCRESAHA.117.311312
- Ntalianis E, Cauwenberghs N, Sabovčik F, et al. Feature-based clustering of the left ventricular strain curve for cardiovascular risk stratification in the general population. Front Cardiovasc Med. 2023;10:1263301. doi: 10.3389/fcvm.2023.1263301 EDN: VEPAAS
- Zhao J, Hou X, Pan M, Zhang H. Attention-based generative adversarial network in medical imaging: a narrative review. Comput Biol Med. 2022;149:105948. doi: 10.1016/j.compbiomed.2022.105948 EDN: TBRKVW
- Al'Aref SJ, Maliakal G, Singh G, et al. Machine learning of clinical variables and coronary artery calcium scoring for the prediction of obstructive coronary artery disease on coronary computed tomography angiography: analysis from the CONFIRM registry. Eur Heart J. 2020;41(3):359–367. doi: 10.1093/eurheartj/ehz565 EDN: UYDWAD
- Oikonomou EK, Siddique M, Antoniades C. Artificial intelligence in medical imaging: a radiomic guide to precision phenotyping of cardiovascular disease. Cardiovasc Res. 2020;116(13):2040–2054. doi: 10.1093/cvr/cvaa021 EDN: JJYPCZ
- Fleg JL, Stone GW, Fayad ZA, et al. Detection of high-risk atherosclerotic plaque: report of the NHLBI Working Group on current status and future directions. JACC Cardiovasc Imaging. 2012;5(9):941–955. doi: 10.1016/j.jcmg.2012.07.007
- Chen Q, Zhou F, Xie G, et al. Advances in artificial intelligence-assisted coronary computed tomographic angiography for atherosclerotic plaque characterization. Rev Cardiovasc Med. 2024;25(1):27. doi: 10.31083/j.rcm2501027 EDN: OLVUVT
- Zvartau NE, Solovyova AE, Endubaeva GV, et al. Analysis of the information about the incidence of heart failure, associated mortality and burden on the healthcare system, based on the encoding data in 15 subjects of the Russian Federation. Russian Journal of Cardiology. 2023;28(2S):9–15. doi: 10.15829/1560-4071-2023-5339 EDN: YOUIRD
- Miller PK, Waring L, Bolton GC, Sloane C. Personnel flux and workplace anxiety: personal and interpersonal consequences of understaffing in UK ultrasound departments. Radiography (Lond). 2019;25(1):46–50. doi: 10.1016/j.radi.2018.07.005
- Gao XF, Ge Z, Kong XQ, et al. 3-Year Outcomes of the ULTIMATE Trial Comparing Intravascular Ultrasound Versus Angiography-Guided Drug-Eluting Stent Implantation. JACC Cardiovasc Interv. 2021;14(3):247–257. doi: 10.1016/j.jcin.2020.10.001 EDN: RXYWYL
- Osipova OA, Kontsevaya AV, Demko VV, et al. Elements of artificial intelligence in a predictive personalized model of pharmacotherapy choice in patients with heart failure with mildly reduced ejection fraction of ischemic origin. Cardiovascular Therapy and Prevention. 2023;22(7):16–24. doi: 10.15829/1728-8800-2023-3619 EDN: XLOMXO
- Luong CL, Jafari MH, Behnami D, et al. Validation of machine learning models for estimation of left ventricular ejection fraction on point-of-care ultrasound: insights on features that impact performance. Echo Res Pract. 2024;11(1):9. doi: 10.1186/s44156-024-00043-2
- Olaisen S, Smistad E, Espeland T, et al. Automatic measurements of left ventricular volumes and ejection fraction by artificial intelligence: clinical validation in real time and large databases. Eur Heart J Cardiovasc Imaging. 2024;25(3):383–395. doi: 10.1093/ehjci/jead280 EDN: ALCWDT
- Knackstedt C, Bekkers SC, Schummers G, et al. Fully automated versus standard tracking of left ventricular ejection fraction and longitudinal strain: the FAST-EFs multicenter study. J Am Coll Cardiol. 2015;66(13):1456–1466. doi: 10.1016/j.jacc.2015.07.052
- Narula S, Shameer K, Salem Omar AM, et al. Machine-learning algorithms to automate morphological and functional assessments in 2D echocardiography. J Am Coll Cardiol. 2016;68(21):2287–2295. doi: 10.1016/j.jacc.2016.08.062
- Zhang J, Gajjala S, Agrawal P. Fully automated echocardiogram interpretation in clinical practice. Circulation. 2018;138(16):1623–1635. doi: 10.1161/CIRCULATIONAHA.118.034338
- Sehly A, Jaltotage B, He A. Artificial intelligence in echocardiography: the time is now. Rev Cardiovasc Med. 2022;23(8):256. doi: 10.31083/j.rcm2308256 EDN: LTPRNG
- Playford D, Bordin E, Mohamad R, et al. Enhanced diagnosis of severe aortic stenosis using artificial intelligence: a proof-of-concept study of 530,871 echocardiograms. JACC Cardiovasc Imaging. 2020;13(4):1087–1090. doi: 10.1016/j.jcmg.2019.10.013 EDN: QKVLDF
- Zhang Y, Wang M, Zhang E, Wu Y. Artificial intelligence in the screening, diagnosis, and management of aortic stenosis. Rev Cardiovasc Med. 2024;25(1):31. doi: 10.31083/j.rcm2501031 EDN: MGUQSK
- Ouyang D, He B, Ghorbani A. Video-based AI for beat-to-beat assessment of cardiac function. Nature. 2020;580(7802):252–256. doi: 10.1038/s41586-020-2145-8
- Tereshchenko SN, Zhirov IV, Uskach TM, et al. Eurasian association of cardiology (EAC)/ The National society of heart failure and myocardial disease (NSHFMD) Guidelines for the diagnosis and and treatment of chronic heart failure (2020). Eurasian heart journal. 2020;(3):6–76. doi: 10.38109/2225-1685-2020-3-6-76 EDN: WPQNAB
- Bustin A, Fuin N, Botnar RM, Prieto C. From compressed-sensing to artificial intelligence-based cardiac MRI reconstruction. Front Cardiovasc Med. 2020;7:17. doi: 10.3389/fcvm.2020.00017
- Bai W, Sinclair M, Tarroni G, et al. Automated cardiovascular magnetic resonance image analysis with fully convolutional networks. J Cardiovasc Magn Reson. 2018;20(1):1–12. doi: 10.1186/s12968-018-0471-x EDN: XCDICM
- Bhuva AN, Bai W, Lau C. A multicenter, scan-rescan, human and machine learning CMR study to test generalizability and precision in imaging biomarker analysis. Circ Cardiovasc Imaging. 2019;12(10):e009214. doi: 10.1161/CIRCIMAGING.119.009214
- Celant LR, Wessels JN, Marcus JT. Toward the implementation of optimal cardiac magnetic resonance risk stratification in pulmonary arterial hypertension. Chest. 2024;165(1):181–191. doi: 10.1016/j.chest.2023.07.028 EDN: KJHFYB
- Farrag NA, Lochbihler A, White JA, Ukwatta E. Evaluation of fully automated myocardial segmentation techniques in native and contrast-enhanced T1-mapping cardiovascular magnetic resonance images using fully convolutional neural networks. Med Phys. 2021;48(1):215–226. doi: 10.1002/mp.14574
- Bernard O, Lalande A, Zotti C. Deep learning techniques for automatic MRI cardiac multi-structures segmentation and diagnosis: is the problem solved? IEEE Trans Med Imaging. 2018;37(11):2514–2525. doi: 10.1109/TMI.2018.2837502
- Fahmy AS, Rausch J, Neisius U. Automated cardiac MR scar quantification in hypertrophic cardiomyopathy using deep convolutional neural networks. JACC Cardiovasc Imaging. 2018;11(12):1917–1918. doi: 10.1016/j.jcmg.2018.04.030
- Fahmy AS, Neisius U, Chan RH, et al. Three-dimensional deep convolutional neural networks for automated myocardial scar quantification in hypertrophic cardiomyopathy: a multicenter multivendor study. Radiology. 2020;294(1):52–60. doi: 10.1148/radiol.2019190737
- Chen C, Bai W, Davies RH, et al. Improving the generalizability of convolutional neural network-based segmentation on CMR images. Front Cardiovasc Med. 2020;7:105. doi: 10.3389/fcvm.2020.00105
- Sinitsyn VE, Mershina EA, Larina OM. Cardiac magnetic resonance imaging opportunities in the diagnosis of cardiomyopathy. Clinical and Experimental Surgery. Petrovsky journal. 2014;(1):54–63. EDN: SDUECR
- Khludova LG. Hypersensitivity reactions to contrast media. Astma i allergiya. 2019;(2):8–11. (In Russ.) EDN: GVMUZB
- Zhang Q, Burrage MK, Lukaschuk E, et al. Toward replacing late gadolinium enhancement with artificial intelligence virtual native enhancement for gadolinium-free cardiovascular magnetic resonance tissue characterization in hypertrophic cardiomyopathy. Circulation. 2021;144(8):589–599. doi: 10.1161/CIRCULATIONAHA.121.054432 EDN: BJCVTF
- Leiner T, Rueckert D, Suinesiaputra A, et al. Machine learning in cardiovascular magnetic resonance: basic concepts and applications. J Cardiovasc Magn Reson. 2019;21(1):1–14. doi: 10.1186/s12968-019-0575-y EDN: UTXASC
- Knott KD, Seraphim A, Augusto JB, et al. The prognostic significance of quantitative myocardial perfusion: an artificial intelligence-based approach using perfusion mapping. Circulation. 2020;141(16):1282–1291. doi: 10.1161/CIRCULATIONAHA.119.044666 EDN: HORRTM
- Shesternikova OP, Finn VK, Lesko KA, Vinokurova LV. Intelligent system for predicting the feasibility of using computed tomography. Artificial Intelligence and Decision Making. 2022;(2):3–16. doi: 10.14357/20718594220201 EDN: QSUQRY
- Krittanawong C, Virk HUH, Bangalore S, et al. Machine learning prediction in cardiovascular diseases: a meta-analysis. Sci Rep. 2020;10(1):16057. doi: 10.1038/s41598-020-72685-1 EDN: TUAGSP
- Abdulalimov TP, Obrezan AG. Artificial intelligence capabilities in predicting coronary artery disease. Cardiology: News, Opinions, Training. 2022;10(1):34–39. doi: 10.33029/2309-1908-2022-10-1-34-39 EDN: JRHPMV
- van Rosendael AR, Maliakal G, Kolli KK, et al. Maximization of the usage of coronary CTA derived plaque information using a machine learning based algorithm to improve risk stratification; insights from the CONFIRM registry. J Cardiovasc Comput Tomogr. 2018;12(3):204–209. doi: 10.1016/j.jcct.2018.04.011
- Han D, Kolli KK, Gransar H, et al. Machine learning based risk prediction model for asymptomatic individuals who underwent coronary artery calcium score: comparison with traditional risk prediction approaches. J Cardiovasc Comput Tomogr. 2020;14(2):168–176. doi: 10.1016/j.jcct.2019.09.005
- Motwani M, Dey D, Berman DS, et al. Machine learning for prediction of all-cause mortality in patients with suspected coronary artery disease: a 5-year multicentre prospective registry analysis. Eur Heart J. 2017;38(7):500–507. doi: 10.1093/eurheartj/ehw188
- Klüner LV, Chan K, Antoniades C. Using artificial intelligence to study atherosclerosis from computed tomography imaging: a state-of-the-art review of the current literature. Atherosclerosis. 2024;398:117580. doi: 10.1016/j.atherosclerosis.2024.117580 EDN: BGKJLP
- Oikonomou EK, Marwan M, Desai MY, et al. Non-invasive detection of coronary inflammation using computed tomography and prediction of residual cardiovascular risk (the CRISP CT study): a post-hoc analysis of prospective outcome data. Lancet. 2018;392(10151):929–939. doi: 10.1016/S0140-6736(18)31114-0 EDN: CFUNJT
- Wolterink JM, Leiner T, de Vos BD, et al. Automatic coronary artery calcium scoring in cardiac CT angiography using paired convolutional neural networks. Med Image Anal. 2016;34:123–136. doi: 10.1016/j.media.2016.04.004
- Zreik M, Lessmann N, van Hamersvelt RW, et al. Deep learning analysis of the myocardium in coronary CT angiography for identification of patients with functionally significant coronary artery stenosis. Med Image Anal. 2018;44:72–85. doi: 10.1016/j.media.2017.11.008
- van Hamersvelt RW, Zreik M, Voskuil M, et al. Deep learning analysis of left ventricular myocardium in CT angiographic intermediate-degree coronary stenosis improves the diagnostic accuracy for identification of functionally significant stenosis. Eur Radiol. 2019;29(5):2350–2359. doi: 10.1007/s00330-018-5822-3 EDN: WVYVWW
- Kelm BM, Mittal S, Zheng Y, et al. Detection, grading and classification of coronary stenoses in computed tomography angiography. Med Image Comput Comput Assist Interv. 2011;14(Pt 3):25–32. doi: 10.1007/978-3-642-23626-6_4
- Zreik M, van Hamersvelt RW, Wolterink JM, et al. A recurrent CNN for automatic detection and classification of coronary artery plaque and stenosis in coronary CT angiography. IEEE Trans Med Imaging. 2019;38(7):1588–1598. doi: 10.1109/TMI.2018.2883807
- Bluemke DA, Moy L, Bredella MA, et al. Assessing radiology research on artificial intelligence: a brief guide for authors, reviewers, and readers-from the radiology editorial board. Radiology. 2020;294(3):487–489. doi: 10.1148/radiol.2019192515
- Oakden-Rayner L, Dunnmon J, Carneiro G, Ré C. Hidden stratification causes clinically meaningful failures in machine learning for medical imaging. In: Proc ACM Conf Health Inference Learn (CHIL 2020). Association for Computing Machinery. New York, 2020. P. 151–159. doi: 10.1145/3368555.3384468
- Tjoa E, Guan C. A survey on explainable artificial intelligence (XAI): toward medical XAI. IEEE Trans Neural Netw Learn Syst. 2021;32(11):4793–4813. doi: 10.1109/TNNLS.2020.3027314 EDN: BZXVNY
- DeGrave AJ, Janizek JD, Lee SI. AI for radiographic COVID-19 detection selects shortcuts over signal. Nature Machine Intelligence. 2021;3(7):610–619. doi: 10.1038/s42256-021-00338-7 EDN: MMHUHL
Қосымша файлдар