Саркопения: современные подходы к решению диагностических задач
- Авторы: Сморчкова А.К.1, Петряйкин А.В.1, Семенов Д.С.1, Шарова Д.Е.1
-
Учреждения:
- Научно-практический клинический центр диагностики и телемедицинских технологий
- Выпуск: Том 3, № 3 (2022)
- Страницы: 196-211
- Раздел: Обзоры
- Статья получена: 31.08.2022
- Статья одобрена: 19.09.2022
- Статья опубликована: 17.10.2022
- URL: https://jdigitaldiagnostics.com/DD/article/view/110721
- DOI: https://doi.org/10.17816/DD110721
- ID: 110721
Цитировать
Аннотация
Саркопения является относительно новым диагнозом для медицинской статистики и системы здравоохранения, и тем не менее представляет социальное и экономическое бремя для системы здравоохранения из-за большого количества возможных неблагоприятных исходов, таких как повышение риска падений, физическая инвалидизация, увеличение времени пребывания в стационаре и увеличение смертности.
Несмотря на то, что узкоспециализированного медикаментозного лечения для саркопении не существует, профилактика и своевременное немедикаментозное лечение помогут снизить риск потенциальных неблагоприятных последствий.
Для установки диагноза саркопении необходимо подтверждение снижения не только мышечной силы, но и мышечной массы. Инструментальная диагностика включает в себя такие методы, как двухэнергетическая рентгеновская абсорбциометрия и биоимпедансометрия. Дополнением к этим методам могут быть алгоритмы искусственного интеллекта для автоматической сегментации мышечной и жировой ткани на компьютерно-томографических и магнитно-резонансных изображениях с последующим расчётом скелетно-мышечного индекса на уровне L3 позвонка. Такое программное обеспечение при его использовании в структурах, подобных Единому радиологическому информационному сервису Единой медицинской информационно-аналитической системы г. Москвы, открывает возможности для оппортунистического скрининга. Тем не менее общепризнанных количественных значений L3 скелетно-мышечного индекса для компьютерно-томографической и магнитно-резонансной диагностики саркопении пока не существует, несмотря на признание данных методик золотым стандартом Европейской рабочей группой по саркопении у пожилых людей. В дополнение к этому существует проблема унификации термина «скелетно-мышечный индекс».
При решении указанных проблем с помощью дальнейших популяционных исследований станет возможным получение новой методики инструментальной диагностики саркопении с последующим её применением для скрининга данного патологического состояния.
Ключевые слова
Полный текст
ВВЕДЕНИЕ
В настоящее время всё больше внимания уделяется системным заболеваниям и состояниям, связанным с общим изменением состава тела человека, в том числе вследствие старения населения. Одной из таких нозологий является саркопения (sarcopenia, от греч. sarx ― мышцы, плоть, penia ― нехватка). Это заболевание входит в синдром старческой астении, или «хрупкости» (Frailty-синдром).
Первое рабочее определение саркопении было опубликовано в 2010 г.; код саркопении, определённый в 2016 г. для МКБ-10, сохраняется в МКБ-11. Таким образом, это относительно новый диагноз для медицинской статистики и системы здравоохранения.
Саркопения ― прогрессирующее генерализованное заболевание скелетной мускулатуры, ассоциированное с повышением риска неблагоприятных исходов, включая падения, переломы, физическую инвалидизацию и смертность [1]. Под термином «саркопения» в гериатрии подразумевают первичную саркопению ― состояние, характеризуемое прогрессирующей генерализованной потерей силы, массы и функции скелетных мышц вследствие старения без других причин [2].
Саркопения влечёт за собой множество отрицательных последствий и исходов, а также неблагоприятных воздействий на организм, таких как увеличение риска падений и, как следствие, переломов [3], физическая инвалидизация [4]. Саркопения связана также с длительностью госпитализаций и более тяжёлыми исходами при многих заболеваниях [5].
Учитывая потенциальное бремя для экономики и здравоохранения, актуальны своевременная диагностика саркопении и профилактика её последствий.
Целью нашего обзора является оценка реальной значимости саркопении в масштабах крупного мегаполиса (Москва), а также определение путей оптимизации диаг-ностики данного состояния.
САРКОПЕНИЯ: ПУТИ ОПТИМИЗАЦИИ ДИАГНОСТИКИ ПАТОЛОГИЧЕСКОГО СОСТОЯНИЯ
Эпидемиология
Первичная саркопения ассоциирована со старением, поэтому ей наиболее подвержены пациенты пожилого возраста. В литературе существуют данные о начале утраты функции мышечной ткани уже с 50 лет [6], однако в клиническом контексте принято рассматривать возрастные группы от 60 лет и старше.
По данным ряда обзоров [7, 8], распространённость саркопении в общей популяции составляет 10% (жители старше 60 лет). Помимо половой принадлежности и отношения к определённой социальной группе [самостоятельно проживающие пожилые (community-dwelling); контингент домов престарелых и специализированных клиник], различия в распространённости зависят от метода диагностики данного состояния: тесты, биоимпедансометрия, двухэнергетическая рентгеновская абсорциометрия, компьютерная и магнитно-резонансная томография.
В России эпидемиологические исследования с крупной выборкой на момент написания данной статьи не проводились. Имеется работа [9] с выборкой из 230 амбулаторных пациентов старше 65 лет, где распространённость саркопении оценивается в 30% по критериям Eвропейской рабочей группы по саркопении у пожилых людей (European Working Group on Sarcopenia in Older People, EWGSOP) и Международной рабочей группы по саркопении (International Working Group on Sarcopenia, IWGS), что не согласуется с данными вышеприведённых обзоров. Возможными причинами расхождений могут быть малый размер выборки и её несбалансированность (95,6% женщин), поэтому данные требуют уточнения.
Влияние саркопении на качество жизни и систему здравоохранения
Саркопения существенно снижает качество жизни, приводя к вынужденному ограничению физических нагрузок [10], что ещё более усугубляет положение пациента. Отрицательное влияние наблюдается как в здоровой, так и страдающей от острых, хронических и онкологических заболеваний популяции [11, 12]. Качество жизни пациентов оценивается с помощью опросников общего назначения Short Form-36 (SF-36)1 и EuroQoL (EQ-5D)2, а также с помощью эффективного специализированного опросника SarQoL (Sarcopenia and Quality of Life) [13−16], доступного на русском языке [17]. При оценке качества жизни по этим опросникам используется стобалльная система. В SF-36 представлена шкала значений от 0 до 100, где 0 соответствует худшему, а 100 ― лучшему качеству жизни. В EQ-5D финальный результат также представлен стобалльной шкалой, но 0 соответствует самому худшему, а 100 ― наилучшему состоянию здоровья.
Помимо снижения качества жизни, саркопения обусловливает существенные экономические затраты для системы здравоохранения. Существуют исследования, описывающие денежные затраты на пациентов с саркопенией и без неё (медиана общих расходов на госпитализацию, средние расходы здравоохранения на человека за 3 мес, расходы на постоперационные мероприятия в течение 90 дней). В частных случаях увеличение затрат на суммарные госпитализационные расходы для пациентов с саркопенией может составлять в среднем до $14,322 на человека [18]. Необходимо иметь в виду, что имеющиеся исследования в основном рассматривают расходы, связанные с госпитализацией для выполнения хирургических вмешательств (например, онкохирургия), используют разные способы диагностики, а также не имеют унифицированных пограничных значений для подтверждения диаг-ноза саркопении [19]. Для более точной оценки общих затрат системы здравоохранения на пациентов с саркопенией необходимы дальнейшие исследования с использованием более однородной выборки, а также дополнением за счёт иных клинических сценариев (в особенности анализ расходов в амбулаторном звене).
Лечение саркопении
В настоящее время не существует унифицированного и узкоспецифического подхода к лечению саркопении. Тем не менее понимание патофизиологии процесса позволяет подбирать возможные варианты терапии. Существуют немедикаментозные и медикаментозные способы лечения саркопении. Среди немедикаментозных методов наиболее эффективными являются физические упражнения, в особенности силовые [20]. В настоящее время они являются наиболее экономически доступным способом не только долговременной профилактики саркопении, но и поддержки и улучшения общего физического здоровья [21]. Для улучшения и закрепления набора мышечной массы и силы используются пищевые добавки, такие как протеины (в том числе сывороточные), антиоксидантные агенты и длинноцепочечные полиненасыщенные жирные кислоты [22]. При немедикаментозной терапии саркопении рекомендуется начинать с физических упражнений как с метода, имеющего более высокую доказательность, нежели изменение диеты [23]. В качестве медикаментозной терапии рассматриваются такие средства, как витамин D [24], селективные модуляторы рецепторов андрогенов, антагонисты миостатина, активина [25], однако на данный момент их эффективность требует дальнейшего подтверждения за счёт большего количества клинических исследований.
Диагностика саркопении
В настоящее время в клинической практике диагностика саркопении зачастую основывается на простых анамнестических данных ― жалобах на симптомы и признаки, свойственные заболеванию: падения, чувство слабости, медленная скорость ходьбы, сложность при вставании из сидячего положения [26]. Для объективизации диагностики, а также в качестве скрининга EWGSOP рекомендует использование опросника SARC-F (Strength, Assistance with walking, Rising from a chair, Climbing stairs, and Falls) [27], учитывающего как силу, так и помощь при ходьбе, подъёме со стула и по лестнице, падениях. Тем не менее ввиду средней чувствительности (25; 31,6; 50%) и высокой специфичности (81,4; 82,4; 81,8%) теста, согласно критериям диагноза EWGSOP, Фонда Национальных институтов здравоохранения США (Foundation for the National Institutes of Health, FNIH) и Международной рабочей группы по саркопении (International Working Group on Sarcopenia, IWGS) [30] соответственно, опросник в большинстве случаев склонен к выявлению только тяжёлых случаев саркопении.
В России саркопения диагностируется не в виде отдельной нозологии, а как компонент синдрома старческой астении; для первичного скрининга используется шкала «Возраст не помеха», а для дальнейшего уточнения диагноза ― комплексная гериатрическая оценка [2].
Для корректной диагностики саркопении необходимо использование инструментальных методов диагностики. Требуется измерение двух параметров ― мышечной силы (включая физическую работоспособность) и мышечной массы [1]. Низкая мышечная сила означает возможность наличия саркопении; для подтверждения диагноза необходимы методы оценки мышечной массы [1].
Для измерения мышечной силы наиболее простым и доступным способом является использование ручного динамометра для оценки силы хвата с последующим сравнением полученных данных с референтными значениями в популяции [1]. Сила хвата хорошо коррелирует с общей мышечной силой, однако для наиболее достоверных результатов необходимо рассматривать разные мышечные группы [29]. Нормативные данные для определения низкой мышечной силы при кистевой динамометрии определяются полом и индексом массы тела (ИМТ): так, у мужчин с ИМТ от 24,1 до 28 пороговым значением является сила пожатия <30 кг, а у женщин с ИМТ от 23,1 до 26 ― <17,3 кг [2]. Для оценки работоспособности применяется тест подъёма со стула [2], могут использоваться тесты «Встань и иди», тест скорости ходьбы, входящие в краткую батарею инструментов по оценке физического состояния (Short Physical Performance Battery, SPPB). При измерении скорости ходьбы пациенту предлагается пройти 4 м с привычной для него скоростью, при этом отмечается время прохождения дистанции и рассчитывается скорость (в м/с) [30]. Рекомендованным порогом для определения тяжёлой саркопении, по версии EWGSOP2 (2019 г.), считается скорость ходьбы ≤0,8 м/с. При тесте «Встань и иди» пациентам предлагается встать со стула, пройти 3 м до маркера, развернуться, дойти обратно до стула и сесть на него [31]. По рекомендациям EWGSOP2, пороговым значением этого теста для диагноза саркопении считается ≥20 сек. Тест SPPB является комплексным и включает в себя оценку скорости ходьбы, оценку равновесия и тест подъёма со стула. В данном тесте максимально возможным результатом является 12 баллов, при этом результат ≤8 баллов указывает на плохую физическую функцию [32].
Для оценки состава тела человека и оценки мышечной массы применяют двухэнергетическую рентгеновскую абсорбциометрию (ДРА; dual energy X-ray absorptiometry) и биоимпедансометрию, биоимпедансный анализ (bioelectrical impedance analysis). Для оценки массы и качества мышечной ткани золотым стандартом, по версии EWGSOP, являются компьютерная и магнитно-резонансная томографии (КТ и МРТ) [1]. EWGSOP рекомендует визуализацию на уровне L3 позвонка с помощью КТ, измерение мышечной ткани в средней трети бедра, а также оценку мышечной ткани с использованием ультразвука [33]. В качестве методов лабораторной оценки саркопении применяются тесты с разведением креатина, ряд нейромышечных биомаркеров, оценка неспецифических воспалительных реакций, гормональные, анаболические факторы [1].
Методы лучевой диагностики саркопении
Лучевая диагностика саркопении основана на оценке снижения объёма мышечной ткани и ухудшении её «качества». Двухэнергетическая рентгеновская абсорбциометрия ― наиболее часто применяемый для этих целей метод, что обусловлено низкой лучевой нагрузкой, возможностью получить воспроизводимые результаты, который, тем не менее, имеет свои недостатки и ограничения: исследование подразумевает измерение безжировой массы тела (lean body mass, LBM), а не изолированно мышечной массы, что может предоставлять некорректные результаты у пациентов с повышенным потреблением жидкости и/или с большим количеством фиброзной ткани; также не представляется возможной оценка качества мышечной ткани ввиду проекционного типа изображений [32]; ограничением метода является необходимость исследований в динамике на одном денситометре с регулярной калибровкой [34]; нет возможности выполнения исследований оппортунистически.
EWGSOP называет КТ и МРТ золотым стандартом неинвазивной оценки количества мышечной ткани, хотя данные методики не имеют широкого распространения по таким причинам, как высокая стоимость исследования/оборудования, отсутствие чётких пороговых диагностических значений, необходимость проведения сегментации для выявления мышц и других анатомических структур [1, 32]. В отличие от двухэнергетической рентгеновской абсорбциометрии, при КТ и МРТ зачастую отсутствует возможность сканирования тела целиком в связи с дозовой нагрузкой (для КТ) или же временными ограничениями (для МРТ), исследование ограничено одной анатомической областью.
В настоящее время одной из наиболее достоверных и эффективных методик КТ-оценки мышечной массы является проведение измерений по аксиальным срезам на уровне L3 позвонка [35]. Для данной анатомической локализации соотношение мышечной массы и жировой ткани хорошо коррелирует с соотношением для всего тела [36]. Данный анатомический ориентир может использоваться для оценки саркопении у пациентов вне зависимости от ИМТ, при этом паренхиматозные органы брюшной полости, костные структуры наименее представлены на данном срезе и в меньшей мере затрудняют сегментацию мышечной и жировой ткани [37, 38].
Диагностика саркопенического ожирения
Одним из наиболее серьёзных сочетанных состояний при саркопении является саркопеническое ожирение. Часто (но не всегда) потеря мышечной массы при саркопении сопровождается увеличением объёма жировой ткани. Этот процесс напрямую влияет на качество мышечной ткани и, следовательно, на физическую работоспособность [39].
Саркопения, как и ожирение, характеризуется подострым хроническим провоспалением, отрицательно влияющим на функцию мышечной и жировой ткани [40]. Выявлены и дополнительные звенья патогенеза, определяющие связь между мышечным и жировым метаболизмом в саркопеническом ожирении [41]. Таким образом, наличие у пациента данного сочетанного состояния умножает риски неблагоприятных последствий [42].
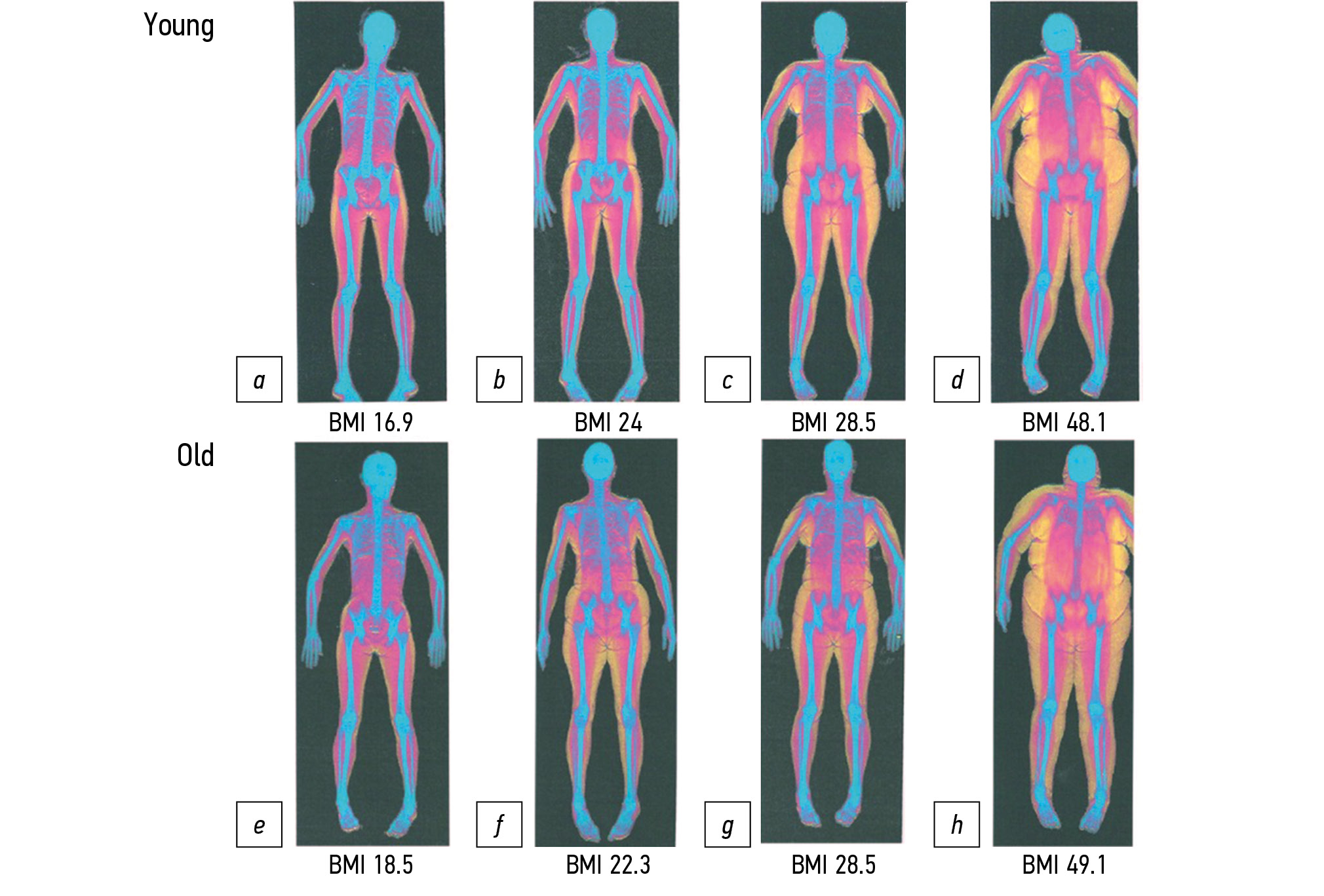
Диагностические возможности медицинской визуализации, используемые при саркопении, хорошо подходят и для саркопенического ожирения: так, двухэнергетическая рентгеновская абсорбциометрия успешно используется для определения состава тела и соотношения массы тканей (рис. 1), а КТ и МРТ позволяют наглядно представить площадь и паттерн распределения лишней жировой ткани в висцеральных органах и в составе подкожно-жировой клетчатки.
*Рис. 1. Пример диагностических изображений, полученных с помощью двухэнергетической рентгеновской абсорбциометрии (по D.J. Tomlinson и соавт. [43]) при различных значениях индекса массы тела (BMI) у молодых (a−d) и пожилых (e−h) женщин. Синим цветом выделена костная ткань, красным ― безжировая мышечная ткань, жёлтым ― жировая ткань.
* Доступен по Creative Commons Attribution 3.0 International License (CC BY 3.0), Physiological Reports.
Количественные критерии диагностики саркопении
Для диагностики снижения мышечной массы чаще всего используются два параметра ― общая скелетная мышечная масса (skeletal muscle mass) и аппендикулярная мышечная масса (АММ; appendicular skeletal muscle mass). Определение АММ производится с помощью двухэнергетической рентгеновской абсорбциометрии (выполняется сканирование всего тела пациента, оцениваются верхние и нижние конечности ― анатомические области, не содержащие паренхиматозные органы; см. рис. 1), тогда как скелетная мышечная масса определяется методом биоимпедансометрии.
В качестве производного параметра определяется скелетно-мышечный индекс (СМИ; skeletal muscle index). Существует проблема унификации терминологии, т.к. в работах разных авторов для одного и того же понятия «скелетно-мышечный индекс» используются разные формулы расчёта [44]. Приводятся следующие способы его определения в зависимости от корректировки по отдельным параметрам: отношение АММ к росту (AMM/м2), отношение АММ к весу (АММ/кг) и отношение АММ к ИМТ (АММ/ИМТ). У каждого способа есть свои преимущества и недостатки: так, СМИ с корректировкой по росту пациента (АММ/м2) имеет менее надёжную корреляцию с астенией у женщин и не учитывает распределение жировой ткани [45]. Приводятся данные, что выявляемость тяжёлой саркопении при использовании СМИ с корректировкой на ИМТ вдвое выше, чем СМИ с корректировкой по росту [44]. Единственным вариантом СМИ, для которого существуют общепризнанные пограничные значения для установки диагноза саркопении, является отношение АММ к росту (АММ/м2). Они закреплены в консенсусах Европейской (EWGSOP) и Азиатской (Asian Working Group on Sarcopenia, AWGS) рабочих групп по саркопении. Эти данные, а также количественные критерии установки диагноза по мышечной силе представлены в табл. 1 и 2. Для иных вариантов СМИ, использующих другие параметры для корректировки (ИМТ, вес), общепринятые пограничные значения отсутствуют.
Таблица 1. Пограничные количественные показатели для постановки диагноза саркопении, принятые консенсусом Европейской рабочей группы по саркопении у пожилых (EWGSOP2)
Метод исследования | Граница для мужчин | Граница для женщин |
Количественные критерии EWGSOP2 для низкой мышечной силы | ||
Сила хвата | <27 кг | <16 кг |
Тест подъёма со стула | >15 сек для 5 вставаний | |
Количественные критерии EWGSOP2 для низкой мышечной массы | ||
Аппендикулярная мышечная масса (АММ) | <20 кг | <15 кг |
АММ/рост2, кг/м2 | <7,0 кг/м2 | <5,5 кг/м2 |
Таблица 2. Пограничные количественные показатели для постановки диагноза саркопении, принятые консенсусом Азиатской рабочей группы по саркопении (AWGS)
Метод исследования | Граница для мужчин | Граница для женщин |
Количественные критерии AWGS для низкой мышечной силы | ||
Сила хвата | <28 кг | <18 кг |
Тест подъёма со стула | ≥12 сек для 5 вставаний | |
Количественные критерии AWGS для низкой мышечной массы | ||
АММ/рост2, кг/м2 | <7,0 кг/м2 | <5,4 кг/м2 |
Вариантом СМИ для посрезовой инструментальной диагностики с помощью КТ и МРТ является расчёт L3 СМИ по формуле , где L3 СМИ ― скелетно-мышечный индекс на уровне L3 позвонка (см2/м); S ― площадь всех групп мышц, попавших в срез (см2); h ― рост человека (м).
На рис. 2 представлен вариант измерения площади мышечной ткани, подкожной жировой и висцеральной жировой ткани, попавших в срез на уровне L3, алгоритмом искусственного интеллекта.
*Рис. 2. Пример измерения площади (в см2) мышечной ткани, подкожной жировой и висцеральной жировой ткани, попавших в срез на уровне L3, алгоритмом искусственного интеллекта L3SEG-net из работы J. Ha и соавт. [46]. Слева направо красным цветом выделена подкожная жировая ткань, фиолетовым ― скелетная мышечная масса, зелёным ― висцеральная жировая ткань.
* Доступен по Creative Commons Attribution 4.0 International License (CC BY 4.0), Scientific Reports.
Несмотря на перспективность применения и признания в качестве золотого стандарта оценку саркопении по данным КТ [1], пока ещё нет единых пограничных значений данного показателя [44].
Для определения саркопении по СМИ, определённому для уровня L3, используются разные критерии. Пограничными значениями для саркопении являются <55 см2/м2 для мужчин и <39 см2/м2 для женщин [47], а также <53 см2/ м2 при ИМТ >25 и <43 см2/м2 для ИМТ <25 для мужчин и <41 см2/м2 вне зависимости от ИМТ для женщин [48]. Отсутствие унификации в очередной раз подчёркивает необходимость дальнейших популяционных исследований для определения корректных значений L3 СМИ.
Новые подходы в лучевой диагностике саркопении
Проблемой применения КТ для достоверной оценки степени снижения мышечной массы является необходимость ручной сегментации мышечной ткани на серии КТ-изображений, что затруднительно при большом потоке пациентов, однако существующее полуавтоматическое морфометрическое компьютерное программное обеспечение (ПО) для сегментации по признаку рентгенологической плотности мышечной ткани (часто в диапазоне от -29 до +150 единиц Хаунсфилда для мышц и от -30 до -190 единиц Хаунсфилда для жира) с применением масок пока не получило повсеместного применения. Примерами такого ПО можно назвать Slice-O-Matic [49], AsanJ-Morphometry [50] и 3D Slicer [51].
С широким приходом в медицинскую визуализацию технологий искусственного интеллекта, в частности машинного обучения (machine learning), нейронных сетей и глубокого обучения (deep learning), появилась возможность создавать ПО, которое более точно сегментирует различные структуры на КТ- и МРТ-снимках, а также имеет возможность самообучения. Несмотря на сопряжённые с разработкой и использованием методики сложности, в литературе представлены соответствующие научные работы, освещающие разработку и валидацию сегментационных алгоритмов машинного обучения, в частности сегментацию скелетных мышц на КТ-исследованиях органов брюшной полости у онкологических пациентов [52−55]. Наиболее популярной используемой архитектурой для обучения моделей является U-Net [56], которая изначально создавалась для визуализации в клеточной биологии, однако позднее с успехом стала применяться и в лучевой диагностике. Второй по частоте использования архитектурой является полносвязная нейронная сеть FCNN (Fully Connected Neural Network) [57], имеющая более общее применение и изначально созданная для семантической сегментации. Основным параметром, по которому оценивается работа нейросетей-сегментаторов, является коэффициент Дайса, показывающий процент соответствия одного массива данных другому, в данном случае ― соответствие предсказанной разметки стандарту, заложенному разработчиками нейросети. В настоящее время в литературе уже имеются примеры алгоритмов, коэффициент Дайса которых превышает 0,97 [58].
Всё чаще исследователи создают комплексные модели на основе нескольких архитектур для нескольких разных подзадач, как, например, в работе J. Ha и соавт. [46]: по сути, готовое ПО использует две архитектуры ― YOLOv3 и FCNN, где первая выполняет задачу поиска конкретного объекта (в данном случае L3 позвонка), а вторая производит непосредственно сегментацию. Использование глубокого обучения открывает также возможность для создания карт, отображающих качество скелетно-мышечной ткани по признаку количества внутримышечного жира. Примером является работа D.W. Kim и соавт. [59], где авторы на основе ранее созданного алгоритма с FCNN-архитектурой создали веб-приложение, позволяющее создавать из КТ-срезов на уровне L3 позвонка размеченные карты, наглядно отображающие соотношение мышечной ткани и внутримышечного жира (рис. 3). Главным прикладным недостатком работы на данный момент является отсутствие соответствующих пограничных значений или же специального индекса, позволивших бы оценивать именно качество мышечной ткани объективно, а не субъективно. Тем не менее, учитывая для полноценной диагностики и прогноза течения саркопении важность не только оценки силы и количества, но и качества мышечной ткани, данное направление является довольно перспективным для будущих исследований.
*Рис. 3. Карты качества мышечной ткани, полученные с использованием автоматизированного веб-инструмента (по D.W. Kim и соавт. [59]). IMAT: зона между-/внутримышечной жировой ткани; LAMA: зона мышечной ткани низкой плотности; NAMA: зона мышечной ткани нормальной плотности; SMA: зона скелетной мышечной ткани; TAMA: общая зона абдоминальной мышечной ткани.
* Доступен по Creative Commons Attribution 4.0 International License (CC BY 4.0), JMIR Medical Informatics.
Стоит отметить, что наличие специализированного ПО на основе технологий глубокого обучения позволяет не только решать клинико-практическую задачу уточнения диагноза саркопении, но и открывает возможности для оппортунистического скрининга данного состояния.
Возможности оппортунистического скрининга
Как было сказано нами ранее, специфика расчёта показателя L3 СМИ и его получения при инструментальной диагностике с помощью лучевых методов делает возможным оппортунистический КТ-скрининг при помощи использования ПО для автоматической сегментации. Данный анатомический ориентир интересен частой встречаемостью в КТ-исследованиях, что отчасти обусловлено стандартами оказания медицинской помощи, например при онкологических заболеваниях, где требуется использование КТ для поиска отдалённых метастазов. Как одно из подтверждений, расчёт L3 СМИ часто доступен у онкологических пациентов и используется для оценки раковой кахексии и её связи с исходами заболевания [47, 48, 60]. В качестве примера успешной работы алгоритма-сегментатора мышечной ткани на крупной ретроспективной скрининговой выборке можно привести публикацию P.M. Graffy и соавт. [61]. Авторы использовали выборку из 8037 асимптоматичных пациентов, которым была проведена КТ органов брюшной полости без контрастного усиления в период с апреля 2004 по декабрь 2016 г. Учитывая тот факт, что бό́льшую часть выборки составляли здоровые пациенты, помимо валидации работы алгоритма авторам также удалось получить средние показатели для здоровой популяции. Ограничениями данного исследования авторы называют использование КТ-изображений пациентов только одного медицинского учреждения, а также неудовлетворительную работу алгоритма на КТ-изображениях с наличием артефактов от металлоконструкций, артефактов движения, а также на КТ-изображениях, полученных с помощью низкодозовых протоколов сканирования. Последнее ограничение свойственно для любых алгоритмов-сегментаторов. Тем не менее, несмотря на недостатки, сложно переоценить одно из главных преимуществ оппортунистического скрининга ― отсутствие необходимости выполнения дополнительных лучевых исследований, а следовательно, снижение получаемой пациентом гипотетической дозы рентгеновского излучения.
Примером успешного внедрения системы оппортунистического скрининга в Едином радиологическом информационном сервисе Единой медицинской информационно-аналитической системы г. Москвы (ЕРИС ЕМИАС) можно назвать проект оппортунистического скрининга остеопороза [62] и ряда других заболеваний и состояний (аневризмы аорты, признаки лёгочной гипертензии с определением диаметра лёгочного ствола, рак лёгкого, признаки инсульта и т.д.) в рамках эксперимента по использованию инновационных технологий в области компьютерного зрения для анализа медицинских изображений и дальнейшего применения в системе здравоохранения города Москвы3 [63].
По аналогии с уже внедрённым решением, а также с учётом опыта зарубежных коллег мы предлагаем возможный вариант организации оппортунистического скрининга саркопении (в том числе ретроспективного) с последующим внедрением в ЕРИС ЕМИАС. В качестве прототипа для разработки инструмента автоматической сегментации мышечной и жировой ткани на КТ-изображениях на уровне L3 позвонка возможно использование архитектуры U-Net++ [64]. Преимуществом данного подхода являются высокие показатели коэффициента Дайса для нейросети даже при очень малом размере обучающей выборки (подкожный жир ― 0,9706, мышцы ― 0,9312, внутримышечный жир ― 0,6465, висцеральный жир ― 0,9609; обучающая выборка ― 15 пациентов). Перспективой данного направления является возможность быстрой оппортунистической оценки количества мышечной ткани, уточнение граничных значений для диагностики саркопении, что позволит своевременно выявлять патологическое состояние, прогнозировать и снижать неблагоприятные исходы при различных инвазивных вмешательствах, предотвращать прогрессирующее снижение качества жизни данной категории пациентов, сокращать расходы ресурсов системы здравоохранения.
ЗАКЛЮЧЕНИЕ
Саркопения является заболеванием, представляющим социальное и экономическое бремя для системы здравоохранения. Несмотря на то, что узкоспециализированного медикаментозного лечения для саркопении не существует, профилактика и своевременное немедикаментозное лечение с помощью силовых физических упражнений поможет снизить риск потенциальных неблагоприятных последствий. Необходима своевременная диагностика снижения как мышечной силы, так и мышечной массы. Хорошим дополнением к уже используемым методам инструментальной диагностики (двухэнергетическая рентгеновская абсорбциометрия и биоимпедансометрия) могут быть алгоритмы искусственного интеллекта для автоматической сегментации мышечной и жировой ткани на КТ- и МР-изображениях с последующим расчётом L3 СМИ. Подобное ПО при использовании в таких системах, как ЕРИС ЕМИАС, открывает возможности для оппортунистического скрининга.
Тем не менее, несмотря на признание EWGSOP золотым стандартом методик КТ и МРТ, общепризнанных количественных значений L3 СМИ для КТ- и МР-диагностики саркопении пока не существует. В дополнение к этому существует проблема унификации термина «скелетно-мышечный индекс». При решении данных проблем с помощью дальнейших популяционных исследований станет возможным получение новой методики инструментальной диагностики саркопении с последующим её применением для скрининга данного состояния.
ДОПОЛНИТЕЛЬНО
Источник финансирования. Даная статья подготовлена авторским коллективом в рамках научно-исследовательской работы (№ ЕГИСУ: АААА-А21-121012290079-2) в соответствии с Программой Департамента здравоохранения города Москвы «Научное обеспечение столичного здравоохранения» на 2020–2022 годы.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: А.К. Сморчкова ― подбор и анализ материалов для обзора, написание текста статьи; А.В. Петряйкин ― написание текста статьи, редактирование; Д.С. Семенов, Д.Е. Шарова ― концепция обзора, написание текста статьи, финальные правки.
ADDITIONAL INFORMATION
Funding source. This article was prepared by a group of authors as part of research (No. in the Unified State Information System for Accounting of Research, Development, and Technological Works (EGISU): АААА-А21-121012290079-2) under the Program of the Moscow Healthcare Department “Scientific Support of the Capital’s Healthcare” for 2020–2022.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. A.S. Smorchkova — data sources collection and analysis, manuscript preparation; A.V. Petraikin — manuscript preparation, manuscript revision; D.S. Semenov, D.E. Sharova — review concept, manuscript preparation, final editing.
1 36-Item Short Form Survey Instrument (SF-36) [Электронный ресурс]. Режим доступа: https://www.rand.org/health-care/surveys_tools/mos/36-item-short-form/survey-instrument.html. Дата обращения: 06.06.2022.
2 EuroQol Research Foundation. EQ-5D-5L User Guide, 2019 [Электронный ресурс]. Режим доступа: https://euroqol.org/publications/user-guides/. Дата обращения: 06.06.2022.
3 Центр диагностики и телемедицины [интернет]. Каталог ИИ-сервисов. ИИ-сервисы в лучевой диагностике. Режим доступа: https://mosmed.ai/service_catalog/. Дата обращения: 26.08.2022.
Об авторах
Анастасия Кирилловна Сморчкова
Научно-практический клинический центр диагностики и телемедицинских технологий
Email: a.smorchkova@npcmr.ru
ORCID iD: 0000-0002-9766-3390
SPIN-код: 4345-8568
Scopus Author ID: 57213145638
Россия, Москва
Алексей Владимирович Петряйкин
Научно-практический клинический центр диагностики и телемедицинских технологий
Email: alexeypetraikin@gmail.com
ORCID iD: 0000-0003-1694-4682
SPIN-код: 6193-1656
д.м.н.
Россия, МоскваДмитрий Сергеевич Семенов
Научно-практический клинический центр диагностики и телемедицинских технологий
Email: d.semenov@npcmr.ru
ORCID iD: 0000-0002-4293-2514
SPIN-код: 2278-7290
Scopus Author ID: 57213154475
ResearcherId: P-5228-2017
Россия, Москва
Дарья Евгеньевна Шарова
Научно-практический клинический центр диагностики и телемедицинских технологий
Автор, ответственный за переписку.
Email: d.sharova@npcmr.ru
ORCID iD: 0000-0001-5792-3912
SPIN-код: 1811-7595
Россия, Москва
Список литературы
- Cruz-Jentoft A.J., Bahat G., Bauer J., et al. Sarcopenia: revised European consensus on definition and diagnosis // Age and Ageing. 2018. Vol. 48, N 1. P. 16–31. doi: 10.1093/ageing/afy169
- Ткачева О.Н., Котовская Ю.В., Рунихина Н.К., и др. Клинические рекомендации «Старческая астения» // Российский журнал гериатрической медицины. 2020. № 1. С. 11–46. doi: 10.37586/2686-8636-1-2020-11-46
- Bischoff-Ferrari H.A., Orav J.E., Kanis J.A., et al. Comparative performance of current definitions of sarcopenia against the prospective incidence of falls among community-dwelling seniors age 65 and older // Osteoporosis Int. 2015. Vol. 26, N 12. P. 2793–2802. doi: 10.1007/s00198-015-3194-y
- da Silva Alexandre T., de Oliveira Duarte Y.A., Ferreira Santos J.L., et al. Sarcopenia according to the European Working Group on sarcopenia in older people (EWGSOP) versus dynapenia as a risk factor for disability in the elderly // J Nutr Health Aging. 2014. Vol. 18, N 5. P. 547–553. doi: 10.1007/s12603-014-0465-9
- Sousa A.S., Guerra R.S., Fonseca I., et al. Sarcopenia and length of hospital stay // Eur J Clin Nutr. 2015. Vol. 70, N 5. P. 595–601. doi: 10.1038/ejcn.2015.207
- Faulkner J.A., Larkin L.M., Claflin D.R., Brooks S.V. Age-related changes in the structure and function of skeletal muscles // Clin Exp Pharmacol Physiol. 2007. Vol. 34, N 11. P. 1091–1096. doi: 10.1111/j.1440-1681.2007.04752.x
- Shafiee G., Keshtkar A., Soltani A., et al. Prevalence of sarcopenia in the world: a systematic review and meta-analysis of general population studies // J Diabetes Metab Disord. 2017. Vol. 16. P. 21. doi: 10.1186/s40200-017-0302-x
- Petermann-Rocha F., Balntzi V., Gray S.R., et al. Global prevalence of sarcopenia and severe sarcopenia: a systematic review and meta-analysis // J Cachexia Sarcopenia Muscle. 2021. Vol. 13, N 1. P. 86–99. doi: 10.1002/jcsm.12783
- Сафонова Ю.A., Зоткин Е.Г. Саркопения у пациенток старшего возраста с остеоартритом крупных суставов // Научно-практическая ревматология. 2019. Т. 57, № 2. С. 154–159. doi: 10.14412/1995-4484-2019-154-159
- Tsekoura M., Kastrinis A., Katsoulaki M., et al. Sarcopenia and its impact on quality of life // Adv Exp Med Biol. 2017. Vol. 987. P. 213–218. doi: 10.1007/978-3-319-57379-3_19
- Sepúlveda-Loyola W., Osadnik C., Phu S., et al. Diagnosis, prevalence, and clinical impact of SARCOPENIA IN COPD: a systematic review and meta-analysis // J Cachexia Sarcopenia Muscle. 2020. Vol. 11, N 5. P. 1164–1176. doi: 10.1002/jcsm.12600
- Nipp R.D., Fuchs G., El-Jawahri A., et al. Sarcopenia is associated with quality of life and depression in patients with advanced cancer // Oncologist. 2017. Vol. 23, N 1. P. 97–104. doi: 10.1634/theoncologist.2017-0255
- Beaudart C., Biver E., Reginster J.Y., et al. Development of a self-administrated quality of life questionnaire for sarcopenia in elderly subjects: the SarQol // Age Ageing. 2015. Vol. 44, N 6. P. 960–966. doi: 10.1093/ageing/afv133
- Geerinck A., Bruyère O., Locquet M., et al. Evaluation of the responsiveness of the SARQOL® questionnaire, a patient-reported outcome measure specific to sarcopenia // Adv Ther. 2018. Vol. 35, N 11. P. 1842–1858. doi: 10.1007/s12325-018-0820-z
- Geerinck A., Locquet M., Bruyère O., et al. Evaluating quality of life in frailty: applicability and clinimetric properties of the SARQOL questionnaire // J Cachexia Sarcopenia Muscle. 2021. Vol. 12, N 2. P. 319–330. doi: 10.1002/jcsm.12687
- Witham M.D., Heslop P., Dodds R.M., et al. Performance of the SARQOL quality of life tool in a UK population of older people with probable sarcopenia and implications for use in clinical trials: findings from the SARCNET registry // BMC Geriatrics. 2022. Vol. 22, N 1. P. 368. doi: 10.1186/s12877-022-03077-5
- Сафонова Ю.A., Лесняк О.М., Баранова И.А., и др. Русский перевод и валидация SarQoL ― опросника качества жизни для пациентов с саркопенией // Научно-практическая ревматология. 2019. Т. 57, № 1. С. 38–45.
- Gani F., Buettner S., Margonis G.A., et al. Sarcopenia predicts costs among patients undergoing major abdominal operations // Surgery. 2016. Vol. 160, N 5. P. 1162–1171. doi: 10.1016/j.surg.2016.05.002
- Bruyère O., Beaudart C., Ethgen O., et al. The health economics burden of sarcopenia: a systematic review // Maturitas. 2019. Vol. 119. P. 61–69. doi: 10.1016/j.maturitas.2018.11.003
- Peterson M.D., Rhea M.R., Sen A., Gordon P.M. Resistance exercise for muscular strength in older adults: a meta-analysis // Ageing Res Rev. 2010. Vol. 9, N 3. P. 226–237. doi: 10.1016/j.arr.2010.03.004
- McKendry J., Currier B.S., Lim C., et al. Nutritional supplements to support resistance exercise in countering the sarcopenia of aging // Nutrients. 2020. Vol. 12, N 7. P. 2057. doi: 10.3390/nu12072057
- Robinson S.M., Reginster J.Y., Rizzoli R., et al. Does nutrition play a role in the prevention and management of sarcopenia? // Clin Nutr. 2018. Vol. 37, N 4. P. 1121–1132. doi: 10.1016/j.clnu.2017.08.016
- Lozano-Montoya I., Correa-Pérez A., Abraha I., et al. Nonpharmacological interventions to treat physical frailty and sarcopenia in older patients: a systematic overview ― the senator Project Ontop series // Clin Interv Aging. 2017. Vol. 12. P. 721–740. doi: 10.2147/CIA.S132496
- Lappe J.M., Binkley N. Vitamin D and Sarcopenia/Falls // J Clin Densitometry. 2015. Vol. 18, N 4. P. 478–482.
- Rooks D., Roubenoff R. Development of pharmacotherapies for the treatment of sarcopenia // J Frailty Aging. 2019. P. 1–11. doi: 10.14283/jfa.2019.11
- Morley J.E., Abbatecola A.M., Argiles J.M., et al. Sarcopenia with limited mobility: an international consensus // J Am Med Dir Assoc. 2011. Vol. 12, N 6. P. 403–409. doi: 10.1016/j.jamda.2011.04.014
- Malmstrom T.K., Miller D.K., Simonsick E.M., et al. SARC-F: a symptom score to predict persons with sarcopenia at risk for poor functional outcomes // J Cachexia Sarcopenia Muscle. 2015. Vol. 7, N 1. P. 28–36. doi: 10.1002/jcsm.12048
- Bahat G., Yilmaz O., Kiliç C., et al. Performance of SARC-F in regard to sarcopenia definitions, muscle mass and functional measures // J Nutr Health Aging. 2018. Vol. 22, N 8. P. 898–903. doi: 10.1007/s12603-018-1067-8
- Porto J.M., Nakaishi A.P., Cangussu-Oliveira L.M., et al. Relationship between grip strength and global muscle strength in community-dwelling older people // Arch Gerontol Geriatr. 2019. Vol. 82. P. 273–278. doi: 10.1016/j.archger.2019.03.005
- Maggio M., Ceda G.P., Ticinesi A., et al. Instrumental and non-instrumental evaluation of 4-meter walking speed in older individuals // PLoS One. 2016. Vol. 11, N 4. P. e0153583. doi: 10.1371/journal.pone.0153583
- Podsiadlo D., Richardson S. The timed “Up & go”: a test of basic functional mobility for frail elderly persons // J Am Geriatr Soc. 1991. Vol. 39, N 2. P. 142–148. doi: 10.1111/j.1532-5415.1991.tb01616.x
- Beaudart C., McCloskey E., Bruyère O., et al. Sarcopenia in daily practice: assessment and management // BMC Geriatrics. 2016. Vol. 16, N 1. P. 170. doi: 10.1186/s12877-016-0349-4
- Stringer H.J., Wilson D. The role of ultrasound as a diagnostic tool for sarcopenia // J Frailty Aging. 2018. Vol. 7, N 4. P. 258−261. doi: 10.14283/jfa.2018.24
- Петряйкин А.В., Смолярчук М.Я., Петряйкин Ф.А., и др. Оценка точности денситометрических исследований. Применение фантома РСК ФК2 // Травматология и ортопедия России. 2019. Т. 25, № 3. С. 124–134. doi: 10.21823/2311-2905-2019-25-3-124-134
- Shen W., Punyanitya M., Wang Z., et al. Total body skeletal muscle and adipose tissue volumes: estimation from a single abdominal cross-sectional image // J Appl Physiol (1985). 2004. Vol. 97, N 6. P. 2333–2338. doi: 10.1152/japplphysiol.00744.2004
- Mourtzakis M., Prado C.M., Lieffers J.R., et al. A practical and precise approach to quantification of body composition in cancer patients using computed tomography images acquired during routine care // Appl Physiol Nutr Metab. 2008. Vol. 33, N 5. P. 997–1006. doi: 10.1139/H08-075
- Kim E.Y., Kim Y.S., Park I., et al. Prognostic significance of CT-determined sarcopenia in patients with small-cell lung cancer // J Thorac Oncol. 2015. Vol. 10, N 12. P. 1795–1799. doi: 10.1097/JTO.0000000000000690
- Baracos V., Kazemi-Bajestani S.M. Clinical outcomes related to muscle mass in humans with cancer and catabolic illnesses // Int J Biochem Cell Biol. 2013. Vol. 45, N 10. P. 2302–2308. doi: 10.1016/j.biocel.2013.06.016
- Franceschi C., Garagnani P., Morsiani C., et al. The continuum of aging and age-related diseases: common mechanisms but different rates // Front Med (Lausanne). 2018. Vol. 5. P. 61. doi: 10.3389/fmed.2018.00061
- Ferrucci L., Fabbri E. Inflammageing: chronic inflammation in ageing, cardiovascular disease, and frailty // Nature Rev Cardiol. 2018. Vol. 15, N 9. P. 505–522. doi: 10.1038/s41569-018-0064-2
- Zamboni M., Rubele S., Rossi A.P. Sarcopenia and obesity // Curr Opin Clin Nutr Metab Care. 2019. Vol. 22, N 1. P. 13–19. doi: 10.1097/MCO.0000000000000519
- Batsis J.A., Villareal D.T. Sarcopenic obesity in older adults: etiology, epidemiology and treatment strategies // Nat Rev Endocrinol. 2018. Vol. 14, N 9. P. 513–537. doi: 10.1038/s41574-018-0062-9
- Tomlinson D.J., Erskine R.M., Winwood K., et al. Obesity decreases both whole muscle and fascicle strength in young females but only exacerbates the aging-related whole muscle level asthenia // Physiol Rep. 2014. Vol. 2, N 6. P. e12030. doi: 10.14814/phy2.12030
- Kim K.M., Jang H.C., Lim S. Differences among skeletal muscle mass indices derived from height-, weight-, and body mass index-adjusted models in assessing sarcopenia // Korean J Intern Med. 2016. Vol. 31, N 4. P. 643–650. doi: 10.3904/kjim.2016.015
- Newman A.B., Kupelian V., Visser M., et al. Sarcopenia: alternative definitions and associations with lower extremity function // J Am Geriatr Soc. 2003. Vol. 51, N 11. P. 1602–1609. doi: 10.1046/j.1532-5415.2003.51534.x
- Ha J., Park T., Kim H.K., et al. Development of a fully automatic deep learning system for L3 selection and body composition assessment on computed tomography // Sci Rep. 2021. Vol. 11, N 1. P. 21656. doi: 10.1038/s41598-021-00161-5
- Prado C.M., Lieffers J.R., McCargar L.J., et al. Prevalence and clinical implications of SARCOPENIC obesity in patients with solid tumours of the respiratory and gastrointestinal tracts: a population-based study // Lancet Oncol. 2008. Vol. 9, N 7. P. 629–635. doi: 10.1016/S1470-2045(08)70153-0
- Martin L., Birdsell L., Macdonald N., et al. Cancer cachexia in the age of obesity: skeletal muscle depletion is a powerful prognostic factor, independent of body mass index // J Clin Oncol. 2013. Vol. 31, N 12. P. 1539–1547. doi: 10.1200/JCO.2012.45.2722
- Popuri K., Cobzas D., Esfandiari N., et al. Body composition assessment in axial CT images using FEM-based automatic segmentation of skeletal muscle // IEEE Trans Med Imaging. 2016. Vol. 35, N 2. P. 512–520. doi: 10.1109/TMI.2015.2479252
- Park J., Gil J.R., Shin Y., et al. Reliable and robust method for abdominal muscle mass quantification using CT/MRI: An explorative study in healthy subjects // PLoS One. 2019. Vol. 14, N 9. P. e0222042. doi: 10.1371/journal.pone.0222042
- Fedorov A., Beichel R., Kalpathy-Cramer J., et al. 3D Slicer as an image computing platform for the quantitative imaging network // Magn Reson Imaging. 2012. Vol. 30, N 9. P. 1323–1341. doi: 10.1016/j.mri.2012.05.001
- Burns J.E., Yao J., Chalhoub D., et al. A machine learning algorithm to estimate sarcopenia on abdominal CT // Acad Radiol. 2020. Vol. 27, N 3. P. 311–320. doi: 10.1016/j.acra.2019.03.011
- Blanc-Durand P., Schiratti J.B., Schutte K., et al. Abdominal musculature segmentation and surface prediction from CT using deep learning for sarcopenia assessment // Diagn Interv Imaging. 2020. Vol. 101, N 12. P. 789–794. doi: 10.1016/j.diii.2020.04.011
- Graffy P.M., Liu J., Pickhardt P.J., et al. Deep learning-based muscle segmentation and quantification at abdominal CT: Application to a longitudinal adult screening cohort for sarcopenia assessment // Br J Radiol. 2019. Vol. 92, N 1100. P. 20190327. doi: 10.1259/bjr.20190327
- Ackermans L.L., Volmer L., Wee L., et al. Deep learning automated segmentation for muscle and adipose tissue from abdominal computed tomography in polytrauma patients // Sensors (Basel). 2021. Vol. 21, N 6. P. 2083. doi: 10.3390/s21062083
- Ronneberger O., Fischer P., Brox T. U-Net: convolutional networks for biomedical image segmentation // Lecture Notes Computer Sci. 2015. P. 234–241. doi: 10.1007/978-3-319-24574-4_28
- Shelhamer E., Long J., Darrell T. Fully convolutional networks for semantic segmentation // IEEE Trans Pattern Anal Mach Intell. 2017. Vol. 39, N 4. P. 640–651. doi: 10.1109/TPAMI.2016.2572683
- Islam S., Kanavati F., Arain Z., et al. Fully-automated deep learning slice-based muscle estimation from CT images for sarcopenia assessment // Clin Radiol. 2022. Vol. 77, N 5. P. e363−e371. doi: 10.1016/j.crad.2022.01.036
- Kim D.W., Kim K.W., Ko Y., et al. Assessment of myosteatosis on computed tomography by automatic generation of a muscle quality map using a web-based toolkit: feasibility study // JMIR Med Inform. 2020. Vol. 8, N 10. P. e23049. doi: 10.2196/23049
- Dong X., Dan X., Yawen A., et al. Identifying sarcopenia in advanced non-small cell lung cancer patients using skeletal muscle CT radiomics and machine learning // Thorac Cancer. 2020. Vol. 11, N 9. P. 2650–2659. doi: 10.1111/1759-7714.13598
- Graffy P.M., Liu J., Pickhardt P.J., et al. Deep learning-based muscle segmentation and quantification at abdominal CT: Application to a longitudinal adult screening cohort for sarcopenia assessment // Br J Radiol. 2019. Vol. 92, N 1100. P. 20190327. doi: 10.1259/bjr.20190327
- Петряйкин А.В., Артюкова З.Р., Низовцова Л.А., и др. Анализ эффективности внедрения системы скрининга остеопороза // Менеджер здравоохранения. 2021. № 2. P. 31–39. doi: 10.21045/1811-0185-2021-2-31-39
- Морозов С.П., Владзимирский А.В., Ледихова Н.В., и др. Московский эксперимент по применению компьютерного зрения в лучевой диагностике: вовлеченность врачей-рентгенологов // Врач и информационные технологии. 2020. № 4. С. 14–23. doi: 10.37690/1811-0193-2020-4-14-23
- Сенюкова О.В., Пятковский С.А., Петряйкин А.В., и др. Автоматическая сегментация мышечной и жировой ткани на КТ-изображениях для оценки состава тела человека и диагностики саркопении // Конференция «Информационные технологии для персонализированной медицины» с блоком летней школы для молодых ученых, 4 ноября 2021 г.: сборник тезисов. Москва, 2021. С. 41. doi: 10.14341/cbaipm-2021-41
Дополнительные файлы