肌肉减少症:解决诊断问题的现代方法
- 作者: Smorchkova A.K.1, Petraikin A.V.1, Semenov D.S.1, Sharova D.E.1
-
隶属关系:
- Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
- 期: 卷 3, 编号 3 (2022)
- 页面: 196-211
- 栏目: 科学评论
- ##submission.dateSubmitted##: 31.08.2022
- ##submission.dateAccepted##: 19.09.2022
- ##submission.datePublished##: 17.10.2022
- URL: https://jdigitaldiagnostics.com/DD/article/view/110721
- DOI: https://doi.org/10.17816/DD110721
- ID: 110721
如何引用文章
详细
肌肉减少症是医学统计和医疗保健系统的一个相对较新的诊断。然而,由于大量可能的不良后果,例如跌倒风险增加、残疾、住院时间延长和死亡率增加,它对医疗体系造成了社会和经济负担。虽然肌肉减少症没有高度专业化的药物疗法,但预防和及时的非药物治疗可以降低潜在不良反应的风险。诊断»肌肉减少症»不仅需要确认肌力下降,还需要确认肌肉质量下降。仪器诊断包括双能X光吸收测量 (DXA) 和生物阻抗测定法 (BIA)等方法。 这些方法可以辅以人工智能 (AI) 算法,用于在计算机断层扫描和磁共振图像上自动分割肌肉和脂肪组织,然后计算L3椎骨水平的肌肉骨骼指数。 此类软件在莫斯科市统一医疗信息和分析系统 (ERIS EMIAS)统一放射信息服务等系统中使用时,为机会性筛查提供了机会。然而,尽管欧洲老年人肌肉减少症工作组将CT和MRI技术认定为“金标准”,但仍然没有公认的用于诊断肌肉减少症的CT 和MR定量L3介质值。除此之外,还有统一术语“肌肉骨骼指数”的问题。如果这些问题通过进一步的人群研究得到解决,将有可能获得一种用于肌肉减少症的仪器诊断的新方法,并随后将其用于筛查这种疾病。
全文:
绪论
目前越来越关注与人类身体组成的普遍变化有关的系统性疾病和病症,其中包括由于人口老化。肌肉减少症就是这样的一种病症(sarcopenia,来自希腊语sarx--肌肉、肉,penia--短缺)。这种病症是老年衰弱综合征的一部分,即 “衰弱”(Frailty syndrome)。
肌肉减少症的第一个工作定义发表于2010年;2016年为ICD-10定义的肌肉疏松症代码也保留在ICD-11中。这样一来这是医学统计和卫生体系中的一种比较新的诊断。
肌肉减少症是指一种进行性的全身骨骼肌肉疾病,与跌倒、骨折、身体残疾和死亡等不良后果的风险有关[1]。在老年病学中肌肉减少症是指原发性肌肉减少症,就是一种在没有其他原因的情况下,由于老化而导致的骨骼肌力量、质量和功能的逐渐普遍丧失[2]。
肌肉减少症会导致很多负面的后果和结果,以及对身体的不良影响,如提高跌倒风险提高导致骨折[3]、身体残疾[4]。肌肉减少症也与住医院时间以及很多疾病的后果更加严重有关[5]。
考虑到对经济与保健事业的潜在负担,及时诊断肌肉减少症和预防其后果是一个很重要的问题。
我们的综述目的是评估在一个大都市地区(莫斯科)范围内肌肉减少症的真正意义,以及确定优化诊断这种疾病的方法。
肌肉减少症: 优化病理状况的诊断方法
流行病学
原发性肌肉减少症与老化有关,所以老年患者最易得病。在文献中具有信息表明从50岁就有肌肉功能的早期丧失[6],但是在临床上平时研究60岁以上的年龄组。
根据一系列综述[7,8]在一般人群中肌肉减少症的患病率为10%(60岁以上的人)。除了性别和社会组之外【独立生活的老年人(community-dwelling); 在养老院住的老年人和住在特殊医院的老年人】,普及性差异取决于诊断法官法:测试、生物电阻抗法、双能x线骨密度测定法、CT扫描、核磁共振成像。
在编制该文章时,在俄罗斯没有进行大样本的流行病学调查研究。有一部著作[9],其包括230个65岁以上的非住院患者,根据欧洲的老年人肌肉减少症工作组(European Working Group on Sarcopenia in Older People, EWGSOP)和国际的肌肉减少症工作组(International Working Group on Sarcopenia, IWGS)的标准,肌肉减少症的普及性评估为30%,这与上述的综述信息不一致。差异可能的原因是样本量小及其不平 衡(95.6%为女性),所以要确认数据。
肌肉减少症对生活质量和医疗体系的影响
肌肉减少症大大降低了生活质量,导致身体活动被迫受到限制[10],这进一步加重了病人的情况。在健康和患有急性、慢性疾病和癌症的人群中都观察到了负面的影 响[11,12]。用Short Form-36 (SF-36)1和 EuroQoL (EQ-5D)2公用调查表评估患者的生活质量,以及用有效的专门的SarQoL(Sarcopenia and Quality of Life)[13-16]调查表,也有俄语版本[17]。根据这些调查表评估生活质量时使用百分制。SF-36提出了一个从0到100的数值,其中0对应的是最差的,100对应的是最好的生活质量。在EQ-5D中,最终得分也是用百分制表示,但0分对应最差的健康状况,100分对应最好的健康状况。
除了降低生活质量,肌肉减少症导致医疗体系的巨大经济费用。有研究描述了患有和不患有肌肉减少症的病人的费用支出(总住院费用的中位数,每人3个月的平均医疗费用,90天的术后费用)。在个别情况下肌肉减少症患者的总住院费用平均每人可增加14,322美元[18]。要考虑到,现有的研究主要考虑与进行手术(如癌症外科)有关的住院治疗费用,使用不同的诊断方法,以及没有统一的边界值,以便确定肌肉减少症的诊断[19]。为了更具体的评估医疗体系对肌肉减少症患者的总费用,必须进一步的研究,并使用更多同质化的样本并辅以其他临床情况(尤其是门诊费用分析)。
肌肉减少症的医疗
目前没有统一的、高度具体的肌肉减少症的疗法。但是病理生理学的理解允许选择可能的疗法。具有肌肉减少症的药物的和非药物的疗法。在非药物的疗法中最有效的是体能锻炼,尤其是力量练习[20]。目前它们是最便宜的长期预防肌肉减少症的方式,也是支持和改善整体身体健康的方式[21]。为了改善和巩固肌肉质量和力量增长使用食物添加剂,如蛋白质(包括乳清蛋白) 、抗氧化剂和长链多不饱和脂肪酸[22]。在使用肌肉减少症的非药物疗法中,建议从体能锻炼开始,因为本方法比饮食调整的证据更多[23] 。药物疗法中使用以下的药物:维生素D[24]、选择性雄激素受体调节剂、肌肽拮抗剂、激活素[25] ,但是目前其有效需要通过大量的试验方法进行进一步确认。
肌肉减少症的诊断
目前在临床实践中肌肉减少症的诊断经常基于普通的既往史信息,就是主诉疾病特有的症状和体征跌倒、感觉虚弱、行走速度慢、从坐位上站起来困难[26]。EWGSOP推荐使用SARC-F (Strength, Assistance with walking, Rising from a chair, Climbing stairs, and Falls)问卷进行客观诊断并作为筛查工具[27] ,考虑到了行走、从椅子和楼梯上爬起以及跌倒时的力量以及是否需要帮助。但是由于其敏感性(25 ;31.6 ;50%)和特异 性(81.4 ;82.4 ;81.8%)中等,根据EWGSOP、美国国立卫生研究院基金会(FNIH)和国际肌肉疏松症工作组(International Working Group on Sarcopenia, IWGS)的诊断标准[30],调查表在大多数情况下只能诊断严重的肌肉减少症。
在俄罗斯肌肉减少症不是作为一个单独的病名来诊断的,而是作为年性肌无力综合征的一个组成部分;用于初级筛查使用“岁数不是障碍”的表格,为了进一步的诊断确定使用综合老年病医学评估[2]。
为了正确的诊断肌肉减少症必须使用仪器诊断手法。必须测量两个参数,就是肌肉力量(包括劳动能力)和肌肉量[1]。肌肉力量低意味着有可能具有肌肉减少症;为了确定诊断要使用评估肌肉质量的方法[1]。
肌肉力量最简单的测量方法是握力计来评估握力,并进一步比较得到的数据和人群中的参考值[1]。握力与总的肌肉力量有很好的相关性,但是为了得到更加准确的结果要考虑不同的肌肉群[29]。腕力测量法中低肌力的规范数据是由性别和体重指数(BMI)决定的:因此,对于BMI为24.1至28的男性,阈值是<30公斤的抖动力量,对于BMI为23.1至26的女性,则是<17.3公斤[2] 。为了评估劳动能力使用从椅子上站起来的测试[2],也可以使用“起身行走试验”、行走速度试验,这些方法列入简易机体功能评估法中(Short Physical Performance Battery, SPPB)。行走速度试验时病人要按平常速度行走4米,同时记录下走完这段距离所需的时间,并计算出速度( 单位:米/秒)[30]。根据EWGSOP2(2019年) 的建议,严重肌肉减少症的阈值是行走速度≤0.8 米/秒。“起身行走试验”时病人要从椅子上站起来,走3米到一个标记处,转身,走回椅子上并在上面坐下[31]。根据EWGSOP2本试验的阈值是≥20秒,为了用于诊断肌肉减少症。SPPB试验是综合的,并包括行走速度评估、平衡状态评估和从椅子上站起来的测试。在本试验最大的可能的结果是12分,≤8分是指身体功能差[32]。
为了评估身体成分和肌肉质量使用双能x线骨密度测定法(dual energy X-ray absorptiometry)和生物电阻抗、生物阻抗分析法(bioelectrical impedance analysis)。为了评估肌肉组织重量及其质量,根据EWGSOP,金本位制是CT扫描和核磁共振成像[1]。EWGSOP建议在L3椎骨水平上进行CT扫描检查、测量大腿中间三分之一的肌肉组织,以及用超声波评估肌肉组织[33]。肌肉减少症的实验室评估方法包括肌酸稀释试验、一系列神经肌肉生物标志物、非特异性炎症反应评估、荷尔蒙、合成代谢因素[1]。
肌肉减少症的放射诊断方法
肌肉减少症的放射诊断基于肌肉组织体积减少和其质量恶化的评估。双能量X射线吸收测定法是最常用的方法,因为它的辐射量低,而且有可能获得可重复的结果,尽管如此,它也有其缺点和限制:该研究涉及测量瘦体质量(lean body mass, LBM)而不是孤立的肌肉质量,这在液体摄入量增加和/或有大量纤维组织的患者中可能会得到不正确的结果;由于图像的投影类型,它也不可能评估肌肉质量[32];该方法的一个局限性是需要在单个密度计上进行动态研究并定期校准[34];不可能进行机会性研究。
EWGSOP将CT扫描和核磁共振成像称无创评估肌肉组织的黄金标准,但是这些方法由于试验/设备贵、缺少明确的诊断阈值以及需要分割来识别肌肉和其他解剖结构等原因而没有被广泛使 用[1, 32]。与双能X放射线吸收测量相比,进行CT扫描和核磁共振成像时不能扫描全身体,因为受剂量(对CT扫描)或者时间限制(对核磁共振成像),所以只能扫描一个身体部分。
目前CT评估肌肉质量的最确实和有效的方法之一是在L3椎体水平测量轴向切片[35]。在这个身体部分肌肉量和脂肪组织比例与整个身体的比例有很好的相关性[36]。该解剖标志可用于评估患者的肌肉减少症,也不考虑到身高体重指数,腹部实质器官、骨骼结构在这个切片上的表现最少,分割肌肉和脂肪组织的难度较小[37,38]。
肌肉减少症肥胖症的诊断
肌肉减少症最严重的并发症之一是肌肉疏松性肥胖症。经常(但不一定)肌肉减少症患者的肌肉质量损失伴随着脂肪组织的增加。这种过程直接影响到肌肉组织的质量,从而影响到身体的表现[39]。
肌肉减少症像肥胖一样,以亚急性慢性促炎症为特征,对肌肉组织和脂肪组织的功能有负面影响。在肌肉减少症肥胖症中还发现了肌肉与脂肪代谢的关系[41]。因此,有这种合并病症会提高不良后果的风险[42]。
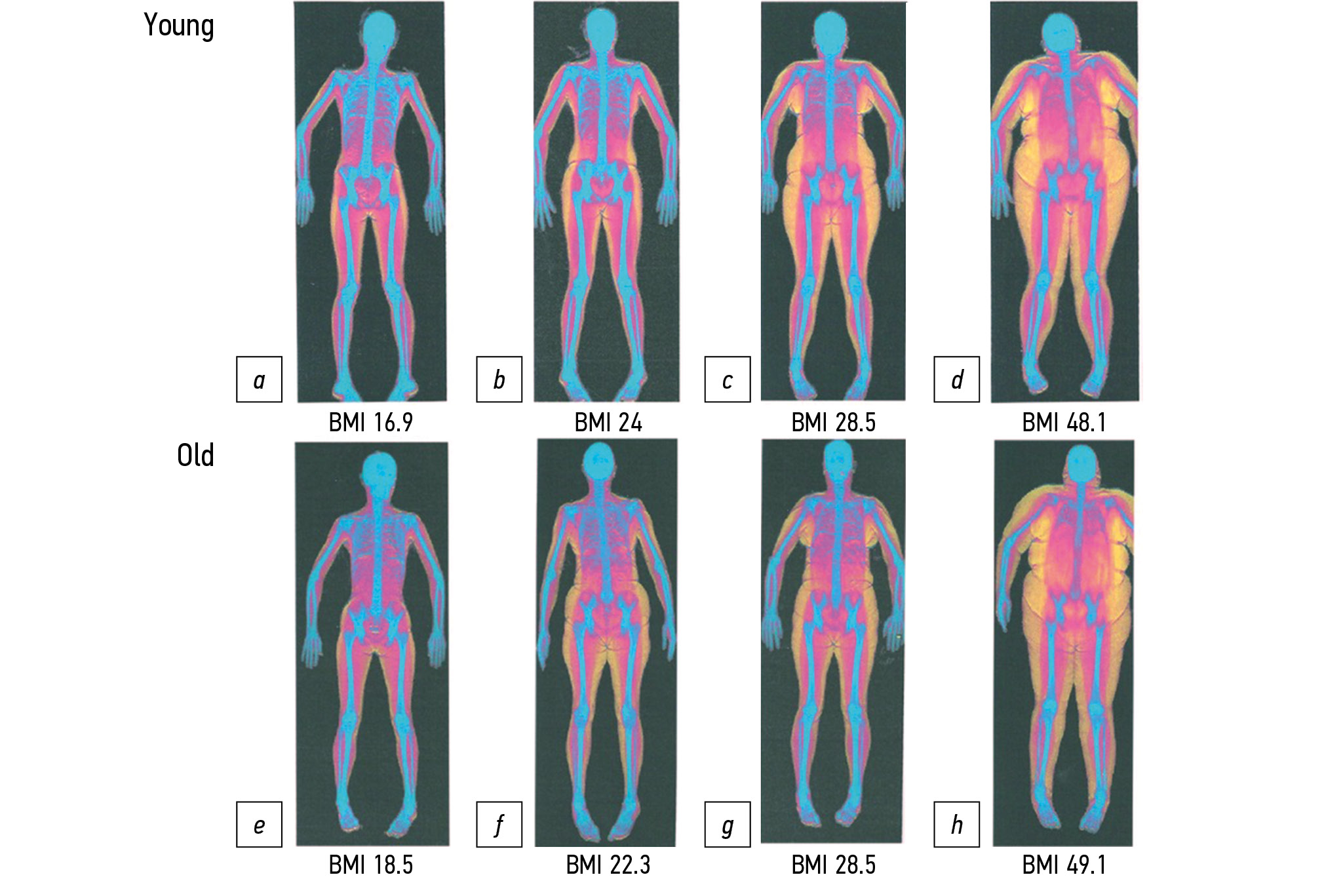
在诊断肌肉和脂肪组织时使用的诊断方法和可以使用于肌肉减少症肥胖症:双能x线骨密度测定法很有效的使用于确定身体成分和组织质量 比( 图1),CT扫描和核磁共振成像可以直观地看到内脏器官和皮下脂肪组织过多的面积和分布模式。
*图1年轻(a-d)和老年(e-h)妇女不同身体质量指数(BMI)值的双能量X射线吸收仪(根据D.J. Tomlinson等人[43])获得的诊断图像实例。用蓝色的标记骨组织,用红色的标记无脂肪的肌组织,用黄色的标记脂肪组织。
*可以在Creative Commons Attribution 3.0 International License (CC BY 3.0), Physiological Reports上找到.
肌肉减少症定量诊断标准
为了诊断肌肉量的降低经常使用两种参数,就是骨骼肌量(skeletal muscle mass)和阑尾骨骼肌量(ASM; appendicular skeletal muscle mass)。ASM是通过双能X射线吸收仪确定的(全身扫描,上肢和下肢--没有实质器官的身体部分;见图1),而骨骼肌质量是通过生物阻抗确定的。
骨骼肌质量参数(SMI;skeletal muscle index)作为导出参数。但是具有术语统一化的问题,因为不同的作者对同一概念的肌肉骨骼指数使用不同的公式[44]。有以下的根据不同参数调整的方法:ASM对身高(ASM/m2),ASM对体 重(ASM/kg)和AMM对身高体重指数(AMM/身高体重指数)。每种方法有自己的缺点:例如,身高调整SMI(ASM/m2)与女性气喘病的相关性不太可靠,而且没有考虑到脂肪组织的分布[45]。有信息,使用基于身高体重指数的SMI比基于身高的SMI对严重的肌肉减少症的检出率高两 倍[44]。唯一有普遍接受的用于确定肌肉减少症诊断的边界值是AMM与身高的比率(ASM/m2)。它们在欧洲(EWGSOP)和亚洲(Asian Working Group on Sarcopenia, AWGS)的肌肉减少症工作组的协议中确定。这些信息以及根据肌肉力量确定诊断的数量标准请见表1和表2。其他SMI方法使用别的调整参数(身高体重指数,重量),缺少通用边界值。
表1欧洲的老年人肌肉减少症工作组(EWGSOP2)的协议中确定的诊断肌肉减少症的数量边界值。
研究方法 | 男性的边界值 | 女性的边界值 |
EWGSOP2对肌力低下的数量标准 | ||
握力 | <27 kg | <16 kg |
从椅子上站起来的测试 | >15秒,5次从椅子上站起来 | |
EWGSOP2对肌肉量低下的数量标准 | ||
阑尾骨骼肌块(ASM) | <20 kg | <15 kg |
ASM/身高2,kg/m2 | <7.0 kg/m2 | <5.5 kg/m2 |
表2亚洲的肌肉减少症工作组(AWGS)的协议中确定的诊断肌肉减少症的数量边界值。
研究方法 | 男性的边界值 | 女性的边界值 |
AWGS对肌力低下的数量标准 | ||
握力 | <28 kg | <18 kg |
从椅子上站起来的测试 | >12秒,5次从椅子上站起来 | |
AWGS对肌肉量低下的数量标准 | ||
ASM/身高2,kg/m2 | <7.0 kg/m2 | <5.4 kg/m2 |
用CT和MRI进行死后仪器诊断的一种变体是用公式计算L3SMI, ,其中L3SMI是 L3椎体水平的骨骼-肌肉指数(cm2/m);S是切片中捕获的所有肌肉群的面积(cm2);h是人的高度(m)。
,其中L3SMI是 L3椎体水平的骨骼-肌肉指数(cm2/m);S是切片中捕获的所有肌肉群的面积(cm2);h是人的高度(m)。
在图2显示了通过人工智能算法测量L3水平的切片中夹有的肌肉组织、皮下脂肪组织和内脏脂肪组织面积的变体。
*图2使用J. Ha等人[46]的L3SEG-net AI算法在L3水平上对测量肌组织的、皮下脂肪组织和内脏脂肪组织进行切片的面积测量实例(单位:cm2)。自左而右用红色标记皮下脂肪组织,用紫色标记骨骼肌肉量,用绿色标记内脏脂肪组织。
*可以在Creative Commons Attribution 4.0 International License (CC BY 4.0), Scientific Reports上找到。
虽然使用CT扫描的应用有前途,并被接受为评估肌肉减少症的金标准[1],但至今还没有该指数的通用边界值[44]。
为了根据L3水平的SMI诊断肌肉减少症使用不同的标准。对男性的肌肉减少症边界值为<55 cm2/m2,对女性的为<39 cm2/m2[47],如果男生的身高体重指数>25为<53 cm2/m2,男生的身高体重指数<25为<43 cm2/m2,对女生不管身高体重指数为<41 cm2/m2[48]。统一化的缺乏再次强调必须进一步的人群研究,为了确定准确的SMI L3值。
肌肉减少症放射学诊断的新方法
使用CT可靠地评估肌肉质量损失程度的问题是需要对一系列CT图像中的肌肉组织进行人工分割,这在病人流量大的情况下是很困难的。然而,目前使用掩膜的半自动形态测量计算机软件在放射学肌肉密度方面的分割(肌肉通常在-29到+150豪斯菲尔德单位的范围内,脂肪在-30到-190豪斯菲尔德单位的范围内)还没有被普遍使用。这样的软件例子是Slice-O-Matic[49], AsanJ-Morphometry[50]和3D Slicer[51]。
随着人工智能技术在医学影像领域的广泛到来,特别是机器学习、神经网络和深度学习,现在有可能创造出能在CT扫描和核磁共振成像图像上更准确地分割不同结构的软件,而且还具有自学能力。尽管开发和使用该技术存在挑战,但文献中有相关科学论文涉及机器学习的分割算法的开发和验证,特别是癌症患者腹部CT扫描的骨骼肌分割[52-55]。用于训练模型的最流行的架构是U-Net[56],其首先开发目的是在细胞生物学进行显象,但是后来开始在放射诊断有效的使用。第二个最常用的架构是全连接神经网络(FCNN; Fully Connected Neural Network)[57] , 它是通用的,并最初是为语义分割开发的。主要的用于评估神经网络分割器性能的参数是有骰子系数,它显示了一个数据集与另一个数据集的一致性百分比,在这种情况下,预测的标记与神经网络开发者制定的标准的一致性。目前在文献中已经具有骰子系数超过0.97的算法例 子[58]。
越来越多的研究人员正在为几个不同的子任务创建基于几个架构的复杂模型,如J. Ha等人[46]:事实上,现成的软件使用了两种架构,YOLOv3和FCNN,其中第一个架构执行搜索特定对象(在本例中为L3椎体)的任务,而第二个架构本身执行分割。深度学习的使用也为创造显示骨骼和肌肉组织质量的地图提供了可能性,即以肌肉内脂肪的数量来显示。例子是D.W. Kim等人的文章[59],著者基于之前创建的FCNN架构的算法创建了一个网络应用,用这个一个网络应用可以从L3椎体水平的CT切片中创建标记图,清楚地显示肌肉组织与肌肉内脂肪的比例( 图 3 )。目前在工作中主要缺点是缺少相关的边界值或专门的指数,为了客观的,而不是主观的评估肌肉组织质量。但是,鉴于评估肌肉组织的强度和数量以及质量对完整诊断和预后肌肉减少症过程的重要性,这是一个相当有前景的未来研究领域。
*图3用网络的自动工具获得的肌肉组织质量图(根据D.W. Kim等人[59])。IMAT: 肌间脂肪组织区;LAMA:低密度肌肉组织区;NAMA:正常密度肌肉组织区;SMA:骨骼肌区;TAMA:腹部的肌肉组织一般区。 *可以在Creative Commons Attribution 4.0 International License (CC BY 4.0), JMIR Medical Informatics上找到。
值得注意的是,基于深度学习技术的专业软件的出现,不仅使临床和实际工作中明确了对肌肉疏松症的诊断,而且也为这种疾病的机会性筛查提供了可能性。
机会性筛查的可能性
正如我们之前所说,计算L3 SMI指数并在使用放射学技术的仪器诊断中获得其特异性,使得使用自动分割软件进行机会主义CT筛查成为可能。该解剖标志很有意思因为它经常出现在CT检查中,这部分是由于护理标准,例如癌症,需要CT扫描来寻找远处的转移灶。作为一种认可,L3SMI的计算在癌症患者中经常可以得到,并被用来评估癌症恶病质及其与疾病结果的关系[47, 48, 60]。P.M. Graffy等人的发表的作品[61]可以作为肌肉组织分割算法在大型回顾性筛查成功的例子。作者使用了2004年4月至2016年12月期间进行无造影剂增强的腹部CT的8037名临床症状不明显的患者的样本。考虑到样本大多数是健康的人,除了验证该算法外,作者还获得了健康人群的平均值。本研究的限制是只是使用了一家医院的CT图像,而且该算法在有金属结构伪影、运动伪影的CT图像和低剂量扫描方案获得的CT图像上表现不佳。最后一个限制任何分割算法所固有的。但是虽然有缺点,不能高估机会性筛查的重要优点之一,就是不必进行补充的X射线检验,因此减少了病人接受的假设X射线剂量。
在莫斯科统一医疗信息和分析系统(ERIS EMIAS)的统一放射学信息服务中成功实施机会性筛查的一个例子是对骨质疏松症[62]和其他一些疾病和状况(主动脉瘤、肺动脉高压的迹象与肺动脉干径的测定、肺癌、中风的迹象等)的机会性筛查项目。 使用计算机视觉技术分析医疗图像并进一步应用于莫斯科市的医疗保健系统进行了实验3[63]。
通过与已经实施的解决方案进行类比,并考虑到国外同事的经验,我们建议一种方案,即组织对肌肉减少症的机会性筛查(包括回顾性筛查),随后在ERIS EMIAS中实施。可以将U-Net++架构作为一个原型,用于开发L3椎体水平CT图像上肌肉和脂肪组织的自动分割工 具[64]。该方法的优点是神经网络的骰子系数值很高,包括训练样本量很小(皮下脂肪0.9706, 肌肉0.9312,肌肉内脂肪0.6465,内脏脂肪0.9609;训练样本量15名患者)。这个方向的前景是可以快速评估肌肉组织的数量,完善诊断 肌肉减少症的边界值,从而及时发现病理状况,预测和减少各种侵入性干预的不良后果,防止这类病人的生活质量逐渐下降,减少卫生系统资源的成本。
结论
肌肉减少症是一种对医疗体系造成社会和经济负担的疾病。虽然肌肉减少症没有高度专业化的药物疗法,但预防和及时的非药物治疗,并进行力量锻炼,可以降低潜在不良反应的风险。必须及时诊断肌肉力量和肌肉量的减少。在CT和MRT图像上自动分割肌肉和脂肪组织并随后计算L3SMI的人工智能算法,可以很好地补充已经使用的仪器诊断方法(双能X射线吸收仪和生物阻抗成像)。在ERIS EMIAS系统使用类似的软件,提供进行机会性筛查的可能性。
虽然EWGSOP将CT扫描和核磁共振成像视为金本位制,目前还没有公认的L3SMI定量值,以便用CT扫描和MRI诊断肌肉减少症。除此之外,还有统一术语“肌肉骨骼指数”的问题。如果这些问题通过进一步的人群研究得到解决,将有可能获得一种用于肌肉减少症的仪器诊断的新方法,并随后将其用于筛查这种疾病。
ADDITIONAL INFORMATION
Funding source. This article was prepared by a group of authors as part of research (No. in the Unified State Information System for Accounting of Research, Development, and Technological Works (EGISU): АААА-А21-121012290079-2) under the Program of the Moscow Healthcare Department “Scientific Support of the Capital’s Healthcare” for 2020–2022.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. A.S. Smorchkova — data sources collection and analysis, manuscript preparation; A.V. Petraikin — manuscript preparation, manuscript revision; D.S. Semenov, D.E. Sharova — review concept, manuscript preparation, final editing.
作者简介
Anastasia K. Smorchkova
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
Email: a.smorchkova@npcmr.ru
ORCID iD: 0000-0002-9766-3390
SPIN 代码: 4345-8568
Scopus 作者 ID: 57213145638
俄罗斯联邦, Moscow
Alexey V. Petraikin
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
Email: alexeypetraikin@gmail.com
ORCID iD: 0000-0003-1694-4682
SPIN 代码: 6193-1656
MD, Cand. Sci. (Med.)
俄罗斯联邦, MoscowDmitry S. Semenov
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
Email: d.semenov@npcmr.ru
ORCID iD: 0000-0002-4293-2514
SPIN 代码: 2278-7290
Scopus 作者 ID: 57213154475
Researcher ID: P-5228-2017
俄罗斯联邦, Moscow
Daria E. Sharova
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
编辑信件的主要联系方式.
Email: d.sharova@npcmr.ru
ORCID iD: 0000-0001-5792-3912
SPIN 代码: 1811-7595
俄罗斯联邦, Moscow
参考
- Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16−31. doi: 10.1093/ageing/afy169
- Tkacheva ON, Kotovskaya YV, Runikhina NK, et al. Clinical guidelines on Frailty. Russ J Geriatric Med. 2020;(1):11−46. (In Russ). doi: 10.37586/2686-8636-1-2020-11-46
- Bischoff-Ferrari HA, Orav JE, Kanis JA, et al. Comparative performance of current definitions of sarcopenia against the prospective incidence of falls among community-dwelling seniors age 65 and older. Osteoporos Int. 2015;26(12):2793–2802 doi: 10.1007/s00198-015-3194-y
- da Silva Alexandre T, de Oliveira Duarte YA, Ferreira Santos JL, et al. Sarcopenia according to the European working group on sarcopenia in older people (EWGSOP) versus Dynapenia as a risk factor for disability in the elderly. J Nutr Health Aging. 2014;18(5):547−553. doi: 10.1007/s12603-014-0465-9
- Sousa AS, Guerra RS, Fonseca I, et al. Sarcopenia and length of hospital stay. Eur J Clin Nutr. 2016;70(5):595−601. doi: 10.1038/ejcn.2015.207
- Faulkner JA, Larkin LM, Claflin DR, Brooks SV. Age-related changes in the structure and function of skeletal muscles. Clin Exp Pharmacol Physiol. 2007;34(11):1091−1096. doi: 10.1111/j.1440-1681.2007.04752.x
- Shafiee G, Keshtkar A, Soltani A, et al. Prevalence of sarcopenia in the world: a systematic review and meta-analysis of general population studies. J Diabetes Metab Disord. 2017;16:21. doi: 10.1186/s40200-017-0302-x
- Petermann-Rocha F, Balntzi V, Gray SR, et al. Global prevalence of sarcopenia and severe sarcopenia: a systematic review and meta-analysis. J Cachexia Sarcopenia Muscle. 2022;13(1):86−99. doi: 10.1002/jcsm.12783
- Safonova YA, Zotkin EG. Sarcopenia in older patients with osteoarthritis of large joints. Sci Pract Rheumatol. 2019;57(2):154−159. (In Russ). doi: 10.14412/1995-4484-2019-154-159
- Tsekoura M, Kastrinis A, Katsoulaki M, et al. Sarcopenia and its impact on quality of life. Adv Exp Med Biol. 2017;987:213−218. doi: 10.1007/978-3-319-57379-3_19
- Sepúlveda-Loyola W, Osadnik C, Phu S, et al. Diagnosis, prevalence, and clinical impact of sarcopenia in COPD: a systematic review and meta-analysis. J Cachexia Sarcopenia Muscle. 2020;11(5):1164−1176. doi: 10.1002/jcsm.12600
- Nipp RD, Fuchs G, El-Jawahri A, et al. Sarcopenia is associated with quality of life and depression in patients with advanced cancer. Oncologist. 2018;23(1):97−104. doi: 10.1634/theoncologist.2017-0255
- Beaudart C, Biver E, Reginster JY, et al. Development of a self-administrated quality of life questionnaire for sarcopenia in elderly subjects: the SarQoL. Age Ageing. 2015;44(6):960−966. doi: 10.1093/ageing/afv133
- Geerinck A, Bruyère O, Locquet M, et al. Evaluation of the responsiveness of the SarQoL questionnaire, a patient-reported outcome measure specific to sarcopenia. Adv Ther. 2018;35(11):1842−1858. doi: 10.1007/s12325-018-0820-z
- Geerinck A, Locquet M, Bruyère O, et al. Evaluating quality of life in frailty: applicability and clinimetric properties of the SarQoL questionnaire. J Cachexia Sarcopenia Muscle. 2021;12(2):319−330. doi: 10.1002/jcsm.12687
- Witham MD, Heslop P, Dodds RM, et al. Performance of the SarQoL quality of life tool in a UK population of older people with probable sarcopenia and implications for use in clinical trials: findings from the SarcNet registry. BMC Geriatr. 2022;22(1):368. doi: 10.1186/s12877-022-03077-5
- Russian translation and validation of SarQoL ― quality of life questionnaire for patients with sarcopenia. Sci Pract Rheumatol. 2019;57(1):38−45. (In Russ). doi: 10.14412/1995-4484-2019-38-45
- Gani F, Buettner S, Margonis GA, et al. Sarcopenia predicts costs among patients undergoing major abdominal operations. Surgery. 2016;160(5):1162−1171. doi: 10.1016/j.surg.2016.05.002
- Bruyère O, Beaudart C, Ethgen O, et al. The health economics burden of sarcopenia: a systematic review. Maturitas. 2019;119:61−69. doi: 10.1016/j.maturitas.2018.11.003
- Peterson MD, Rhea MR, Sen A, Gordon PM. Resistance exercise for muscular strength in older adults: a meta-analysis. Ageing Res Rev. 2010;9(3):226−237. doi: 10.1016/j.arr.2010.03.004
- McKendry J, Currier BS, Lim C, et al. Nutritional supplements to support resistance exercise in countering the sarcopenia of aging. Nutrients. 2020;12(7):2057. doi: 10.3390/nu12072057
- Robinson SM, Reginster JY, Rizzoli R, et al. Does nutrition play a role in the prevention and management of sarcopenia? Clin Nutr. 2018;37(4):1121−1132. doi: 10.1016/j.clnu.2017.08.016
- Lozano-Montoya I, Correa-Pérez A, Abraha I, et al. Nonpharmacological interventions to treat physical frailty and sarcopenia in older patients: a systematic overview ― the SENATOR Project ONTOP Series. Clin Interv Aging. 2017;12:721−740. doi: 10.2147/CIA.S132496
- Lappe JM, Binkley N. Vitamin D and sarcopenia/falls. J Clin Densitom. 2015;18(4):478−482. doi: 10.1016/j.jocd.2015.04.015
- Rooks D, Roubenoff R. Development of pharmacotherapies for the treatment of sarcopenia. J Frailty Aging. 2019;8(3):120−130. doi: 10.14283/jfa.2019.11
- Morley JE, Abbatecola AM, Argiles JM, et al. Sarcopenia with limited mobility: an international consensus. J Am Med Dir Assoc. 2011;12(6):403−409. doi: 10.1016/j.jamda.2011.04.014
- Malmstrom TK, Miller DK, Simonsick EM, et al. SARC-F: a symptom score to predict persons with sarcopenia at risk for poor functional outcomes. J Cachexia Sarcopenia Muscle. 2016;7(1):28−36. doi: 10.1002/jcsm.12048
- Bahat G, Yilmaz O, Kiliç C, et al. Performance of SARC-F in regard to sarcopenia definitions, muscle mass and functional measures. J Nutr Health Aging. 2018;22(8):898−903. doi: 10.1007/s12603-018-1067-8
- Porto JM, Nakaishi AP, Cangussu-Oliveira LM, et al. Relationship between grip strength and global muscle strength in community-dwelling older people. Arch Gerontol Geriatr. 2019;82:273−278. doi: 10.1016/j.archger.2019.03.005
- Maggio M, Ceda GP, Ticinesi A, et al. Instrumental and non-instrumental evaluation of 4-meter walking speed in older individuals. PLoS One. 2016;11(4):e0153583. doi: 10.1371/journal.pone.0153583
- Podsiadlo D, Richardson S. The timed “Up & go”: a test of basic functional mobility for frail elderly persons. J Am Geriatr Soc. 1991;39(2):142−148. doi: 10.1111/j.1532-5415.1991.tb01616.x
- Beaudart C, McCloskey E, Bruyère O, et al. Sarcopenia in daily practice: assessment and management. BMC Geriatr. 2016;16(1):170. doi: 10.1186/s12877-016-0349-4
- Stringer HJ, Wilson D. The role of ultrasound as a diagnostic tool for sarcopenia. J Frailty Aging. 2018;7(4):258−261. doi: 10.14283/jfa.2018.24
- Petraikin AV, Smoliarchuk MY, Petryaykin FA, et al. Assessment the accuracy of densitometry measurements using DMA PP2 Phantom. Traumatol Orthopedics Russ. 2019;25(3):124−134. (In Russ). doi: 10.21823/2311-2905-2019-25-3-124-134
- Shen W, Punyanitya M, Wang Z, et al. Total body skeletal muscle and adipose tissue volumes: estimation from a single abdominal cross-sectional image. J Appl Physiol (1985). 2004;97(6):2333−2338. doi: 10.1152/japplphysiol.00744.2004
- Mourtzakis M, Prado CM, Lieffers JR, et al. A practical and precise approach to quantification of body composition in cancer patients using computed tomography images acquired during routine care. Appl Physiol Nutr Metab. 2008;33(5):997−1006. doi: 10.1139/H08-075
- Kim EY, Kim YS, Park I, et al. Prognostic significance of CT-determined sarcopenia in patients with small-cell lung cancer. J Thorac Oncol. 2015;10(12):1795−1799. doi: 10.1097/JTO.0000000000000690
- Baracos V, Kazemi-Bajestani SM. Clinical outcomes related to muscle mass in humans with cancer and catabolic illnesses. Int J Biochem Cell Biol. 2013;45(10):2302−2308. doi: 10.1016/j.biocel.2013.06.016
- Franceschi C, Garagnani P, Morsiani C, et al. The continuum of aging and age-related diseases: common mechanisms but different rates. Front Med (Lausanne). 2018;5:61. doi: 10.3389/fmed.2018.00061
- Ferrucci L, Fabbri E. Inflammageing: chronic inflammation in ageing, cardiovascular disease, and frailty. Nat Rev Cardiol. 2018;15(9):505−522. doi: 10.1038/s41569-018-0064-2
- Zamboni M, Rubele S, Rossi AP. Sarcopenia and obesity. Curr Opin Clin Nutr Metab Care. 2019;22(1):13−19. doi: 10.1097/MCO.0000000000000519
- Batsis JA, Villareal DT. Sarcopenic obesity in older adults: etiology, epidemiology and treatment strategies. Nat Rev Endocrinol. 2018;14(9):513−537. doi: 10.1038/s41574-018-0062-9
- Tomlinson DJ, Erskine RM, Winwood K, et al. Obesity decreases both whole muscle and fascicle strength in young females but only exacerbates the aging-related whole muscle level asthenia Physiol Rep. 2014;2(6):e12030. doi: 10.14814/phy2.12030
- Kim KM, Jang HC, Lim S. Differences among skeletal muscle mass indices derived from height-, weight-, and body mass index-adjusted models in assessing sarcopenia. Korean J Intern Med. 2016;31(4):643−650. doi: 10.3904/kjim.2016.015
- Newman AB, Kupelian V, Visser M, et al. Sarcopenia: alternative definitions and associations with lower extremity function. J Am Geriatr Soc. 2003;51(11):1602−1609. doi: 10.1046/j.1532-5415.2003.51534.x
- Ha J, Park T, Kim HK, et al. Development of a fully automatic deep learning system for L3 selection and body composition assessment on computed tomography. Sci Rep. 2021;11(1):21656. doi: 10.1038/s41598-021-00161-5
- Prado CM, Lieffers JR, McCargar LJ, et al. Prevalence and clinical implications of sarcopenic obesity in patients with solid tumours of the respiratory and gastrointestinal tracts: a population-based study. Lancet Oncol. 2008;9(7):629−635. doi: 10.1016/S1470-2045(08)70153-0
- Martin L, Birdsell L, Macdonald N, et al. Cancer cachexia in the age of obesity: skeletal muscle depletion is a powerful prognostic factor, independent of body mass index. J Clin Oncol. 2013;31(12):1539−1547. doi: 10.1200/JCO.2012.45.2722
- Popuri K, Cobzas D, Esfandiari N, et al. Body composition assessment in axial ct images using fem-based automatic segmentation of skeletal muscle. IEEE Trans Med Imaging. 2016;35(2):512−520. doi: 10.1109/TMI.2015.2479252
- Park J, Gil JR, Shin Y, et al. Reliable and robust method for abdominal muscle mass quantification using CT/MRI: an explorative study in healthy subjects. PLoS One. 2019;14(9):e0222042. doi: 10.1371/journal.pone.0222042
- Fedorov A, Beichel R, Kalpathy-Cramer J, et al. 3D Slicer as an image computing platform for the quantitative imaging network. Magn Reson Imaging. 2012;30(9):1323−1341. doi: 10.1016/j.mri.2012.05.001
- Burns JE, Yao J, Chalhoub D, et al. A machine learning algorithm to estimate sarcopenia on abdominal CT. Acad Radiol. 2020;27(3):311−320. doi: 10.1016/j.acra.2019.03.011
- Blanc-Durand P, Schiratti JB, Schutte K, et al. Abdominal musculature segmentation and surface prediction from CT using deep learning for sarcopenia assessment. Diagn Interv Imaging. 2020;101(12):789−794. doi: 10.1016/j.diii.2020.04.011
- Graffy PM, Liu J, Pickhardt PJ, et al. Deep learning-based muscle segmentation and quantification at abdominal CT: application to a longitudinal adult screening cohort for sarcopenia assessment. Br J Radiol. 2019;92(1100):20190327. doi: 10.1259/bjr.20190327
- Ackermans LL, Volmer L, Wee L, et al. Deep learning automated segmentation for muscle and adipose tissue from abdominal computed tomography in polytrauma patients. Sensors (Basel). 2021;21(6):2083. doi: 10.3390/s21062083
- Ronneberger O, Fischer P, Brox T. U-Net: convolutional networks for biomedical image segmentation. Lecture Notes Computer Sci. 2015:234−241. doi: 10.1007/978-3-319-24574-4_28
- Shelhamer E, Long J, Darrell T. Fully convolutional networks for semantic segmentation. IEEE Trans Pattern Anal Mach Intell. 2017;39(4):640−651. doi: 10.1109/tpami.2016.2572683
- Kanavati F, Islam S, Arain Z, et al. Fully-automated deep learning slice-based muscle estimation from CT images for sarcopenia assessment. Clin Radiol. 2022;77(5):e363−e371. doi: 10.1016/j.crad.2022.01.036
- Kim DW, Kim KW, Ko Y, et al. Assessment of myosteatosis on computed tomography by automatic generation of a muscle quality map using a web-based toolkit: feasibility study. JMIR Med Inform. 2020;8(10):e23049. doi: 10.2196/23049
- Dong X, Dan X, Yawen A, et al. Identifying sarcopenia in advanced non-small cell lung cancer patients using skeletal muscle CT radiomics and machine learning. Thorac Cancer. 2020;11(9):2650−2659. doi: 10.1111/1759-7714.13598
- Graffy PM, Liu J, Pickhardt PJ, et al. Deep learning-based muscle segmentation and quantification at abdominal CT: Application to a longitudinal adult screening cohort for sarcopenia assessment. Br J Radiol. 2019;92(1100):20190327. doi: 10.1259/bjr.20190327
- Petraikin AV, Artyukova ZR, Nizovtsova LA, et al. Analysis of the effectiveness of implementing screening of osteoporosis. Health Care Manager. 2021;(2):31−39. (In Russ). doi: 10.21045/1811-0185-2021-2-31-39
- Morozov SP, Vladzymyrsky AV, Ledikhova NV, et al. Moscow experiment on Computer Vision in radiology: Involvement and participation of Radiologists. Doctor Inform Tech. 2020;(4):14−23. (In Russ). doi: 10.37690/1811-0193-2020-4-14-23
- Senyukova OV, Pyatkovskiy SA, Petraikin AV, et al. Automatic segmentation of muscle and adipose tissue on CT images for assessing human body composition and diagnosing sarcopenia. In: Conference “Information Technologies for personalized medicine” with a block of the summer school for young scientists, November 4, 2021: collection of abstracts. Moscow; 2021. P. 41. (In Russ). doi: 10.14341/cbaipm-2021-41
补充文件