Кальциноз митрального клапана как важная находка при сердечно-сосудистой визуализации
- Авторы: Филатова Д.А.1, Мершина Е.А.1, Плотникова М.Л.1, Лисицкая М.В.1, Синицын В.Е.1
-
Учреждения:
- Московский государственный университет имени М.В. Ломоносова
- Выпуск: Том 5, № 2 (2024)
- Страницы: 219-230
- Раздел: Оригинальные исследования
- Статья получена: 17.12.2023
- Статья одобрена: 24.01.2024
- Статья опубликована: 20.09.2024
- URL: https://jdigitaldiagnostics.com/DD/article/view/624754
- DOI: https://doi.org/10.17816/DD624754
- ID: 624754
Цитировать
Аннотация
Обоснование. Кальциноз митрального клапана — это хронический дегенеративный процесс в фиброзных структурах митрального клапана, на продвинутых стадиях повышающий риск развития эндокардита и нарушений ритма сердца, а также вносящий вклад в структуру сердечно-сосудистой смертности. Этиология кальциноза митрального клапана пока является дискутабельным вопросом, однако вклад атеросклероза в его развитие в настоящее время не вызывает сомнений. Распространённость кальциноза митрального клапана варьирует в разных возрастных группах и в среднем выше у людей с заболеваниями сердечно-сосудистой системы.
Цель — оценка распространённости кальциноза митрального клапана у пациентов, проходящих компьютерную томографическую ангиографию; выявление взаимосвязи между кальцинозом аортального и митрального клапанов и индексом коронарного кальция, а также признаками ремоделирования.
Материалы и методы. Проведено ретроспективное исследование 336 пациентов, проходивших компьютерную томографическую коронароангиографию с внутривенным контрастированием на базе Медицинского научно-образовательного центра Московского государственного университета имени М.В. Ломоносова в период с 13.11.2020 по 14.05.2022.
Результаты. Исследование показало высокую распространённость кальциноза аортального (16,4%) и митрального (11%) клапанов в популяции людей, проходящих обследование сердечно-сосудистой системы, а также наличие взаимосвязи между кальцинозом клапанов и индексом коронарного кальция.
Заключение. Выявление кальциноза митрального клапана у пациентов при рутинном обследовании играет важную роль для прогнозирования дальнейшего лечения и исхода, поскольку кальциноз клапанов является косвенным показателем риска ишемической болезни сердца. Будучи, как правило, случайной находкой при обследовании, кальциноз клапанов может свидетельствовать о наличии у пациента повышенного сердечно-сосудистого риска и должен быть поводом для дополнительного обследования при клинической необходимости.
Полный текст
Обоснование
Кальциноз митрального клапана (КМК) представляет собой хронический дегенеративный процесс в фиброзном кольце митрального клапана (МК), проявляющийся отложением кальция, чаще в области его задней створки. В качестве отдельного типа поражения МК также выделяют казеозный кальциноз, при котором происходит биохимическая трансформация кальция с образованием масс творожистой консистенции (что объясняет появление названия «казеозный»). Зачастую КМК (обычный или казеозный) ошибочно принимают за новообразование по результатам визуализирующих методик, и потому грамотное применение различных методик является важным для дифференциальной диагностики.
Общая встречаемость КМК оценивается в 13% [1], однако она может варьировать в зависимости от популяции в диапазоне от 4,6% до 15,8% [2]. При этом в группах пациентов с симптомами сердечно-сосудистых заболеваний КМК встречается в 35% случаев [3], а с продвинутой стадией почечной недостаточности — в 36% случаев [1]. Такой большой вариабельности способствует тот факт, что КМК чаще всего не вызывает клинических проявлений, а является случайной находкой при обследовании. В ходе Фрамингемского исследования было выявлено, что КМК практически никогда не регистрируется у людей моложе 40 лет [4]. Этот процесс вносит существенный вклад в структуру сердечно-сосудистой заболеваемости и смертности, а также оказывает влияние на результаты сердечно-сосудистой хирургии. В отличие от ревматического поражения, при кальцинозе функция МК обычно существенно не нарушается; тем не менее тяжёлый КМК может проводить к митральной регургитации.
Цель
Целью данной работы было выявление частоты встречаемости и характеристик КМК и кальциноза аортального клапана (КАК) у пациентов, проходящих обследование на предмет наличия атеросклероза коронарных артерий путём компьютерной томографической (КТ) коронароангиографии, а также поиск возможной связи между этими процессами и изучение влияния кальциноза на функцию МК и морфологию камер сердца.
Материалы и методы
Дизайн исследования
Проведено ретроспективное обсервационное одноцентровое сплошное исследование, включавшее пациентов, проходивших КТ-коронароангиографию на базе отделения рентгенодиагностики Медицинского научно-образовательного центра Московского государственного университета имени М.В. Ломоносова.
Критерии соответствия
Критерии включения: пациенты, направленные на КТ-коронароангиографию с контрастированием с целью исключения атеросклероза коронарных артерий.
Критерии невключения:
- состояние после стентирования, шунтирования коронарных артерий (ввиду невозможности оценить кальциевый индекс);
- состояние после протезирования клапанов сердца;
- наличие врождённых пороков и новообразований сердца;
- наличие в анамнезе тяжёлой аллергической реакции на йод-содержащий контрастный препарат;
- тяжёлое состояние пациента, не позволяющее провести исследование диагностического качества.
Критерии исключения: отказ пациента от участия в исследовании.
Продолжительность исследования
Исследование было проведено в период с 13.11.2020 по 14.05.2022.
Описание медицинского вмешательства
Пациентам проводилась синхронизированная с электрокардиограммой КТ-коронароангиография, включавшая два последовательных сканирования: нативное сканирование для определения суммарного кальциевого индекса Агатстона (СКИ) и сканирование в артериальную фазу введения контрастного препарата (использовался йод-содержащий контрастный препарат в дозе 300 мг йода в мл, 1 мл на кг массы тела). Во всех случаях была использована ретроспективная синхронизация с электрокардиограммой, что дало возможность дополнительно визуализировать камеры сердца в различные фазы сердечного сокращения. При анализе полученных изображений использовалась реконструкция коронарных артерий в режиме MPR.
Основной исход исследования
Выявление КМК и КАК, а также кальцинированных бляшек в стенках коронарных артерий.
Дополнительные исходы исследования
Выявление признаков ремоделирования сердца (дилатация левого предсердия).
Анализ в подгруппах
Пациенты были разделены на подгруппы в зависимости от наличия кальциноза клапанов сердца:
- группа КМК;
- группа КАК;
- группа КМК и КАК;
- группа без кальциноза клапанов.
Кроме того, пациенты были разделены на подгруппы в зависимости от значения СКИ:
- 0 (нет поражения коронарных артерий);
- 1–10 (минимальное поражение);
- 11–100 (незначительное поражение);
- 101–400 (умеренное поражение);
- выше 400 единиц (тяжёлое поражение).
Этическая экспертиза
Проведение исследования одобрено этическим комитетом Медицинского научно-образовательного центра Московского государственного университета имени М.В. Ломоносова от 24.09.2020.
Статистический анализ
Статистический анализ проведён на базе Microsoft Office Excel 2010 (Microsoft Corporation, США). Для анализа полученных данных использованы критерии Краскела–Уоллиса, Манна–Уитни, хи-квадрат. Уровень значимости p <0,05.
Результаты
Участники исследования
В исследовании приняли участие 336 пациентов, среди них 195 мужчин (58%). Средний возраст составил 61,1±11,8 года.
Основные результаты исследования
Частота встречаемости КМК в группе исследования составила 11% (37 пациентов), КАК — 16,4% (55 пациентов); у 3,9% (13 пациентов) встречался кальциноз обоих клапанов. У 7 (2,1%) пациентов был отмечен казеозный КМК.
Подробная информация по группам исследования и выявленной частоте встречаемости кальциноза клапанов показана в табл. 1.
Таблица 1. Частота встречаемости кальциноза клапанов сердца в группе исследования
КМК | КАК | КМК, КАК | Без кальциноза | |
Количество пациентов | 37 | 55 | 13 | 251 |
Средний возраст, лет | 66,1±8,9 | 66,7±7,9 | 67,0±9,7 | 60,1±11,6 |
Мужчины/Женщины | 16/21 | 32/23 | 5/8 | 149/102 |
СКИ, ед. | 582,3±875,3 | 435,3±591,4 | 314,2±215,2 | 176,5±402,9 |
Примечание. КАК — кальциноз аортального клапана; КМК — кальциноз митрального клапана; СКИ — суммарный кальциевый индекс.
При разделении пациентов на группы в зависимости от наличия кальциноза того или иного клапана оказалось, что различия СКИ между ними статистически значимы (анализ проведён с использованием критерия Краскела–Уоллиса, p <0,001): максимальное значение СКИ было получено в группе пациентов с КМК, минимальное — в группе пациентов без кальциноза.
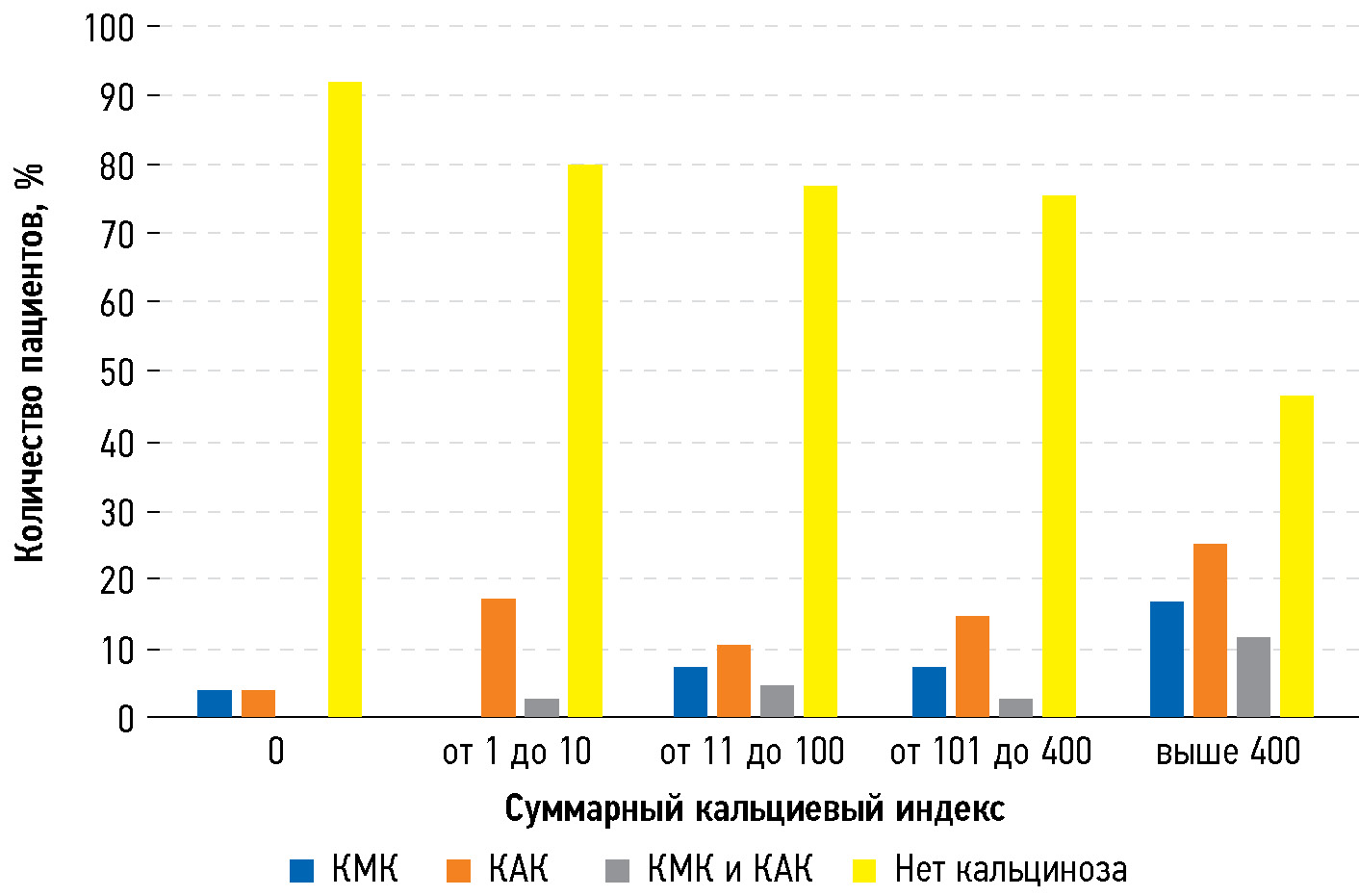
При анализе произвольных таблиц сопряжённости с использованием критерия хи-квадрат была выявлена положительная корреляция между СКИ и частотой встречаемости КМК и КАК (p <0,01) (рис. 1). Тем не менее в случае КАК достоверность связи оказалась ниже, чем в случае КМК.
Рис. 1. Количество пациентов с кальцинозом различных клапанов в группах с разным суммарным кальциевым индексом: КМК — кальциноз митрального клапана, КАК — кальциноз аортального клапана.
Выраженность кальциноза клапанов была оценена посредством подсчёта СКИ и ориентировочного объёма кальция; при сопоставлении СКИ коронарных артерий и выраженности кальциноза клапанов (с использованием критерия Манна–Уитни) оказалось, что между этими параметрами не существует значимой взаимосвязи. Эта закономерность соблюдалась как в группе пациентов с КМК, так и в группе с КАК.
Дополнительные результаты исследования
Была исследована возможная ассоциация между увеличением левого предсердия (косвенным фактором наличия митрального порока) и КМК. При анализе с использованием критерия хи-квадрат оказалось, что связь между фактором КМК и исходом в виде увеличения левого предсердия статистически значима (p=0,002).
Нежелательные явления
В ходе исследования нежелательных результатов и побочных эффектов от контрастного препарата зарегистрировано не было.
Обсуждение
Резюме основного результата исследования
Данные проведённого ретроспективного исследования показали высокую встречаемость КМК и КАК в популяции людей, проходящих обследование сердечно-сосудистой системы методом КТ-коронароангиографии, а также наличие взаимосвязи между кальцинозом клапанов и СКИ; при этом более значимая корреляция отмечалась в случае КМК. Впрочем, выраженность кальциноза оказалась не связана с СКИ коронарных артерий. Кроме того, выявлена взаимосвязь между КМК и дилатацией левого предсердия.
Обсуждение основного результата исследования
Имеются литературные данные о наличии корреляции между КМК, КАК и коронарным атеросклерозом [5]. В свою очередь последний коррелирует с системным атеросклерозом. Полученные в ходе настоящего исследования результаты представляют интерес ввиду того, что КАК оказался не так значимо связан с уровнем СКИ, по сравнению с КМК. Это подчёркивает тот факт, что вероятность кальциноза клапанов сердца определяется не только системным атеросклерозом и его традиционными факторами риска, но и другими условиями. Своевременная диагностика КМК имеет клиническое значение в свете того, что его наличие можно расценивать как предиктор развития атеросклероза и порока МК в будущем.
Патофизиология формирования КМК пока окончательно не выяснена. P.F. Nestico и соавт. описали КМК как хронический дегенеративный ассоциированный с возрастом процесс в волокнистой опорной структуре МК [6]. В первое десятилетие жизни митральное кольцо состоит из параллельных тонких коллагеновых и некоторого количества эластических волокон. С возрастом происходит утолщение и уплотнение коллагеновых волокон, а также увеличение количества эластических волокон; при этом между коллагеновыми волокнами накапливаются липидные пятна, и в тех же зонах появляются очаги кальцификации. С годами дезориентация коллагеновых волокон усиливается, отложения липидов и кальция увеличиваются в размерах. Известно, что предрасположенными к развитию атеросклероза являются прежде всего области со сниженным напряжением сдвига и повышенной турбулентностью кровотока [7]. Кальцификация и отложение липидов в области митрального кольца являются обычными аутопсийными находками у людей без макроскопической картины КМК [8].
Исследования продемонстрировали значимые сходства между сосудистым атеросклерозом и хроническими дегенеративными изменениями клапанов (митрального и аортального) [9]; триггером для всех этих событий, как правило, является повреждение или дисфункция эндотелия [10]. Более того, в процессе развития кальциноза клапан претерпевает характерные для атеросклероза изменения, в том числе развитие воспаления [11], накопление липидов [12] и активацию матриксных металлопротеиназ [13]. Показано также, что потенциальную роль в развитии кальциноза клапанов может играть ренин-ангиотензин-альдостероновая система [14]. Фокальное накопление кальциевых депозитов и липопротеинов в областях микроповреждений со временем трансформируется в плотные ригидные структуры, формирующие КМК. Кроме того, многочисленные исследования показали существенную корреляцию между выраженностью системного атеросклероза и его факторов риска с КМК [15–17]. Таким образом, ряд исследователей высказывают мнение о том, что КМК и сосудистый атеросклероз являются разными формами одного заболевания.
Тем не менее, важным аспектом понимания патогенеза КМК является то, что, в отличие от классического атеросклероза, который чаще поражает мужчин, КМК чаще встречается у женщин [18], причём именно у них отмечаются более крупные отложения в области митрального кольца. Есть предположение, что формирование внематочных отложений кальция у возрастных женщин связано с тяжёлой потерей костной массы вследствие остеопороза в постменопаузе [19]. Кроме того, показано, что использование бисфосфонатов коррелирует с более низкой распространённостью сердечно-сосудистой кальцификации у женщин в возрасте старше 65 лет [20].
Кроме атеросклероза, нельзя недооценивать роль в развитии КМК состояний, сопровождающихся длительной перегрузкой МК: артериальной гипертензии, аортального стеноза, гипертрофической кардиомиопатии. При этих состояниях пиковое систолическое давление и давление закрытия МК увеличиваются, что приводит к возрастанию нагрузки на митральное кольцо и его дегенерации [21].
Ещё одним важным фактором, предрасполагающим к развитию КМК, является хроническая почечная недостаточность. Выявлено, что сниженная скорость клубочковой фильтрации, терминальная почечная недостаточность и потребность в гемодиализе коррелируют с частотой встречаемости КМК [22]. Причины данной ассоциации могут быть разными, в их числе большая распространённость факторов риска сердечно-сосудистых заболеваний и атеросклероза у данной категории пациентов, более тяжёлая коморбидность, а также нарушение кальциево-фосфорного метаболизма [23, 24]. A. Jesri и соавт. продемонстрировали, что почти у 60% пациентов с КМК отмечается снижение скорости клубочковой фильтрации до значений 60 мл/(мин×1,73 м2) и менее [25]. Интересно, что подобной связи между хронической болезнью почек и КАК найдено не было [26]. К развитию КМК также больше предрасположены люди с некоторыми врождёнными нарушениями, например, с синдромом Марфана, когда возникает системное поражение соединительной ткани и сердечно-сосудистой системы [27].
В ходе Фрамингемского исследования было выявлено, что наличие КМК коррелирует с частотой развития неблагоприятных сердечно-сосудистых событий, а также с сердечно-сосудистой смертностью [28], причём вероятность последних зависит от выраженности КМК [17]. Основной причиной этого является то, что КМК считается одним из маркёров системного атеросклероза и атеросклероза коронарных артерий [29]. Свой вклад в данную взаимосвязь могут вносить также воспалительные, иммунные и метаболические процессы. Показано, что наличие КМК у людей младше 65 лет с болью в грудной клетке — важный независимый предиктор значимого стеноза по крайней мере одной коронарной артерии. У женщин моложе 65 лет отсутствие КМК показано как независимый предиктор отсутствия ишемической болезни сердца [3]. Таким образом, факт выявления КМК у лиц младше 65 лет должен расцениваться клиницистами как значимый маркёр наличия ишемической болезни сердца. Особое значение это имеет у лиц с отсутствием клинической картины данной патологии, чьи факторы риска и образ жизни должны быть скорректированы для уменьшения риска неблагоприятных коронарных событий.
В случае корреляции КМК и инсульта в литературе на сегодняшний день всё не так однозначно. В одних исследованиях (например, J.R. Kizer и соавт. [30]) показано, что такая корреляция есть, в других (C.J. Rodriguez и соавт. [31]) она значительно снижалась после учёта классических факторов риска инсульта. Данные о наличии корреляции между КМК и инсультом можно объяснить тем, что КМК ассоциируется с наличием атеросклеротического поражения коронарных артерий, а также фибрилляцией желудочков [32, 33].
Есть данные о том, что кальциноз может влиять на функцию МК по причине того, что при наличии плотной инфильтрации основания задней створки уменьшается её мобильность. Это в свою очередь увеличивает вероятность элонгации и разрыва хорд, следствием чего является вторичная митральная регургитация [34]. Что касается эндокардита, то частота его развития при наличии КМК неизвестна. Это редкое, но потенциально летальное состояние проявляется образованием вегетаций на створках МК либо на самом митральном кольце [35].
Ассоциация КМК и нарушений ритма сердца известна давно. Наиболее часто развиваются атриовентрикулярная блокада, блокада ножек пучка Гиса, внутрижелудочковые блокады проведения [36]. В литературе есть данные о том, что в группе пациентов с КМК частота нарушений ритма сердца значительно выше, чем в группе контроля (70% против 34%) [37]. Возможно, это связано с прямым распространением кальцинации на область атриовентрикулярного узла и пучков Гиса. Значимую корреляцию КМК и фибрилляции предсердий связывают также с расширением левого предсердия [38].
С учётом преимущественно бессимптомного течения КМК и его потенциально жизнеугрожающих последствий, важное значение приобретает своевременная диагностика данного состояния. В ряде случаев сложность представляет дифференциальная диагностика КМК с тромбом и новообразованием. Кроме того, часть авторов отмечает, что кальциноз может быть схож по внешнему виду с абсцессом миокарда [39].
Методом первичной диагностики КМК служит эхокардиография (ЭхоКГ): КМК проявляется наличием статичной гиперэхогенной структуры с чёткими краями, обычно в подклапанном пространстве под задней створкой МК. Иногда структура КМК бывает неоднородной, с гипоэхогенными включениями. Кальцинаты крупного размера могут создавать акустическую тень, которая препятствует чёткой визуализации. При наличии типичных характеристик КМК дальнейшее обследование не требуется, однако зачастую чувствительность ЭхоКГ оказывается недостаточной для различения кальция и других плотных структур (например, коллагена). Абсцесс на поздних стадиях своего развития может быть внешне схож с КМК ввиду наличия участков консолидации и кальцификации. Использование магнитно-резонансной томографии (МРТ) и КТ как методов дообследования оправдано в случаях затруднения визуализации при ЭхоКГ, наличия неспецифического повышения уровней маркёров воспаления (что не позволяет исключить абсцесс или новообразование), а также при некоторых других неоднозначных ситуациях.
При МРТ КМК обычно имеет пониженный сигнал на стандартных кино-последовательностях, что порой затрудняет чёткую дифференцировку кальция, прилежащего миокарда и других объёмных образований данной локализации. Сканирование в режиме Т2-взвешенных изображений позволяет более чётко дифференцировать КМК от других близлежащих структур; после введения контрастного препарата не выявляется значимая перфузия в раннюю фазу контрастирования, и отсроченное контрастирование — в позднюю фазу (рис. 2, c). Возможно обнаружение тонкого ободка контрастирования по периферии в отсроченную фазу. Отсутствие васкуляризации и некроза в центральной части позволяет отличить КМК от доброкачественного или злокачественного новообразования. В отличие от КМК, центральная часть которого имеет на Т1- и Т2-взвешенных изображениях гипоинтенсивный сигнал, при миксоме и липоме отмечается гиперинтенсивность, что объясняется наличием муцина или жира в структуре стромы [40]. МР-признаки абсцессов миокарда зависят от стадии, однако чаще всего они представляют собой образования с гиперинтенсивным сигналом в центре и гипоинтенсивным — по периферии. Тем не менее чувствительность и специфичность МРТ не всегда достаточны для однозначной дифференциальной диагностики КМК с тромбом и опухолью; в качестве метода дообследования в этих случаях применяется КТ.
Рис. 2. Пациентка, 65 лет. Кальциноз митрального клапана по данным различных визуализирующих методик: a, b — компьютерная томография (аксиальная и сагиттальная проекции, без контрастирования); c — магнитно-резонансная томография (четырёхкамерная проекция по длинной оси, режим отсроченного контрастного усиления).
При проведении КТ КМК однозначно выявляется как гиперденсная структура без признаков накопления контрастного препарата с аваскулярным «мягким» центром; иногда по периферии визуализируется фиброзная капсула с неравномерными плотными включениями кальция [41] (см. рис. 2, a, b). КТ позволяет определять локализацию КМК, его величину и влияние на функцию клапана. Количественно оценить КМК можно с помощью подсчёта СКИ.
Таким образом, для постановки однозначного диагноза в случае КМК рекомендуется использование мультимодального подхода: методом первой линии является ЭхоКГ, в случае получения неоднозначных результатов обследование должно быть дополнено проведением как МРТ, так и КТ. Стоит отметить, что использование различных методов визуализации позволяет не только поставить чёткий диагноз, но и даёт важную информацию о других состояниях пациента (атеросклерозе коронарных артерий, стенозе клапана, снижении сократительной функции желудочков, участках гипо- или дискинеза и др.), что может повлиять на тактику его ведения.
Ограничения исследования
К ограничениям исследования относится анализ исключительно кальцинированных бляшек коронарных артерий, без учёта мягких бляшек. Анализ корреляции степени стенозов коронарных артерий, а также мягких бляшек будет проведён на следующем этапе исследования. Кроме того, среди ограничений следует отметить отсутствие клинических данных, а также данных ЭхоКГ.
Заключение
КМК часто встречается в популяции, обычно в бессимптомной форме. Этиология данного состояния в настоящее время не вполне ясна, однако не вызывает сомнения его ассоциация с системным атеросклерозом. Ввиду наличия ассоциации КМК с атеросклерозом и пороком МК ранняя диагностика этого состояния приобретает важное клиническое значение для профилактики потенциально опасных состояний.
В ходе настоящего исследования была выявлена высокая частота встречаемости кальциноза клапанов в популяции (частота КМК составила 11%, частота КАК — 16,4%, кальциноз обоих клапанов встречался в 3,9% случаев), а также корреляция между кальцинозом клапанов и коронарных артерий, при этом более выраженная взаимосвязь отмечалась в случае МК. Кроме того, была выявлена взаимосвязь между КМК и дилатацией левого предсердия.
Зачастую возникают сложности при проведении дифференциальной диагностики КМК с новообразованиями сердца, тромбозом и некоторыми другими состояниями. Первичным методом диагностики КМК является ЭхоКГ, однако данная патология часто может быть ошибочно принята за новообразование или тромбоз. Именно поэтому при получении недостаточного количества информации рекомендовано проводить дообследование в объёме МРТ и КТ сердца. Рекомендуется комплексный подход и грамотное наблюдение за пациентами с КМК и сопутствующими состояниями, в том числе кальцинозом других клапанов сердца.
Дополнительная информация
Источник финансирования. Работа выполнена в рамках Государственного задания МГУ имени М.В. Ломоносова (тема 0708 «Применение новых функциональных и перфузионных методик КТ и МРТ для улучшения диагностики»).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Наибольший вклад распределён следующим образом: Д.А. Филатова — формирование группы исследования, проведение статистического анализа данных, написание текста статьи; Е.А. Мершина — разработка концепции исследования, редактирование текста статьи; М.Л. Плотникова — редактирование текста статьи; М.В. Лисицкая — разработка концепции исследования, редактирование текста статьи; В.Е. Синицын — разработка концепции исследования, утверждение окончательного варианта текста.
Об авторах
Дарья Андреевна Филатова
Московский государственный университет имени М.В. Ломоносова
Автор, ответственный за переписку.
Email: dariafilatova.msu@mail.ru
ORCID iD: 0000-0002-0894-1994
SPIN-код: 2665-5973
MD
Россия, МоскваЕлена Александровна Мершина
Московский государственный университет имени М.В. Ломоносова
Email: elena_mershina@mail.ru
ORCID iD: 0000-0002-1266-4926
SPIN-код: 6897-9641
канд. мед. наук
Россия, МоскваМария Леонидовна Плотникова
Московский государственный университет имени М.В. Ломоносова
Email: maria_plotnikova@inbox.ru
ORCID iD: 0000-0001-7533-9867
SPIN-код: 1857-0770
MD
Россия, МоскваМария Валерьевна Лисицкая
Московский государственный университет имени М.В. Ломоносова
Email: lissenok@inbox.ru
ORCID iD: 0000-0002-8402-7643
SPIN-код: 2301-8480
канд. мед. наук
Россия, МоскваВалентин Евгеньевич Синицын
Московский государственный университет имени М.В. Ломоносова
Email: vsini@mail.ru
ORCID iD: 0000-0002-5649-2193
SPIN-код: 8449-6590
д-р мед. наук, профессор
Россия, МоскваСписок литературы
- Maher E.R., Young G., Smyth-Walsh B., Pugh S., Curtis J.R. Aortic and mitral valve calcification in patients with end-stage renal disease // Lancet. 1987. Vol. 330, N 8564. P. 875–877. doi: 10.1016/s0140-6736(87)91370-5
- Fox E., Harkins D., Taylor H., et al. Epidemiology of mitral annular calcification and its predictive value for coronary events in African Americans: the Jackson Cohort of the Atherosclerotic Risk in Communities Study // Am. Heart J. 2004. Vol. 148, N 6. P. 979–984. doi: 10.1016/j.ahj.2004.05.048
- Atar S., Jeon D.S., Luo H., Siegel R.J. Mitral annular calcification: a marker of severe coronary artery disease in patients under 65 years old // Heart. 2003. Vol. 89, N 2. P. 161–164. doi: 10.1136/heart.89.2.161
- Savage D.D., Garrison R.J., Castelli W.P., et al. Prevalence of submitral (anular) calcium and its correlates in a general population-based sample (the Framingham Study) // Am. J. Cardiol. 1983. Vol. 51, N 8. P. 1375–1378. doi: 10.1016/0002-9149(83)90315-6
- Barasch E., Gottdiener J.S., Larsen E.K.M., et al. Clinical significance of calcification of the fibrous skeleton of the heart and aortosclerosis in community dwelling elderly. The Cardiovascular Health Study (CHS) // Am. Heart J. 2006. Vol. 151, N 1. P. 39–47. doi: 10.1016/j.ahj.2005.03.052
- Nestico P.F., Depace N.L., Morganroth J., Kotler M.N., Ross J. Mitral annular calcification: clinical, pathophysiology, and echocardiographic review // Am. Heart J. 1984. Vol. 107, N 5 Pt 1. P. 989–996. doi: 10.1016/0002-8703(84)90840-8
- Stary H.C., Blankenhorn D.H., Chandler A.B., et al. A definition of the intima of human arteries and of its atherosclerosis-prone regions. A report from the Committee on Vascular Lesions of the Council on Arteriosclerosis, American Heart Association // Arterioscler. Thromb. J. Vasc. Biol. 1992. Vol. 12, N 1. P. 120–134. doi: 10.1161/01.atv.12.1.120
- Allison M.A., Cheung P., Criqui M.H., Langer R.D., Wright C.M. Mitral and Aortic Annular Calcification Are Highly Associated With Systemic Calcified Atherosclerosis // Circulation. 2006. Vol. 113, N 6. P. 861–866. doi: 10.1161/CIRCULATIONAHA.105.552844
- Otto C.M., Kuusisto J., Reichenbach D.D., Gown A.M., O’Brien K.D. Characterization of the early lesion of “degenerative” valvular aortic stenosis. Histological and immunohistochemical studies // Circulation. 1994. Vol. 90, N 2. P. 844–853. doi: 10.1161/01.cir.90.2.844
- Mohler E.R. Mechanisms of aortic valve calcification // Am. J. Cardiol. 2004. Vol. 94, N 11. P. 1396–1402. doi: 10.1016/j.amjcard.2004.08.013
- Shahi C.N., Ghaisas N.K., Goggins M., et al. Elevated levels of circulating soluble adhesion molecules in patients with nonrheumatic aortic stenosis // Am. J. Cardiol. 1997. Vol. 79, N 7. P. 980–982. doi: 10.1016/s0002-9149(97)00027-1
- Olsson M., Thyberg J., Nilsson J. Presence of oxidized low density lipoprotein in nonrheumatic stenotic aortic valves // Arterioscler. Thromb. Vasc. Biol. 1999. Vol. 19, N 5. P. 1218–1222. doi: 10.1161/01.atv.19.5.1218
- Edep M.E., Shirani J., Wolf P., Brown D.L. Matrix metalloproteinase expression in nonrheumatic aortic stenosis // Cardiovasc. Pathol. 2000. Vol. 9, N 5. P. 281–286. doi: 10.1016/s1054-8807(00)00043-0
- O’Brien K.D., Shavelle D.M., Caulfield M.T., et al. Association of Angiotensin-Converting Enzyme With Low-Density Lipoprotein in Aortic Valvular Lesions and in Human Plasma // Circulation. 2002. Vol. 106, N 17. P. 2224–2230. doi: 10.1161/01.CIR.0000035655.45453.D2
- Pohle K., Otte M., Mäffert R., et al. Association of cardiovascular risk factors to aortic valve calcification as quantified by electron beam computed tomography // Mayo Clin. Proc. 2004. Vol. 79, N 10. P. 1242–1246. doi: 10.4065/79.10.1242
- Wong N.D., Sciammarella M., Arad Y., et al. Relation of thoracic aortic and aortic valve calcium to coronary artery calcium and risk assessment // Am. J. Cardiol. 2003. Vol. 92, N 8. P. 951–955. doi: 10.1016/s0002-9149(03)00976-7
- Fox C.S., Vasan R.S., Parise H., et al. Mitral Annular Calcification Predicts Cardiovascular Morbidity and Mortality // Circulation. 2003. Vol. 107, N 11. P. 1492–1496. doi: 10.1161/01.CIR.0000058168.26163.BC
- Tenenbaum A., Fisman E.Z., Pines A., et al. Gender paradox in cardiac calcium deposits in middle-aged and elderly patients: mitral annular and coronary calcifications interrelationship // Maturitas. 2000. Vol. 36, N 1. P. 35–42. doi: 10.1016/s0378-5122(00)00120-1
- Sugihara N., Matsuzaki M. The influence of severe bone loss on mitral annular calcification in postmenopausal osteoporosis of elderly Japanese women // Jpn. Circ. J. 1993. Vol. 57, N 1. P. 14–26. doi: 10.1253/jcj.57.14
- Elmariah S., Delaney J.A.C., O’Brien K.D., et al. Bisphosphonate Use and Prevalence of Valvular and Vascular Calcification in Women MESA (The Multi-Ethnic Study of Atherosclerosis) // J. Am. Coll. Cardiol. 2010. Vol. 56, N 21. P. 1752–1759. doi: 10.1016/j.jacc.2010.05.050
- Elmariah S., Delaney J.A.C., Bluemke D.A., et al. Associations of LV hypertrophy with prevalent and incident valve calcification: Multi-Ethnic Study of Atherosclerosis // JACC Cardiovasc. Imaging. 2012. Vol. 5, N 8. P. 781–788. doi: 10.1016/j.jcmg.2011.12.025
- Adler Y., Koren A., Fink N., et al. Association between mitral annulus calcification and carotid atherosclerotic disease // Stroke. 1998. Vol. 29, N 9. P. 1833–1837. doi: 10.1161/01.str.29.9.1833
- Umana E., Ahmed W., Alpert M.A. Valvular and perivalvular abnormalities in end-stage renal disease // Am. J. Med. Sci. 2003. Vol. 325, N 4. P. 237–242. doi: 10.1097/00000441-200304000-00010
- Alfrey A.C. The role of abnormal phosphorus metabolism in the progression of chronic kidney disease and metastatic calcification // Kidney Int. Suppl. 2004. N 90. P. S13–S17. doi: 10.1111/j.1523-1755.2004.09003.x
- Jesri A., Braitman L.E., Pressman G.S. Severe mitral annular calcification predicts chronic kidney disease // Int. J. Cardiol. 2008. Vol. 128, N 2. P. 193–196. doi: 10.1016/j.ijcard.2007.05.015
- Ribeiro S., Ramos A., Brandão A., et al. Cardiac valve calcification in haemodialysis patients: role of calcium-phosphate metabolism // Nephrol. Dial. Transplant. 1998. Vol. 13, N 8. P. 2037–2040. doi: 10.1093/ndt/13.8.2037
- Correia J., Rodrigues D., da Silva A.M., Sá e Melo A., Providência L.A. Massive calcification of the mitral valve annulus in an adolescent with Marfan syndrome. A case report // Rev. Port. Cardiol. 2006. Vol. 25, N 10. P. 921–926.
- Völzke H., Haring R., Lorbeer R., et al. Heart valve sclerosis predicts all-cause and cardiovascular mortality // Atherosclerosis. 2010. Vol. 209, N 2. P. 606–610. doi: 10.1016/j.atherosclerosis.2009.10.030
- Tenenbaum A., Shemesh J., Fisman E.Z., Motro M. Advanced mitral annular calcification is associated with severe coronary calcification on fast dual spiral computed tomography // Invest. Radiol. 2000. Vol. 35, N 3. P. 193–198. doi: 10.1097/00004424-200003000-00006
- Kizer J.R., Wiebers D.O., Whisnant J.P., et al. Mitral annular calcification, aortic valve sclerosis, and incident stroke in adults free of clinical cardiovascular disease: the Strong Heart Study // Stroke. 2005. Vol. 36, N 12. P. 2533–2537. doi: 10.1161/01.STR.0000190005.09442.ad
- Rodriguez C.J., Bartz T.M., Longstreth W.T., et al. Association of annular calcification and aortic valve sclerosis with brain findings on magnetic resonance imaging in community dwelling older adults: the cardiovascular health study // J. Am. Coll. Cardiol. 2011. Vol. 57, N 21. P. 2172–2180. doi: 10.1016/j.jacc.2011.01.034
- O’Neal W.T., Efird J.T., Nazarian S., et al. Mitral annular calcification and incident atrial fibrillation in the Multi-Ethnic Study of Atherosclerosis // EP Europace. 2015. Vol. 17, N 3. P. 358–363. doi: 10.1093/europace/euu265
- Willens H.J., Ferreira A.C., Gallagher A.J., Morytko J.A. Mobile components associated with rapidly developing mitral annulus calcification in patients with chronic renal failure: review of mobile elements associated with mitral annulus calcification // Echocardiogr. 2003. Vol. 20, N 4. P. 363–367. doi: 10.1046/j.1540-8175.2003.03042.x
- Movahed M.R., Saito Y., Ahmadi-Kashani M., Ebrahimi R. Mitral Annulus Calcification is associated with valvular and cardiac structural abnormalities // Cardiovasc. Ultrasound. 2007. Vol. 5, N 1. P. 14. doi: 10.1186/1476-7120-5-14
- Vistarini N., d’Alessandro C., Aubert S., et al. Surgery for infective endocarditis on mitral annulus calcification // J. Heart Valve Dis. 2007. Vol. 16, N 6. P. 611–616.
- Fulkerson P.K., Beaver B.M., Auseon J.C., Graber H.L. Calcification of the mitral annulus: Etiology, clinical associations, complications and therapy // Am. J. Med. 1979. Vol. 66, N 6. P. 967–977. doi: 10.1016/0002-9343(79)90452-2
- Takamoto T., Popp R.L. Conduction disturbances related to the site and severity of mitral anular calcification: A 2-dimensional echocardiographic and electrocardiographs correlative study // Am. J. Cardiol. 1983. Vol. 51, N 10. P. 1644–1649. doi: 10.1016/0002-9149(83)90202-3
- Pekdemir H., Cansel M., Yağmur J., et al. Assessment of atrial conduction time by tissue Doppler echocardiography and P-wave dispersion in patients with mitral annulus calcification // J. Electrocardiol. 2010. Vol. 43, N 4. P. 339–343. doi: 10.1016/j.jelectrocard.2010.02.013
- Sveric K.M., Platzek I., Golgor E., et al. Purposeful use of multimodality imaging in the diagnosis of caseous mitral annular calcification: a case series report // BMC Med. Imaging. 2022. Vol. 22. P. 7. doi: 10.1186/s12880-021-00725-x
- Tyebally S., Chen D., Bhattacharyya S., et al. Cardiac Tumors: JACC CardioOncology State-of-the-Art Review // JACC CardioOncology. 2020. Vol. 2, N 2. P. 293–311. doi: 10.1016/j.jaccao.2020.05.009
- Mayr A., Müller S., Feuchtner G. The Spectrum of Caseous Mitral Annulus Calcifications // JACC Case Rep. 2020. Vol. 3, N 1. P. 104–108. doi: 10.1016/j.jaccas.2020.09.039
Дополнительные файлы