Новые методы визуализации атеросклероза
- Авторы: Syed M.B.1, Fletcher A.J.1, Forsythe R.O.1, Kaczynski J.1, Newby D.E.1, Dweck M.R.1, R. van Beek E.J.1
-
Учреждения:
- University of Edinburgh
- Выпуск: Том 2, № 3 (2021)
- Страницы: 386-409
- Раздел: Обзоры
- Статья получена: 17.06.2021
- Статья одобрена: 17.06.2021
- Статья опубликована: 15.10.2021
- URL: https://jdigitaldiagnostics.com/DD/article/view/71633
- DOI: https://doi.org/10.17816/DD71633
- ID: 71633
Цитировать
Полный текст
Аннотация
Атеросклероз ― это хроническое иммуномодулируемое заболевание, которое поражает артерии и приводит к значительному бремени болезней во всём мире. Традиционные методы визуализации сосредоточены на морфологических особенностях атеросклероза, таких как степень стеноза, вызванного поражением сосудов. С появлением современных компьютерных, магнитно-резонансных и позитронно-эмиссионных томографов повысились скорость получения изображений и пространственное разрешение, что обеспечивает широкие возможности их применения в клинической практике. Комплексная визуализация способствует более точному прогнозированию сердечно- сосудистого риска и даёт развёрнутую информацию о состоянии и метаболических процессах в стенках сосудов. Конкретные этапы развития болезни можно выявить с помощью биологических индикаторов и «умных» контрастных веществ. Эти подходы позволяют врачам оценить метаболическое состояние атеросклеротической бляшки.
В обзоре представлены данные о современных методах визуализации атеросклероза, применение которых поможет выявить основные морфологические характеристики заболевания.
Данная публикация является перепечатанной версией статьи с переводом оригинала [Syed MB, Fletcher AJ, Forsythe RO, Kaczynski J, Newby DE, Dweck MR, van Beek EJ. Emerging techniques in atherosclerosis imaging. Br J Radiol. 2019;92(1103):20180309. doi: 10.1259/bjr.20180309] на русский язык.
Полный текст
Список сокращений
КТ ― компьютерная томография
КТА ― компьютерная томографическая ангиография
МРС ― магнитно-резонансная спектроскопия
МРТ ― магнитно-резонансная томография
ОКТ ― оптическая когерентная томография
ПЭТ — позитронно-эмиссионная томография
УЗИ ― ультразвуковое исследование
18F-FDG (fluorodeoxyglucose, 18F) ― 18F-фтордезоксиглюкоза, радиофармпрепарат
18F-MISO (18F-flumisonidazole) ― 18F-флумисонидазол, радиофармпрепарат
18F-NaF (18F-sodium fluoride) ― 18F-фторид натрия, радиофармпрепарат
USPIO (ultra-small superparamagnetic particles of iron oxide) ― сверхмалые парамагнитные частицы оксида железа, радиофармпрепарат
ВВЕДЕНИЕ
Атеросклероз ― хронический иммуномодулируемый патологический процесс с поражением сосудов ― является основной причиной заболеваемости и смертности во всём мире [1]. Как правило, атеросклероз развивается медленно и характеризуется длительной бессимптомной фазой. На поздних стадиях из-за сужения просвета сосудов появляются симптомы при физической нагрузке, а в ряде случаев развиваются неблагоприятные события, обусловленные разрывом бляшки и формированием местной окклюзии, как при инфаркте миокарда. Кроме того, внезапный разрыв атеросклеротической бляшки способен вызвать дистальную эмболию, что обычно наблюдается при ишемическом инсульте дистального типа в проксимальном отделе внутренней сонной артерии.
Технологии структурной визуализации сосудов всего организма стремительно развиваются. Некоторые морфологические особенности атеросклеротических бляшек связаны с повышенным риском развития заболевания [2]. Комплексное применение известных стратегий визуализации в сочетании с «умными» контрастными веществами и биологическими индикаторами позволяет дополнительно оценить биологическую активность в бляшках и получить более полное представление о патофизиологических процессах, что позволит улучшить методологию стратификации и управления рисками у пациентов.
В данном обзоре основное внимание уделяется доступным методам визуализации атеросклероза, описанию наиболее подходящих из них для визуализации отдельных компонентов сердечно-сосудистой системы и иллюстрации того, как изучение биологической активности в бляшках расширяет возможности в выявлении заболеваний, оценке рисков и ведении пациентов.
БИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ АТЕРОСКЛЕРОЗА
Атеросклероз ― это мультифокальное и иммуновоспалительное заболевание артерий среднего и крупного калибра [3]. Воздействие известных факторов риска, таких как гипертония, гиперхолестеринемия и курение, создаёт системную среду, которая способствует эндотелиальной дисфункции [4], окислению липопротеинов [5], образованию свободных радикалов кислорода [6], миграции лейкоцитов [7]. В результате накопления окисленных липопротеинов в стенке сосуда образуются липидные полоски. Макрофаги мигрируют по эндотелию и фагоцитируют богатые липидами белки. Высокое внутриклеточное содержание холестерина в макрофагах вызывает гибель клеток. Их остатки наряду с некротическими эндотелиальными и гладкомышечными клетками являются основной составляющей богатого липидами ядра (рис. 1) [8].
Рис. 1. Патофизиология атеросклероза. Поперечный срез артерии свидетельствует о том, что прогрессирующий атеросклероз характеризуется интенсивной биологической активностью, вызванной инфильтрацией макрофагов в ответ на субэндотелиальное накопление окисленных липопротеинов. Ряд процессов приводит к гибели клеток и образованию богатого липидами некротического ядра. Локальная гипоксия в области богатого липидами ядра вызывает экспрессию αvβ3-интегрина и ангиогенез. В результате инфильтрации макрофагами и потери сосудистых гладкомышечных клеток происходит истончение фиброзной покрышки, а вследствие гибели клеток вокруг некротического ядра возникают очаги микрокальцификации. Такая биологически активная бляшка подвержена высокому риску разрыва. Неактивная фаза атеросклероза, напротив, представляет собой хроническое излеченное воспаление с положительным ремоделированием. Для стабильной бляшки характерны кальцификация фиброзной покрышки и низкий риск разрыва.
Атеросклеротические бляшки состоят из некротических тканей, образовавшихся в результате внешнего ремоделирования, и фиброзной покрышки на поверхности интимы. Нестабильные бляшки склонны к разрыву и имеют некоторые патологоанатомические особенности, такие как большие богатые липидами некротические ядра, содержащиеся в тонкой (менее 65 мкм), богатой макрофагами фиброзной покрышке с очагами микрокальцификации [9]. В метаболически активных бляшках макрофаги накапливаются в фиброзной покрышке и разрушают внеклеточный матрикс, вырабатываемый гладкомышечными клетками сосудов [7]. Некротическое ядро создаёт микросреду гипоксии и инициирует ангиогенез [10].
Отложение кальция при воспалении стенок сосудов — это опосредованный макрофагами репаративный ответ на отложение окисленных липидов и эндотелиальную дисфункцию. Однако кальцификация сосудов не является пассивным побочным продуктом деградации, напротив, это активный и контролируемый процесс. Процесс кальцификации при атеросклерозе в первую очередь затрагивает интиму, что отличает его от медиальной кальцификации, обычно наблюдаемой у пациентов с диабетом или хронической болезнью почек и характеризуемой концентрической трансмуральной морфологией [11]. Кальцификация сосудов начинается на микроскопическом уровне (за пределами стандартной визуализации) и представляет собой отложение кристаллов гидроксиапатита, богатых кальцием и фосфатом [12]. Эта ранняя стадия микрокальцификации свидетельствует об интенсивной биологической активности и повышенной нестабильности бляшки. Впоследствии отложения, образованные в результате макроскопической кальцификации, становятся более крупными, бляшка ― стабильной, а заболевание переходит в более спокойную фазу.
Нестабильные бляшки имеют тонкую фиброзную покрышку, лишённую сосудистых гладкомышечных клеток, и характеризуются интенсивным накоплением макрофагов [13]. Разрыв фиброзной покрышки приводит к попаданию богатого липидами некротического ядра в просвет сосуда, инициируя быстрый и агрессивный тромбоз, который может вызвать окклюзию артерии. Однако разрыв бляшки часто протекает бессимптомно. Со временем, в результате васкулярного ремоделирования в сосудах образуются тромбы, а степень тяжести стеноза становится более выраженной.
Ангиогенез и коллатерализация могут частично компенсировать снижение кровотока, вызванное усилением стеноза сосудов, однако если разрушение артерии происходит стремительно, действие компенсаторного ангиогенеза будет недостаточным, что может привести к тяжёлой форме ишемии. Разрыв нестабильной бляшки опасен внезапной артериальной окклюзией, уменьшением перфузии тканей и необратимым поражением органов-мишеней, поэтому с целью минимизации некроза тканей требуется своевременное проведение терапевтической реперфузии [14].
АНАТОМИЧЕСКАЯ ВИЗУАЛИЗАЦИЯ
Анатомическая визуализация разнообразна и гибка, её основные цели ― выявление сужения просвета и определение характеристик атеросклеротической бляшки. Визуализация также позволяет глобально оценить бремя атеросклеротического поражения в сосудистом бассейне, что позволяет врачам стратифицировать риск будущих неблагоприятных событий.
Катетерная контрастная ангиография ― наиболее распространённый метод визуализации коронарных сосудов, который позволяет получить изображение высокого пространственно-временного разрешения. Катетерная ангиография, являясь ничем иным, как «люменограммой» коронарного кровообращения, открывает широкие возможности для медицинских вмешательств.
Определение характеристик атеросклеротической бляшки возможно, но для этого требуется специальное оборудование. Внутрисосудистая оптическая и ультразвуковая визуализация позволяют детально оценить морфологические изменения бляшки. Эти методы — оптимальный выбор для обследования пациентов из групп высокого риска, которым могут потребоваться вмешательства одновременно на двух и более сосудах.
В некоторых случаях возникает необходимость выявления неблагоприятных характеристик бляшки с помощью неинвазивных методов визуализации. Это особенно актуально для пациентов группы низкого и среднего риска. В современной медицине всё чаще используют неинвазивные методы визуализации для выявления сердечно-сосудистых заболеваний. Компьютерная и магнитно-резонансная ангиография достаточно безопасны и представляют собой надёжную альтернативу катетерной ангиографии. Эти методы визуализации позволяют одновременно получить изображение стенки сосуда и любых окружающих её поражённых участков. Аналогичным образом с помощью ультразвука можно определить кровоток через поражённый участок для количественной оценки стеноза, при этом состояние бляшки можно оценить с помощью спектрального анализа и специализированных контрастных веществ. Кроме того, неинвазивные методы визуализации положительно влияют на принятие клинических решений, позволяя проводить диагностику без соответствующих вмешательств, а многопрофильной команде специалистов — принимать наиболее рациональные решения.
В данной статье мы рассматриваем доступные методы визуализации морфологических особенностей сосудов с атеросклеротическим поражением и кратко останавливаемся на том, как эти методы помогают в определении характеристик бляшки.
Внутрисосудистая визуализация
Методы внутрисосудистой визуализации позволяют получать изображения в непосредственной близости от бляшки, т.е. изображения с чрезвычайно высоким разрешением.
Оптическая когерентная томография
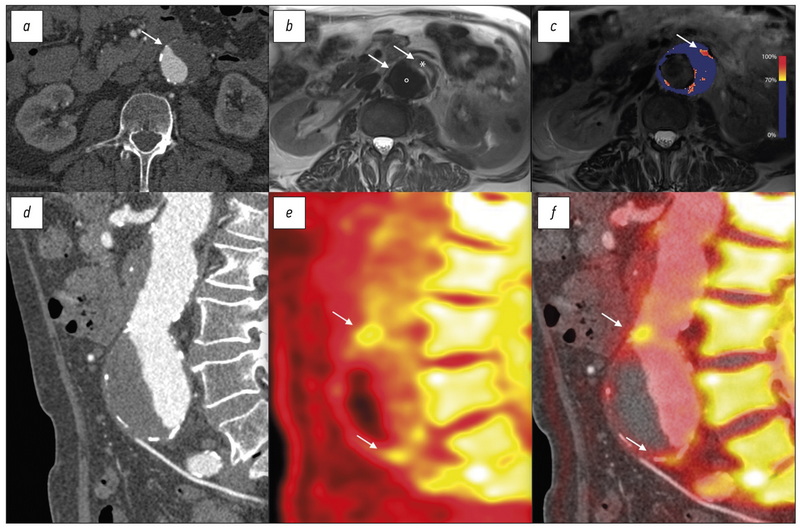
Оптическая когерентная томография (ОКТ) позволяет получить исключительно детальные изображения фиброзной покрышки с помощью оптического излучения ближнего инфракрасного диапазона, передаваемого через оптоволоконный провод (рис. 2, с). При ОКТ катетер размещают над проводником, а в обескровленный сосудистый бассейн вводят физиологический раствор или контрастное вещество. Анализ частотных характеристик позволяет получить детальные изображения прилегающей тонкой фиброзной покрышки. Полученные результаты хорошо коррелируют с гистологическими данными [15]. Высокочастотные сигналы в фиброзной покрышке указывают на прилипание макрофагов и образование тромба [16]. Для того чтобы получить снимки высокого разрешения, необходимо свести к минимуму проникновение сигнала в близлежащие ткани, что ограничивает оценку более глубоких компонентов бляшки. ОКТ используется в клинической практике для обнаружения нестабильных бляшек и проведения антитромботической терапии [17, 18]. В настоящее время ОКТ используется для этих целей при стенозе сонных артерий [19] и заболеваниях периферических сосудов [20].
Рис. 2. Визуализация атеросклероза коронарных сосудов у пациента с инфарктом миокарда без подъёма сегмента ST. а ― катетерная ангиография демонстрирует неравномерное поражение в проксимальном отделе левой передней нисходящей коронарной артерии (стрелка). b ― трансаксиальное изображение, полученное при компьютерной томографии (i), свидетельствует о поражении коронарного русла с образованием сложной структуры, состоящей из кальцинированной (белой) бляшки и фиброзно-жировой ткани (°) вокруг центрального протока (*). c ― при оптической когерентной томографии выявлены тонкая фиброзная покрышка (стрелка) и липидные пятна (*). d ― спектроскопия в ближней инфракрасной области и внутрисосудистое ультразвуковое исследование подтверждают высокую липидную нагрузку в бляшке (жёлтый цвет). e ― при реконструкции центральной линии левой передней нисходящей артерии визуализируются очаги кальцификации и бляшки вдоль всего сосуда (стрелка). f ― позитронно-эмиссионная томография, совмещённая с компьютерной томографией, выявляет высокое поглощение 18F-фторида натрия в атеросклеротической бляшке (стрелка) [18].
Спектроскопия в ближней инфракрасной области / внутрисосудистое ультразвуковое исследование
Спектроскопия в ближней инфракрасной области — ещё один инвазивный метод визуализации с использованием катетера, который не требует обескровливания сосуда и использует рассеяние волн для создания карты градиента, соответствующей вероятности накопления липидов (рис. 2, d). Полученный в результате индекс нагрузки на липидные ядра указывает на соотношение высокого содержания липидов в прилежащих структурах к общей площади исследования. Современные датчики сочетаются с внутрисосудистым ультразвуковым исследованием (УЗИ) для обеспечения структурного контекста морфологических данных [21].
Внутрисосудистое УЗИ — давно применяемый и, следовательно, более рентабельный метод визуализации, чем ОКТ и спектроскопия ближней инфракрасной области. Высокочастотный ультразвуковой зонд помещается в катетер, что позволяет непосредственно визуализировать атеросклеротическую бляшку в просвете сосуда (см. рис. 2, d). На изображениях с высоким разрешением и нейтральным цветовым пространством видна структура атеросклеротической бляшки и прилегающей стенки сосуда. Особенности компонентов бляшки можно определить путём анализа обратного рассеяния и достоверно выявить богатое липидами некротическое ядро, очаги кальцификации и фиброзно-жировую бляшку [22, 23]. Несмотря на достаточную глубину проникновения в ткани, внутрисосудистое УЗИ не имеет соответствующего пространственного разрешения для измерения толщины фиброзной покрышки. Как и при обычном ультразвуковом сканировании, минерализованные отложения кальция отбрасывают акустические тени, скрывая тем самым детали подлежащих тканей.
Спектроскопия ближней инфракрасной области и внутрисосудистое УЗИ хорошо зарекомендовали себя в выявлении и лечении заболеваний коронарных сосудов [15, 24], сонных артерий [25] и артерий нижних конечностей [26].
НЕИНВАЗИВНАЯ ВИЗУАЛИЗАЦИЯ
Ультразвуковое исследование
В поверхностных сосудах, таких как сонные артерии и артерии конечностей, дуплексное УЗИ объединяет структурные и функциональные данные для количественной оценки степени стеноза, вызванного атеросклеротической бляшкой. При этом оценивается соотношение пиковой систолической скорости проксимальнее и дистальнее предполагаемого поражения. Ультразвук можно использовать для измерения общей площади бляшки [27], а интенсивность пикселей серой шкалы на изображениях атеросклеротических бляшек, как было показано, соответствует гистологическим характеристикам [28]. Ультразвуковые аппараты неинвазивны, портативны и нерадиоактивны, следовательно, этот метод визуализации часто используют в первую очередь для количественной оценки стеноза сосудистого дерева периферических артерий.
УЗИ высокого разрешения позволяет дифференцировать компоненты артериальной стенки в поверхностных сосудах. Патологическая пролиферация слоя интимы-медиа ― признак раннего субклинического формирования бляшки [29], т.е. показателя, по которому можно судить об общем состоянии сердечно-сосудистой системы человека. Фактически, увеличение толщины интимы-медиа связано со значительным повышением риска инфаркта миокарда, инсульта и летального исхода [30].
Контрастные вещества, содержащие однородную суспензию микропузырьков инертного газа (например, SF6), вводимые в венозное пространство, могут выявить специфические особенности артериальных атеросклеротических бляшек. В сонных артериях микропузырьки выявляют неоваскуляризацию при серьёзных поражениях, вызывающих острое состояние, с чувствительностью и специфичностью более 80% [31]. У пациентов с аневризмами брюшной аорты УЗИ с контрастным усилением позволяет охарактеризовать кровоток в просвете сосуда в режиме реального времени. Этот метод также позволяет визуализировать осложнения после эндоваскулярной коррекции, в частности эндоподтекания [19, 32]. За счёт отсутствия ионизирующего излучения УЗИ с контрастным усилением является идеальным методом в тех случаях, когда требуется повторная визуализация.
Стандартизация ультразвуковой оценки сосудистых русел снижает риск вариабельности результатов у разных исследователей-аналитиков. Оценка сосудов не всегда возможна, если обзор затруднён из-за плотно расположенных очагов кальцификации. Аналогичным образом кость или газ, закрывающие обзор целевого сосуда, препятствуют адекватной визуализации с помощью УЗИ, ограничивая его использование исследованием легкодоступных артерий.
Компьютерная томография (КТ)
Использование КТ-ангиографии (КТА) хорошо зарекомендовало себя в оценке состояния сердечно-сосудистой системы. Этот метод неинвазивен и доступен. Дополнительное преимущество КТА ― визуализация всего сосуда от его начала до целевой области, в том числе извилистых сосудов. Среди многочисленных преимуществ КТА следует отметить пространственное разрешение, позволяющее выявлять очаговый стеноз просвета сосудов и проводить глобальную оценку сосудистых заболеваний. Благодаря короткому времени сканирования на компьютерных томографах нового поколения стало возможным получение детальных изображений коронарных сосудов. Так, КТА с высокой точностью определяет степень выраженности коронарного стеноза и включена во многие клинические рекомендации как метод визуализации первой линии для лиц с подозрением на боль в области сердца. КТА используется на всех участках сосудистого дерева. При выявлении стеноза сонных артерий площадью более 70% чувствительность КТА приближается к 100%, а специфичность ― к 63% (95% доверительный интервал 25–88) [22, 33, 34].
Помимо оценки люминального стеноза, КТ может охарактеризовать морфологические особенности бляшки, в частности признаки высокого риска образования бляшек, такие как положительное ремоделирование, точечная кальцификация, фиброзные бляшки с высокой степенью затухания и некротические, богатые липидами бляшки с низкой степенью затухания [35–37]. Признак «салфеточного кольца» при реконструкции центральной линии коронарных сосудов свидетельствует о дифференциации между фиброзной бляшкой и некротическим ядром [38]. При этом визуализируется отражающая гистологическую структуру бляшки морфологическая картина ― серповидный рисунок с высокой степенью затухания вокруг атероматозного поражения с низким затуханием, отличным от просвета сосуда.
КТ хорошо подходит для визуализации сосудистой кальцификации. Однако увеличение жёсткости излучения по отношению к плотно кальцинированной бляшке приводит к расплывчатости изображения и, следовательно, визуальному увеличению размера бляшки и затемнению просвета, в частности в сосудах малого калибра с высокой степенью кальцификации. При острой форме заболевания КТ не даёт возможность дифференцировать компоненты мягких тканей бляшки. Например, невозможно напрямую отличить стабильное фиброатероматозное поражение от острого кровоизлияния в бляшку или тромбоза. Идентификация «виновных» бляшек основана на сочетании радиологических характеристик, а также клинических проявлений и характера повреждения органов-мишеней.
Магнитно-резонансная томография (МРТ)
Ангиография с использованием МРТ лучше всего подходит для визуализации крупных стабильных сосудов, таких как сонные артерии. МРТ с мультиконтрастной визуализацией (Т1- и Т2-взвешенные изображения, Т1-ВИ, Т2-ВИ; протонная плотность) обеспечивает превосходную характеристику мягких тканей, что позволяет исследовать составные части атеросклеротической бляшки без использования ионизирующего излучения. Благодаря этим свойствам МРТ часто применяют в продольных исследованиях хронических сердечно-сосудистых заболеваний. Введение контрастного вещества на основе гадолиния (Gd) улучшает время получения изображения и даёт дополнительную структурную информацию, очерчивающую различия между кровяным депо и стенкой сосуда [39].
Двигательный артефакт в области сердца затрудняет визуализацию мелких сосудов. Достижения в области МРТ позволили устранить это ограничение. За счёт ускоренной технологии получения изображения уменьшаются двигательный артефакт и шумы [40]. При использовании методов «яркой крови» в качестве контрастного вещества используется сама кровь, что снижает потребность в контрастных веществах на основе Gd. В настоящее время аппарат МРТ 1,5 Тл может выявить значительное поражение ствола левой коронарной артерии или трёхсосудистое поражение у 94% пациентов [41].
Несмотря на более низкое качество изображений, получаемых при МРТ, в сравнении с КТ-коронарографией, магнитно-резонансная ангиография может быть полезна при оценке аневризмы и устьев аберрантных коронарных артерий [42]. Кроме того, режим Т1-ВИ позволяет обнаружить внутрипросветные тромбы или кровоизлияния в бляшку. МРТ имеет дополнительное преимущество в оценке сердечной динамики, а также перфузии и жизнеспособности миокарда. Постоянные достижения в области МРТ сердца обеспечивают перспективность методу в будущем.
МРТ позволяет измерить толщину фиброзной покрышки и визуализировать некротическое ядро за счёт высокоточной дискриминации мягких тканей сонных артерий [43]. Чувствительность обнаружения богатых липидами ядер может быть дополнительно улучшена с использованием контрастных веществ на основе Gd [44]. При остром нарушении, таком как вызванная разрывом бляшки внутренней сонной артерии транзиторная ишемическая атака, МРТ в режиме Т1-ВИ может выявить кровоизлияние в бляшку и тромб, что связано с риском дальнейшего развития ишемических событий [45, 46]. Более высокая напряжённость электрического поля снижает фоновый шум и артефакты. Кальций обычно визуализируется в виде гиподенсных очагов, тогда как фиброзная ткань имеет низкую интенсивность сигнала на Т1-ВИ и высокую интенсивность сигнала на Т2-ВИ.
«Умные» контрастные вещества для МРТ
Сверхмалые парамагнитные частицы оксида железа (USPIO) представляют собой наночастицы оксида железа размером 30 нм, стабилизированные низкомолекулярным декстраном, которые накапливаются в макрофагах после фагоцитоза и остаются в кровотоке в течение длительного времени [47]. Области, богатые USPIO-позитивными макрофагами, имеют низкую интенсивность сигнала при МРТ в режиме Т2-ВИ и Т2*-ВИ [48]. Накопление частиц USPIO в сонных артериях при атеросклерозе совпадает с активной фазой образования бляшек, где наблюдается интенсивная инфильтрация макрофагами [49]. USPIO также накапливаются с высокой степенью сродства в областях инфильтрации макрофагами в аневризмах брюшной аорты (рис. 3, c) [50]. Использование «умных» контрастных веществ при МРТ имеет огромные перспективы в области визуализации клеточной активности в сосудистом русле. Эти методы, в конечном итоге, могут привести к обнаружению нестабильных бляшек с риском неминуемых событий и проведению последующей корректирующей терапии.
Магнитно-резонансная спектроскопия (МРС)
МРС сочетает пространственную визуализацию, полученную с помощью МРТ, со спектральным анализом для определения химического состава и метаболического состояния сердечно-сосудистой ткани. МРС способна определять ряд атомов, включая водород-1 (1Н), фосфор-31 (31Р) и углерод-13 (13С) [51]. Исследования сонных артерий in vivo с использованием МРС позволили успешно определить количественные значения холестериловых эфиров в атеросклеротических бляшках [46, 52]. Холестериловые эфиры ― это основной класс липидов, присутствующий в богатом липидами некротическом ядре нестабильных бляшек. Химический состав структур оценивается с помощью последовательной визуализации химического сдвига, что позволяет получить спектры над бляшкой и вокруг неё. Амплитуды МРС для конкретных метаболитов, таких как липиды, затем интерпретируются как отношение к амплитуде колебаний внутренней жидкости [53, 54]. Окончательный анализ позволяет обнаружить и количественно оценить содержание липидов в атеросклеротической бляшке.
МОЛЕКУЛЯРНАЯ ВИЗУАЛИЗАЦИЯ
Биологически активные атеросклеротические поражения по своей природе нестабильны и склонны к разрыву [55]. Определённые биологические трассирующие вещества позволяют с помощью позитронно-эмиссионной томографии (ПЭТ) и однофотонной эмиссионной КТ выявлять активные стадии заболевания, например повышенную гликолитическую активность или микрокальцификацию.
Молекулы биологических радиоактивных индикаторов обычно состоят из двух компонентов. Одна часть содержит лиганд, который нацелен на участки специфической активности заболевания, а второй компонент ― радиоизотоп. ПЭТ- и однофотонный эмиссионный КТ-сканеры могут определять интенсивность и распределение активности радиоактивных индикаторов в результате молекулярного взаимодействия с целевыми процессами заболевания. ПЭТ имеет более высокую чёткость изображения и, следовательно, большую популярность в сравнении с однофотонной эмиссионной КТ.
Молекулярная визуализация при оценке сердечно-сосудистых заболеваний в последнее время достигла значительных успехов благодаря постоянно расширяющемуся набору биологических индикаторов, направленных на различные процессы. Подходы к стандартизации количественной оценки поглощения радиоактивных веществ улучшили отчётность и воспроизводимость результатов [56].
Рис. 3. Компьютерная (КТ), магнитно-резонансная (МРТ) и позитронно-эмиссионная (ПЭТ) томография у пациента с юкстаренальной аневризмой брюшной аорты. а ― на поперечном изображении аневризмы при КТ видна расширенная аорта с тромбом (стрелка). b ― режим Т2-ВИ при МРТ-исследовании той же аорты позволяет различить просвет (°), тромб (*) и прилегающие структуры. c ― параметрическая карта разницы в интенсивности Т2*-ВИ при МРТ до и после введения ультрамелких частиц поглощения оксида железа показывает высокое очаговое поглощение в передней стенке аневризмы (стрелка). d ― в сагиттальной плоскости при КТ визуализируется морфологическая структура аневризмы. e ― ПЭТ с 18F-фторидом натрия выявляет поглощение в передней стенке аорты (стрелки), определяя области наибольшего повреждения сосудов. f ― при совмещении ПЭТ и КТ подтверждается высокое поглощение 18F-фторида натрия в шейке аневризмы и вблизи бифуркации (стрелки).
Глюкоза и гликолиз
18F-фтордезоксиглюкоза (18F-FDG) является аналогом глюкозы и биологическим индикатором, наиболее часто используемым в клинической практике. 18F-FDG поглощается метаболически активными клетками, а её непосредственный метаболит задерживается внутри клетки в результате фосфорилирования, что позволяет получить количественную оценку гликолитической активности в клетках. При воспалении сосудов интенсивное поглощение 18F-FDG происходит в макрофагах, гладкомышечных и эндотелиальных клетках [57]. Повышенное поглощение 18F-FDG при каротидном и коронарном атеросклерозе свидетельствует о нестабильности бляшек и гистологических признаках их уязвимости [58, 59], включая повышенную плотность CD68-позитивных макрофагов [60].
Поскольку 18F-FDG отражает гликолитическую активность, процесс его поглощения неспецифичен, что ограничивает при ПЭТ интерпретацию признаков заболевания в структурах, смежных с теми, где отмечается высокое физиологическое сродство к глюкозе, например в миокарде. Для того чтобы визуализировать поглощение индикатора 18F-FDG при ПЭТ коронарных артерий, необходимо подавить его поглощение миокардом с помощью подготовительной диеты с низким содержанием углеводов и высоким содержанием жиров. Однако такие попытки подавления активности миокарда неэффективны примерно у 1/4 пациентов, что чрезвычайно усложняет оценку состояния бляшек в коронарных сосудах [61].
Макрофаги и воспаление
Индикаторы, направленные непосредственно на макрофаги, такие как аналоги рецептора соматостатина 2, преодолевают ограничения, вызванные низкой специфичностью 18F-FDG. В данном случае комбинация лиганда соматостатина с хелаторами DOTA (1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота) или NOTA (1,4,7-трикарбоксиметил-1,4,7-триазациклононан) привела к разработке новых индикаторов, в частности с содержанием позитрон-излучающих изотопов, таких как галлий-68 (68Ga) или медь-64 (64Cu). ПЭТ-исследования показывают, что эти вещества демонстрируют преимущественно высокую степень поглощения в сосудах у пациентов с установленными факторами сердечно-сосудистого риска и неблагоприятными показателями риска по Фремингемской шкале оценки риска (Framingham risk score) [62].
Гистологическое сравнение бляшек сонных артерий с высоким поглощением 63Ga-DOTA-TATE (1,4,7,10-тетраазациклододекан-N,N',N',N',N''-тетрауксусная кислота-D-Phe1, Tyr3-октреотат) выявляет избирательное связывание радиоактивного вещества с CD68-позитивными макрофагами. Так, в экспериментальном исследовании с помощью 63Ga-DOTA-TATE удалось правильно определить метаболически активные поражения коронарных и сонных артерий с хорошей воспроизводимостью и более высокой чувствительностью, чем при использовании индикатора 18F-FDG [64].
К другим индикаторам, направленным на выявление активности макрофагов, относятся молекула адгезии сосудистых клеток-1 (VCAM-1), 11C-холин и 18F-флутимидин. Главными среди них являются лиганды транслокаторного белка TSPO (11C-PK11195), которые представляют собой 18 кДа-белки, экспрессируемые в митохондриях большинства клеток. Активированные макрофаги демонстрируют значительное повышение уровня транслокаторных белков. Предварительные исследования показывают, что при проведении ПЭТ/КТ с индикатором 11C-PK11195 подозрительные поражения сонных артерий идентифицируются правильно и с более благоприятным соотношением очаг/фон по сравнению с использованием индикатора 18F-FDG [65].
Активированные воспалительные клетки в атеросклеротической бляшке имеют рецепторы CXCR-4. Для воздействия на эти рецепторы можно использовать новые ПЭТ-индикаторы, такие как 63Ga-пентаксифор [66]. 63Ga-пентаксифор имеет высокую концентрацию в «виновных» коронарных сосудах после острого инфаркта миокарда (среднее максимальное стандартизированное значение поглощения ― 1,96; интерквартильный размах ― 1,55–2,31). При таких поражениях также наблюдается высокая концентрация CD68-позитивных макрофагов [67].
Микрокальцификация
18F-фторид натрия (18F-NaF) связывается с открытыми кристаллами гидроксиапатита. Благодаря воздействию на всю площадь исследуемой поверхности, этот индикатор преимущественно связывается с очагами развивающейся микрокальцификации, которые находятся за пределами разрешения КТ [63, 68]. С учётом низкого уровня фонового сигнала и что 18F-NaF не поглощается миокардом, это даёт возможность визуализировать сигнал даже относительно низкой интенсивности внутри коронарных сосудов (см. рис. 2, f), что является значительным преимуществом по сравнению с использованием индикатора 18F-FDG.
Исследования in vivo продемонстрировали способность 18F-NaF связываться с очагами активной кальцификации, свидетельствующими о нестабильности бляшек. В проспективных исследованиях обнаружена высокая степень поглощения 18F-NaF в бляшках «виновных» коронарных и сонных артерий [69]. Данные, полученные в ходе исследования бляшек сонных артерий, в значительной степени коррелировали с гистологическими особенностями бляшек высокого риска, включая инфильтрацию макрофагов, некроз и апоптоз. В «виновных» коронарных сосудах высокая степень поглощения 18F-NaF во многом согласуется с признаками высокого риска, выявляемыми, к примеру, при внутрисосудистом УЗИ [69].
Применение индикатора 18F-NaF при ПЭТ/КТ подходит для исследования сосудистой кальцификации в более разветвлённом артериальном дереве. В проспективном исследовании с участием 72 пациентов с аневризмами брюшной аорты отмечалось значительное поглощение 18F-NaF в стенках аневризмы по сравнению с неаневризматическими участками аорты в контрольной группе условно здоровых людей. Высокое поглощение 18F-NaF свидетельствовало об ослаблении стенки аорты и значительном расширении или разрыве аневризмы [70]. Эти данные указывают на связь между метаболически активными аневризмами брюшной аорты и морфологическими особенностями прогрессирующего заболевания.
Гипоксия и ангиогенез
18F-флумисонидазол (18F-MISO) ― это биологический индикатор, который концентрируется в жизнеспособных гипоксических клетках вследствие накопления его метаболитов в среде, лишённой кислорода. Результаты исследования на животных показали, что 18F-MISO позволяет определить аортальный атеросклероз и участки поглощения фтордезоксиглюкозы [71]. Экспериментальные исследования на людях показывают, что при использовании индикатора 18F-MISO в ПЭТ/КТ-исследованиях визуализируются области гипоксии сосудов, повышенной плотности макрофагов и поглощения 18F-ФДГ при симптоматических заболеваниях сонных артерий [68, 72].
Ангиогенные эндотелиальные клетки и макрофаги в гипоксических областях атеросклеротической бляшки экспрессируют гликопротеины αvβ3-интегрина на клеточной поверхности. В животных моделях целевая визуализация αvβ3-интегрина с помощью парамагнитных частиц, чувствительных к МРТ, позволяет выявить участки ангиогенной пролиферации [73]. Новый ПЭТ-индикатор 18F-Galacto-RGD также может быть нацелен на обнаружение αvβ3-интегрина [74], и в мышиных моделях атеросклероза связывается с участками новых атеросклеротических бляшек. Однако гистологический анализ на этих моделях показал, что в отличие от ангиогенеза, процесс поглощения индикатора локализуется в богатой макрофагами атеросклеротической бляшке [75]. «Виновные» бляшки сонных артерий демонстрируют высокую степень поглощения 18F-Galacto-RGD при ПЭТ/КТ-исследованиях, проводимых в ходе предоперационной подготовки и ауторадиографического анализа в послеоперационном периоде. В небольшой выборке пациентов обнаружена тенденция к связыванию 18F-Galacto-RGD с бляшками, богатыми макрофагами с характерной повышенной плотностью vasa vasorum [76].
ПРИМЕНЕНИЕ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Анатомическая визуализация является частью повседневной клинической практики. Достижения в области визуализации сердечно-сосудистой системы позволяют определять характеристики бляшек не только по степени стеноза сосудов. Комбинированные методы позволяют в естественных условиях выявлять признаки высокого риска и «виновные» бляшки (таблица). Биологические ПЭТ-индикаторы позволяют выявить и количественно оценить специфические процессы заболевания до того, как они проявятся в виде структурных изменений или вызовут клинически значимые события. Улучшение диагностики, точное прогнозирование риска и целенаправленное лечение остаются важнейшей задачей в лечении атеросклеротических заболеваний.
Таблица. Методы визуализации атеросклеротических бляшек с признаками высокого риска
Признаки бляшек высокого риска | Оптическая визуализация | УЗИ | КТ | МРТ | ПЭТ |
Стеноз или окклюзия сосудов | ОКТ | Дуплексное сканирование | КТА | МРА | - |
Истончение фиброзной покрышки | ОКТ | - | - | - | - |
Большое некротическое ядро | ОКТ, БИК | Внутрисосудистое УЗИ, виртуальная гистология | Реконструкция центральной линии артерии | Визуализация бляшек с высокоинтенсивным МР-сигналом в режиме Т1-ВИ | - |
Ангиогенез и кровоизлияние в бляшку | ОКТ | Дуплексное сканирование, внутрисосудистое УЗИ, УЗИ с контрастным усилением | - | Визуализация бляшек с высокоинтенсивным МР-сигналом в режиме Т1-ВИ, парамагнитные частицы, нацеленные на выявление αvβ3-интегрина | 18F-MISO, 18F-Galacto-RGD |
Разрыв бляшки при субклиническом атеросклерозе | ОКТ, БИК | Дуплексное сканирование, внутрисосудистое УЗИ | - | Визуализация бляшек с высокоинтенсивным МР-сигналом в режиме Т1-ВИ | Новые биоиндикаторы, нацеленные на выявление фибрина и тромбоцитов |
Гликолитическая активность | - | - | - | - | 18F-FDG |
Инфильтрация макрофагов | ОКТ | - | - | USPIO | 18F-DOTA-TATE, VCAM-1, 11C-холин, 18F-холин, 11C-PK11195 |
Микрокальцификация | - | - | - | - | 18F-фторид натрия (NaF) |
Примечание. УЗИ ― ультразвуковое исследование; КТ ― компьютерная томография; МРТ ― магнитно-резонансная томография; ПЭТ ― позитронная эмиссионная томография; ОКТ ― оптическая когерентная томография; КТА ― компьютерная томографическая ангиография; МРА ― магнитно-резонансная ангиография; БИК ― спектроскопия в ближней инфракрасной области; USPIO ― сверхмалые парамагнитные частицы оксида железа.
Атеросклеротическая болезнь сердца
Клиническая картина окклюзии коронарных артерий разнообразна. Современная визуализация коронарных сосудов решает две важные задачи ― оценка общего состояния бляшек и выявление ишемии органов-мишеней. Дополнительные методы визуализации позволяют оценить функциональное и метаболическое состояние атеросклеротических бляшек, что открывает новые перспективы в исследовании атеросклероза.
Диагностическая визуализация играет важную роль в оценке пациентов со стабильной болью в груди. Традиционно риск развития ишемической болезни сердца оценивался с помощью соответствующих клинических инструментов. При подозрении на клинический диагноз рекомендовались тестирование с физической нагрузкой и перфузионные исследования миокарда. В соответствии с правками от 2016 года, внесёнными Национальным институтом здоровья и клинического совершенствования Великобритании в рекомендации о преимуществах КТ-ангиографии коронарных артерий, данный метод визуализации теперь рекомендуется в качестве исследования первой линии у пациентов со стабильной болью в груди предположительно сердечного происхождения. Исследование SCOT-HEART показало, что КТА коронарных артерий позволяет переклассифицировать диагноз ишемической болезни сердца примерно у 1/4 таких пациентов и повышает точность диагностики стенокардии [77]. Так, чувствительность и отрицательная прогностическая значимость при КТА коронарных артерий составляют 99% с пороговым значением выраженности стеноза 50% [78]. Таким образом, КТА коронарных артерий предлагает надёжный подход с низким уровнем риска, позволяющий исключить серьёзные поражения коронарных артерий у пациентов низкого и среднего риска.
Стеноз коронарных сосудов сам по себе не является индикатором риска последующего развития сердечно-сосудистых заболеваний. Напротив, на подобные риски указывают неблагоприятные характеристики бляшек и общая ишемическая нагрузка: при большом количестве бляшек увеличивается вероятность их разрыва и возникновения ишемии миокарда [79]. Оценка индекса коронарного кальция ― этот метод неконтрастной КТ, который позволяет оценить общую кальцификацию сосудистого русла и способствует более точному прогнозированию будущих сердечно-сосудистых событий у пациентов со средним риском развития ишемической болезни сердца (менее 10% по шкале Framingham) [80]. В частности, индекс коронарного кальция позволяет выявить пациентов с высокой степенью риска, которые в противном случае были бы неправильно классифицированы при использовании традиционных методов [81].
Комплексная визуализация позволяет получить ещё один показатель при оценке пациентов с болью в груди. Например, у пациентов с острым коронарным синдромом индекс липидного ядра, полученный в ходе спектроскопии ближней инфракрасной области, независимо предсказывает будущие сердечно-сосудистые события (отношение рисков 1,19; 95% доверительный интервал 1,07–1,32; p=0,001) [82]. Использование ПЭТ в кардиологической диагностике сопряжено со сложностями вследствие неспецифического поглощения индикатора 18F-FDG окружающим миокардом [69], тогда как в случае с индикатором 18F-NaF отмечается более избирательное его поглощение в очагах микрокальцификации, что делает его идеальным контрастным веществом для исследования коронарных артерий. В исследовании с участием 80 пациентов 18F-NaF преимущественно связывался с «виновными» бляшками коронарных сосудов, выявленными методом внутрисосудистого УЗИ [69]. Аналогичным образом, исследование с участием 119 участников показало, что результаты ПЭТ/КТ с использованием 18F-NaF коррелировали со стенокардией в качестве первопричинного заболевания (p=0,023), предшествующими сердечно-сосудистыми событиями (p=0,016) и оценкой по шкале риска Framingham (p=0,011) [83]. Прогностическая способность индикатора 18F-NaF в определении «виновных» бляшек коронарных сосудов находится в центре внимания текущего проспективного многоцентрового исследования PRE18FFIR (NCT02278211), где участвуют пациенты с недавно перенесённым острым коронарным синдромом и многососудистым поражением. Можно ли улучшить диагностическую точность с помощью других современных радиоактивных индикаторов, таких как 68Ga-DOTATATE [84], ещё предстоит выяснить.
Неинвазивная комплексная визуализация позволяет выявлять признаки высокого риска in vivo и способствует более точному прогнозированию рисков. Группы высокого риска могут стать объектом более интенсивной корректирующей терапии, например с использованием новых ингибиторов пропротеиновой конвертазы субтилизин/кексин типа 9. Однако дополнительные преимущества такого метода визуализации должны быть установлены в ходе проспективных исследований, таких как DIAMOND (NCT02110303), где оценивается польза двойной антитромбоцитарной терапии у пациентов с высоким уровнем поглощения 18F-NaF при ПЭТ коронарных сосудов.
Атеросклероз сонных артерий
Разрыв бляшки в экстракраниальном отделе сонной артерии приводит к интенсивному образованию тромба, который может окклюзировать внутреннюю сонную артерию или спровоцировать её дальнейшее расслоение. Тромб может эмболизировать в мозг или глаз, вызывая необратимую потерю тканей. Целью лечения заболевания сонных артерий является предотвращение тромбоэмболических событий в будущем. Визуализация сонных артерий играет важную роль в прогнозировании цереброваскулярного риска. В исследованиях NASCET [85] и ECST [86] доказана польза эндартерэктомии при симптоматическом стенозе сонных артерий высокой степени [87]. При этом УЗИ является основным методом стратификации риска развития симптоматического стеноза сонных артерий [88].
На сегодняшний день известно, что хирургическое вмешательство необходимо проводить на раннем этапе после неблагоприятных событий, что позволяет снизить частоту повторных эмболических эпизодов при поражении сонных артерий. У пациентов может быть несколько сопутствующих заболеваний. Группа таких пациентов была исключена на начальном этапе исследования NASCET. Многие руководства по этой причине не рекомендуют использовать дуплексное ультразвуковое сканирование в качестве единственного метода визуализации в предоперационный период. В этом случае преимущество имеют КТА и магнитно-резонансная ангиография, поскольку позволяют преодолеть извилистость сосудов и визуализировать всю артерию [89]. Однако примерно 1/3 повторных инсультов с потерей трудоспособности или смертельным исходом происходит у пациентов со стенозом внутренней сонной артерии, составляющим менее 50% [86]. УЗИ, КТ и МРТ ограничиваются исследованием морфологических особенностей атеросклеротической бляшки и не могут достоверно прогнозировать будущие цереброваскулярные события в группах «низкого» риска с меньшей степенью стеноза [89].
Дополнительные методы визуализации, такие как УЗИ с контрастным усилением, многопараметрическая или USPIO-усиленная МРТ, могут выявлять нестабильные и «виновные» атеросклеротические бляшки. Более того, ПЭТ-исследование с использованием индикаторов 18F-FDG или 18F-NaF позволяет выявить биологическую активность «виновных» бляшек, при этом 18F-NaF, в частности, связывается с поражёнными участками сонных артерий, характеризующимися богатым липидами некротическим ядром (рис. 4) [69]. Комбинация ПЭТ/МРТ даёт гораздо лучшие результаты, позволяя одновременно оценить кровоток, тромб, липидное ядро, разрыв бляшки и нестабильную бляшку некротического типа с очагами микрокальцификации.
Вопрос лечения бессимптомных пациентов с заболеваниями сонных артерий остаётся спорным [90]. Не существует также единого мнения о том, как лучше лечить симптоматичных пациентов с заболеваниями внутренних сонных артерий, степень которых не достигает порога для вмешательства. Комплексная визуализация способна обеспечить более точное прогнозирование риска неинвазивным и мощным способом. В исследованиях SAFFIRE (NCT03215563 и NCT03215550) планируют оценить клиническую значимость ПЭТ/МРТ с использованием 18F-NaF в отношении уязвимости бляшек, необходимости хирургического вмешательства и клинических исходов. Это даст возможность улучшить стратификацию рисков у пациентов с инсультом и определить характер последующего оперативного вмешательства, т.е. избежать ненужной каротидной эндартерэктомии и в то же время обратить внимание на бляшки высокой степени риска, не превышающей текущий порог для хирургического вмешательства.
Аортопатия
Патобиология аневризмы брюшной аорты имеет ряд общий черт с атеросклеротическим заболеванием. В этом случае УЗИ является основным методом скрининга и наблюдения за аневризмами брюшной аорты. Однако современные модели прогнозирования опираются лишь на единственное морфологическое измерение переднезаднего диаметра аневризмы с целью прогнозирования риска её разрыва. У мужчин этот диаметр составляет 55 мм [91], для женщин этот порог, по мнению многих, должен быть меньшим. Необходимость эндоваскулярного или открытого хирургического вмешательства рассматривается в том случае, когда размеры аневризмы достигают этого порога [92].
Некоторые аневризмы могут разрываться при диаметре менее 55 мм, в то время как другие достигают больших размеров, не причиняя никакого вреда. Как и при заболевании сонных артерий, в этом случае предпочтительнее использовать комплексные методы визуализации, что обеспечит лучшую стратификацию риска по сравнению с УЗИ, где определяется лишь диаметр аневризмы.
Рис. 4. Позитронно-эмиссионная томография с 18F-фторидом натрия и магнитно-резонансная ангиография симптоматического поражения правой внутренней сонной артерии. а ― комбинированная позитронно-эмиссионная томография с 18F-фторидом натрия, наложенная на магнитно-резонансную ангиограмму, локализует очаговое поглощение радиоактивного вещества в «виновной» бляшке правой внутренней сонной артерии (стрелка). b ― хирургическая эндартерэктомия подтверждает наличие сильно изъязвлённого поражения с положительным ремоделированием и выраженной неравномерностью интимы.
Интенсивность МРТ-сигнала может охарактеризовать структуру тромба с высокой точностью. Сигнал высокой интенсивности в режиме Т1-ВИ наблюдается при дезорганизованном тромбе, который обычно нестабилен [93]. В исследовании с участием 35 пациентов с аневризмами брюшной аорты обнаружено, что у лиц с высокой интенсивностью Т1-сигнала рост аневризмы происходил в два раза быстрее по сравнению с лицами с организованным тромбом [94]. При этом остаётся неясным, ускоряет ли образование тромба рост аневризмы. Одно из возможных объяснений заключается в том, что организованный тромб является продуктом хронической стабильной морфологии аневризмы, в то время как быстро растущая аневризма характеризуется интенсивным образованием тромба, который по своей природе нестабилен.
«Умные» контрастные вещества, такие как USPIO, могут дополнительно охарактеризовать биологическую активность в стенке аневризмы. Высокая степень поглощения частиц USPIO в стенке аорты локализуется в областях инфильтрации макрофагами и свидетельствует о воспалении стенки сосуда. Повышенное поглощение USPIO наблюдается в аневризмах с более быстрыми темпами расширения [48]. ПЭТ/КТ с использованием 18F-NaF при аневризмах выявляет очаги микрокальцификации аорты, что является общей конечной точкой многочисленных патологических процессов, в конечном итоге приводящих к её дегенеративным изменениям. Повышенное поглощение индикатора 18F-NaF связано с более быстрым ростом аневризмы и повышенным риском её разрыва или необходимостью последующего вмешательства независимо от её диаметра [70].
Роль своевременного хирургического вмешательства неоценима в предотвращении необратимых последствий разрыва аневризмы. И наоборот, более точное прогнозирование риска поможет в принятии решения о консервативных методах лечения аневризмы у пациентов с серьёзными сопутствующими заболеваниями. Как и при заболевании сонных артерий, комплексная визуализация в этом случае может дать полезное представление о будущих рисках и стать лучшим руководством при принятии решения о хирургическом вмешательстве у пациентов с аневризмами выше и ниже текущего порога, требующего лечения и предусматривающего вмешательство при диаметре аневризмы более 55 мм.
Заболевания периферических сосудов
Заболевания периферических сосудов ― гетерогенная группа окклюзионных заболеваний артерий нижних конечностей. Атеросклероз в первую очередь вызывает кальцификацию интимы, тогда как сахарный диабет и хроническая болезнь почек ― артериальную жёсткость, усиливая трансмуральную кальцификацию медиального слоя артерии. Оба процесса инициируются микрокальцификацией.
Дуплексное сканирование артерий, магнитно-резонансная ангиография и КТА позволяют визуализировать просвет крупных сосудов, но могут либо переоценить, либо недооценить степень стеноза в более узких артериях, например ниже колена. Так, кальцификация в мелких сосудах вызывает расплывчатость изображения на КТ-ангиограммах, что приводит к затемнению просвета. Если кальцификация отсутствует, остаточный просвет, усиленный контрастом, может быть переоценён при КТ за счёт больших массивов вокселей. Таким образом, ангиография остаётся наиболее приемлемым методом диагностической визуализации сужения просвета нижних конечностей благодаря высокому пространственному разрешению. Однако при этом подходе невозможно получить изображение артериальной стенки или данные о биологической активности в сосудах.
Что касается биологических индикаторов, 18F-фторид хорошо связывается с бляшками бедренной артерии и лучше выявляет воспалительный процесс по сравнению с 18F-FDG [95]. В исследовании 409 онкологических пациентов, прошедших ПЭТ/КТ с 18F-NaF, случайно обнаружено значительное поглощение 18F-фторида в бедренной артерии. Степень поглощения сильно коррелировала с гипертонией, гиперхолестеринемией, курением, сахарным диабетом и предшествующими сердечно-сосудистыми событиями [96]. Клиническое течение такого поглощения ещё предстоит подтвердить в продольных исследованиях.
ОЦЕНКА ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Комплексная визуализация может обеспечить объективные суррогатные конечные точки для подтверждения воздействия на цель и эффективности лечения в относительно небольших популяциях.
Одним из примеров является изучение действия статинов при сердечно-сосудистых заболеваниях. Влияние статинов при атеросклерозе широко изучалось с помощью инвазивных [97–99] и неинвазивных [100–102] методов визуализации. Внутрисосудистая визуализация с использованием ОКТ и внутрисосудистого УЗИ использовалась для изучения влияния статинов на атерому в таких исследованиях, как ASTEROID [97], ESTABLISH [99], REVERSAL [103]. Аналогичным образом МРТ использовали для количественной оценки снижения содержания липидов в некротическом ядре после лечения розувастатином на протяжении 1 и 2 лет наблюдения [100, 101]. В исследовании ATHEROMA использовали USPIO-усиленную МРТ, что позволило выявить уменьшение воспаления бляшек в сонных артериях в течение 3 месяцев от начала приёма аторвастатина [102].
Визуализация может использоваться для подтверждения эффекта терапевтических вмешательств. В исследовании REMNANT изучался эффект аспирации тромба из «виновных» бляшек у пациентов с острым коронарным синдромом. С помощью внутрисосудистого УЗИ, проводимого для количественной оценки процентного увеличения объёма просвета после аспирации тромба, исследователи показали, что агрессивное вмешательство, скорее всего, приведёт к успешной установке стента [104]. В то же время МРТ и ПЭТ/КТ использовали для определения отсутствия клинической эффективности. Исследование dal-PLAQUE не показало уменьшения воспаления стенок сосудов при использовании ингибитора CETP (cholesterylester transfer protein) далцетрапиба ― препарата, который, как теперь известно, клинически неэффективен [105].
ЗАКЛЮЧЕНИЕ
Детальная структурная и функциональная оценка сосудистого дерева возможна с помощью стандартных методов визуализации. Однако перспективы выявления нестабильных атеросклеротических бляшек, приводящих к сердечно-сосудистым событиям, по-прежнему неясны. Комплексная визуализация сердечно-сосудистой системы даёт клиницисту ценную информацию о её морфологических особенностях и метаболическом состоянии при атеросклеротических заболеваниях. Сочетание методов визуализации предлагает мощные инструменты для изучения конкретных процессов заболевания в контексте диагностики, прогнозирования риска и целенаправленного вмешательства.
Для того чтобы уйти от оценки лишь степени тяжести стеноза, требуется смена парадигмы. Выявление особенностей бляшки с высокой степенью риска позволит переклассифицировать лиц с низким и средним риском, которые на самом деле подвержены высокому риску развития неблагоприятных сердечно-сосудистых событий. Корректное определение этой группы лиц является самой большой неудовлетворённой клинической потребностью в области современной визуализации сердечно-сосудистой системы. Использование новых методов позволяет устранить ограничения современных подходов, основанных на оценке степени выраженности стеноза. Внедрение широкого спектра методов визуализации в клиническую практику является следующим важным шагом в оценке атеросклеротических бляшек. Текущие исследования, посвящённые визуализации метаболических процессов, имеют целью выявить и спрогнозировать развитие сердечно-сосудистых заболеваний, что позволит получить более полное представление о внедрении новых методов визуализации в клиническую практику.
Об авторах
Maaz B.J. Syed
University of Edinburgh
Email: maaz.syed@ed.ac.uk
ORCID iD: 0000-0003-0530-8306
Великобритания, Эдинбург
Alexander J. Fletcher
University of Edinburgh
Email: maaz.syed@ed.ac.uk
ORCID iD: 0000-0001-9984-8391
Великобритания, Эдинбург
Rachael O. Forsythe
University of Edinburgh
Email: maaz.syed@ed.ac.uk
ORCID iD: 0000-0002-3311-9599
Великобритания, Эдинбург
Jakub Kaczynski
University of Edinburgh
Email: maaz.syed@ed.ac.uk
ORCID iD: 0000-0002-3005-6860
Великобритания, Эдинбург
David E. Newby
University of Edinburgh
Email: maaz.syed@ed.ac.uk
ORCID iD: 0000-0001-7971-4628
Великобритания, Эдинбург
Marc R. Dweck
University of Edinburgh
Email: maaz.syed@ed.ac.uk
ORCID iD: 0000-0001-9847-5917
Великобритания, Эдинбург
Edwin J. R. van Beek
University of Edinburgh
Автор, ответственный за переписку.
Email: maaz.syed@ed.ac.uk
ORCID iD: 0000-0002-2777-5071
Великобритания, Эдинбург
49 Little France Crescent, Edinburgh EH16 4SB
Список литературы
- Herrington W., Lacey B., Sherliker P., et al. Epidemiology of atherosclerosis and the potential to reduce the global burden of atherothrombotic disease//Circ Res. 2016. Vol. 118, N 4. Р. 535–546. doi: 10.1161/CIRCRESAHA.115.307611
- Puchner S.B., Liu T., Mayrhofer T., et al. High-Risk plaque detected on coronary ct angiography predicts acute coronary syndromes independent of significant stenosis in acute chest pain//J Am Coll Cardiol. 2014. Vol. 64, N 7. Р. 684–692. doi: 10.1016/j.jacc.2014.05.039
- Teague H.L., Ahlman M.A., Alavi A., et al. Unraveling vascular inflammation: from immunology to imaging//J Am Coll Cardiol. 2017. Vol. 70, N 11. Р. 1403–1412. doi: 10.1016/j.jacc.2017.07.750
- Davignon J., Ganz P. Role of endothelial dysfunction in atherosclerosis//Circulation 2004. Vol. 109, N 23, Suppl 1. Р. III-27-20. doi: 10.1161/01.CIR.0000131515.03336.f8
- Pirillo A., Bonacina F., Norata G.D., Catapano A.L. The interplay of lipids, lipoproteins, and immunity in atherosclerosis//Curr Atheroscler Rep. 2018. Vol. 20, N 3. Р. 12. doi: 10.1007/s11883-018-0715-0
- Mullick A.E., Soldau K., Kiosses W.B., et al. Increased endothelial expression of Toll-like receptor 2 at sites of disturbed blood flow exacerbates early atherogenic events//J Exp Med. 2008. Vol. 205, N 2. Р. 373–383. doi: 10.1084/jem.20071096
- Newby A.C. Metalloproteinase production from macrophages — a perfect storm leading to atherosclerotic plaque rupture and myocardial infarction//Exp Physiol. 2016. Vol. 101, N 11. Р. 1327–1337. doi: 10.1113/EP085567
- Stary H.C., Chandler A.B., Dinsmore R.E., et al. A definition of advanced types of atherosclerotic lesions and a histological classification of atherosclerosis: a report from the Committee on vascular lesions of the Council on arteriosclerosis, American heart association//Circulation. 1995. Vol. 92, N 5. Р. 1355–1374. doi: 10.1161/01.cir.92.5.1355
- Virmani R., Burke A.P., Kolodgie F.D., Farb A. Pathology of the thin-cap fibroatheroma//J Intervent Cardiol. 2003. Vol. 16, N 3. Р. 267–272. doi: 10.1034/j.1600-0854.2003.8042.x
- Sluimer J.C., Gasc J.M., van Wanroij J.L., et al. Hypoxia, hypoxia-inducible transcription factor, and macrophages in human atherosclerotic plaques are correlated with intraplaque angiogenesis//J Am Coll Cardiol. 2008. Vol. 51, N 13. Р. 1258–1265. doi: 10.1016/j.jacc.2007.12.025
- Fuery M.A., Liang L., Kaplan F.S., Mohler E.R. Vascular ossification: pathology, mechanisms, and clinical implications//Bone. 2018. Vol. 109. Р. 28–34. doi: 10.1016/j.bone.2017.07.006
- Hirsch D., Azoury R., Sarig S., Kruth H.S. Colocalization of cholesterol and hydroxyapatite in human atherosclerotic lesions//Calcif Tissue Int. 1993. Vol. 52, N 2. Р. 94–98. doi: 10.1007/BF00308315
- Virmani R., Burke A.P., Kolodgie F.D., Farb A. Pathology of the thin-cap fibroatheroma: a type of vulnerable plaque//J Interv Cardiol. 2003. Vol. 16, N 3. Р. 267–272. doi: 10.1034/j.1600-0854.2003.8042.x
- Emberson J., Lees K.R., Lyden P., et al. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a meta-analysis of individual patient data from randomised trials//Lancet. 2014. Vol. 384, N 9958. Р. 1929–1935. doi: 10.1016/S0140-6736(14)60584-5
- Jang I.K., Tearney G.J., MacNeill B., et al. In vivo characterization of coronary atherosclerotic plaque by use of optical coherence tomography//Circulation. 2005. Vol. 111, N 12. Р. 1551–1555. doi: 10.1161/01.CIR.0000159354.43778.69
- Tearney G.J., Yabushita H., Houser S.L., et al. Quantification of macrophage content in atherosclerotic plaques by optical coherence tomography//Circulation. 2003. Vol. 107, N 1. Р. 113–119. doi: 10.1161/01.CIR.0000044384.41037.43
- Bouma B.E., Tearney G.J., Yabushita H., et al. Evaluation of intracoronary stenting by intravascular optical coherence tomography//Heart. 2003. Vol. 89, N 3. Р. 317–320. doi: 10.1136/heart.89.3.317
- Jang I.K., Bouma B.E., Kang D.H., et al. Visualization of coronary atherosclerotic plaques in patients using optical coherence tomography: comparison with intravascular ultrasound//J Am Coll Cardiol. 2002. Vol. 39, N 4. Р. 604–609. doi: 10.1016/S0735-1097(01)01799-5
- Dohad S., Zhu A., Krishnan S., et al. Optical coherence tomography guided carotid artery stent procedure: technique and potential applications//Catheter Cardiovasc Interv. 2018. Vol. 91, N 3. Р. 521–530. doi: 10.1002/ccd.27344
- Schwindt A.G., Bennett J.G., Crowder W.H., et al. Lower extremity revascularization using optical coherence tomography ― guided directional atherectomy: final results of the evaluati on of the pantheris optical coherence tomography imaging atherectomy system for use in the peripheral vasculature (VISION) study//J Endovasc Ther. 2017. Vol. 24, N 3. Р. 355–366. doi: 10.1177/1526602817701720
- Waxman S., Dixon S.R., L'Allier P., et al. In vivo validation of a Catheter-Based near-infrared spectroscopy system for detection of lipid core coronary plaques//JACC Cardiovascular Imaging. 2009. Vol. 2, N 7. Р. 858–868. doi: 10.1016/j.jcmg.2009.05.001
- Voros S., Rinehart S., Qian Z., et al. Prospective validation of standardized, 3-dimensional, quantitative coronary computed tomographic plaque measurements using radiofrequency Backscatter intravascular ultrasound as reference standard in intermediate coronary arterial lesions: results from the Atlanta (assessment of tissue characteristics, lesion morphology, and hemodynamics by angiography with fractional flow reserve, intravascular ultrasound and virtual histology, and noninvasive computed tomography in atherosclerotic plaques) I study//JACC Cardiovasc Interv. 2011. Vol. 4, N 2. Р. 198–208. doi: 10.1016/j.jcin.2010.10.008
- Broersen A., de Graaf M.A., Eggermont J., et al. Enhanced characterization of calcified areas in intravascular ultrasound virtual histology images by quantification of the acoustic shadow: validation against computed tomography coronary angiography//Int J Cardiovasc Imaging 2016. Vol. 32, N 4. Р. 543–552. doi: 10.1007/s10554-015-0820-x
- Brugaletta S., Garcia-Garcia H.M., Serruys P.W., et al. Nirs and IVUS for characterization of atherosclerosis in patients undergoing coronary angiography//JACC Cardiovascular Imaging. 2011. Vol. 4, N 6. Р. 647–655. doi: 10.1016/j.jcmg.2011.03.013
- Štěchovský C., Hájek P., Horváth M., et al. Near-Infrared spectroscopy combined with intravascular ultrasound in carotid arteries//Int J Cardiovasc Imaging. 2016. Vol. 32, N 1. Р. 181–188. doi: 10.1007/s10554-015-0687-x
- Yin D., Matsumura M., Rundback J., et al. Comparison of plaque morphology between peripheral and coronary artery disease (from the clarity and ADAPT-DES IVUS substudies//Coron Artery Dis. 2017. Vol. 28, N 5. Р. 369–375. doi: 10.1097/MCA.0000000000000469
- Mitchell C., Korcarz C.E., Gepner A.D., et al. Ultrasound carotid plaque features. cardiovascular disease risk factors and events: the multi-ethnic study of atherosclerosis//Atherosclerosis. 2018. Vol. 276. Р. 195–202. doi: 10.1016/j.atherosclerosis.2018.06.005
- Lal B.K., Hobson R.W., Pappas P.J., et al. Pixel distribution analysis of B-mode ultrasound scan images predicts histologic features of atherosclerotic carotid plaques//J Vasc Surg. 2002. Vol. 35, N 6. Р. 1210–1217. doi: 10.1067/mva.2002.122888
- Finn A.V., Kolodgie F.D., Virmani R. Correlation between carotid intimal/medial thickness and atherosclerosis: a point of view from pathology//Arterioscler Thromb Vasc Biol. 2010. Vol. 30, N 2. Р. 177–181. doi: 10.1161/ATVBAHA.108.173609
- Stein J.H., Korcarz C.E., Hurst R.T., et al. Use of carotid ultrasound to identify subclinical vascular disease and evaluate cardiovascular disease risk: a consensus statement from the American Society of echocardiography carotid intima-media thickness Task force endorsed by the Society for vascular medicine//J Am Soc Echocardiogr. 2008. Vol. 21, N 2. Р. 93–111. doi: 10.1016/j.echo.2007.11.011
- Huang R., Abdelmoneim S.S., Ball C.A., et al. Detection of carotid atherosclerotic plaque neovascularization using contrast enhanced ultrasound: a systematic review and meta-analysis of diagnostic accuracy studies//J Am Soc Echocardiogr. 2016. Vol. 29, N 6. Р. 491–502. doi: 10.1016/j.echo.2016.02.012
- Mirza T.A., Karthikesalingam A., Jackson D., et al. Duplex ultrasound and contrast-enhanced ultrasound versus computed tomography for the detection of endoleak after EVAR: systematic review and bivariate meta-analysis//Eur J Vasc Endovasc Surg. 2010. Vol. 39, N 4. Р. 418–428. doi: 10.1016/j.ejvs.2010.01.001
- Moneta G.L., Edwards J.M., Chitwood R.W., et al. Correlation of North American Symptomatic Carotid Endarterectomy Trial (NASCET) angiographic definition of 70% to 99% internal carotid artery stenosis with duplex scanning//J Vasc Surg. 1993. Vol. 17, N 1. Р. 152–159. doi: 10.1016/0741-5214(93)90019-I
- Josephson S.A., Bryant S.O., Mak H.K., et al. Evaluation of carotid stenosis using CT angiography in the initial evaluation of stroke and TIA//Neurology. 2004. Vol. 63, N 3. Р. 457–460. doi: 10.1212/01.WNL.0000135154.53953.2C
- Maurovich-Horvat P., Ferencik M., Voros S., et al. Comprehensive plaque assessment by coronary CT angiography//Nat Rev Cardiol. 2014. Vol. 11, N 7. Р. 390–402. doi: 10.1038/nrcardio.2014.60
- Divakaran S., Cheezum M.K., Hulten E.A., et al. Use of cardiac CT and calcium scoring for detecting coronary plaque: implications on prognosis and patient management//Br J Radiol. 2015. Vol. 88, N 1046. Р. 20140594. doi: 10.1259/bjr.20140594
- Motoyama S., Ito H., Sarai M., et al. Plaque characterization by coronary computed tomography angiography and the likelihood of acute coronary events in mid-term follow-up//J Am Coll Cardiol. 2015. Vol. 66, N 4. Р. 337–346. doi: 10.1016/j.jacc.2015.05.069
- Maurovich-Horvat P., Hoffmann U., Vorpahl M., et al. The Napkin-Ring sign: CT signature of high-risk coronary plaques?//JACC Cardiovasc Imaging. 2010. Vol. 3, N 4. Р. 440–444. doi: 10.1016/j.jcmg.2010.02.003
- Fathi A., Weir-McCall J.R., Struthers A.D., et al. Effects of contrast administration on cardiac MRI volumetric, flow and pulse wave velocity quantification using manual and software-based analysis//Br J Radiol. 2018. Vol. 91, N 1084. Р. 20170717. doi: 10.1259/bjr.20170717
- Akçakaya M., Basha T.A., Chan R.H., et al. Accelerated isotropic sub-millimeter whole-heart coronary MRI: compressed sensing versus parallel imaging//Magn Reson Med. 2014. Vol. 71, N 2. Р. 815–822. doi: 10.1002/mrm.24683
- Kim W.Y., Danias P.G., Stuber M., et al. Coronary magnetic resonance angiography for the detection of coronary stenoses//N Engl J Med. 2001. Vol. 345, N 26. Р. 1863–1869. doi: 10.1056/NEJMoa010866
- Dweck M.R., Williams M.C., Moss A.J., et al. Computed tomography and cardiac magnetic resonance in ischemic heart disease//J Am Coll Cardiol. 2016. Vol. 68, N 20. Р. 2201–2216. doi: 10.1016/j.jacc.2016.08.047
- Hatsukami T.S., Ross R., Polissar N.L., Yuan C. Visualization of fibrous cap thickness and rupture in human atherosclerotic carotid plaque in vivo with high-resolution magnetic resonance imaging//Circulation. 2000. Vol. 102, N 9. Р. 959–964. doi: 10.1161/01.CIR.102.9.959
- Kerwin W.S., Zhao X., Yuan C., et al. Contrast-Enhanced MRI of carotid atherosclerosis: dependence on contrast agent//J Magn Reson Imaging. 2009. Vol. 30, N 1. Р. 35–40. doi: 10.1002/jmri.21826
- Chu B., Kampschulte A., Ferguson M.S., et al. Hemorrhage in the atherosclerotic carotid plaque: a high-resolution MRI study//Stroke. 2004. Vol. 35, N 5. Р. 1079–1084. doi: 10.1161/01.STR.0000125856.25309.86
- Saam T., Hetterich H., Hoffmann V., et al. Meta-Analysis and systematic review of the predictive value of carotid plaque hemorrhage on cerebrovascular events by magnetic resonance imaging//J Am Coll Cardiol. 2013. Vol. 62, N 12. Р. 1081–1091. doi: 10.1016/j.jacc.2013.06.015
- Kooi M.E., Cappendijk V.C., Cleutjens K.B., et al. Accumulation of ultrasmall superparamagnetic particles of iron oxide in human atherosclerotic plaques can be detected by in vivo magnetic resonance imaging//Circulation. 2003. Vol. 107, N 19. Р. 2453–2458. doi: 10.1161/01.CIR.0000068315.98705.CC
- Richards J.M., Semple S.I., MacGillivray T.J., et al. Abdominal aortic aneurysm growth predicted by uptake of ultrasmall superparamagnetic particles of iron oxide//Circulation. 2011. Vol. 4, N 3. Р. 274–281. doi: 10.1161/CIRCIMAGING.110.959866
- Trivedi R.A., U-King-Im J.M., Graves M.J., et al. In vivo detection of macrophages in human carotid atheroma: temporal dependence of ultrasmall superparamagnetic particles of iron oxide-enhanced MRI//Stroke. 2004. Vol. 35, N 7. Р. 1631–1635. doi: 10.1161/01.STR.0000131268.50418.b7
- McBride O.M., Berry C., Burns P., et al. MRI using ultrasmall superparamagnetic particles of iron oxide in patients under surveillance for abdominal aortic aneurysms to predict rupture or surgical repair: MRI for abdominal aortic aneurysms to predict rupture or surgery ― the MA 3 RS study//Open Heart. 2015. Vol. 2, N 1. Р. e000190. doi: 10.1136/openhrt-2014-000190
- Neubauer S. Cardiac magnetic resonance spectroscopy//Curr Cardiol Rep. 2003. Vol. 5, N 1. Р. 75–82. doi: 10.1007/s11886-003-0041-0
- Zajicek J., Pearlman J.D., Merickel M.B., et al. High-Resolution proton NMR spectra of human arterial plaque//Biochem Biophys Res Commun. 1987. Vol. 149, N 2. Р. 437–442. doi: 10.1016/0006-291X(87)90386-X
- Xin L., Lanz B., Lei H, Gruetter R. Assessment of metabolic fluxes in the mouse brain in vivo using 11 H-[ 13 C] NMR Spectroscopy at 14.1 Tesla//J Cereb Blood Flow Metab. 2015. Vol. 35, N 5. Р. 759–765. doi: 10.1038/jcbfm.2014.251
- Deelchand D.K., Moortele P.F., Adriany G., et al. In vivo 1H NMR spectroscopy of the human brain at 9.4T: initial results//J Magn Reson. 2010. Vol. 206, N 1. Р. 74–80. doi: 10.1016/j.jmr.2010.06.006
- Bentzon J.F., Otsuka F., Virmani R., Falk E. Mechanisms of plaque formation and rupture//Circ Res. 2014. Vol. 114, N 12. Р. 1852–1866. doi: 10.1161/CIRCRESAHA.114.302721
- Gholami S., Salavati A., Houshmand S., et al. Assessment of atherosclerosis in large vessel walls: a comprehensive review of FDG-PET/CT image acquisition protocols and methods for uptake quantification//J Nucl Cardiol. 2015. Vol. 22, N 3. Р. 468–479. doi: 10.1007/s12350-015-0069-8
- Folco E.J., Sheikine Y., Rocha V.Z., et al. Hypoxia but not inflammation augments glucose uptake in human macrophages: implications for imaging atherosclerosis with 18Fluorine-Labeled 2-deoxy-D-glucose positron emission tomography//J Am Coll Cardiol. 2011. Vol. 58, N 6. Р. 603–614. doi: 10.1016/j.jacc.2011.03.044
- Menezes L.J., Kotze C.W., Agu O., et al. Investigating vulnerable atheroma using combined 18F-FDG PET/CT angiography of carotid plaque with immunohistochemical validation//J Nucl Med. 2011. Vol. 52, N 11. Р. 1698–1703. doi: 10.2967/jnumed.111.093724
- Wykrzykowska J., Lehman S., Williams G., et al. Imaging of inflamed and vulnerable plaque in coronary arteries with 18F-FDG PET/CT in patients with suppression of myocardial uptake using a low-carbohydrate, high-fat preparation//J Nucl Med. 2009. Vol. 50, N 4. Р. 563–568. doi: 10.2967/jnumed.108.055616
- Græbe M., Pedersen S.F., Borgwardt L., et al. Molecular pathology in vulnerable carotid plaques: correlation with [18]-fluorodeoxyglucose positron emission tomography (FDG-PET)//Eur J Vasc Endovasc Surg. 2009. Vol. 37, N 6. Р. 714–721. doi: 10.1016/j.ejvs.2008.11.018
- Tarkin J.M., Dweck M.R., Evans N.R., et al. Imaging atherosclerosis//Circ Res. 2016. Vol. 118, N 4. Р. 750–769. doi: 10.1161/CIRCRESAHA.115.306247
- Malmberg C., Ripa R.S., Johnbeck C.B., et al. 64Cu-DOTATATE for noninvasive assessment of atherosclerosis in large arteries and its correlation with risk factors: head-to-head comparison with 68Ga-DOTATOC in 60 patients//J Nucl Med. 2015. Vol. 56, N 12. Р. 1895–1900. doi: 10.2967/jnumed.115.161216
- Dweck M.R., Aikawa E., Newby D.E., et al. Noninvasive molecular imaging of disease activity in atherosclerosis//Circ Res. 2016. Vol. 119, N 2. Р. 330–340. doi: 10.1161/CIRCRESAHA.116.307971
- Tarkin J.M., Joshi F.R., Evans N.R., et al. Detection of Atherosclerotic Inflammation by 68 Ga-DOTATATE PET Compared to [18 F] FDG PET Imaging//J Am Coll Cardiol. 2017. Vol. 69, N 14. Р. 1774–1791. doi: 10.1016/j.jacc.2017.01.060
- Gaemperli O., Shalhoub J., Owen D.R., et al. Imaging intraplaque inflammation in carotid atherosclerosis with 11C-PK11195 positron emission tomography/computed tomography//Eur Heart J. 2012. Vol. 33, N 15. Р. 1902–1910. doi: 10.1093/eurheartj/ehr367
- Weiberg D., Thackeray J.T., Daum G., et al. Clinical molecular imaging of chemokine receptor cxcr4 expression in atherosclerotic plaque using 88 Ga-Pentixafor PET: correlation with cardiovascular risk factors and calcified plaque burden//J Nucl Med. 2018. Vol. 59, N 2. Р. 266–272. doi: 10.2967/jnumed.117.196485
- Derlin T., Sedding D.G., Dutzmann J., et al. Imaging of chemokine receptor CXCR4 expression in culprit and nonculprit coronary atherosclerotic plaque using motion-corrected [68Ga]pentixafor PET/CT//Eur J Nucl Med Mol Imaging. 2018. Vol. 45, N 11. Р. 1934–1944. doi: 10.1007/s00259-018-4076-2
- Vesey A.T., Jenkins W.S., Irkle A., et al. 18F-Fluoride and 18F-fluorodeoxyglucose positron emission tomography after transient ischemic attack or minor ischemic stroke: Case-Control study//Circ Cardiovasc Imaging. 2017. Vol. 10, N 3. Р. e004976–e004976. doi: 10.1161/CIRCIMAGING.116.004976
- Joshi N.V., Vesey A.T., Williams M.C., et al. 18F-fluoride positron emission tomography for identification of ruptured and high-risk coronary atherosclerotic plaques: a prospective clinical trial//Lancet. 2014. Vol. 383, N 9918. Р. 705–713. doi: 10.1016/S0140-6736(13)61754-7
- Forsythe R.O., Dweck M.R., McBride O.M., et al. 18F-Sodium fluoride uptake in abdominal aortic aneurysms: the SoFIA3 study//J Am Coll Cardiol. 2018. Vol. 71, N 5. Р. 513–523. doi: 10.1016/j.jacc.2017.11.053
- Mateo J., Izquierdo-Garcia D., Badimon J.J., et al. Noninvasive assessment of hypoxia in rabbit advanced atherosclerosis using 18 f-fluoromisonidazole positron emission tomographic imaging//Circulation. 2014. Vol. 7, N 2. Р. 312–320. doi: 10.1161/CIRCIMAGING.113.001084
- Joshi F.R., Manavaki R., Fryer T.D., et al. Imaging of hypoxia and inflammation in carotid atherosclerosis with 18F-fluoromisonidazole and 18F-fluorodeoxyglucose positron emission tomography//Circulation. 2013. Vol. 128. Р. A14673.
- Winter P.M., Morawski A.M., Caruthers S.D., et al. Molecular imaging of angiogenesis in early-stage atherosclerosis with αvβ3-integrin–targeted nanoparticles//Circulation. 2003. Vol. 108, N 18. Р. 2270–2274. doi: 10.1161/01.CIR.0000093185.16083.95
- Haubner R., Kuhnast B., Mang C., et al. [18 F] Galacto-RGD: synthesis, radiolabeling, metabolic stability, and radiation dose estimates//Bioconjug Chem. 2004. Vol. 15, N 1. Р. 61–69. doi: 10.1021/bc034170n
- Laitinen I., Saraste A., Weidl E., et al. Evaluation of αVβ3 integrin-targeted positron emission tomography tracer 18F-Galacto-RGD for imaging of vascular inflammation in atherosclerotic MiceCLINICAL perspective//Circ Cardiovasc Imaging. 2009. Vol. 2, N 4. Р. 331–338. doi: 10.1161/CIRCIMAGING.108.846865
- Beer A.J., Pelisek J., Heider P., et al. Pet/Ct imaging of integrin αvβ3 expression in human carotid atherosclerosis//JACC Cardiovascular Imaging. 2014. Vol. 7, N 2. Р. 178–187. doi: 10.1016/j.jcmg.2013.12.003
- SCOT-HEART investigators. CT coronary angiography in patients with suspected angina due to coronary heart disease (SCOT-HEART): an open-label, parallel-group, multicentre trial//Lancet. 2015. Vol. 385, N 9985. Р. 2383–2391. doi: 10.1016/S0140-6736(15)60291-4
- Pugliese F., Mollet N.R., Runza G., et al. Diagnostic accuracy of non-invasive 64-slice CT coronary angiography in patients with stable angina pectoris//Eur Radiol. 2006. Vol. 16, N 3. Р. 575–582. doi: 10.1007/s00330-005-0041-0
- Williams M.C., Moss A.J., Dweck M., et al. Coronary artery plaque characteristics associated with adverse outcomes in the SCOT-HEART study//J Am Coll Cardiol. 2019. Vol. 73, N 3. Р. 291–301. doi: 10.1016/j.jacc.2018.10.066
- Greenland P., LaBree L., Azen S.P., et al. Coronary artery calcium score combined with Framingham score for risk prediction in asymptomatic individuals//JAMA. 2004. Vol. 291, N 2. Р. 210–215. doi: 10.1001/jama.291.2.210
- Polonsky T.S., McClelland R.L., Jorgensen N.W., et al. Coronary artery calcium score and risk classification for coronary heart disease prediction//JAMA. 2010. Vol. 303, N 16. Р. 1610–1616. doi: 10.1001/jama.2010.461
- Schuurman A.S., Vroegindewey M., Kardys I., et al. Near-Infrared spectroscopy-derived lipid core burden index predicts adverse cardiovascular outcome in patients with coronary artery disease during long-term follow-up//Eur Heart J. 2018. Vol. 39, N 4. Р. 295–302. doi: 10.1093/eurheartj/ehx247
- Dweck M.R., Chow M.W., Joshi N.V., et al. Coronary arterial 18F-Sodium fluoride uptake: a novel marker of plaque biology//J Am Coll Cardiol. 2012. Vol. 59, N 17. Р. 1539–1548. doi: 10.1016/j.jacc.2011.12.037
- Dalm V.A., van Hagen P.M., van Koetsveld P.M., et al. Expression of somatostatin, cortistatin, and somatostatin receptors in human monocytes, macrophages, and dendritic cells//Am J Physiol Endocrinol Metab. 2003. Vol. 285, N 2. Р. E344–E353. doi: 10.1152/ajpendo.00048.2003
- Gasecki A.P., Eliasziw M., Ferguson G.G., et al. Long-Term prognosis and effect of endarterectomy in patients with symptomatic severe carotid stenosis and contralateral carotid stenosis or occlusion: results from NASCET. North American Symptomatic Carotid Endarterectomy Trial (NASCET) Group//J Neurosurg. 1995. Vol. 83, N 5. Р. 778–782. doi: 10.3171/jns.1995.83.5.0778
- Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European carotid surgery trial (ECST)//Lancet. 1998. Vol. 351, N 9113. Р. 1379–1387. doi: 10.1016/S0140-6736(97)09292-1
- Rothwell P.M., Eliasziw M., Gutnikov S.A., et al. Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery//Lancet. 2004. Vol. 363, N 9413. Р. 915–924. doi: 10.1016/S0140-6736(04)15785-1
- Oates C.P., Naylor A.R., Hartshorne T., et al. Joint recommendations for reporting carotid ultrasound investigations in the United Kingdom//Eur J Vasc Endovasc Surg. 2009. Vol. 37, N 3. Р. 251–261. doi: 10.1016/j.ejvs.2008.10.015
- Brott T.G., Halperin J.L., Abbara S., et al. ASA/ACCF/AHA/AANN/AANS/ACR/ASNR/CNS/SAIP/SCAI/SIR/SNIS/SVM/SVS guideline on the management of patients with extracranial carotid and vertebral artery disease: a report of the American College of cardiology Foundation/American heart association Task force on practice guidelines, and the American stroke association, American association of neuroscience nurses, American association of neurological Surgeons, American College of radiology, American Society of Neuroradiology, Congress of neurological Surgeons, society of atherosclerosis imaging and prevention, Society for cardiovascular angiography and interventions, society of interventional radiology, society of NeuroInterventional surgery, Society for vascular medicine, and Society for vascular surgery developed in collaboration with the American Academy of Neurology and society of cardiovascular computed tomography//J Am Coll Cardiol. 2011. Vol. 57, N 8. Р. e16–94. doi: 10.1016/j.jacc.2010.11.006
- Spence J.D., Naylor A.R., Endarterectomy N.A. Endarterectomy, stenting, or neither for asymptomatic carotid-artery stenosis//N Engl J Med. 2016. Vol. 374, N 11. Р. 1087–1088. doi: 10.1056/NEJMe1600123
- Forsythe R.O., Newby D.E., Robson J.M. Monitoring the biological activity of abdominal aortic aneurysms Beyond Ultrasound//Heart. 2016. Vol. 102, N 11. Р. 817–824. doi: 10.1136/heartjnl-2015-308779
- Duddalwar V.A. Multislice CT angiography: a practical guide to CT angiography in vascular imaging and intervention//Br J Radiol. 2004. Vol. 77, Suppl 1. Р. S27–S38. doi: 10.1259/bjr/25652856
- Castrucci M., Mellone R., Vanzulli A., et al. Mural thrombi in abdominal aortic aneurysms: MR imaging characterization--useful before endovascular treatment?//Radiology. 1995. Vol. 197, N 1. Р. 135–139. doi: 10.1148/radiology.197.1.7568811
- Nguyen V.L., Leiner T., Hellenthal F.A., et al. Abdominal aortic aneurysms with high thrombus signal intensity on magnetic resonance imaging are associated with high growth rate//Eur J Vasc Endovasc Surg. 2014. Vol. 48, N 6. Р. 676–684. doi: 10.1016/j.ejvs.2014.04.025
- Derlin T., Tóth Z., Papp L., et al. Correlation of inflammation assessed by 18F-FDG PET, active mineral deposition assessed by 18F-fluoride PET, and vascular calcification in atherosclerotic plaque: a dual-tracer PET/CT study//J Nucl Med. 2011. Vol. 52, N 7. Р. 1020–1027. doi: 10.2967/jnumed.111.087452
- Janssen T., Bannas P., Herrmann J., et al. Association of linear 18F-sodium fluoride accumulation in femoral arteries as a measure of diffuse calcification with cardiovascular risk factors: a PET/CT study//J Nucl Cardiol. 2013. Vol. 20, N 4. Р. 569–577. doi: 10.1007/s12350-013-9680-8
- Chhatriwalla A.K., Nicholls S.J., Nissen S.E. The asteroid trial: coronary plaque regression with high-dose statin therapy//Future Cardiol. 2006. Vol. 2, N 6. Р. 651–654. doi: 10.2217/14796678.2.6.651
- Nissen S.E., Tuzcu E.M., Schoenhagen P., et al. Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis//JAMA. 2004. Vol. 291, N 9. Р. 1071–1080. doi: 10.1001/jama.291.9.1071
- Okazaki S., Yokoyama T., Miyauchi K., et al. Early statin treatment in patients with acute coronary syndrome: demonstration of the beneficial effect on atherosclerotic lesions by serial volumetric intravascular ultrasound analysis during half a year after coronary event: the establish study//Circulation. 2004. Vol. 110, N 9. Р. 1061–1068. doi: 10.1161/01.CIR.0000140261.58966.A4
- Underhill H.R., Yuan C., Zhao X.Q., et al. Effect of rosuvastatin therapy on carotid plaque morphology and composition in moderately hypercholesterolemic patients: a high-resolution magnetic resonance imaging trial//Am Heart J. 2008. Vol. 155, N 3. Р. 584.e1–584.e8. doi: 10.1016/j.ahj.2007.11.018
- Zhao X.Q., Dong L., Hatsukami T., et al. Mr imaging of carotid plaque composition during lipid-lowering therapy: a prospective assessment of effect and time course//JACC Cardiovasc Imaging. 2011. Vol. 4, N 9. Р. 977–986. doi: 10.1016/j.jcmg.2011.06.013
- Tang T.Y., Howarth S.P., Miller S.R., et al. The atheroma (atorvastatin therapy: effects on reduction of macrophage activity) study: evaluation using ultrasmall superparamagnetic iron oxide-enhanced magnetic resonance imaging in carotid disease//J Am Coll Cardiol. 2009. Vol. 53, N 22. Р. 2039–2050. doi: 10.1016/j.jacc.2009.03.018
- Schoenhagen P., Tuzcu E.M., Apperson-Hansen C., et al. Determinants of arterial wall remodeling during lipid-lowering therapy: serial intravascular ultrasound observations from the reversal of atherosclerosis with aggressive lipid lowering therapy (reversal) trial//Circulation. 2006. Vol. 113, N 24. Р. 2826–2834. doi: 10.1161/CIRCULATIONAHA.105.585703
- Zimarino M., Angeramo F., Prasad A., et al. Reduction of atherothrombotic burden before stent deployment in non-ST elevation acute coronary syndromes: reduction of myocardial necrosis achieved with nose-dive manual thrombus aspiration (remnant) trial. A volumetric intravascular ultrasound study//Cathet Cardiovasc Intervent. 2016. Vol. 88, N 5. Р. 716–725. doi: 10.1002/ccd.26301
- Fayad Z.A., Mani V., Woodward M., et al. Safety and efficacy of dalcetrapib on atherosclerotic disease using novel non-invasive multimodality imaging (dal-PLAQUE): a randomised clinical trial//Lancet. 2011. Vol. 378, N 9802. Р. 1547–1559. doi: 10.1016/S0140-6736(11)61383-4.
Дополнительные файлы