原发性进行性失语症变体的灰质结构变化
- 作者: Akhmadullina D.R.1, Konovalov R.N.1, Shpilyukova Y.A.1, Fedotova E.Y.1
-
隶属关系:
- Research Center of Neurology
- 期: 卷 4, 编号 4 (2023)
- 页面: 467-480
- 栏目: 原创性科研成果
- ##submission.dateSubmitted##: 27.07.2023
- ##submission.dateAccepted##: 22.08.2023
- ##submission.datePublished##: 15.12.2023
- URL: https://jdigitaldiagnostics.com/DD/article/view/567783
- DOI: https://doi.org/10.17816/DD567783
- ID: 567783
如何引用文章
详细
论证。原发性进行性失语症是一种罕见的神经退行性疾病。它的异质性使诊断变得非常复杂。基于体素的形态测量法可对大脑灰质病变进行客观评估,并确定每种疾病变异的萎缩模式特征。这可以改善诊断,也可被用于发病机制的研究。
该研究的目的是确定原发性进行性失语症各变体与对照组相比的萎缩模式。
材料与方法。被诊断为原发性进行性失语症变体之一的患者被纳入主研究组。诊断是根据现行诊断标准确定的。对照组由无神经系统表现和脑结构变化的健康志愿者组成。我们对所有参与者都进行了脑部磁共振成像,随后进行了图像后处理和基于体素的形态测量。对每种疾病变体与对照组的灰质体积进行了比较。研究人员考虑到参与者的性别、年龄和颅内容积。
结果。研究对象包括25名非流利型原发性进行性失语的患者、11名语义型原发性进行性失语的患者和9名logopenic型原发性进行性失语的患者,以及20名健康志愿者。基于体素的形态测量显示了,每种变体都有不同的萎缩模式。在非流利型原发性进行性失语症中,额叶和岛叶主要受累。在语义型原发性进行性失语症中,颞叶和海马主要受累。logopenic型原发性进行性失语症的的特点是额颞叶模式更加弥漫。
结论。在研究过程中,我们发现了原发性进行性失语症各变体特有的脑萎缩模式。基本上,这些结果与疾病的临床表现相符。但是有些研究结果(logopenic型没有后外侧裂部位萎缩和有运动皮层病变;非流利型有眶额皮质和小脑病变;语义型有运动前皮层、中央前回和额下回病变)与原发性进行性失语症发病机制的通常观点不符,需要进一步研究。
关键词
全文:
论证
原发性进行性失语症是一种神经退行性疾病,其特征是早期和稳定的进行性语言障碍,没有或很少有其他认知、运动和/或行为障碍。原发性进行性失语症属于早发性痴呆(65岁之前),虽然发病率相对较低,但却是一个重要的社会经济问题。根据发展中失语症的特征,该病可分为三种临床变异型:非流利型原发性进行性失语、语义型原发性进行性失语和少词型原发性进行性失语。
其中非流利型原发性进行性失语和语义型原发性进行性失语这两种变体更常见于额颞叶痴呆,而第三种变体,即少词型原发性进行性失语,属于非典型阿尔茨海默病。然而,这种划分只是假设的,因为在每种原发性进行性失语症变体中都可以观察到不同的病理形态和遗传变异,从而导致该病的临床表现多种多样,并使其诊断复杂化。
除神经系统检查外,神经系统影像学检查是唯一获准用于鉴别诊断原发性进行性失语变异型的方法。早期的研究帮助确定了每种变异型的特定病变区域,这反映在2011年更新的诊断标准中[1]:
- 非流利型原发性进行性失语的主要表现为左侧额叶后部萎缩(尤其是额下回、运动前皮质、辅助运动区)和岛叶;
- 语义型原发性进行性失语的特征是左颞叶前下部萎缩;
- 少词型原发性进行性失语的特征是左半球后部外侧裂周区和/或顶叶发生病变。
后来进行的一项荟萃分析证实了,每种原发性进行性失语症变体都存在特定的神经变性模式,但揭示了更广泛的病变,例如,语义型原发性进行性失语影响颞叶内侧;非流利型原发性进行性失语影响中央前回、颞上回和颞中回;少词型原发性进行性失语影响后扣带皮层[2]。关于原发性进行性失语症影响灰质的研究数量较少,这是局限性之一。例如,上述荟萃分析只包括20篇论文,共涉及317名患者(169名 语义型原发性进行性失语患者、90名非流利型原发性进行性失语患者和58名少词型原发性进行性失语患者)。此外,许多被纳入的研究都是使用较早的诊断标准进行的,这就对研究结果的相关性提出质疑,尤其是对于非流利型原发性进行性失语和少词型原发性进行性失语的病例来说。近年来较大规模的研究表明,因原发性进行性失语导致的灰质病变可能比以前认为的更为常见,但所发现的萎缩模式往往不一致[3,4]。此外,由于语言特征不同,不同人群中原发性进行性失语症变体的临床表现也可能不同,而这又可能伴随着灰质退化的差 异[5]。同时,唯一关于评估俄罗斯人群中原发性进行性失语症大脑结构变化的研究只包括非流利型原发性进行性失语患者,而在撰写本文时,还没有关于语义型原发性进行性失语和少词型原发性进行性失语的研究[6]。
与此同时,神经成像技术越来越多地被用于原发性进行性失语患者的诊断、检查和动态随访。例如,基于结构性磁共振成像数据的机器学习方法既可被用于原发性进行性失语症或额颞叶痴呆变异的鉴别诊断,也可作为神经退行性痴呆的广泛鉴别诊断的一部分。此外,神经成像还可被用于监测开发中疗法的治疗效果[3,7,8]。所有这些都进一步强调了此类研究的现实意义。
目的
本研究旨在描述俄罗斯人群中每种原发性进行性失语症变体的萎缩模式,并将获得的数据与早前的研究进行比较。
方法
研究设计
本研究是一项实验性、单中心、横向的研究。
纳排标准
根据纳入和未纳入标准将参与者纳入研究。
主要组(原发性进行性失语症组)的纳入标准:年龄大于18岁;根据现行诊断标准[1],确诊为原发性进行性失语症变体之一。
对照组的纳入标准:18岁以上;无神经症状。
未纳入标准:存在磁共振成像禁忌症;存在脑部结构性病灶变化。
执行条件
该研究在莫斯科神经学科学中心进行。
研究持续时间
研究参与者在2022年至2023年期间招募。
医疗干预措施描述
在原发性进行性失语症组中,使用了改良版Addenbrooke认知功能评估量表以评估认知障碍;使用了神经精神问卷以评估情绪行为障碍;使用了额颞叶痴呆症严重程度评定量表以评估疾病严重程度。
所有研究参与者在3T磁感应强度的Magnetom Verio或Magnetom Prisma断层扫描仪上以3D-T1 MPR模式接受了脑部磁共振成像检查。
磁共振成像图像被用于基于体素形态学分析。
后处理和统计分析使用基于Matlab R2019b(Mathworks,美国)的SPM12软件 包(Institute of Neurology,英国)进行。后处理包括:
- 将图像归一化为单一的立体定向蒙特利尔神经学研究所空间(蒙特利尔神经研究所的三维人脑坐标系);
- 使用DARTEL算法将图像分割为灰质、白质和脑脊液;
- 使用各向同性高斯核(半高全宽为8mm)进一步平滑获得的图像。
对基于体素形态学分析结果的评估包括对每个原发性进行性失语症变体与对照组进行分组分析。采用双样本t检验法对研究组之间的灰质容量进行体素比较。使用为各组分别创建的灰质掩膜对灰质进行专门分析。研究参与者的年龄和性别被用作协变量。研究根据颅内容积进行了调整,颅内容积以灰质、白质和脑脊液容积的总和来衡量。最小体积≥100个体素的集群被纳入分析。集群中单个体素的纳入阈值设定为p<0.05,并对预期误发现率进行了校正。
使用bspmview软件[9]实现了VBM结果的可视化、统计分析数据的输出和坐标定位。
伦理审查
该研究获得了神经病学科学中心伦理委员会的批准(2022年12月21日第11-7/22号协议)。
统计分析
使用IBM SPSS Statistics 26.0软件包(IBM,美国)进行了统计数据处理。使用Fisher精确检验分析了名义变量和定序变量之间的差异,使用Kruskal-Wallis检验和Bonferroni校正分析了定量变量之间的差异。
结果
研究对象(参与者)
45名原发性进行性失语症患者和30名对照组参与者被纳入该研究。在45名患者中,25人患有非流利型原发性进行性失语,11人患有语义型原发性进行性失语,9人患有少词型原发性进行性失语。表1给出研究组的主要特征。非流利型原发性进行性失语、语义型原发性进行性失语和少词型原发性进行性失语组的中位年龄分别为64岁、67岁和65岁。在非流利型原发性进行性失语和语义型原发性进行性失语组中,女性患者居多,而在少词型原发性进行性失语组中,男性患者居多。病程从6个月到108个月不等,非流利型原发性进行性失语组的病程更长。病情严重程度从非常轻微到严重不等,以轻度到中度病例为主。虽然病程较短,但认知和情绪行为障碍最严重的是语义型原发性进行性失语组。
表1。研究组的临床特征
指标 | 非流利型原发性进行性失语 (n=25) | 语义型原发性进行性失语 (n=11) | 少词型原发性进行性失语 (n=9) | 对照组 (n=30) |
性别,男/女(%) | 9/16 (36%; 64%) | 5/6 (45%; 55%) | 6/3 (67%; 33%) | 10/20 (33%; 67%) |
年龄,岁 | 64 [57; 67]* | 65 [56; 67] | 56 [51; 59]*,† | |
病程,月 | 48 [36; 60] | 36 [16; 48] | 36 [23; 48] | – |
ACE-R,总分/100 | 68 [36; 80] | 38 [26; 50] | 53 [37; 75] | – |
神经精神问卷,分数/144 | 8 [1; 14]* | – |
注:数据单位为Me[Q1; Q3];ACE-R——改良版Addenbrooke认知功能评估量表;*,†——组间差异具有统计学意义(p<0.05)。
虽然存在这些差异,但各个原发性进行性失语症变体之间在性别、年龄、病程或认知障碍的严重程度方面并无统计学意义上的显著差异。
与对照组比较发现,参与者的性别分布没有差异,同时对照组在统计学意义上明显比非流利型原发性进行性失语和语义型原发性进行性失语组的患者年轻。
研究的主要成果
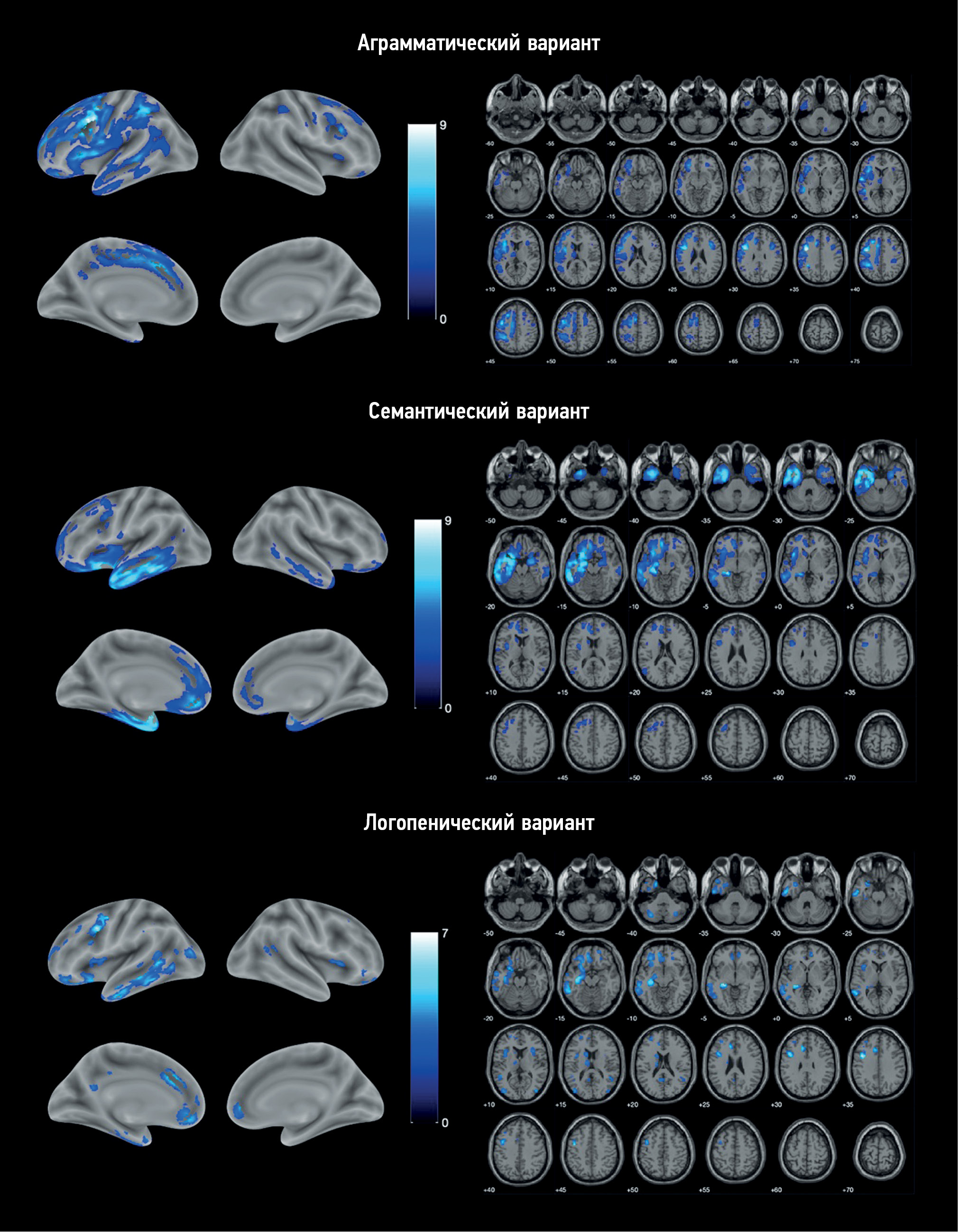
基于体素形态学分析显示了,与对照组相比,每种原发性进行性失语症变体都存在萎缩区(图1)。在所有病例中,萎缩过程都是不对称的,以左半球为主。
图1。与对照组相比,原发性进行性失语症变异型患者灰质体积减少的区域定位。色标代表T值。
非流利型原发性进行性失语组:萎缩过程的 “核心”位于左侧额下回和中央前回(表2)。此外,两半球的辅助运动区、运动前皮质、眶额皮层和岛叶也发生了明显变化。只有左半球的颞叶受到影响,且仅限于其外侧区域,主要是颞中回和颞下回,并向颞顶叶交界处和顶叶下部过渡。此外,皮层下结构也出现萎缩:左侧尾状核、丘脑和壳儿以及小脑。
表2。与对照组相比,非流利型原发性进行性失语组中的患者灰质体积减少的区域
脑区 | 体积,体素 | 蒙特利尔神经学研究所峰坐标 x,y,z |
前额回、额下回、辅助运动区、岛叶、额上回和中回、眶额皮层、扣带回皮质、顶叶下部、角回和眶上回、颞叶外侧、壳儿、尾状核,S | 37644 | -40, 4, 34 |
-42, -2, 42 | ||
-57, -4, 4 | ||
额下回的岛盖部和三角部,D | 2264 | 39, 18, 26 |
38, 6, 27 | ||
36, 4, 40 | ||
尾状核、丘脑,S | 1065 | -16, -16, 22 |
-14, -12, 10 | ||
-10, 10, 16 | ||
眶额皮层, D | 180 | 24, 38, -9 |
小脑Crus I,D | 101 | 18, -72, -36 |
楔前叶,S | 105 | -10, -57, 27 |
中央后回,D | 314 | 33, -34, 38 |
36, -26, 39 | ||
岛叶,D | 191 | 34, 20, 10 |
中央前回,D | 257 | 52, -6, 45 |
57, -6, 33 |
注:S——在左侧,D——在右侧。
语义型原发性进行性失语组:萎缩主要集中在左侧颞叶,包括其极点、下外侧和内侧区域,以及左侧海马体和岛叶(表3)。单个病变区域出现在左额叶,包括眶额皮层、内侧前额叶皮层和运动前皮层,以及中央前回和额下回。总体而言,除了左侧尾状核的一个萎缩区域外,这些变化比非流利型原发性进行性失语更为局部,而且没有超出额颞岛区域。在右半球也发现了类似但范围较小的萎缩区域。
表3。与对照组相比,语义型原发性进行性失语组中的患者灰质体积减少的区域
脑区 | 体积,体素 | 蒙特利尔神经学研究所峰坐标 x,y,z |
海马体、颞叶外侧和内侧部分、颞极、岛叶、前扣带回皮层、眶额皮层、尾状核,S,和眶额皮层,D | 36682 | -24, -30, -4 |
-52, -46, -15 | ||
-56, -39, -16 | ||
海马、颞叶极、颞下回、眶额皮层,D | 6563 | 24, -6, -21 |
39, 10, -33 | ||
24, 9, -21 | ||
颞上回的中间部分,S | 344 | -57, -6, 4 |
运动前皮层、中央前回中段、额下回岛盖部,S | 1809 | -28, 10, 54 |
-40, 3, 32 | ||
-24, 6, 38 | ||
颞中回后部,S | 253 | -51, -68, 16 |
-44, -57, 15 | ||
内侧前额叶皮层,S | 125 | -9, 22, 48 |
颞中回和颞下回的后部,D | 104 | 56, -62, 9 |
58, -54, -3 |
注:S——在左侧,D——在右侧。
少词型原发性进行性失语组:灰质体积减少最严重的部位也在左颞叶,但主要涉及颞中回和颞下回的后部,其次是颞极。此外,它还延伸到了海马旁回、海马体和杏仁核(表4)。在左额叶的各个部分中,萎缩程度最严重的是中央前回、前扣带皮层、眶额皮层和内侧前额叶皮层。在这种原发性进行性失语症变体中,除额颞区外,萎缩过程还扩散到岛叶、左顶叶和枕叶、小脑和左尾状核。
表4。与对照组相比,少词型原发性进行性失语组中的患者灰质体积减少的区域
脑区 | 体积,体素 | 蒙特利尔神经学研究所峰坐标 x,y,z |
中央前回,S | 1304 | -40, 6, 34 |
-42, 0, 45 | ||
-36, 3, 52 | ||
海马体、杏仁核、颞下回、颞中回、眶额皮层,S | 8136 | -26, -30, -3 |
-36, -16, -15 | ||
-27, -24, -9 | ||
前扣带回皮层,S | 501 | -12, 26, 27 |
前扣带回皮层,S;内侧前额叶皮层,S和D | 1130 | -10, 44, -14 |
14, 45, -2 | ||
-9, 38, -6 | ||
小脑Crus II,S | 325 | -32, -70, -39 |
-38, -60, -42 | ||
枕中回,S | 328 | -40, 82, 14 |
尾状核,S | 325 | -14, -10, 20 |
岛叶和额下回,S | 537 | -14, 16, 8 |
-38, 4, 15 | ||
颞极,S | 218 | -45, -15, -36 |
颞中回后部,D | 166 | 46, -48, 15 |
嘴外侧前额皮层,S | 389 | -30, 51, 21 |
-21, 56, 10 | ||
-33, 42, 24 | ||
眶额皮层,D | 110 | 20, 52, -14 |
小脑Crus I,D | 145 | 32, -66, -39 |
尾状核,S | 201 | -14, 6, 18 |
楔前叶,S | 170 | -8, -54, 18 |
岛叶,D | 211 | 33, 18, 12 |
34, 9, 14 |
注:S——在左侧,D——在右侧。
讨论
研究主要成果的综述
在研究过程中,我们确定了受每种原发性进行性失语症变体影响的灰质区域。检测到的萎缩模式与文献数据基本一致,但也发现了一些特殊之处。
对研究主要成果的讨论
对非流利型原发性进行性失语患者来说,灰质病变预计包括额下回、中央前回、运动前皮层、辅助运动区和前岛叶,这些区域的萎缩在患有非流利型原发性进行性失语的情况下已被多次描述,并与该变体特异性言语障碍密切相关[10]。因此,以前非流利型原发性进行性失语患者额下回灰质体积的减少与失语症和语法缺失症的总体严重程度有关,左侧岛叶与流利话语障碍的严重程度有关,辅助运动区和运动前皮层的萎缩与言语失用、发音速度和非语言运动使用有关[11–14]。此外,中央前回的退化还可能与伴有非流利型原发性进行性失语的运动神经元疾病有关,在我们的样本中,16%的非流利型原发性进行性失语患者患有这种疾病。
除额叶外,萎缩还扩展到左侧颞叶的外侧部分。虽然这种病变在患有非流利型原发性进行性失语的情况下被认为是不太“典型”的,但在大多数调查这种变异型结构变化的研究中都发现了这种病变。这可能反映神经退行性过程随着时间的推移而不断发展,以及对一些个别单词和命名的理解出现障碍[2,15,16]。
尤其值得注意的是,我们发现了双侧眶额皮层萎缩,这在非流利型原发性进行性失语中极为罕见,而且通常与情感和行为障碍的发展有关。在我们的样本中,绝大多数患者都出现了轻度至中度的行为障碍,这或许可以解释这一发现。此外,以前也曾在与GRN基因突变相关的原发性进行性失语症患者中发现过眶额皮层萎缩,但仅出现在无法分类的原发性进行性失语症病例中,其临床表现不符合任何一种疾病变异的定义[17]。在我们的样本中,有2名非流利型原发性进行性失语患者的GRN基因被证实发生了突变,但他们的临床表现是这种变异的典型表现,因此我们无法将发现的萎缩与该组患者的遗传特征联系起来。总之,这一发现需要在我们地区的更大样本中进行进一步研究。
在皮层下区域中,非流利型原发性进行性失语患者的左丘脑、壳儿和尾状核萎缩了。近年来,越来越多的研究注意到在患有额颞叶痴呆症变异型,尤其是遗传型额颞叶痴呆症的情况下存在丘脑萎缩,但这种变化更多是额颞叶痴呆症行为变异型的特征,而非非流利型原发性进行性失语的特征,后者的丘脑萎缩更多是局部性的,并非在所有病例中都发生[2,16–19]。以前的一些个别研究也描述了壳儿和尾状核的萎缩,但在更大规模的研究中却没有发现[4,10,13]。总体而言,虽然有新证据表明丘脑和基底核因与额顶区的联系而参与言语的发音和语音功能,但这些结构的病变在多大程度上参与原发性进行性失语症言语障碍的发生仍没有明确的答案[20]。
此外,小脑萎缩也不是非流利型原发性进行性失语的典型症状。在额颞叶痴呆症 中,该区域的萎缩首先在C9orf72基因突变的遗传变异中被描述,但其更多的特征是双侧相对对称的萎缩,除小脑外,通常还延伸到顶枕区,而我们的研究中没有发现这种情况。另一个可能的解释是小脑在提供言语功能方面的作用。例如,以前的研究表明,小脑半球的第七叶(我们的研究发现了该叶的萎缩)在口语表达过程中参与提供反馈,其重要性在大脑语言区域逐渐紊乱的情况下会增 加[20]。
总体而言,语义型原发性进行性失语的萎缩模式与文献数据相合。在两个大脑半球的颞极观察到灰质体积的最明显减少,其中以左侧为主。左侧颞极是存储、处理和检索言语语义信息的语义枢纽。颞极萎缩是语义型原发性进行性失语的一个主要特征,它与该变异型出现命名性失语和对单个词的意义理解受损有关[21]。我们在该研究中发现,海马体、颞叶内侧和下叶的非对称性萎缩也是语义型原发性进行性失语的主要特征之一,并且在这一变异型中被多次描述过。有趣的是,与阿尔茨海默病不同,语义型原发性进行性失语的特征是海马体前部萎缩,这也与患者语义缺失的严重程度相关[22]。颞叶下部(尤其是纺锤形回)受累与语义型原发性进行性失语中的情感行为障碍和面孔失认症有关,而颞上回和颞中回的外侧部分受累则与命名性失语、单词理解障碍和阅读障碍的严重程度有关[21,23]。前扣带回、内侧前额叶皮层、眶额皮层、小核和尾状核体积减少是语义型原发性进行性失语晚期的特征,与病理过程逐渐从左颞极向密切相关区域扩散有关[24,25]。这些区域的病变与患者社交活动受损有关;但迄今为止,这方面的研究数量还很少[26]。在语义型原发性进行性失语中,左侧额下回、运动前皮层和中央前回的萎缩并不那么典型,而我们已经发现了这种萎缩。这些变化可能与该病临床表现的逐渐发展和言语运动成分障碍的出现有关[16]。
在少词型原发性进行性失语中,检测到的灰质体积减少具有最弥漫的特征,有许多相对较小的退化灶。在我们的样本中,左侧颞叶和额叶的萎缩区域最为明显。少词型原发性进行性失语患者通常会出现颞中回和颞下回体积减少的情况,这与特定的语言障 碍(命名性失语和长句重复障碍)有关,其发生是由于短期语音记忆功能受损[27]。海马体和杏仁核的非对称性萎缩也是少词型原发性进行性失语的特征,很可能是阿尔茨海默氏症潜在变性的一部分。这也可能是萎缩向顶叶、枕叶和小脑等后部区域扩散的原因。
左侧颞极、额下回、岛叶和外侧前额叶皮层的体积减少也曾在少词型原发性进行性失语中出现过,通常发生在晚期。显然,这反映病理过程向其他言语区域的扩散,并与临床表现中出现的其他原发性进行性失语症变体更具特征性的症状(如对一些个别单词的理解能力受损)相 关[16]。
中央前回、眶额皮层和内侧额叶的萎缩即使在原发性进行性失语症的对数开放变异型晚期也不太明显。如上所述,眶额皮层的损伤可能与情绪行为障碍有关。前扣带皮质的体积减少在阿尔茨海默病中被多次描述,可能反映患者非语言认知障碍的发展。最令人感兴趣的是前中央回的明显退化,因为虽然以前也描述过这种变化,但它们通常不是最重要的萎缩区域之一,而且只在长期随访中出现[3]。在检查时,少词型原发性进行性失语组患者没有运动皮层病变的临床表现,很可能该区域的萎缩是继发性的,在疾病的发病机制中没有发挥主要作用。
与预期相反,在少词型原发性进行性失语组中没有发现下顶叶、眶上回和角回以及颞上回后部的变性,而这些部位被认为是这种变异的最主要病理特征,并被纳入诊断标准。这一事实,以及我们在少词型原发性进行性失语组中发现的更为弥漫的局灶性萎缩特征,可能是由于样本相对较少及其病理形态异质性造成的。虽然阿尔茨海默氏症在少词型原发性进行性失语中占主导地位,占所有病例的85%-100%[28,29],但在我们的样本中,只有三分之一的患者证实了阿尔茨海默氏症。以前的研究表明,原发性进行性失语症的萎缩模式会因潜在的病理形态学过程而有所不同,这可能会影响我们的研究结果[30]。同时,我们的研究结果表明,少词型原发性进行性失语的临床表现并不一定非要有后部外侧裂周区萎缩,这也间接强调颞中回在该病发病机制中的重要性。
研究局限性
值得注意的是,我们的工作存在一些局限性。如前所述,语义型原发性进行性失语和少词型原发性进行性失语组的样本量较小。研究组的遗传和病理形态异质性也是一个相对限制因素。一方面,这可以更好地代表原发性进行性失语症患者群体,但另一方面,这可能会影响基于体素形态学分析的结果,因为每种遗传和病理形态变异的萎缩模式都可能有其自身的特殊性。此外,我们的工作中没有对检测到的萎缩与疾病的临床表现进行相关性分析,因此无法对检测到的变化的临床意义以及新检测到的萎缩区域在原发性进行性失语症发病机制中的作用做出明确的结论。在计划该领域的进一步研究时,应考虑到这些局限性。
结论
在使用基于体素形态学分析进行的研究中,发现了每种原发性进行性失语症变体特有的灰质萎缩模式。研究结果与言语功能和社交行为的功能解剖相一致。研究结果与之前在其他国家进行的研究结果部分相合。不过,也发现了一些差异,需要在更大的样本中进一步验证。
ADDITIONAL INFORMATION
Funding source. This research was funded by Russian Science Foundation, grant number 23-25-00483.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. D.R. Akhmadullina participated in clinical and neuroimaging data collection, data analysis and interpretation and original draft preparation; R.N. Konovalov conceptualized and supervised the study, performed data analysis and interpretation, reviewed and edited the manuscript; Yu.A. Shpilyukova collected clinical data, reviewed and edited the manuscript; E.Yu. Fedotova planned research design, supervised the study, reviewed and edited the manuscript.
作者简介
Diliara R. Akhmadullina
Research Center of Neurology
编辑信件的主要联系方式.
Email: akhmadullinadr1@gmail.com
ORCID iD: 0000-0001-6491-2891
SPIN 代码: 5721-8567
俄罗斯联邦, Moscow
Rodion N. Konovalov
Research Center of Neurology
Email: krn_74@mail.ru
ORCID iD: 0000-0001-5539-245X
SPIN 代码: 2515-7673
Scopus 作者 ID: 23497502900
Researcher ID: B-6834-2012
MD, Cand. Sci. (Med.)
俄罗斯联邦, MoscowYulia A. Shpilyukova
Research Center of Neurology
Email: jshpilyukova@gmail.com
ORCID iD: 0000-0001-7214-583X
SPIN 代码: 7502-8984
MD, Cand. Sci. (Med.)
俄罗斯联邦, MoscowEkaterina Y. Fedotova
Research Center of Neurology
Email: ekfedotova@gmail.com
ORCID iD: 0000-0001-8070-7644
SPIN 代码: 3466-2212
MD, Dr. Sci. (Med.)
俄罗斯联邦, Moscow参考
- Gorno-Tempini ML, Hillis AE, Weintraub S, et al. Classification of primary progressive aphasia and its variants. Neurology. 2011; 76(11):1006–1014. doi: 10.1212/WNL.0b013e31821103e6
- Bisenius S, Neumann J, Schroeter ML. Validating new diagnostic imaging criteria for primary progressive aphasia via anatomical likelihood estimation meta-analyses. European Journal of Neurology. 2016;23(4):704–712. doi: 10.1111/ene.12902
- Lombardi J, Mayer B, Semler E, et al. Quantifying progression in primary progressive aphasia with structural neuroimaging. Alzheimer’s & Dementia. 2021;17(10):1595–1609. doi: 10.1002/alz.12323
- Chapman CA, Polyakova M, Mueller K, et al. Structural correlates of language processing in primary progressive aphasia. Brain Communications. 2023;5(2). doi: 10.1093/braincomms/fcad076
- Canu E, Agosta F, Battistella G, et al. Speech production differences in English and Italian speakers with nonfluent variant PPA. Neurology. 2020;94(10):e1062–e1072. doi: 10.1212/WNL.0000000000008879
- Akhmadullina D, Konovalov R, Shpilyukova Y, et al. Brain atrophy patterns in patients with frontotemporal dementia: voxel-based morphometry. Bulletin of Russian State Medical University. 2020;(6):84–89. doi: 10.24075/brsmu.2020.075
- Lampe L, Huppertz HJ, Anderl-Straub S, et al. Multiclass prediction of different dementia syndromes based on multi-centric volumetric MRI imaging. NeuroImage: Clinical. 2023;37:103320. doi: 10.1016/j.nicl.2023.103320
- Staffaroni AM, Ljubenkov PA, Kornak J, et al. Longitudinal multimodal imaging and clinical endpoints for frontotemporal dementia clinical trials. Brain. 2019;142(2):443–459. doi: 10.1093/brain/awy319
- zenodo.org [Internet]. spunt/bspmview: BSPMVIEW v.20161108 (Version 20161108). Zenodo. [cited 26 July 2023]. Available from: https://zenodo.org/badge/latestdoi/21612/spunt/bspmview doi: 10.5281/zenodo.168074
- Gorno-Tempini ML, Dronkers NF, Rankin KP, et al. Cognition and anatomy in three variants of primary progressive aphasia. Annals of Neurology. 2004;55(3):335–346. doi: 10.1002/ana.10825
- Tetzloff KA, Utianski RL, Duffy JR, et al. Quantitative analysis of agrammatism in agrammatic primary progressive aphasia and dominant apraxia of speech. Journal of Speech, Language, and Hearing Research. 2018;61(9):2337–2346. doi: 10.1044/2018_JSLHR-L-17-0474
- Whitwell JL, Duffy JR, Strand EA, et al. Distinct regional anatomic and functional correlates of neurodegenerative apraxia of speech and aphasia: An MRI and FDG-PET study. Brain and Language. 2013;125(3):245–252. doi: 10.1016/j.bandl.2013.02.005
- Mandelli ML, Vitali P, Santos M, et al. Two insular regions are differentially involved in behavioral variant FTD and nonfluent/agrammatic variant PPA. Cortex. 2016;74:149–157. doi: 10.1016/j.cortex.2015.10.012
- Cordella C, Quimby M, Touroutoglou A, et al. Quantification of motor speech impairment and its anatomic basis in primary progressive aphasia. Neurology. 2019;92(17):e1992–e2004. doi: 10.1212/WNL.0000000000007367
- Breining BL, Faria AV, Tippett DC, et al. Association of Regional Atrophy With Naming Decline in Primary Progressive Aphasia. Neurology. 2023;100(6):e582–e594. doi: 10.1212/WNL.0000000000201491
- Rogalski E, Cobia D, Harrison TM, et al. Progression of language decline and cortical atrophy in subtypes of primary progressive aphasia. Neurology. 2011;76(21):1804–1810. doi: 10.1212/WNL.0b013e31821ccd3c
- Samra K, MacDougall AM, Bouzigues A, et al. Genetic forms of primary progressive aphasia within the GENetic Frontotemporal dementia Initiative (GENFI) cohort: comparison with sporadic primary progressive aphasia. Brain Communications. 2023;5(2). doi: 10.1093/braincomms/fcad036
- Rohrer JD, Nicholas JM, Cash DM, et al. Presymptomatic cognitive and neuroanatomical changes in genetic frontotemporal dementia in the Genetic Frontotemporal dementia Initiative (GENFI) study: a cross-sectional analysis. The Lancet Neurology. 2015;14(3):253–262. doi: 10.1016/S1474-4422(14)70324-2
- McKenna MC, Li Hi Shing S, Murad A, et al. Focal thalamus pathology in frontotemporal dementia: Phenotype-associated thalamic profiles. Journal of the Neurological Sciences. 2022;436:120221. doi: 10.1016/j.jns.2022.120221
- Ziegler W, Ackermann H. Subcortical Contributions to Motor Speech: Phylogenetic, Developmental, Clinical. Trends in Neurosciences. 2017;40(8):458–468. doi: 10.1016/j.tins.2017.06.005
- Migliaccio R, Boutet C, Valabregue R, et al. The Brain Network of Naming: A Lesson from Primary Progressive Aphasia. PLOS ONE. 2016;11(2):e0148707. doi: 10.1371/journal.pone.0148707
- Wisse LEM, Ungrady MB, Ittyerah R, et al. Cross-sectional and longitudinal medial temporal lobe subregional atrophy patterns in semantic variant primary progressive aphasia. Neurobiology of Aging. 2021;98:231–241. doi: 10.1016/j.neurobiolaging.2020.11.012
- Fittipaldi S, Ibanez A, Baez S, et al. More than words: Social cognition across variants of primary progressive aphasia. Neuroscience & Biobehavioral Reviews. 2019;100:263–284. doi: 10.1016/j.neubiorev.2019.02.020
- Brown JA, Deng J, Neuhaus J, et al. Patient-Tailored, Connectivity-Based Forecasts of Spreading Brain Atrophy. Neuron. 2019;104(5):856–868.e5. doi: 10.1016/j.neuron.2019.08.037
- Collins JA, Montal V, Hochberg D, et al. Focal temporal pole atrophy and network degeneration in semantic variant primary progressive aphasia. Brain. 2017;140(2):457–471. doi: 10.1093/brain/aww313
- Kumfor F, Landin-Romero R, Devenney E, et al. On the right side? A longitudinal study of left- versus right-lateralized semantic dementia. Brain. 2016;139(3):986–998. doi: 10.1093/brain/awv387
- Henry ML, Wilson SM, Babiak MC, et al. Phonological Processing in Primary Progressive Aphasia. Journal of Cognitive Neuroscience. 2016;28(2):210–222. doi: 10.1162/jocn_a_00901
- Montembeault M, Brambati SM, Gorno-Tempini ML, Migliaccio R. Clinical, Anatomical, and Pathological Features in the Three Variants of Primary Progressive Aphasia: A Review. Frontiers in Neurology. 2018;9. doi: 10.3389/fneur.2018.00692
- Bergeron D, Gorno-Tempini ML, Rabinovici GD, et al. Prevalence of amyloid-β pathology in distinct variants of primary progressive aphasia. Annals of Neurology. 2018;84(5):729–740. doi: 10.1002/ana.25333
- Preiß D, Billette OV, Schneider A, et al. The atrophy pattern in Alzheimer-related PPA is more widespread than that of the frontotemporal lobar degeneration associated variants. NeuroImage: Clinical. 2019;24:101994. doi: 10.1016/j.nicl.2019.101994