核心脏病学放射性核素成像模拟计算机建模虚拟平台。与临床数据比较
- 作者: Denisova N.V.1,2, Gurko M.A.1,2, Kolinko I.P.1,2, Ansheles A.A.3, Sergienko V.B.3
-
隶属关系:
- Novosibirsk State University
- Khristianovich Institute of Theoretical and Applied Mechanics
- National Medical Research Centre of Cardiology Named After Academician E.I. Chazov
- 期: 卷 4, 编号 4 (2023)
- 页面: 492-508
- 栏目: 原创性科研成果
- ##submission.dateSubmitted##: 22.09.2023
- ##submission.dateAccepted##: 31.10.2023
- ##submission.datePublished##: 15.12.2023
- URL: https://jdigitaldiagnostics.com/DD/article/view/595696
- DOI: https://doi.org/10.17816/DD595696
- ID: 595696
如何引用文章
详细
论证。在放射性核素成像领域,人体临床试验(in vivo)因辐射负荷和伦理规范而受到限制。因此,数学建模方法和模拟计算机试验(in silico)方法越来越重要。这些方法以数值模型为基础。在英文文献中,这种方法被称为“Virtual clinical trials”(虚拟临床试验)。
该研究的目的是利用放射性药物99mTc-MIBI,开发单光子发射计算机断层扫描及计算机断层扫描对心肌灌注进行放射性核素成像模拟建模的软件工具;开展旨在提高单光子发射计算机断层扫描准确度的研究。
材料与方法。我们开发了“核心脏病学单光子发射计算机断层扫描及计算机断层扫描方法模拟测试虚拟平台”综合软件。开发综合软件的时候,我们使用了患者、扫描仪的数字模型和心肌评估,心肌评估是使用“极坐标靶心图”形式的左心室数字图像进行的。通过与临床数据对比,对软件系统进行了验证。临床数据是在以E.I.CHAZOV院士命名的国家心脏病学医学研究中心(NATIONAL MEDICAL RESEARCH CENTRE OF CARDIOLOGY NAMED AFTER ACADEMICIAN E.I.CHAZOV,莫斯科)获得的。我们还进行了模拟计算机测试,在测试期间研究了心肌评估的准确度,这取决于极坐标靶心图归一化的方法和重建算法中校正因子的考虑。
结果。模拟测试结果表明了,左心室心肌灌注的评估很大程度上取决于极坐标靶心图归一化的方法和重建算法中校正因子的考虑。使用心肌正常区域活动的平均值计算归一化因子时,估算结果最为准确。结果表明了,用强度最大的像素进行归一化的常见方法会导致误 差。“虚拟”测试的结果与临床观察完全一致。
结论。从心肌活性累积的相对归一化值过渡到绝对定量估计值,可以消除现有的局限性和不确定性,是提高核心脏病学中单光子发射计算机断层扫描及计算机断层扫描方法诊断准确度的主要条件。
关键词
全文:
论证
单光子发射计算机断层成像及计算机断层扫描相(SPECT/CT)是一种现代核医学诊断方法。它作为心血管疾病患者的临床检查标准已被广泛采用[1]。通过SPECT/CT方法,可以观察到不可逆转的致命损伤之前的心肌灌注(供血)障碍。检查时,向患者静脉注射放射性药物(RP),该药物在心肌中的分布与血流量成比例,并反映心肌的灌注状态。放射性药物只在健康的心肌细胞中积聚,因此是心肌功能正常的标志。
单光子发射计算机断层成像方法的基础是评估左心室心肌细胞中放射性药物积累的不规则性。左心室可视化以切片和“极坐标图”模式进行。极坐标图使用图形的数字化表示,它在一个平面图像中覆盖左心室心肌的整个表面,并可量化正常灌注区域、病变的分布和严重程度。几乎在同一时间,3个商业软件包被开发出来,用于以极坐标图的形式表示左心室:
- 4D-MSPECT(美国密歇根州密歇根大学医学中心)[2];
- ECTb Emory’s Cardiac Toolbox(美国亚特兰大埃默里大学)[3];
- Quantitative Perfusion SPECT(QPS)(美国洛杉矶Cedars-Sinai医疗中心)[4].
目前,这三种软件包均已标准化,并广泛应用于临床单光子发射计算机断层成像系统。然而,根据文献,这些软件包对心肌状态的定量评估各不相同[5]。G.Germano的一篇社论[6]指出,虽然使用不同软件包得出的最终结论基本一致,但在量化心肌灌注方面,软件包之间存在显著差异。
问题是:获得的估计值有多准确,它们在多大程度上符合放射性药物在心肌中的真实分布?为了分析单光子发射计算机断层成像方法在核心脏病学中的准确性,需要进行研究,将重建左心室心肌图像的极坐标图与已知放射性药物分布的模型参考极坐标图进行比较评估。此类研究是在临床环境中使用真实模型(in vitro)进行的,但在进行数十、数百项研究时,由于成本高和研究人员的辐射负担,它们受到限制。此外,使用真实模型进行的研究无法涵盖各种临床病例。一个值得考虑的替代方法是使用数字拟人模型模拟不同体质的病人以及不同位置和大小的病变,进行计算机模拟(in silico)。计算机模拟试验包括使用SPECT/CT方法检查的所有连续阶段,从放射性药物在患者器官中的分布到使用极坐标图对灌注进行半定量评估。这种被称为“虚拟临床试验”的方法在过去二十年中一直在世界高科技核医学中心积极发展[7]。在俄罗斯,此类研究最近才开始发展[8, 9]。
目的
这项研究的目的是开发一个“用于核心脏病学SPECT/CT方法模拟测试虚拟平台”软件包,使用患者、扫描仪和基于极坐标图形式的左心室数字表征的心肌状态估计的数字模型。在模拟计算机实验中,首次研究了左心室心肌灌注状态的半定量评估与极坐标图归一化方法的关系,以及在重建算法中考虑校正因素。
材料和方法
利用患者、扫描仪的数字模型以及极坐标图形式的左心室数字图像对心肌状态的评估,创建了“用于核心脏病学SPECT/CT方法模拟测试虚拟平台”的综合软件。该软件包采用模块化结构,目前包括4个模块,模拟从注射的放射性药物 (锝-99m-甲氧基异丁基异腈配合物,99mTc-MIBI)在患者器官中的分布到基于极坐标图法评估左心室心肌灌注的所有连续检查阶段:
- 虚拟病人程序;
- 虚拟断层扫描程序;
- 图像重建算法程序;
- 极坐标图程序。
虚拟病人程序
本文使用了拟人化的数学幻影,既是先前在理论与应用力学研究所(新西伯利亚)开发的躯干数学模型(MMT)[9, 10]。躯干数学模型的每个器官都是根据描述适当三维图形(平面、圆锥、圆柱体、抛物面、椭圆体等)的解析几何方程建立的。布尔逻辑运算符用于对这些图形进行叠加、交叉和截断操作,以创建描述器官轮廓的复杂几何组合,接近图谱图像[11]。幻影图像以64×64×64或 128×128×128尺寸的数字阵列表示。
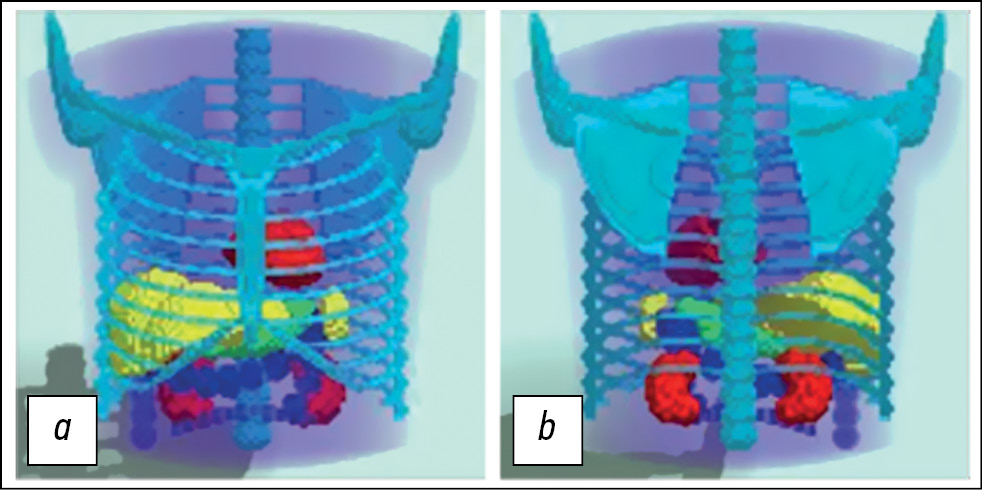
事实上,躯干数学模型是根据解析几何方程创建的矢量模型。这些方程描述了分隔具有不同形态特征的结构的表面(边界)。通过改变几何图形的参数,可以创建不同解剖结构和不同位置的幻影。。在这项研究中,我们使用了一个普通男性病人的解剖模型,病人处于双臂向上举起的姿势。模型包括躯干、胸骨系统、肺、心、脾、胃、肾。肠道以大肠为模型。对于核医学诊断任务,通常不需要精细的解剖结构细节。躯干数学模型不考虑心跳和呼吸变化。原则上,这种模型对应于现代SPECT/CT系统在相位模式下的扫描,并去除心脏和呼吸运动。该模型如图1所示。
图1。躯干的三维数学模型,模拟一名普通男性患者双臂上举姿势的解剖结构:a——前视图;b——后视图。该模型以128×128×128的离散形式表示。
在核医学领域的模拟研究中,起主要作用的不是病人的解剖结构,而是放射性药物在各器官中的分布情况。虚拟病人程序利用99mTc-MIBI分布的临床数据,在躯干数学模型中生成放射性药物累积的三维图(“活动图”)。例如,图2显示了一名真实病人的临床重建单光子发射计算机断层成像图像,其中标有以脉冲/象素为单位的不同器官的活动值。这些数据是患者在俄罗斯联邦卫生部联邦国家预算机构“以院士E.I.Chazov(以下简称Chazov院士国家心脏病学医学研究中心)命名的国家心脏医学研究中心”使用 BrightView XCT SPECT/CT系统(荷兰Philips)对患者进行检查时获得的。这些数值可能因人而异。在本研究中,表1中的数值用于创建躯干数学模型模体的活动图。每个器官内的活动分布均匀,但模拟LV心肌缺血性损伤的情况除外。
图2。临床数据。患者胸部器官中99mTc-MIBI放射性药物累积的相对值(脉冲/象素)。这些图像是患者在俄罗斯联邦卫生部联邦国家预算机构“以E.I.Chazov院士命名的国家心脏医学研究中心”的Philips BrightView XCT设备上接受单光子发射计算机断层成像与计算机断层扫描检查时获得。
表1。99mTc-MIBI放射性药物在数学躯干模型模型器官中累积的值
器官名称 | 99mTc-MIBI放射性药物的累积相对值,脉冲/象素 |
软组织 | 130 |
肺 | 100 |
肝脏 | 900 |
心脏 | 750 |
大肠 | 1000 |
胆囊 | 2500 |
图3显示了躯干数学模型模体的活动图。图像是根据伽马相机的大小进行“裁剪”的。肺,肾,脾,胃没被分离出来,因为它们的放射性药物浓度与软组织中的几乎相同,因此没有突出显示。左心室、肝脏、胆囊和肠襻清晰可见。心脏模型只用左心室表示,因为右心室壁厚度较小,在单光子发射计算机断层成像图像上几乎看不到。
图3。a——放射性药物累积图:根据躯干数学模型计算的99mTc-MIBI相对浓度值的三维分布。该图以128×128×100的离散形式表示;b——根据躯干数学模型生成的衰减校正图。该图以128×128×100的离散形式表示。图中显示的是中心纵切面。
在临床检查中,为了考虑伽马射线在不同密度的生物组织中的衰减校正,计算机断层扫描数据被用来生成病人的个人三维“衰减校正图”衰减校正。在这项研究中,衰减校正图是为躯干数学模型模体生成的,其中包括物质密度的主要差异。考虑了三种不同密度的介质:肺(空气)、软组织(水)和骨骼。表2给出了本文中使用的140keV伽马射线的衰减校正系数值 [12]。
表2。能量为140keV的伽马辐射(锝)的衰减校正系数值
器官(环境) | 能量为140keV的伽马射线的衰减校正系数值,1/cm |
软组织(水) | 0.15 |
肺(空气) | 0.04 |
骨骼 | 0.28 |
因此,虚拟病人程序创建了3个模型:一个拟人化的躯干数学模型解剖模型、一个活动图和一个衰减校正图。
虚拟断层扫描程序
“虚拟断层扫描仪”程序模拟对“虚拟患者”进行SPECT/CT扫描。使用蒙特卡罗统计建模方法计算原始投影数据。用数学术语来说,这个阶段可以称为直接问题的解决方案:即考虑伽马射线从给定空间源穿过不同密度物质的问题。解决这类问题主要有两种方法。
第一种方法基于求解描述伽马射线在物质中传播的输运方程,以及计算伽马射线通过准直器探测器系统时的几何近似值。然而,这种方法需要额外的特殊“噪声”程序,以考虑到数据的泊松特性。
第二种方法是以蒙特卡洛方法为基础的统计方法。这种方法意味着在描述物理过程的各种分布的统计建模方法中使用随机(伪随机)数发生器。例如,这些分布包括Poisson分布(放射性衰变、自由路径长度)、Klein-Nishina-Tamm分布(散射光子的角度分布)和Gaussian分布(探测系统的各种波动)。
原始数据采集建模分几个阶段进行:
- 伽玛源发射伽玛量子;
- 辐射在物质中的传输;
- 探测器响应的形成。
在源发射伽马射线的模拟阶段,根据给定的分布,伽马射线的坐标、方向、能量等变化特征产生。在模拟99mTc-MIBI辐射源时,粒子发射方向的分布被假定为在整个实体角上均匀分布,能量分布由一个值等于140.5keV的delta函数给出。伽马射线发射坐标的分布由“活动图”给出。
通过物质进行辐射传输的建模阶段是最耗时的。必须准确地选择物理过程的描述模型,并在算法上准确地实现它们。在这项研究中,我们使用了自己开发的软件,该软件采用了几种成熟的算法来模拟伽马量子传播及其与物质相互作用的影响。
伽马量子与物质相互作用的截面数据库采用了NIST XCOM数据库[13]。伽马量子穿过物质时的三种主要相互作用被考虑在内:光效应、康普顿效应和相干散射。康普顿效应和相干散射的散射角指示用Geant4模拟 包(Geant4 Collaboration)[14]中的低能电磁模型“Livermore”中描述的算法进行了模拟。伽马射线的传播是通过几种算法的组合来实现的。如果此时伽马射线量子所在的体积是不均匀的(即体素或参数定义),则采用最大横截面 法(Woodcock Tracking)生成自由路径长 度[15]。在均匀体积的情况下,自由路径长度根据指数衰减校正定律生成。这些方法输出的自由路径长度与粒子离开该体积或进入另一体积前的路径长度进行比较,后者是通过寻找光束与几何图形交叉点的算法计算得出。
本项研究计算了伽马量子通过Low Energy High Resolution(LEHR)的情况。通过与相应的临床数据进行比较,验证了投影数据的计算方法。图4显示了蒙特卡罗生成的原始数据:左前 斜(a)、额斜(b)、右前斜(c)和左外 侧(d)投影。计算投影时考虑了虚拟病人的99mTc-MIBI积累图和衰减校正图(见图3)。为便于比较,图中显示了患者在国家心脏医学研究中心设备上通过PhilipsBrightView XCT进行SPECT/CT检查时获得的类似临床投影。这些投影上的左心室心肌图像非常一致。
图4。病人检查时在临床条件下获得的投影(上图)与使用虚拟病人的三维活动图通过蒙特卡罗法计算得出的投影(下图)的对比:a——左前斜投影;b——额部投影;c——右前斜投影;d——左外侧投影。临床数据是在俄罗斯联邦卫生部联邦国家预算机构“以院士E.I.Chazov的国家心脏医学研究中心”的Philips BrightView XCT设备上通过单光子发射计算机断层成像检查病人时获得。
图像重建算法程序
在现代商用SPECT/CT系统中,图像重建问题是通过基于Maximum Likelihood Expectation Maximization(MLEM)统计方法[16]及其加速版本Ordered Subsets Expectation Maximization(OSEM)的算法来解决的:
(1)
其中:
- 和,在迭代过程的第(n+1)-步和第n步中第j个象素的活动值(脉冲/象素);
- gi,检测器第i个像素上记录的脉冲数;
- aij 是一个系统矩阵,描述了在累积图的第j个象素中发射的光子在探测器的第i个象素中记录的概率。
第一步,假定分布是均匀的。
使用自行开发的软件“图像重建算法”计算了一个系统矩阵,这个系统矩阵考虑了伽马辐射通过生物组织和准直器-探测器系统时产生的物理效应。重建图像的质量取决于系统矩阵计算的准确性。系统矩阵的元素用以下形式表示:
(2)
其中:
- 确定在活动图的第j体素中发射的光子穿过虚拟患者的生物组织并到达准直器表面的第k像素的概率。换句话说,这个变量描述了伽马射线在生物组织中散射造成的衰减校正效应。在英文文献中,这种效应用Attenuation Correction(AC)术语来描述;
- 决定光子通过准直器并在探测器k像素中记录为脉冲的概率。换句话说,这个变量描述了通过准直器和探测器晶体的效果,考虑了点扩散函数。在英文文献中,这种效应用Resolution Recovery(RR)术语来描述。
图5显示了躯干数学模型模体99mTc-MIBI积累图的部分片段,以及OSEM算法利用虚拟断层扫描程序(见图4)计算的数据重建的结果。为便于比较,我们提供了一张类似的临床图像。该图像是在Chazov院士国家心脏病学医学研究中心检查真实患者的心肌灌注时使用Astonish算法获得的。
图5。99mTc-MIBI放射性药物在胸部器官中的分布:a——模型;b——重建;c——临床病例。临床病例是患者在俄罗斯联邦卫生部联邦国家预算机构“以E.I.Chazov院士命名的国家心脏医学研究中心”接受单光子发射计算机断层成像检查时获得。
极坐标图程序
由于现有商业极坐标图软件包的封闭形式,无法改变其参数,因此许多研究小组在研究中使用自己开发的软件[17-20]。最早的极坐标图生成程序之一是比利时鲁汶天主教大学(Catholic University of Leuven)为计算机模拟研究而开发的[17],并在后来A.Turco等人的研究中使用。
日本金泽大学的一个研究小组提出了三种标准软件包的替代方案[18]。他们在研究中注意到,使用不同的软件包(4D-MSPECT、ECTb、QPS)对同一患者的诊断结果是不同的,因此开发了自己的开源软件产品,以进一步规范研究。在俄罗斯,由圣彼得堡的E.Kotina领导的研究小组开发了极坐标图[19]。
图6显示了Chazov院士国家心脏病学医学研究中心放射科使用QPS软件包获得的临床图像示例。第一列(左边)显示的是压力测试(stress)后的切片模式图像,第二列显示的是静息(rest)时的相同研究。在断层切片模式下,数据以三个截面显示:垂直长轴(Vertical Long Axis,VLA)、水平长轴(Horizontal Long Axis,HLA)和短轴(Short Axis,SAX)。第三列显示百分比模式下的极坐标图(从上到下依次为负荷图、静息图和差图)。第四栏显示左心室的三维图像。
图6。单光子发射计算机断层成像心肌灌注临床检查结果图示。图像是在俄罗斯联邦卫生部联邦国家预算机 构“以E.I.Chazov院士命名的国家心脏医学研究中心”对患者进行检查时使用QPS软件包获得的。
这项研究开发了一种接近商业QPS方案的极坐标图制作方法。对左心室图像进行手动分割、确定主轴及其旋转。为了消除与划线相关的潜在误差,本研究使用了由模型定义的心外膜和心内膜表面。如图7所示,左心室图像被转移到一个单独的文件中,并沿长轴分成若干层。下一步是收集各层的累积活动值(脉冲/象素)。累积活动的分布与心肌灌注水平成正比,以圆形轮廓的形式在各层依次提取。数据采集可以用两个嵌套循环来表示:第一个循环从左心室顶部(基底部分)到底部(心尖部分)逐层下降,而第二个循环则收集横截面每个区域的累积活动值数据。计算心肌厚度和切片每个扇区的平均值。正如A.Turco等人的研究[20]中指出,与按心肌厚度最大值计算累积值相比,这种计算累积活动的方法提高了准确性。这种计算累积活动的方法比按心肌厚度的最大值计算累积值更精确。每个切片分为多少个区段是自动计算的,取决于左心室的形状和大小。如图7所示,每个切面的累积活动值通过同心圆环投影到极坐标图上,这样左心室基底部分对应外环,心尖部分对应内环。
图7。左心室模型垂直长轴(VLA,左侧)的横截面被分为短轴(SAX)层,每个横截面的累积活动值被同心环投射到极坐标图上,左心室基底部分对应外环,心尖部分对应内环(箭头表示每层投射到极坐标图上的位置)。
“虚拟”研究
计算机软件测试的方法
通过SPECT/CT使用99mTc-MIBI进行心肌灌注研究的所有连续阶段,从放射性药物在患者器官中的分布到极坐标图上的灌注评估,均在计算机模拟中进行计算。首先,“虚拟病人”程序使用躯干数学模型解剖模型计算放射性药物分布。虚拟病人扫描过程的模拟是由“虚拟断层扫描仪”程序使用蒙特卡罗方法进行的。数据采集参数近似于临床参数,并根据欧洲核医学协会(EANM)协议[21]确定。伽马相机的转弧度为180度,从左斜后投影到右斜前投影。数据记录以圆形轨道逐步进行模拟。投影次数(n=32)和每个视图的曝光时间(15秒)均按照 Philips BrightView XCT的标准临床方案进行。蒙特卡罗模拟在每个角度记录了约100000个脉冲(counts)。原始数据记录时间内记录的脉冲总数为400万个。根据标准OSEM算法(8subsets,2iterations)计算出的投影数据用于图像重建。然后,使用极坐标图程序,以切片和极坐标图的形式表示左心室三维图像,并计算心肌灌注的半定量评估。通过将重建的左心室心肌图像的极坐标图与参考极坐标 图(具有已知预定放射性药物分布的虚拟患者)进行比较,分析了单光子发射计算机断层成像方法的准确性评估。
研究的问题
在模拟计算机软件测试中,根据极坐标图归一化的方法以及重建算法中校正因素的考虑,研究了评估心肌灌注的准确性。
心肌灌注评估对极坐标图归一化方法的依赖性对放射性药物分布均匀性的评估是在对重建的左心室图像进行制图的基础上进行的,制图形式为标准极坐标图,共有17个片段。在临床研究中,对左心室心肌灌注状态的总和静息评分(SRS)、总应激评分(SSS)和总和差异评分(SDS)等指标进行了评估。在数学建模中,假定放射性药物分布与静息模式相对应。在本研究中,计算百分比模式下的局部相对灌注值(归一化)和总静息评分分数时采用了文献中描述的以下三种方法:
A.估算Smax
这种方法最为普遍,是4D-MSPEC[2]、ECTb[3]和QPS[4]程序计算极坐标图的基础。在极坐标图上,活动值最大的像素被选中并赋值100%。其他像素则根据其与最大值的比例分配相应的百分比值。然后确定每个区段的平均累积值(百分比)及其总和Smax(即总和静息评分指标)。
B.估算S90
为尽量减少假“热点”的影响,Cedar-Sinai AutoQUANT QPS/QGS v.7.2软件包用户手册建议对极坐标图进行归一化处理,使第90百分位数等于100%。然后计算每个扇区的平均累积值(百分比)及其总和S90。
C.估算Snorm
在最近的一份出版物(2019 年)中,E.V.Garcia等人[22]介绍了商业程序4D-MSPEC[2]、ECTb[3]和Q PS[4](2007年)作者对极坐标图分布归提出一化的建议:使用的100%值不是最大强度值,而是“左心室内最正常区域的灌注强度”。所有高于和等于正常强度的像素值都等同于100%,其余的按比例计算。计算每个扇形的平均累积值及其总和Snorm。K.Okuda和等人[18]的研究还建议根据心肌正常区域的平均强度值进行归一化。同时在正常区域下,假设根据完整数据样本计算具有第80(±10)百分位强度值的像素群。
在所有三种方法中,极坐标图的每个区域都以百分比模式表示的放射性药物累积平均值计算了。灌注量根据表3中的阈值进行评估,表3是一个标准模板。根据获得的累积百分比值,每个区域被分配一个从0到4的分数,然后将这些分数相加。因此,结果就是总分(类似于总和静息评分)。
表3。左心室心肌灌注评估
病变的严重程度 | 分数 | 区段灌注量(相对于最大值) |
定额 | 0 | ≥70% |
初始灌注障碍 | 1 | 50–69% |
中度灌注障碍 | 2 | 30–49% |
严重灌注障碍 | 3 | 10–29% |
缺乏灌注 | 4 | <10% |
心肌灌注估算与图像重建算法中校正因子的关系
在俄罗斯和世界范围内,有大量没有 计算机断层扫描辅助的单光子发射计算机断层成像设备在运行。在计算机模拟试验中,对重建算法中考虑和不考虑衰减校正的心肌灌注评估进行了对比分析。在用衰减校正(AC)重建图像时,公式(2)中的值是根据衰减校正图为每个零体素单独计算的。
在不考虑衰减校正(non-AC)的计算机建模中,=1。对于重建的左心室心肌图像,分别创建极性衰减校正图和非衰减校正图。
EANM手册[21]指出,将点源图像的“分辨率恢复”效果(Resolution Recovery,RR)纳入重建算法的问题需要进行全面的模型研究。本文在计算机模拟测试中对有分辨率恢复(RR)和非分辨率恢复(non-RR)重建模式下获得的极图进行了对比分析。
结果
研究对象
两名虚拟患者参加了计算机模拟测试:一名患者心脏健康,另一名患者左心室心肌前外侧区域有缺血性病变。对于这些病例,虚拟病人程序根据躯干数学模型设置了适当的99mTc-MIBI积累图或活动图。
在第一个病例研究中,使用在左心室心肌中均匀分布99mTc-MIBI活性的躯干数学模型作为虚拟病人。该模型的参考极坐标图如图8所示。它是均匀的,与归一化方法无关。在每个区域,放射性药物累积的相对值均为100%,参考总和静息评分灌注分数(Sref)为0。
图8。一位心肌健康(正常)的虚拟患者的左心室心肌灌注参考极坐标图。SRS(总和静息评分)值: 。
在第二个病例研究中,研究对象是一名左心室心肌缺血病变的虚拟患者。在数学躯干数学模型的99mTc-MIBI积累图中,添加了左心室前外侧区域的缺损,其形式为放射性药物积累值降低的病灶。根据上述归一化方法绘制的参考极坐标图(A、B和C)见图12。这些极坐标图的总和静息评分灌注估算值各不相同,但差别很小:
计算机测试的总体方案如下。对虚拟患者进行模拟扫描后,使用OSEM算法(含或不含校正因子)进行图像重建。在重建图像上对左心室进行分割,并根据A、B和C方法创建三种极坐标图。
主要研究成果
病例1:左心室心肌健康的虚拟患者
该病例的参考极坐标图如图8所示,参考总和静息评分估计值:Sref=0。图9显示的是考虑了衰减校正和分辨率恢复(AC/RR)后重建得到的极坐标图。极坐标图根据方法 A、B和C进行了归一化处理。由于重建误差,活动分布看起来不再均匀。在所有三幅图中,顶端区域的活动都明显减少。这种伪影被称为假性心肌尖缺损,经常出现在临床衰减校正图像上。不同归一化方法计算的总和静息评分灌注估计值如下:Smax=10,S90=1,Snorm=3。在这种情况下,S90和Snorm的估计值在正常范围内,Smax值被高估,对灌注状态的估计不正确。Smax计算值被高估也与临床经验相符。临床c上安装的软件使用强度最大的像素对极坐标图进行归一化处理,正如A.A.Ansheles的研究[1]所指出的,衰减校正图像的问题之一是,由于不明原因,它们的分数总和(SSS、SRS)可能被明显高估。
图9。AC/RR。重建左心室心肌灌注图像的极坐标图。用衰减校正(AC)和分辨率恢复(RR)进行重建。三种极坐标图计算方法的总和静息评分(SRS)值: а — Smax=10; b — S90=1; c — Snorm=3。
图10显示了使用OSEM算法进行图像重建时获得的极坐标图,该算法未考虑衰减校正,但考虑了分辨率恢复(non-AC/ RR)。这些图像在极坐标图的下部显示出活动减弱的伪影。这种伪影是non-AC下临床图像的典型特征。值得注意的是,假性心尖缺损消失了,这在临床实践中通常是在non-AC图像上观察到的。SRS灌注评分的得出的汇总值如下:Smax=17,S90=9,Snorm=4。这比参考值(Sref=0)高出很多。显然,non-AC图像需要不同的模板,以相同的模式获取。
图10。Non-AC/RR。重建左心室的极坐标图。重建时未进行衰减校正(non-AC),但进行了分辨率恢复(RR)。 总和静息评分(SRS)值:а — Smax=17; b — S90=9; c — Snorm=4。
图11显示了OSEM算法在考虑衰减校正但不考虑分辨率恢复(AC/non-RR)的情况下重建图像后得到的极坐标图。SRS灌注估计值的汇总值如下:Smax=9、S90=3、Snorm=4。图9中的AC/RR图像和图11中的AC/non-RR图像看起来相似,但AC/RR模式下的SRS评分估计值更为准确。
图11。AC/non-RR。重建的左心室心肌灌注图像的极坐标图。重建时进行了衰减校正(AC),但未考虑非分辨率恢复(non-RR)。 a — Smax=9; b — S90=3; c — Snorm=4。
病例2:左心室心肌缺血性损伤的虚拟患者
该病例的参考极坐标图见图12,三种极坐标图归一化方法的参考SRS估计值差别不大,均为 图13显示了为一名缺血性病变虚拟患者的AC/RR图像计算的极坐标图。SRS估计值:Smax=12,S90=6,Snorm=6。
图12。缺血性病变左心室灌注参考极值图。总和静息评分(SRS)值:a — Smax=6; b — S90=5; c — Snorm=6。
图13中对AC/RR图像进行极坐标图归一化的三种变体重建的缺损与图12中参考极坐标图中的图像相对应,但右心室一侧出现了一个伪影,看起来像是真实缺损的镜像。
图13。衰减校正/模糊显象。重建的左心室心肌灌注图像的极坐标图。用衰减校正校正(AC)和模糊显象(RR)进行重建。总和静息评分(SRS)得分:a — Smax=12; b — S90=6; c — Snorm=6。
图14显示了通过non-AC/RR重建获得的极坐标图。可以看出,与图12中的参考极坐标图相比,缺损的尺寸较小。右下侧出现了一个假缺损,而顶端缺损则不存在。图15显示的是在AC/non-RR模式下进行重建时获得的极坐标图,其中包含衰减校正,但未考虑分辨率恢复。缺陷边界与AC/RR的缺陷边界大致对应。不同极坐标图构建技术的SRS估计总值如下:Smax=21,S90=10,Snorm=6。
图14。Non-AC/RR。重建左心室灌注图像的极坐标图。重建时未进行衰减校正(non-AC),但考虑了分辨率恢 复(RR)。总和静息评分(SRS): a — Smax=23; b — S90=7; c — Snorm=2。
图15。AC/non-RR。重建左心室的极坐标图。重建时进行了衰减校正,但未考虑分辨率恢复。总和静息评 分(SRS)得分:a — Smax=21; b — S90=10; c — Snorm=6。
讨论
主要研究成果概述
虚拟试验结果显示完全符合临床数据。虚拟患者左心室图像重建的极坐标图显示出与真实患者临床图像相同的误差(伪影)。这些结果证实,所开发的“核心脏病学SPECT/CT方法模拟测试虚拟平台”软件包适用于研究核心脏病学问题。在AC/RR模式下进行重建,并根据心肌正常区域活动的平均值对极坐标图进行归一化,获得了最接近精确值的灌注和缺血灶估计值。
对研究主要成果的讨论
SPECT/CT的左心室心肌灌注图像可视化是利用泊松数据解决图像重建的反不正确问题的结果。用随机数据求解不适定问题的理论属于数学的一个年轻领域,目前仍在发展之中,因此复杂的现代重建算法“无法创造奇迹”[21],所获得的解决方案也存在误差(伪影)。在近似临床条件的模拟数学建模中,获得了在临床图像中观察到的相同伪影。
在AC模式下使用OSEM算法重建时,所有极坐标图上都会出现假性心尖缺损,这在临床实践中是众所周知的。根据A.A.Anscheles的研究[1],大约50%的临床病例在衰减校正校正重建中会出现这种伪影,而且很少被视为可靠的缺陷。在实践中,假性根尖缺损和根尖区小灶性病变之间的鉴别诊断可能很困难。在我们对一名心肌缺血病变的虚拟患者进行的模拟研究中,病灶病变部分叠加在假性心尖缺损区域上(图13),导致高估了缺损的严重程度。
Non-AC图像(图10和图14)显示出极坐标图下部强度降低的假象。同时,假性心尖缺损消失。这种表现是在non-AC模式下获得的临床极坐标图的典型特征。对一个缺血性左心室心肌病变病例的模拟数学模型所获得的极坐标图进行对比直观分析表明,在AC/RR模式下观察到的病变大小最接近参考值。在non-AC/RR重建中,病变面积明显缩小,这与临床观察结果相符。A.A.Ansheles的研究[23]指出,“在SRS研究中,总和静息评分和瞬时缺血面积值明显大于non-AC研究”。
模拟建模方法的优点是可以比较极坐标图每个扇区的半定量估计值,以及重建图像的SRS总参数与模板(即模型极坐标图)的比较。对比分析表明,在我们的数值实验中,左心室下壁显示了错误的活性升高值,这可能是由于肝脏的影响(这里我们指的是一种对医生来说隐藏的效应,与肝脏发射的伽马量子散射到左心室下壁有关)。这些散射光子的一部分正好进入左心室图像的探测器,可能会造成误差)。
在这种情况下,按最大像素归一化会导致出现低灌注区域。与参考极坐标图相比,SRS总估计值会增加。通过对正常区域的活动进行平均归一化,可获得最佳估计值。这一结果符合标准商业极地制图软件包作者发布的新建议[22]。
由于重建算法的局限性,在健康患者的图像中也会出现伪影。这就是为什么现代的 SPECT/CT在重建左心室极坐标图上使用相对估计值的同时,也使用与标准基础比较的相对估计值,从而能够准确地识别灌注缺陷。这些研究结果表明,与重建左心室极坐标图上的相对估计值相比,比较相对估计值更值得信赖。然而,这种方法有很大的局限性:临床图像的所有采集的条件都必须与创建标准基础的条件一致。
结论
本文所取得的结果有力地证明,计算机模拟建模是辅助临床方法了解心肌灌注研究的局限性、不确定性和误差的实用工具。从心肌活性累积的相对归一化值过渡到绝对定量估计值,可以消除现有的局限性和不确定性,是提高核心脏病学中SPECT/CT方法诊断准确性的主要条件。
ADDITIONAL INFORMATION
Funding source. This study was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
N.V. Denisova — development of the concept and planning of scientific work, drafting the manuscript, final approval of the published version of the manuscript, development of the “Virtual Patient” and “Reconstruction Algorithms” programs; M.A. Gurko — development of the “Virtual Tomograph” program, participation in writing and editing the manuscript; I.P. Kolinko — development of the “Polar map” program; A.A. Ansheles, V.B. Sergienko — clinical data, analysis of scientific papers, critical revision with the introduction of valuable intellectual content.
作者简介
Natalya V. Denisova
Novosibirsk State University; Khristianovich Institute of Theoretical and Applied Mechanics
编辑信件的主要联系方式.
Email: NVDenisova2011@mail.ru
ORCID iD: 0000-0001-9374-1753
SPIN 代码: 4928-8185
Dr. Sci. (Phys.-Math.), Professor
俄罗斯联邦, Novosibirsk; NovosibirskMikhail A. Gurko
Novosibirsk State University; Khristianovich Institute of Theoretical and Applied Mechanics
Email: m.gurko@g.nsu.ru
ORCID iD: 0000-0002-6154-172X
SPIN 代码: 3214-5765
俄罗斯联邦, Novosibirsk; Novosibirsk
Inna P. Kolinko
Novosibirsk State University; Khristianovich Institute of Theoretical and Applied Mechanics
Email: kiina131313@gmail.com
ORCID iD: 0009-0001-6779-1535
SPIN 代码: 1625-6043
俄罗斯联邦, Novosibirsk; Novosibirsk
Alexey A. Ansheles
National Medical Research Centre of Cardiology Named After Academician E.I. Chazov
Email: aansheles@gmail.com
ORCID iD: 0000-0002-2675-3276
SPIN 代码: 7781-6310
MD, Dr. Sci. (Med.), Assistant Professor
俄罗斯联邦, MoscowVladimir B. Sergienko
National Medical Research Centre of Cardiology Named After Academician E.I. Chazov
Email: vbsergienko@yandex.ru
ORCID iD: 0000-0002-0487-6902
SPIN 代码: 4918-3443
MD, Dr. Sci. (Med.), Professor
俄罗斯联邦, Moscow参考
- Ansheles AA, Sergienko VB. Yadernaya Kardiologiya. Sergienko VB, editor. Moscow: FGBU «NMITs kardiologii» Minzdrava Rossii; 2021. (In Russ).
- Ficaro E, Lee B, Kritzman J, Corbett J. Corridor4DM: The Michigan method for quantitative nuclear cardiology. Journal of Nuclear Cardiology. 2007;14(4):455–465. doi: 10.1016/j.nuclcard.2007.06.006
- Garcia E, Faber T, Cooke C, et al. The increasing role of quantification in clinical nuclear cardiology: The Emory approach. Journal of Nuclear Cardiology. 2007;14(4):420–432. doi: 10.1016/j.nuclcard.2007.06.009
- Germano G, Kavanagh P, Slomka P, et al. Quantitation in gated perfusion SPECT imaging: The Cedars-Sinai approach. Journal of Nuclear Cardiology. 2007;14(4):433–454. doi: 10.1016/j.nuclcard.2007.06.008
- Wolak A. Quantitative myocardial-perfusion SPECT: Comparison of three state-of-the-art software packages. Journal of Nuclear Cardiology. 2008;15(1):27–34. doi: 10.1016/j.nuclcard.2007.09.020
- Germano G. Quantitative measurements of myocardial perfusion and function from SPECT (and PET) studies depend on the method used to perform those measurements. Journal of Nuclear Cardiology. 2018;25(3):925–928. doi: 10.1007/s12350-016-0757-z
- Abadi E, Segars WP, Tsui BMW, et al. Virtual clinical trials in medical imaging: a review. Journal of Medical Imaging. 2020;7(4):1. doi: 10.1117/1.JMI.7.4.042805
- Denisova NV, Ansheles AA. A study of false apical defects in myocardial perfusion imaging with SPECT/CT. Biomedical Physics & Engineering Express. 2018;4(6):065018. doi: 10.1088/2057-1976/aae414
- Denisova N, Ondar M, Kertesz H, Beyer T. Development of anthropomorphic mathematical phantoms for simulations of clinical cases in diagnostic nuclear medicine. Computer Methods in Biomechanics and Biomedical Engineering: Imaging & Visualization. 2023;11(3):433–441. doi: 10.1080/21681163.2022.2074308
- Denisova NV. Computational Phantoms for Medical Radiology. Medical Radiology and Radiation Safety. 2022;67(6):51–61. doi: 10.33266/1024-6177-2022-67-6-51-61
- Sinel’nikov RD, Sinel’nikov AYa, Sinel’nikov YaR. Atlas Anatomii Cheloveka. 2nd Volume. Moscow: Novaya volna; 2022. (In Russ).
- Patton JA, Turkington TG. SPECT/CT Physical Principles and Attenuation Correction. Journal of Nuclear Medicine Technology. 2008;36(1):1–10. doi: 10.2967/jnmt.107.046839
- Seltzer S. XCOM-Photon Cross Sections Database [Internet]. Gaithersburg (MD): NIST Standard Reference Database 8. [cited 2023 Oct 10]. Available from: https://www.nist.gov/pml/xcom-photon-cross-sections-database doi: 10.18434/T48G6X
- Ivanchenko VN, Incerti S, Allison J, et al. Geant4 electromagnetic physics: improving simulation performance and accuracy. In: Caruge D, Calvin C, Diop CM, Malvagi F, Trama JC, editorss. SNA + MC 2013 — Joint International Conference on Supercomputing in Nuclear Applications + Monte Carlo. doi: 10.1051/snamc/201403101
- Behlouli A, Visvikis D, Bert J. Improved Woodcock tracking on Monte Carlo simulations for medical applications. Physics in Medicine & Biology. 2018;63(22):225005. doi: 10.1088/1361-6560/aae937
- Shepp LA, Vardi Y. Maximum Likelihood Reconstruction for Emission Tomography. IEEE Transactions on Medical Imaging. 1982;1(2):113–122. doi: 10.1109/TMI.1982.4307558
- Nuyts J, Mortelmans L, Suetens P, Oosterlinck A, de Rou M. Model-based quantification of myocardial perfusion images from SPECT. Journal of nuclear medicine. 1989;30(12):1992–2001.
- Okuda K, Nakajima K, Hosoya T, et al. Quantification of myocardial perfusion SPECT using freeware package (cardioBull). Annals of Nuclear Medicine. 2011;25(8):571–579. doi: 10.1007/s12149-011-0504-0
- Ploskikh V, Kotina E. Challenges of gated myocardial perfusion SPECT processing. Cybernetics and Physics. 2021;10(3):171–177. doi: 10.35470/2226-4116-2021-10-3-171-177
- Turco A, Nuyts J, Gheysens O, et al. Lesion quantification and detection in myocardial 18F-FDG PET using edge-preserving priors and anatomical information from CT and MRI: a simulation study. EJNMMI Physics. 2016;3(1):9. doi: 10.1186/s40658-016-0145-4
- Verberne HJ, Acampa W, Anagnostopoulos C, et al. EANM procedural guidelines for radionuclide myocardial perfusion imaging with SPECT and SPECT/CT: 2015 revision. European Journal of Nuclear Medicine and Molecular Imaging. 2015;42(12):1929–1940. doi: 10.1007/s00259-015-3139-x
- Garcia EV, Slomka P, Moody JB, Germano G, Ficaro EP. Quantitative Clinical Nuclear Cardiology, Part 1: Established Applications. Journal of Nuclear Medicine. 2019;60(11):1507–1516. doi: 10.2967/jnumed.119.229799
- Ansheles AA. Specific features of interpretation of myocardial perfusion single-photon emission computed tomography with computed tomographic absorption correction. Journal of Radiology and Nuclear Medicine (Vestnik rentgenologii i radiologii). 2014;(2):5–20. (In Russ). doi: 10.20862/0042-4676-2014-0-2-5-20
补充文件