A case of spontaneous liver rupture and the role of imaging: from computed tomography to interventional treatment
- Authors: Montatore M.1, Masino F.1, Muscatella G.1, Gifuni R.1, Tupputi R.2, Quinto F.3, Guglielmi G.1,2,4
-
Affiliations:
- Foggia University School of Medicine
- Dimiccoli Hospital
- L. Bonomo Hospital
- IRCCS Casa Sollievo della Sofferenza Hospital
- Issue: Vol 5, No 3 (2024)
- Pages: 632-641
- Section: Case reports
- Submitted: 15.11.2023
- Accepted: 18.04.2024
- Published: 04.12.2024
- URL: https://jdigitaldiagnostics.com/DD/article/view/623377
- DOI: https://doi.org/10.17816/DD623377
- ID: 623377
Cite item
Full Text
Abstract
Hepatic parenchymal rupture is a rare but potentially fatal condition that can be caused by trauma, iatrogenic factors, spontaneous causes, etc. This case report describes the diagnostic and therapeutic steps employed in a patient with spontaneous hepatic parenchymal rupture. An older woman came to the emergency department with diffuse stomach pain. After clinical evaluation, she underwent computed tomography. The first computed tomography did not reveal a full-blown parenchymal rupture. Owing to data ambiguity, indicating that the abdominal discomfort could be caused by renal or biliary colic, obtaining an early diagnosis was very difficult. In truth, only few hypodense oval shapes with characteristic suprafluid densitometry were found in the liver parenchyma. However, after a few days, the discomfort persisted, and as the condition worsened, the patient underwent additional radiological examinations, which revealed the rupture of the liver parenchyma that required arteriography, and a long hospital stay until clinical resolution.
Keywords
Full Text
АКТУАЛЬНОСТЬ
Разрыв паренхимы печени — нечастое, но потенциально серьёзное повреждение, которое может быть обусловлено различными причинами, включая тупую или проникающую травму живота, ятрогенные причины, неустановленные причины, не упомянутые пациентом (спонтанные), и другие редкие, но серьёзные нарушения (цирроз печени, гемолиз, повышение уровня печёночных ферментов и тромбоцитопения, ревматическая болезнь, амилоидоз и послеродовой период) [1–7].
В острых ситуациях диагностика разрыва паренхимы печени может быть затруднена, однако она имеет решающее значение для эффективного выявления и оптимальных сроков разрешения состояния.
В данной статье описан случай пожилой пациентки, у которой возникла острая боль в животе, первоначально идентифицированная как желчная или почечная колика. Однако результаты компьютерной томографии (КТ) показали, что у пациентки произошел разрыв паренхимы печени и образовалась обширная интракапсулярная гематома.
ОПИСАНИЕ СЛУЧАЯ
Анамнез
Пациентка 86 лет поступила в отделение неотложной помощи с острой нестерпимой болью в животе. Из-за сильной боли у пациентки было нарушено сознание (9 баллов по шкале комы Глазго). После быстрого клинического обследования, несмотря на «острый» живот, была локализована периодическая интенсивная боль от эпигастрия до правого подреберья. В связи с этим у врачей возникло подозрение на желчную или почечную колику. По результатам ультразвукового исследования (УЗИ) подозрение на почечную колику исключили, но выявили вероятную связь боли с печенью.
Диагностическая оценка и дифференциальная диагностика
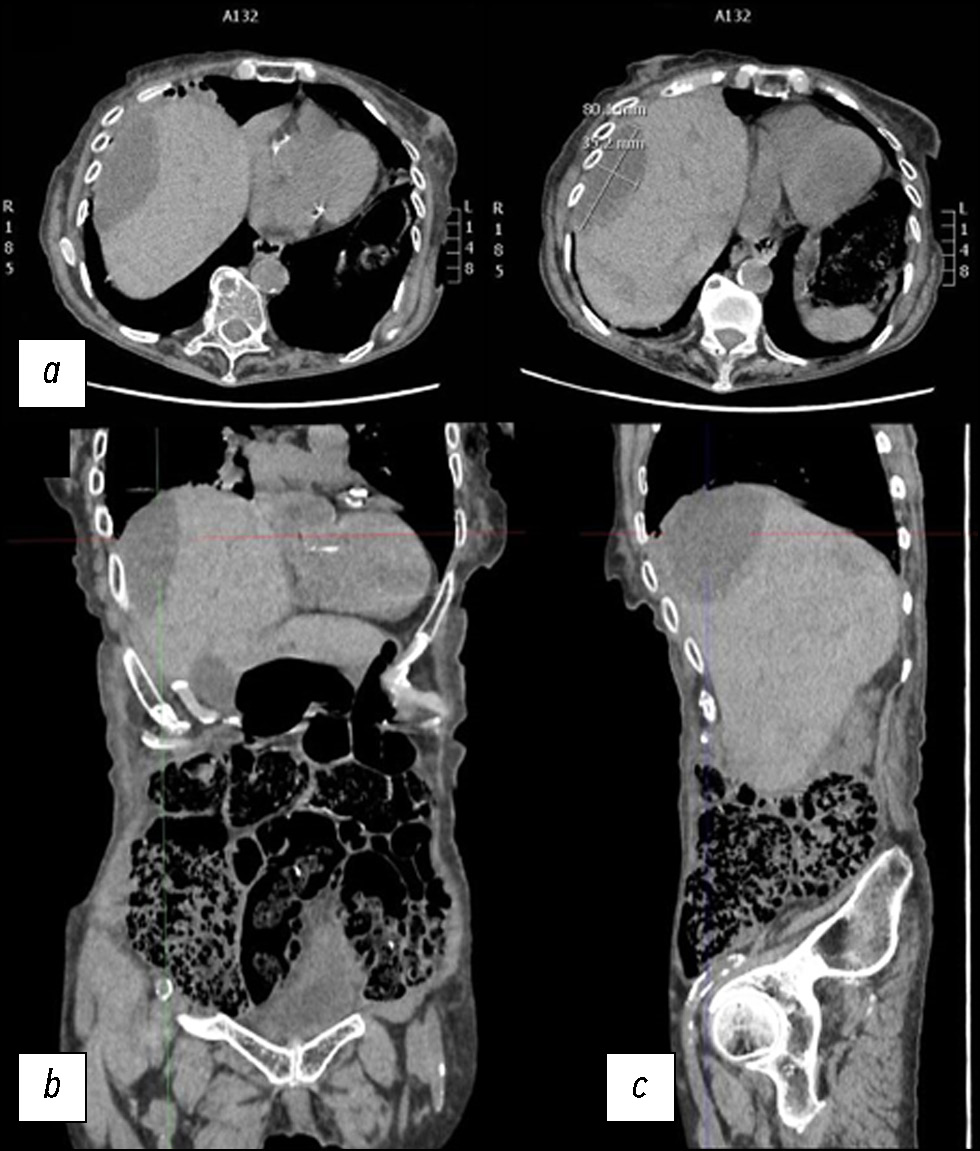
По данным УЗИ, паренхима печени была относительно неоднородной, с гипоэхогенными участками, некоторые из которых имели овальную форму. Учитывая эти данные, потребовалась КТ. Первую КТ выполняли без контрастирования, согласно требованиям отделения неотложной помощи. Кроме того, у пациентки были очень высокие показатели креатинина, что объяснялось её возрастом. По результатам первой КТ выявили несколько гиподенсных овальных участков в печени со специфическим ослаблением сигнала от жидкости (рис. 1).
Рис. 1. Снимки компьютерной томографии без контрастного усиления: a — аксиальная плоскость; b — корональная плоскость; c — сагиттальная плоскость.
На снимках в аксиальной плоскости сверху (справа, с указанием размеров), в корональной и сагиттальной плоскостях наблюдались неоднородное ослабление сигнала и увеличение печени с гиподенсными овальными образованиями и жидкостью повышенной плотности (25–30 единиц по шкале Хаунсфилда) в субкапсулярной области, самое большое из которых соответствовало VII сегменту печени и имело передне-заднюю ширину 8 см и максимальную толщину 35 мм. В брюшной полости наблюдался сопутствующий выпот.
Пациентку госпитализировали, поместили под наблюдение, её состояние стабилизировали с помощью анальгетических лекарственных препаратов для купирования боли, однако жалобы сохранялись. Нефролог назначил подготовительную терапию к следующей плановой КТ, чтобы избежать острого повреждения почек, вызванного контрастирующим веществом.
Через несколько дней была проведена повторная КТ с контрастным усилением, по результатам которой выявили разрыв паренхимы печени в VII сегменте на уровне ворот печени. Повреждение сопровождалось обширной интракапсулярной гиподенсной сферической зоной, интрапаренхиматозной гематомой толщиной до 5 см и диффузной субкапсулярной гематомой, занимающей 40–50% площади поверхности (II–III степени по шкале повреждений печени Американской ассоциации хирургии травм [The American Association for the Surgery of Trauma, AAST]). На КТ-снимках выявили умеренный объём гемоперитонеума, вероятно, из печени (рис. 2).
Рис. 2. Снимки компьютерной томографии с контрастным усилением в портально-венозной фазе: a — аксиальная плоскость; b — корональная плоскость; c — сагиттальная плоскость.
На снимках в аксиальной, корональной и сагиттальной плоскостях по сравнению с предыдущими снимками выявили усугубление разрыва паренхимы печени в VII сегменте на уровне ворот печени с обширной распространённой интракапсулярной гематомой сферической формы с максимальной толщиной около 5 см (обозначена красной звёздочкой) и субкапсулярной гематомой. Кроме того, наблюдалось растяжение мочевого пузыря.
В связи с сохраняющейся болью и ухудшением клинического состояния через несколько часов была проведена третья КТ. На полученном снимке было выявлено распространение выпота в направлении таза вблизи локализованных гиперденсных очагов в печени, особенно на уровне VII сегмента. Это указывало на активную экстравазацию контрастного вещества — опасную и потенциально смертельную ситуацию, которая требовала срочного проведения артериографии (рис. 3).
Рис. 3. Снимки компьютерной томографии с контрастным усилением в артериальной фазе: a, b — аксиальная плоскость; c — корональная плоскость; d — сагиттальная плоскость.
На снимках с контрастным усилением в артериальной фазе на уровне VIII сегмента печени наблюдалось два точечных гиперденсных пятна, расположенных близко друг к другу. Большое пятно было размером около 5 мм (обведено красным цветом на снимках a, c и d и представлено с размерами на снимке b), что объясняется очагами активной экстравазации контрастного вещества.
Вмешательства
Учитывая тяжесть клинического состояния, пациентке сразу после рентгенологических исследований была проведена ангиоэмболизация, а также эмболизация точек незначительных утечек контрастного вещества, затрагивающих VII и VIII сегменты печени. Для их выявления в VII и VIII сегментах печени провели селективную катетеризацию чревного ствола и верхней брыжеечной артерии [8, 9].
Была проведена микрокатетеризация ранее упомянутых печёночных ветвей, и для их эмболизации было введено 2 мл микросфер (BEAD BLOCK диаметром 300–500 мкм) [10, 11] (рис. 4).
Рис. 4. Ангиография печени. a, b — по результатам первой артериографии в паренхиме печени наблюдалось несколько очагов артериального кровотечения, соответствующих VII и VIII сегментам печени; c — контроль после эмболизации с использованием 2 мл частиц на основе поливинилового спирта диаметром 300–500 мкм показал, что очаги кровотечения были полностью эмболизированы при заключительном осмотре.
Последующее наблюдение и исход
После лечения пациентка была госпитализирована более чем на 2 недели для надлежащего лечения и разрешения проявлений сопутствующих заболеваний. На контрольной КТ после ангиографии не выявили признаков активного кровотечения или осложнений выполненных вмешательств, таких как некроз печени, а выявленная ранее интракапсулярная печёночная гематома стабильно оставалась в стадии разрешения. Субкапсулярная гематома также по-прежнему визуализировалась, но была стабильной (рис. 5). Для разрешения состояния потребовалось более длительное пребывание в стационаре.
Рис. 5. Снимки компьютерной томографии с контрастным усилением в артериальной фазе через несколько дней после ангиографии: a, b — аксиальная плоскость; c — корональная плоскость; d — сагиттальная плоскость.
Компьютерную томографию с контрастным усилением в артериальной фазе провели через несколько дней после ангиографии. На контрольном снимке не было рентгенологических признаков, указывающих на активную экстравазацию контрастного вещества в VIII сегменте печени, поскольку в отмеченной красным кругом области в различных плоскостях: аксиальной, корональной и сагиттальной — не было отмечено гиперденсных пятен. Интракапсулярная гематома находилась в стадии разрешения: около 3,5 см, измерено на снимке b и выделено жёлтым цветом, по сравнению с 5 см на предыдущей компьютерной томографии (см. рис. 2).
ОБСУЖДЕНИЕ
Значительная травма живота часто сопровождается разрывом паренхимы печени. Это состояние также может возникнуть после незначительной травмы, особенно у пациентов с уже существующими заболеваниями печени, вследствие ятрогенных причин или, в редких случаях, по неизвестным причинам у взрослых/пожилых пациентов или детей.
Если у пациента в анамнезе есть травма или системное заболевание, которое может вызвать разрыв печени, диагноз можно легко поставить, проследив клиническую связь; однако если у пациента нет травмы в анамнезе, а присутствует только боль в животе неизвестной этиологии, это затрудняет диагностический процесс. Даже если симптомы внешней травмы печени отсутствуют, у пациентов с сильной болью в животе следует подозревать наличие такой травмы, особенно у пожилых пациентов, у которых может быть несколько сопутствующих заболеваний.
Наиболее популярной системой оценки повреждений печени считается шкала повреждений печени AAST, которая была обновлена в 2018 году. По этой шкале оценивают разрыв паренхимы печени в зависимости от наличия субкапсулярной гематомы, интрапаренхиматозной гематомы и разрывов (рис. 6).
Рис. 6. Шкала повреждений печени Американской ассоциации хирургии травм, включающая пять степеней. Эта шкала позволяет оценить степень разрыва паренхимы печени, принимая во внимание наличие субкапсулярной гематомы, затрагивающей различные области (характеризуется наличием скопления эллиптической формы между капсулой и паренхимой, оказывающего давление на паренхиму), интрапаренхиматозной гематомы (от 10 см до внепечёночных повреждений), повреждения сосудов и разрывов.
В данном случае интракапсулярная диффузная гематома (до 5 см) и активное кровотечение в паренхиме печени были связаны с субкапсулярной гематомой (занимающей около 50% площади поверхности), наличием разрыва паренхимы печени (III степени по шкале повреждений печени AAST) и внутрипечёночным кровоизлиянием, вызвавшим гемодинамическую нестабильность. В отсутствие надлежащего лечения все эти состояния могут привести к жизнеугрожающим явлениям, включая гиповолемический шок и смерть. КТ, особенно с контрастным усилением, позволяет выявить разрыв паренхимы печени и активную экстравазацию контрастного вещества из мелкой разорванной артерии. В подобных случаях ангиография с последующей направленной эмболизацией повреждённых печёночных артерий всегда служит эффективным методом остановки кровотечения и лечения поражения [10, 11].
AAST разработала систему классификации повреждений печени, основанную на этих распространённых результатах КТ, с которыми радиологи должны быть знакомы (см. рис. 6).
КТ также позволяет оценить отсроченные последствия разрыва паренхимы при тупой травме печени, такие как отсроченное кровотечение, печёночный или околопечёночный абсцесс, посттравматическая псевдоаневризма, гемобилия и нарушения функции желчевыводящих путей, например, билома и желчный перитонит. У пациентов с повреждениями печени высокой степени тяжести следует проводить повторную КТ для выявления любых потенциальных проблем, требующих неотложной помощи.
В данном случае предполагалось, что диффузная сферическая интракапсулярная гематома на уровне VII сегмента печени, связанная с субкапсулярной гематомой, вызвала местную воспалительную реакцию, приведшую к накоплению жидкости (околопечёночный выпот в брюшной полости). Это состояние, по-видимому, привело к разрыву паренхимы печени. По мнению врачей, оно могло быть вызвано предыдущей травмой, о которой пожилая пациентка не сообщила. Эта клиническая гипотеза получила широкое распространение, особенно когда в анамнезе пациента нет системных заболеваний или каких-либо известных нарушений (цирроз печени, ревматическая болезнь, амилоидоз, гемангиома, злокачественные новообразования и метастазы, абсцесс, гидатидная киста и так далее).
Субкапсулярные и интракапсулярные гематомы возникают вследствие тупой травмы печени и могут привести к серьёзной гемодинамической нестабильности. Если их размеры невелики, можно применить выжидательную тактику [5–7]. Возможно, отсроченная диагностика жизнеугрожающей патологии была связана с переоценкой первоначального результата КТ, однако состояние пациентки не позволило провести КТ с контрастным усилением, поскольку оно могло вызвать острую почечную недостаточность. Тем не менее наличие сосудистых поражений, как в данном случае, и, как следствие, постоянное кровотечение в паренхиме печени указывают на необходимость срочного интервенционного подхода, например артериографии. После эмболизации пациентка находилась под пристальным наблюдением для выявления любых признаков ятрогенных проблем в результате перенесённых вмешательств или персистирующего кровотечения [11].
ЗАКЛЮЧЕНИЕ
Разрыв паренхимы печени, будь то спонтанный или нет, с сопутствующей диффузной интракапсулярной гематомой — нечастая, но потенциально опасная клиническая ситуация. В данном случае точная клиническая причина была неясна. Это могла быть гериатрическая патология (возможно, связанная с приёмом лекарственных препаратов, таких как антикоагулянты), ещё не известное системное или онкологическое заболевание или незначительная травма, о которой пациентка не сообщила при поступлении в отделение неотложной помощи. Однако для снижения риска осложнений кровотечения (гиповолемического шока и смерти) и улучшения клинических исходов крайне важны ранняя диагностика и неотложное лечение. Для точной оценки поражения и планирования лечения необходимо сочетание процедур визуализации, включая УЗИ, КТ с контрастированием, артериографию и сравнение полученных разными методами результатов исследований.
Дополнительная информация
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении работы.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Наибольший вклад распределён следующим образом: M. Montatore, F. Masino, G. Muscatella, R. Gifuni — концепция и дизайн работы; M. Montatore, F. Masino — сбор данных; G. Guglielmi, F. Quinto — анализ и интерпретация данных; M. Montatore, G. Muscatella, F. Masino, G. Guglielmi, R. Tupputi — написание и редактирование текста статьи.
Информированное согласие на публикацию. Авторы получили письменное согласие пациента на публикацию медицинских данных и фотографий в обезличенной форме в журнале Digital Diagnostics.
Благодарности. Авторы выражают особую благодарность G. Masino за вклад в оформление рис. 6, представленного в статье.
ADDITIONAL INFORMATION
Funding source. This article was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
M. Montatore, F. Masino, G. Muscatella, R. Gifuni — work conception and design; M. Montatore, F. Masino — data collection; G. Guglielmi, F. Quinto — analysis and interpretation of data; M. Montatore, G. Muscatella, F. Masino, G. Guglielmi, R. Tupputi — writing and editing the manuscript.
Consent for publication. Written consent was obtained from the patient for publication of relevant medical information and all of accompanying images within the manuscript in Digital Diagnostics Journal.
Acknowledgments. A special acknowledgment to G. Masino, who has contributed to the design of fig. 6 present in the text.
About the authors
Manuela Montatore
Foggia University School of Medicine
Email: manuela.montatore@unifg.it
ORCID iD: 0009-0002-1526-5047
MD
Italy, FoggiaFederica Masino
Foggia University School of Medicine
Email: federicamasino@gmail.com
ORCID iD: 0009-0004-4289-3289
MD
Italy, FoggiaGianmichele Muscatella
Foggia University School of Medicine
Email: muscatella94@gmail.com
ORCID iD: 0009-0004-3535-5802
MD
Italy, FoggiaRossella Gifuni
Foggia University School of Medicine
Email: rossella.gifuni@unifg.it
ORCID iD: 0009-0009-9679-3861
MD
Italy, FoggiaRuggiero Tupputi
Dimiccoli Hospital
Email: rutudott@gmail.com
ORCID iD: 0009-0006-0329-6320
MD
Italy, BarlettaFabio Quinto
L. Bonomo Hospital
Email: fabio.quinto@aslbat.it
ORCID iD: 0000-0001-7730-7711
MD
Italy, AndriaGiuseppe Guglielmi
Foggia University School of Medicine; Dimiccoli Hospital; IRCCS Casa Sollievo della Sofferenza Hospital
Author for correspondence.
Email: giuseppe.guglielmi@unifg.it
ORCID iD: 0000-0002-4325-8330
MD, Professor
Italy, Foggia; Barletta; San Giovanni RotondoReferences
- Fundora W, Fuster-Anglada C, Bassaganyas C, et al. An infrequent cause of spontaneous liver rupture. Journal of hepatology. 2023;78(5):e160–e161. doi: 10.1016/j.jhep.2023.01.012
- Onishi Y, Shimizu H, Oka S, et al. Transcatheter arterial embolization for subcapsular hematoma of the liver. Abdominal radiology. 2023;48(2):765–772. doi: 10.1007/s00261-022-03732-w
- Le ACM, Bohlin T, Grønvold L, et al. Ruptured liver. Tidsskr Nor Laegeforen. 2023;143(8). doi: 10.4045/tidsskr.22.0805
- Sutton BC, Dunn ST, Landrum J, Mielke G. Fatal postpartum spontaneous liver rupture: case report and literature review. Journal of forensic sciences. 2008;53(2):472–475. doi: 10.1111/j.1556-4029.2008.00677.x
- Donati M, Stavrou GA, Donati A, Oldhafer KJ. The risk of spontaneous rupture of liver hemangiomas: a critical review of the literature. Journal of hepato-biliary-pancreatic sciences. 2011;18(6):797–805. doi: 10.1007/s00534-011-0420-7
- Jun CH, Yoon JH, Wi JW, et al. Risk factors and clinical outcomes for spontaneous rupture of pyogenic liver abscess. Journal of digestive diseases. 2015;16(1):31–36. doi: 10.1111/1751-2980.12209
- Seifeddine B, Amel C, Ghofrane T, et al. Spontaneous rupture of hydatid cyst of liver in the peritoneal cavity with intact proligerous membrane: about a case and literature review. The Pan African medical journal. 2018;30:174. doi: 10.11604/pamj.2018.30.174.15054
- Cadili A, Gates J. The Role of Angioembolization in Hepatic Trauma. The American surgeon. 2021;87(11):1793–1801. doi: 10.1177/0003134820973729
- García IC, Villalba JS, Iovino D, et al. Liver Trauma: Until When We Have to Delay Surgery? A Review. Life (Basel). 2022;12(5):694. doi: 10.3390/life12050694
- Segalini E, Morello A, Leati G, et al. Primary angioembolization in liver trauma: major hepatic necrosis as a severe complication of a minimally invasive treatment narrative review. Updates in Surgery. 2022;74(5):1511–1519. doi: 10.1007/s13304-022-01372-9
- Parks RW, Chrysos E, Diamond T. Management of liver trauma. The British journal of surgery. 1999;86(9):1121–1135. doi: 10.1046/j.1365-2168.1999.01210.x
Supplementary files