Capabilities of positron emission tomography/computed tomography in a comparative assessment of the effect of various targeted therapy options in patients with EGFR-mutated non-small-cell lung cancer
- Authors: Strutynsky V.A.1,2, Sinitsyn V.E.1, Platonova O.E.2
-
Affiliations:
- Lomonosov Moscow State University
- JSC “Medicine”
- Issue: Vol 5, No 3 (2024)
- Pages: 394-406
- Section: Original Study Articles
- Submitted: 13.12.2023
- Accepted: 03.04.2024
- Published: 04.12.2024
- URL: https://jdigitaldiagnostics.com/DD/article/view/624504
- DOI: https://doi.org/10.17816/DD624504
- ID: 624504
Cite item
Full Text
Abstract
BACKGROUND: No publications in the Russian medical literature have examined the potential of positron emission tomography combined with computed tomography through a comparative evaluation of the effect of various targeted therapies involving tyrosine kinase inhibitors in patients with non-small cell lung cancer and mutations in the EGFR gene.
AIM: To explore the capabilities of positron emission tomography combined with computed tomography based on the RECIST 1.1 criteria and changes in SUVmax and SUVmean metabolic parameters for the comparative assessment of the tumor response to targeted monotherapy and combination therapy with tyrosine kinase inhibitors in patients with EGFR-mutant non-small cell lung cancer.
MATERIALS AND METHODS: The 2019–2022 examination records of positron emission tomography combined with computed tomography with 18F-fluorodeoxyglucose (18F-FDG) in 105 patients with non-small cell lung cancer were analyzed, including 75 patients with EGFR-activating mutation. The radiation exposure was adjusted individually and ranged from 45 to 90 mSv. The volume activity of the 18F-FDG radiopharmaceutical was 260–500 MBq. The change in the total largest diameters of the target lesions and SUVmax and SUVmean metabolic parameters were assessed before treatment initiation and 1.5–2.0 months after it. The follow-up duration for the changes in positron emission tomography combined with computed tomography findings in 17 patients with non-small cell lung cancer was at least 12 months.
RESULTS: According to positron emission tomography combined with computed tomography images and SUVmax and SUVmean changes, disease progression was significantly less common (p = 0.043 and p =0.029) in patients with EGFR-mutant non-small cell lung cancer from Groups 2 and 3 who received combination therapy with tyrosine kinase inhibitors and bevacizumab or chemotherapy than in Group 1 and control group (4.2% vs. 20.0%–21.8%). An insignificant trend (p =0.092) to a higher partial response to therapy (58.3% vs. 40.0%) was noted. Similar changes in the total largest diameters of the target lesions at the early stage of therapy appeared to be not significant (p =0.187). Within the long-term follow-up of some patients with non-small cell lung cancer, in at least 50% of cases, changes in the total largest lesion diameters are consistent with the relevant SUVmax and SUVmean alterations found in the first control study.
CONCLUSIONS: Based on the positron emission tomography combined with computed tomography data and alterations in SUVmax and SUVmean metabolic parameters, the early tumor response to combined therapy with tyrosine kinase inhibitors and bevacizumab or chemotherapy compared with targeted monotherapy with tyrosine kinase inhibitors or chemotherapy of the control group was characterized by a significantly lower rate of metabolic disease progression, although a similar tendency of the change in the total largest diameters of target lesions according to RECIST 1.1. was not significant. Changes in SUVmax and SUVmean metabolic parameters at the early stage of therapy are at least 50% faster than similar changes in the total largest diameters of the target lesions, which can be used for the timely identification of patients with a high risk of further progression as determined by RECIST 1.1.
Full Text
ОБОСНОВАНИЕ
Немелкоклеточный рак лёгкого (НМРЛ) занимает одно из первых мест среди всех злокачественных новообразований по показателям заболеваемости и смертности пациентов [1]. В последние годы повышение эффективности противоопухолевого лечения пациентов с НМРЛ и мутацией в генах EGFR, VEGF и других связывают с внедрением в клиническую практику молекулярно-направленной, или таргетной терапии, которая позволяет достоверно улучшить результаты противоопухолевого лечения у этих пациентов по сравнению с традиционной химиотерапией (ХТ) на основе платиносодержащих препаратов [2–4].
Согласно современным клиническим рекомендациям, у пациентов с мутациями в гене EGFR в качестве терапии первой или второй линии показано применение как монотерапии ингибиторами тирозинкиназной активности рецепторов EGFR (ИТК: гефитиниб, эрлотиниб и другие), так и комбинации этих препаратов с гуманизированным моноклональным антителом бевацизумабом, блокирующим избыточную продукцию эндотелиального фактора роста (VEGF), стимулирующего процесс неоангиогенеза опухоли [4–9] или с современными химиотерапевтическим препаратами.
В нескольких сравнительных клинических исследованиях было показано, что комбинированная терапия по сравнению с таргетной монотерапией, как минимум, отличается более высоким показателем выживаемости больных без прогрессирования заболевания [4–6].
Важнейшей проблемой таргетной терапии является выбор метода ранней диагностики эффекта противоопухолевого лечения. Известно, что одним из информативных методов оценки ответа НМРЛ на противоопухолевое лечение является позитронная эмиссионная томография, совмещённая с компьютерной томографией (ПЭТ/КТ) [10–12].
Метод позволяет количественно оценивать изменение в процессе лечения как анатомических параметров опухоли по критериям RECIST 1.1 (Response evaluation criteria in solid tumors), так и степени поглощения опухолью 18F-ФДГ на основании изменения значений SUVmax, SUVmean, SUVpeak и других показателей метаболической активности опухоли [10, 12–15].
Известно, что метаболические показатели ПЭТ/КТ отличаются более высокой информативностью в оценке ответа солидных опухолей на лечение, поскольку поглощение опухолью 18F-ФДГ в процессе лечения наступает значительно раньше соответствующих изменений размеров опухолевых очагов и является, таким образом, независимым прогностическим фактором оценки результатов лечения [10–12, 14, 16, 17].
В России за последние 10–15 лет метод ПЭТ/ КТ с 18F-ФДГ и другими РФП всё чаще применяется для более точной диагностики опухолей различной локализации, а также для оценки эффективности лучевой и химиотерапии у этих больных, в том числе у пациентов с НМРЛ [10, 11, 13, 18]. Тем не менее ни в одной из этих работ нет данных об изучении возможностей метода ПЭТ/ КТ для сравнительной оценки эффективности различных вариантов таргетной терапии с использованием ИТК у пациентов с НМРЛ и мутацией в гене EGFR.
ЦЕЛЬ
Изучить возможности совмещённой ПЭТ/КТ с 18F-ФДГ с использованием критериев RECIST 1.1 и изменений метаболических показателей SUVmax и SUVmean в сравнительной оценке ответа опухоли таргетную монотерапию и комбинированное лечение ИТК у пациентов с НМРЛ и мутацией в гене EGFR.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
Ретроспективное обсервационное выборочное контролируемое одноцентровое исследование выполнено на материалах электронной базы данных ПЭТ/КТ при исследованиях в режиме всего тела.
Критерии соответствия
Критерии включения: возраст старше 18 лет; наличие впервые выявленного НМРЛ, не подвергавшегося ранее противоопухолевой терапии; наличие активирующей мутации в гене EGFR (кроме пациентов группы контроля).
Критерии исключения: наличие в анамнезе других злокачественных новообразований; острые инфекционные заболевания и обострения хронических воспалительных процессов; аллергическая реакция на контрастные вещества в анамнезе; сахарный диабет (суб- и декомпенсированный); наличие тяжёлых заболеваний печени, почек, сердечной недостаточности III–IV функционального класса; психомоторное возбуждение.
Условия проведения
Ретроспективное исследование выполнено в отделении радионуклидной и лучевой диагностики Института Ядерной Медицины АО «Медицина».
Продолжительность исследования
Проанализированы протоколы исследований ПЭТ/КТ, зарегистрированных в базе данных в период с 2019 г. по 2022 г. Анализировали результаты исследований до начала противоопухолевой терапии (исходные данные) и через 1,5–2,0 месяца лечения (1-е контрольное исследование).
Описание медицинского вмешательства
Анализу были подвергнуты протоколы исследований ПЭТ/КТ с 18F-ФДГ всего тела. Все исследования выполнялись на аппаратах Biograph mCT 64 (Siemens, Германия), Gemini TF TOF (Philips, Нидерланды) и Discovery PET/CT 710 (GE Healthcare, США). Радиофармпрепарат 18F-ФДГ с объёмной активностью 260–500 МБк вводился внутривенно каждому пациенту. Для получения КТ-изображений внутривенно вводился йогексол (300 мг в 100 мл) со скоростью 2,5 мл/с. Лучевая нагрузка во время исследования составляла от 45 до 90 мЗв. Напряжение на трубке составляло 100–150 кВ с автоматической модуляцией силы тока (15–30 мА). Толщина среза –1,25 мм. Обработка результатов ПЭТ/КТ-данных проводилась с применением программного обеспечения Siemens Healthineers (Германия) Syngo Via и рабочей станции Syngo CT workplace — IES Tower 8E.
Основной исход исследования
В каждой группе обследованных определяли частоту частичного ответа на лечение, стабилизации или прогрессирования заболевания, выявленную при 1-м контрольном исследовании (через 1,5–2,0 месяца от начала противоопухолевой терапии). Динамику суммы наибольших диаметров целевых очагов в процессе лечения рассчитывали согласно критериям RECIST 1.1. Ответ метаболических показателей на лечение оценивали на основании изменений значений SUVmax и SUVmean до и после лечения. Частичный ответ на лечение диагностировали при уменьшении показателей на ≥30% (или 0,8 единицы SUV) по сравнению с исходным уровнем. Увеличение поглощения 18F-ФДГ ≥30% (или 0,8 единицы SUV) определяли как метаболическое прогрессирование. Другие изменения расценивались как стабилизация заболевания.
Анализ в подгруппах
В исследование включены 75 пациентов с активирующей мутацией в гене EGFR, в том числе 32 пациента (1-я группа), лечившихся ИТК; 24 пациента, получавших ИТК в сочетании с бевацизумабом (2-я группа); 19 пациентов, лечившихся ИТК в сочетании с химиотерапией (3-я группа) и 30 пациентов без мутации в гене EGFR (контрольная группа), получавших ХТ в сочетании с бевацизумабом. У 17 пациентов с НМРЛ повторные исследования ПЭТ/КТ проводились на протяжении 12 месяцев от начала лечения.
Методы регистрации исходов
У всех пациентов анализировали протоколы исследований ПЭТ/КТ.
Статистический анализ
Статистическую обработку материала проводили с использованием пакета статистических прикладных программ (SPSS Inc., версия 21.0; IBM, США). Категориальные показатели представлены абсолютными (n) и относительными (%) частотами встречаемости. Для сравнения категориальных показателей в двух независимых группах использовали χ2 критерий Пирсона и/или точный критерий Фишера. Часть данных, представленных в виде М±SD, сравнивались с помощью параметрического критерия Стьюдента (t) или непараметрического критерия Манна–Уитни. Статистически значимым считалось значение p <0,05.
РЕЗУЛЬТАТЫ
Объекты исследования
Всего в исследование было включено 105 пациентов с НМРЛ, в том числе 75 — с мутацией в гене EGFR (48 мужчин и 57 женщин в возрасте от 32 до 90 лет). Из табл. 1 видно, что по основным клиническим характеристикам, половозрастному составу, наличию сопутствующих заболеваний, а также средним значениям SLD, SUVmax и SUVmean по данным ПЭТ/КТ до начала лечения пациенты различных групп достоверно не отличались друг от друга. У всех пациентов отсутствовали признаки тяжёлых заболеваний печени, почек, сердечной недостаточности III–IV функционального класса.
Таблица 1. Клиническая характеристика обследованных пациентов с немелкоклеточным раком лёгкого (число пациентов, %) и средние значения SLD, SUVmax и SUVmean по данным базового исследования (позитронная эмиссионная томография, совмещённая с компьютерной томографией) до начала лечения (M±SD)
Показатели | Группы | Р 2-3 | Р 2-4 | Р 3-4 | |||
Контроль (n=30) | 1-я (n=32) | 2-я (n=24) | 3-я (n=19) | ||||
1 | 2 | 3 | 4 | ||||
Средний возраст, лет | 61,2±6, | 57,8±5, | 64,2±6, | 60,1±7,6 | 0,284 | 0,091 | 0,364 |
Мужчины | 14 (46,7%) | 16 (50,0%) | 10 (41,7%) | 8 (42,1%) | 0,104 | 0,232 | 0,170 |
III–IV стадии немелкоклеточного рака лёгкого | 13 (43,3%) | 12 (37,5%) | 8 (33,3%) | 6 (31,6%) | 0,205 | 0,170 | 0,193 |
Метастазы | 11 (36,7%) | 10 (31,2%) | 9 (37,5%) | 7 (36,8%) | 0,223 | 0,187 | 203 |
Курение | 10 (33,3%) | 3 (9,4%)# | 2 (8,3%)# | 2 (10,5%)# | 0,309 | 0,361 | 0,198 |
Гипертензия | 6 (20,0%) | 7 (21,9%) | 5 (20,8%) | 4 (21,0%) | 0,268 | 0,301 | 0,319 |
Сахарный диабет, компенсированный | 4 (13,3%) | 4 (12,5%) | 3 (12,5%) | 3 (15,7%) | 0,309 | 0,361 | 0,359 |
Стенокардия I–II функционального класса | 5 (16,7%) | 4 (12,5%) | 4 (16,7%) | 3 (15,7%) | 0,282 | 0,306 | 0,319 |
Хронический бронхит | 6 (20,0%) | 4 (12,5%) | 3 (12,5%) | 2 (10,5%) | 0,313 | 0,341 | 0,359 |
Базовые значения SLD, SUVmax и SUVmean (M±SD) | |||||||
SLD, мм | 19,7±5,6 | 22,3±6,1 | 21,1±5,4 | 26,6±5,7 | 0,207 | 0,148 | 0,161 |
SUVmax | 7,12±2,4 | 8,2±3,1 | 8,2±2,8 | 15,5±4,5 | 0,245 | 0,146 | 0,148 |
SUVmean | 5,37±2,1 | 6,3±1,3 | 6,4±1,2 | 12,1±4,2 | 0,369 | 0,207 | 0,210 |
# статистически значимые отличия от показателя контрольной группы (p <0,05).
Основные результаты исследования
В табл. 2 представлены результаты раннего ответа таргетных очагов на противоопухолевое лечение. При 1-м контрольном исследовании ПЭТ/КТ у пациентов группы контроля частичный ответ на лечение, согласно критериям RECIST 1.1, наблюдался у четверти больных НМРЛ (23,3%), стабилизация опухолевого процесса — более чем у 60% пациентов, и прогрессирование заболевания — в 10% случаев. При анализе изменений метаболических показателей SUVmax и SUVmean частичный ответ определялся в 1,8 раза чаще (p=0,049 и p=0,037), а стабилизация патологического процесса — реже, чем при использовании критериев RECIST 1.1 (p=0,013). В 2 раза чаще по данным SUVmax и SUVmean определялось прогрессирование заболевания (p=0,163).
Таблица 2. Ответ целевых очагов на противоопухолевое лечение, выявленный при 1-м контрольном исследовании методом совмещённой позитронно-эмиссионной и компьютерной томографии у пациентов с немелкоклеточным раком лёгкого и наличием активирующих мутаций в гене EGFR и пациентов контрольной группы (число пациентов, %)
Ответ на лечение | Критерии оценки | Группы | p (2–3) | p (2–4) | p (3–4) | |||
Контроль (n=30) | 1-я (n=32) | 2-я (n=24) | 3-я (n=19) | |||||
1 | 2 | 3 | 4 | |||||
Частичный ответ | RECIST 1.1 (SLD) | 7 (23,3%) | 11 (34,4%) | 10 (41,7%) | 8 (42,1%) | 0,187 | 0,201 | 0,243 |
SUVmax | 13 (43,3%)* | 14 (43,7%) | 13 (54,2%) | 11 (57,9%) | 0,159 | 0,141 | 0,140 | |
SUVmean | 12 (40,0%)* | 13 (40,6%) | 14 (58,3%) | 10 (52,6%) | 0,092 | 0,163 | 0,226 | |
Стабилизация | RECIST 1.1 (SLD) | 20 (66,7%) | 15 (46,9%)# | 12 (50,0%) | 10 (52,6%) | 0,207 | 0,210 | 0,237 |
SUVmax | 11* (36,7%) | 13 (40,6%) | 11 (45,8%) | 8 (42,1%) | 0,199 | 0,229 | 0,235 | |
SUVmean | 12* (40,0%) | 12 (37,5%) | 9 (37,5%) | 9 (47,4%) | 0,311 | 0,182 | 0,198 | |
Прогрессирование | RECIST 1.1 (SLD) | 3 (10,0%) | 6 (18,7%) | 2 (8,3%) | 1 (5,3%) | 0,176 | 0,148 | 0,424 |
SUVmax | 6 (20,0%) | 5 (15,6%) | 0# | 0# | 0,049 | 0,085 | 0,294 | |
SUVmean | 6 (20,0%) | 7 (21,8%) | 1 (4,2%)# | 0# | 0,043 | 0,029 | 0,558 | |
* статистически достоверные отличия от соответствующего результата по критериям RECIST 1.1 (p <0,05);
# статистически достоверные отличия от соответствующего результата в группе контроля (p <0,05)
Такое соотношение динамики анатомических и метаболических параметров опухоли в ответ на лечение сохранялось во всех группах обследованных, хотя только у пациентов контрольной группы разница оказалась статистически значимой (p=0,049 и p=0,037 соответственно).
У пациентов 1-й группы, получавших в качестве монотерапии ИТК первого поколения, частота как частичного ответа на лечение, так и прогрессирования заболевания согласно критериям RECIST 1.1 и изменениям SUVmax и SUVmean не отличалась от частоты соответствующих изменений в контрольной группе (p=0,201 и p=0,235 соответственно).
У пациентов 2-й группы частичный ответ на комбинированную терапию (ИТК + бевацизумаб) несколько превышал таковой у пациентов 1-й группы и группы контроля, как по критериям RECIST 1.1, так и согласно изменениям метаболических показателей, однако разница оказалась статистически незначимой (p=0,092 и p=0,187). В отличие от этого уже при 1-м контрольном исследовании у пациентов 2-й группы наблюдалась значительно более низкая частота прогрессирования заболевания (4,2%), которая по данным SUVmax и SUVmean статистически значимо отличалась от соответствующих результатов у пациентов 1-й группы (p=0,043) и группы контроля (p=0,049). Определялась также тенденция к аналогичным изменениям суммы наибольших диаметров целевых очагов, которая на раннем этапе лечения была статистически незначимой.
У пациентов 3-й группы, получавших другой вариант комбинированной таргетной терапии (ХТ + ИТК в качестве поддерживающей терапии), частота частичного ответа на лечение, согласно критериям RECIST 1.1 и изменениям SUVmax и SUVmean, практически не отличалась от соответствующих результатов у пациентов 2-й группы, но была выше, чем у пациентов 1-й группы и группы контроля, хотя разница также была статистически незначимой (p=0,163 и p=0,143). Так же, как и у пациентов 2-й группы, основным отличием результатов лечения пациентов 3-й группы явилась очень низкая частота прогрессирования заболевания, статистически значимо отличающаяся по данным SUVmax и SUVmean от соответствующего показателя у пациентов 1-й группы (p=0,029) и группы контроля (p=0,046).
Следует отметить, что у пациентов 2-й и 3-й групп также определялась отчётливая тенденция к аналогичным изменениям суммы наибольших диаметров опухолевых очагов, которые на раннем этапе лечения оказались статистически незначимыми (значение p от 0,148 до 0,237).
Высокое прогностическое значение изменений метаболических показателей опухоли в процессе лечения было подтверждено у 17 пациентов с НМРЛ, у которых повторные исследования ПЭТ/КТ проводились на протяжении 12 месяцев от начала лечения. При 1-м контрольном исследовании у всех 17 пациентов по данным RECIST 1.1 определялась стабилизация опухолевого процесса, однако у 13 из них по данным SUVmax и SUVmean были выявлены признаки частичного положительного ответа на лечение, а у 4 человек — признаки метаболического прогрессирования заболевания. В дальнейшем у 7 из 13 пациентов (53,8%) уже при 2-м контрольном исследовании частичный положительный ответ на лечение определялся не только по данным SUVmax и SUVmean, но и по критериям RECIST 1.1. При последующих исследованиях ПЭТ/КТ с 18F-ФДГ вплоть до окончания наблюдения сохранялись признаки частичного ответа на продолжение ранее назначенной терапии или стабилизации заболевания.
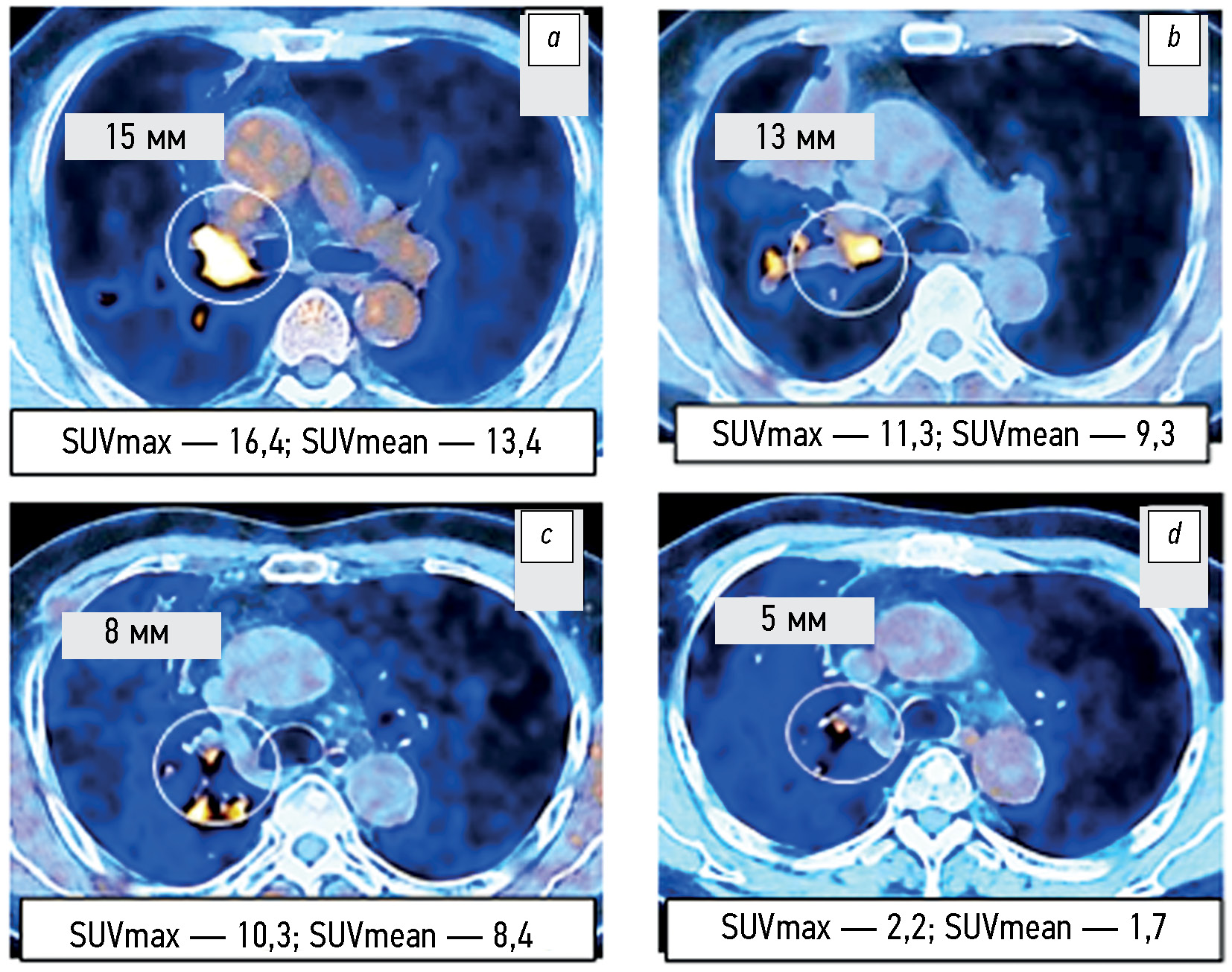
В отличие от этого у 3 из 4 пациентов, у которых при 1-м контрольном исследовании признаки прогрессирования заболевания определялись только по изменениям SUVmax и SUVmean, уже при 2-м контрольном исследовании наблюдалось достоверное увеличение суммы наибольших диаметров целевых очагов, соответствующее (по критериям RECIST 1.1) прогрессированию заболевания, что послужило основанием для пересмотра у этих больных стратегии противоопухолевого лечения (рис. 1, рис. 2).
Рис. 1. Динамика показателей совмещённой позитронно-эмиссионной и компьютерной томографии пациента В. (63 года) с немелкоклеточным раком лёгкого IIВ стадии (Т1bN1M0) и мутацией в гене EGFR (лечение гефитинибом): a — базовое исследование; b, c, d — 1-е, 2-е и 3-е контрольные исследования.
Рис. 2. Динамика показателей совмещённой позитронно-эмиссионной и компьютерной томографии с 18F-ФДГ пациента О. (65 лет) с немелкоклеточным раком лёгкого IА стадии и мутацией в гене EGFR (лечение эрлотинибом): a — базовое исследование; b, c — 1-е и 2-е контрольные исследования.
Уже при 1-м контрольном исследовании степень поглощения опухолью 18F-ФДГ уменьшилась на 31% и 30%, что соответствовало частичному ответу на лечение, хотя размеры опухоли практически не изменились. При 2-м контрольном исследовании размеры опухоли уменьшились на 38,5%, что, согласно критериям RECIST 1.1, свидетельствовало о частичном ответе на лечение. Наконец, по результатам 3-го контрольного исследования через 10 месяцев лечения положительная динамика как анатомических, так и метаболических параметров опухоли полностью сохранялась.
Первое контрольное исследование показало небольшое (на 17%) увеличение размеров опухоли, которое, впрочем, не достигало критериев истинного прогрессирования заболевания по RECIST 1.1 В то же время значения SUVmax и SUVmean в 2 раза превышали таковые, выявленные при базовом исследовании, что свидетельствовало о выраженном метаболическом прогрессировании опухолевого поражения. Классические признаки прогрессирования согласно общепринятым критериям RECIST 1.1 были выявлены ещё через 2 месяца лечения эрлотинибом во время 2-го контрольного исследования, когда увеличение размеров опухоли превысило 40% исходного уровня, что послужило основанием для пересмотра лечения.
Таким образом, изменения метаболической активности опухоли под влиянием лечения существенно опережали аналогичные изменения суммы наибольших диаметров целевых очагов.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
По результатам 1-го контрольного исследования ПЭТ/ КТ у пациентов с НМРЛ и мутацией в гене EGFR 2-й и 3-й групп, получавших комбинированную терапию ИТК в сочетании с бевацизумабом или ХТ, показана достоверно более низкая (по сравнению с таргетной монотерапией и ХТ пациентов группы контроля) частота метаболического прогрессирования, хотя аналогичная тенденция суммы наибольших диаметров целевых очагов по критериям RECIST 1.1 была статистически незначимой. Кроме того, у пациентов, получавших комбинированную терапию ИТК, выявлялась недостоверная тенденция к более высокой частоте частичного ответа на лечение. Статистически значимых отличий изменений метаболических и анатомических показателей ПЭТ/КТ у пациентов 1-й группы и группы контроля обнаружено не было. Изменения метаболических показателей SUVmax и SUVmean, выявленные при 1-м контрольном исследовании, уже при 2-м исследовании не менее чем в 50% случаев сопровождались аналогичными изменениями суммы наибольших диаметров целевых очагов.
Обсуждение основного результата исследования
В настоящее время хорошо изучены возможности ПЭТ/КТ и её метаболических показателей в оценке ответа солидных опухолей на ХТ, лучевую терапию и таргетную иммунотерапию, хотя вопрос о прогностическом значении отдельных метаболических показателей ПЭТ/КТ нельзя считать окончательно решённым.
В литературе опубликовано сравнительно небольшое количество работ, посвящённых изучению возможностей ПЭТ/КТ в оценке ответа на таргетную монотерапию ИТК, которые в последнее время всё чаще применяются у больных НМРЛ с мутациями в гене EGFR. К сожалению, в отечественной литературе до сих пор отсутствуют подобные публикации.
В нашем исследовании для оценки ответа НМРЛ на лечение ИТК мы использовали изменения метаболических показателей SUVmax и SUVmean, которые, как и другие показатели (SUVpeak, MTV, TLG), удовлетворительно отражают степень поглощения опухолью 18F-ФДГ [19].
При сравнении результатов лечения больных 1-й группы и группы контроля, выявленных при 1-м контрольном исследовании, существенных различий в частоте частичного ответа на лечение и прогрессирования заболевания согласно изменению анатомических и метаболических показателей обнаружено не было, что на первый взгляд противоречило результатам нескольких клинических исследований (без использования ПЭТ/КТ), подтверждавших более высокую эффективность монотерапии ИТК по сравнению с ХТ у пациентов с НМРЛ и мутацией в гене EGFR [21–23].
Между тем следует учитывать, что в нашем исследовании в группу контроля были включены пациенты с НМРЛ, которые, помимо классических химиопрепаратов, получали бевацизумаб, дополнительно блокирующий процесс ангиогенеза опухоли. А это, как известно, способствует более высокой эффективности лечения по сравнению с изолированной ХТ [24].
Наибольший интерес представляют результаты сопоставления изменений показателей ПЭТ/КТ при таргетной монотерапии ИТК и двух вариантов комбинированной терапии с использованием ИТК.
Главным отличием результатов комбинированной терапии ИТК в сочетании с бевацизумабом у пациентов 2-й группы явилась значительно более низкая частота прогрессирования заболевания, достоверно отличавшаяся от соответствующего показателя у пациентов 1-й группы и группы контроля, хотя аналогичная тенденция суммы наибольших диаметров целевых очагов по критериям RECIST 1.1. на раннем этапе лечения была статистически незначимой.
Кроме того, частичный ответ на лечение несколько чаще наблюдался и у пациентов 2-й группы, чем у больных 1-й и контрольной групп, хотя разница оказалась статистически незначимой (вероятно, в связи с относительно малым числом пациентов в группах).
В целом эти данные соответствуют результатам нескольких рандомизированных клинических исследований, посвящённых оценке эффективности комбинации эрлотиниба и бевацизумаба у больных НМРЛ с наличием мутации в гене EGFR, в которых было показано, что основное преимущество такой комбинированной терапии заключается, прежде всего, в замедлении процесса прогрессирования заболевания и достоверно более высоких показателях выживаемости больных без прогрессирования заболевания, тогда как достоверных различий по показателю общей выживаемости получено не было [4–6, 9].
Более высокая эффективность комбинированного лечения ИТК в сочетании с бевацизумабом объясняется возможностью блокирования сразу двух взаимосвязанных сигнальных путей (EGFR и VEGF), отвечающих за пролиферацию, метастазирование и неоангиогенез опухолевых клеток [4].
У пациентов 3-й группы, получавших другой вариант комбинированной терапии (ИТК в сочетании с ХТ), как и у пациентов 2-й группы, основным отличием результатов лечения явилась достоверно очень низкая частота прогрессирования заболевания, а также статистически незначимая тенденция к более высокой частоте частичного ответа на лечение.
Эффективность этого варианта комбинированного лечения больных НМРЛ с мутацией в гене EGFR (эрлотиниб или гефитиниб в качестве поддерживающей терапии на фоне ХТ первой линии) также была продемонстрирована в нескольких рандомизированных плацебо-контролируемых клинических исследованиях (FASTACT-2, NCT01469000, SATURN). В большинстве из них продемонстрировано статистически значимое увеличение выживаемости без прогрессирования по сравнению с монотерапией ИТК, что объясняется дополнительным цитотоксическим действием химиопрепаратов [25].
Интересно, что высокий эффект такой терапии наблюдался только при последовательном назначении ХТ и гефитиниба, поскольку ИТК при одновременном применении с ХТ могут ограничивать цитотоксическое действие химиопрепаратов на опухолевые клетки.
Следует подчеркнуть, что для подтверждения результатов лечения ни в одном из приведённых клинических исследований комбинированной терапии ИТК не использовалась методика ПЭТ/КТ и оценка метаболической активности опухоли в процессе лечения. Таким образом, в нашем исследовании впервые получены результаты, подтверждающие возможность использования ПЭТ/КТ и изменений показателей SUVmax и SUVmean в оценке ответа опухоли на применение комбинированной терапии ИТК в сочетании с бевацизумабом или ХТ.
Полученные данные подтверждают результаты многочисленных исследований последних лет, в которых показано, что изменения метаболической активности опухоли в процессе лечения значительно опережают соответствующие изменения её анатомических параметров, что может быть использовано для более точного прогноза результатов дальнейшего противоопухолевого лечения [10, 11, 15–17].
Этот вывод иллюстрируется результатами повторных исследований ПЭТ/КТ у 17 пациентов с НМРЛ на протяжении 12 месяцев от начала лечения. Было показано, что практически у всех пациентов, у которых при 1-м контрольном исследовании динамика SUVmax и SUVmean соответствовала частичному ответу на лечение, в дальнейшем сохранялся либо частичный ответ на лечение, либо стабилизация заболевания, а более чем у половины из них (53,8%) частичный ответ на лечение определялся по анатомическим критериям RECIST 1.1.
Наоборот, у пациентов, у которых при 1-м контрольном исследовании изменения SUVmax и SUVmean соответствовали категории прогрессирования заболевания, уже при 2-м контрольном исследовании признаки прогрессирования определялись и по анатомическим критериям RECIST 1.1, что потребовало коррекции ранее назначенной терапии.
Сходные данные приведены в работе Н.А. Мещеряковой, посвящённой оценке эффективности ХТ и лучевую ЛТ у больных НМРЛ с помощью ПЭТ/КТ [10]. По данным автора, выявление при 1-м контрольном исследовании изменений метаболических показателей, соответствующих частичному ответу на лечение, более чем в половине случаев (как и в нашем исследовании) гарантировало в дальнейшем аналогичный эффект и по анатомическим критериям RECIST 1.1.
В метаанализе 26 исследований X. Xie и соавт. [20] также показано, что в группах больных со снижением в ранние сроки от начала лечения химиотерапевтическими препаратами уровня поглощения 18F-ФДГ солидными опухолями, в том числе с уменьшением SUVmax до значений, соответствующих частичному ответу на лечение, наблюдались значительно более высокие показатели выживаемости без прогрессирования, общей выживаемости и времени до наступления прогрессирования болезни.
Ограничения исследования
Исследование имеет ряд ограничений. Ретроспективный характер исследования не исключал возможность систематической ошибки выбора. В большинстве случаев отсутствовала возможность длительного динамического наблюдения за обследованными пациентами и сравнения результатов ПЭТ/КТ 18F-ФДГ с известными клиническими показателями эффективности лечения (выживаемость без прогрессирования заболевания и общая выживаемость). Кроме того, малое число пациентов в сравниваемых группах снижало статистическую значимость полученных результатов.
ЗАКЛЮЧЕНИЕ
В нашем исследовании изучена возможность ПЭТ/ КТ и метаболических показателей SUVmax и SUVmean в сравнительной оценке ответа опухоли на различные варианты таргетной терапии с использованием ИТК у пациентов с НМРЛ и мутацией в гене EGFR. Впервые по данным ПЭТ/КТ и изменениям метаболических показателей показано, что ранний ответ опухоли на комбинированное лечение ИТК в сочетании с бевацизумабом или ХТ по сравнению с ответом на таргетную монотерапию ИТК или химиотерапевтическое лечение больных контрольной группы характеризуется достоверно более низкой частотой метаболического прогрессирования заболевания, хотя аналогичная тенденция суммы наибольших диаметров целевых очагов по критериям RECIST 1.1 была статистически незначимой. Изменение метаболических показателей SUVmax и SUVmean на раннем этапе лечения не менее чем в 50% случаев опережает аналогичные изменения суммы наибольших диаметров целевых очагов, что может быть использовано для своевременного выделения группы больных с высоким риском дальнейшего прогрессирования, определяемым по критериям RECIST 1.1.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: В.А. Струтынский — концепция и дизайн исследования, сбор и обработка материалов, анализ и интерпретация полученных данных, написание текста статьи; В.Е. Синицын — концепция и дизайн исследования; редактирование статьи; утверждение окончательного варианта рукописи для публикации; О.Е. Платонова — анализ и интерпретация полученных данных; написание текста статьи.
Благодарности. Авторы выражают благодарность Президенту многопрофильной клиники АО «Медицина» д-р мед. наук академику РАН Г.Е. Ройтбергу за предоставленную возможность выполнить данную работу.
ADDITIONAL INFORMATION
Funding source. This study was not supported by any external sources of funding
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. V.A. Strutynsky — concept and design of the study, collection and processing of materials, analysis and interpretation of the data obtained, writing the text of the article; V.E. Sinitsyn — concept and design of the study; editing of the article; approval of the final version of the manuscript for publication; O.E. Platonova — analysis and interpretation of the data obtained; writing the text of the article.
Acknowledgments. The authors express their gratitude to the President of the multidisciplinary clinic of JSC “Medicine”, Academician of the Russian Academy of Sciences, Dr. Sci (Medicine) G.E. Roitberg, MD, for the opportunity to perform this work.
About the authors
Vladislav A. Strutynsky
Lomonosov Moscow State University; JSC “Medicine”
Author for correspondence.
Email: Rammen2@yandex.ru
SPIN-code: 6810-5644
Russian Federation, Moscow; Moscow
Valentin E. Sinitsyn
Lomonosov Moscow State University
Email: Vsini@mail.ru
ORCID iD: 0000-0002-5649-2193
SPIN-code: 8449-6590
MD, Dr. Sci. (Medicine), Professor
Russian Federation, MoscowOksana E. Platonova
JSC “Medicine”
Email: Platonova@medicina.ru
ORCID iD: 0000-0003-0093-7285
MD, Cand. Sci. (Medicine)
Russian Federation, MoscowReferences
- Kaprin AD, Starinskii VV, Shakhzadova AO. Malignant neoplasms in Russia in 2019 (morbidity and mortality). Moscow: Moskovskii gosudarstvennyi nauchno–issledovatel’skii meditsinskii institut im. P.A. Gertsena; 2020. (In Russ.)
- Sakaeva DD, Reutova EV. Targeted therapy for metastatic non-small cell lung cancer. In: Laktionov KK, Breder VV, editors. Lung cancer. Moscow: “Granat”; 2020. P:75–88. (In Russ.)
- Tyulyandin SA. Targeted therapy: twenty years of success and failures. Practical oncology. 2019;20(4):274–288. doi: 10.31917/2004274
- Deng W, Wang K, Jiang Y, et al. Erlotinib plus bevacizumab versus erlotinib alone in patients with EGFR-positive advanced non-small-cell lung cancer: a systematic review and meta-analysis of randomised controlled trials. BMJ Open. 2022;12(8):e062036. doi: 10.1136/bmjopen-2022-062036
- Landre T, Des Guetz G, Chouahnia R, et al. First-line angiogenesis inhibitor plus erlotinib versus erlotinib alone for advanced non-small-cell lung cancer harboring an EGFR mutation. Cancer Res Clin Oncol. 2020;146(12):3333–3339. doi: 10.1007/s00432-020-03311-w
- Maemondo M, Fukuhara T, Saito H, et al. NEJ026: Final overall survival analysis of bevacizumab plus erlotinib treatment for NSCLC patients harboring activating EGFR-mutations. Journal of Clinical Oncology. 2020;38(15):9506–9506. doi: 10.1200/JCO.2020.38.15_suppl.9506
- Rocco D, Della Gravara L, Palazzolo G, et al. The role of antiangiogenic monoclonal antibodies combined to EGFR-TKIs in the treatment of advanced non-small cell lung cancer with activating EGFR mutations: acquired resistance mechanisms and strategies to overcome them. Cancer Drug Resist. 2022;5(4):1016–1024. doi: 10.20517/cdr.2022.77
- Saito H, Fukuhara T, Furuya N, et al. Erlotinib plus bevacizumab versus erlotinib alone in patients with EGFR-positive advanced non-squamous non-small-cell lung cancer (NEJ026): interim analysis of an open-label, randomised, multicentre, phase 3 trial. Lancet Oncol. 2019;20(5):625–635. doi: 10.1016/S1470-2045(19)30035-X
- Stinchcombe TE, Jänne PA, Wang X, et al. Effect of Erlotinib Plus Bevacizumab vs Erlotinib Alone on Progression-Free Survival in Patients With Advanced EGFR-Mutant Non-Small Cell Lung Cancer: A Phase 2 Randomized Clinical Trial. JAMA Oncol. 2019;5(10):1448–1455. doi: 10.1001/jamaoncol.2019.1847
- Meshcheryakova NA. Positron emission tomography combined with computed tomography in the diagnosis and evaluation of treatment effectiveness of non-small cell lung cancer [dissertation]. Moscow; 2018.
- Meshcheryakova NA, Dolgushin MB, Borisova TN, Davydov MM, Laktionov KK. Efficacy of 18F-FDG and 18F-FLT PET/CT for Assessment of Chemoradiotherapy in Patient with Non-Small Cell Lung Cancer (Clinical Observation). Medical Visualization. 2017;(1):53–56. doi: 10.24835/1607-0763-2017-1-53-56
- Wahl R, Jacene Н, Kasamon Y, Lodge M. From RECIST to PERCIST: Evolving Considerations for PET Response Criteria in Solid Tumors. J Nucl Med. 2009;50(5):4–11. doi: 10.2967/jnumed.111.093443
- Gelezhe PB, Morozov SP, Shavladze N. Comparison of the accuracy of evaluating the attenuation correction and tumor size during sequential performance of breast 18F-FDG PET CT and PET/ MRI. Vestnik of the Russian scientific center of roentgenoradiology. 2019;19(4):48–62. EDN: LWGHUU
- Ding Q, Chen X, Yang L, et al. PET/CT evaluation of response to chemotherapy in non-small cell lung cancer: PET response criteria in solid tumors (PERCIST) versus response evaluation criteria in solid tumors (RECIST). J Thorac Dis. 2014;6(6):677–683. doi: 10.3978/j.issn.2072-1439.2014.05.10
- Pierson C, Grinchak T, Sokolovic C, et al. Response criteria in solid tumors (PERCIST/RECIST) and SUVmax in early-stage non-small cell lung cancer patients treated with stereotactic body radiotherapy. Radiat Oncol. 2018;13(1):34. doi: 10.1186/s13014-018-0980-7
- Beer L, Hochmair M, Haug AR, et al. Comparison of RECIST and PERCIST for the Evaluation of Response to PD-1/PD-L1 Blockade Therapy in Patients With Non-Small Cell Lung Cancer. Clin Nucl Med. 2019;44(7):535–543. doi: 10.1097/RLU.0000000000002603
- Kaira K, Higuchi T, Naruse I, et al. Metabolic activity by 18 F–FDG-PET/ CT is predictive of early response after nivolumab in previously treated NSCLC. Eur J Nucl Med Mol Imaging. 2018;45(1):56–66. doi: 10.1007/s00259-017-3806-1
- Khodzhibekova MM. Value of combined PET/CT in the diagnosis and monitoring of treatment of lymphoma patients [dissertation]. Moscow; 2019. (In Russ.)
- Koopman D, Jager PL, Slump CH, et al. SUV variability in EARL-accredited conventional and digital PET. EJNMMI Res. 2019;9(1):106. doi: 10.1186/s13550-019-0569-7
- Xie X, Chen H, Yang H, Lin H. Predictive value of positron emission tomography for the prognosis of molecularly targeted therapy in solid tumors. Z Onco Targets Ther. 2018;7(11):8885–8899. doi: 10.2147/OTT.S178076
- Kamiyoshihara M, Igai H, Ohsawa F, Numajiri K, et al. Gefitinib Monotherapy Afforded Long-Term Survival of an Octogenarian Patient with a Postoperative Recurrence of a Pulmonary Adenocarcinoma — A Case Report. Gan To Kagaku Ryoho. 2023;50(2):187–189. (In Japanese)
- Stinchcombe TE. Foreword: Gefitinib in Non-Small-Cell Lung Cancer: The IDEAL 1 Trial. J Clin Oncol. 2023;41(6):1159–1160. doi: 10.1200/JCO.22.02660
- Zhong WZ, Wang Q, Mao WM, et al. Gefitinib versus vinorelbine plus cisplatin as adjuvant treatment for stage II-IIIA (N1-N2) EGFR-mutant NSCLC (ADJUVANT/CTONG1104): a randomised, open-label, phase 3 study. Lancet Oncol. 2018;19(1):139–148. doi: 10.1016/S1470-2045(17)30729-5
- Liu M, Luo N, Fang Z, Liu Q, et al. The efficacy and toxicity of maintenance therapy with bevacizumab plus pemetrexed versus bevacizumab/pemetrexed alone for stage IIIB/IV nonsquamous non-small cell lung cancer: A meta-analysis of randomized controlled trials. Clin Pharm Ther. 2022;47(2):157–167. doi: 10.1111/jcpt.13534
- Chen Z, Shen S. Intercalated combination of chemotherapy and erlotinib for stage IIIA non-small-cell lung cancer: a multicenter, open-label, single-arm, phase II study. Cancer Manag Res. 2019;11:6543–6552. doi: 10.2147/CMAR.S189287 DOI: https://doi.org/10.17816/DD624504
Supplementary files