Radiological assessment of pulmonary vascular changes and gastrointestinal changes in patients with COVID-19 referred to a tertiary health care center in Chennai, India: a prospective cross-sectional study
- Authors: Sathishkumar H.1, Faizal A.2, Majith A.2, Raj V.2, Venkataramani A.3
-
Affiliations:
- Government Chengalpattu Medical College and Hospital
- Saveetha Medical College and Hospital, Saveetha Institute of Medical and Technical Sciences
- Mahatma Gandhi Medical College and Research Institute
- Issue: Vol 5, No 3 (2024)
- Pages: 480-490
- Section: Original Study Articles
- Submitted: 10.02.2024
- Accepted: 14.05.2024
- Published: 04.12.2024
- URL: https://jdigitaldiagnostics.com/DD/article/view/626759
- DOI: https://doi.org/10.17816/DD626759
- ID: 626759
Cite item
Full Text
Abstract
BACKGROUND: The coronavirus disease pandemic (COVID-19), caused by severe acute respiratory syndrome coronavirus 2, has led to significant morbidity and mortality worldwide since its emergence in 2019. Although primarily a respiratory illness, COVID-19 can also affect other organ systems, including the vascular and gastrointestinal systems. COVID-19 is linked to both venous and arterial thrombosis, and numerous studies have indicated a heightened risk of pulmonary embolism. Autopsies have revealed pulmonary vasculature thrombosis and bowel ischemia in patients with COVID-19.
AIM: To assess radiological pulmonary vascular changes, specifically pulmonary embolism, and gastrointestinal changes in patients with COVID-19 referred to a tertiary healthcare center in Chennai, India.
MATERIALS AND METHODS: Computed tomography pulmonary angiography and contrast-enhanced computed tomography of the abdomen were conducted in 100 patients with COVID-19 who met the selection criteria. A radiologist with 5 years of experience evaluated pulmonary vascular and bowel changes. Subsequently, statistical analysis was performed to determine the significance of the relationship between patients with COVID-19 and the occurrence of pulmonary vascular and bowel changes.
RESULTS: In this study, 11 patients exhibited pulmonary thromboembolism, and 7 showed significant bowel changes such as bowel wall thickening, mesenteric ischemia, and omental infarction, indicative of potential gastrointestinal involvement of patients with COVID-19. A positive correlation was found between pulmonary embolism prevalence in patients with COVID-19. Pulmonary embolism was diagnosed at a mean of 11 days from disease onset. Of the 24 patients with severe acute respiratory illness, 7 showed pulmonary embolism, detected by computed tomography pulmonary angiography. In addition, of the 10 patients on mechanical ventilation, pulmonary embolism was found in 7. Among the seven patients with bowel changes, four had pulmonary embolism, as detected by computed tomography pulmonary angiography, indicating a significant association between the two concomitant complications. The observed bowel changes were attributed to intravascular thrombosis.
CONCLUSIONS: Based on our findings, pulmonary emboli and bowel changes often occur in patients with COVID-19. Multivariate analyses also revealed a connection between invasive mechanical ventilation and pulmonary embolism. The results indicate that patients with severe COVID-19 may also experience concurrent acute pulmonary embolism. Thus, for these patients, the use of contrast-enhanced computed tomography instead of standard non-contrast computed tomography may aid in treatment decision-making.
Full Text
ОБОСНОВАНИЕ
COVID-19, также известный как коронавирусная инфекция 2019 года, был впервые выявлен в 2019 году в китайской провинции Ухань. Начавшись как обычное респираторное заболевание, инфекция быстро распространилась по всему миру, перерастая в пандемию. В марте 2020 года Всемирная организация здравоохранения официально объявила, что вспышка COVID-19, вызванная коронавирусом тяжёлого острого респираторного синдрома-2 (SARS-CoV-2), приобрела характер пандемии [1].
«Нулевой пациент» с COVID-19 был зарегистрирован в Ухане в конце 2019 года. Симптомы COVID-19 похожи на симптомы любой инфекции верхних дыхательных путей или обычной простуды, однако заболевание может также поражать нижние дыхательные пути. У большинства пациентов наблюдаются лёгкие симптомы, а заболевание разрешается без лечения. Однако в ряде случаев инфекция характеризуется тяжёлым течением и требует лечения в отделении интенсивной терапии. Вирус в основном передаётся воздушно-капельным и контактным путём при вдыхании вирусных аэрозольных частиц и тесном межличностном контакте, а в некоторых случаях — при механическом переносе частиц вируса на слизистые глаз, носа или рта.
Считалось, что распространение вируса за пределы дыхательной системы в течение второй недели болезни на фоне клинического ухудшения способствует гиперкоагуляции и усилению иммуноопосредованного поражения. Исследователи предположили, что тромбоэмболия лёгочной артерии (ТЭЛА) может усугублять течение вирусной пневмонии, ещё больше снижая эффективность лечения.
Недостаточная вентиляция и большое скопление людей увеличивают время нахождения вирусных частиц в воздухе и таким образом повышают риск передачи инфекции [2]. Заражение может возникать при прикосновении к глазам, носу или рту после контакта с вирусными частицами.
Основным проявлением инфекции COVID-19 служит поражение дыхательных путей, причём в тяжёлых случаях наблюдается развитие дыхательной или полиорганной недостаточности. Тяжёлое воспаление на фоне заболевания может стать причиной нарушения системы гемостаза. Почти у 20% пациентов с COVID-19 наблюдаются серьёзные нарушения свёртываемости крови, часто проявляющиеся в виде гиперкоагуляции [3]. Высокая концентрация D-димера в плазме крови, наблюдаемая у пациентов с COVID-19 при поступлении в стационар, коррелировала с повышенным показателем смертности [4].
Помимо нарушений свёртываемости крови, COVID-19 сопровождался развитием тромбозов вен и артерий, особенно у пациентов в критическом состоянии [5]. Многочисленные исследования выявили повышенный риск развития ТЭЛА у пациентов с COVID-19 с преимущественным поражением сегментарных артерий. Выявление ТЭЛА на ранних этапах имеет решающее значение для надлежащего ведения пациентов и улучшения результатов лечения, учитывая вариабельность результатов последних исследований и принимая во внимание другие факторы риска развития ТЭЛА.
Кроме того, в исследованиях отмечены случаи нарушения свёртываемости крови у пациентов с COVID-19, при этом высокая концентрация D-димера является предиктором внутрибольничной смертности [6, 7]. Рентгенологические исследования проводятся главным образом с целью выявления специфических нарушений. Например, при проведении компьютерной томографии (КТ) грудной клетки у пациентов с COVID-19 могут визуализироваться затемнения по типу матового стекла и уплотнения, часто присутствующие в обоих лёгких [8].
Недавние исследования выявили связь между воспалением, вызванным COVID-19, низкой сатурацией кислорода, нарушением свёртываемости крови и тромбоэмболическими явлениями, подчеркнув важность профилактических мер для предотвращения венозной тромбоэмболии у пациентов с COVID-19, находящихся на лечении в стационаре.
Настоящее исследование призвано пролить свет на сложное взаимодействие между COVID-19, связанными с ним рентгенологическими признаками нарушений со стороны лёгких и желудочно-кишечного тракта, а также их потенциального влияния на степень тяжести заболевания и тактику ведения пациентов.
ЦЕЛЬ
Оценка рентгенологических признаков изменений в сосудах лёгких (в частности, ТЭЛА) у пациентов, поступивших в стационар с клиническими признаками и симптомами COVID-19, а также оценка рентгенологических признаков изменений со стороны желудочно-кишечного тракта у данных пациентов. Кроме того, будет изучена корреляция между степенью тяжести поражения лёгких и развитием ТЭЛА.
МАТЕРИАЛЫ И МЕТОДЫ
Данное проспективное одномоментное исследование проводилось в течение 1 года в период с сентября 2020 года по август 2021 года.
Размер выборки определяли по формуле:
n=Z×Z×p×q/d×d,
где n — размер выборки; Z — показатель 95% доверительного интервала; p — частота COVID-19 у пациентов с острой ТЭЛА, нуждающихся в искусственной вентиляции лёгких (согласно результатам предыдущих исследований); q — дополнение p; d — относительная точность. После подстановки значений в формулу рассчитанный объём выборки составил 100 человек. Данная цифра была скорректирована с учётом 10% доли случаев отсутствия ответа для обеспечения устойчивости объёма выборки.
В исследовании приняли участие 100 человек с положительным результатом теста на COVID-19 (использовался метод полимеразной цепной реакции с обратной транскрипцией) и клиническими признаками и симптомами ТЭЛА, такими как боль в груди, одышка, учащённое сердцебиение, кашель, а в тяжёлых случаях — цианоз или низкая сатурация кислорода. Данные пациенты были направлены в наше отделение для проведения КТ. В редких случаях было дополнительно показано проведение КТ брюшной полости, как правило, при возникновении специфических симптомов со стороны желудочно-кишечного тракта, в том числе боли в животе, диареи, рвоты и других нарушений, требующих дальнейшего обследования.
Критерии соответствия
Критерии включения:
- возраст ≥18 лет;
- положительный результат теста на COVID-19 (метод полимеразной цепной реакции с обратной транскрипцией);
- наличие признаков ТЭЛА по результатам КТ грудной клетки (периферические клиновидные или сегментарные участки консолидации, а также наличие плеврального выпота или зон инфаркта);
- клинические проявления ТЭЛА;
- наличие тяжёлого острого респираторного синдрома (SARI).
Критерии невключения:
- возраст до 18 лет;
- наличие сахарного диабета;
- беременность;
- наличие аллергии на контрастные вещества;
- нарушения функции почек.
В исследовании использовалось несколько способов сбора данных, включая визуализационный метод исследования с помощью мультиспирального компьютерного томографа GE-Optima (GE Healthcare, США) на 128 срезов. Участники исследования предоставляли письменное информированное согласие. Регистрировали дату постановки диагноза COVID-19 по результату теста методом полимеразной цепной реакции с обратной транскрипцией. Кроме того, записывали демографические и клинические данные, полученные в течение 72 часов после проведения визуализации. Фиксировали также и результаты визуализации, указывающие на наличие ТЭЛА, и другие соответствующие признаки.
Описание медицинской процедуры (протокол визуализации)
Компьютерная томографическая ангиография (КТА) сосудов лёгких с введением контрастного вещества (йогексол) в объёме 70–100 мл (Омнипак 300; GE Healthcare) проводилась с задержкой дыхания. Время болюсного введения контрастного вещества до достижения максимального контрастирования (в единицах по шкале Хаунсфилда) в лёгочной артерии определяли по специальному протоколу Smart Prep (GE Healthcare) в среднем сегменте верхней полой вены. Данные были получены в аксиальной проекции при толщине томографического среза 1,25 мм, а также в проекциях максимальной интенсивности (MIP) в области съёмки 8 мм; в коронарной и сагиттальной плоскостях — при толщине среза 1,25 мм, в MIP в области съёмки 5 мм. Параметры были установлены таким образом, чтобы обеспечить оптимальную визуализацию сосудистых структур лёгких и эмболов.
Аналогичным образом была проведена КТ брюшной полости с контрастированием при установлении параметров, адаптированных для визуализации брюшной полости. Объём вводимого контрастного вещества и время контрастирования были скорректированы таким образом, чтобы оптимизировать визуализацию структур желудочно-кишечного тракта и выявить любые сопутствующие патологии. Протокол КТ брюшной полости включал многоплоскостную реформацию и MIP для комплексной оценки изменений в сосудах кишечника и других нарушений брюшной полости. Кроме того, были тщательно подобраны количество фаз и время получения изображения, что позволило зарегистрировать артериальную, венозную и отсроченную фазы, необходимые для полной оценки патологий сосудов лёгких и брюшной полости. Данные стандартизированные протоколы обеспечивают стабильное и надёжное качество визуализации при всех обследованиях, облегчая точную диагностику и планирование лечения пациентов с COVID-19 при наличии изменений в сосудах лёгких и желудочно-кишечного тракта. Анализ изображений выполнен с помощью программы OsiriX (Pixmeo SARL, Швейцария).
КТА сосудов лёгких и КТ брюшной полости были выполнены рентгенологом с 5-летним опытом работы в области визуализационных исследований, были получены изображения поперечных срезов. Рентгенологу были известны клинические данные пациентов. OsiriX, многоплоскостная реформация и MIP использовались по мере необходимости.
Этические аспекты исследования
Проведение исследования было одобрено этическим комитетом Государственного медицинского колледжа и больницы Стэнли (г. Ченнаи, Индия). Протокол GSMCH/IEC/29122020/005 от 29.12.2020.
Статистический анализ
Анализ данных выполнен с помощью программы SPSS Statistics для Windows версии 26.0 (IBM Corp., США). Для характеристики данных была использована описательная статистика, в том числе частотный анализ для категориальных переменных и средние значения со стандартными отклонениями для непрерывных переменных. Уровень значимости p соответствовал <0,05.
РЕЗУЛЬТАТЫ
В исследовании представлены результаты всестороннего анализа факторов ТЭЛА у пациентов с COVID-19 в соответствии с данными, полученными в выборке из 100 человек. Возраст участников находился в диапазоне от 17 до 85 лет (среднее значение 50 лет; стандартное отклонение 16,7 года). Примечательно, что большинство пациентов относились к возрастным группам «41–50 лет» (25%) и «старше 60 лет» (27%). В исследуемой популяции была отмечена более высокая доля мужчин (61%), женщины составляли 39% выборки.
Что касается сопутствующих заболеваний, у 15% пациентов наблюдались сердечно-сосудистые заболевания, у 7% — хроническая дыхательная недостаточность, и у 5% — злокачественные новообразования (табл. 1). Обычная КТ позволила выявить признаки ТЭЛА в 3% случаев, в то время как клинические симптомы ТЭЛА наблюдались у 6% пациентов. Кроме того, у 24% пациентов имели место клинические признаки острого тяжёлого респираторного синдрома.
Таблица 1. Сравнение сопутствующих заболеваний при выявлении тромбоэмболии лёгочной артерии по результатам компьютерной томографической ангиографии сосудов лёгких
Сопутствующие заболевания | ТЭЛА по данным КТА | Всего | |
Есть | Нет | ||
N (%) | N (%) | ||
Сердечно-сосудистые | 4 | 11 | 15 |
Хроническая дыхательная недостаточность | 2 | 5 | 7 |
Злокачественное новообразование | 1 | 4 | 5 |
Отсутствуют | 4 | 69 | 73 |
Всего | 11 | 89 | 100 |
Примечание. ТЭЛА — тромбоэмболия лёгочной артерии; КТА — компьютерная томографическая ангиография.
В дальнейшем ангиография сосудов лёгких позволила выявить ТЭЛА в 11% случаев. Примечательно, что 10% пациентов требовалась инвазивная вентиляция лёгких. Ангиография сосудов лёгких была проведена на разных этапах, в большинстве случаев (45%) через 7–9 дней с момента начала заболевания.
Для оценки корреляции между изучаемыми факторами и развитием ТЭЛА был проведён статистический анализ. Сравнения не выявили значимой корреляции между ТЭЛА и возрастом (p=0,272) или полом (p=0,263). Однако клинические признаки ТЭЛА находились в значимой связи с выявлением ТЭЛА по данным КТА сосудов лёгких (p=0,001) (табл. 2). Аналогичным образом, признаки ТЭЛА по данным обычной КТ сильно коррелировали с выявлением ТЭЛА по данным КТА сосудов лёгких (p=0,00001) (табл. 3).
Таблица 2. Сравнение пациентов с клиническими признаками тромбоэмболии лёгочной артерии при установлении заболевания по результатам компьютерной томографической ангиографии сосудов лёгких (критерий хи-квадрат, где χ2=9,9, p <0,05, что свидетельствует о высокой значимости)
Клинические признаки ТЭЛА | ТЭЛА по данным КТА | Всего | значение p | |
Да | Нет | |||
N (%) | N (%) | |||
Да | 3 (27) | 3 (3) | 6 | 0,001* |
Нет | 8 (73) | 86 (97) | 94 | |
Всего | 11 | 89 | 100 | |
Примечание. ТЭЛА — тромбоэмболия лёгочной артерии; КТА — компьютерная томографическая ангиография; * значимость p <0,05 при использовании критерия хи-квадрат.
Таблица 3. Сравнение пациентов с признаками тромбоэмболии лёгочной артерии по результатам КТ при установлении заболевания по результатам компьютерной томографической ангиографии сосудов лёгких (критерий хи-квадрат, где χ2=24,91, p <0,05, что свидетельствует о высокой значимости)
ТЭЛА по данным КТ | ТЭЛА по данным КТА | Всего | значение p | |
Да | Нет | |||
N (%) | N (%) | |||
Да | 3 (27) | 0 | 3 | 0,00001* |
Нет | 8 (73) | 89 (100) | 97 | |
Всего | 11 | 89 | 100 | |
Примечание. ТЭЛА — тромбоэмболия лёгочной артерии; КТА — компьютерная томографическая ангиография; * значимость p <0,05 при использовании критерия хи-квадрат.
Более того, клинические проявления острого тяжёлого респираторного синдрома были статистически значимо связаны с развитием ТЭЛА (p=0,003) (табл. 4). Кроме того, изменения в сосудах кишечника (утолщение стенки кишечника, мезентериальная ишемия и инфаркт сальника), наблюдаемые при КТ брюшной полости, значимо коррелировали с наличием ТЭЛА (p=0,000054) (табл. 5), а также с потребностью в искусственной вентиляции лёгких (p=0,00001) (табл. 6).
Таблица 4. Сравнение пациентов с острым тяжёлым респираторным синдромом при установлении заболевания по результатам компьютерной томографической ангиографии сосудов лёгких (критерий хи-квадрат, где χ2=9,96, p <0,05, что свидетельствует о высокой значимости)
SARI | ТЭЛА по данным КТА | Всего | значение p | |
Да | Нет | |||
N (%) | N (%) | |||
Да | 7 (29) | 17 (71) | 24 | 0,003* |
Нет | 4 (5) | 72 (95) | 76 | |
Всего | 11 | 89 | 100 | |
Примечание. SARI — тяжёлый острый респираторный синдром; ТЭЛА — тромбоэмболия лёгочной артерии; КТА — компьютерная томографическая ангиография; * значимость p <0,05 при использовании критерия хи-квадрат.
Таблица 5. Сравнение пациентов с изменениями в сосудах кишечника при наличии тромбоэмболии лёгочной артерии, установленной по результатам компьютерной томографической ангиографии сосудов лёгких (критерий хи-квадрат, где χ2=16,30, p <0,05, что свидетельствует о высокой значимости)
Изменения в сосудах кишечника по результатам КТ брюшной полости | ТЭЛА по данным КТА | Всего | значение p | |
Да | Нет | |||
N (%) | N (%) | |||
Да | 4 (57) | 3 (43) | 7 | 0,000054* |
Нет | 7 (8) | 86 (92) | 93 | |
Всего | 11 | 89 | 100 | |
Примечание. ТЭЛА — тромбоэмболия лёгочной артерии; КТА — компьютерная томографическая ангиография; * значимость p <0,05 при использовании критерия хи-квадрат.
Таблица 6. Сравнение пациентов с COVID-19 на искусственной вентиляции лёгких при наличии тромбоэмболии лёгочной артерии, установленной по результатам компьютерной томографической ангиографии сосудов лёгких (критерий хи-квадрат, где χ2=39,47, p <0,05, что свидетельствует о высокой значимости)
Пациенты с COVID-19, находящиеся на искусственной вентиляции лёгких | ТЭЛА по данным КТА | Всего | значение p | |
Да | Нет | |||
N (%) | N (%) | |||
Да | 7 (64) | 3 (3) | 10 | 0,00001* |
Нет | 4 (36) | 86 (97) | 90 | |
Всего | 11 | 89 | 100 | |
Примечание. ТЭЛА — тромбоэмболия лёгочной артерии; КТА — компьютерная томографическая ангиография; * значимость p <0,05 при использовании критерия хи-квадрат.
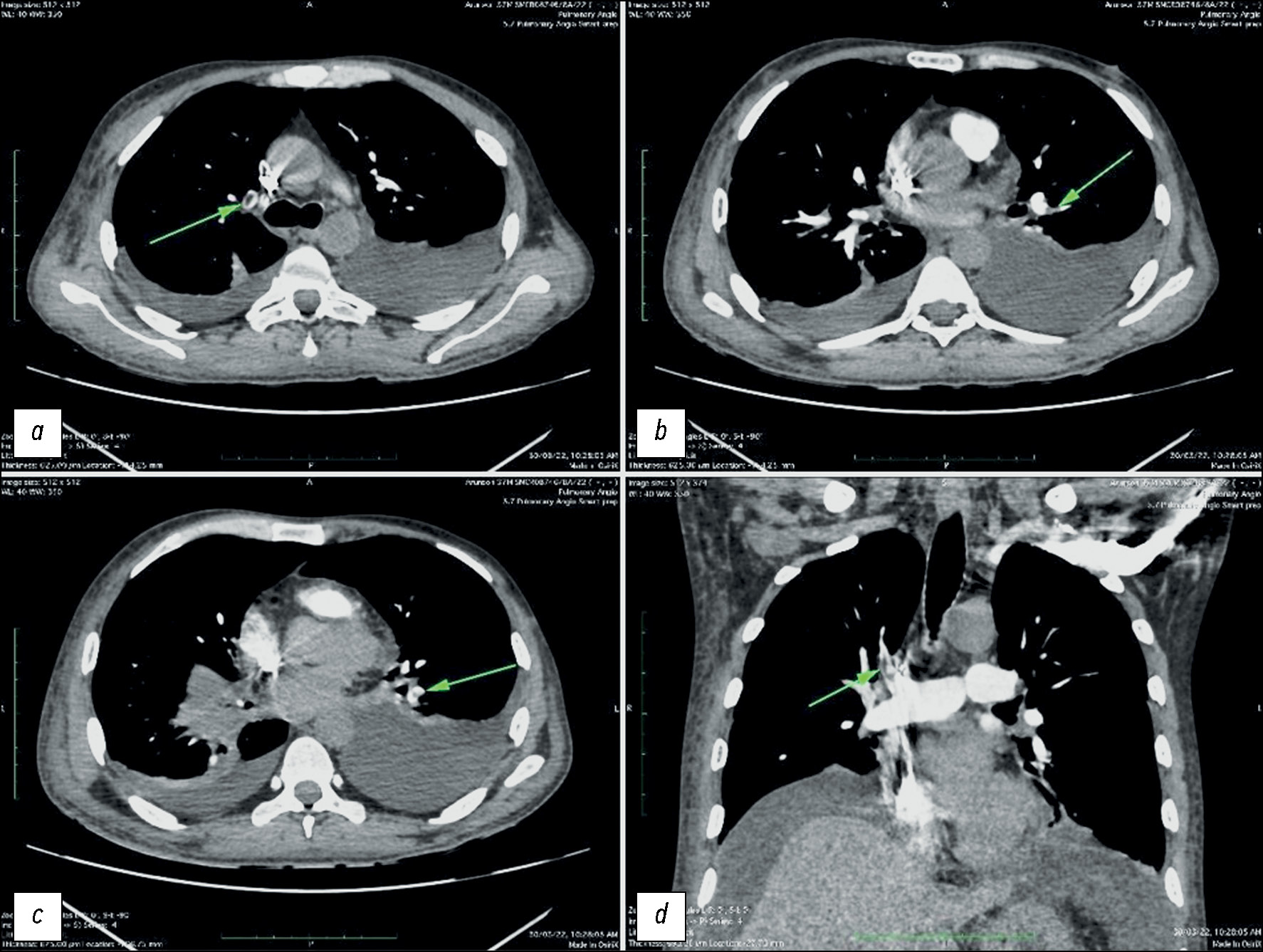
Несколько наглядных случаев изменений сосудов лёгких и кишечника у пациентов с COVID-19 показаны на рис. 1–3.
Рис. 1. Результаты компьютерной томографии, выполненной у пациента мужского пола, 27 лет, с COVID-19, у которого выявлен двусторонний плевральный выпот: a — тромб в лёгочной артерии непосредственно вблизи сегментарных ветвей; b — тромб в боковой сегментарной артерии нижней доли левого лёгкого; c — тромб в лёгочной артерии нижней доли левого лёгкого перед разделением на ветви; d — тромб в лёгочной артерии верхней доли правого лёгкого непосредственно проксимальнее сегментарных ветвей.
Рис. 2. Результаты компьютерной томографии, выполненной у пациента мужского пола, 33 лет, с COVID-19: a — тромб в заднем сегменте нижней доли левого лёгкого; b — плотное поражение мягких тканей в левом лёгком, прорастающее в область прилежащего ребра, и очаг деструкции в грудном позвонке.
Рис. 3. Результаты компьютерной томографии брюшной полости с контрастированием, выполненной у пациента мужского пола, 34 лет, с COVID-19: a — уплотнение жировой ткани сальника в правой нижней части живота, что свидетельствует о наличии инфаркта сальника; b — утолщение стенки подвздошной кишки в области дистального отдела с гипоконтрастированием по сравнению с прилегающей кишкой.
В целом, исследование подчёркивает, что, помимо результатов КТ и КТА сосудов лёгких, при диагностике ТЭЛА у пациентов с COVID-19 большое значение имеют клинические и рентгенологические показатели, в частности — наличие респираторного дистресс-синдрома и изменений в сосудах кишечника.
ОБСУЖДЕНИЕ
В нашем исследовании 100 пациентам с COVID-19 была проведена КТА сосудов лёгких. У 11 из них была выявлена ТЭЛА, а у 7 — значительные изменения в сосудах кишечника. Полученные результаты указывают на положительную корреляцию между ТЭЛА и COVID-19. В большинстве случаев ТЭЛА была диагностирована в среднем через 11 дней с момента начала заболевания. G.B. Danzi и соавт. подтвердили наличие связи между тяжёлым течением COVID-19 и вероятностью развития ТЭЛА [9]. В настоящем исследовании у 7 из 24 пациентов с острым тяжёлым респираторным синдромом была выявлена ТЭЛА по данным КТА сосудов лёгких. G. Chi и соавт., а также F. Grillet и соавт. показали, что пациентам с COVID-19 и ТЭЛА чаще требуется искусственная вентиляция лёгких, чем пациентам без ТЭЛА [10, 11]. В настоящем исследовании по данным КТА сосудов лёгких ТЭЛА была выявлена у 7 из 10 пациентов, находившихся на искусственной вентиляции лёгких.
Степень поражения лёгких не коррелировала с ТЭЛА. Мы признаем, что полученные результаты носят предварительный характер в отношении населения Южной Индии, учитывая ретроспективный дизайн исследования и ограниченный размер выборки. Не был проведён анализ ряда важнейших клинических показателей (например, концентрации D-димера), которые могли бы пролить свет на связь ТЭЛА и COVID-19. Тем не менее данное исследование указывает на вероятность развития ТЭЛА у пациентов с тяжёлым течением COVID-19, что подчёркивает потенциальную значимость КТА сосудов лёгких при принятии терапевтических решений в подобных случаях.
M.A. Abdelmohsen и соавт. обнаружили значительные изменения в сосудах кишечника у пациентов с COVID-19 [12]. В настоящем исследовании значимые изменения в сосудах кишечника (n=7) проявлялись в виде утолщения стенки кишечника, мезентериальной ишемии и инфаркта сальника. У 4 из 7 указанных пациентов была выявлена ТЭЛА по данным КТА сосудов лёгких, что указывает на значимую связь ТЭЛА и изменений в сосудах кишечника. Наблюдаемые изменения в сосудах кишечника могут быть обусловлены внутрисосудистым тромбозом. Потенциальные причины изменений со стороны сосудов желудочно-кишечного тракта у людей с COVID-19 включают непосредственную вирусную инвазию, тромбоз мелких кровеносных сосудов или неокклюзионную форму мезентериальной ишемии.
Ограничения исследования
Исследование имеет несколько заметных ограничений, которые заслуживают упоминания. Во-первых, учитывая одномоментный дизайн исследования, не представлялось возможным провести анализ результатов последующего наблюдения и показателей выживаемости, которые могли бы иметь большое значение с точки зрения оценки исходов ТЭЛА у пациентов с COVID-19 в долгосрочной перспективе. Во-вторых, относительно небольшой размер выборки вызывает опасения относительно возможности использования полученных результатов применительно к более широкой популяции. В-третьих, существенное ограничение представляет собой отсутствие биохимических исследований, в том числе определения концентрации D-димера, поскольку этот и другие маркёры могут предоставить важную информацию о корреляции между концентрацией D-димера и развитием ТЭЛА.
Кроме того, установлению связи между развитием ТЭЛА и COVID-19 препятствовало наличие у участников исследования других сопутствующих заболеваний, например, злокачественных новообразований. Более того, ретроспективный характер сбора данных вызывает неизбежные ошибки и ограничения при учёте факторов, которые могут повлиять на результаты исследования. Данные ограничения подчёркивают необходимость соблюдения осторожности при интерпретации полученных результатов, а также важность дальнейших исследований с использованием более крупных выборок и перспективных схем для подтверждения и расширения наблюдаемых корреляций.
ЗАКЛЮЧЕНИЕ
В соответствии с действующими рекомендациями стандартное обследование пациентов с COVID-19 и определение степени тяжести заболевания зачастую включает проведение КТ грудной клетки без контрастирования. Предыдущие исследования указывали на наличие корреляции между коагулопатией и COVID-19. Кроме того, у пациентов нередко наблюдаются факторы риска развития ТЭЛА, в том числе искусственная вентиляция лёгких и нахождение в отделении интенсивной терапии. Для всесторонней оценки состояния паренхимы лёгких и выявления потенциальных причин респираторного дистресс-синдрома мы рекомендуем проводить КТ с контрастированием у пациентов с COVID-19 при наличии симптомов тяжёлого течения заболевания.
Полученные результаты показывают, что у пациентов с COVID-19 часто наблюдается ТЭЛА и изменения в сосудах кишечника. Многофакторный анализ выявил связь между инвазивной искусственной вентиляцией лёгких и развитием ТЭЛА. К сожалению, отсутствие важнейших клинических показателей, например, концентрации D-димера, ограничивало возможность дать объяснения или проанализировать наличие корреляции с возникновением ТЭЛА. Тем не менее результаты исследования показывают, что тяжёлое течение COVID-19 может быть связано с развитием острой ТЭЛА. В таких случаях проведение КТ с контрастированием, в отличие от стандартной КТ без контрастирования, позволит выявить сосудистые изменения на ранних этапах заболевания и спланировать лечение соответствующим образом.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: H. Sathishkumar — дизайн исследования, сбор и анализ данных, написание рукописи; A. Faizal — написание рукописи, поиск и редактирование изображений, научное редактирование; A. Majith — сбор и анализ данных критически пересмотрел рукопись на предмет важного интеллектуального содержания; V. Raj — поиск и редактирование изображений, научное редактирование текста статьи; A. Venkataramani — интерпретация данных, подготовка рисунков и таблиц, окончательная вычитка рукописи.
ADDITIONAL INFORMATION
Funding source. This study was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. H. Sathishkumar — study design, collection of data, data analysis, writing the manuscript; A. Faizal — writing the manuscript, sourcing and editing of images, critical review; A. Majith — data collection and analysis critically revised the manuscript for important intellectual content; V. Raj — sourcing and editing the images, critical review and revision; A. Venkataramani — data interpretation, prepared figures and tables, final proofreading of the manuscript.
About the authors
Hariharan Sathishkumar
Government Chengalpattu Medical College and Hospital
Email: harisathish00788@gmail.com
ORCID iD: 0009-0005-3198-9899
MD
India, ChengalpattuAfwaan Faizal
Saveetha Medical College and Hospital, Saveetha Institute of Medical and Technical Sciences
Email: affanfaizal4498@gmail.com
ORCID iD: 0009-0000-9664-6698
MD
India, ChennaiAbdul Majith
Saveetha Medical College and Hospital, Saveetha Institute of Medical and Technical Sciences
Author for correspondence.
Email: radsaveetha@gmail.com
ORCID iD: 0009-0005-2351-2644
MD
India, ChennaiVishnu Raj
Saveetha Medical College and Hospital, Saveetha Institute of Medical and Technical Sciences
Email: vishnurajsedhu@gmail.com
ORCID iD: 0009-0004-2436-4586
MD
India, ChennaiAgathiyanathan Venkataramani
Mahatma Gandhi Medical College and Research Institute
Email: aakashv3@gmail.com
ORCID iD: 0009-0004-7403-8164
India, Puducherry
References
- Manfrini N, Notarbartolo S, Grifantini R, Pesce E. SARS-CoV-2: A Glance at the Innate Immune Response Elicited by Infection and Vaccination. Antibodies. 2024;13(1):13. doi: 10.3390/antib13010013
- Thornton GM, Fleck BA, Kroeker E, et al. The impact of heating, ventilation, and air conditioning design features on the transmission of viruses, including the 2019 novel coronavirus: A systematic review of ventilation and coronavirus. PLOS Glob Public Health. 2022;2(7):e0000552. doi: 10.1371/journal.pgph.0000552
- Chen AT, Wang CY, Zhu WL, Chen W. Coagulation Disorders and Thrombosis in COVID-19 Patients and a Possible Mechanism Involving Endothelial Cells: A Review. Aging Dis. 2022;13(1):144–156. doi: 10.14336/AD.2021.0704
- Nemec HM, Ferenczy A, Christie BD 3rd, Ashley DW, Montgomery A. Correlation of D-dimer and Outcomes in COVID-19 Patients. Am Surg. 2022;88(9):2115–2118. doi: 10.1177/00031348221091940
- Stark K, Massberg S. Interplay between inflammation and thrombosis in cardiovascular pathology. Nat Rev Cardiol. 2021;18:666–682. doi: 10.1038/s41569-021-00552-1
- Al-Samkari H, Karp Leaf RS, Dzik WH, et al. COVID-19 and coagulation: bleeding and thrombotic manifestations of SARS-CoV-2 infection. Blood. 2020;136(4):489–500. doi: 10.1182/blood.2020006520
- Covino M, De Matteis G, Polla DAD, et al. Predictors of in-hospital mortality AND death RISK STRATIFICATION among COVID-19 PATIENTS aged ≥80 YEARs OLD. Archives of Gerontology and Geriatrics. 2021;95:104383. doi: 10.1016/j.archger.2021.104383
- Parekh M, Donuru A, Balasubramanya R, Kapur S. Review of the Chest CT Differential Diagnosis of Ground-Glass Opacities in the COVID Era. Radiology. 2020;297(3):E289–E302. doi: 10.1148/radiol.2020202504
- Danzi GB, Loffi M, Galeazzi G, Gherbesi E. Acute pulmonary embolism and COVID-19 pneumonia: a random association? Eur Heart J. 2020;41(19):1858. doi: 10.1093/eurheartj/ehaa254
- Chi G, Lee JJ, Jamil A, et al. Venous thromboembolism among hospitalized patients with COVID-19 undergoing thromboprophylaxis: a systematic review and meta-analysis. J Clin Med. 2020;9(8):2489. doi: 10.3390/jcm9082489
- Grillet F, Behr J, Calame P, Aubry S, Delabrousse E. Acute pulmonary embolism associated with COVID-19 pneumonia detected with pulmonary CT angiography. Radiology. 2020;296(3):E186–E188. doi: 10.1148/radiol.2020201544
- Abdelmohsen MA, Alkandari BM, Gupta VK, et al. Gastrointestinal tract imaging findings in confirmed COVID-19 patients: a non-comparative observational study. Egypt J Radiol Nucl Med. 2021;52. doi: 10.1186/s43055-021-00433-0
Supplementary files