Diagnostic capabilities of cardiac computed tomography in the preoperative diagnosis of hypertrophic cardiomyopathy
- Authors: Dariy O.Y.1,2, Yurpolskaya L.A.1, Rychina I.E.1, Dorofeev A.V.1, Golukhova E.Z.1
-
Affiliations:
- Bakulev Scientific Center for Cardiovascular Surgery
- Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
- Issue: Vol 5, No 3 (2024)
- Pages: 467-479
- Section: Original Study Articles
- Submitted: 15.03.2024
- Accepted: 10.04.2024
- Published: 04.12.2024
- URL: https://jdigitaldiagnostics.com/DD/article/view/629141
- DOI: https://doi.org/10.17816/DD629141
- ID: 629141
Cite item
Full Text
Abstract
BACKGROUND: A comprehensive approach to studying hypertrophic cardiomyopathy with diagnostic equipment and the latest scanning methods will ensure quality control and effective treatment of patients with this condition. The implementation of innovative technologies and computer calculation using next-generation scanners may become relevant and promising in studying various phenotypes of left ventricular remodeling in combination with abnormalities of the chordopapillary apparatus of the mitral valve and myocardial structure.
AIM: To examine the diagnostic capabilities of computed tomography in the preoperative examination of various hypertrophic cardiomyopathy phenotypes.
MATERIALS AND METHODS: The retrospective data analysis included 47 patients with hypertrophic cardiomyopathy (mean age, 52±7 full years) before surgical correction. computed tomography was performed using our protocol with automatic bolus tracking in the left atrium with a 90 HU threshold and biphasic contrast injection to assess the heart chambers and coronary arteries anatomy and mitral valve morphology. Moreover, to assess myocardial structure remodeling, iodine dual-energy computed tomography maps obtained with delayed contrast enhancement were analyzed. All patients with hypertrophic cardiomyopathy were classified by morphological types. The anatomy of chordopapillary apparatus was evaluated in each case.
RESULTS: This study demonstrated variability in hypertrophic cardiomyopathy phenotypes, which were conventionally divided into five morphological categories, but not restricted by them. Among the patients, 26 (55%) had diffuse septum hypertrophic cardiomyopathy, 5 (11%) had midventricular hypertrophic cardiomyopathy, 2 (4%) had midventricular obstruction and apical aneurysm, 8 (18%) had focal basal septum hypertrophic cardiomyopathy, 4 (8%) had concentric hypertrophic cardiomyopathy, and the remaining 4 (8%) had apical hypertrophic cardiomyopathy. Most patients were diagnosed with chordopapillary abnormalities of the mitral valve, categorized by papillary muscle number and position, and the ratio of chords to muscles. In 10 (21%) patients, data on the myocardial bridge of a coronary artery were obtained, whereas 3 (14%) of them had dynamic stenosis. All patients had focal iodine uptake on dual-energy computed tomography maps. An extracellular volume increase was observed in 10 out of 13 (76%) patients. As shown by dual-energy computed tomography, the mean extracellular volume of the left ventricular myocardium was 30.58% (95% confidence interval, 27–34%).
CONCLUSION: Our scanning protocols developed with computed tomography scanners of various generations enable to evaluate the specific morphological patterns of hypertrophic cardiomyopathy in a single study and provide a detailed interpretation of the geometry of cardiac valves and chambers, left ventricular function, state of the coronary bed, and structural changes of the left ventricular myocardium.
Full Text
ОБОСНОВАНИЕ
Сердечно-сосудистая медицина развивается стремительно, иногда с ослепительной скоростью создавая новые и важные инициативы лечения заболеваний, ранее считавшихся неизлечимыми. Кардиомиопатии по-прежнему остаются одними из наименее изученных кардиологических заболеваний. Гипертрофическая кардиомиопатия (ГКМП) — пожалуй, самое известное среди всех генетических заболеваний. Она сопровождается комплексом специфических морфофункциональных изменений и характеризуется развитием гипертрофии миокарда левого (ЛЖ) и/или (реже) правого желудочков, чаще асимметричной за счёт утолщения межжелудочковой перегородки (МЖП) и/или иных стенок, с возможным развитием обструкции выводного отдела левого желудочка (ВОЛЖ) [1]. Прогресс в изучении ГКМП происходил параллельно с развитием диагностических методик, что привело к постепенной ассимиляции клинических, патологических и физиологических особенностей в единую теорию когерентных болезней [2]. Согласно рекомендациям консенсуса Американской ассоциации сердечно-сосудистой визуализации, магнитно-резонансная томография (МРТ) сердца показана при первичной диагностике пациентов с ГКМП, если позволяют ресурсы медицинской организации и имеется опыт в выполнении исследования (класс I, уровень В) [3]. Пациентам с ГКМП, которым проведение МРТ противопоказано или невозможно по техническим причинам, для оценки линейной морфометрии и функции сердца рекомендуется выполнять компьютерную томографию с контрастированием (класс IIа, уровень С) [3]. Мультиспиральная компьютерная ангиография сердца (МСКТ-АГ) является высокоинформативным методом, позволяющим за одно исследование получить равновесное контрастирование полостей обоих желудочков, изучить анатомию камер сердца, клапанного аппарата и коронарного русла у пациентов с ГКМП. Кроме прочего, МСКТ-АГ имеет преимущество перед МРТ в оценке геометрии ЛЖ, особенно при среднежелудочковом фенотипе ГКМП (в выявлении изменений формы и конфигурации полости ЛЖ по типу «гантели» с выраженным систолическим сужением в средней трети). У пациентов со среднежелудочковым фенотипом ГКМП отмечается частое наличие аневризм в области верхушки ЛЖ, обусловленное резким повышением систолического давления из-за обструкции средней трети ЛЖ [4]. Особенности фенотипических форм ГКМП заключаются в частой ассоциации с желудочковыми аритмиями, некрозом миокарда и системной эмболией [5]. После публикации исследования о возможности определения фиброза миокарда у пациентов с острым инфарктом миокарда с помощью двухэнергетической компьютерной томографии (ДЭКТ) появились работы по внедрению методики отсроченного контрастирования для определения участков фиброзно-изменённого миокарда у пациентов с ГКМП [6, 7]. Сравнительное исследование показало высокую точность метода ДЭКТ-АГ, сопоставимую с результатами метода МРТ сердца в изучении линейных и функциональных параметров, а также структурных аномалий миокарда [8]. Основным недостатком метода ДЭКТ-АГ является более низкое временное разрешение и более низкое контрастирование мягких тканей [8]. Актуальным и перспективным становится внедрение инновационных технологий и компьютерных вычислений на сканерах нового поколения с двумя источниками излучения со сниженным объёмом контрастного препарата, что создаст более безопасные условия для исследования структурных аномалий миокарда у пациентов с ГКМП.
ЦЕЛЬ
Изучение возможностей компьютерной томографии в предоперационной диагностике фенотипических форм ГКМП как альтернативы методу МРТ сердца.
МАТЕРИАЛЫ И МЕТОДЫ
В Федеральном государственном бюджетном учреждении «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии имени А.Н. Бакулева» Министерства здравоохранения Российской Федерации накоплен многолетний опыт хирургического лечения ГКМП, который представлен многообразием оперативных техник в сочетании с коррекцией нарушений ритма сердца [9]. Проведён ретроспективный анализ данных 47 пациентов с ГКМП (средний возраст 52±7 полных лет), из них 25 мужчин, в период с 2015 по 2022 год. Диагноз был поставлен лечащими врачами в соответствии с принципами действующих руководств, на основе комплекса данных, полученных при обследовании и сборе семейного анамнеза.
Дизайн исследования
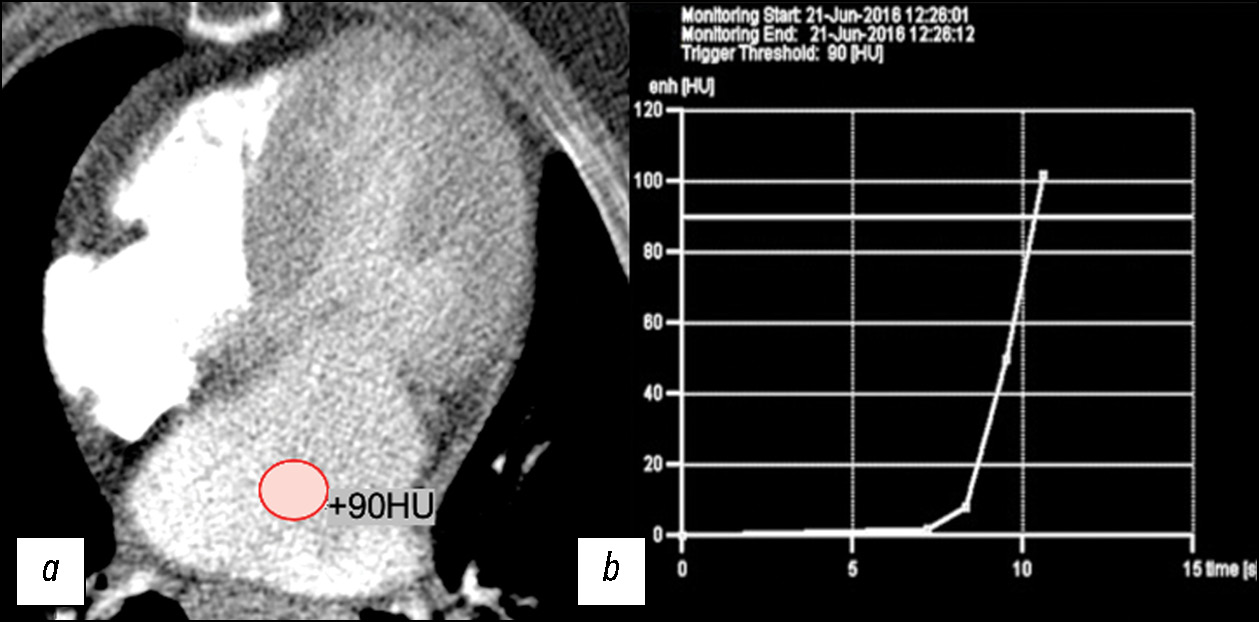
Для изучения анатомии камер сердца и коронарных артерий, морфологии митрального клапана (МК) и подклапанных структур методом МСКТ-АГ сердца у 34 пациентов с ГКМП был применён разработанный нами и описанный в предыдущих публикациях протокол сканирования на аппаратах Somatom Definition Flash (Siemens, Германия) и Brilliance iCT 256 (Philips, Нидерланды) [11]. Автоматический мониторинг болюса контрастного препарата был установлен в полости левого предсердия c пороговым значением 90 HU и двухфазным последовательным введением препарата (рис. 1).
Рис. 1. Изображение компьютерной томографии премониторинга и графика мониторинга: a — установка автоматического мониторинга болюса контрастного препарата в полости левого предсердия c пороговым значением болюса 90 HU; b — пример графика мониторинга болюса контрастного препарата.
Для изучения структурных изменений миокарда ЛЖ проведён ретроспективный анализ данных ДЭКТ 13 пациентов с ГКМП, обследованных на сканере второго поколения с двумя источниками рентгеновского излучения и двумя детекторами (SOMATOM Force; Siemens Healthineers, Германия). Использовались следующие параметры сканирования с ретроспективной синхронизацией по электрокардиографии:
- напряжение на одной рентгеновской трубке 100 кВ, произведение силы тока на экспозицию 160 мАс;
- напряжение на второй рентгеновской трубке 140 кВ, произведение силы тока на экспозицию 130 мАс;
- коллимация 64×0,6 мм;
- время ротации трубки 0,33 с.
Протокол сканирования включал две фазы: ангиографическую и отсроченную. Первая, ангиографическая, фаза была выполнена согласно ранее апробированному протоколу на аппарате SOMATOM Definition Flash (Siemens Healthineers, Германия) (рис. 2).
Рис. 2. Пример пост-процессорной обработки изображений компьютерной ангиографии сердца пациента с гипертрофической кардиомиопатией. Визуализации полостей сердца, коронарных артерий и головок папиллярных мышц: a — 3D-реконструкция четырёхкамерной проекции сердца; b — 3D-реконструкция коронарных артерий; c — мультипланарная реконструкция в двухкамерной проекции сердца. ЛП — левое предсердие, ЛЖ — левый желудочек, ПП — правое предсердие, ПЖ — правый желудочек.
Вторая (отсроченная) фаза сканирования была проведена через 7 минут после ангиографической фазы для оценки структурных изменений миокарда ЛЖ. Область сканирования и поле обзора были скорректированы в соответствии с размером сердца для каждого пациента. По умолчанию, середина диастолы использовалась как фаза реконструкции с высоким и низким напряжением на трубке в аксиальной плоскости со следующими параметрами: толщина среза 0,75 мм, интервал 0,5 мм, фильтр реконструкции D30f. Построение йодных карт ДЭКТ проводили на рабочей станции (Syngo.via VB30A; Siemens Healthineers, Германия) с использованием приложения Heart PBV (perfused blood volume). Изображения отсроченной фазы сканирования были переформатированы в плоскость короткой оси с толщиной среза 8 мм и интервалом 0,5 мм (рис. 3).
Рис. 3. Йодные карты двухэнергетической компьютерной томографии: a — четырёхкамерная проекция сердца (ROI — измерение распределения йода в полости левого желудочка и межжелудочковой перегородке); b — короткая ось сердца (ROI — измерение распределения йода в полости левого желудочка и по межжелудочковой перегородке).
Основной исход исследования
Всех пациентов с ГКМП классифицировали на 5 морфологических типов, используя 17-сегментарную модель ЛЖ (классификация Американской ассоциации сердца — American Heart Association, AHA) [10]. В каждом случае оценивалась анатомия хордопапиллярного аппарата.
Статистический анализ
Материалы исследования были подвергнуты статистической обработке с использованием методов параметрического и непараметрического анализа. Статистический анализ проводился в MS Excel (Microsoft Inc., США). Количественные показатели описывались в виде средних арифметических величин (M) и стандартных отклонений (SD). Для сравнения категориальных переменных применялся коэффициент Пирсона (r).
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Основные показатели, полученные методами МСКТ-АГ и ДЭКТ у исследуемой группы пациентов (n=47), представлены в табл. 1.
Таблица 1. Линейные и объёмные показатели сердца у исследуемой группы 47 пациентов
Параметр | Значение |
Левый желудочек | |
КДР ЛЖ, мл | 41,14±4,6 |
КСР ЛЖ, мл | 20,4±5,2 |
КДО ЛЖ, мл | 114,9±47,1 |
КСО ЛЖ, мл | 28,8±14,0 |
УО ЛЖ, мл | 85,7±38,0 |
ФВ ЛЖ, % | 67,5±22,0 |
толщина задней стенки ЛЖ, мм | 13,5±5,7 |
толщина МЖП, мм | 18,32±5,6 |
размер ВОЛЖ, мм | 24,7±2,8 |
площадь ВОЛЖ, см2 | 3,2±0,6 |
Левое предсердие | |
переднезадний размер, мм | 50,9±7,6 |
медиолатеральный размер, мм | 63,2±10,3 |
Примечание: ЛЖ — левый желудочек; КДР — конечно-диастолический размер; КСР — конечно-систолический размер; КДО — конечно-диастолический объём; КСО — конечно-систолический объём; УО — ударный объём; ФВ — фракция выброса; МЖП — межжелудочковая перегородка; ВОЛЖ — выводной отдел левого желудочка.
Основные результаты исследования
Согласно локализации гипертрофии миокарда ЛЖ по данным КТ были сформированы морфологические варианты ГКМП. Наше исследование демонстрирует вариабельность фенотипических проявлений ГКМП, условно разделённых на 5 морфологических типов и не ограниченных данными вариантами. Большинство — 26 из 47 (55%) — пациентов в нашей работе имели диффузно-септальный морфологический фенотип ГКМП (рис. 4).
Рис. 4. Пример 3D-изображений компьютерной томографии диффузно-септального фенотипа ГКМП: a — плоскость двухкамерной проекции левых отделов сердца; b — короткая ось сердца; c — четырёхкамерная проекция сердца. ЛЖ — левый желудочек, ЛП — левое предсердие, ПЖ — правый желудочек, ПП — правое предсердие.
Среднежелудочковый фенотип выявлен у 5 из 47 (11%) пациентов (рис. 5), из них среднежелудочковый фенотип с апикальным выпячиванием/аневризмой ЛЖ выявлен у 2 (40%) пациентов.
Рис. 5. Пример MPR и 3D-изображений компьютерной томографии среднежелудочкового фенотипа гипертрофической кардиомиопатии с признаками систолической обструкции полости ввиду вариантной аномалии хордо-папиллярного аппарата и асимметричной гипертрофии миокарда левого желудочка: a — плоскость двухкамерной проекции левых отделов сердца; b — трёхкамерная проекция сердца; c — четырёхкамерная проекция сердца. Апикальное смещение заднебоковой папиллярной мышцы и прямой контакт с передней створкой митрального клапана; расщепление ножек сосочковых мышц + добавочная мышечная трабекула.
У 8 из 47 (18%) пациентов был выявлен ассиметричный вариант фокально-базального фенотипа ГКМП с S-образной/«сигмовидной» МЖП, характеризующийся гипертрофией миокарда перегородочных сегментов на базальном уровне вблизи ВОЛЖ (рис. 6).
Рис. 6. Пример 3D-изображений компьютерной томографии фокально-базального фенотипа гипертрофической кардиомиопатии: a — плоскость двухкамерной проекции левых отделов сердца; b — короткая ось сердца. ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек; МЖП — межжелудочковая перегородка; Ао — аорта.
У 4 из 47 (8%) пациентов выявлен концентрический фенотип, характеризующийся симметричной гипертрофией стенок ЛЖ с уменьшением полости. Еще 4 (8%) пациента соответствовали апикальному фенотипу (рис. 7).
Рис. 7. Пример MPR и 3D-изображений компьютерной томографии пациента с апикальным фенотипом гипертрофической кардио-миопатии после имплантации кардиовертер-дефибриллятора: a — плоскость четырёхкамерной проекции; b — двухкамерная проекция левых отделов сердца; c — 3D VRT реконструкции четырёхкамерной проекции сердца.
По результатам нашего исследования пациенты, которым была выполнена хирургическая коррекция ГКМП путём миэктомии, в большинстве случаев имели диффузно-септальный фенотип ГКМП. Всем пациентам со среднежелудочковым фенотипом выполнена хирургическая коррекция по методу Л.А. Бокерия, а с фокально-базальным фенотипом — сочетанная коррекция порока (протезирование или пластика МК + операция Морроу + иссечение субвальвулярного аппарата МК).
Экстремальная гипертрофия ≥30 мм выявлена у 2 из 47 (4%) пациентов с ГКМП. По примеру научных трудов С. Harrigan и G. Efthimiadis мы провели анализ величины гипертрофии миокарда ЛЖ по данным МСКТ-АГ и ДЭКТ сердца и установили, что величина гипертрофии выше у пациентов с обструктивным типом ГКМП [11].
Дополнительные результаты исследования
При оценке линейных параметров МК у исследуемой группы пациентов средний размер фиброзного кольца МК по 4-камерной оси составил 36,8±6,6 мм и по 2-камерной оси — 37,6±6,5 мм, площадь открытия фиброзного кольца МК — 8,8±2,9 см2, длина передней митральной створки (ПМС) — 28,9±3,1 мм, и длина задней митральной створки (ЗМС) — 20,8±3,4 мм. Определить морфологический тип хордального аппарата папиллярных мышц (ПМ) и тип расположения ПМ удалось у всех пациентов.
В соответствии с результатами исследования сформированы 4 группы аномалий хордо-папиллярного аппарата [13, 16].
- В первую группу вошли 6 (13%) пациентов, у которых отмечались неразделённые ПМ с чётко дифференцированными хордами, соединяющие вентрикулярную поверхность и свободный край створок МК с головкой ПМ.
- Во вторую группы вошли 23 (49%) пациента с так называемым «разделённым» типом ПМ, характеризующимся наличием многочисленных добавочных ПМ, с прямым креплением одной из головок к ЗМС, а других — к комиссуральной области ПМС.
- Третью группу составили 13 (27%) пациентов с делением ПМ на множественное количество головок, атипичным прямым креплением одной из головок к комиссуре МК, диспропорциональным удлинением хорд МК и развитием пролапса, а также гипермобильностью створок МК (пролабирование ПМС в ВОЛЖ).
- Четвёртая группа состояла из 5 (11%) пациентов и включала комплекс ПМ, характеризующийся делением и поэтапным расхождением головок ПМ, хорошо дифференцированных на изображениях по короткой оси сердца.
Стоит отметить, что в настоящей работе по результатам данных ДЭКТ 5 (38%) пациентам из третьей группы аномалий хордо-папиллярного аппарата хирургическое лечение ГКМП было дополнено техникой переориентации ПМ и фиксирования подвижных ПМ к задней стенке ЛЖ.
У всех пациентов была проведена оценка коронарных артерий. Среднее значение диаметра устья левой коронарной артерии (ЛКА) составило 3,7±2,3 мм, а среднее значение диаметра правой коронарной артерии (ПКА) составило 2,6±1,8 мм. Значимых различий полученных параметров КТ и селективной коронарографии нами установлено не было (p >0,05) (табл. 2).
Таблица 2. Сравнительный анализ анатомии и патологии коронарных артерий методами компьютерной томографии и селективной коронарографии
Параметр | Компьютерная томография, n=47 | Коронарография, n=47 | p | |
Аномалия устьев | 2% (1) | 2% (1) | 1,0000 | |
Тип кровоснабжения | правый | 85% (40) | 87% (41) | 0,5371 |
левый | 11% (5) | 11% (5) | 1,0000 | |
сбалансированный | 4% (2) | 2% (1) | 0,3458 | |
Атеросклероз и кальциноз коронарных артерий | 28% (13) | 34% (16) | 0,5015 | |
При анализе анатомии коронарных артерий, интра-миокардиальный ход ЛКА выявлен у 10 (21%) пациентов, из которых у 3 (14%) отмечались признаки динамического сужения.
Оценка морфологии аортального клапана важна при планировании миэктомии у пациентов с ГКМП. По нашим результатам, среднее значение размера фиброзного кольца аортального клапана составило 29,1±3,4 мм. Нами была получена слабая корреляционная зависимость размера ВОЛЖ от размера фиброзного кольца аортального клапана (r=0,2, p >0,05). Кроме того, у 29 (62%) обследованных пациентов обнаружены признаки обструкции ВОПЖ из-за гипертрофии МЖП и утолщения мышечных трабекул ЛЖ.
Оценка структурных изменений миокарда методом ДЭКТ выполнена 13 (27%) пациентам. У всех пациентов выявлены очаговые накопления йода на картах отсроченного контрастирования (рис. 8).
Рис. 8. Пример визуальной оценки очагового накопления йода в сегментах миокарда ого желудочка по данным йодной карты двухэнергетической компьютерной томографии: a — короткая ось сердца; b — аксиальная проекция сердца.
Зоны интрамиокардиального очагового накопления йода в 10 из 13 (76%) случаев локализировались по МЖП. Кроме того, на йодных картах отсроченного контрастирования проведен подсчёт фракции внеклеточного объёма (ECV) на среднем уровне ЛЖ. Значение ECV по данным йодных карт определялось следующим выражением:
где ΔHUm — плотность накопления йода в миокарде ЛЖ, а ΔHUb — в полости ЛЖ.
В нашей работе у 10 из 13 (76%) пациентов отмечалось увеличение значения показателя в одном и более сегментах (N=25,4%). Среднее значение ECV миокарда ЛЖ по данным ДЭКТ составило 30,58% (95% доверительный интервал 27–34%) и превышало нормальные диапазоны.
ОБСУЖДЕНИЕ
В современном мире сердечно-сосудистой хирургии комплексный подход изучения ГКМП с помощью арсенала диагностической аппаратуры и новейших методик сканирования позволит обеспечить качественный контроль и эффективность лечения пациентов с ГКМП. На сегодняшний день с помощью МРТ возможна оценка как грубых макроскопических аномалий миокарда ЛЖ (увеличение толщины сегментов и заместительный фиброз в отсроченные фазы контрастирования), так и изменений клеточного и внеклеточного пространства миокарда (путём проведения картирования с оценкой времени Т1-релаксации), а именно диффузного фиброза миокарда (класс IIа, уровень В) [3]. Несмотря на все свои преимущества, МРТ имеет ряд абсолютных и относительных противопоказаний [12]. Абсолютными противопоказаниями считаются: наличие у пациента МР-несовместимого кардиостимулятора, мозговых клипс, кохлеарных имплантатов и других металлсодержащих устройств и имплантатов [12]. Кроме того, стоит отметить, что, несмотря на увеличение доступности метода МРТ, проведение исследования сердца возможно далеко не в каждом медицинском центре. МСКТ-АГ имеет широкий спектр клинических применений благодаря возможности оценки анатомических и функциональных свойств сердца. Тем не менее метод показан только в случае диагностических сомнений, плохого акустического окна при эхокардиографии и/или противопоказаний для выполнения МРТ сердца. Именно поэтому МСКТ-АГ сердца редко используется в качестве первичного метода обследования пациентов с ГКМП. Однако, ДЭКТ с построением йодных карт контрастирования может считаться альтернативным методом диагностической визуализации в оценке аномалий структуры миокарда ЛЖ [13]. Кроме того, перед хирургическим лечением пациентов с ГКМП методом расширенной миэктомии с иссечением субвальвулярного аппарата МК рекомендовано включить компьютерную томографию в мультимодальный алгоритм диагностики [14]. Данный метод точно отвечает на наиболее важные вопросы кардиохирурга, такие как: тип, место и субстрат обструкции у пациентов с ГКМП (то есть аномалии МК и ПМ), что позволяет на предоперационном этапе смодифицировать ход хирургических манипуляций и выбрать оптимальный путь устранения обструкции ЛЖ. Детальное изучение геометрии ЛЖ на дооперационном этапе позволит оптимизировать алгоритм инструментальных исследований, уменьшить время и количество диагностических процедур в предоперационный период.
В нашем исследовании большинство пациентов имели диффузно-септальный морфологический фенотип ГКМП, характеризующийся гипертрофией МЖП. В данном фенотипе ГКМП часто встречается комбинированный тип обструкции, как на уровне ВОЛЖ, так и внутри желудочковой локализации [15], иногда сопровождающийся выраженным некомпактным слоем боковой стенки ЛЖ [16]. Кроме того, большая часть пациентов в исследуемой группе имела фокально-базальный фенотип ГКМП с S-образной/«сигмовидной» МЖП, характеризующийся гипертрофией миокарда перегородочных сегментов на базальном уровне вблизи ВОЛЖ. Этот вариант может вызывать субаортальную обструкцию и регургитацию на МК [16]. Среднежелудочковый фенотип выявлен лишь у 5 пациентов, этот фенотип характеризуется гипертрофией среднего отдела ЛЖ, которая вызывает локальное сужение полости ЛЖ и апикальную дилатацию. Особенность этого фенотипа ГКМП заключается в его частой ассоциации с желудочковой аритмией, некрозом миокарда и системной эмболией [4]. Меньшинство пациентов соответствовали апикальному фенотипу, характеризующемуся полной или частичной облитерации полости ЛЖ в верхушечных сегментах. Считается, что этот фенотип имеет лучший прогноз, чем другие варианты, хотя он в большей степени связан с ишемией и апикальным инфарктом миокарда ЛЖ [10].
Изучение вариантной анатомии хордо-папиллярного аппарата МК имеет колоссальный вклад в развитие хирургических методик коррекции ГКМП. Доказано, что аномальное прикрепление хорд к основанию ПМС, длина ПМС и увеличение угла подвижности передне-латеральной ПМ достоверно связаны с динамической обструкций ВОЛЖ, независимо от других факторов, включая толщину МЖП [18]. Кроме того, показано, что удлинение ПМС коррелирует с аномалиями подклапанных структур МК (включая утолщение головок ПМ) и атипичным креплением головок/ хорд ПМ у пациентов с ГКМП [18]. Осведомлённость хирурга об особенностях строения МК помогает заранее определить возможность сохранения МК, либо подготовится к протезированию клапана с целью обеспечения полного устранения градиента на ВОЛЖ. Раннее в нашем центре было выявлено, что у пациентов с ГКМП уменьшение показателей площади ВОЛЖ (менее чем на 2,6 см2) и увеличение длины ПМС (более чем на 27 мм) может считаться предиктором возникновения обструкции на ВОЛЖ ≥30 мм рт. ст. [14].
Наличие ишемии миокарда у больных ГКМП в настоящее время является общепризнанным фактом [19]. Необходимо помнить, что интрамиокардиальное расположение коронарных артерий вызывает сдавление коронарных артерий в систолу, что в свою очередь приводит к коронарной недостаточности, вплоть до внезапной смерти [1]. В нашем исследовании у 10 пациентов выявлен интрамиокарардиальный ход ПМЖВ ЛКА.
Изменения во внеклеточном матриксе и коронарной микроциркуляции играют ключевую роль в развитии патологического структурного ремоделирования миокарда, так называемого фибротического ремоделирования миокарда. Подсчёт фракции внеклеточного объёма (ECV) в каждом сегменте миокарда ЛЖ является перспективным инструментом для количественной оценки фибротического ремоделирования миокарда. Публикации последних лет демонстрируют повышенный интерес и стремление к внедрению в алгоритм исследования пациентов с ГКМП, альтернативной методики диагностической визуализации структуры миокарда ЛЖ, а именно ДЭКТ с построением йодных карт контрастирования [20, 21]. Опубликованы данные нормальных референтных значениях ECV в миокарде ЛЖ методом ДЭКТ — 25,4% [13, 20]. В нашем исследовании у 10 пациентов, обследованных методом ДЭКТ, отмечалось увеличение значения показателя в одном и более сегментах. В работе группы Northwestern University Feinberg School of Medicine описано, что по данным гистологии диффузный фиброз миокарда ЛЖ был более распространён у пациентов с ГКМП умерших от внезапной сердечной смерти, чем у пациентов с гипертрофией миокарда ЛЖ гипертонического происхождения и смертью, не связанной с сердечно-сосудистыми причинами, что позволяет предположить увеличение значений ECV как про аритмический субстрат [22].
Ограничения исследования
В исследования включены данные пациентов одной медицинской организации, полученные на двух компьютерных томографах с применением специально разработанных протоколов. Ожидаемые результаты в иных условиях, разумеется, требуют дополнительного изучения.
ЗАКЛЮЧЕНИЕ
Успех диагностики ГКМП методом компьютерной томографии определяется правильно подобранными параметрами сканирования. Разработанные нами протоколы сканирования на компьютерных томографах разных поколений позволяют определить характерные паттерны морфологических типом ГКМП в одном исследовании и детально интерпретировать геометрию камер и клапанной системы сердца, функцию левого желудочка и состояние коронарного русла, а кроме того — структурные изменения миокарда левого желудочка. Метод предоставляет кардиохирургу подробную информацию о причине и месте гипотетической динамической обструкции, имеет принципиальное значение в выборе оптимального хирургического пособия.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: О.Ю. Дарий — разработка концепции статьи, написание текста; Л.А. Юрпольская — написание и рецензирование текста; И.Е. Рычина — разработка концепции статьи; А.В. Дорофеев, Е.З. Голухова — утверждение окончательного варианта текста.
ADDITIONAL INFORMATION
Funding source. This study was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. O.Yu. Dariy — development of the article concept, writing the text; L.A Yurpolskaya— writing and reviewing the text; I.E. Rychina — development of the article concept; A.V. Dorofeev, E.Z. Golukhova — approval of the final version of the text.
About the authors
Olga Y. Dariy
Bakulev Scientific Center for Cardiovascular Surgery; Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
Email: dariiolyka@mail.ru
ORCID iD: 0000-0003-0140-8166
SPIN-code: 1844-4944
MD, Cand. Sci. (Medicine)
Russian Federation, Moscow; MoscowLiudmila A. Yurpolskaya
Bakulev Scientific Center for Cardiovascular Surgery
Email: layurpolskaya@bakulev.ru
ORCID iD: 0000-0001-7780-2405
SPIN-code: 8436-9665
MD, Dr. Sci. (Medicine)
Russian Federation, MoscowInna E. Rychina
Bakulev Scientific Center for Cardiovascular Surgery
Email: ierychina@bakulev.ru
ORCID iD: 0000-0001-8056-4188
SPIN-code: 3516-0729
MD, Cand. Sci. (Medicine)
Russian Federation, MoscowAleksey V. Dorofeev
Bakulev Scientific Center for Cardiovascular Surgery
Email: avdorofeev@bakulev.ru
ORCID iD: 0000-0003-0833-9650
MD, Cand. Sci. (Medicine)
Russian Federation, MoscowElena Z. Golukhova
Bakulev Scientific Center for Cardiovascular Surgery
Author for correspondence.
Email: egolukhova@bakulev.ru
ORCID iD: 0000-0002-6252-0322
SPIN-code: 9334-5672
MD, Dr. Sci. (Medicine), Academician of Russian Academy of Science
Russian Federation, MoscowReferences
- Maron BJ, McKenna WJ, Danielson GK, et al. American College of Cardiology/European Society of Cardiology Clinical Expert Consensus Document on Hypertrophic Cardiomyopathy. J Am Coll Cardiol. 2003;42(9):1687–1713. doi: 10.1016/s0735-1097(03)00941-0
- Kotkar KD, Said SM, Dearani JA, Schaff HV. Hypertrophic obstructive cardiomyopathy: the Mayo Clinic experience. Ann Cardiothorac Surg. 2017;6(4):329–336. doi: 10.21037/acs.2017.07.03
- Ommen SR, Mital S, Burke MA, et al. 2020 AHA/ACC Guideline for the Diagnosis and Treatment of Patients With Hypertrophic Cardiomyopathy: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circultation. 2020;142(25):e558–e631. doi: 10.1161/CIR.0000000000000937
- Brigden W. Uncommon myocardial diseases: the non-coronary cardiomyopathies. Lancet. 1957;273(7008):1243–1249. doi: 10.1016/s0140-6736(57)91537-4
- Choudhury L, Mahrholdt H, Wagner A, et al. Myocardial scarring in asymptomatic or mildly symptomatic patients with hypertrophic cardiomyopathy. J Am Coll Cardiol. 2002;40(12):2156–2164. doi: 10.1016/S0735-1097(02)02602-5
- Shiozaki AA, Senra T, Arteaga E, et al. Myocardial fibrosis detected by cardiac CT predicts ventricular fibrillation/ventricular tachycardia events in patients with hypertrophic cardiomyopathy. J Cardiovasc Comput Tomogr. 2013;7(3):173–181. doi: 10.1016/j.jcct.2013.04.002
- Qin L, Chen C, Gu S, et al. A radiomic approach to predict myocardial fibrosis on coronary CT angiography in hypertrophic cardiomyopathy. International Journal of Cardiology. 2021;337:113–118. doi: 10.1016/j.ijcard.2021.04.060
- Berliner JI, Kino A, Carr JC, Bonow RO, Choudhury L. Cardiac computed tomographic imaging to evaluate myocardial scarring/fibrosis in patients with hypertrophic cardiomyopathy: a comparison with cardiac magnetic resonance imaging. Int J Cardiovasc Imaging. 2013;29(1):191–197. doi: 10.1007/s10554-012-0048-y
- Bokeriya LA. Hypertrophic obstructive cardiomyopathy. Annals of Surgery (Russia). 2013;5:5–14. (In Russ).
- Baxi AJ, Restrepo CS, Vargas D, et al. Hypertrophic cardiomyopathy from A to Z: genetics, pathophysiology, imaging, and management. Radiographics. 2016;36:335–354. doi: 10.1148/rg.2016150137
- Efthimiadis GK, Pagourelias ED, Hadjimiltiades S, et al. Feasibility and significance of preclinical diagnosis in hypertrophic cardiomyopathy. Cardiol Rev. 2015;23(6):297–302. doi: 10.1097/CRD.0000000000000076
- Vasil’ev YuA, Semenov DS, Akhmad ES, et al. Peculiarities of magnetic resonance imaging in patients with implants and metal structures. Moscow: Obshchestvo s ogranichennoi otvetstvennost’yu «Izdatel’skie resheniya»; 2022. (In Russ.) EDN: WNQXXM
- Bandula S, White SK, Flett AS, et al. Measurement of myocardial extracellular volume fraction by using equilibrium contrast-enhanced CT: validation against histologic findings. Radiology. 2013;269(2):396–403. doi: 10.1148/radiology.13130130
- Bokeriya LA, Darii OYu, Makarenko VN, et al. Computed and magnetic resonance imaging of hypertrophic cardiomyopathy. Educational and methodological manual. Moscow: Natsional’nyi meditsinskii issledovatel’skii tsentr serdechno-sosudistoi khirurgii imeni A.N. Bakuleva; 2022. (In Russ.) EDN: MOGFHL
- Patel P, Dhillon A, Popovic Z, et al. Left ventricular outflow tract obstruction in hypertrophic cardiomyopathy patients without severe septal hypertrophy: implications of mitral valve and papillary muscle abnormalities assessed using cardiac magnetic resonance and echocardiography. Circ Cardiovasc Imaging. 2015;8(7):e003132. doi: 10.1161/CIRCIMAGING.115.003132
- Laaroussi L, Ben Halima A, Boukhris M. Left ventricular non-compaction associated with hypertrophic cardiomyopathy in the same patient. Kardiol Pol. 2017;75(4):397. doi: 10.5603/KP.2017.0064
- Wigle ED, Auger P, Marquis Y. Muscular subaortic stenosis: the initial left ventricular inflow tract pressure as evidence of outflow tract obstruction. Can Med Assoc J. 1966;95(16):793–797.
- Ramsheyi SA, Pargaonkar S, Lassau JP, Acar C. Morphologic classification of the mitral papillary muscles. J Heart Valve Dis. 1996;5(5):472–476.
- Kovalevskaya EA, Krylova NS, Poteshkina NG, et al. Clinical profile of patients with hypertrophic cardiomyopathy with myocardial ischemia in the absence of coronary atherosclerosis. The journal of general medicine. 2018;(4):36–42. EDN: VVQBKY
- Abadia A, Assen M, Martin S, et al. Myocardial extracellular volume fraction to differentiate healthy from cardiomyopathic myocardium using dual-source dual-energy CT. Journal of Cardiovascular Computed Tomography. 2020;14(2):162–167. doi: 10.1016/j.jcct.2019.09.008
- Vullaganti S, Levine J, Raiker N, et al. Fibrosis in Hypertrophic Cardiomyopathy Patients With and Without Sarcomere Gene Mutations. Heart Lung Circ. 2021;30(10):1496–1501. doi: 10.1016/j.hlc.2021.04.008
Supplementary files