Navigating secondary breast angiosarcoma: a case report
- Authors: Balbino M.1, Montatore M.1, Masino F.1, Carpagnano F.A.2, Guglielmi G.1,2,3
-
Affiliations:
- Foggia University School of Medicine
- Dimiccoli Hospital
- IRCCS Casa Sollievo della Sofferenza Hospit
- Issue: Vol 5, No 3 (2024)
- Pages: 656-663
- Section: Case reports
- Submitted: 20.02.2024
- Accepted: 15.05.2024
- Published: 04.12.2024
- URL: https://jdigitaldiagnostics.com/DD/article/view/627282
- DOI: https://doi.org/10.17816/DD627282
- ID: 627282
Cite item
Full Text
Abstract
We describe a rare case of secondary breast angiosarcoma in a 72-year-old woman with a history of breast cancer who presented to our clinic with a painless palpable mass in the outer upper quadrant of the left breast. The diagnosis required a multidisciplinary approach involving a senologist, anatomopathologist, and oncologist. Imaging modalities such as mammography, ultrasonography, and magnetic resonance imaging made it possible to assess the extent of the tumor, lymph node involvement, and distant metastases. The diagnosis was confirmed by a tissue biopsy. Herein, a rare case is presented, with the main educational purpose of describing the clinical presentation and complex diagnostic evaluation and discussing the differential diagnosis and management. Indeed, secondary mammary angiosarcoma is a rare and aggressive neoplasm, and understanding its unique features is essential for clinical decision-making and patient outcomes. The tumor has a worse prognosis because of its late diagnosis, higher risk of rapid distant spread, and limited treatment options. Such cases require close monitoring, aggressive strategies, and supportive care.
Full Text
АКТУАЛЬНОСТЬ
Ангиосаркома молочной железы — редкое и агрессивное злокачественное новообразование из эндотелиальных клеток выстилки кровеносных сосудов, диагностика и лечение которого представляет сложную задачу. Первичная и вторичная ангиосаркомы молочной железы — это разные заболевания с разными клиническими характеристиками, подходами к диагностике и лечению и прогнозами [1, 2]. Комплексное изучение указанных различий позволяет выработать алгоритм принятия клинических решений и оптимизировать исходы при ведении пациентов с этим редким и агрессивным злокачественным новообразованием. Первичная ангиосаркома молочной железы впервые образуется в ткани молочной железы, а вторичная возникает в результате метастазирования или как осложнение после лучевой терапии [3].
Первичная ангиосаркома молочной железы представляет собой, как правило, быстрорастущее пальпируемое образование в ткани молочной железы, которое может сопровождаться изменением цвета кожных покровов в соответствующей области, образованием язв или возникновением кровотечения [4, 5]. Пациентки могут жаловаться на боль, припухлость и утолщение в груди. Вторичная ангиосаркома молочной железы часто возникает в виде повторного или нового очага после лучевой терапии, проведённой по поводу рака молочной железы. Клиническая картина вторичной ангиосаркомы молочной железы зависит от локализации метастазов и распространённости опухолевого процесса [6].
В настоящей статье рассматриваются сложные аспекты ведения пациентов с вторичной ангиосаркомой молочной железы, а также её клинические проявления, подходы к диагностике и лечению, прогноз.
ОПИСАНИЕ СЛУЧАЯ
Анамнез
Клинический случай зарегистрирован у 72-летней пациентки с вторичной ангиосаркомой молочной железы и раком молочной железы в анамнезе, по поводу которого 10 лет назад были проведены квадрантэктомия и адъювантная лучевая терапия. В отделении пациентка сообщила, что три месяца назад в той же молочной железе, в которой ранее был зарегистрирован первичный очаг, появилось быстрорастущее пальпируемое образование, требующее дополнительного обследования. В ходе физикального обследования обнаружилось плотное безболезненное образование диаметром приблизительно 6 см в верхнем наружном квадранте левой молочной железы. Подмышечные лимфатические узлы не пальпировались. Диагностика вторичной ангиосаркомы молочной железы требует комплексного подхода с проведением клинических, рентгенологических и гистологических исследований. Сразу после обращения пациентке выполнили маммографию, ультразвуковое исследование и магнитно-резонансную томографию (МРТ) для установления диагноза, оценки распространённости опухолевого процесса и планирования лечения. Результаты биопсии подтвердили злокачественный характер опухоли.
Обследование
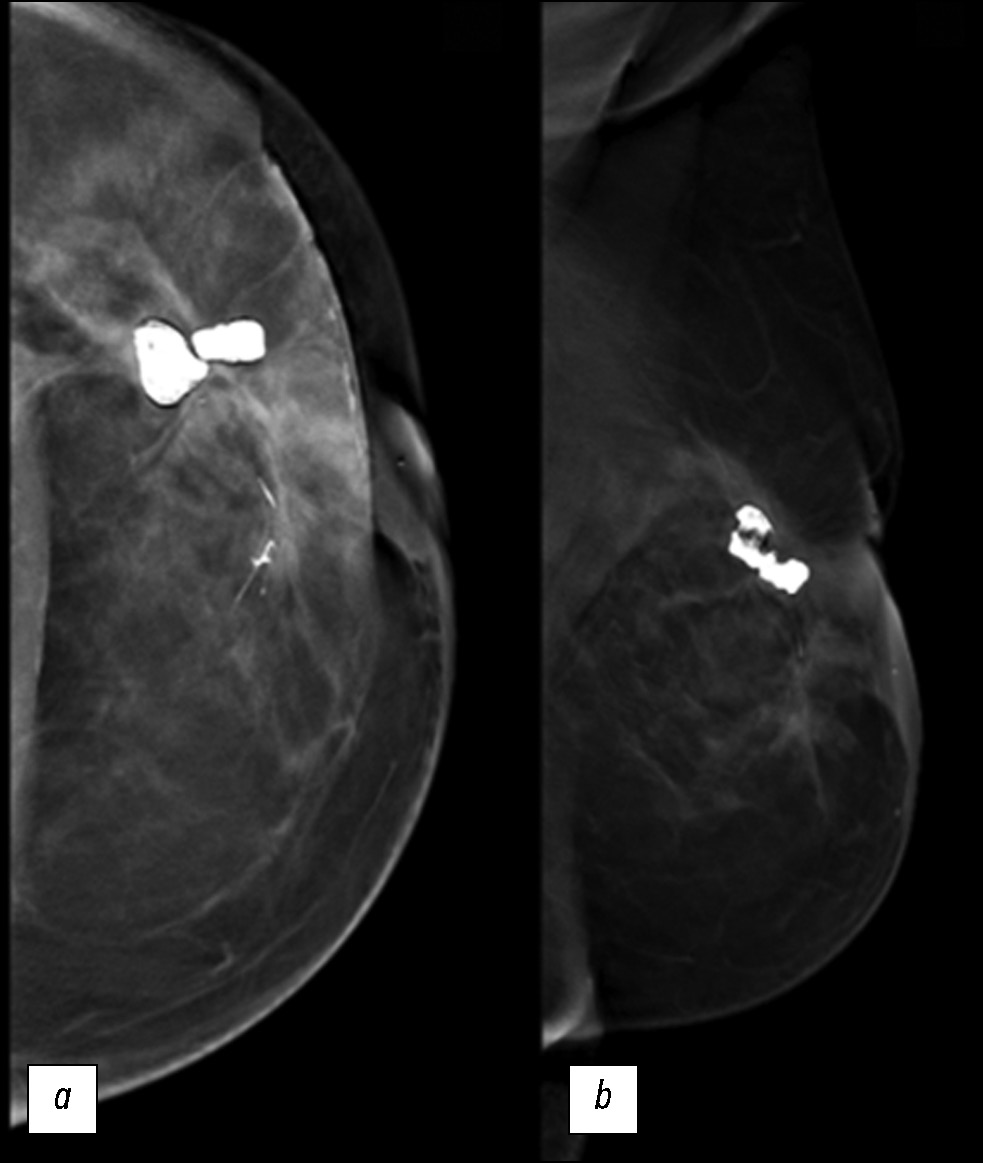
При проведении маммографии визуализировалось гетерогенное образование с неровными нечёткими краями и сопутствующими структурными деформациями, которое распространялось преимущественно в верхний наружный квадрант левой молочной железы и проходило вблизи крупных липонекротических кальцинатов. Наблюдалось также выраженное утолщение кожных покровов. Диаметр очага составил приблизительно 7 см (рис. 1).
Рис. 1. Маммограммы: а — краниокаудальная проекция; b — медиолатеральная (косая) проекция. В верхнем наружном квадранте левой молочной железы наблюдается рентгеноконтрастный очаг, связанный с деформацией паренхимы в результате квадрантэктомии.
По данным ультразвукового исследования, вторичная ангиосаркома молочной железы представляла собой гетерогенное гипоэхогенное образование с неровными краями и акустическим затенением позади. При проведении цветового допплеровского картирования наблюдался усиленный сосудистый рисунок, что свидетельствует о выраженной васкуляризации очага.
Хотя результаты маммографии и ультразвукового исследования содержат ценную информацию о размере, локализации и характеристиках опухолевого очага, для установления окончательного диагноза вторичной ангиосаркомы молочной железы, как правило, требуется гистопатологическое исследование полученных в ходе биопсии образцов опухолевой ткани.
Через несколько дней выполнили толстоигольную биопсию, и результаты гистопатологического исследования образца ткани подтвердили диагноз вторичной ангиосаркомы молочной железы.
Кроме того, провели МРТ для дополнительной оценки степени распространённости опухолевого процесса и выявления других очагов и получения других значимых сведений. По данным динамических последовательностей МРТ, после введения контраста в наружных квадрантах левой молочной железы наблюдался обширный очаг диаметром приблизительно 7 см с гетерогенным контрастированием и инфильтратами в коже и подкожной ткани, которые были более выраженными в области вокруг ареолы соска (рис. 2).
Рис. 2. Магнитно-резонансная томография. T1-взвешенное трёхмерное изображение в аксиальной плоскости на разных уровнях (a, b, c) в рамках первой динамической системы после введения контраста. Очаг неправильной формы с неоднородным контрастированием левой ретроареолярной области и наружного верхнего квадранта.
Дифференциальная диагностика
Дифференциальная диагностика предусматривает разграничение вторичной ангиосаркомы молочной железы и других первичных опухолей и метастазов молочной железы, а также других заболеваний со сходными признаками и симптомами. В качестве дифференциального диагноза можно рассмотреть первичный рак молочной железы или метастаз ранее перенесённого рака молочной железы и других солидных опухолей, например рака лёгкого, рака почки и меланомы. Кроме того, рассмотрены такие дифференциальные диагнозы, как лимфома кожи, первичная саркома молочной железы, неопухолевое поражение кожи, например, дерматит, экзема и гранулёма, а также образования из сосудов кожи, например, гемангиома и сосудистые мальформации [7].
Вмешательства
Пациентку прооперировали, удалив опухоль, после чего провели адъювантную химиотерапию. Несмотря на интенсивное лечение, болезнь прогрессировала с образованием отдалённых метастазов. Вторичная ангиосаркома молочной железы — осложнение ранее проведённого курса терапии по поводу рака молочной железы, что свидетельствует о важности тщательного наблюдения за пациентками и их комплексного ведения для достижения оптимальных исходов. На примере рассматриваемого случая показана необходимость проведения дополнительного обследования для установления первопричинных механизмов развития вторичной ангиосаркомы молочной железы и подбора оптимального лечения.
Последующее наблюдение и исходы
Послеоперационный период протекал без осложнений, пациентка чувствовала себя удовлетворительно, однако через три месяца выявили местный рецидив опухоли и отдалённые метастазы в лёгкие и печень. Несмотря на интенсивный курс лечения, включавший системную химиотерапию и таргетную терапию, состояние пациентки ухудшалось, и через 6 месяцев после установления диагноза она скончалась.
ОБСУЖДЕНИЕ
Вторичная ангиосаркома молочной железы — редкое, но трудно поддающееся лечению злокачественное новообразование, возникающее у пациенток с раком молочной железы в анамнезе, особенно после прохождения лучевой терапии [8, 9].
Комплекс инструментальных исследований, включающий маммографию, ультразвуковое исследование и МРТ, позволяет обнаружить и охарактеризовать опухоль, своевременно поставить диагноз вторичной ангиосаркомы молочной железы и подобрать подходящее лечение. Такой комплексный междисциплинарный подход предусматривает разработку индивидуального плана лечения для каждой пациентки с участием онкологов, хирургов, радиотерапевтов и патоморфологов [10, 11]. Хирургическая резекция — основной метод лечения опухолей, который заключается в полном удалении очага с сохранением функции органа. Адъювантная лучевая терапия направлена на снижение риска возникновения местного рецидива. Системная терапия применяется в качестве паллиативной помощи на поздних стадиях заболевания.
Хотя и существует неблагоприятный прогноз по причине высокого риска рецидива и образования метастазов, достичь оптимального исхода можно, если выявить опухоль на ранней стадии и своевременно начать лечение. Скорость прогрессирования заболевания и его исходы зависят от степени злокачественности опухоли, её размера, гистологического типа и статуса краёв резекции [12].
Несмотря на существенное повышение качества диагностики и эффективности лечения, вторичная ангио-саркома молочной железы по-прежнему трудно поддаётся лечению и требует дополнительного изучения с целью установления первопричинного молекулярного механизма развития опухоли и выявления новых мишеней для терапии. Ключевую роль в поисках путей оптимизации исходов лечения играют совместные клинические исследования и многопрофильные онкологические советы, что свидетельствует о важности комплексного подхода к ведению онкологических пациентов для повышения их выживаемости [11–14]. Результаты анализа рассматриваемого случая подтверждают значимость тщательного наблюдения и комплексного подхода к ведению пациенток с вторичной ангиосаркомой молочной железы и подчёркивают необходимость более углублённого изучения этой редкой опухоли с целью повышения эффективности её лечения.
ЗАКЛЮЧЕНИЕ
Вторичная ангиосаркома — сложно поддающаяся диагностике и лечению злокачественная опухоль с ограниченным выбором вариантов терапии и неблагоприятным прогнозом. Несмотря на существенное повышение качества диагностики и эффективности лечения, выживаемость пациентов по-прежнему остаётся низкой по причине агрессивного характера опухоли, высокой частоты развития местных рецидивов и образования отдалённых метастазов. Успех лечения в значительной степени зависит от комплексного подхода к ведению пациентов, который предусматривает раннее выявление опухоли, постановку верного диагноза и своевременное начало лечения. Невзирая на интенсивное лечение, частота рецидивов остаётся высокой. При вторичных ангиосаркомах важно тщательно наблюдать за состоянием пациентов и предоставлять необходимую паллиативную помощь. Необходимо провести дополнительные исследования для изучения молекулярных механизмов развития вторичных ангиосарком и выявления новых мишеней для терапии. В рамках клинических исследований следует оценить новые методы лечения, в том числе комбинированные, на предмет их влияния на исходы.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении работы.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Наибольший вклад распределён следующим образом: M. Balbino, M. Montatore, F. Masino, G. Guglielmi — концепция и дизайн работы; M. Montatore, F. Masino — сбор данных; G. Guglielmi, F.A. Carpagnano — анализ и интерпретация данных M. Balbino, F.A. Carpagnano, G. Guglielmi — написание и редактирование текста статьи.
Информированное согласие на публикацию. Авторы получили письменное согласие пациентки на публикацию медицинских данных и фотографий в обезличенной форме в журнале Digital Diagnostics.
ADDITIONAL INFORMATION
Funding source. This article was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
M. Balbino, M. Montatore, F. Masino, G. Guglielmi — work conception and design; M. Montatore, F. Masino — data collection; G. Guglielmi, F.A. Carpagnano — data analysis and interpretation; M. Balbino, F.A. Carpagnano, G. Guglielmi — writing and editing the manuscript.
Consent for publication. Written consent was obtained from the patient for publication of relevant medical information and all of accompanying images within the manuscript in Digital Diagnostics Journal.
About the authors
Marina Balbino
Foggia University School of Medicine
Email: marinabalbino93@gmail.com
ORCID iD: 0009-0009-2808-5708
MD
Italy, FoggiaManuela Montatore
Foggia University School of Medicine
Email: manuela.montatore@unifg.it
ORCID iD: 0009-0002-1526-5047
MD
Italy, FoggiaFederica Masino
Foggia University School of Medicine
Email: federicamasino@gmail.com
ORCID iD: 0009-0004-4289-3289
MD
Italy, FoggiaFrancesca A. Carpagnano
Dimiccoli Hospital
Email: c.francesca1991@gmail.com
ORCID iD: 0000-0001-7681-2898
MD
Italy, BarlettaGiuseppe Guglielmi
Foggia University School of Medicine; Dimiccoli Hospital; IRCCS Casa Sollievo della Sofferenza Hospit
Author for correspondence.
Email: giuseppe.guglielmi@unifg.it
ORCID iD: 0000-0002-4325-8330
MD, Professor
Italy, Foggia; Barletta; San Giovanni RotondoReferences
- Fraga-Guedes C, André S, Mastropasqua MG, et al. Angiosarcoma and atypical vascular lesions of the breast: Diagnostic and prognostic role of MYC gene amplification and protein expression. Breast cancer research and treatment. 2015;151(1):131–140. doi: 10.1007/s10549-015-3379-2
- Esposito E, Avino F, di Giacomo R, et al. Angiosarcoma of the breast, the unknown—a review of the current literature. Translational Cancer Research. 2019;8 Suppl 5:S510–S517. doi: 10.21037/tcr.2019.07.38
- Issar P, Ravindranath M, Dewangan M, Issar AK. Primary angiosarcoma of the breast: a rare case report in postmenopausal women. The Indian journal of radiology & imaging. 2022;32(4):607–610. doi: 10.1055/s-0042-1754358
- Sasahara A, Tanabe M, Hayashi K, et al. A case of primary breast angiosarcoma with multiple discontinuous small lesions. Surgical case reports. 2019;5(1):157. doi: 10.1186/s40792-019-0704-8
- An R, Men XJ, Ni XH, et al. Angiosarcoma of the breast: A review. Heliyon. 2024;10(3):e24413. doi: 10.1016/j.heliyon.2024.e24413
- Agha RA, Franchi T, Sohrabi C, et al. For the SCARE Group the SCARE 2020 Guideline: updating consensus Surgical CAse REport (SCARE) guidelines. International journal of surgery. 2020;84:226–230. doi: 10.1016/j.ijsu.2020.10.034
- Karlin NJ, Wong DA. Mesenchymal Neoplasms and Primary Lymphomas of the Breast. The Breast (Fifth Edition). 2018:156–168.e6. doi: 10.1016/B978-0-323-35955-9.00011-8
- Li GZ, Raut CP, Hunt KK, et al. Breast Sarcomas, Phyllodes Tumors, and Desmoid Tumors: Epidemiology, Diagnosis, Staging, and Histology-Specific Management Considerations. American Society of Clinical Oncology educational book. 2021;41:390–404. doi: 10.1200/EDBK_321341
- Žatecký J, Coufal O, Fabian P, et al. Primary Breast Sarcoma: A Two-Centre Analysis and Review of Literature. Breast Care (Basel). 2023;18(4):262–269. doi: 10.1159/000530934
- Zelek L, Llombart-Cussac A, Terrier P, et al. Prognostic Factors in Primary Breast Sarcomas: A Series of Patients with Long-Term Follow-Up. Journal of clinical oncology. 2003;21(13):2583–2588. doi: 10.1200/JCO.2003.06.080
- Yin M, Mackley HB, Drabick JJ, Harvey HA. Primary female breast sarcoma: clinicopathological features, treatment, and prognosis. Scientific reports. 2016;6:31497. doi: 10.1038/srep31497
- Duncan MA, Lautner MA. Sarcomas of the Breast. The Surgical clinics of North America. 2018;98(4):869–876. doi: 10.1016/j.suc.2018.03.013
- Sato F, Yamamoto T. Breast angiosarcoma after primary breast cancer surgery: A systematic review. Journal of plastic, reconstructive & aesthetic surgery. 2022;75(9):2882–2889. doi: 10.1016/j.bjps.2022.06.046
- Bousquet G, Confavreux C, Magné N, et al. Outcome and prognostic factors breast sarcoma: a multicenter study from the rare cancer network. Radiotherapy and oncology. 2007;85(3):355–361. doi: 10.1016/j.radonc.2007.10.015
Supplementary files