Частота сердечных осложнений у детей, выявленных после радикальной коррекции тетрады Фалло с помощью компьютерной томографии
- Авторы: Каблуллина А.М.1, Синицын В.Е.2, Рахимжанова Р.И.1, Даутов Т.Б.3, Садуакасова А.Б.4, Калиев Б.Б.1, Бастарбекова Л.А.1, Молдаханова Ж.А.1
-
Учреждения:
- Медицинский университет Астана
- Московский государственный университет имени М.В. Ломоносова
- Национальный научный кардиохирургический центр Республики Казахстан
- Больница Медицинского центра Управления делами Президента Республики Казахстан
- Выпуск: Том 4, № 3 (2023)
- Страницы: 268-279
- Раздел: Оригинальные исследования
- Статья получена: 02.05.2023
- Статья одобрена: 09.06.2023
- Статья опубликована: 26.09.2023
- URL: https://jdigitaldiagnostics.com/DD/article/view/375285
- DOI: https://doi.org/10.17816/DD375285
- ID: 375285
Цитировать
Аннотация
Обоснование. Частота возникновения тетрады Фалло составляет примерно 0,5/1000 живорождённых, что соответствует 7–10% всех случаев врождённых пороков сердца и является второй по частоте формой сложных врождённых пороков сердца. Достижения в области диагностики, хирургического и послеоперационного лечения тетрады Фалло привели к тому, что всё большее число пациентов этой категории достигает зрелого возраста, при этом наблюдается резкое увеличение выживаемости (почти до 90%) к 30 годам, что требует длительного мониторинга определённых анатомических параметров для своевременного выявления осложнений. Данное исследование направлено на изучение частоты осложнений, выявленных с помощью компьютерной томографии, после радикальной коррекции тетрады Фалло у пациентов детского возраста.
Цель ― выявить с помощью компьютерной томографии маркеры наиболее часто встречающихся осложнений после коррекции тетрады Фалло у пациентов детского возраста.
Материалы и методы. Проведён ретроспективный анализ данных 613 пациентов с тетрадой Фалло за период с октября 2011 по июнь 2020 года. В исследование были включены 116 пациентов, из них 69 мужского и 47 женского пола, у которых после коррекции тетрады Фалло возникли осложнения, выявленные с помощью компьютерной томографии. На момент операции средний возраст пациентов составлял от 10 до 36 (в среднем 12) месяцев, средняя масса тела 21 кг, средний рост 105,4 см, средняя площадь поверхности тела 0,74 м2. Средний возраст пациентов на момент проведения компьютерной томографии составил 17,5 (возрастной диапазон 7–36) лет.
Результаты. Среди 116 пациентов с осложнениями после коррекции тетрады Фалло у 49 был стеноз лёгочной артерии, у 92 ― стеноз ветвей лёгочной артерии (из них у 56 ― основной ветви левой лёгочной артерии, у 36 ― основной ветви правой лёгочной артерии), у 8 ― стеноз выходного тракта правого желудочка, у 32 ― дефект межжелудочковой перегородки, у 1 ― тромбоз шунта, у 12 ― послеоперационная деформация лёгочной артерии, у 10 ― выраженная дилатация правого желудочка, у 2 ― аневризма выходного тракта правого желудочка, в 6 случаях ― кальцификация и стеноз кондуита. У пациентов со стенозом ветви левой лёгочной артерии вероятность развития стеноза ветви правой лёгочной артерии была в 6,5 раз выше (p <0,001).
Заключение. Наиболее частыми осложнениями, выявляемыми с помощью компьютерной томографии после коррекции тетрады Фалло, были стеноз лёгочной артерии и её ветвей. Пациенты со стенозом лёгочной артерии и её ветвей не имели существенных различий по возрасту, антропометрическим параметрам (рост, вес, площадь поверхности тела) и гендерному распределению при наличии или отсутствии различных типов стеноза (лёгочной артерии, правой или левой лёгочной артерии), однако стеноз правой лёгочной артерии повышает вероятность развития стеноза левой ветви.
Полный текст
Список сокращений
ВТПЖ ― выходной тракт правого желудочка
ДМП ― дефект межжелудочковой перегородки
КТ ― компьютерная томография
МРТ ― магнитно-резонансная томография
МСКТ ― мультиспиральная компьютерная томография
ТФ ― тетрада Фалло
ОБОСНОВАНИЕ
Тетрада Фалло (ТФ) составляет 7–10% всех случаев врождённых пороков сердца, встречается у 0,5/1000 живорождённых и является второй по частоте формой сложных врождённых пороков сердца [1]. Достижения в области диагностики, хирургического и послеоперационного лечения ТФ привели к тому, что всё большее число пациентов этой категории достигает зрелого возраста, при этом наблюдается резкое увеличение выживаемости (почти до 90%) к 30 годам [2], что требует длительного мониторинга определённых анатомических параметров для своевременного выявления осложнений.
После коррекции ТФ необходимо использовать средства визуализации для оценки объёма правого желудочка и перегрузки давлением вследствие трёхстворчатой и лёгочной регургитации или стеноза, для сканирования на предмет систолической и диастолической дисфункции правого и левого желудочков, наличия послеоперационных рубцов, аневризмы и фиброза правого желудочка, а также сопутствующих аномалий, таких как расширение корня аорты и аортальная недостаточность [1].
Неинвазивная визуализация играет важную роль в наблюдении за пациентами после коррекции ТФ. Трансторакальная эхокардиография является основным и рутинным инструментом клинического исследования для анатомической и функциональной оценки, необходимой в таких случаях, однако важно отметить, что её результаты во многом зависят от операторов оборудования. Компьютерную (КТ) и магнитно-резонансную (МРТ) томографию сердца обычно используются для этих целей в качестве дополнительных инструментов [3, 4].
Важнейшую роль в оценке сложных анатомических находок у пациентов с ТФ до и после коррекции играет мультиспиральная компьютерная томография (МСКТ), обладающая высоким пространственно-временным разрешением [2]. КТ сердца позволяет получить необходимую функциональную и анатомическую информацию для принятия обоснованных решений в сложных случаях врождённых пороков сердца. Для интерпретации изображений необходимы знания об общих подходах к оперативному лечению и остаточных гемодинамических нарушениях [5]. На сегодняшний день технический прогресс позволяет получать высококачественные снимки и заметно снижать дозу облучения при КТ сердца. При определённых показаниях технология может дать более полную информацию с меньшим риском по сравнению с другими диагностическими методами, что может оказаться полезным при оценке ТФ [1]. МРТ сердца у маленьких детей, напротив, имеет ряд ограничений, в частности длительность исследования, требующую седации с сохранением сознания или общей анестезии, и относительно низкое пространственное разрешение, что отчасти объясняет малочисленность данных МРТ сердца у маленьких детей с ТФ в литературе. Кроме того, КТ не создаёт помех для кардиостимуляторов и дефибрилляторов, даже в старых моделях, несовместимых с МР-томографами.
Цель исследования ― изучение частоты осложнений у пациентов детского возраста после радикальной коррекции ТФ, выявленных с помощью КТ.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
Данное ретроспективное исследование проведено в высокоспециализированном госпитале третичного звена. КТ сердца проводили в рамках стандартной клинической практики с декабря 2011 по июнь 2020 года пациентам с коррекцией ТФ в анамнезе, проходившим лечение в отделениях кардиоторакальной хирургии и кардиологии.
Выполнен ретроспективный анализ данных 613 пациентов с ТФ. Из 613 проведённых КТ-исследований сердца 138 были выполнены до хирургического вмешательства, 25 ― после паллиативной операции (шунтирование, установка стента в выходной тракт правого желудочка или расширение выходного тракта правого желудочка), 424 ― после тотальной хирургической коррекции ТФ (закрытие дефекта межжелудочковой перегородки) и устранение обструкции выходного тракта правого желудочка), 26 ― после замены клапана лёгочной артерии (состоящей из 4 этапов лечения).
По результатам КТ мы отобрали данные 116 пациентов (69 мужчин и 47 женщин) с осложнениями после радикальной коррекции ТФ. На момент операции средний возраст пациентов составлял от 10 до 36 (в среднем 12) месяцев, средняя масса тела 21 кг, средний рост 105,4 см, средняя площадь поверхности тела 0,74 м2. Средний возраст пациентов на момент проведения КТ составил 17,5 (возрастной диапазон 7–36) лет (табл. 1).
Таблица 1. Общая характеристика пациентов (n=116)
Характеристика пациентов | Частота (в среднем) |
Пол, n (%) | |
Мужчины | 69 (59) |
Женщины | 47 (41) |
Возраст при первичной коррекции, мес | 12 (10–36) |
Предшествующее шунтирование, n (%) | 25 (21,5) |
Первичная коррекция | |
Трансаннулярная пластика, n (%) | 67 (57,7) |
Миэктомия/вальвулотомия, n (%) | 40 (35,5) |
Клапаносодержащий кондуит Contegra, n (%) | 9 (7,7) |
Масса тела, кг | 21,08 |
Рост, см | 105,4 |
Площадь поверхности тела, м2 | 0,7 |
Критерии соответствия
Из исследования были исключены пациенты со следующими заболеваниями: аллергия на йод; высокий уровень креатинина; взрослые пациенты с ТФ, не подвергавшейся коррекции (n=4). В дальнейшем применялись следующие критерии включения: наличие информированного согласия; предварительная коррекция ТФ.
Компьютерная томография сердца
Детям, перенёсшим паллиативные операции и коррекцию ТФ, сканирование проводилось на компьютерном томографе SOMATOM Definition AS 64 (Германия) в радиологическом отделении. Сканирование выполняли с проспективной кардиосинхронизацией и реконструкцией, толщиной среза 0,6 мм.
Все пациенты обследованы в положении лёжа, головой вперёд, с внутривенным болюсным введением препарата через автоматический бескамерный инжектор Ohiotandem со скоростью инфузии 1–2 мл/с.
Для седации младенцев и детей младшего возраста до 4 лет использовали перорально хлоралгидрат (75 мг/ кг) и кетамин (1 мг/кг). Для детей старшего возраста и взрослых седация не применялась.
Для оптимизации дозы облучения при проведении КТ в нашем учреждении использовались стандартные протоколы, адаптированные к размерам тела. В их основу положены соотношения массы тела и размера сердечной тени, наблюдаемой на ориентировочных снимках, что позволило определить оптимальное произведение силы тока на время ротации трубки [6].
Этическая экспертиза
Исследование одобрено Комитетом по этике Национального исследовательского кардиохирургического центра (разрешение № 01-92/2021 от 22.04.2021). Предполагаемых рисков для участников не выявлено. В процессе сбора данных все персональные данные были закодированы и обезличены для защиты прав пациентов и предотвращения разглашения личной информации. Исследователи имели доступ к электронной базе данных, содержащей только информацию о демографических и клинических характеристиках пациентов, которую анализировали и представляли в обобщённом виде, обеспечивая тем самым её конфиденциальность. Исследование проводилось в соответствии с принципами Хельсинкской декларации. Перед участием в исследовании от всех пациентов или их законных представителей было получено информированное согласие.
Статистический анализ
Описательные данные представлены в процентах (для категориальных переменных), при необходимости ― как среднее значение ± стандартное отклонение или медиана (интерквартильный размах). Когорты были разделены на две группы: выжившие и умершие пациенты. Категориальные переменные сравнивали с помощью χ2-теста, непрерывные ― с помощью t-теста или U-теста Манна–Уитни.
Сравнение между тремя группами проводилось посредством бивариационного анализа для нормально распределённых величин. С помощью такого же анализа оценивали связь между стенозом лёгочной артерии и другими переменными. Для оценки взаимосвязи между функциональными параметрами, исследованными в трёх различных группах, использовали коэффициент корреляции Пирсона или коэффициент ранговой корреляции Спирмена. p-Значения были двусторонними и считались значимыми при <0,005 во всех видах анализа.
Статистическую обработку данных выполняли с использованием программы SPSS (версия 24.0, IBM Corp.).
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
В ретроспективном исследовании, проведённом в период с октября 2011 по июнь 2020 года, приняли участие 613 пациентов с ТФ. По результатам КТ выявлены 116 пациентов с осложнениями после радикальной коррекции ТФ. У 49 пациентов после коррекции обнаружен стеноз лёгочной артерии (табл. 2), у 92 ― стеноз ветвей лёгочной артерии, у 56 из них стеноз затрагивал основную ветвь левой лёгочной артерии (табл. 3), у 36 ― основную ветвь правой лёгочной артерии (табл. 4). Кроме того, у 8 пациентов был диагностирован стеноз выходного тракта правого желудочка (ВТПЖ), у 32 ― дефект межжелудочковой перегородки (ДМП), у 1 ― тромбоз шунта, у 12 ― послеоперационная деформация лёгочной артерии, у 10 ― выраженная дилатация правого желудочка, у 2 ― аневризма ВТПЖ, у 6 ― кальцификация и стеноз кондуита (рис. 1).
Таблица 2. Сравнение медицинских характеристик пациентов с наличием и отсутствием стеноза лёгочной артерии (n=116)
Переменная | Нет (n=67) | Да (n=49) | p |
Возраст, мес | 28,5 (29,5) | 24,6 (27) | 0,48 |
Рост, см | 107,1 (29,4) | 103,1 (29,8) | 0,47 |
Масса тела, кг | 22,6 (17,4) | 19 (12,9) | 0,23 |
Площадь поверхности тела | 0,75 (0,29) | 0,72 (0,34) | 0,5 |
Пол | 0,14 | ||
Мужчины | 36 (52,2%) | 33 (47,8%) | |
Женщины | 31 (66%) | 16 (34%) | |
Паллиативная операция | 0,8 | ||
Нет | 52 (57,1%) | 39 (42,9%) | |
Да | 15 (60%) | 10 (40%) | |
Тип тетрады Фалло | 0,08 | ||
Стеноз лёгочной артерии | 56 (55%) | 46 (45%) | |
Атрезия лёгочной артерии | 11 (79%) | 3 (21%) | |
Тип операции | 0,69 | ||
Трансаннулярная пластика | 38 (56,7%) | 29 (43,3%) | |
Без трансаннулярной пластики | 23 (56,1%) | 18 (43,9%) | |
Кондуит | 6 (75%) | 2 (25%) | |
Тромбоз шунта | 0,58 | ||
Нет | 66 (57,4%) | 49 (42,6%) | |
Да | 1 (100%) | 0 | |
Дефект межжелудочковой перегородки | 0,84 | ||
Нет | 49 (58,3%) | 35 (41,7%) | |
Да | 18 (56,3%) | 14 (43,7%) | |
Стеноз выходного тракта правого желудочка | 0,26 | ||
Нет | 61 (56,5%) | 47 (43,5%) | |
Да | 6 (75%) | 2 (25%) | |
Аневризма выходного тракта правого желудочка | 0,33 | ||
Нет | 65 (57%) | 49 (43%) | |
Да | 2 (100%) | 0 | |
Деформация лёгочной артерии | 0,61 | ||
Нет | 60 (58%) | 44 (42,3%) | |
Да | 7 (58,3%) | 5 (41,7%) | |
Стеноз правой лёгочной артерии | 0,93 | ||
Нет | 46 (57,5%) | 34 (42,5%) | |
Да | 21 (58,3%) | 15 (41,7%) | |
Стеноз левой лёгочной артерии | 0,03* | ||
Нет | 29 (48,3%) | 31 (51,7%) | |
Да | 38 (67,9%) | 18 (32,1%) | |
Расширение правого желудочка | 0,58 | ||
Нет | 61 (57,6%) | 45 (42,4%) | |
Да | 6 (60%) | 4 (40%) | |
Кальцификация и стеноз кондуита | 0,19 | ||
Нет | 62 (56,4%) | 48 (43,6%) | |
Да | 5 (83,3%) | 1 (16,7%) | |
Примечание. * Критерий хи-квадрат; ОШстенозЛЛА да=0,44, т.е. отношение шансов (ОШ) развития стеноза лёгочной артерии у лиц со стенозом левой лёгочной артерии (ЛЛА) в 0,44 раза (56%) ниже, чем у тех, у кого стеноз левой лёгочной артерии не выявлен.
Таблица 3. Сравнение медицинских характеристик пациентов с наличием и отсутствием стеноза левой лёгочной артерии (n=116)
Переменная | Нет (n=60) | Да (n=56) | p |
Возраст, мес | 29,3 (32,2) | 24,3 (24,1%) | 0,35 |
Рост, см | 108 (28,3) | 102 (30,7) | 0,3 |
Масса тела, кг | 20,3 (12,4) | 21,9 (18,7) | 0,6 |
Площадь поверхности тела | 0,76 (0,33) | 0,72 (0,29) | 0,46 |
Пол | 0,1 | ||
Мужчины | 40 (58%) | 29 (42%) | |
Женщины | 20 (42,6%) | 27 (57,4%) | |
Паллиативная операция | 0,35 | ||
Нет | 45 (49,5%) | 46 (50,5%) | |
Да | 15 (60%) | 10 (40%) | |
Тип тетрады Фалло | 0,06 | ||
Стеноз лёгочной артерии | 56 (55%) | 46 (45%) | |
Атрезия лёгочной артерии | 4 (28,6%) | 10 (71,4%) | |
Тип операции | 0,96 | ||
Трансаннулярная пластика | 34 (50,8%) | 33 (49,2%) | |
Без трансаннулярной пластики | 22 (53,7%) | 19 (46,3%) | |
Кондуит | 4 (50%) | 4 (50%) | |
Тромбоз шунта | 0,52 | ||
Нет | 59 (51,3%) | 56 (48,7%) | |
Да | 1 (100%) | 0 | |
Дефект межжелудочковой перегородки | 0,024* | ||
Нет | 38 (45,2%) | 46 (54,8%) | |
Да | 22 (68,8%) | 10 (31,3) | |
Стеноз выходного тракта правого желудочка | 0,6 | ||
Нет | 56 (51,8%) | 52 (48,2%) | |
Да | 4 (50%) | 4 (50%) | |
Аневризма выходного тракта правого желудочка | 0,23 | ||
Нет | 60 (52,6%) | 54 (47,4%) | |
Да | 0 | 2 (100%) | |
Деформация лёгочной артерии | - | ||
Нет | 56 (53,8%) | 48 (46,2%) | 0,15 |
Да | 4 (33,3%) | 8 (66,7%) | |
Расширение правого желудочка | 0,42 | ||
Нет | 54 (51%) | 52 (49%) | |
Да | 6 (60%) | 4 (40%) | |
Кальцификация и стеноз кондуита | 0,63 | ||
Нет | 57 (51,8%) | 53 (48,2%) | |
Да | 3 (50%) | 3 (50%) | |
Примечание. * Критерий хи-квадрат; ОШДМП да=0,38, т.е. отношение шансов (ОШ) развития стеноза левой лёгочной артерии в 0,38 раза (62%) ниже для пациентов с дефектом межжелудочковой перегородки по сравнению с теми, у кого дефект межжелудочковой перегородки не выявлен.
Таблица 4. Сравнение медицинских характеристик пациентов с наличием и отсутствием стеноза правой лёгочной артерии (n=116)
Переменная | Нет (n=80) | Да (n=36) | p |
Возраст, мес | 26 (29,5) | 28,7 (26,8) | 0,64 |
Рост, см | 107,8 (28,2) | 100 (31,9) | 0,19 |
Масса тела, кг | 20 (12) | 23,6 (22) | 0,26 |
Площадь поверхности тела | 0,75 (0,32) | 0,72 (0,29) | 0,61 |
Пол | 0,32 | ||
Мужчины | 50 (72,5%) | 19 (27,5%) | |
Женщины | 30 (63,8%) | 17 (36,2%) | |
Паллиативная операция | 0,35 | ||
Нет | 64 (70,3%) | 27 (29,7%) | |
Да | 16 (64%) | 9 (36%) | |
Тип тетрады Фалло | 0,45 | ||
Стеноз лёгочной артерии | 71 (69,6%) | 31 (30,4%) | |
Атрезия лёгочной артерии | 9 (64,3%) | 5 (35,7%) | |
Тип операции | 0,86 | ||
Трансаннулярная пластика | 47 (70,2%) | 20 (29,8%) | |
Без трансаннулярной пластики | 28 (68,3%) | 13 (31,7%) | |
Кондуит | 5 (62,5%) | 3 (37,5%) | |
Тромбоз шунта | 0,69 | ||
Нет | 79 (68,7%) | 36 (31,3%) | |
Да | 1 (100%) | 0 | |
Дефект межжелудочковой перегородки | 0,68 | ||
Нет | 57 (67,9%) | 27 (32,1%) | |
Да | 23 (71,9%) | 9 (28,1%) | |
Стеноз выходного тракта правого желудочка | 0,52 | ||
Нет | 74 (68,5%) | 34 (31,5%) | |
Да | 6 (75%) | 2 (25%) | |
Аневризма выходного тракта правого желудочка | 0,09 | ||
Нет | 80 (70,2%) | 34 (29,8%) | |
Да | 0 | 2 (100%) | |
Деформация лёгочной артерии | 0,55 | ||
Нет | 72 (69,2%) | 32 (30,8%) | |
Да | 8 (66,7%) | 4 (33,3%) | |
Стеноз левой лёгочной артерии | <0,001* | ||
Нет | 52 (86,7%) | 8 (13,3%) | |
Да | 28 (50%) | 28 (50%) | |
Расширение правого желудочка | 0,62 | ||
Нет | 73 (68,9%) | 33 (31,1%) | |
Да | 7 (70%) | 3 (30%) | |
Кальцификация и стеноз кондуита | 0,39 | ||
Нет | 75 (68,2%) | 35 (31,8%) | |
Да | 5 (83,3%) | 1 (16,7%) | |
Примечание. * Критерий хи-квадрат; ОШЛЛА да=6,5, т.е. отношение шансов (ОШ) развития стеноза правой лёгочной артерии в 6,5 раза (550%) выше у пациентов со стенозом левой лёгочной артерии (ЛЛА) в сравнении с теми, у кого стеноз левой лёгочной артерии не выявлен.
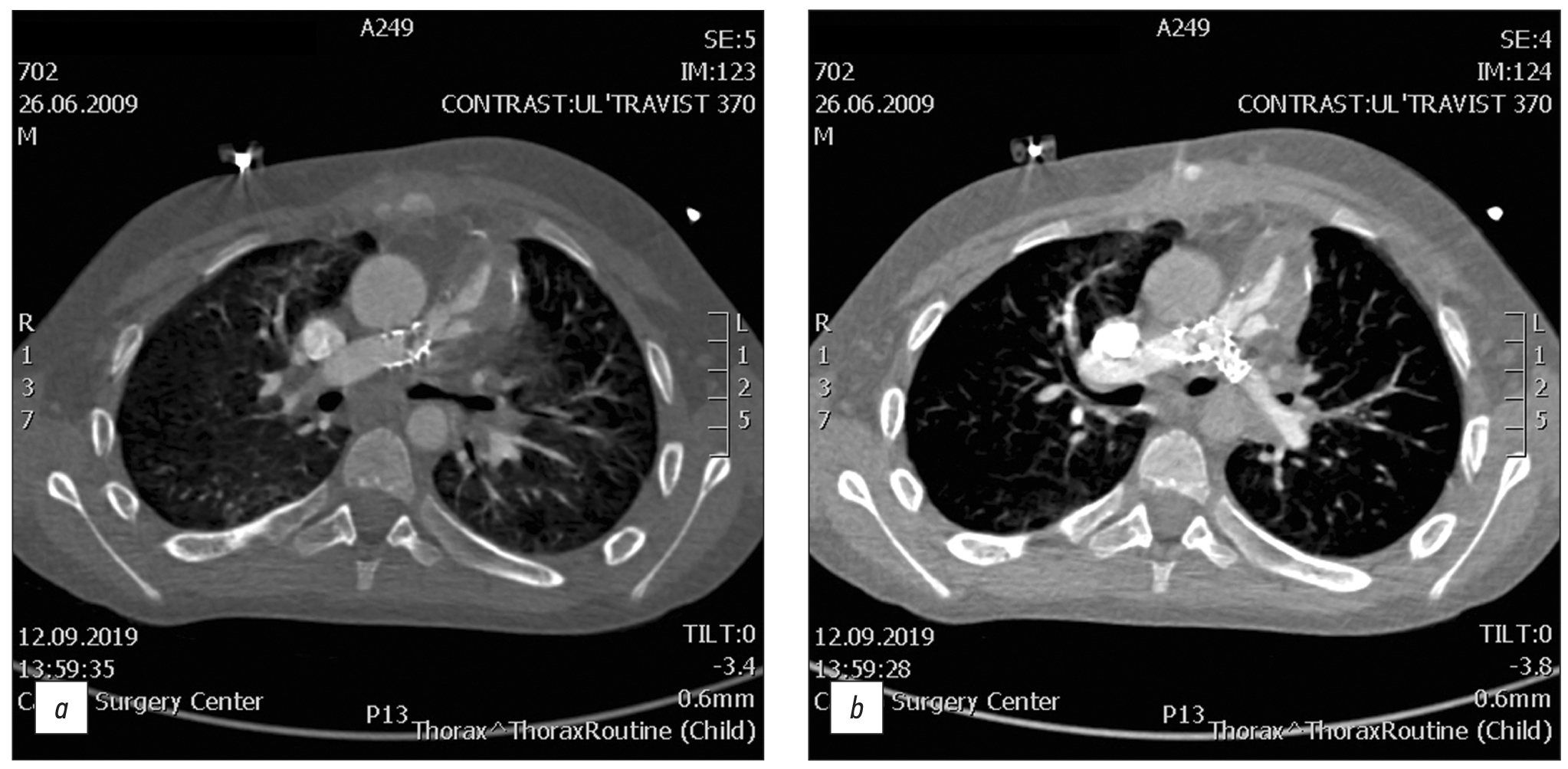
На рис. 1 представлены снимки 12-летнего мальчика после коррекции ТФ, которому установили клапансодержащий кондуит Contegra № 16 и двусторонние стенты Palmaz Genesis XD 19-10. КТ сердца чётко демонстрирует тромбоз кондуита. Все осложнения, выявленные на КТ, подтверждены результатами ангиографии, после чего пациент был прооперирован.
Рис. 1. Компьютерная томография клапансодержащего кондуита Contegra № 16 (a) и двусторонних стентов Palmaz Genesis XD 19-10 (b).
Основные результаты исследования
Наиболее частые осложнения ― стеноз лёгочной артерии и её ветвей. Мы решили сравнить медицинские характеристики пациентов со стенозом и без стеноза лёгочной артерии и её ветвей с помощью бивариационного анализа и оценки отношения шансов.
При сравнении трёх пар данных не выявлено существенных различий в возрасте, антропометрических параметрах (рост, вес, площадь поверхности тела) и гендерном распределении пациентов при наличии или отсутствии у них различных типов стеноза (лёгочной артерии, правой или левой лёгочной артерии). Кроме того, не выявлено значимых различий по типу ТФ, наличию тромбоза шунта и паллиативной операции, а также типу выполненного хирургического вмешательства (p >0,05). Фактически данные групп сравнения были сопоставимы по вышеуказанным критериям.
Пациенты с ДМП имели более низкий риск развития стеноза левой лёгочной артерии [отношение шансов (ОШ) 0,039; 95% доверительный интервал (ДИ) 0,16–0,89; p <0,005]. В то же время наличие ДМП не было связано с риском развития стеноза лёгочной артерии или её правой ветви (p >0,005).
Как видно из табл. 2 и 3, значимых ассоциаций между наличием стеноза или аневризмы ВТПЖ и развитием стеноза лёгочной артерии, её правой или левой ветвей не обнаружено. Аналогичные результаты получены в отношении наличия или отсутствия деформации лёгочной артерии (p >0,005).
Вероятность развития стеноза лёгочной артерии была достоверно ниже (ОШ 0,44; 95% ДИ 0,21–0,94; p <0,005) у пациентов со стенозом левой, но не правой лёгочной артерии (p >0,005). В то же время у пациентов со стенозом левой лёгочной артерии вероятность развития стеноза правой лёгочной артерии была в 6,5 раза выше (95% ДИ 2,62–16,15; p <0,001).
Значимой связи между дилатацией правого желудочка или кальцификацией и стенозом кондуита и развитием стеноза лёгочной артерии, её левой или правой ветви не выявлено (p >0,005).
ОБСУЖДЕНИЕ
Всё большее число взрослых пациентов с врождёнными пороками сердца нуждаются в пожизненном наблюдении посредством диагностической визуализации с использованием КТ и МРТ сердца. Для таких пациентов характерен большой спектр уникальных анатомических и функциональных изменений, возникших в результате одномоментной или многоэтапной паллиативной и хирургической коррекции. Рентгенологи, выполняющие диагностическую задачу по мониторингу эффекта лечения и выявлению возможных осложнений, должны знать типичные результаты КТ и МРТ сердца, наблюдаемые у взрослых пациентов после коррекции сложных форм врождённых пороков сердца [7].
Благодаря высокому пространственно-временному разрешению, а также возможности получения высококачественных трёхмерных реконструированных изображений, МСКТ стала основным методом исследования у ряда пациентов, преимущественно при оценке лёгочной артерии и основных аортолёгочных коллатеральных артерий [8]. В данном исследовании обнаружено, что наиболее частыми осложнениями, возникающими после радикальной коррекции ТФ, являются стеноз лёгочной артерии и её ветвей.
Эхокардиография по-прежнему считается основным методом оценки послеоперационных осложнений у пациентов с врождёнными пороками сердца, что обусловлено её известными преимуществами: безопасностью, доступностью, отсутствием ионизирующего излучения, а также превосходными возможностями в визуализации внутрисердечной анатомии и физиологических функций сердца. Однако из-за зависимости результатов исследования от оператора и узкого акустического окна эхокардиография сопряжена с трудностями визуализации внесердечной анатомии, а также с рядом проблем при количественной оценке размеров, функций и клапанной регургитации правого желудочка [9].
КТ и МРТ сердца относятся к малоинвазивным методам оценки внесердечных послеоперационных сосудистых осложнений, однако КТ сердца превосходит по своим возможностям МРТ в аспектах распознавания внутрисердечных анатомических элементов, оценки анатомии мелких сосудов (включая лёгочные вены, дистальные ветви лёгочной артерии и аортопульмональные коллатерали), выявления функциональных и структурных аномалий или осложнений после хирургических вмешательств у пациентов с врождённым пороком сердца. Таким образом, КТ уверенно становится неоценимым средством визуализации, способным восполнить пробелы между эхокардиографией, катетеризацией сердца и МРТ сердца [10].
При хирургической коррекции ТФ используются различные типы кондуитов. Непосредственные послеоперационные результаты превосходны, но со временем возникает прогрессирующая обструкция кондуита из-за несоответствия анатомических особенностей пациента и протеза, стеноза дистального анастомоза, перекручивания кондуита, тромбоза и развития кальцификатов. МСКТ позволяет точно определить точный механизм обструкции кондуита, а также оценить уровень, степень и протяжённость стеноза [2].
Трансаннулярная пластика часто приводит к дилатации и аневризмам ВТПЖ, хронической и тяжёлой лёгочной регургитации, последующему расширению и дисфункции правого желудочка. Аневризма ВТПЖ ― это выбухание стенки желудочка после реконструкции путей оттока из правого желудочка, которое считается независимым предиктором расширения правого желудочка и систолической дисфункции у пациентов, подвергшихся коррекции ТФ. На фоне аневризмы часто возникают желудочковые аритмии. МСКТ позволяет отчётливо визуализировать аневризмы ВТПЖ, а также сопутствующую дилатацию основной лёгочной артерии и её центральных ветвей. МСКТ отлично воспроизводит морфологию ВТПЖ и сердечные аномалии, связанные с лёгочной регургитацией, а также позволяет точно измерить увеличенные объёмы правого желудочка, что служит одним из основных показателей для замены лёгочного клапана [2].
Ограничения исследования
Настоящее исследование имеет ряд ограничений. Во-первых, исследование носило ретроспективный характер, следовательно, размер выборки был невелик. Кроме того, поскольку исследование было наблюдательным, золотой стандарт для сравнения полученных результатов отсутствовал.
ЗАКЛЮЧЕНИЕ
Наше исследование показало, что наиболее частыми осложнениями у пациентов детского возраста после коррекции ТФ были стеноз лёгочной артерии и её ветвей. Пациенты с такими осложнениями не имели существенных различий по возрасту, антропометрическим данным (рост, вес, площадь поверхности тела) и гендерному распределению при наличии или отсутствии у них различных типов стеноза (лёгочной артерии, правой или левой её ветви), однако отмечено, что наличие стеноза правой лёгочной артерии повышает вероятность развития стеноза левой лёгочной артерии.
МСКТ ― исключительно полезный метод визуализации для оценки нормальных и аномальных результатов после хирургической коррекции ТФ благодаря широкой доступности и высокому пространственно-временному разрешению получаемых изображений. МСКТ всё чаще используется для оценки пациентов с ТФ, так как позволяет достоверно и точно оценить сложную анатомию и сопутствующие аномалии у пациентов, не подвергавшихся коррекции ТФ, а также определиться с хирургической тактикой и необходимым типом операции. Помимо этого, МСКТ дала нам возможность в полной мере понять и оценить поздние последствия хирургического вмешательства, послеоперационные осложнения и остаточные поражения. Именно поэтому в настоящее время крайне важно проводить регулярное наблюдение за пациентами, перенёсшими коррекцию ТФ, для оценки наличия остаточных явлений и послеоперационных осложнений с целью их своевременного и эффективного лечения.
ДОПОЛНИТЕЛЬНО
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: Р.И. Рахимжанова, Т.Б. Даутов ― концепция и дизайн работы; А.М. Кабдуллина, Б.Б. Калиев, Л.А. Бастарбекова, З.А. Молдаханова ― сбор и анализ данных; А.Б. Садуакасова, А.М. Кабдуллина ― интерпретация результатов, В.Е. Синицын ― утверждение окончательного варианта рукописи.
Благодарности. Авторы выражают благодарность руководителю Национального научного кардиохирургического центра, д.м.н. профессору Ю.В. Пя за предоставленную возможность выполнить данную работу.
ADDITIONAL INFORMATION
Funding source. This study was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. R.I. Rakhimzhanova, T.B. Dautov ― conception and design of the work; A.M. Kabdullina, B.B. Kaliyev, L.A. Bastarbekova, Zh.A. Moldakhanova ― acquisition, analysis of data; A.M. Kabdullina, A.B. Saduakassova ― interpretation of data; V.E. Sinitsyn ― approved the final version of the work.
Acknowledgments. We thank the Chief of the National Research Cardiac Surgery Center MD Ph.D. professor Yuriy V. Pya for the opportunity to carry out this work.
Об авторах
Ажар Муслюмкановна Каблуллина
Медицинский университет Астана
Автор, ответственный за переписку.
Email: azharazh@mail.ru
ORCID iD: 0000-0003-0521-5484
SPIN-код: 4169-1761
Казахстан, Астана
Валентин Евгеньевич Синицын
Московский государственный университет имени М.В. Ломоносова
Email: vsini@mail.ru
ORCID iD: 0000-0002-5649-2193
SPIN-код: 8449-6590
д-р мед. наук, профессор
Россия, МоскваРаушан Ибжановна Рахимжанова
Медицинский университет Астана
Email: rakhimzhanova01@rambler.ru
ORCID iD: 0000-0002-3490-6324
д-р мед. наук, профессор
Казахстан, АстанаТаирхан Бекполатович Даутов
Национальный научный кардиохирургический центр Республики Казахстан
Email: tairkhan.dautov@mail.ru
ORCID iD: 0000-0002-5267-0108
д-р мед. наук, профессор
Казахстан, АстанаАйгуль Болатовна Садуакасова
Больница Медицинского центра Управления делами Президента Республики Казахстан
Email: sadik.a@mail.ru
ORCID iD: 0000-0001-7089-5696
д-р мед. наук
Казахстан, АстанаБауржан Бахытович Калиев
Медицинский университет Астана
Email: Baur233113@mail.ru
ORCID iD: 0000-0003-4825-749X
Казахстан, Астана
Ляззат Абылхановна Бастарбекова
Медицинский университет Астана
Email: lbastarbekova@mail.ru
ORCID iD: 0000-0001-8246-4754
SPIN-код: 8634-6601
Казахстан, Астана
Жанар Акбергенова Молдаханова
Медицинский университет Астана
Email: moldahanova1991@mail.ru
ORCID iD: 0000-0002-5980-9563
Казахстан, Астана
Список литературы
- Apostolopoulou S.C., Manginas A., Kelekis N.L., Noutsias M. Cardiovascular imaging approach in pre and postoperative tetralogy of Fallot // BMC Cardiovasc Dis. 2019. Vol. 19, N 1. P. 7. doi: 10.1186/s12872-018-0996-9
- Shaaban M., Tantawy S., Elkafrawy F., et al. Multi-detector computed tomography in the assessment of tetralogy of Fallot patients: Is it a must? // Egyptian Heart J. 2020. Vol. 72, N 1. P. 17. doi: 10.1186/s43044-020-00047-3
- Goo H.W. Changes in right ventricular volume, volume load, and function measured with cardiac computed tomography over the entire time course of tetralogy of Fallot // Korean J Radiol. 2019. Vol. 20, N 6. P. 956–966. doi: 10.3348/kjr.2018.0891
- Stout K.K., Daniels C.J., Aboulhosn J.A., et al. 2018 AHA/ACC Guideline for the management of adults with congenital heart disease: Executive summary: A report of the American College of Cardiology / American Heart Association Task Force on Clinical Practice Guidelines // J Am College Cardiol. 2019. Vol. 73, N 12. P. 1494–1563. doi: 10.1016/j.jacc.2018.08.1028
- Chelliah A., Shah A.M., Farooqi K.M., Einstein A.J. Cardiovascular CT in cyanotic congenital heart disease // Curr Cardiovasc Imaging Rep. 2019. Vol. 12, N 7. Р. 30. doi: 10.1007/s12410-019-9507-3
- Goo H.W. Comparison of chest pain protocols for electrocardiography-gated dual-source cardiothoracic CT in children and adults: The effect of tube current saturation on radiation dose reduction // Korean J Radiol. 2018. Vol. 19, N 1. P. 23–31. doi: 10.3348/kjr.2018.19.1.23
- Siripornpitak S., Goo H.W. CT and MRI for repaired complex adult congenital heart diseases // Korean J Radiol. 2021. Vol. 22, N 3. P. 308–323. doi: 10.3348/kjr.2020.0895
- Singh R., Jain N., Kumar S., Garg N. Multi-detector computed tomography angiographic evaluation of right ventricular outflow tract obstruction and other associated cardiovascular anomalies in tetralogy of Fallot patients // Polish J Radiol. 2019. Vol. 84. P. 511–516. doi: 10.5114/pjr.2019.91203
- Kossaify A. Echocardiographic assessment of the right ventricle, from the conventional approach to speckle tracking and three-dimensional imaging, and insights into the «Right Way» to explore the forgotten chamber // Clin Med Insights Cardiol. 2015. Vol. 9. Р. 65–75. doi: 10.4137/CMC.S27462
- Pushparajah K., Duong P., Mathur S., Babu-Narayan S.V. Cardiovascular MRI and CT in congenital heart disease // Echo Res Pract. 2019. Vol. 6, N 4. Р. R121–138. doi: 10.1530/ERP-19-0048
Дополнительные файлы