Ограничения использования гистологического исследования биоптатов как «золотого стандарта» диагностики на примере аденокарциномы пищевода: описание случая
- Авторы: Ахмедзянова Д.А.1, Юцевич О.К.2, Решетников Р.В.1, Тащян О.В.3, Пирогов С.С.2, Мазурова М.П.2, Волченко Н.Н.2, Камалов А.К.2, Шумская Ю.Ф.1, Мнацаканян М.Г.3
-
Учреждения:
- Научно-практический клинический центр диагностики и телемедицинских технологий
- Московский научно-исследовательский онкологический институт имени П.А. Герцена — филиал Национального медицинского исследовательского центра Радиологии
- Первый Московский государственный медицинский университет имени И.М. Сеченова
- Выпуск: Том 4, № 4 (2023)
- Страницы: 633-642
- Раздел: Клинические случаи и серии клинических случаев
- Статья получена: 18.07.2023
- Статья одобрена: 16.11.2023
- Статья опубликована: 15.12.2023
- URL: https://jdigitaldiagnostics.com/DD/article/view/561354
- DOI: https://doi.org/10.17816/DD561354
- ID: 561354
Цитировать
Аннотация
Аденокарцинома пищевода — одно из самых распространённых злокачественных новообразований желудочно-кишечного тракта. Для выявления заболевания на ранних стадиях используют эндоскопические, морфологические, иммуногистохимические методы обследования, однако они требуют не только применения высокоспециализированного оборудования, но и зависят от профессионализма врача-эндоскописта и врача-патоморфолога.
В статье описано клиническое наблюдение пациента с прогрессирующей дисфагией, вызванной опухолью пищевода, распространяющейся на субкардиальный отдел желудка, которую не удавалось патоморфологически верифицировать в течение одного года. Данные эзофагогастродуоденоскопии, выполненной в медицинской организации по месту жительства, компьютерной томографии и рентгеноскопии пищевода с двойным контрастированием не оставляли сомнений в злокачественности новообразования, однако результаты многочисленных гистологических исследований свидетельствовали в пользу аденомы пилорических желёз, аденомы из париетальных, либо онкоцитарных клеток с фокусами дисплазии эпителия высокой степени. Эндоскопическое исследование с таргетированной биопсией в условиях специализированного учреждения позволило доказать злокачественность опухолевого процесса.
Результаты исследования демонстрируют важность клинической картины и инструментальных методов для постановки заключительного диагноза при противоречивых данных патоморфологических исследований и в очередной раз поднимают проблему ограничений гистологического исследования биоптатов как «золотого стандарта» диагностики злокачественных новообразований.
Полный текст
АКТУАЛЬНОСТЬ
Злокачественные новообразования пищевода занимают шестое место в структуре онкологической смертности в мире [1], при этом в индустриально развитых странах среди них стремительно растёт доля аденокарциномы [2]. Данный тип неоплазии пищевода крайне агрессивен: 5-летняя выживаемость пациентов составляет менее 20% [3]. Факторы риска развития аденокарциномы пищевода и пищеводно-желудочного перехода включают воздействие на слизистую оболочку механических, химических и термических раздражителей, мужской пол, ожирение и курение [4], при этом наиболее значимым фактором риска является гастроэзофагеальный рефлюкс с последующим развитием пищевода Барретта [5]. Прогноз заболевания определяется не только стадией опухолевого процесса, но и макроскопическим типом опухоли [6–8]. Так, в работе W.R.C. Knight и соавт. было показано, что пациенты с изъязвлённой формой рака пищевода имеют более благоприятный прогноз, нежели пациенты с экзофитным или стенозирующим характером роста опухоли [9].
Для диагностики новообразований пищевода используются лучевые методы обследования: рентгеноскопия пищевода и желудка с двойным контрастированием и компьютерная томография (КТ) органов грудной клетки [10]. Они позволяют оценить объём поражения, предположить глубину инвазии и тип роста опухоли, однако их основным недостатком является отсутствие возможности гистологической верификации новообразования [3]. Эзофагогастродуоденоскопия (ЭГДС) и трансназальная эндоскопия, используемые для диагностики новообразований пищевода, позволяют не только визуально оценить состояние органа, но и провести забор материала для морфологического исследования, которое в свою очередь является «золотым стандартом» верификации новообразований [11]. Однако в силу зависимости результатов гистологических исследований от квалификации и опыта врача-патоморфолога и врача-эндоскописта, качества реактивов, используемых при подготовке биоптатов к морфологическому исследованию, и качества материала, получаемого при эндоскопической щипцовой биопсии, не всегда результат исследования соответствует клинической и эндоскопической картине, а также данным лучевых методов [12]. Кроме того, диагностику усложняет то, что аденокарцинома, развивающаяся на фоне пищевода Барретта, наиболее часто характеризуется эндофитным ростом и требует применения специфической методики взятия биопсии [13].
Мы представляем описание случая пациента с прогрессирующей дисфагией, у которого была диагностирована аденокарцинома пищевода, распространяющаяся до средней трети пищевода и субкардиального отдела желудка. Клинико-инструментальные данные не оставляли сомнений в злокачественности новообразования, однако многократные морфологические исследования не подтверждали предположение клиницистов. Лишь выполнение эзофагогастродуоденоскопии с таргетированной биопсией в специализированном онкологическом учреждении позволило установить диагноз.
Данное описание случая было подготовлено в соответствии с рекомендациями CARE (CAse REport — описание случаев) [14].
ОПИСАНИЕ СЛУЧАЯ
Анамнез
Пациент Н. — мужчина в возрасте 35 лет.
Март 2021 г. — стал отмечать постепенное снижение аппетита. Не обследовался, так как связывал появление симптомов со стрессовой ситуацией на работе.
Март 2022 г. — впервые обратился к терапевту с жалобами на прогрессирующее в течение трёх недель затруднение прохождения твёрдой пищи, тошноту и рвоту, ощущение кома в горле. На момент обращения рост пациента составлял 192 см, масса тела 185 кг (индекс массы тела 50,18 кг/м2, ожирение третьей степени).
Тогда же была проведена ЭГДС, по результатам которой в пищеводе, начиная с расстояния 30 см от резцов и практически до уровня кардии, определялись разрастания опухолевой ткани со множественными изъязвлениями. Выполнена биопсия, по данным патоморфологического исследования достоверных признаков наличия опухолевых клеток, дисплазии и атипии в исследованном материале обнаружено не было.
Апрель 2022 г. — пациент был направлен к гастроэнтерологу, который назначил повторную ЭГДС. При контрольном обследовании в средней и нижней трети пищевода просвет был значительно сужен за счёт циркулярно расположенной опухоли с очагами распада. Проксимальная граница опухоли определялась на расстоянии 25 см, дистальная — на расстоянии 45 см от резцов, достигая субкардиальной части желудка, где визуализировалась подслизистая опухолевая инфильтрация. Вновь была взята биопсия из изъязвлённых участков; по результатам морфологического исследования в доставленном материале были обнаружены фрагменты опухоли ворсинчатого строения, выстланной цилиндрическим эпителием со слабой дисплазией. С целью повторной верификации образования была проведена еще одна ЭГДС с биопсией, в результате признаков клеточной атипии не определялось.
Предварительный диагноз. Выявленные патоморфологические изменения укладывались в картину аденомы пилорических желёз, аденомы из париетальных, либо онкоцитарных клеток с фокусами дисплазии высокой степени, крайне подозрительными в отношении малигнизации. Данные гистологического исследования противоречили клинической и эндоскопической картине. Ввиду расхождения данных эндоскопического и гистологического исследований было проведено иммуногистохимическое исследование, которое показало пилорический иммунофенотип опухоли с экспрессией муцинов покровно-ямочного эпителия желудка и муцинов пилорических желёз. Опухолевые клетки не демонстрировали мутации в гене р53 и не показывали высокой пролиферативной активности. Таким образом, по данным иммуногистохимического исследования достоверно установить злокачественный характер опухоли также не удалось, и образование было расценено как аденома пилорических желёз. Врачом-гастроэнтерологом муниципального звена здравоохранения пациенту было рекомендовано динамическое наблюдение.
Май 2022 г. — больной самостоятельно обратился к гастроэнтерологу в связи нарастанием жалоб на нарушение прохождения пищи, снижение массы тела на 15 кг (индекс массы тела 46,12 кг/м2) за последние 3 месяца. Пациент был госпитализирован в гастроэнтерологическое отделение для выполнения обследования и верификации диагноза.
Лабораторная диагностика
По данным анализов крови были отмечены гиперурикемия (мочевая кислота 634,8 мкмоль/л, при норме N 154–357 мкмоль/л) и повышение уровней неспецифических воспалительных маркёров:
- скорость оседания эритроцитов — увеличение до 50 мм/час (N 2–20);
- фибриноген — увеличение концентрации до 4,81 г/л (N 1,8–4);
- С-реактивный белок — увеличение концентрации до 11,4 мг/л (N 0–5).
Кроме того, был установлен латентный железодефицит:
- гемоглобин — 147 г/л (N 132–180);
- цветовой показатель — 0,9;
- железо — 5,9 мкмоль/л (N 10,7–32,2).
Инструментальная диагностика
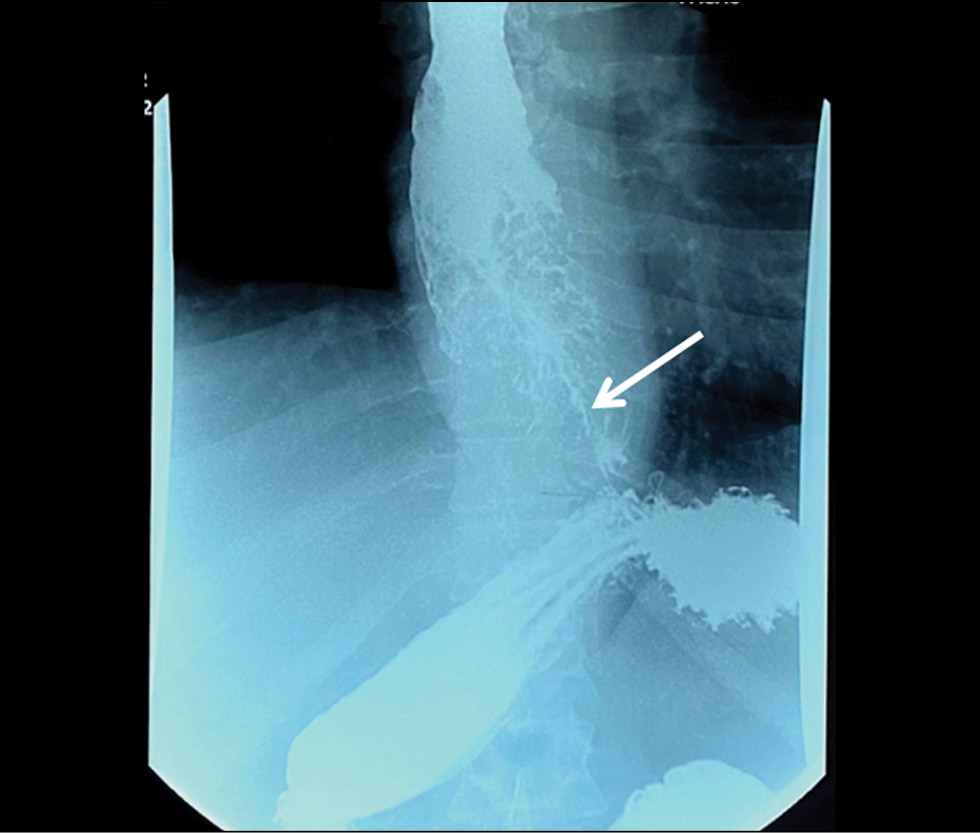
Было принято решение о проведении рентгеноскопии желудка и пищевода с бариевым контрастированием, по результатам которой также было заподозрено протяжённое образование средней и нижней трети пищевода, стенозирующее просвет (рис. 1).
Рис. 1. Рентгенография пищевода. Циркулярное сужение пищевода, тонкий канал поступления бариевой взвеси (указан стрелкой).
По данным КТ органов грудной клетки было выявлено новообразование пищевода протяжённостью 186 мм с распространением на кардиальный отдел желудка, утолщением стенок пищевода за счёт полиповидных разрастаний до 41 мм, выраженным сужением просвета пищевода в области нижней трети до 2 мм и признаками опухолевого поражения регионарных лимфатических узлов (рис. 2).
Рис. 2. Компьютерная томография органов грудной клетки. Белыми стрелками отмечены патологические изменения: a — новообразование пищевода, с распространением на кардиальный отдел желудка, протяжённостью 186 мм; b — массивные разрастания опухолевой ткани с сужением просвета в средней трети пищевода; c — опухолевое поражение регионарного парааортального лимфоузла; d — сужение просвета пищевода до 2 мм в нижней трети.
КТ органов брюшной полости не выявило отдалённого метастазирования. Результаты проведённого обследования свидетельствовали в пользу наличия местно-распространённой злокачественной опухоли пищевода, вовлекающей кардиальный отдел желудка.
Пациент был направлен на консультацию онколога в специализированное онкологическое учреждение. Согласно данным эндоскопического исследования, проведённого в онкологическом стационаре, на уровне 24 см от резцов в пищеводе определялась проксимальная граница опухолевой инфильтрации в виде множественных узлов белесовато-красного цвета, сливающихся между собой, распространяющихся циркулярно до субкардиального отдела желудка. В пределах опухоли визуализированы глубокие изъязвления, покрытые фибрином и некротическим налётом, на расстоянии 36 см от резцов в опухолевой ткани определено устье свищевого хода, из которого определяется поступление в просвет сливкообразного опалесцирующего содержимого. Просвет пищевода значительно сужен за счёт экзофитного компонента новообразования (рис. 3). Опухолевая ткань имела тестовидную консистенцию, легко кровоточила при контакте. Кардиоэзофагеальный переход был определён на расстоянии 44 см от резцов, циркулярно инфильтрирован опухолью. Опухолевая инфильтрация распространялась по задней стенке до уровня субкардии (рис. 4).
Рис. 3. Эндофото. Стенозирующая аденокарцинома на фоне пищевода Барретта. Голубыми стрелками указаны участки циркулярно расположенной опухоли.
Рис. 4. Эндофото. Стенозирующая аденокарцинома на фоне Барретта. Жёлтой стрелкой отмечен эндоскоп, находящийся на входе в желудок, зелёной стрелкой отмечена ткань опухоли.
Была выполнена таргетированная ступенчатая биопсия опухоли в зоне отсутствия некроза. Результаты патоморфологического исследования укладывались в картину высокодифференцированной аденокарциномы пищевода на фоне пищевода Барретта.
Диагноз и лечение
Пациенту был установлен диагноз: высокодифференцированная аденокарцинома на фоне пищевода Барретта с распространением на кардиальный отдел желудка сT3N1M0, осложнённая формированием пищеводно-медиастинального свища.
С учётом отсутствия данных, свидетельствующих в пользу отдалённого метастазирования опухоли и принимая во внимание молодой возраст пациента, было решено выполнить радикальное хирургическое лечение. В июле 2022 г. пациенту была выполнена торакоскопическая одномоментная резекция и пластика пищевода стеблем из большой кривизны желудка с анастомозом на шее с лимфаденэктомией 2S. В ходе выполнения оперативного вмешательства также был удалён пищеводно-медиастинальный свищ.
При патоморфологическом исследовании операционного материала была подтверждена высокодифференцированная аденокарцинома пищевода на фоне пищевода Барретта с участками некроза, изъязвлением поверхности. Опухоль прорастала слизистую оболочку, подслизистый мышечный слой стенки пищевода, распространялась на кардиальный отдел желудка. Важно отметить, что метастазы опухоли были выявлены в 4 из 11 околопищеводных лимфатических узлов и в 4 из 6 лимфатических узлов по малой кривизне желудка.
Таким образом, заключительный диагноз был сформулирован так: аденокарцинома пищевода на фоне пищевода Барретта pТ4N1M0, III стадия опухолевого процесса.
Послеоперационный период у пациента осложнился формированием трахеопищеводного свища. На фоне проведения эндоскопической вакуумной терапии в течение трёх недель свищ эпителизировался. С учётом распространённости опухолевого процесса, высокого риска развития рецидива заболевания и молодого возраста пациента, было проведено 9 курсов адъювантной полихимиотерапии по схеме FOLFOX (препараты фолинат кальция, фторурацил и оксалиплатин).
При контрольных обследованиях в декабре 2022 г. и апреле 2023 г. признаков местного рецидива и прогрессирования опухолевого процесса выявлено не было.
ОБСУЖДЕНИЕ
В данном клиническом наблюдении раскрыт ряд проблем эндоскопической и патоморфологической диагностики злокачественного новообразования на фоне пищевода Барретта. Без гистологического подтверждения наличия опухолевого процесса и типа новообразования невозможно как выполнение хирургического вмешательства, так и проведение других методов лечения. Выбор химиотерапии или сочетанной химиолучевой терапии, а также оценка необходимости их применения в адъювантном или неоадъювантном режиме напрямую зависят как от стадии опухолевого процесса, так и от гистологического строения опухоли. В описанном случае основная проблема заключалась в несоответствии данных эндоскопических и лучевых методов результатам гистологического исследования.
Современное эндоскопическое оборудование даёт возможность визуализировать слизистую полых органов в высоком разрешении. При этом основополагающим принципом должен служить тщательный осмотр всего органа и выявление наиболее подозрительных участков слизистой оболочки. Это более трудоёмкая и требующая большего количества времени манипуляция. Только после детального осмотра врачом-эндоскопистом должно быть принято решение о выполнении таргетированной (прицельной) биопсии, которую от биопсии «вслепую» и классической щипцовой биопсии отличает взятие материала из наиболее подозрительных участков с использованием уточняющих методик, таких как узкоспектральная эндоскопия с близким фокусом [15].
Аденокарцинома на фоне пищевода Барретта на ранней стадии опухолевого процесса чаще всего характеризуется плоским типом роста в пределах сегмента метаплазии [16]. В описанном случае аденокарцинома пищевода развилась на фоне массивных разрастаний аденоматозной ткани, многочисленные неприцельно выполненные биопсии из которой и послужили причиной задержки верификации злокачественного процесса. Таргетированная ступенчатая биопсия опухоли в зоне отсутствия некроза позволила поставить корректный диагноз.
По данным литературы, правильное выявление и предоперационное стадирование аденокарциномы пищевода наблюдалось лишь для 35% пациентов [17], отражением чего также является и описанный нами случай. Одной из причин описана недостаточная точность щипцовой биопсии как метода забора материала для патоморфологического исследования. Кроме того, показана необходимость выполнения эндоскопической резекции слизистой при подозрении на злокачественное новообразование пищевода [18]. Ценность биопсии при этом возрастает при заборе не менее пяти фрагментов ткани — увеличивается вероятность даже случайного выявления в одном из них атипичных опухолевых клеток [19, 20].
Среди патоморфологов также могут встречаться расхождения в отношении того, относить ли выявленные в биоптате изменения к дисплазии или к признакам злокачественного новообразования. По данным A.H. Ormsby и соавт., даже при оценке тотально удалённой опухоли, патологоанатомы, специализирующиеся на образованиях желудочно-кишечного тракта, не достигают высокой степени согласия относительно того, является ли новообразование аденомой с тяжёлой дисплазией эпителия или аденокарциномой [21]. Авторы приходят к выводу, что стратегии лечения, основанные на гистологическом отличии тяжёлой дисплазии от внутрислизистой аденокарциномы с использованием ограниченного количества биоптатов, должны быть пересмотрены.
ЗАКЛЮЧЕНИЕ
Представленный нами случай наглядно демонстрирует важность критического подхода врача-клинициста к результатам патоморфологического исследования. Суждение о диагнозе должно опираться на клиническую картину и результаты инструментальных обследований. При этом в случае неясных результатов гистологического исследования метод забора материала должен производиться из наиболее качественного либо объёмного участка патологического изменения, даже если для этого необходимы повторные исследования.
ДОПОЛНИТЕЛЬНО
Источник финансирования. Данная статья подготовлена авторским коллективом в рамках научно-исследовательской работы «Оппортунистический скрининг социально значимых и иных распространённых заболеваний», (№ в Единой государственной информационной системе учёта: № 123031400009-1) в соответствии с Приказом от 21.12.2022 г. № 1196: «Об утверждении государственных заданий, финансовое обеспечение которых осуществляется за счёт средств бюджета города Москвы государственным бюджетным (автономным) учреждениям, подведомственным Департаменту здравоохранения города Москвы, на 2023 год и плановый период 2024 и 2025 годов» Департамента здравоохранения города Москвы.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли вклад в разработку концепции, проведение работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: Д.А. Ахмедзянова ― концепция, сбор и обработка материала, анализ полученных данных, написание текста рукописи; О.К. Юцевич ― сбор и обработка материала, написание текста рукописи; Р.В. Решетников ― концепция, редактирование текста рукописи; О.В. Тащян, М.П. Мазурова, Н.Н. Волченко, А.К. Камалов, Ю.Ф. Шумская ― редактирование текста рукописи, подготовка иллюстративного материала; С.С. Пирогов, М.Г. Мнацаканян ― окончательное редактирование, одобрение рукописи.
Информированное согласие на публикацию. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации и фотографий в обезличенной форме в журнале Digital Diagnostics.
Благодарности. Авторы выражают благодарность Блохину Ивану Андреевичу за помощь в работе с текстом.
Об авторах
Дина Альфредовна Ахмедзянова
Научно-практический клинический центр диагностики и телемедицинских технологий
Автор, ответственный за переписку.
Email: AkhmedzyanovaDA@zdrav.mos.ru
ORCID iD: 0000-0001-7705-9754
SPIN-код: 6983-5991
Scopus Author ID: 58104960900
Россия, Москва
Ольга Константиновна Юцевич
Московский научно-исследовательский онкологический институт имени П.А. Герцена — филиал Национального медицинского исследовательского центра Радиологии
Email: o.yutsevitch@yandex.ru
ORCID iD: 0000-0002-3860-9853
Россия, Москва
Роман Владимирович Решетников
Научно-практический клинический центр диагностики и телемедицинских технологий
Email: r.reshetnikov@npcmr.ru
ORCID iD: 0000-0002-9661-0254
SPIN-код: 8592-0558
канд. ф.-м. наук
Россия, МоскваОльга Валерьевна Тащян
Первый Московский государственный медицинский университет имени И.М. Сеченова
Email: olgatash1@rambler.ru
ORCID iD: 0000-0001-6759-6820
SPIN-код: 3658-1120
канд. мед. наук
Россия, МоскваСергей Сергеевич Пирогов
Московский научно-исследовательский онкологический институт имени П.А. Герцена — филиал Национального медицинского исследовательского центра Радиологии
Email: pirogov@mail.ru
ORCID iD: 0000-0002-8101-2155
SPIN-код: 7812-5502
д-р мед. наук
Россия, МоскваМария Павловна Мазурова
Московский научно-исследовательский онкологический институт имени П.А. Герцена — филиал Национального медицинского исследовательского центра Радиологии
Email: mnioi_morphology@mail.ru
ORCID iD: 0000-0002-4873-4455
SPIN-код: 4455-3055
канд. мед. наук
Россия, МоскваНадежда Николаевна Волченко
Московский научно-исследовательский онкологический институт имени П.А. Герцена — филиал Национального медицинского исследовательского центра Радиологии
Email: mnioi_morphology@mail.ru
ORCID iD: 0000-0003-0421-4172
д-р мед. наук, профессор
Россия, МоскваАзиз Кураглиевич Камалов
Московский научно-исследовательский онкологический институт имени П.А. Герцена — филиал Национального медицинского исследовательского центра Радиологии
Email: kak6768@mail.ru
ORCID iD: 0000-0001-7376-6056
SPIN-код: 1671-1600
Россия, Москва
Юлия Федоровна Шумская
Научно-практический клинический центр диагностики и телемедицинских технологий
Email: ShumskayaYF@zdrav.mos.ru
ORCID iD: 0000-0002-8521-4045
SPIN-код: 3164-5518
Россия, Москва
Марина Генриковна Мнацаканян
Первый Московский государственный медицинский университет имени И.М. Сеченова
Email: mnatsakanyan08@mail.ru
ORCID iD: 0000-0001-9337-7453
SPIN-код: 2015-1822
д-р мед. наук, профессор
Россия, МоскваСписок литературы
- Bray F., Ferlay J., Soerjomataram I., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries // CA Cancer J Clin. 2018. Vol. 68, N 6. P. 394–424. doi: 10.3322/caac.21492
- McColl K.E.L. What is causing the rising incidence of esophageal adenocarcinoma in the West and will it also happen in the East? // J Gastroenterol. 2019. Vol. 54, N 8. P. 669–673. doi: 10.1007/s00535-019-01593-7
- Joseph A., Raja S., Kamath S., et al. Esophageal adenocarcinoma: A dire need for early detection and treatment // Cleve Clin J Med. 2022. Vol. 89, N 5. P. 269–279. doi: 10.3949/ccjm.89a.21053
- Uhlenhopp D.J., Then E.O., Sunkara T., Gaduputi V. Epidemiology of esophageal cancer: update in global trends, etiology and risk factors // Clin J Gastroenterol. 2020. Vol. 13, N 6. P. 1010–1021. doi: 10.1007/s12328-020-01237-x
- Zhang H.Y., Spechler S.J., Souza R.F. Esophageal adenocarcinoma arising in Barrett esophagus // Cancer Lett. 2009. Vol. 275, N 2. P. 170–177. doi: 10.1016/j.canlet.2008.07.006
- Deng H.Y., Alai G., Luo J., et al. Cancerous esophageal stenosis before treatment was significantly correlated to poor prognosis of patients with esophageal cancer: a meta-analysis // J Thorac Dis. 2018. Vol. 10, N 7. P. 4212–4219. doi: 10.21037/jtd.2018.06.89
- Sillah K., Pritchard S.A., Watkins G.R., et al. The degree of circumferential tumour involvement as a prognostic factor in oesophageal cancer // Eur J Cardiothorac Surg. 2009. Vol. 36, N 2. P. 368–373. doi: 10.1016/j.ejcts.2008.12.052
- Deng H.Y., Li G., Luo J. Does oesophageal stenosis have any impact on survival of oesophageal cancer patients? // Interact Cardiovasc Thorac Surg. 2018. Vol. 27, N 3. P. 384–386. doi: 10.1093/icvts/ivy095
- Knight W.R.C., McEwen R., Byrne B.E., et al. Endoscopic tumour morphology impacts survival in adenocarcinoma of the oesophagus // Eur J Surg Oncol. 2020. Vol. 46, N 12. P. 2257–2261. doi: 10.1016/j.ejso.2020.07.003
- И–74 Информативность методов лучевой диагностики при различных патологических состояниях организма. Раздел 2. Диагностика патологических состояний и заболеваний желудочно-кишечного тракта / под ред. С.П. Морозова. Москва, 2018.
- Ishihara R., Goda K., Oyama T. Endoscopic diagnosis and treatment of esophageal adenocarcinoma: introduction of Japan Esophageal Society classification of Barrett’s esophagus // J Gastroenterol. 2019. Vol. 54, N 1. P. 1–9. doi: 10.1007/s00535-018-1491-x
- Загайнова Е.В., Загайнов В.Е., Гладкова Н.Д., и др. Оптическая когерентная томография при хирургическом лечении рака пищевода // Вестник хирургии имени И.И. Грекова. 2007. Т. 166(2. С. 22–26.
- Давыдов М.И., Тер-Ованесов М.Д., Стилиди И.С., и др. Пищевод Барретта: от теоретических основ к практическим рекомендациям // Практическая онкология. 2003. Т. 4, № 2. С. 109–119.
- Barber M.S., Aronson J.K., von Schoen-Angerer T., et al. Рекомендации CARE для описания случаев: разъяснения и уточнения // Digital Diagnostics. Vol. 3, N 1. C. 16–42. doi: 10.17816/DD105291
- Wani S., Rubenstein J.H., Vieth M., Bergman J. Diagnosis and Management of Low-Grade Dysplasia in Barrett’s Esophagus: Expert Review From the Clinical Practice Updates Committee of the American Gastroenterological Association // Gastroenterology. 2016. Vol. 151, N 5. P. 822–835. doi: 10.1053/j.gastro.2016.09.040
- di Pietro M., Canto M.I., Fitzgerald R.C. Endoscopic Management of Early Adenocarcinoma and Squamous Cell Carcinoma of the Esophagus: Screening, Diagnosis, and Therapy // Gastroenterology. 2018. Vol. 154, N 2. P. 421–436. doi: 10.1053/j.gastro.2017.07.041
- Winiker M., Mantziari S., Figueiredo S.G., et al. Accuracy of preoperative staging for a priori resectable esophageal cancer // Dis Esophagus. 2018. Vol. 31, N 1. P. 1–6. doi: 10.1093/dote/dox113
- Elsadek H.M., Radwan M.M. Diagnostic Accuracy of Mucosal Biopsy versus Endoscopic Mucosal Resection in Barrett’s Esophagus and Related Superficial Lesions // Int Sch Res Notices. 2015. Vol. 2015. doi: 10.1155/2015/735807
- Трякин А.А., Бесова Н.С., Волков Н.М., и др. Практические рекомендации по лекарственному лечению рака пищевода и пищеводно-желудочного перехода // Злокачественные опухоли. 2021. Т. 11, № 3S2-1. С. 299–313. doi: 10.18027/2224-5057-2021-11-3s2-20
- Ajani J.A., D’Amico T.A., Bentrem D.J., et al. Esophageal and Esophagogastric Junction Cancers, Version 2.2023, NCCN Clinical Practice Guidelines in Oncology // J Natl Compr Canc Netw. 2023. Vol. 21, N 4. P. 393–422. doi: 10.6004/jnccn.2023.0019
- Ormsby A.H., Petras R.E., Henricks W.H., et al. Observer variation in the diagnosis of superficial oesophageal adenocarcinoma // Gut. 2002. Vol. 51, N 5. P. 671–676. doi: 10.1136/gut.51.5.671
Дополнительные файлы