将活检标本的组织学检查作为诊断“金标准”的局限性:一个例子
- 作者: Akhmedzyanova D.A.1, Yutsevich O.K.2, Reshetnikov R.V.1, Tashchyаn O.V.3, Pirogov S.S.2, Mazurova M.P.2, Volchenko N.N.2, Kamalov A.K.2, Shumskaya Y.F.1, Mnatsakanyan M.G.3
-
隶属关系:
- Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
- P.A. Herzen Moscow Oncology Research Institute, Branch, National Medical Research Radiological Center
- The First Sechenov Moscow State Medical University
- 期: 卷 4, 编号 4 (2023)
- 页面: 633-642
- 栏目: 临床病例及临床病例的系列
- ##submission.dateSubmitted##: 18.07.2023
- ##submission.dateAccepted##: 16.11.2023
- ##submission.datePublished##: 15.12.2023
- URL: https://jdigitaldiagnostics.com/DD/article/view/561354
- DOI: https://doi.org/10.17816/DD561354
- ID: 561354
如何引用文章
详细
食管腺癌是胃肠道最常见的恶性肿瘤之一。为了在早期阶段发现这种疾病,医生采用内窥镜、形态学、免疫组化等检查方法。但是,这些方法不仅需要使用高度专业化的设备,还取决于内镜医师和病理形态学医师的专业水平。
本文描述了对一名进行性吞咽困难患者的临床观察。吞咽困难是由食道肿瘤引起的。肿瘤已扩散到胃的贲门下段。肿瘤在一年内无法进行病理形态学验证。在居住地医疗机构进行的食管胃十二指肠镜检查、电子计算机断层扫描和食管双对比透视检查的数据证实了肿瘤的恶性程度。然而,大量组织学检查的结果都支持幽门腺腺瘤、顶体腺瘤或带有高度上皮发育不良病灶的肿瘤细胞腺瘤。在专业机构的条件下,通过内窥镜检查和靶向活检,才有可能证实肿瘤的恶性程度。
研究结果表明,在病理形态学检查数据相互矛盾的情况下,临床表现和仪器方法对最终诊断的重要。这再次提出活检标本的组织学检查作为诊断恶性肿瘤“金标准”的局限性问题。
全文:
背景
食道恶性肿瘤在全球癌症死亡率结构中排名第六位[1],其中腺癌在工业化国家迅速增长[2]。这种食道肿瘤具有极强的侵袭性:患者的5年生存率不到20%[3]。食管和食管胃交界处腺癌发病的风险因素包括食管粘膜受机械、化学和热刺激的影响、男性、肥胖和吸烟[4],其中最重要的风险因素是胃食管反流,随后发展为巴雷特食管[5]。疾病的预后不仅取决于肿瘤的发展阶段,还取决于肿瘤的宏观类型[6–8]。因此,W.R.C.Knight等人的研究表明了,溃疡型食管癌患者比外生型或狭窄型肿瘤生长型患者预后更好[9]。
用于诊断食道肿瘤的放射学检查方法包括食道和胃的双对比X射线透视以及胸部器官的电子计算机断层扫描(CT)[10]。这些方法可以估计病变的体积,提示肿瘤的浸润深度和生长类型,但其主要缺点是无法对肿瘤进行组织学验证[3]。用于诊断食管肿瘤的食管胃十二指肠镜检查和经鼻内窥镜检查不仅可以直观地评估器官的状况,还可以收集材料进行形态学检查,而形态学检查又是验证肿瘤的“金标准”[11]。然而,由于组织学检查结果取决于病理形态学家和内窥镜医师的资质和经验、制备形态学检查活检标本所用试剂的质量以及内窥镜镊子活检所获材料的质量,检查结果并不总是与临床和内窥镜图像以及放射方法的数据一致[12]。此外,在巴雷特食管背景下发生的腺癌通常以内生性生长为特征,需要特殊的活检技术,这也使诊断变得复杂[13]。
我们报告了一例吞咽困难患者的病例,该患者被确诊为食管腺癌,癌细胞已扩展至食管中三分之一和胃贲门区域。临床和器械检查数据表明该肿瘤无疑是恶性的,但反复的形态学检查并未证实临床医生的推测。只有在肿瘤专科医院进行食管胃十二指肠镜检查伴有靶向活检,才能确定诊断。
本病例报告是根据CARE(CAse Report,病例描述)指南[14]编写。
病例介绍
病史
患者N,男性,35岁。
2021年3月,开始注意到食欲逐渐下降。患者没有接受检查,因为他认为症状的出现与工作压力有关。
2022年3月,他因持续三周难以食入固体食物、恶心、呕吐和喉咙肿块感而首次就诊于全科医生。就诊时,患者身高为192cm,体重为185kg(体重指数为50.18kg/m2,三级肥胖)。
同时进行的食管胃十二指肠镜检查结果显示了,从切牙30cm处开始,几乎到贲门水平,食道内发现肿瘤组织增生,并伴有多处溃疡。进行了活组织检查;根据病理形态学检查,在检查材料中没有发现肿瘤细胞、发育不良和异型性的可靠迹象。
2022年4月,患者被转诊至消化内科,该医生要求再次进行食管胃十二指肠镜检查。在复查时,由于肿瘤呈环形分布,并伴有糜烂灶,食道中下三分之一处的管腔明显狭窄。肿瘤近端边界距离切牙25cm,远端边界距离切牙45cm,直达胃贲门部位,在那里可以看到粘膜下肿瘤浸润。在溃疡部位再次进行了活检;根据形态学检查的结果,送检材料中含有绒毛状肿瘤的碎片,外皮是轻度发育不良的圆柱形上皮。为了再次核实肿块,又进行了一次食管胃十二指肠镜检查和活检,没有发现细胞异型的迹象。
初步诊断。所发现的病理形态学变化与幽门腺腺瘤、顶细胞腺瘤或伴有高度发育不良的病灶的肿瘤细胞腺瘤的症状一致,高度怀疑为恶性肿瘤。组织学检查结果与临床和内窥镜检查结果相矛盾。鉴于内窥镜检查和组织学检查结果之间的差异,对肿瘤进行了免疫组化检查,结果显示肿瘤具有幽门免疫表型,有胃毛细血管上皮的粘蛋白和幽门腺粘蛋白的表达。肿瘤细胞没有显示出p53基因突变,也没有显示出高度的增殖活性。因此,根据免疫组化检查,无法可靠地确定肿瘤的恶性性质,肿块被认为是幽门腺腺瘤。市医疗中心的一位消化内科医生建议对患者进行动态随访。
2022年5月,患者独立求助于消化内科医生,原因是在过去3个月中,患者越来越多地抱怨进食受阻,体重下降了15kg(体重指数为46.12kg/m2)。患者在消化内科住院进行检查和确诊。
实验室诊断
血液检测显示出高尿酸血症(尿酸为634.8μmol/l;正常值为154–357μmol/l)和非特异性炎症标志物水平升高:
- 红细胞沉降率:增加到50mm/h(N 2–20);
- 纤维蛋白原:浓度增至4.81g/l(N 1.8–4);
- C反应蛋白:浓度增至11.4mg/l(N 0–5);
- 此外,还诊断出了潜伏性缺铁症:
- 血红蛋白:147g/l(N 132–180);
- 色值:0.9;
- 铁:5.9μmol/l(N 10.7–32.2)。
仪器诊断
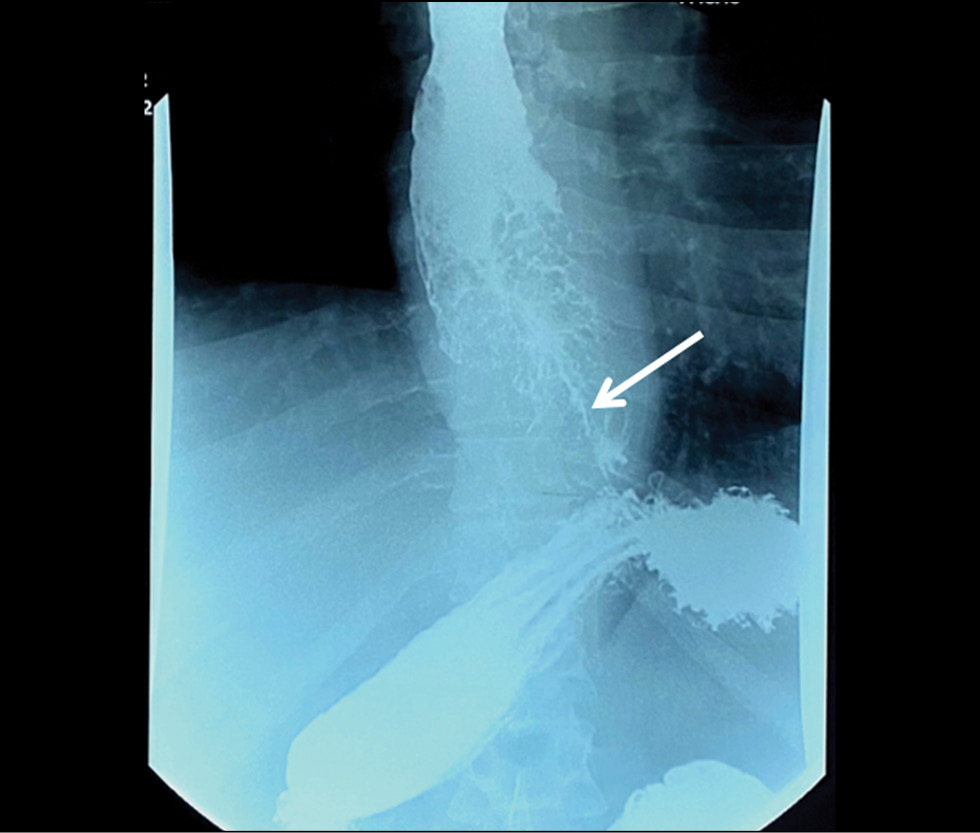
医生决定了进行食道和胃的钡对比X射线透视。检查结果显示了,食道中下三分之一处有一个扩展的肿块,导致管腔狭窄(图1)。
图1。食道的射线照相。食道呈环形狭窄,钡胶浆通道较细(箭头所示)。
胸部器官计算机断层扫描显示了,食道肿瘤长186mm,并扩展到胃贲门部位,食道壁因息肉样增生而增厚达41mm,食道腔明显狭窄在下三分之一区域达2mm,区域淋巴结有肿瘤病变迹 象(图2)。
图2。胸部器官的计算机断层扫描。白色箭头表示病理变化:a——食道肿瘤,延伸至胃贲门部位,长186mm;b——肿瘤组织大量增生,食道中三分之一处的管腔狭窄;c——区域主动脉旁淋巴结的肿瘤病变;d——食道下三分之一处的管腔狭窄达到2mm。
腹腔计算机断层扫描显示没有远处转移。检查结果证明食道恶性肿瘤局部性扩散,累及胃贲门部分。
患者被转诊到肿瘤专科医院进行肿瘤诊治。根据在肿瘤医院进行的内窥镜检查,在距食道切牙24cm处,确定食道近端肿瘤浸润为多个白红色结节,相互融合,呈环状扩散至胃贲门区域。在肿瘤内部可以看到覆盖着纤维蛋白和坏死斑的深层溃疡;在距离切牙36cm处的肿瘤组织中发现了一个,确定有粘液状乳白色内容物从中流入管腔。由于肿瘤的外生成分,食管腔明显变窄(图3)。肿瘤组织呈面团状,一接触就容易出血。贲门食管交界处距切牙44cm,肿瘤呈环状浸润。肿瘤浸润沿后壁向贲门下水平扩散(图4)。
图3。内窥镜照片。巴雷特食管引起的狭窄性腺癌。蓝色箭头表示肿瘤呈环状分布的区域。
图4。内窥镜照片。巴雷特食管引起的狭窄性腺癌。黄色箭头表示胃入口处的内窥镜,绿色箭头表示肿瘤组织。
对无坏死区域的肿瘤进行了靶向多灶性活检。病理形态学检查结果符合以巴雷特食管为背景的高分化食管腺癌的模式。
诊断和治疗
患者被诊断为巴雷特食管背景下的高分化腺癌,癌细胞扩散到胃贲门部位сT3N1M0,并伴有食管纵隔瘘的形成。
由于缺乏支持肿瘤远处转移的证据,并考虑到患者年龄较小,决定对其进行根治性手术治疗。2022年7月,患者接受了胸腔镜下的一期切除术和食道成形术,从胃大弯处取茎,在颈部吻合,并进行了2S淋巴腺切除。手术过程中还切除了食道纵隔瘘管。
对手术材料进行的病理形态学检查证实,在巴雷特食管的背景下,食道腺癌分化程度很高,有坏死和表面溃疡的区域。肿瘤通过食管壁粘膜和粘膜下肌层生长,扩散到胃贲门部位。值得注意的是,在11个食管周围淋巴结中的4个和沿胃小弯的6个淋巴结中的4个发现了肿瘤转移。
因此,最终诊断结果如下:巴雷特食管背景下的食管腺癌pT4N1M0,肿瘤进程为III期。
患者的术后情况因气管食管瘘的形成而变得复杂。在内窥镜真空治疗的背景下,瘘管在三周内上皮化。考虑到肿瘤进程的普遍性、疾病复发的高风险和患者的年轻,根据FOLFOX方案(亚叶酸钙、氟尿嘧啶和奥沙利铂)进行了9个疗程的辅助多化疗。
在2022年12月和2023年4月的对照检查中,未发现局部性复发和肿瘤进程进展的迹象。
讨论
本病例揭示了在巴雷特食道背景下对恶性肿瘤进行内窥镜和病理形态学诊断的一系列问题。如果不能从组织学上确认肿瘤的存在过程和类型,就无法进行手术干预和其他治疗方法。选择化疗或联合放化疗,以及评估是否需要在辅助或新辅助方案中使用它们,直接取决于肿瘤过程的阶段和肿瘤的组织学结构。在所述病例中,主要问题是内窥镜和放射方法的数据与组织学检查结果之间存在差异。
现代内窥镜设备可以高分辨率地观察中空器官的粘膜。在这种情况下,基本原则应该是彻底检查整个器官,并确定粘膜上最可疑的区域。这是一项耗费大量人力和时间的操作。只有经过详细检查后,内窥镜医师才能决定是否进行靶向活检。靶向活检有别于盲目活检和传统的镊子活检,它是利用近焦窄谱窥镜检查等清晰技术,从最可疑的部位取材[15]。
对巴雷特食管腺癌在肿瘤过程的早期阶段而言,最常见的特征是在一段变性组织内的扁平型生长[16]。在本病例中,食管腺癌是在大量腺瘤组织大量增生的背景下发生的,大量非靶向活检导致恶性过程的验证被延迟。在没有坏死的区域对肿瘤进行靶向多灶性活检后,才得以做出正确诊断。
根据文献,只有35%的食管腺癌患者能在术前进行正确的检测和分期[17],我们描述的病例也反映了这一点。其中一个原因是镊子活检作为病理形态学检查的材料收集方法缺乏准确性。此外,在怀疑食道恶性肿瘤的情况下进行内窥镜下粘膜切除术的必要性已经得到证实[18]。如果至少取5个组织片段,活检的价值就会增加,即使在其中一个片段中意外检测非典型肿瘤细胞的概率也会增加[19, 20]。
对于活检样本中发现的变化应归因于发育不良还是恶性肿瘤,病理形态学家之间也可能存在分歧。根据A.H.Ormsby等人的报告,即使在评估一个完全切除的肿瘤时,胃肠道肿瘤专业病理学家在肿瘤是上皮严重发育不良的腺瘤还是腺癌的问题上也无法达成高度一致[21]。作者的结论是,应重新考虑利用数量有限的活检标本在组织学上区分严重发育不良和粘膜内腺癌的治疗策略。
结论
本病例清楚地说明了临床医生对病理形态学检查结果采取批判性态度的重要性。对诊断的判断应基于临床表现和仪器检查的结果。在这种情况下,如果组织学检查结果不明确,则应从病理变化中质量最好或体积最大的部分采集材料,即使为此目的需要重复检查。
ADDITIONAL INFORMATION
Funding source. This article was prepared by a group of authors as a part of the research and development effort titled “Opportunistic screening of high-profile and other common diseases”, No. 123031400009-1”, (USIS No. 123031400009-1) in accordance with the Order No. 1196 dated December 21, 2022 “On approval of state assignments funded by means of allocations from the budget of the city of Moscow to the state budgetary (autonomous) institutions subordinate to the Moscow Health Care Department, for 2023 and the planned period of 2024 and 2025” issued by the Moscow Health Care Department.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
D.A. Akhmedzyanova — concept, collection and processing of data, data analysis, manuscript writing; O.K. Yutsevich — collection and processing of data, manuscript writing; R.V. Reshetnikov — concept, manuscript editing; O.V. Tashchyan, S.S. Pirogov, M.P. Mazurova, N.N. Volchenko, A.K. Kamalov, Y.F. Shumskaya — manuscript editing, preparation of illustrative material; M.G. Mnatsakanyan — final editing, manuscript approval.
Consent for publication. Written consent was obtained from the patient for publication of relevant medical information and all of accompanying images within the manuscript in Digital Diagnostics Journal.
Acknowledgments. The authors express their gratitude to Ivan A. Blokhin for his support in the text editing.
作者简介
Dina A. Akhmedzyanova
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
编辑信件的主要联系方式.
Email: AkhmedzyanovaDA@zdrav.mos.ru
ORCID iD: 0000-0001-7705-9754
SPIN 代码: 6983-5991
Scopus 作者 ID: 58104960900
俄罗斯联邦, Moscow
Olga K. Yutsevich
P.A. Herzen Moscow Oncology Research Institute, Branch, National Medical Research Radiological Center
Email: o.yutsevitch@yandex.ru
ORCID iD: 0000-0002-3860-9853
俄罗斯联邦, Moscow
Roman V. Reshetnikov
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
Email: r.reshetnikov@npcmr.ru
ORCID iD: 0000-0002-9661-0254
SPIN 代码: 8592-0558
Cand. Sci. (Phys.-Math.)
俄罗斯联邦, MoscowOlga V. Tashchyаn
The First Sechenov Moscow State Medical University
Email: olgatash1@rambler.ru
ORCID iD: 0000-0001-6759-6820
SPIN 代码: 3658-1120
MD, Cand. Sci. (Med.)
俄罗斯联邦, MoscowSergey S. Pirogov
P.A. Herzen Moscow Oncology Research Institute, Branch, National Medical Research Radiological Center
Email: pirogov@mail.ru
ORCID iD: 0000-0002-8101-2155
SPIN 代码: 7812-5502
MD, Dr. Sci. (Med.)
俄罗斯联邦, MoscowMaria P. Mazurova
P.A. Herzen Moscow Oncology Research Institute, Branch, National Medical Research Radiological Center
Email: mnioi_morphology@mail.ru
ORCID iD: 0000-0002-4873-4455
SPIN 代码: 4455-3055
MD, Cand. Sci. (Med.)
俄罗斯联邦, MoscowNadezhda N. Volchenko
P.A. Herzen Moscow Oncology Research Institute, Branch, National Medical Research Radiological Center
Email: mnioi_morphology@mail.ru
ORCID iD: 0000-0003-0421-4172
MD, Dr. Sci. (Med.), Professor
俄罗斯联邦, MoscowAziz K. Kamalov
P.A. Herzen Moscow Oncology Research Institute, Branch, National Medical Research Radiological Center
Email: kak6768@mail.ru
ORCID iD: 0000-0001-7376-6056
SPIN 代码: 1671-1600
俄罗斯联邦, Moscow
Yuliya F. Shumskaya
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies
Email: ShumskayaYF@zdrav.mos.ru
ORCID iD: 0000-0002-8521-4045
SPIN 代码: 3164-5518
俄罗斯联邦, Moscow
Marina G. Mnatsakanyan
The First Sechenov Moscow State Medical University
Email: mnatsakanyan08@mail.ru
ORCID iD: 0000-0001-9337-7453
SPIN 代码: 2015-1822
MD, Dr. Sci. (Med.), Professor
俄罗斯联邦, Moscow参考
- Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394–424. doi: 10.3322/caac.21492
- McColl KEL. What is causing the rising incidence of esophageal adenocarcinoma in the West and will it also happen in the East? J Gastroenterol. 2019;54(8):669–673. doi: 10.1007/s00535-019-01593-7
- Joseph A, Raja S, Kamath S, et al. Esophageal adenocarcinoma: A dire need for early detection and treatment. Cleve Clin J Med. 2022;89(5):269–279. doi: 10.3949/ccjm.89a.21053
- Uhlenhopp DJ, Then EO, Sunkara T, Gaduputi V. Epidemiology of esophageal cancer: update in global trends, etiology and risk factors. Clin J Gastroenterol. 2020;13(6):1010–1021. doi: 10.1007/s12328-020-01237-x
- Zhang HY, Spechler SJ, Souza RF. Esophageal adenocarcinoma arising in Barrett esophagus. Cancer Lett. 2009;275(2):170–177. doi: 10.1016/j.canlet.2008.07.006
- Deng HY, Alai G, Luo J, et al. Cancerous esophageal stenosis before treatment was significantly correlated to poor prognosis of patients with esophageal cancer: a meta-analysis. J Thorac Dis. 2018;10(7):4212–4219. doi: 10.21037/jtd.2018.06.89
- Sillah K, Pritchard SA, Watkins GR, et al. The degree of circumferential tumour involvement as a prognostic factor in oesophageal cancer. Eur J Cardiothorac Surg. 2009;36(2):368–373. doi: 10.1016/j.ejcts.2008.12.052
- Deng HY, Li G, Luo J. Does oesophageal stenosis have any impact on survival of oesophageal cancer patients? Interact Cardiovasc Thorac Surg. 2018;27(3):384–386. doi: 10.1093/icvts/ivy095
- Knight WRC, McEwen R, Byrne BE, et al. Endoscopic tumour morphology impacts survival in adenocarcinoma of the oesophagus. Eur J Surg Oncol. 2020;46(12):2257–2261. doi: 10.1016/j.ejso.2020.07.003
- Morozov SP, editor. I-74 Informativeness of radial diagnostics methods in various pathological conditions of the organism. Section 2: Diagnostics of pathological conditions and diseases of the gastrointestinal tract. Moscow; 2018. (In Russ).
- Ishihara R, Goda K, Oyama T. Endoscopic diagnosis and treatment of esophageal adenocarcinoma: introduction of Japan Esophageal Society classification of Barrett’s esophagus. J Gastroenterol. 2019;54(1):1–9. doi: 10.1007/s00535-018-1491-x
- Zagajnova EV, Zagajnov VE, Gladkova ND, et al. Optical coherence tomography in surgical treatment of esophageal cancer. Grekov’s Bulletin of Surgery. 2007;166(2):22–26.
- Davydov MI, Ter-Ovanesov MD, Stilidi IS, et al. Barrett’s esophagus: from theoretical foundations to practical recommendations. Practical oncology. 2003;4(2):109–119. (In Russ).
- Barber MS, Aronson JK, von Schoen-Angerer T, et al. CARe guidelines for case reports: explanation and elaboration document. Translation into Russian. Digital Diagnostics. 2022;3(1):16–42. doi: 10.17816/DD105291
- Wani S, Rubenstein JH, Vieth M, Bergman J. Diagnosis and Management of Low-Grade Dysplasia in Barrett’s Esophagus: Expert Review From the Clinical Practice Updates Committee of the American Gastroenterological Association. Gastroenterology. 2016;151(5):822–835. doi: 10.1053/j.gastro.2016.09.040
- di Pietro M, Canto MI, Fitzgerald RC. Endoscopic Management of Early Adenocarcinoma and Squamous Cell Carcinoma of the Esophagus: Screening, Diagnosis, and Therapy. Gastroenterology. 2018;154(2):421–436. doi: 10.1053/j.gastro.2017.07.041
- Winiker M, Mantziari S, Figueiredo SG, et al. Accuracy of preoperative staging for a priori resectable esophageal cancer. Dis Esophagus. 2018;31(1):1–6. doi: 10.1093/dote/dox113
- Elsadek HM, Radwan MM. Diagnostic Accuracy of Mucosal Biopsy versus Endoscopic Mucosal Resection in Barrett’s Esophagus and Related Superficial Lesions. Int Sch Res Notices. 2015;2015. doi: 10.1155/2015/735807
- Tryakin AA, Besova NS, Volkov NM, et al. Practice guidelines for drug treatment of esophageal and gastroesophageal junction cancers. Malignant tumours (Zlokačestvennye opuholi). 2021;11(3S2-1):299–313. (In Russ). doi: 10.18027/2224-5057-2021-11-3s2-20
- Ajani JA, D’Amico TA, Bentrem DJ, et al. Esophageal and Esophagogastric Junction Cancers, Version 2.2023, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2023;21(4):393–422. doi: 10.6004/jnccn.2023.0019
- Ormsby AH, Petras RE, Henricks WH, et al. Observer variation in the diagnosis of superficial oesophageal adenocarcinoma. Gut. 2002;51(5):671–676. doi: 10.1136/gut.51.5.671
补充文件