Возможности и ограничения магнитно-резонансной томографии для диагностики эндоцервикальных аденокарцином шейки матки
- Авторы: Антонова И.Б.1, Аксенова С.П.1, Нуднов Н.В.1,2,3, Кригер А.В.1
-
Учреждения:
- Российский научный центр рентгенорадиологии
- Российский университет дружбы народов имени Патриса Лумумбы
- Российская медицинская академия непрерывного профессионального образования
- Выпуск: Том 5, № 2 (2024)
- Страницы: 149-166
- Раздел: Оригинальные исследования
- Статья получена: 19.09.2023
- Статья одобрена: 04.12.2023
- Статья опубликована: 20.09.2024
- URL: https://jdigitaldiagnostics.com/DD/article/view/585195
- DOI: https://doi.org/10.17816/DD585195
- ID: 585195
Цитировать
Аннотация
Обоснование. В последние десятилетия отмечается рост аденокарцином шейки матки с 5% до 20%. Установлено, что эндоцервикальные аденокарциномы характеризуются более агрессивным течением и ранним метастазированием. В связи с трудностями цитологической диагностики аденокарциномы шейки матки лучевая диагностика играет ключевую роль на этапе установления диагноза и стадирования впоследствии. На настоящий момент исследований, посвящённых использованию магнитно-резонансной томографии в диагностике аденокарцином шейки матки, очень мало.
Цель — определить диагностическую информативность магнитно-резонансной томографии в стадировании аденокарцином шейки матки по Т-критерию, а также в оценке глубины инвазии опухоли в строму шейки матки, уточнить семиотические признаки аденокарциномы и особенности роста опухоли в матке.
Материалы и методы. В период с 2020 по 2023 год обследовано 123 пациентки с диагнозом рак шейки матки (С53). Детально проанализированы результаты обследования 22 (18%) пациенток с аденокарциномой шейки матки (средний возраст 56 лет), которым проводилась магнитно-резонансная томография органов малого таза на томографе с напряжённостью магнитного поля 1,5 Тл. Анализ информативности магнитно-резонансной томографии оценивался у 11/22 (50%) пациенток, у которых первым этапом было проведено хирургическое лечение в объёме экстирпации матки с придатками. Для анализа диагностической информативности проводилось сравнение данных магнитно-резонансной томографии и патоморфологического исследования операционного материала. Статистическая обработка результатов исследования проводилась с использованием программного приложения Microsoft Excel, JavaStat.
Результаты. В нашем исследовании аденокарцинома шейки матки определялась в 18% наблюдений среди всех случаев рака шейки матки. Информативность магнитно-резонансной томографии в оценке местной распространённости эндоцервикальных аденокарцином (по Т-критерию) составила (здесь и далее в скобках после основного значения указан 95% доверительный интервал): чувствительность — 77,78% (39,99–97,19%); специфичность — 50,00% (1,26–98,74%); предсказательная ценность положительного результата — 87,50% (62,64–96,69%); предсказательная ценность отрицательного результата — 33,33% (7,30–76,04%); точность — 72,73% (39,03–93,98%). Информативность магнитно-резонансной томографии в оценке глубины инвазии опухоли в строму шейки матки составила: отношение шансов — 3,500 (0,145–84,694); чувствительность — 85,7% (0,757–0,993), специфичность — 33,3% (0,018–0,0648), предсказательная ценность положительного результата — 75% (0,673–0,883), предсказательная ценность отрицательного результата — 50% (0,027–0,972).
Заключение. Настоящее исследование показало, что магнитно-резонансная томография является хорошим инструментом с высокими показателями диагностической информативности метода в выявлении эндоцервикальной аденокарциномы шейки матки. Выделенные в ходе анализа данных магнитно-резонансной томографии 4 типа макроструктуры опухолевого роста аденокарциномы шейки матки указывают на местноагрессивный рост опухоли, высокую частоту отсевов в эндометрий, а также позволят структурировать описательную картину врачу-рентгенологу в том числе при верифицированной аденокарциноме шейки матки, что в дальнейшем позволит лучшим образом выработать план лечения пациентки.
Полный текст
ОБОСНОВАНИЕ
Несмотря на широкое внедрение профилактических мероприятий и цитологического скрининга, а также активное лечение предраковых заболеваний, заболеваемость раком шейки матки (РШМ) остаётся на высоком уровне. По данным Всемирной организации здравоохранения, РШМ занимает 4-е место по распространённости и смертности от злокачественных новообразований у женщин в мире [1]. В развитых странах отмечается тенденция к снижению заболеваемости [1, 2]. В России РШМ стабильно занимает 5-е место в структуре онкологической заболеваемости и 10-е место в структуре онкологической смертности. При этом большинство вновь выявленных случаев заболевания приходится на женщин репродуктивного возраста (40–49 лет). В течение последнего десятилетия на 10% выросло число таких пациенток [3].
По данным метаанализа, проведённого в 2011 году, отмечается рост числа случаев выявления РШМ, ассоциированного с вирусом папилломы человека (ВПЧ) 16-го, 18-го, 31-го и других типов. Так, среди плоскоклеточных карцином шейки матки, которые до 90% случаев ассоциированы с ВПЧ, чаще всего преобладает 16-й тип (59,3% случаев) [4]. Второй по частоте встречаемости гистологический вариант карциномы шейки матки — аденокарцинома (АКШМ) — в 75% случаев ассоциирована с ВПЧ, при этом в зависимости от стран преобладает 18-й или 16-й тип. 18-й тип ВПЧ выявлен в 36,8% случаев среди всех ВПЧ-положительных АКШМ [5, 6]. Другие гистологические типы злокачественных новообразований диагностируются не более чем в 1% случаев [7, 8]. Группа АКШМ отличается значительной неоднородностью гистологических подтипов. Связь АКШМ и ВПЧ легла в основу новой патогенетической классификации IECC от 2018 года (International Endocervical Adenocarcinoma Criteria and Classification). Среди ВПЧ-зависимых АКШМ выделяют обычный тип, виллогландулярный, муцинозный, кишечный, перстневидный и ВПЧ-ассоциированную аденокарциному без дополнительного уточнения. К ВПЧ-независимым АКШМ, которые составляют 15–20%, относят желудочный, светлоклеточный, мезонефральный, серозный, эндометриоидный подтипы карциномы, а также аденокарциному без дополнительного уточнения [9, 10].
Разделение на группы — ВПЧ-зависимые и независимые эндоцервикальные аденокарциномы — определено клиническими особенностями, различным биологическим поведением опухолей, разным прогнозом и ответом на лечение. Типичным вариантом является наиболее распространённая ВПЧ-ассоциированная эндоцервикальная аденокарцинома, составляющая ~75% всех эндоцервикальных аденокарцином [10]. Эндоцервикальные аденокарциномы муцинозного типа составляют ~10% всех эндоцервикальных аденокарцином, ассоциированных с ВПЧ [9, 11]. Эндоцервикальная аденокарцинома эндометриоидного типа также встречается редко. При использовании строгих диагностических критериев она составляет менее 1% всех АКШМ и возникает на фоне эндометриоза [9, 11].
На фоне проведения скрининга и профилактики РШМ отмечается снижение заболеваемости и смертности от инвазивной плоскоклеточной карциномы шейки матки. При этом в последние десятилетия отмечается рост АКШМ с 5% до 20% [4, 10, 12]. Помимо диагностических трудностей, АКШМ характеризуются более агрессивным течением, ранним метастазированием, более низкой чувствительностью к воздействию лучевой и лекарственной терапии и представляет серьёзную проблему онкогинекологической практики [13–15]. Особенности локализации и течения АКШМ при очевидных диагностических проблемах приводят к закономерному результату, выражающемуся в выявлении опухолевого процесса на более поздних стадиях, высокой частоте рецидивов и смертности [4, 12]. Таким образом, краеугольный камень успешного лечения — совершенствование диагностических мероприятий и формирование алгоритмов ранней диагностики данного заболевания.
В настоящее время, по классификации Международной федерации акушеров-гинекологов (FIGO) от 2019 года, стадии IA2, IB1 и IIA1 относятся к локализованным формам РШМ, стадии IB2 и IIA2–IVA расценивают как местнораспространённые, а опухоли, имеющие отдалённые метастазы, соответствуют распространённой стадии опухолевого процесса (IVB) [16]. Клиническое стадирование РШМ, в частности и АКШМ, согласно пересмотренной классификации FIGO от 2018 года, основывается на комплексном обследовании и включает данные анамнеза, физикального осмотра, морфологическую верификацию, а также результаты лучевых методов диагностики: магнитно-резонансной томографии (МРТ), ультразвукового исследования, компьютерной томографии и позитронно-эмиссионной компьютерной томографии. Верное клиническое стадирование при впервые выявленном заболевании имеет определяющее влияние на успех дальнейшего лечения и прогноз [7, 16]. Стадирование локализованных форм РШМ основывается на размерах опухоли, в то же время размер первичного очага в шейке матки не будет играть значения при местнораспространённом опухолевом процессе, когда речь идёт о переходе опухоли на влагалище, параметрий, мочеточники и смежные органы. Несмотря на то, что при стадировании РШМ учитывается размер первичной опухоли, в последнем сообщении FIGO упоминается, что глубина инвазии более 50% толщины стромы шейки матки и поражение наружных отделов стромального кольца являются факторами неблагоприятного прогноза и увеличивают частоту рецидивов [16].
Говоря об АКШМ, которые развиваются не из области аденосквамозного соединения (как это позиционируется при плоскоклеточной карциноме шейки матки), а из глубины цервикального канала, внутри крипт, надо отметить, что эта особенность находит отражение в типе роста опухоли, который носит преимущественно эндофитный характер, что сопряжено с отсутствием ранних клинических проявлений и поздним обнаружением опухоли. Развитие опухоли в глубоких отделах эндоцервикса, ближе к внутреннему зеву шейки матки, приводит к тому, что опухоль одновременно распространяется на перешеек матки и эндометрий, расположенные в непосредственной близости, и инфильтрирует строму шейки матки и миометрий, имитируя рак эндометрия. При визуализации опухоли (методами ультразвукового исследования, МРТ и компьютерной томографии) на стадии одновременного вовлечения в процесс тела и шейки матки установление первичной опухолевой патологии и стадирование становятся крайне трудными задачами. Согласно классификации FIGO, при РШМ распространение опухоли на тело матки не влияет на стадию заболевания, в то время как поражение шейки матки при раке эндометрия переводит опухоль из стадии Т1 в Т2, что значимо влияет на выбор лечения и прогноз заболевания. При окончательной постановке диагноза в данных случаях ключевыми исследованиями будут являться гистологическое и иммуногистохимическое. Иммуногистохимические маркёры для дифференциальной диагностики — белок p16, рецепторы эстрогена и прогестерона, белок p53 [17]. Положительное окрашивание на белок p16 более характерно для ВПЧ-ассоциированной эндоцервикальной аденокарциномы типичного типа, а положительная реакция на рецепторы эстрогена и/или прогестерона чаще встречается при эндометриоидной аденокарциноме эндометрия, хотя может частично наблюдаться и при АКШМ [17]. Корейские исследователи во главе с J.Y. Song в 2022 году провели исследование с использованием искусственного интеллекта, обучив его дифференцировать разные подтипы РШМ и рака тела матки между собой, обозначив высокие показатели информативности предложенного алгоритма (AUC — area under curve — 0,977 для РШМ, 0,944 — для рака эндометрия, 0,939 — для дифференцировки аденокарциномы шейки и тела матки) [18].
По данным проведённого метаанализа в 2020 году, в котором рассматривали диагностическую эффективность различных методов визуализации (МРТ, ультразвуковое исследование, компьютерная томография, позитронно-эмиссионная томография) в оценке локального распространения опухоли и метастазов в лимфатические узлы у пациенток с впервые диагностированным РШМ, наибольшая чувствительность и специфичность для локальной распространённости РШМ была у метода МРТ. Для выявления метастазов в лимфатические узлы высокой специфичностью обладают все вышеперечисленные методы [19]. По данным ряда исследований, в том числе отечественных (работа Н.А. Рубцовой и соавт.), общая точность МРТ в определении стадии инвазивного РШМ составила 77–90% [20, 21]. МРТ обладает хорошей разрешающей способностью по отношению к мягким тканям и более точно определяет глубину инвазии и дооперационный размер опухоли, а конкретно — визуализация на Т2-взвешенных изображениях (ВИ). Однако информативность МРТ в оценке параметральной инвазии остаётся дискутабельной по настоящий момент, имея не очень высокий показатель чувствительности (~73–76%), связанный с высоким процентом ложноположительных результатов [22, 23]. Исследований, направленных на изучение особенностей визуализации эндоцервикальных аденокарцином с помощью МРТ, крайне мало.
ЦЕЛЬ
Определить диагностическую информативность МРТ в стадировании РШМ по Т-критерию, а также в оценке глубины инвазии эндоцервикальной аденокарциномы в строму шейки матки; уточнить семиотические признаки аденокарциномы и особенности роста опухоли в матке.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
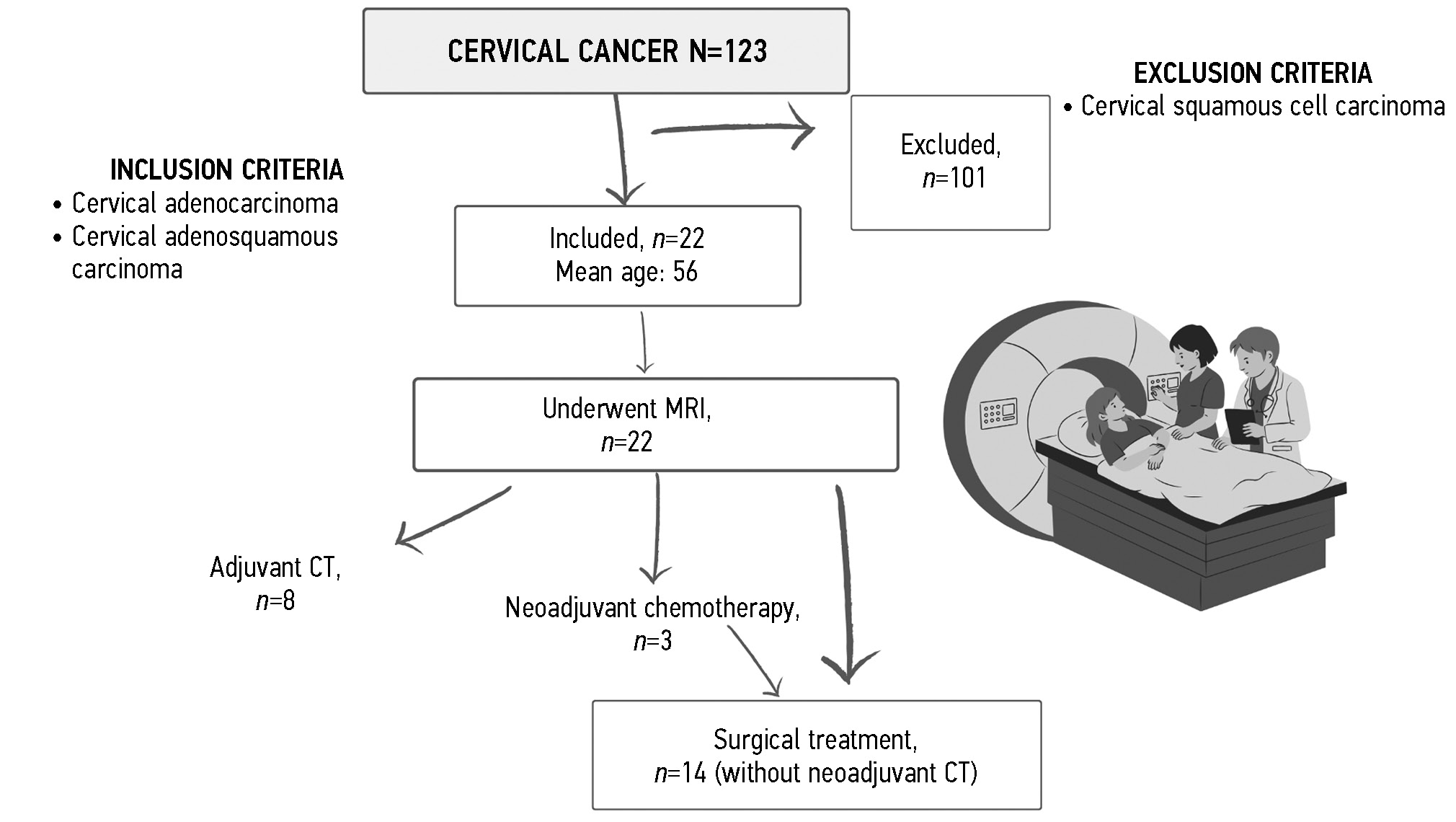
Настоящее исследование являлось одноцентровым, ретроспективным, выборочным. В исследование для определения тенденции заболеваемости АКШМ на первом этапе работы было включено 123 пациентки с диагнозом РШМ (С53), проходивших обследование и лечение в Федеральном государственном бюджетном учреждении «Российский научный центр рентгенорадиологии» Министерства здравоохранения Российской Федерации в период с 2020 по 2023 год.
В исследование включались пациентки с гистологически верифицированным РШМ. Детальному анализу подлежали пациентки с АКШМ: нами проанализированы результаты обследований 22 (18%) пациенток с данным гистологическим вариантом рака. Средний возраст пациенток c АКШМ составил 56 лет (min 35 лет, max 74 года). При анализе данных исключались пациентки с плоскоклеточным раком.
Дизайн исследования представлен на рис. 1. Распределение пациенток в зависимости от гистологического типа опухоли и степени дифференцировки представлено в табл. 1. Распределение пациенток по стадиям заболевания согласно классификации Международной федерации акушеров-гинекологов (FIGO) представлено в табл. 2.
Рис. 1. Дизайн исследования. МРТ — магнитно-резонансная томография; ХТ — химиотерапия; ШМ — шейка матки.
Таблица 1. Распределение пациенток в зависимости от гистологического типа опухоли и степени дифференцировки
Гистологический тип | Кол-во пациенток (n=22) | |
Эндоцервикальная аденокарцинома | Высокодифференцированная | 7 |
Умеренно дифференцированная | 4 | |
Низкодифференцированная | 2 | |
Серозная аденокарцинома | 3 | |
Эндометриоидная аденокарцинома | 5 | |
Железисто-плоскоклеточный рак | 1 | |
Таблица 2. Распределение пациенток по стадиям заболевания согласно классификации Международной федерации акушеров-гинекологов
Стадия | Количество пациенток (n=22) |
Рак in situ | 2 |
IB | 4 |
IB1 | 3 |
IB2 | 1 |
IIA | 1 |
IIB | 2 |
IIIB | 1 |
IIIC | 1 |
IIIC1 | 3 |
IV | 2 |
IVB | 2 |
Методы исследования
Обследование врачом акушером-гинекологом проведено у 123 женщин. При обследовании пациенток выполнялся сбор жалоб, анамнеза, бимануальное ректовагинальное обследование, осмотр влагалища и шейки матки в зеркалах, цитологическое исследование соскобов с шейки матки и из цервикального канала, гистологическое исследование биоптата шейки матки.
22 (18%) пациенткам была проведена мультипараметрическая МРТ органов малого таза на томографах с напряжённостью магнитного поля 1,5 Тл. Исследование выполнялось в положении пациенток на спине с использованием гибкой катушки для тела. В протокол мультипараметрической МРТ включались Т1- и Т2-ВИ, STIR, диффузионно-взвешенные изображения с b-факторами 0, 800 и 1000 c/мм2, а также динамическое контрастное усиление с солями гадолиния, что соответствовало требованиям проведения МРТ по протоколу ESUR (European Society of Urogenital Radiology) [24]. По рекомендациям ESUR достаточным для диагностики патологии матки в рутинной практике является b-фактор 1000 с/мм2.
По данным МРТ на Т2-ВИ оценивались: размер и глубина инвазии опухоли в строму шейки матки (пример измерения представлен на рис. 2), наличие параметральной инвазии, поражение внутреннего зева матки, поражение перешейка матки, поражение эндометрия, поражение придатков матки, поражение лимфатических узлов, наличие «питающей ножки» в опухоли. «Питающей ножкой» была обозначена область соединения опухоли и стенки матки, из которой, по нашим представлениям, исходила опухоль, и в структуре которой визуализировались питающие опухоль сосуды в артериальную и венозную фазы динамического контрастного усиления.
Рис. 2. Пример измерения глубины инвазии аденокарциномы шейки матки в строму и расстояния от опухоли до экзоцервикса на Т2-взвешенных изображениях в сагиттальной плоскости: a — опухоль расположена в верхней трети шейки матки, имеет глубину инвазии 8 мм и расположена на расстоянии 20 мм от наружного зева; b — опухоль расположена в верхней и средней третях шейки матки, имеет глубину инвазии 6 мм и расположена на расстоянии 16 мм от наружного зева. Опухоль обведена фиолетовой линией, эндоцервикальный канал отмечен розовыми линиями. Заключение патоморфологического исследования: высокодифференцированная эндоцервикальная аденокарцинома шейки матки; глубина инвазии в строму шейки матки 5 мм (менее 1/2 толщины стенки шейки матки); обнаружена ангиолимфатическая инвазия; опухоль врастает во внутренний зев; эндометрий в фазе секреции.
Оперативное лечение в объёме экстирпации матки с придатками с тазовой лимфаденэктомией выполнено 14 пациенткам (64%). У 3 пациенток (21%) оперативное лечение было проведено после курсов неоадъювантной полихимиотерапии. У 11 пациенток, у которых противоопухолевое лечение начиналось с хирургического этапа, патоморфологами были проанализированы размер и глубина инвазии АКШМ в строму шейки матки. В удалённых препаратах также оценивалось наличие инвазии опухоли в строму шейки матки, переход опухоли на влагалище, наличие параметральной инвазии, поражение тела матки (глубина инвазии в миометрий), поражение придатков матки и лимфатических узлов. Было проведено сравнение данных предоперационной МРТ, проведённой в срок не более 1 месяца до начала лечения, и данных патоморфологического исследования постоперационного материала у 11 пациенток. У 8 пациенток (36%) проводилось комплексное лечение, включающее проведение химиотерапии и сочетанной лучевой терапии.
Статистическая обработка результатов исследования проводилась с использованием программного приложения Microsoft Excel (Microsoft, США), JavaStat.
Этическая экспертиза
Заключение Независимого этического комитета при Федеральном государственном бюджетном учреждении «Российский научный центр рентгенорадиологии» Министерства здравоохранения Российской Федерации (протокол заседания № 9 от 29.09.2023): научное исследование «Возможности и ограничения МРТ в диагностике эндоцервикальных аденокарцином шейки матки» не требует заключения независимого этического комитета.
РЕЗУЛЬТАТЫ
АКШМ в нашем исследовании выявлена в 18% (22 из 123) случаев среди пациенток с диагнозом РШМ, обследованных в период 2020–2023 гг.
У 5 пациенток (23%) АКШМ была выявлена случайно при плановом осмотре гинекологом. У 13 пациенток (59%) отмечались кровянистые выделения из половых путей, у 2 пациенток (9%) — серозные выделения, у 6 пациенток (27%) манифестация заболевания возникла с тянущих болей внизу живота, у 1 пациентки (5%) имелись боли при мочеиспускании.
Фоновые заболевания шейки матки (эктропион, эрозия, хронический цервицит) в анамнезе отмечены у 8 (36%) пациенток, дисплазия шейки матки (I–III степени) — у 3 (14%). У 11 (50%) пациенток не было отмечено патологии шейки матки до установления диагноза АКШМ. Данные гинекологического осмотра представлены в табл. 3.
Таблица 3. Результаты гинекологического осмотра
Данные гинекологического осмотра | Да n (%) | Нет n (%) |
Поражение шейки матки | 10 (45) | 12 (55) |
Распространение на параметрий (клинически «тяжистость сводов») | 11 (50) | 11 (50) |
Распространение на влагалище | 11 (50) | 11 (50) |
У 2 женщин по данным МРТ (9%) опухоль не визуализировалась. Результаты данных МРТ 22 пациенток представлены в табл. 4. Средний объём опухоли, измеренный на Т2-ВИ, составил 25 см3 (min 1 см3, max 71 см3). Расчёт диагностической информативности МРТ в оценке местной распространённости АКШМ (по Т-критерию) у 11 пациенток, которым первым этапом проводилось хирургическое лечение, показал следующие результаты:
- чувствительность — 77,78% (95% доверительный интервал — ДИ — 39,99–97,19);
- специфичность — 50,00% (95% ДИ 1,26–98,74);
- предсказательная ценность положительного результата — 87,50% (95% ДИ 62,64–96,69);
- предсказательная ценность отрицательного результата — 33,33% (95% ДИ 7,30–76,04);
- точность — 72,73% (95% ДИ 39,03–93,98).
Таблица 4. Результаты данных магнитно-резонансной томографии
Параметр | Да n (%) | Нет n (%) |
Инвазия в строму шейки матки | 17 (77) | 5 (23) |
Параметральная инвазия | 9 (41) | 13 (59) |
Поражение внутреннего зева матки | 12 (55) | 10 (45) |
Поражение перешейка матки | 9 (41) | 13 (59) |
Поражение эндометрия | 6 (27) | 16 (73) |
Поражение придатков матки | 4 (18) | 18 (82) |
Поражение лимфатических узлов | 9 (41) | 13 (59) |
Наличие центрального питающего сосуда | 9 (41) | 13 (59) |
У 8 пациенток (40%) опухоль шейки матки находилась на некотором расстоянии от наружного зева, это среднее расстояние составило 11 мм (min 4 мм, max 18 мм). Таким образом, при данной локализации опухоли визуально недоступны при гинекологическом осмотре, так как наружный зев интактен. У 9 пациенток (45%) отмечалась инфильтрация влагалищной части шейки матки. Средние значения показателей измеряемого коэффициента диффузии (ИКД) в опухоли составили 0,833×10-3 мм/сек (min 0,440×10-3 мм/сек, max 0,1282×10-3 мм/сек).
Нами выделено две формы роста опухоли в строме шейки матки: наиболее часто встречающаяся — эндофитная (75%, n=15), которая характеризовалась диффузным увеличением и бочкообразной трансформацией шейки матки (рис. 3), и экзофитная, которая в нашем исследовании встречалась в 25% случаев (n=5). Экзофитная опухоль чаще имела локализацию во влагалищной части шейки матки, при этом опухолевые массы пролабировали во влагалище либо в просвет цервикального канала (см. рис. 3). Экзофитная опухоль была представлена разными гистологическими подтипами АКШМ:
- низко- и умеренно дифференцированная типичная эндоцервикальная аденокарцинома — 2 наблюдения;
- низкодифференцированная серозная аденокарцинома — 1 наблюдение;
- аденоплоскоклеточный рак — 1 наблюдение;
- эндометриоидная эндоцервикальная аденокарцинома — 1 наблюдение.
Рис. 3. Форма роста аденокарциномы шейки матки. Верхний ряд изображений представлен Т2-взвешенными изображениями в сагиттальных плоскостях, нижний — в аксиальных проекциях.
Опухоли с эндофитной формой роста также характеризовались большим разнообразием гистологических типов и дифференцировки. Нами не было выявлено связи между формой роста опухоли и её гистологическим подтипом.
Ключевым моментом в диагностическом поиске врачей-гинекологов и рентгенологов при выявлении аденокарциномы матки была дифференциальная диагностика локализации первичной опухоли: являлись ли визуализируемые изменения в матке раком эндометрия с переходом на шейку матки или АКШМ с переходом на эндометрий. Все спорные моменты с диагностической точки зрения, в которых преобладание опухоли было в полости матки, были дополнительно просмотрены патоморфологами, и у всех пациентов была подтверждена эндоцервикальная аденокарцинома — опухоль шейки матки. Так, на основании преимущественной локализации опухоли по данным МРТ и патоморфологического исследования, ретроспективно нами было отмечено и выделено четыре типа макроструктуры опухоли в зависимости от её локализации (рис. 4):
- преобладание опухолевых масс в шейке матки (n=13, 65%);
- преобладание опухолевых масс в теле матки (n=2, 10%);
- поражение эндоцервикса и эндометрия в равной степени (n=2, 10%);
- изолированное поражение шейки матки с наличием очага отсева АКШМ в полости матки (в эндометрии), подтверждённое патоморфологическим и иммуногистохимическим исследованиями (n=3, 15%).
Рис. 4. Тип макроструктуры аденокарциномы шейки матки, Т2-взвешенные изображения в сагиттальной плоскости.
Следует отметить, что опухоли типов 2, 3 и 4 при МРТ были описаны как рак тела матки, и лишь при патоморфологическом исследовании была подтверждена первичная АКШМ.
Средняя глубина инвазии аденокарциномы в строму шейки матки по результатам патоморфологического исследования составила 8,2 мм (min 2 мм, max 15 мм). Результаты данных операционного материала представлены в табл. 5.
Таблица 5. Результаты данных операционного материала 14 пациенток
Параметр | Да n (%) | Нет n (%) |
Инвазия в строму шейки матки | 13 (93) | 1 (7) |
Параметральная инвазия | 0 (0) | 14 (100) |
Поражение эндометрия | 4 (29) | 10 (71) |
Поражение придатков матки | 2 (14) | 12 (86) |
Поражение лимфатических узлов | 2 (14) | 12 (86) |
Анализ сравнения глубины инвазии по данным МРТ и постоперационного патоморфологического исследования был выполнен у 11 пациенток, которым не проводилось неоадъювантного химиотерапевтического лечения (табл. 6). По данным МРТ отмечался ложноположительный результат (гипердиагностика) в оценке глубины инвазии опухоли в строму шейки матки у 2 пациенток (18%), ложноотрицательный результат (гиподиагностика) у 1 пациентки (9%). Данные МРТ и патоморфологического исследования совпали у 8 пациенток (73%). Расхождение данных МРТ и патоморфологического исследования в пределах 4 мм расценивалось как погрешность метода, так как толщина среза МРТ (измерения проводились на Т2-ВИ) составляла 4 мм.
Таблица 6. Данные информативности магнитно-резонансной томографии в диагностике аденокарциномы шейки матки
Параметр | Чувствительность | Специфичность | ПЦПР | ПЦОР |
Оценка глубины инвазии опухоли в строму шейки матки | 85,7% (ДИ 0,757–0,993) | 33,3% (ДИ 0,018–0,0648) | 75% (ДИ 0,673–0,883) | 50% (ДИ 0,027–0,972) |
Оценка стадии опухоли по Т-критерию | 77,78% (ДИ 39,99–97,19) | 50,00% (ДИ 1,26–98,74) | 87,50% (ДИ 62,64–96,69) | 33,33% (ДИ 7,30–76,04) |
Примечание. ДИ — 95% доверительный интервал; ПЦПР — предсказательная ценность положительного результата; ПЦОР — предсказательная ценность отрицательного результата.
Таким образом, информативность МРТ в оценке глубины инвазии АКШМ в строму шейки матки составила:
- отношение шансов — 3,500 (95% ДИ 0,145–84,694);
- чувствительность — 85,7% (95% ДИ 0,757–0,993);
- специфичность — 33,3% (95% ДИ 0,018–0,0648);
- предсказательная ценность положительного результата — 75% (95% ДИ 0,673–0,883);
- предсказательная ценность отрицательного результата — 50% (95% ДИ 0,027–0,972).
При анализе отсевов АКШМ в эндометрий нами отмечен их локально инвазивный характер роста с формированием «питающей ножки» и визуализацией питающих сосудов (41%) (рис. 5).
Рис. 5. Рак шейки матки IIA стадии (T2aNoMo), умереннодифференцированная аденокарцинома, присутствует лимфоваскулярная инвазия. Магнитно-резонансная томография малого таза, опухоль в шейке матки и очаг отсева в эндометрий: a — комплексное изображение, слева направо и сверху вниз: Т2-взвешенное изображение, T1FS-взвешенное изображение с контрастным усилением (артериальная фаза динамического контрастного усиления), диффузионно-взвешенное изображение, карта измеряемого коэффициента диффузии (ИКД). Отмечены также: опухоль (очаг отсева, стрелка), область «ножки» опухоли и питающих сосудов (пунктирная стрелка). В артериальную фазу динамического контрастного усиления определяется накопление парамагнетика базальным слоем эндометрия и сосудами в «питающей ножке» опухоли; b — сагиттальная плоскость, Т2-взвешенное изображение (слева) и T1FS+C (справа). Отмечены: первичная опухоль (стрелка), отсев в теле матки (звезда), сосуды в очаге отсева (пунктирная стрелка); с — гистологическое исследование операционного материала, окраска гематоксилином и эозином, ×10; d — иммуногистохимическое исследование, экспрессия р16. Заключение патоморфологического исследования: Умеренно дифференцированная эндоцервикальная аденокарцинома шейки матки. Опухоль врастает в строму шейки матки на глубину 1,3 см (2/3 толщины стенки шейки матки в области переходной зоны). Опухоль врастает в миометрий (на глубину 0,6 см, 1/3 толщины стенки тела матки) и эндометрий. Влагалищная часть шейки матки покрыта многослойным плоским эпителием.
ОБСУЖДЕНИЕ
Аденокарцинома и смешанные аденосквамозные поражения шейки матки в нашем исследовании выявлены в 18% (22 из 123) случаев среди пациенток с диагнозом РШМ. Эти данные подтверждают относительный рост заболеваемости АКШМ, отмеченный как зарубежными исследователями (Z.F. Chan и соавт., F. Islami и соавт.), так и российскими (О.Г. Григорук и соавт.) [4, 10, 12]. Относительное увеличение частоты встречаемости АКШМ связано, как мы полагаем, с отсутствием ярких признаков заболевания (в нашем исследовании у 48% пациенток не было визуальных изменений шейки матки при гинекологическом осмотре, и определялся интактный наружный зев по данным МРТ), а также отсутствием эффективных стратегий скрининга для их выявления. По данным проведённого A. Castanon и соавт. популяционного исследования было выявлено, что существующий цитологический скрининг неэффективен в диагностике предраковых заболеваний АКШМ (аденокарциномы in situ или высокодифференцированной железистой интраэпителиальной неоплазии шейки матки), однако способствует их выявлению на более ранних стадиях (стадии IA). Это связывают с тем, что АКШМ развиваются преимущественно в эндоцервикальном канале, внутри цервикальных крипт, что затрудняет забор материала, содержащего атипичные клетки [25]. В исследовании F. Islami и соавт. отмечен рост АКШМ in situ и инвазивных форм преимущественно у молодых женщин (35–54 года) за счёт улучшенного скрининга РШМ [12]. Схожие данные получены и в исследованиях Z.F. Chan и соавт., а также D.H. Suh и соавт. [4, 26].
Говоря о предраковых заболеваниях, предвестником эндоцервикальной аденокарциномы желудочного типа является эндоцервикальная железистая гиперплазия, в том числе атипичная аденокарцинома in situ [27, 28]. В нашем исследовании у 50% пациенток имелись фоновые заболевания шейки матки (хронический цервицит и пр.), атипичная аденокарцинома in situ отмечена у 1 пациентки, у которой в анамнезе были множественные конизации шейки матки по поводу дисплазии тяжёлой степени (CIN III). Эндометриоз наблюдался у 10 пациенток.
Несмотря на высокие показатели информативности МРТ в выявлении и оценке распространённости РШМ, в нашем исследовании у 2 пациенток (9%) с гистологически верифицированной АКШМ на томограммах с мультипараметрическим принципом сканирования опухоль не визуализировалась. Мы предполагаем, что это связано с малым объёмом опухоли и её стелющимся характером роста по ходу цервикального канала, а также с техническими ограничениями метода.
При сравнении данных МРТ и патоморфологического исследования нами получены хорошие результаты:
- общая точность МРТ в оценке глубины инвазии в строму шейки матки составила 70%, чувствительность — 87,5%;
- в оценке распространения опухоли (по Т-критерию) точность составила 72,3%, чувствительность — 77,8%.
В нашем исследовании в случае с гиподиагностикой (n=1) разночтения были связаны с опухолевым распадом, который приводил к неоднородности магнитно-резонансного сигнала на Т2-ВИ и не был учтён при измерении размера. В случаях с гипердиагностикой (n=2) несоответствие было обусловлено выраженной деформацией матки на фоне смешанной формы аденомиоза и субмукозно расположенных лейомиом.
Несмотря на достаточно большое количество преимуществ МРТ, зарубежные исследования также демонстрируют достаточно частое расхождение между клиническим стадированием и хирургическими находками с тенденцией к занижению стадии заболевания, при этом чем выше стадия, тем больше это расхождение выражено. Для АКШМ эти расхождения ещё более существенны [29, 30].
Помимо объективных ошибок, при оценке распространённости различных гистологических форм РШМ к гипердиагностике приводит сопутствующая воспалительная инфильтрация, возникающая после проведения инвазивных манипуляций на шейке матки или в результате распада крупных опухолей. Гиподиагностике же способствует скопление ретенционных кист, расположенных во влагалищной порции шейки матки, в том числе вокруг наружного зева, затрудняющих оценку структуры эпителиального покрова и подлежащей шеечной стромы [31].
Возвращаясь к теме отсевов АКШМ в эндометрий, нами отмечен локально инвазивный характер роста очагов отсева в эндометрии и ряда АКШМ, локализованных в перешейке и в средней трети эндоцервикального канала, с формированием «питающей ножки» и визуализацией питающих сосудов (41%). Данная особенность описывается впервые и не анализировалась в статьях ранее. Отмеченный неоангиогенез в опухоли, при котором она получает питание от аркуатных и крупных интрамуральных сосудов миометрия, визуализируемых методом МРТ, как мы полагаем, говорит об агрессивном характере роста опухоли, высокой вероятности лимфоваскулярной инвазии (LVI+), повышению вероятности метастазирования в лимфатические узлы и неблагоприятном прогнозе. Однако, в связи с малым количеством наблюдений и отсутствием сравнения с патоморфологическими данными (ввиду ретроспективного анализа данных), выявляемые особенности носят больше наблюдательный характер и требуют дальнейших научных изысканий.
Способность АКШМ давать отсевы в эндометрий отмечена рядом исследователей, которые объясняют это теорией «seed and soil» (теория «семени и почвы») — отсоединением части раковых клеток от первичного очага опухоли, их миграцией в полость матки и имплантацией в эндометрий [32]. Факт имплантации клеток с развитием впоследствии питающих сосудов и преобладанием роста очага отсева в матке, как мы полагаем, может быть объяснён лучшим кровоснабжением миометрия в сравнении с шейкой матки, в строме которой преобладает фиброзная ткань.
Несомненно, использование диффузионно-взвешенных изображений и анализ ИКД-карт повышают эффективность метода по сравнению со стандартными режимами МРТ [33, 34]. В исследовании F. Kuang и соавт. показано, что значения коэффициента ИКД являются надёжным маркёром для дифференциации РШМ от нормальной шейки матки с высокой диагностической точностью (значения ИКД при РШМ были значительно ниже, чем у нормальной шейки матки: 0,81±0,13×10-3 мм2/сек против 1,41±0,10×10-3 мм2/сек). Значения ИКД также могут быть использованы для указания степени дифференцировки и гистологического типа РШМ, хотя существует некоторое перекрытие значений. При этом стоит отметить, что чем выше значение ИКД, тем более дифференцирована опухоль [34, 35]. В нашем исследовании средний показатель ИКД в опухоли при измерении в выбранном участке (region of interest, ROI) составил 0,833×10-3 мм2/сек (min 440×10-3 мм2/сек, max 1282×10-3 мм2/сек), что в целом совпадает с данными литературы.
Имеются данные о различии значений показателя ИКД между плоскоклеточной карциномой шейки матки и АКШМ: значения ИКД при плоскоклеточном раке значительно ниже [36].
В исследовании Y.-C. Lin и соавт. было показано, что при неоднозначной морфологии значение ИКД опухоли можно использовать для дифференцировки её гистологической принадлежности: средние значения ИКД были значительно ниже при раке эндометрия (0,766×10-3 мм2/ сек), чем при РШМ (0,969×10-3 мм2/ сек). Отмечено также, что при раке эндометрия опухоль характеризуется преимущественно продольным ростом в шейке матки, а при РШМ форма роста преимущественно овальная [37, 38]. Изучением семиотических различий между АКШМ и плоскоклеточной карциномой шейки матки занимались исследователи Е.В. Тарачкова и соавт. У 90 пациенток с гистологически верифицированным РШМ выявлено, что для аденокарциномы по сравнению с плоскоклеточным раком характерны более высокая интенсивность и меньшая неоднородность сигнала на Т2-ВИ с подавлением сигнала от жировой ткани [39].
Ключевым моментом в дифференциальной диагностике аденокарциномы матки по данным МРТ являлась установка локализации первичной опухоли. Так, эндоцервикальная аденокарцинома матки с поражением эндометрия и аденокарцинома эндометрия с распространением на шейку матки по сигнальным характеристикам в большинстве случаев неотличимы друг от друга. И, как показало данное исследование, однозначно не стоит полагаться только на анализ локализации большего объёма опухоли.
В нашем исследовании лишь в 65% (13 из 20) случаев гистологически подтверждённая эндоцервикальная АКШМ локализовалась исключительно в шейке матки. В 35% случаев (7 из 20) опухоль имитировала рак эндометрия, при этом опухолевые массы определялись как в полости матки, так и по ходу цервикального канала. А в случаях с очагами отсева эндоцервикальной аденокарциномы в эндометрий (3 из 20, 15%) у 2 пациенток размеры опухолевого импланта в эндометрии превышали размеры первичной опухоли шейки матки (см. рис. 5, d). Схожая тенденция роста АКШМ отмечена исследователями из института Джона Хопкинса — A. Yemelyanova и соавт. — в 2009 году. Учёные детально проанализировали 10 случаев АКШМ с одновременным поражением тела и шейки матки и пришли к выводу, что довольно часто эндометриоидные аденокарциномы с минимальным поражением шейки матки в конечном результате оказывались АКШМ [40].
На настоящий момент патоморфологическое и иммуногистохимическое исследования являются объективным инструментом для дифференциальной диагностики сложных случаев аденокарциномы шейки и тела матки между собой. В то же время стоит отметить, что даже патоморфологическое и иммуногистохимическое исследования не в 100% случаев позволяют установить однозначный диагноз, так как часть эндометриоидных аденокарцином довольно сложно отличить от эндоцервикальной АКШМ: возможно частичное окрашивание АКШМ последних на p16 и рецепторы эстрогена и прогестерона [17]. Диагноз аденокарциномы эндометриоидного типа РШМ следует ставить с осторожностью. У эндометриоидной аденокарциномы шейки и тела матки иммуногистохимический профиль в целом может не отличаться [41]. При одновременном поражении тела и шейки матки следует исключить распространённый вариант аденокарциномы эндометрия и яичников, а также провести корреляцию клинических и диагностических данных, так как первичная локализация опухоли будет иметь решающее значение при выборе тактики лечения и схем химиотерапии. Согласно IECC, термин «эндометриоидная эндоцервикальная аденокарцинома» должен соответствовать опухолям с эндометриоидными железами низкой степени злокачественности и подтверждаться наличием сопутствующих патологий (плоскоклеточной метаплазией или эндометриозом) [41].
Таким образом, на настоящий момент дифференциальная диагностика сложных случаев аденокарциномы шейки и тела матки должна основываться на комплексном обследовании пациенток и включать данные анамнеза и физикального осмотра, морфологическую верификацию, иммуногистохимическое исследование и результаты МРТ.
ЗАКЛЮЧЕНИЕ
В связи с инфильтративным ростом опухоли и частым её расположением в верхних отделах цервикального канала и области слизистой перешейка матки, эндоцервикальная АКШМ диагностируется на поздних стадиях. В равной степени это связано и с трудностями забора адекватного цитологического материала при ПАП-тесте и отсутствием визуализации изменений шейки матки при гинекологическом осмотре, что не позволяет своевременно выявить наличие опухоли. Поздняя диагностика эндоцервикальной АКШМ приводит к выявлению уже местнораспространённого процесса с частым прямым или метастатическим поражением эндометрия, которые имитирует первичный рак эндометрия.
Настоящее исследование показало, что МРТ является хорошим инструментом с высокими показателями диагностической информативности метода в выявлении опухолевой патологии матки. Выделенные в ходе анализа данных МРТ 4 типа макроструктуры опухолевого роста АКШМ указывают на местноагрессивный рост опухоли и высокую частоту отсевов в эндометрий, а также позволят структурировать описательную картину врачу-рентгенологу в том числе при верифицированной АКШМ, что в дальнейшем позволит лучшим образом выработать план лечения пациентки.
Имеющиеся ограничения в выявлении малых опухолей АКШМ методом МРТ связаны с преимущественно инфильтративным и стелющимся характером ростом опухоли, без увеличения размеров матки и изменения сигнальных характеристик эндоцервикса. В то же время неоднородное расширение и гиперплазия цервикального канала по данным МРТ позволяют заподозрить опухолевую патологию и своевременно направить женщину к онкогинекологу. Ввиду отсутствия чётких рекомендаций по ведению пациенток с АКШМ in situ, МРТ является методом выбора при наблюдении за данной категорией больных. В спорных моментах установки первичной принадлежности аденокарциномы матки следует полагаться на комбинирование физикальных (осмотр гинеколога), инструментальных (МРТ) и морфологических методов диагностики.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: И.Б. Антонова — концепция и дизайн исследования, согласование окончательного варианта текста; С.П. Аксенова — написание текста статьи, анализ результатов, подготовка иллюстраций, редактирование рукописи; Н.В. Нуднов — концепция и дизайн исследования, согласование окончательного варианта текста; А.В. Кригер — написание текста статьи, анализ результатов, редактирование рукописи.
Об авторах
Ирина Борисовна Антонова
Российский научный центр рентгенорадиологии
Email: Iran24@yandex.ru
ORCID iD: 0000-0003-2668-2110
SPIN-код: 6247-3917
д-р мед. наук
Россия, МоскваСветлана Павловна Аксенова
Российский научный центр рентгенорадиологии
Автор, ответственный за переписку.
Email: fabella@mail.ru
ORCID iD: 0000-0003-2552-5754
SPIN-код: 4858-4627
канд. мед. наук
Россия, МоскваНиколай Васильевич Нуднов
Российский научный центр рентгенорадиологии; Российский университет дружбы народов имени Патриса Лумумбы; Российская медицинская академия непрерывного профессионального образования
Email: nvnudnov@rncrr.ru
ORCID iD: 0000-0001-5994-0468
SPIN-код: 3018-2527
д-р мед. наук, профессор
Россия, Москва; Москва; МоскваАнна Валентиновна Кригер
Российский научный центр рентгенорадиологии
Email: dr.akriger@gmail.com
ORCID iD: 0000-0001-6823-2658
SPIN-код: 2338-6164
Россия, Москва
Список литературы
- Global health estimates: Leading causes of death. Cause-specific mortality, 2000–2019. World Health Organization; c2024. Доступ по ссылке: https://www.who.int/data/gho/data/themes/mortality-and-global-health-estimates/ghe-leading-causes-of-death
- Sung H., Ferlay J., Siegel R.L., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries // CA Cancer J Clin. 2021. Vol. 71, N 3. P. 209–249. doi: 10.3322/caac.21660
- Состояние онкологической помощи населению России в 2021 году / под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. Москва : МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2022.
- Chan Z.F., Zhi K.Z. Prevalence and attribution of high-risk HPV in different histological types of cervical cancer // Zhonghua Fu Chan Ke Za Zhi. 2019. Vol. 54, N 5. P. 293–300. doi: 10.3760/cma.j.issn.0529-567x.2019.05.002
- Li N., Franceschi S., Howell-Jones R., et al. Human papillomavirus type distribution in 30,848 invasive cervical cancers worldwide: Variation by geographical region, histological type and year of publication // Int J Cancer. 2011. Vol. 128, N 4. P. 927–935. doi: 10.1002/ijc.25396
- Nicolás I., Marimon L., Barnadas E., et al. HPV-negative tumors of the uterine cervix // Mod Pathol. 2019. Vol. 32, N 8. P. 1189–1196. doi: 10.1038/s41379-019-0249-1
- NCCN guidelines panel. Cervical Cancer. Version 1.2021 PA: National Comprehensive Cancer Network; c2024. Доступ по ссылке: https://www.nccn.org/guidelines/guidelines-detail?category=1&id=1426
- Клинические рекомендации — Рак шейки матки. ID 537. Одобрено Научно-практическим Советом Минздрава РФ. 2020. Режим доступа: https://cr.minzdrav.gov.ru/recomend/537_1
- Stolnicu S., Barsan I., Hoang L., et al. International Endocervical Adenocarcinoma Criteria and Classification (IECC): A New Pathogenetic Classification for Invasive Adenocarcinomas of the Endocervix // Am J Surg Pathol. 2018. Vol. 42, N 2. P. 214–226. doi: 10.1097/PAS.0000000000000986
- Григорук О.Г., Москвина Т.А., Цой Д.А., и др. Эндоцервикальные аденокарциномы. Цитологическая, гистологическая и молекулярно-генетическая диагностика // Опухоли женской репродуктивной системы. 2022. Т. 18, № 2. С. 109–118. doi: 10.17650/1994-4098-2022-18-2-109-118
- World Health Organization. Female Genital Tumors. In: WHO Classification of Tumours, 5th Edition, Volume 4. International Agency for Research on Cancer, 2020.
- Islami F., Fedewa S.A., Jemal A. Trends in cervical cancer incidence rates byage, race/ethnicity, histological subtype, and stage at diagnosis in the United States // Preventive Medicine. 2019. Vol. 123. P. 316–323. doi: 10.1016/j.ypmed.2019.04.010
- Hu J., Zheng P., Zhu L. Comparison of clinical pathological characteristics in ovarian preserving patients with stage IB1 cervical adenocarcinoma and squamous cell carcinoma // Journal of Peking University (Health Sciences). 2016. Vol. 48, N 5. P. 783–787. doi: 10.3969/j.issn.1671-167X.2016.05.006
- Hu K., Wang W., Liu X., et al. Comparison of treatment outcomes between squamous cell carcinoma and adenocarcinoma of cervix after definitive radiotherapy or concurrent chemoradiotherapy // Radiat Oncol. 2018. Vol. 13, N 1. P. 249. doi: 10.1186/s13014-018-1197-5
- Fan Y., Wang M., Mu Y., et al. Ovarian metastasis in women with cervical carcinoma in stages IA to IIB // Medicine (Baltimore). 2020. Vol. 99, N 31. P. e21146. doi: 10.1097/MD.0000000000021146
- Bhatla N., Aoki D., Sharma D.N., et al. Cancer of the cervix uteri: 2021 update // Int J Gynaecol Obstet. 2021. Vol. 155 Suppl. 1. P. 28–44. doi: 10.1002/ijgo.13865
- Stewart C.J.R., Crum C.P., McCluggage W.G., et al. Guidelines to Aid in the Distinction of Endometrial and Endocervical Carcinomas, and the Distinction of Independent Primary Carcinomas of the Endometrium and Adnexa From Metastatic Spread Between These and Other Sites // Int J Gynecol Pathol. 2019. Vol. 38 Suppl. 1, N 1 Suppl. 1. P. S75–S92. doi: 10.1097/PGP.0000000000000553
- Song J., Im S., Lee S.H., Jang H.J. Deep Learning-Based Classification of Uterine Cervical and Endometrial Cancer Subtypes from Whole-Slide Histopathology Images // Diagnostics (Basel). 2022. Vol. 12, N 11. P. 2623. doi: 10.3390/diagnostics12112623
- Woo S., Atun R., Ward Z.J., et al. Diagnostic performance of conventional and advanced imaging modalities for assessing newly diagnosed cervical cancer: systematic review and meta-analysis // Eur Radiol. 2020. Vol. 30, N 10. P. 5560–5577. doi: 10.1007/s00330-020-06909-3
- Merz J., Bossart M., Bamberg F., et al. Revised FIGO Staging for Cervical Cancer — A New Role for MRI // Rofo. 2020. Vol. 192, N 10. P. 937–944. doi: 10.1055/a-1198-5729
- Рубцова Н.А., Новикова Е.Г., Синицын В.Е. Возможности МРТ в предоперационной оценке местной распространенности рака шейки матки // Акушерство, гинекология и репродукция. 2012. Т. 6, № 3. С. 6–13. EDN: PUVJZT
- Balcacer P., Shergill A., Litkouhi B. MRI of cervical cancer with a surgical perspective: staging, prognostic implications and pitfalls // Abdom Radiol (NY). 2019. Vol. 44, N 7. P. 2557–2571. doi: 10.1007/s00261-019-01984-7
- Woo S., Suh C.H., Kim S.Y., et al. Magnetic resonance imaging for detection of parametrial invasion in cervical cancer: An updated systematic review and meta-analysis of the literature between 2012 and 2016 // European Radiology. 2018. Vol. 28, N 2. P. 530–541. doi: 10.1007/s00330-017-4958-x
- Alt C.D., Bharwani N., Danza F.M., et al. ESUR Quick Guide to Female Pelvis Imaging. ESUR, 2019. Доступ по ссылке: https://www.researchgate.net/publication/334725882_ESUR_Quick_Guide_to_Female_Pelvis_Imaging
- Castanon A., Landy R., Sasieni P.D. Is cervical screening preventing adenocarcinoma and adenosquamous carcinoma of the cervix? // Int J Cancer. 2016. Vol. 139, N 5. P. 1040–1045 doi: 10.1002/ijc.30152
- Suh D.H., Ha H.I., Lee Y.J., et al. Incidence and treatment outcomes of uterine cervical cancer in Korea 1999–2018 from the national cancer registry // J Gynecol Oncol. 2023. Vol. 34, N 2. P. e39. doi: 10.3802/jgo.2023.34.e39
- Miyamoto T., Kobara H., Shiozawa T. Biology and management of lobular endocervical glandular hyperplasia // J Obstet Gynaecol Res. 2022. Vol. 48, N 12. P. 3056–3067. doi: 10.1111/jog.15441
- Kerwin C.M., Markese M., Moroney M.R., et al. Adenocarcinoma of the uterine cervix, gastric-type (GAS): a review of the literature focused on pathology and multimodality imaging // Abdom Radiol (NY). 2023. Vol. 48, N 2. P. 713–723. doi: 10.1007/s00261-022-03724-w
- Marnitz S., Tsunoda A.T., Martus P., et al. Surgical versus clinical staging prior to primary chemoradiation in patients with cervical cancer FIGO stages IIB–IVA: oncologic results of a prospective randomized international multicenter (Uterus-11) intergroup study // Int J Gynecol Cancer. 2020. Vol. 30, N 12. P. 1855–1861. doi: 10.1136/ijgc-2020-001973
- Akhavan S., Mousavi A., Sheikh Hassani S., et al. Evaluation of Cervical Cancer Staging Based on Magnetic Resonance Imaging in Comparison with Surgical Staging // Int J Cancer Manag. 2023. Vol. 16, N 1. P. e126966. doi: 10.5812/ijcm-126966
- Трухачёва Н.Г., Фролова И.Г., Коломиец Л.А., и др. Оценка степени распространённости рака шейки матки при использовании МРТ // Сибирский онкологический журнал. 2015. № 2. С. 64–70. EDN: TSLSAD
- Horn L.C., Höhn A.K., Stark S., et al. Endocervical adenocarcinoma in situ (AIS) with ovarian and pulmonary involvement: report of a case and review of the literature suggesting a “seed and soil hypothesis” // J Cancer Res Clin Oncol. 2019. Vol. 145, N 8. P. 2061–2069. doi: 10.1007/s00432-019-02966-4
- Mao L., Zhang X., Chen T., et al. High-resolution reduced field-of-view diffusion-weighted magnetic resonance imaging in the diagnosis of cervical cancer // Quant Imaging Med Surg. 2023. Vol. 13, N 6. P. 3464–3476. doi: 10.21037/qims-22-579
- Kuang F., Ren J., Zhong Q., et al. The value of apparent diffusion coefficient in the assessment of cervical cancer // Eur Radiol. 2013. Vol. 23, N 4. P. 1050–1058. doi: 10.1007/s00330-012-2681-1
- Wang M., Perucho J.A.U., Chan Q. Diffusion Kurtosis Imaging in the Assessment of Cervical Carcinoma // Acad Radiol. 2020. Vol. 27, N 5. P. E94–E101. doi: 10.1016/j.acra.2019.06.022
- Monist M., Lewkowicz D., Piętak P., et al. Synchronously occurring endometrioid carcinomas of the uterine corpus and uterine cervix preceded by different precancerous lesions: A case study and a literature review // Pathol Res Pract. 2023. Vol. 245. P. 154452. doi: 10.1016/j.prp.2023.154452
- Lin Y.C., Lin G., Chen Y.R., et al. Role of magnetic resonance imaging and apparent diffusion coefficient at 3T in distinguishing between adenocarcinoma of the uterine cervix and endometrium // Chang Gung Med J. 2011. Vol. 34, N 1. P. 93–100.
- Gui B., Lupinelli M., Russo L., et al. MRI in uterine cancers with uncertain origin: Endometrial or cervical? Radiological point of view with review of the literature // European journal of radiology. 2022. Vol. 153. P. 110357. doi: 10.1016/j.ejrad.2022.110357
- Тарачкова Е.В., Шориков М.А., Панов В.О., и др. Возможности мультипараметрической магнитно-резонансной томографии в дифференциальной диагностике гистологического типа рака шейки на дооперационном этапе // Опухоли женской репродуктивной системы. 2016. Т. 12, № 2. С. 60–69. doi: 10.17650/1994-4098-2016-12-2-60-69
- Yemelyanova A., Vang R., Seidman J.D., Gravitt P.E., Ronnett B.M. Endocervical adenocarcinomas with prominent endometrial or endomyometrial involvement simulating primary endometrial carcinomas: utility of HPV DNA detection and immunohistochemical expression of p16 and hormone receptors to confirm the cervical origin of the corpus tumor // Am J Surg Pathol. 2009. Vol. 33, N 6. P. 914–924. doi: 10.1097/PAS.0b013e3181971fdd
- Jain P., Aggarwal A., Ghasi R.G., et al. Role of MRI in diagnosing the primary site of origin in indeterminate cases of uterocervical carcinomas: a systematic review and meta-analysis // Br J Radiol. 2022. Vol. 95, N 1129. P. 20210428. doi: 10.1259/bjr.20210428
Дополнительные файлы