Трудности лучевой диагностики зрелой тератомы надпочечника, имитирующей нейробластому, у ребёнка
- Авторы: Щелканова Е.С.1, Терещенко Г.В.1, Краснов А.С.1
-
Учреждения:
- Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева
- Выпуск: Том 5, № 2 (2024)
- Страницы: 379-389
- Раздел: Клинические случаи и серии клинических случаев
- Статья получена: 27.10.2023
- Статья одобрена: 13.02.2024
- Статья опубликована: 20.09.2024
- URL: https://jdigitaldiagnostics.com/DD/article/view/622768
- DOI: https://doi.org/10.17816/DD622768
- ID: 622768
Цитировать
Аннотация
Наиболее частое образование надпочечников у детей раннего возраста — это нейробластома, в дифференциальный ряд которой включены такие образования, как нефробластома, кровоизлияние в надпочечник, ангиомиолипома, миелолипома и аденома. В данной статье описан случай одной из самых редких опухолей надпочечников у детей — тератомы, которая на начальных этапах диагностики, несмотря на крупный размер, демонстрировала все рентгенологические и гистологические признаки нейробластомы.
Тератомы — это герминогенно-клеточные опухоли, обычно обнаруживаемые в области гонад. Тератомы надпочечников встречаются крайне редко и составляют около 0,13% всех образований надпочечников. Как правило, тератомы надпочечников протекают бессимптомно за счёт того, что забрюшинное пространство достаточно обширно для свободного роста образования.
Впервые в отечественной литературе нами представлен клинический случай тератомы надпочечника у ребёнка в возрасте 3 месяцев. В статье также подробно описан ход диагностических исследований и те сложности, с которыми рентгенологи и клиницисты столкнулись, встретив распространённую в детском возрасте опухоль в очень редкой для неё локализации.
Данная статья может помочь врачам повысить осведомлённость о таком редком заболевании и включить тератому надпочечников в потенциальный дифференциальный ряд новообразований надпочечников.
Ключевые слова
Полный текст
АКТУАЛЬНОСТЬ
Первичные опухоли надпочечников относятся к одному из важных и трудных в диагностическом и лечебном плане разделов клинической онкологии.
Четвёртое издание классификации эндокринных опухолей Всемирной организации здравоохранения, опубликованное в 2017 году, делит все опухоли надпочечников на две большие группы [1]:
1) опухоли коры надпочечников;
2) опухоли мозгового вещества надпочечников и вненадпочечниковых параганглиев.
В первую группу входят опухоли, возникающие из коры надпочечников или преимущественно поражающие её: аденокарцинома, аденома, стромальные опухоли полового тяжа, аденоматоидная опухоль, мезенхимальные и стромальные опухоли (миелолипома и шваннома), гематолимфоидные опухоли.
Во вторую группу включены: феохромоцитома, параганглиома и нейробластные опухоли надпочечников (нейробластома, ганглионейробластома, ганглионеврома).
На сегодняшний день нейробластома является наиболее распространённой опухолью надпочечников у детей, а в её дифференциальный ряд включены такие образования, как нефробластома, кровоизлияние в надпочечник, ангиомиолипома, миелолипома и аденома [2–4].
В данной статье мы хотим сообщить о случае первичной зрелой тератомы левого надпочечника у ребёнка, которая первоначально была расценена как нейробластома, а также привести дифференциальный ряд данной патологии.
Проведённый нами обзор литературы показал, что в мире описано около 20 подобных случаев среди детского населения [3, 5, 6]. При этом нам не удалось найти ни одного описанного случая в отечественной литературе.
ОПИСАНИЕ СЛУЧАЯ
Анамнез
Пациентка, девочка, больна с августа 2020 года, когда в возрасте 2 месяцев на плановом ультразвуковом исследовании (УЗИ) органов брюшной полости обнаружили объёмное образование левой почки (объём 197 см3). Анамнез жизни ребёнка без особенностей.
Из истории заболевания известно следующее:
21.09.2020 — Ребёнок был госпитализирован в урологическое отделение по месту жительства. Онкомаркёры от 22.09.2020:
- нейронспецифическая енолаза (NSE) повышена до 24,7 нг/мл (при норме 0–16,3 нг/мл);
- альфа-фетопротеин (АФП) повышен до 971 нг/мл (при норме 323±278 нг/мл).
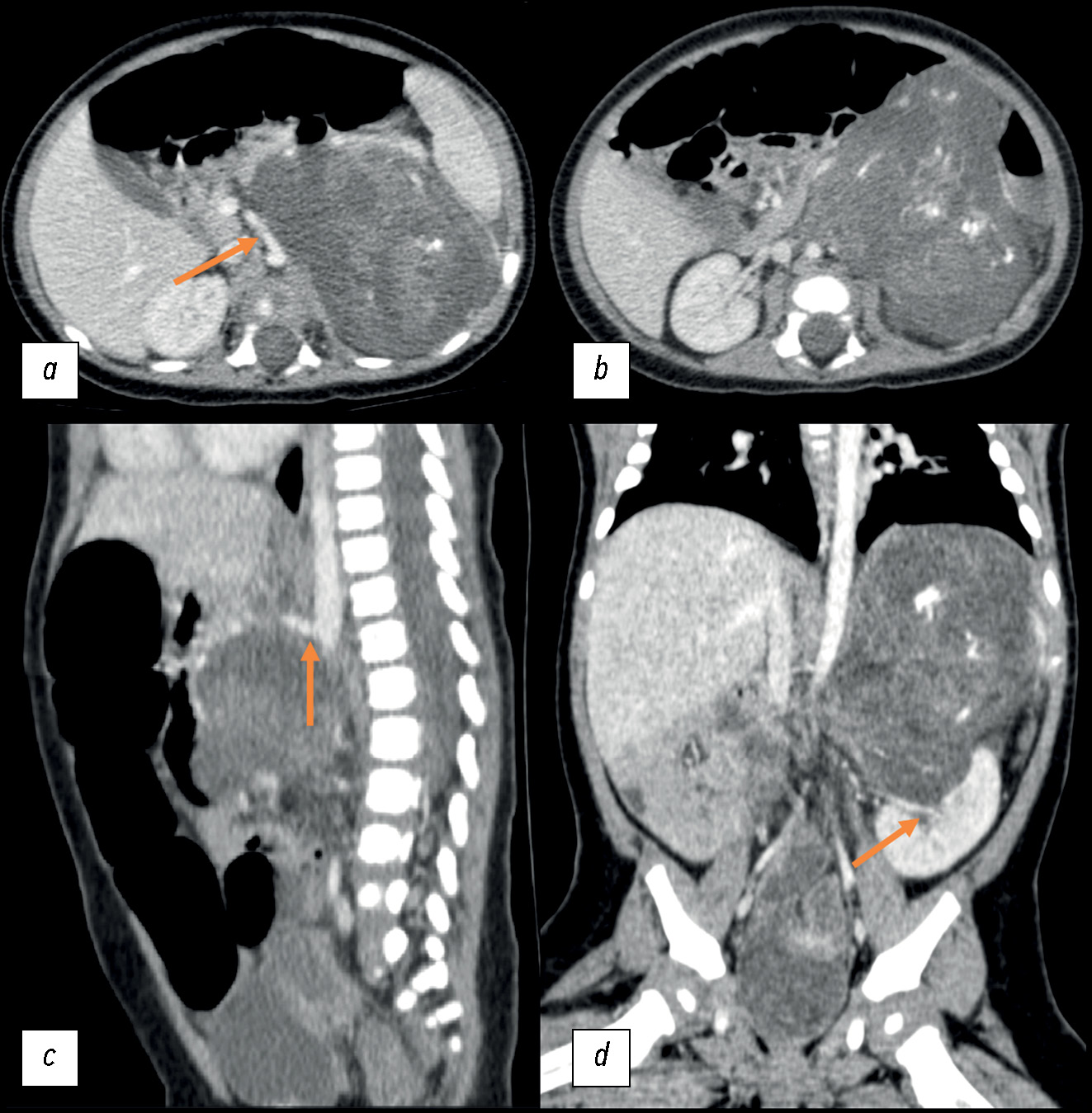
23.09.2020 — По результатам мультиспиральной компьютерной томографии (МСКТ) органов брюшной полости с контрастным усилением определялось массивное объёмное образование забрюшинно слева, размерами 81×71×87 мм (объём 260 см3), неоднородной структуры, с наличием кальцинатов и кистозных включений, со слабым накоплением контрастного препарата. Образование распространялось в область почечного синуса, чётких признаков распространения на паренхиму почки не отмечалось. Надпочечник был распластан по латеральному контуру. Почечные сосуды слева проходили по контуру опухоли, верхняя брыжеечная артерия была смещена вправо, чревный ствол — вверх (рис. 1).
Рис. 1. Первичная компьютерная томография органов брюшной полости с внутривенным контрастированием от 23.09.2020, картина объёмного образования забрюшинного пространства слева: a — аксиальная плоскость, стрелкой указано смещение верхней брыжеечной артерии вправо; b — аксиальная плоскость; c — сагиттальная плоскость, стрелкой указано смещение чревного ствола вверх; d — корональная плоскость, стрелкой указано распространение опухоли в почечный синус.
29.09.2020 — Результат анализа миелограммы: опухолевые клетки не обнаружены.
В начале октября было выполнено оперативное вмешательство в объёме лапаротомии и биопсии образования забрюшинного пространства. Гистологически верифицирована низкодифференцированная нейробластома. Пересмотр гистологических препаратов в Федеральном государственном бюджетном учреждении «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» Министерства здравоохранения Российской Федерации также подтвердил диагноз. Цитогенетическое исследование не было проведено из-за скудного материала.
После обследования был выставлен клинический диагноз: «Нейробластома забрюшинного пространства слева, с распространением в брюшную полость», и начата терапия по протоколу NB-2004.
16.10.2020 — В целях оценки динамики опухоли по месту жительства была назначена магнитно-резонансная томография (МРТ), где было выявлено прогрессирование заболевания в виде увеличения размеров опухоли до 104×77×118 мм (объём 491 см3). Визуализировалась кистозно-солидная структура образования с наличием участков кровоизлияния, с признаками активного накопления контрастного препарата. Надпочечник был распластан по латеральному контуру образования. Почечные сосуды слева проходили по контуру опухоли, верхняя брыжеечная артерия была смещена вправо, чревный ствол — вверх. В исследовании не были представлены контрастные серии и взвешенности с подавлением сигнала от жировой ткани (рис. 2).
Рис. 2. Магнитно-резонансная томография органов брюшной полости от 16.11.2020: a — Т1-взвешенное изображение в сагиттальной проекции; b — Т2-взвешенное изображение в сагиттальной проекции; c, d — Т1-взвешенные изображения в аксиальной проекции, объёмное образование левого надпочечника, с увеличением в динамике. Оранжевыми стрелками показаны сниженные сигналы от кистозного компонента опухоли, синей стрелкой показан повышенный сигнал от солидного компонента опухоли.
Госпитализация
В связи с прогрессией заболевания ребёнок был госпитализирован в Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева в отделение клинической онкологии для проведения дообследования и решения дальнейшей тактики лечения.
При поступлении в стационар был повторно взят анализ на NSE: повышен до 19,64 нг/мл (при норме 0–16,3 нг/ мл). Для исключения гормонпродуцирующей опухоли взяли биохимический анализ на кортизол: 17,3 мкг/дл (при норме 3,7–19,4 мкг/дл).
30.10.2020 — Была выполнена сцинтиграфия с метайодбензилгуанидином, по результатам которой достоверных данных за накопление опухолью радиофармацевтического препарата получено не было (рис. 3).
Рис. 3. Сцинтиграфия c метайодбензилгуанидином от 30.10.2020. Накопление опухолью радиофармпрепарата не определяется.
01.11.2020 — С целью уточнения характера опухоли было повторно выполнено МРТ-исследование с контрастным усилением, где на серии сканов брюшной полости сохранялись признаки объёмного кистозно-солидного образования в забрюшинном пространстве слева, неправильной формы, с достаточно чёткими и ровными контурами, с наличием внутриопухолевых кровоизлияний (участки ограничения диффузии на диффузионно-взвешенных изображениях) и жировых включений (выпадение сигнала в режиме SPIR), общими размерами до 89×112×141 мм (объём 731 см3). Отмечалось увеличение объёма опухоли на 49% в сравнении с предыдущим исследованием. При внутривенном контрастировании опухоль фрагментарно накапливала магнитно-резонансное контрастное средство в солидных компонентах. Опухоль каудально дистопировала левую почку в область малого таза. Левый надпочечник не визуализировался. Селезёнка была оттеснена кпереди, граница с опухолью прослеживалась отчётливо. Селезёночные сосуды проходили по переднему контуру опухоли, чревный ствол — по медиальному контуру. Поджелудочная железа была распластана по переднему контуру опухоли, интимно прилегала к ней. Верхняя граница опухоли прилежала к левому куполу диафрагмы, оттесняя его каудально, за счёт чего наблюдалось уменьшение объёма левого лёгкого (рис. 4).
Рис. 4. Магнитно-резонансная томография брюшной полости с контрастным усилением от 01.11.2020 в корональной (a) и аксиальной (b–e) плоскостях: a — Т2-взвешенное изображение, уменьшение объёма левого лёгкого за счёт давления опухолью на левый купол диафрагмы (двойная оранжевая стрелка), дистопия левой почки в область таза (оранжевая стрелка); b — Т2-взвешенное изображение, множественные кисты в структуре опухоли (оранжевая стрелка); c — Т1-взвешенное изображение +С, фрагментарное накопление контрастного средства в солидных компонентах (оранжевая стрелка); d — T2 SPIR, выпадение сигнала от жировых включений опухоли (оранжевый круг); e — диффузионно-взвешенное изображение, участки ограничения диффузии от внутриопухолевых кровоизлияний (оранжевые стрелки).
По результатам МРТ-исследования, в связи с выявлением жировых включений (подавление сигнала в режиме SPIR), которые не характерны для нейробластомы, впервые была заподозрена герминогенно-клеточная опухоль — тератома забрюшинного пространства (левого надпочечника?) или опухоли мезенхимальной природы.
На следующий день была проведена компьютерная томография брюшной полости, где было подтверждено наличие кальцинатов и жировых включений в кистозно-солидном образовании со слабым накоплением контрастного вещества (рис. 5).
Рис. 5. Компьютерная томография органов брюшной полости с контрастным усилением от 01.11.2020: a, b — аксиальная проекция; c — сагиттальной проекция; d — корональная проекция. Оранжевые стрелки указывают на гиподенсивные (жировые) включения в структуре опухоли, плотностью –80 HU; синие стрелки указывают на кальцинаты.
Учитывая полученные данные об увеличении опухоли на фоне проведения 1 курса полихимиотерапии, характеристики опухоли с признаками наличия включений жира и инфильтрации опухолью области почечного синуса, а также ввиду отсутствие данных цитогенетического исследования, ребёнку было показано хирургическое вмешательство в объёме релапаротомии, удаления образования забрюшинного пространства, с целью проведения планового гистологического и цитогенетического исследований.
04.11.2020 — Была выполнена операция в следующем объёме: лапаротомия, удаление образования забрюшинного пространства, стентирование левого мочеточника.
09.11.2020 — В лабораторных анализах отмечалась нормализация концентрации АФП: 51 нг/мл.
При гистологическом исследовании морфологическая картина соответствовала зрелой тератоме левого надпочечника. Опухоль первично исходила из мозгового вещества надпочечника.
Таким образом, пациенту был установлен окончательный диагноз: «Зрелая тератома левого надпочечника».
Ребёнок в возрасте 5 мес в стабильном соматическом статусе был выписан под динамическое наблюдение детского онколога по месту жительства. Показаний для продолжения специфической терапии не было.
ОБСУЖДЕНИЕ
Тератомы представляют собой герминогенно-клеточные опухоли, происходящие из тотипотентных клеток [5]. Они содержат хорошо дифференцированные или не полностью дифференцированные элементы как минимум двух слоёв зародышевых клеток (энтодермы, эктодермы и/или мезодермы).
Считается, что первичное забрюшинное вовлечение возникает в результате прерывания нормальной эмбриологической миграции первичных зародышевых клеток в различных точках между их происхождением в желточном мешке и их конечным пунктом назначения в половых валиках [7]. Тератомы делят на 4 гистологических варианта: зрелые, незрелые, тератомы со злокачественной трансформацией и монодермальные [7]. Зрелые тератомы хорошо дифференцированы по отношению к зародышевым слоям клеток. Незрелые тератомы не полностью дифференцированы и сходны с фетальной или эмбриональной тканью [8]. Тератомы в своей структуре могут содержать волосы, кожу, зубы, нервы, жировую ткань, хрящи и так далее [3]. Тератомы вне половых желёз встречаются редко, а тератомы надпочечников встречаются ещё реже. Самое большое из найденных нами исследований заболеваний надпочечников было проведено в Китае на базе Пекинского союзного медицинского колледжа, где в период с марта 2009 г. по февраль 2014 г. проходили лечение 3901 пациент, из которых пять пациентов (4 взрослых и один ребёнок 16 лет) имели диагноз «первичная тератома надпочечников», что составило всего 0,13% [9].
Больные тератомой надпочечников обычно не имеют клинических проявлений, так как забрюшинное пространство достаточно обширно для свободного роста. Некоторые пациенты жалуются на боль в пояснице, пальпируемое образование в животе, боль в верхней части живота [3].
УЗИ органов брюшной полости обычно является первым методом визуализации, используемым в педиатрии. Антенатальное ультразвуковое исследование плода и профилактическое проведение УЗИ органов брюшной полости и забрюшинного пространства в 1-й месяц после рождения увеличило выявление образований на ранней стадии [10]. С помощью УЗИ можно идентифицировать кистозные, солидные и другие сложные компоненты опухоли [11].
МСКТ и МРТ полезны для определения распространённости заболевания в забрюшинном пространстве и его связи с крупными сосудами, что обеспечивает лучшее предоперационное планирование и повышает вероятность полного удаления опухоли с меньшим ятрогенным повреждением [12]. Жировые включения, образование кист и кальцификация считаются важными предикторами доброкачественности тератомы при МСКТ [13]. МРТ демонстрирует высокую естественную контрастность мягких тканей, а также обладает большей чувствительностью к мелким включениям жира при использовании последовательностей с жироподавлением. Забрюшинные тератомы могут экспрессировать АФП, и его концентрация в сыворотке является хорошим показателем для диагностики и оценки рецидива опухоли [14].
Данный клинический случай наглядно демонстрирует необходимость внимательного изучения структуры опухолевого узла и оценки плотности различных её элементов. Ретроспективный анализ ошибок, допущенных при диагностике пациента, показал, что предположить диагноз тератомы можно было уже на первичном МСКТ органов брюшной полости за счёт наличия мелких гиподенсивных включений плотностью –70 HU, что соответствует жировому компоненту опухоли, который не характерен для нейробластомы (рис. 6).
Рис. 6. Инициальная компьютерная томография органов брюшной полости с контрастным усилением, в аксиальной проекции от 23.09.2020. Стрелками показаны мелкие гиподенсивные включения в структуру опухоли, плотностью –70 HU.
Кроме того, в пользу тератомы надпочечника говорил тот факт, что опухоль имела чёткий ровный контур, смещала сосуды, не окружая их, в отличие от нейробластомы, которая имеет нечёткий неровный контур и вовлекает сосуды, инфильтрируя их. Наличие кистозно-солидного компонента и кальцификации характерно для обоих опухолей. Отсутствие накопления радиофармпрепарата при сцинтиграфии, низкая концентрация NSE и высокая концентрация АФП также говорят в пользу тератомы. Ошибки гистологического исследования, вероятно, связаны с биопсией малоинформативного участка ткани и скудностью материала.
Следует отметить, что, за исключением нейробластом, опухоли надпочечников чрезвычайно редко встречаются у детей. Тератомы следует дифференцировать с другими опухолями, содержащими жировой компонент и участки кальцификации.
К жиросодержащим образованиям надпочечника относят миелолипому, липому и миелосаркому, микроскопическое включение жира могут иметь аденома, феохромацитома и адренокортикальная карцинома.
Миелолипома в основном диагностируется в возрасте от 50 до 70 лет и чаще в области правого надпочечника [15]. Рентгенологически на МСКТ имеет большие очаги жировой ткани с «дымчатыми» или «пёстрыми» областями вкраплений ткани с более высокой плотностью от 20 до 30 HU (миелоидные элементы). В редких случаях может содержать включения из мелких кальцинатов.
Липома надпочечника — очень редкая патология, с медианой возраста 54 года, чаще всего поражающая правый надпочечник. В отличие от тератомы, это гомогенное гиподенсивное образование, состоящее исключительно из жирового компонента [16].
Не стоит также исключать из дифференциального диагноза липосаркому, хоть она и крайне редко встречается в детском возрасте. Для неё характерны нечёткие, неровные контуры, инвазия в окружающие ткани и сосуды. Часто визуализируются метастазы [17].
Наиболее распространёнными образованиями надпочечника, содержащими кальцинаты в структуре, являются метастатическое поражение (как известно, у пациента в данном клиническом случае это была первичная опухоль, других новообразований найдено не было) и туберкулёзное поражение (эпидемиологическое окружение пациента чистое, данных за туберкулёзный процесс нет) [3].
ЗАКЛЮЧЕНИЕ
Первичная тератома надпочечника встречается крайне редко, но имеет при этом классические рентгенологические признаки, которые в некоторых случаях могут быть очень схожи с другими широко распространёнными опухолями детского возраста данной локализации. В продемонстрированном случае у рентгенолога была возможность предположить наличие данного заболевания уже на начальных этапах диагностического поиска. Отсутствие настороженности в отношении редкой локализации, невнимательность при оценке структуры опухолевого узла и неверная трактовка данных гистологического исследования привели к ошибкам в постановке диагноза. Демонстрация редких случаев из практики и работа над ошибками являются важными элементами повышения качества лучевой диагностики.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении работы.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: Е.С. Щелканова — обзор публикаций по теме статьи, подготовка текста рукописи, подготовка списка литературы; Г.В. Терещенко — утверждение окончательного варианта публикации; А.С. Краснов — редактирование текста рукописи.
Информированное согласие на публикацию. Авторы получили письменное согласие законных представителей пациента на публикацию медицинских данных и фотографий в журнале Digital Diagnostics.
ADDITIONAL INFORMATION
Funding source. This article was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. E.S. Shchelkanova — review of publications on the topic of the article, writing the text of the article, preparation of a list of references; G.V. Tereshchenko — approval of the final version of the publication; A.S. Krasnov — editing the text of the manuscript.
Consent for publication. Written consent was obtained from the patient’s legal representatives for publication of relevant medical information and all of accompanying images within the manuscript in Digital Diagnostics Journal.
Об авторах
Екатерина Сергеевна Щелканова
Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева
Автор, ответственный за переписку.
Email: dr.shelkanova@yandex.ru
ORCID iD: 0009-0002-3582-8783
SPIN-код: 9198-4674
Россия, Москва
Галина Викторовна Терещенко
Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева
Email: Galina.Tereshenko@fccho-moscow.ru
ORCID iD: 0000-0001-7317-7104
SPIN-код: 9413-2500
канд. мед. наук
Россия, МоскваАлексей Сергеевич Краснов
Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева
Email: Alexey.Krasnov@fccho-moscow.ru
ORCID iD: 0000-0003-1099-9332
SPIN-код: 3238-4124
Россия, Москва
Список литературы
- WHO Classification of Tumours Editorial Board. WHO classification of tumours of endocrine organs, 4th ed. Lloyd R.V., Osamura R.Y., Kloppel G., Rosai J., editors. Lyon : International Agency for Research on Cancer, 2017.
- Emre Ş., Özcan R., Bakır A.C., Kuruğoğlu S., et al. Adrenal masses in children: Imaging, surgical treatment and outcome // Asian J Surg. 2020. Vol. 43, N 4. P. 207–212. doi: 10.1016/j.asjsur.2019.03.012
- He C., Yang Y., Yang Y., et al. Teratoma of the adrenal gland: clinical experience and literature review // Gland Surg. 2020. Vol. 9, N 4. P. 1056–1064. doi: 10.21037/gs-20-648
- Феоктистова Е.В., Ускова Н.Г., Варфоломеева С.Р., и др. Дифференциальная диагностика кистозной формы нейробластомы и кровоизлияния в надпочечник у детей первых месяцев жизни // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2017. Т. 16, № 1. С. 62–68. doi: 10.24287/1726-1708-2017-16-1-62-68
- Wang X., Li X., Cai H., et al. Rare Primary Adrenal Tumor: A Case Report of Teratomas and Literatures Review // Front Oncol. 2022. Vol. 12. P. 830003. doi: 10.3389/fonc.2022.830003
- AlQattan A., Alsharit M., Alsaihaty E., et al. The ‘’Monstrous tumor’’ of Adrenal gland: A case report and review of literature on adrenal teratomas // Int. J. Surg. Open. 2023. Vol. 60. P. 100696. doi: 10.1016/j.ijso.2023.100696
- Craig W.D., Fanburg-Smith J.C., Henry L.R., et al. Fat-containing lesions of the retroperitoneum: radiologic-pathologic correlation // Radiographics. 2009. Vol. 29, N 1. P. 261–290. doi: 10.1148/rg.291085203
- Wetherell D., Weerakoon M., Williams D., et al. Mature and Immature Teratoma: A Review of Pathological Characteristics and Treatment Options // Med Surg Urol. 2014. Vol. 3, N 1. P. 124. doi: 10.4172/2168-9857.1000124
- Li S., Li H., Ji Z., Yan W., Zhang Y. Primary adrenal teratoma: Clinical characteristics and retroperitoneal laparoscopic resection in five adults // Oncol Lett. 2015. Vol. 10, N 5. P. 2865–2870. doi: 10.3892/ol.2015.3701
- Sandoval J.A., Williams R.F. Neonatal Germ Cell Tumors // Curr Pediatr Rev. 2015. Vol. 11, N 3. P. 205–215. doi: 10.2174/1573396311666150714105531
- Wootton-Gorges S.L., Thomas K.B., Harned R.K., et al. Giant cystic abdominal masses in children // Pediatr Radiol. 2005. Vol. 35, N 12. P. 1277–1288. doi: 10.1007/s00247-005-1559-7
- Zhao Z., Deng X., Peng L., Kong X. Case Report Management of retroperitoneal teratoma in infants younger than one-year-old // Int J Clin Exp Med. 2018. Vol. 11, N 2. P. 1362–1366.
- Singh A.P., Jangid M., Morya D.P., Gupta A. Retroperitoneal Teratoma in an Infant // Journal of Case Reports. 2014. Vol. 4, N 2. P. 317–319. doi: 10.17659/01.2014.0079
- Rattan K.N., Kadian Y.S., Nair V.J., et al. Primary retroperitoneal teratomas in children: a single institution experience // Afr J Paediatr Surg. 2010. Vol. 7, N 1. P. 5–8. doi: 10.4103/0189-6725.59350
- Lam A.K. Lipomatous tumours in adrenal gland: WHO updates and clinical implications // Endocr Relat Cancer. 2017. Vol. 24, N 3. P. 65–79. doi: 10.1530/ERC-16-0564
- Tejedor D.C., Gutierrez V.R., Afonso J.M., et al. Adrenal lipoma: A case report and literature review // Urol Case Rep. 2020. Vol. 34. P. 101506. doi: 10.1016/j.eucr.2020.101506
- Liao T., Du W., Li X., et al. Recurrent metastatic retroperitoneal dedifferentiated liposarcoma: a case report and literature review // BMC Urol. 2023. Vol. 23, N 1. P. 63. doi: 10.1186/s12894-023-01252-3
Дополнительные файлы