一名患有模仿神经母细胞瘤的肾上腺成熟性畸胎瘤的儿童的放射诊断难题
- 作者: Shchelkanova E.S.1, Tereshchenko G.V.1, Krasnov A.S.1
-
隶属关系:
- Dmitry Rogachev National Medical Research Center of Pediatric Hematology, Oncology and Immunology
- 期: 卷 5, 编号 2 (2024)
- 页面: 379-389
- 栏目: 临床病例及临床病例的系列
- ##submission.dateSubmitted##: 27.10.2023
- ##submission.dateAccepted##: 13.02.2024
- ##submission.datePublished##: 20.09.2024
- URL: https://jdigitaldiagnostics.com/DD/article/view/622768
- DOI: https://doi.org/10.17816/DD622768
- ID: 622768
如何引用文章
详细
神经母细胞瘤是幼儿最常见的肾上腺肿块,其鉴别系列包括肾母细胞瘤、肾上腺出血、血管肌脂肪瘤、骨髓脂肪瘤和腺瘤。本文描述了一例最罕见的儿童肾上腺肿瘤,即畸胎瘤,尽管其体积较大,但在诊断初期却显示出神经母细胞瘤的所有放射学和组织学特征。
畸胎瘤是生殖细胞肿瘤,通常出现在性腺区域。肾上腺畸胎瘤极为罕见,约占所有肾上腺肿块的 0.13%。肾上腺畸胎瘤通常没有症状,这是因为腹膜后间隙足够大,肿块可以自由生长。
我们首次在俄罗斯文献中介绍了一个 3 个月大儿童肾上腺畸胎瘤的临床病例。文章还详细描述了诊断检查的过程,以及放射科医生和临床医生在罕见部位遇到常见儿童肿瘤时所遇到的困难。
文章旨在帮助医生提高对这种罕见疾病的认识,并将肾上腺畸胎瘤纳入肾上腺肿瘤的潜在鉴别系列。
全文:
论证
原发性肾上腺肿瘤是临床肿瘤学诊断和治疗计划中的重要和难点之一。
世界卫生组织2017年发布的第四版内分泌肿瘤分类将所有肾上腺肿瘤分为两大类[1]:
1)肾上腺皮质肿瘤;
2)肾上腺髓质和肾上腺外副神经节肿瘤。
第一组包括起源于或主要影响肾上腺皮质的肿瘤:腺癌、腺瘤、生殖道间质肿瘤、腺瘤、间质和间质肿瘤(髓脂瘤和分裂瘤)、血淋巴瘤。
第二组包括:嗜铬细胞瘤、副神经节瘤和肾上腺神经母细胞瘤(神经母细胞瘤、神经节瘤、神经节细胞瘤)。
迄今为止,神经母细胞瘤是最常见的儿童肾上腺肿瘤,其鉴别包括肾母细胞瘤、肾上腺出血、血管脂肪瘤、骨髓脂肪瘤和腺瘤[2-4]。
在本文中,我们希望报告一例儿童左肾上腺原发性成熟畸胎瘤病例,最初被认为是神经母细胞瘤,并介绍该病理的鉴别系列。
我们对文献的回顾显示,全球范围内大约有 20 例这样的儿科病例[3, 5, 6]。与此同时,我们在国内文献中未发现一例此类病例。
病例描述
简介
该患者是一名女孩,自2020年8月以来一直生病,当时在2个月大的时候,在腹部器官的常规超声检查(超声)中发现左肾体积形成(体积197立方厘米)。 一个没有特殊性的孩子的生活史。
病史如下:
2020 年 9 月 21 日 - 患儿在居住地的泌尿科住院。2020年9月22日的肿瘤标志物:
- 神经元特异性烯醇化酶(NSE)升高至7ng/ml(正常范围为0-16.3ng/ml);
- 甲胎蛋白(AFP)升高到971ng/ml(正常范围为323±278ng/ml)。
2020年9月23日—根据腹部器官多光谱计算机断层扫描(MSCT)的结果,确定左侧腹膜后有大量体积形成,尺寸为81×71×87mm(体积260cm3),具有异质结构,存在钙化物和囊性包裹体。
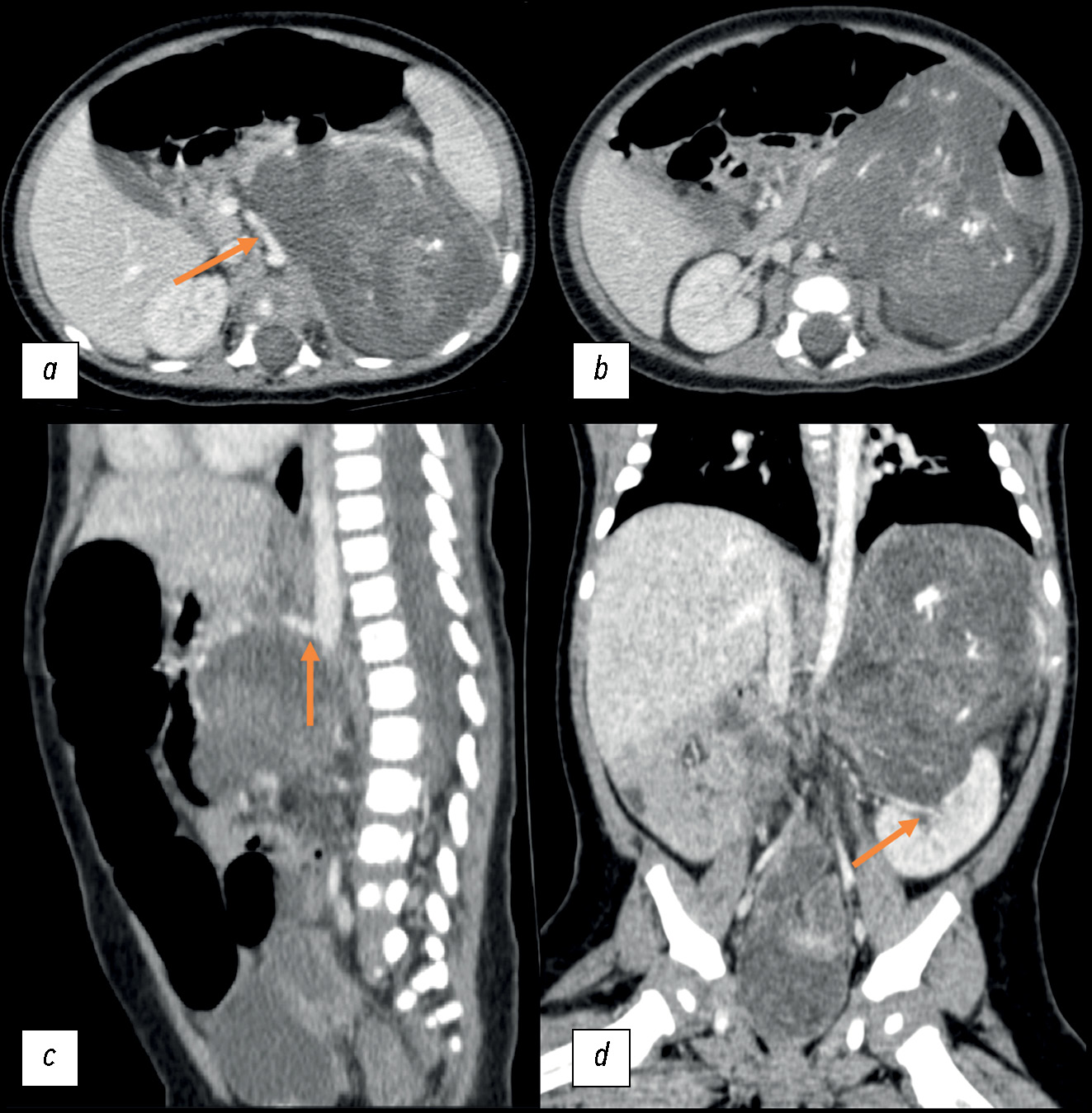
肿块延伸至肾窦,但没有明显延伸至肾实质的迹象。肾上腺沿外侧轮廓变平。左侧肾血管沿肿瘤轮廓通过,肠系膜上动脉向右移位,肾小球干向上移位(图 1)。
图 1. 2020 年 9 月 23 日静脉注射造影剂的腹腔器官原始计算机断层扫描图,左侧为腹膜后体积肿块:a - 轴向平面,箭头表示肠系膜上动脉向右移位;b - 轴向平面;c - 矢状平面,箭头所指为顶干向上移位;d - 冠状平面,箭头所指为肿瘤扩散至肾窦
2020 年 9 月 29 日 - 骨髓造影分析结果:未检测到肿瘤细胞。
10 月初,在剖腹手术和腹膜后间隙形成活检范围内进行了手术干预。低分化神经母细胞瘤在组织学上得到证实。在 Dmitry Rogachev National Medical Research Center for Pediatric Hematology, Oncology and Immunology 进行的组织学检查也证实了这一诊断。由于材料匮乏,没有进行细胞遗传学研究。
经过检查,临床诊断为 “左侧腹膜后神经母细胞瘤,并向腹腔扩散”,并根据 NB-2004 方案开始治疗。
2020 年 10 月 16 日--为评估肿瘤在局部的动态变化,患者接受了磁共振成像(MRI)检查,结果显示肿瘤的大小增加到 104×77×118 毫米(体积491立方厘米),病情有所发展。可视化形成的囊实性结构,存在出血区域,有造影剂活跃积聚的迹象。
肾上腺沿着肿块的外侧轮廓融合。左侧肾血管沿肿瘤轮廓运行,肠系膜上动脉向右移位,肾小球干向上移位。该研究不包括造影剂系列和脂肪组织信号抑制的重量(图 2)。
图 2。2020 年 11 月 16 日的腹腔器官磁共振成像:a - T1 加权矢状投影图像;b - T2 加权矢状投影图像;c、d - T1 加权轴向投影图像,左肾上腺肿块,动态放大。橙色箭头表示肿瘤囊性成分信号降低,蓝色箭头表示肿瘤实性部分信号增强。
住院治疗
由于病情恶化,患儿被送往 Dmitry Rogachev National Medical Research Center for Pediatric Hematology, Oncology and Immunology 的临床肿瘤科住院接受进一步检查,并决定进一步的治疗策略。入院后,重新进行了NSE分析:增加到19.64ng/ml(正常范围为0-16.3ng/ml)。 为了排除产生激素的肿瘤,采取了皮质醇的生化分析:17.3mcg/dl(正常范围为3.7-19.4mcg/dl)。
2020 年 10 月 30 日 - 使用甲碘苄胍进行闪烁扫描,结果未获得放射性药物在肿瘤中蓄积的可靠数据(图 3)。
图 3. 2020 年 10 月 30 日使用甲碘苄胍进行的闪烁扫描。未发现肿瘤积聚放射性药物。
2020 年 11 月 1 日 - 为了澄清肿瘤的性质,重复了具有对比度增强的磁共振成像研究,在一系列腹部扫描中,左侧腹膜后空间保留了体积囊实性形成的迹象,形状不规则,具有足够清晰和均匀的轮廓线,存在肿瘤内出血(扩散加权图像的扩散限制区域)和脂肪内含物(SPIR模式下的信号损失),总尺寸高达89×112×141mm(体积731立方厘米)。与之前的研究相比,肿瘤体积增加了 49%。在静脉注射造影剂时,肿瘤碎块积聚了磁共振造影剂的固体成分。肿瘤向左侧肾脏尾部扩展至盆腔区域。左肾上腺未显影。脾脏被推到前面,与肿瘤的边界清晰可见。脾脏血管沿着肿瘤前部轮廓延伸,脾干沿着内侧轮廓延伸。胰腺沿肿瘤前轮廓呈扁平状,与肿瘤紧密相连。肿瘤上缘紧邻左侧膈肌穹隆,将其推向尾部,导致左肺容积缩小(图 4)。
图 4. 2020 年 11 月 1 日对比增强的腹部磁共振成像(冠状面(a)和轴面(b-e): a - T2 加权图像,由于肿瘤对左侧膈肌圆顶的压力导致左肺体积缩小(双橙色箭头),盆腔内左肾停跳(橙色箭头);b - T2 加权图像,肿瘤结构中的多个囊肿(橙色箭头);c - T1 加权 图像+C,造影剂在实性成分中碎裂堆积(橙色箭头);d - T2 SPIR,脂肪瘤内含物造成的信号丢失(橙色圆圈);e - 扩散加权图像,瘤内出血造成的扩散受限区域(橙色箭头)。
根据核磁共振成像结果,由于检测到脂肪包裹体(SPIR模式下信号抑制),这不是典型的神经母细胞瘤,因此首先怀疑是生殖细胞瘤--腹膜后畸胎瘤(左肾上腺?)或间充质性质的肿瘤。
第二天进行了腹腔 CT 扫描,证实囊实性肿块内有钙化物和脂肪包裹体,造影剂有微弱积聚(图 5)。
图 5. 2020 年 11 月 1 日腹腔器官对比增强计算机断层扫描图:a、b - 轴位投影;c - 矢状位投影;d - 冠状位投影。橙色箭头表示肿瘤结构中的低密度(脂肪)包裹体,密度-80 HU;蓝色箭头表示钙化物。
考虑到在第一个疗程的多化疗背景下获得的肿瘤增大的数据、肿瘤的特征以及有脂肪包涵体和肿瘤浸润肾窦区域的迹象,以及缺乏细胞遗传学研究数据,该患儿接受了外科手术治疗,在再次剖腹探查术的范围内切除了腹膜后肿块,以便进行常规的组织学和细胞遗传学研究。
2020 年 11 月 4 日 - 实施了以下手术:开腹手术、腹膜后肿块切除术、左侧输尿管支架植入术。
2020年11月9日—实验室测试中注意到AFP浓度正常化:51ng/ml。
组织学检查显示,肿瘤形态与左肾上腺成熟畸胎瘤相符。肿瘤主要来自肾上腺髓质。
因此,患者最终被诊断为左肾上腺成熟畸胎瘤。
患儿在 5 个月大时身体状况稳定,在居住地儿科肿瘤学家的动态观察下出院。没有继续进行特殊治疗的指征。
讨论
畸胎瘤是起源于全能细胞的生殖细胞肿瘤[5]。它们包含至少两个生殖细胞层(内胚层、外胚层和/或中胚层)中分化良好或未完全分化的细胞成分。
原发性腹膜后畸胎瘤被认为是原发性生殖细胞从卵黄囊起源到生殖辊最终目的地之间不同阶段的正常胚胎迁移中断所致[7]。畸胎瘤分为4种组织学类型:成熟畸胎瘤、未成熟畸胎瘤、恶性转化畸胎瘤和单胚层畸胎瘤 [7]。成熟畸胎瘤的生殖细胞层分化良好。未成熟畸胎瘤分化不完全,类似于胎儿或胚胎组织[8]。畸胎瘤可能含有毛发、皮肤、牙齿、神经、脂肪组织、软骨等[3]。性腺外畸胎瘤很少见,肾上腺畸胎瘤更少见。我们发现的最大规模的肾上腺疾病研究是在中国北京协和医学院进行的。该研究在 2009 年 3 月至 2014 年 2 月间收治了 3901 名患者,其中 5 名患者(4 名成人和 1 名 16 岁儿童)被诊断为原发性肾上腺畸胎瘤,仅占 0.13%[9]。
肾上腺畸胎瘤患者通常没有临床表现,因为腹膜后空间足够大,可以自由生长。有些患者主诉腰痛、腹部可触及肿块和上腹部疼痛 [3]。
腹腔超声通常是儿科中使用的第一种成像方法。 产前胎儿超声检查以及出生后第1个月对腹部器官和腹膜后间隙进行预防性超声检查可增加早期病变的检[10]。 超声可用于识别囊性,固体和其他复杂肿瘤成分[11]。
MSCT 和磁共振成像有助于确定腹膜后疾病的范围及其与主要血管的关系,从而更好地制定术前计划,并增加肿瘤完全切除的可能性,减少先天性损伤[12]。脂肪包裹体、囊肿形成和钙化被认为是预测 MSCT 中畸胎瘤良性的重要指标[13]。磁共振成像可显示较高的自然软组织对比度,在使用脂肪抑制序列时,对小的脂肪包裹体也有更高的灵敏度。腹膜后畸胎瘤可表达AFP,其血清浓度是诊断和判断肿瘤复发的良好指标[14]。
这一临床病例清楚地表明,有必要仔细研究肿瘤结节的结构并评估其各种要素的密度。对患者诊断错误的回顾性分析表明,在腹腔器官的初诊 MSCT 中,由于出现了密度为 -70 HU 的低密度小包涵体,可以推断出畸胎瘤的诊断,这与肿瘤的脂肪成分相符,而神经母细胞瘤的脂肪成分并不典型(图 6)。
图 6. 2020 年 9 月 23 日腹腔造影剂增强的初始 CT 扫描(轴向投影)。箭头所示为肿瘤结构中的小低密度包涵体,密度-70 HU。
此外,与神经母细胞瘤不同,肾上腺畸胎瘤的证据还包括肿瘤的轮廓清晰平整,肿瘤移位血管但不包围血管,而神经母细胞瘤的轮廓不清晰不规则,肿瘤通过浸润血管而累及血管。囊实性成分和钙化是这两种肿瘤的特征。扫描显像中无放射性药物蓄积、NSE 浓度低和 AFP 浓度高也有利于畸胎瘤的诊断。组织学检查错误可能与组织信息较少和材料匮乏的活检有关。
需要注意的是,除神经母细胞瘤外,肾上腺肿瘤在儿童中极为罕见。畸胎瘤应与其他含有脂肪成分和钙化部位的肿瘤鉴别。
肾上腺脂肪肿块包括骨髓脂肪瘤、脂肪瘤和骨髓肉瘤,而腺瘤、嗜铬细胞瘤和肾上腺皮质癌可能有微小的脂肪包裹体。
骨髓脂肪瘤主要在50至70岁之间被诊断出来,多发于右侧肾上腺区域 [15]。从 MSCT 的放射学角度看,它有大块脂肪组织病灶,并伴有 “烟雾状 ”或 “斑驳状 ”的组织包涵体区域,密度较高,为 20 至 30 HU(髓样元素)。在极少数情况下,它可能含有小钙化物包涵体。
肾上腺脂肪瘤是一种非常罕见的病变,中位年龄为 54 岁,最常见于右侧肾上腺。与畸胎瘤不同,它是一种完全由脂肪成分组成的均匀低密度肿块[16]。
尽管它在儿童时期极其罕见,脂肪肉瘤也不应被排除在鉴别诊断之外。脂肪肉瘤的特点是轮廓不清晰、不规则、侵犯周围组织和血管。通常可以看到转移灶[17]。
结构中含有钙化物的肾上腺最常见的病变是转移性病变(我们知道,在本临床病例中,患者患有原发性肿瘤,未发现其他肿瘤)和结核性病变(患者的流行病学环境是干净的,没有结核病的证据)[3].
结论
原发性肾上腺畸胎瘤极为罕见,但具有典型的放射学特征,在某些情况下可能与该部位的其他常见儿童肿瘤非常相似。在本病例中,放射科医生能够在诊断搜索的最初阶段就提示这种疾病的存在。对罕见的定位缺乏谨慎、不注意评估肿瘤结节的结构以及对组织学结果的误读导致了诊断错误。从实践中展示罕见病例并处理错误是提高放射诊断质量的重要因素。
ADDITIONAL INFORMATION
Funding source. This article was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. E.S. Shchelkanova — review of publications on the topic of the article, writing the text of the article, preparation of a list of references; G.V. Tereshchenko — approval of the final version of the publication; A.S. Krasnov — editing the text of the manuscript.
Consent for publication. Written consent was obtained from the patient’s legal representatives for publication of relevant medical information and all of accompanying images within the manuscript in Digital Diagnostics Journal.
作者简介
Ekaterina S. Shchelkanova
Dmitry Rogachev National Medical Research Center of Pediatric Hematology, Oncology and Immunology
编辑信件的主要联系方式.
Email: dr.shelkanova@yandex.ru
ORCID iD: 0009-0002-3582-8783
SPIN 代码: 9198-4674
俄罗斯联邦, Moscow
Galina V. Tereshchenko
Dmitry Rogachev National Medical Research Center of Pediatric Hematology, Oncology and Immunology
Email: Galina.Tereshenko@fccho-moscow.ru
ORCID iD: 0000-0001-7317-7104
SPIN 代码: 9413-2500
MD, Cand. Sci. (Medicine)
俄罗斯联邦, MoscowAlexey S. Krasnov
Dmitry Rogachev National Medical Research Center of Pediatric Hematology, Oncology and Immunology
Email: Alexey.Krasnov@fccho-moscow.ru
ORCID iD: 0000-0003-1099-9332
SPIN 代码: 3238-4124
俄罗斯联邦, Moscow
参考
- WHO Classification of Tumours Editorial Board. WHO classification of tumours of endocrine organs, 4th ed. Lloyd R.V., Osamura RY, Kloppel G, Rosai J, editors. Lyon: International Agency for Research on Cancer; 2017.
- Emre Ş, Özcan R, Bakır AC, Kuruğoğlu S, et al. Adrenal masses in children: Imaging, surgical treatment and outcome. Asian J Surg. 2020;43(4):207–212. doi: 10.1016/j.asjsur.2019.03.012
- He C, Yang Y, Yang Y, et al. Teratoma of the adrenal gland: clinical experience and literature review. Gland Surg. 2020;9(4):1056–1064. doi: 10.21037/gs-20-648
- Feoktistova EV, Uskova NG, Varfolomeeva SP, et al. Differential diagnosis of congenital cystic neuroblastoma and prenatal adrenal hemorrhage in children of the first months of life. Pediatric Hematology/Oncology and Immunopathology. 2017;16(1):62–68. doi: 10.24287/1726-1708-2017-16-1-62-68
- Wang X, Li X, Cai H, et al. Rare Primary Adrenal Tumor: A Case Report of Teratomas and Literatures Review. Front Oncol. 2022;12:830003. doi: 10.3389/fonc.2022.830003
- AlQattan A, Alsharit M, Alsaihaty E, et al. The ‘’Monstrous tumor’’ of Adrenal gland: A case report and review of literature on adrenal teratomas. Int. J. Surg. Open. 2023;60:100696. doi: 10.1016/j.ijso.2023.100696
- Craig WD, Fanburg-Smith JC, Henry LR, et al. Fat-containing lesions of the retroperitoneum: radiologic-pathologic correlation. Radiographics. 2009;29(1):261–290. doi: 10.1148/rg.291085203
- Wetherell D, Weerakoon M, Williams D, et al. Mature and Immature Teratoma: A Review of Pathological Characteristics and Treatment Options. Med Surg Urol. 2014;3(1):124. doi: 10.4172/2168-9857.1000124
- Li S, Li H, Ji Z, Yan W, Zhang Y. Primary adrenal teratoma: Clinical characteristics and retroperitoneal laparoscopic resection in five adults. Oncol Lett. 2015;10(5):2865–2870. doi: 10.3892/ol.2015.3701
- Sandoval JA, Williams RF. Neonatal Germ Cell Tumors. Curr Pediatr Rev. 2015;11(3):205–215. doi: 10.2174/1573396311666150714105531
- Wootton-Gorges SL, Thomas KB, Harned RK, et al. Giant cystic abdominal masses in children. Pediatr Radiol. 2005;35(12):1277–1288. doi: 10.1007/s00247-005-1559-7
- Zhao Z, Deng X, Peng L, Kong X. Case Report Management of retroperitoneal teratoma in infants younger than one-year-old. Int J Clin Exp Med. 2018;11(2):1362–1366.
- Singh AP, Jangid M, Morya DP, Gupta A. Retroperitoneal Teratoma in an Infant. Journal of Case Reports. 2014;4(2):317–319. doi: 10.17659/01.2014.0079
- Rattan KN, Kadian YS, Nair VJ, et al. Primary retroperitoneal teratomas in children: a single institution experience. Afr J Paediatr Surg. 2010;7(1):5–8. doi: 10.4103/0189-6725.59350
- Lam AK. Lipomatous tumours in adrenal gland: WHO updates and clinical implications. Endocr Relat Cancer. 2017;24(3):65–79. doi: 10.1530/ERC-16-0564
- Tejedor DC, Gutierrez VR, Afonso JM, et al. Adrenal lipoma: A case report and literature review. Urol Case Rep. 2020;34:101506. doi: 10.1016/j.eucr.2020.101506
- Liao T, Du W, Li X, et al. Recurrent metastatic retroperitoneal dedifferentiated liposarcoma: a case report and literature review. BMC Urol. 2023;23(1):63. doi: 10.1186/s12894-023-01252-3
补充文件