比较具有不同经验的放射科医生检测前列腺癌的多参数和双参数磁共振成像协议
- 作者: Vasilev Y.A.1, Omelyanskaya O.V.1, Vladzymyrskyy A.V.1, Gelezhe P.B.1,2, Reshetnikov R.V.1, Gonchar A.P.1, Blokhin I.A.1, Abdullin I.I.1, Kieva I.N.3
-
隶属关系:
- Moscow Center for Diagnostics and Telemedicine
- Joint stock company “European Medical Center”
- Speransky Children’s Hospital
- 期: 卷 4, 编号 4 (2023)
- 页面: 455-466
- 栏目: 原创性科研成果
- ##submission.dateSubmitted##: 15.04.2023
- ##submission.dateAccepted##: 15.06.2023
- ##submission.datePublished##: 15.12.2023
- URL: https://jdigitaldiagnostics.com/DD/article/view/322816
- DOI: https://doi.org/10.17816/DD322816
- ID: 322816
如何引用文章
详细
论证。磁共振成像(MRI)允许发现有临床意义的前列腺癌、诊断囊外扩展并对癌症发展进行分期。如果扫描协议仅包括T2加权和弥散加权图像,只要检查的诊断准确度保持较高水平,其就能很好地替代多参数磁共振成像。在最近的研究中,双参数(bpMRI)和多参 数(mpMRI)磁共振成像在检测前列腺癌方面的诊断准确度差别不大。
该研究的目的是比较bpMRI和mpMRI在检测有临床意义的前列腺癌方面的诊断准确度。比较是根据PI-RADS v2.1系统进行的,以MRI引导下的多点活检为金标准。
材料和方法。本研究是一项回顾性研究。我们初步处理了126名患者的病史。纳入标准 为:(1)符合PI-RADS 2.1标准的mpMRI;(2)血液中游离和结合前列腺特异性抗原水平的临床信息;(3)前列腺多点活检。磁共振成像与活检之间的时间间隔不超过14天。研究由三名放射科医生进行。医生的工作经验分别为2年以下、2至5年和5年以上。这些医 生(研究人员)独立评估前列腺bpmRI 是否存在病灶。2周后,研究人员(这些医生)对前列腺mpMRI 数据集进行了评估。从PI-RADS 3类别开始,将发现的每个病灶与多点融合活检结果进行了比较。活检结果显示为Gleason评分值的总和。Gleason评分7分或更高被认为是有临床意义的活检结果。磁共振成像显示的肿瘤灶被认为是符合PI-RADS标准4和5的结果。
结果。前列腺磁共振成像检测病灶的最佳灵敏度和特异度分别为62.5%和74.6%。诊断准确率最高达到70.1%。由工作经验少于2年和多于5年的放射科医生进行mpMRI解读时,前列腺病灶检测的特异度更高。
结论。前列腺的bpMRI和mpMRI都显示出不理想的诊断准确度。随着放射科医生经验的增加,该方法的灵敏度和特异度有提高的趋势。与多参数协议相比,双参数前列腺扫描协议具有明显的经济优势。这种优势是不需要造影剂和消耗品的费用,并大大减少磁共振扫描仪的装载时间。不过,使用这种方法可能会降低诊断准确度。
全文:
论证
多参数磁共振成像(mpMRI),包括T2加权成 像(T2-WI)、弥散加权成像(DWI)和动态对比增 强(DCE),在前列腺特异性抗原水平升高患者的临床治疗中发挥着重要作用。
磁共振成像可检测临床意义重大的前列腺癌,诊断囊外扩展,并对肿瘤过程进行分期。为规范磁共振成像数据采集、图像解读,美国放射学会(American College of Radiology,ACR)、欧洲泌尿生殖放射学会(European Symposium on Urogenital Radiology,ESUR)于2019年发布了前列腺影像报告和数据系统(Reporting and Data System,PI-RADS)2.1版(v2.1)[1]。
自2020年起,欧洲和美国的泌尿外科指南推荐对未经活检的疑似前列腺癌男性进行多参数磁共振成像(mpMRI)检查[2, 3]。O.Rouvière等人的临床研究数据[3]显示了,在前列腺特异性抗原浓度升高时进行多参数磁共振成像可避免对27%的男性进行不必要的活检。由于大多数男性终生都要接受前列腺特异性抗原检测,因此应用这些建议会导致前列腺磁共振成像的需求大幅增加。
动态对比增强在确定PI-RADS分级方面的作用相对较小,因为它仅用于对局部性外周区的PI-RADS第3类和第4类病灶的鉴别诊断。此外,在肾功能衰竭患者中使用动态对比增强会带来肾源性系统性纤维化的风险。因此,人们对不使用动态对比增强的前列腺磁共振成像简略方案或双参数磁共振成像(bpMRI)越来越感兴趣[4–6]。
只包T2加权成像和弥散加权成像在内的扫描方案是多参数磁共振成像的可行替代方案,只要该检查的诊断准确率仍然很高[7]。在最近的研究中,双参数磁共振成像和多参数磁共振成像在检测前列腺癌方面的诊断准确性差别不大[6]。建立双参数磁共振成像方案的成功尝试表明了,其亮度不均性、分辨率和非线性与多参数磁共振成像相当[8]。
鉴于人们对双参数磁共振成像的兴趣与日俱增,PI-RADS指导委员会发表了一份共识声明,呼吁“在就双参数磁共振成像作为初始诊断检查提出循证建议之前,应先获得更好的数据”[9]。
该研究的目的是以靶向磁共振成像/经直肠超声融合活检(点数)为金标准,比较双参数磁共振成像和多参数磁共振成像在根据PI-RADS v2.1检测有临床意义的前列腺癌方面的诊断准确性。
该研究的目标是确定多参数磁共振成像和双参数磁共振成像在诊断有临床意义(PI-RADS第4类及以上)的前列腺癌方面的灵敏度和特异性,比较不同经验的放射科医生在分析多参数磁共振成像和双参数磁共振成像时的灵敏度和特异性,并评估不同经验的医生在分析多参数磁共振成像和双参数磁共振成像时的一致性。
材料和方法
研究设计
本研究是一项观察性单中心回顾性随机研究。
纳排标准
纳入标准:提供根据PI-RADS 2.1标准进行的多参数磁共振成像结果、血清中游离和结合前列腺特异性抗原水平的临床信息;进行靶向磁共振成像/经直肠超声融合活检,同时遵守磁共振成像和活检之间的时间间隔不超过14天。
未纳入标准:具有技术伪影或前列腺磁共振成像不符合PI-RADS 2.1标准;无一种或多种临床标记物;多参数磁共振成像和活检之间的时间间隔较长。
排除标准:有明显的多参数磁共振成像伪影,无法对研究进行充分评估,以及活检结果无法提供信息。
根据所给出的标准,具有2年以下和5年以上工作经验的放射科医生从样本中排除了19名患者,具有2至5年工作经验的放射科医生排除了23名患者。
进行研究的条件
接受前列腺磁共振成像和多灶性融合活检的患者是在European Medical Center私立医疗机构选择的。
研究期限
研究选取了2022年1月1日至2022年6月1日期间的电子病历记录。
医疗干预措施的描述
作者一共分析了126名患者的病历。前列腺多参数磁共振成像是在Siemens Aera 1.5 T 4G断层扫描仪(德国)上使用体线圈进行的。扫描方案包括以下一组脉冲序列(表1)。经过上传和匿名处理后,从多参数磁共振成像中剔除了带有动态对比增强的图像系列,然后形成了双参数磁共振成像 双参数磁共振成像检查数据集。三名研究人员(具有2年以下、2至5年和5年以上经验的放射科医生)独立评估了前列腺多参数磁共振成像是否存在病灶。根据PI-RADS v2.1,将检测到的病灶划分为第1至第5 类(对外周区病灶根据弥散加权成像数据分析,对过渡区病灶根据T2加权成像数据分析)。此外,还确定了整个腺体的PI-RADS类别。参考方法是基于靶向磁共振成像/经直肠超声融合活检的前列腺组织病理学检查。
表1。前列腺多参数磁共振成像方案
脉冲序列 | 切片方向 | TE/TR, ms | FOV,mm | 像素尺寸,mm | 切片厚度/重叠,mm | 大约扫描时间,min |
T2加权涡轮自旋回波 | 矢状 | 120/3800 | 250×250 | 1×1 | 3/0.3 | 2:26 |
T2加权涡轮自旋回波 | 轴向 | 110/3938 | 180×180 | 0.45×0.6 | 2.5/0 | 3:33 |
单次激发平面回波扩散加权成像 | 轴向 | 87/2425 | 160×160 | 1.25×1.32 | 3/0.3 | 6:50 |
T2加权涡轮自旋回波 | 冠状 | 110/2500 | 160×160 | 0.38×0.42 | 2.5/0 | 4:50 |
带动态对比增强的T1加权成像,时间分辨率为15s | 轴向 | 2.3/4.6 | 250×250 | 0.9×1 | 3/0 | 5:46 |
对比增强之后的T1加权成像 | 轴向 | 1.3/2.3 | 400×350 | 1.6×1.7 | 4/0 | 0:21 |
两周后,研究人员对前列腺多参数磁共振成像数据集进行了评估,其中包括动态对比增强系列。在进行磁共振成像解读时,研究人员无法获得活检结果。根据 PI-RADS 2.1[1],早期对比增强信息可以可靠地区分外周区的PI-RADS第3类和第4类病灶。
研究的主要成果
根据双参数磁共振成像或多参数磁共振成像检测到的前列腺巢与组织病理学检查结果的对应关系。
记录成果的方法
作者根据PI-RADS 2.1分段将检测到的病灶信息输入一览表,并提出了其定位。中心区和纤维肌基质不在评估范围内。
从PI-RADS第3类开始,每个确定的病灶都与靶向磁共振成像/经直肠超声融合活检结果相匹配。在融合活检中,医生会获取前列腺的超声图像;这包括将超声图像叠加到先前存储的前列腺磁共振成像图像上(通常是轴向的T2加权成像)。融合后会生成前列腺的三维重建图,并在重建的模型上锁定和追踪活检部位。
活检结果显示为Gleason值的总和[10],Gleason 7及以上被认为是有临床意义的活检结果。根据磁共振成像标准,符合PI-RADS第4类和第5类的结果被视为肿瘤灶。
伦理审查
研究已获得European Medical Center当地伦理委员会的同意(2023年4月24日第1次会议记录)。
统计分析
作者对专家处理的每个数据集分别计算了诊断效率指标,包括约登指数(Youden index)。专家之间结果的一致性以百分比和Fleiss’s kappa进行评估。
计算是在R 4.1.31环境下使用irr2和dplyr3软件包进行的。
结果
研究对象(参与者)
所分析的患者数据集总数为:具有2年以下和5年以上工作经验的放射科医生分析了107个病历,具有2至5年工作经验的放射科医生分析了103个。
主要研究成果
双参数磁共振成像检测前列腺病灶的最佳灵敏度和特异性分别为70.0%和67.2%。多参数磁共振成像检测前列腺病灶的最佳灵敏度和特异性分别为62.5% 和74.6%。
没有发现不良现象。
表2给出具有不同工作经验的放射科医生检测到的前列腺肿瘤灶数量。表3给出专家在评估双参数磁共振成像时的诊断准确度数据,表4给出专家在评估多参数磁共振成像时的诊断准确度数据。表5(单位分数)和表6(Fleiss’s kappa)给出专家之间结果的一致性。
表2。不同经验的放射科医生检测到的前列腺病灶的绝对数和相对数,n(%)
工作经验,年数 | 方案 | 真阳性 | 真阴性 | 假阳性 | 假阴性 |
<2 | bpMRI | 19 (17.8) | 47 (43.9) | 20 (18.7) | 21 (19.6) |
mpMRI | 19 (17.8) | 52 (48.6) | 15 (14.0) | 21 (19.6) | |
2至5 | bpMRI | 31 (29.8) | 23 (22.1) | 42 (40.4) | 8 (7.7) |
mpMRI | 32 (30.8) | 19 (18.3) | 46 (44.2) | 7 (6.7) | |
>5 | bpMRI | 28 (26.2) | 45 (42.1) | 22 (20.6) | 12 (11.2) |
mpMRI | 25 (23.4) | 50 (46.7) | 17 (15.9) | 15 (14.0) |
注:bpMRI/mpMRI是双参数/多参数磁共振成像。
表3。具有不同经验的放射科医生根据PI-RADS 2.1通过双参数磁共振成像检测前列腺病灶的诊断标准比较
工作经验,年数 | 灵敏度 | 特异性 | 准确度 | 预后价值 | 约登 指数 | |
阳性 | 阴性 | |||||
<2 | 47.5 (31.5–63.9) | 70.2 (57.7–80.7) | 61.7 (51.8–70.9) | 48.7 (36.8–60.8) | 69.1 (61.6–75.8) | 0.177 |
2至5 | 79.5 (63.5–90.7) | 35.4 (23.9–48.2) | 51.9 (41.9–61.8) | 42.5 (36.7–48.4) | 74.2 (58.8–85.3) | 0.149 |
>5 | 70.0 (53.5–83.4) | 67.2 (54.6–78.2) | 68.2 (58.5–76.9) | 56.0 (46.1–65.5) | 79.0 (69.4–86.1) | 0.372 |
注:数据以中位数(Me)和95%置信区间(95% CI)表示。
表4。具有不同经验的放射科医生根据PI-RADS 2.1通过多参数磁共振成像检测前列腺病灶的诊断标准比较
工作经验,年数 | 灵敏度 | 特异性 | 准确度 | 预后价值 | 约登 指数 | |
阳性 | 阴性 | |||||
<2 | 47.5 (31.5–63.9) | 77.6 (65.8–86.9) | 66.4 (56.6–75.2) | 37.4 (28.2–47.3) | 55.9 (42.2–68.8) | 0.251 |
2至5 | 82.1 (66.5–92.5) | 28.2 (18.6–41.8) | 49.0 (39.1–59.0) | 41.0 (35.9–46.3) | 73.1 (55.7–85.4) | 0.113 |
>5 | 62.5 (45.8–77.3) | 74.6 (62.5–84.5) | 70.1 (60.5–78.6) | 59.5 (47.8–70.3) | 76.9 (68.6–83.6) | 0.371 |
注:数据以中位数(Me)和95%置信区间(95% CI)表示。
表5。专家之间结果的一致性(单位分数)
方案 工作经验 | bpMRI,<2年 | mpMRI,<2年 | bpMRI,>5年 | mpMRI,>5年 | bpMRI, 2至5年 | mpMRI, 2至5年 |
bpMRI,<2年 | 1 | 0.798 | 0.558 | 0.673 | 0.413 | 0.356 |
mpMRI,<2年 | 1 | 0.654 | 0.817 | 0.356 | 0.298 | |
bpMRI,>5年 | 1 | 0.808 | 0.442 | 0.452 | ||
mpMRI,>5年 | 1 | 0.413 | 0.357 | |||
bpMRI,2至5年 | 1 | 0.904 | ||||
mpMRI,2至5年 | 1 |
注:bpMRI/mpMRI是双参数/多参数磁共振成像。
表6。专家间结果的一致性(Fleiss's kappa)
方案 工作经验 | bpMRI,<2年 | mpMRI,<2年 | bpMRI,>5年 | mpMRI,>5年 | bpMRI, 2至5年 | mpMRI, 2至5年 |
bpMRI,<2年 | 1 | 0.669 | 0.318 | 0.482 | 0.195 | 0.136 |
mpMRI,<2年 | 1 | 0.446 | 0.693 | 0.129 | 0.087 | |
bpMRI,>5年 | 1 | 0.699 | 0.206 | 0.229 | ||
mpMRI,>5年 | 1 | 0.194 | 0.165 | |||
bpMRI,2至5年 | 1 | 0.846 | ||||
mpMRI,2至5年 | 1 |
注:bpMRI/mpMRI是双参数/多参数磁共振成像。
讨论
主要研究成果概述
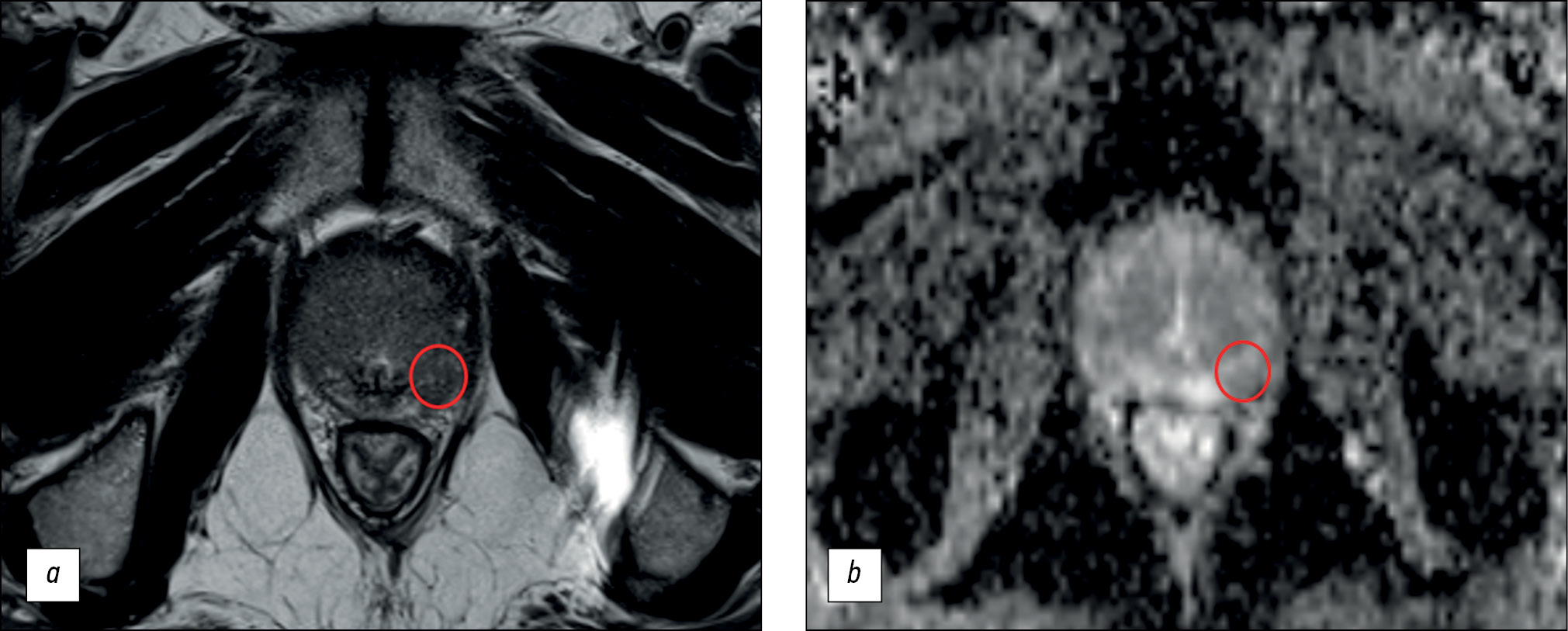
我们研究的主要结论是前列腺磁共振成像的诊断效率较低。因此,病灶检测的灵敏度和特异性值分别不超过62.5%和74.6%,最高诊断准确率为70.1%。所获得的参数不允许将磁共振成像视为一种早期诊断方法,首先是因为其灵敏度值太低(图1)。
图1。双参数磁共振成像的假阳性结果示例:a——轴向的T2加权成像:在前列腺中部左叶外周区的外侧后段,发现一个与扩散受限区相对应的信号减弱灶;b——测得的扩散系数图。医生将该病灶定性为PI-RADS第5类。多灶活检显示了,前列腺组织没有肿瘤生长的迹象。
从我们的研究中可以得出的第二个结论表明,在由工作经验少于2年(双参数磁共振成像为77.6%和70.2%)和工作经验多于5年(双参数磁共振成像为74.6%和67.2%)的放射科医生进行判读时,由于特异性的提高,多参数磁共振成像的诊断效率也会提高。
对主要研究成果的讨论
获得的结果与世界科学文献发表的结果极为接近。例如,在J.Wallström等人的研究[6]中,通过多参数磁共振成像发现了一个额外的肿瘤病例(84例对83例)。在C.K.Kuhl等人的回顾性研究[7]中,多参数磁共振成像使329例肿瘤中多发现10例。在J.P.Zawaideh等人的前瞻性研究[11]中,双参数磁共振成像检测到116例癌症,多参数磁共振成像检测到117例。元分析也不例外。因此,在Z.Kang[12]和X.K.Niu[13]领导的研究报告中,双参数磁共振成像和多参数磁共振成像检测前列腺癌的诊断准确度相似。
我们的数据与经典的PROMIS研究结果相矛盾[14],根据该研究,磁共振成像的灵敏度高(93%),但特异性低(41%)。不过,在本研究中,PI-RADS第3类病灶被视为阳性磁共振成像结果。具有临床意义的前列腺癌的组织学标准也有所不同:Gleason评分为3+4的病灶不包括在内。我们的样本中正常病例和病理病例分布异常可能是磁共振成像诊断准确度不佳的原因之一。
多参数磁共振成像的一个关键区别在于扫描方案中使用了 动态对比增强。在我们的研究中,我们发现使用动态对比增强提高了工作经验少于2年和多于5年的医生检测前列腺病灶的特异性(见表2和 表3,图2)。在评估多参数磁共振成像数据集时,具有2至5年经验的放射科医生的特异性反而下降了。
图2。使用动态对比增强的PI-RADS类别升级示例:a——轴向的T2加权成像:在前列腺中部右叶外周区的外侧后段,发现一个与扩散受限区相对应的信号减弱灶;b——测量的扩散系数图:医生通过双参数磁共振成像将该病灶定性为PI-RADS第3类,但在动态对比增强(c)时,该病灶显示出早期对比增强,因此可将其被视为PI-RADS第4类。
传统上,在前列腺多参数磁共振成像中使用动态对比增强的缺点包括数据采集时间增加,这不仅包括造影剂的注射过程,还包括准备过程,包括为病人进行导管插入。重要的一点是,使用动态对比增强进行检查分析所需的时间增加,对软件的要求也提升。不过,使用动态对比增强 后,诊断准确度略有提高(工作经验少于2 的放射科医生的诊断准确度为66.4%对61.7%,工作经验多于5年的放射科医生的诊断准确度为70.1%对68.2%)。
支持双参数磁共振成像的另一个理由是对钆基造影剂长期安全性的担忧。例如,有研究表明,少量的钆会在大脑和其他组织中持续存在。虽然在临床实践中还没有证明现代大环造影剂对肾功能正常的患者有不良影响,但就安全性而言,可以说只有在造影剂能增加显著诊断价值时才应使用磁共振成像造影剂[15],我们的研究就证明了这一点。
如前所述,在多参数磁共振成像中使用动态对比增强的目的是对前列腺外周区的PI-RADS第3和第4类病灶进行鉴别诊断。根据Epstein标准,临床意义不大的癌症的Gleason评分总和≤6,有器官界限(TNM分期<T3),体积<0.5cm3,应在解剖标本上确 定[16]。PI-RADS v2.1[1]也采用了相同的定义。识别临床意义不大的肿瘤是为了对其进行积极的监测。
在我们的研究中,与上述研究[6,7]不同的是,使用动态对比增强检测前列腺肿瘤的假阳性病例数量有所减少。因此,检测的阳性预测值提高了。J.P.Zawaideh等人的研究也得出了类似的结 果[11]。
如果检测到PI-RADS第3类及以上的结节,进行动态对比增强不会改变前列腺活检的计划。鉴于经直肠活检是一种侵入性手术,有感染并发症的风险,且需要住院治疗,因此应考虑到这一事实[17]。
研究的局限性
然而,应该认识到,我们的研究存在严重的局限性。首先,回顾性研究设计只选择多灶性活检患者。因此,我们样本中的正态和病理分布并不符合正态分布。其次,虽然有两周的洗脱期,但放射科医生对双参数磁共振成像和多参数磁共振成像数据集的顺序审查并不能排除偏见。第三,由于参与研究的放射科医生人数较少,我们无法就他们评估的一致性得出明确结论。
工作经验较少(少于2年)和工作经验较多(超过5年)的专家之间的一致性程度适中,这一点不容忽视。有关这一问题的文献数据各不相同:例如,E.D.Campli等人[18]发现了放射科医生的经验对两种方案的诊断质量没有显著影响,但M.Gatti等人的研究[19]表明了,经验不足的放射科医生评估双参数磁共振成像的准确度较低。
结论
无论采用哪种扫描方案,前列腺磁共振成像的诊断效果都不理想。虽然与多参数方案相比,双参数前列腺扫描方案由于无需造影剂和耗材成本,且大大缩短磁共振成像扫描仪的装载时间,因此具有明显的经济优势,但使用双参数扫描方案可能会导致方法的诊断准确性下降。
随着放射科医生经验的增加,该方法的灵敏度和特异性都有提高的趋势,这表明根据PI-RADS进行前列腺磁共振成像解读规则培训的重要性。
为了确认双参数磁共振成像在前列腺癌早期诊断中的作用,还需要进行前瞻性研究。
ADDITIONAL INFORMATION
Funding source. This article was prepared by a group of authors as a part of the research and development effort titled “Scientific evidence for using radiomics-guided medical imaging to diagnose cancer”, No. 123031400009-1”, (USIS No. 123031500005-2) in accordance with the Order No. 1196 dated December 21, 2022 “On approval of state assignments funded by means of allocations from the budget of the city of Moscow to the state budgetary (autonomous) institutions subordinate to the Moscow Health Care Department, for 2023 and the planned period of 2024 and 2025” issued by the Moscow Health Care Department.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. Yu.A. Vasilev, O.V. Omelyanskaya, A.V. Vladzymyrskyy ― research concept; P.B. Gelezhe, R.V. Reshetnikov ― data analysis, text writing; A.P. Gonchar, I.A. Blokhin, I.I. Abdullin, I.N. Kieva ― data analysis.
1 The R Project for Statistical Computing。访问方式:https://www.r-project.org/。
2 irr: Various Coefficients of Interrater Reliability and Agreement。访问方式:https://cran.r-project.org/web/packages/irr/index.html。
3 dplyr: A grammar of data manipulation。访问方式:https://github.com/tidyverse/dplyr。
作者简介
Yuriy A. Vasilev
Moscow Center for Diagnostics and Telemedicine
Email: npcmr@zdrav.mos.ru
ORCID iD: 0000-0002-0208-5218
SPIN 代码: 4458-5608
MD, Cand. Sci. (Med)
俄罗斯联邦, MoscowOlga V. Omelyanskaya
Moscow Center for Diagnostics and Telemedicine
Email: o.omelyanskaya@npcmr.ru
ORCID iD: 0000-0002-0245-4431
SPIN 代码: 8948-6152
俄罗斯联邦, Moscow
Anton V. Vladzymyrskyy
Moscow Center for Diagnostics and Telemedicine
Email: npcmr@zdrav.mos.ru
ORCID iD: 0000-0002-2990-7736
SPIN 代码: 3602-7120
MD, Dr. Sci. (Med), Professor
俄罗斯联邦, MoscowPavel B. Gelezhe
Moscow Center for Diagnostics and Telemedicine; Joint stock company “European Medical Center”
编辑信件的主要联系方式.
Email: gelezhe.pavel@gmail.com
ORCID iD: 0000-0003-1072-2202
SPIN 代码: 4841-3234
俄罗斯联邦, Moscow; Moscow
Roman V. Reshetnikov
Moscow Center for Diagnostics and Telemedicine
Email: reshetnikov@fbb.msu.ru
ORCID iD: 0000-0002-9661-0254
SPIN 代码: 8592-0558
俄罗斯联邦, Moscow
Anna P. Gonchar
Moscow Center for Diagnostics and Telemedicine
Email: a.gonchar@npcmr.ru
ORCID iD: 0000-0001-5161-6540
SPIN 代码: 3513-9531
俄罗斯联邦, Moscow
Ivan A. Blokhin
Moscow Center for Diagnostics and Telemedicine
Email: i.blokhin@npcmr.ru
ORCID iD: 0000-0002-2681-9378
SPIN 代码: 3306-1387
俄罗斯联邦, Moscow
Iskander I. Abdullin
Moscow Center for Diagnostics and Telemedicine
Email: iabdullin@emcmos.ru
ORCID iD: 0000-0003-1138-0822
SPIN 代码: 6560-5219
俄罗斯联邦, Moscow
Irina N. Kieva
Speransky Children’s Hospital
Email: kieva.irina@gmail.com
ORCID iD: 0000-0002-4060-5966
SPIN 代码: 2279-9141
俄罗斯联邦, Moscow
参考
- Turkbey B, Rosenkrantz AB, Haider MA, et al. Prostate imaging reporting and data system version 2.1: 2019 Update of prostate imaging reporting and data system version 2. Eur Urol. 2019;76(3):340–351. doi: 10.1016/j.eururo.2019.02.0331
- Bjurlin MA, Carroll PR, Eggener S, et al. Update of the standard operating procedure on the use of multiparametric magnetic resonance imaging for the diagnosis, staging and management of prostate cancer. J Urol. 2020;203(4):706–712. doi: 10.1097/JU.0000000000000617
- Rouvière O, Puech P, Renard-Penna R, et al. Use of prostate systematic and targeted biopsy on the basis of multiparametric MRI in biopsy-naive patients (MRI-FIRST): A prospective, multicentre, paired diagnostic study. Lancet Oncology. 2019;20(1):100–109. doi: 10.1016/S1470-2045(18)30569-2
- Boesen L, Thomsen FB, Nørgaard N, et al. A predictive model based on biparametric magnetic resonance imaging and clinical parameters for improved risk assessment and selection of biopsy-naïve men for prostate biopsies. Prostate Cancer Prostatic Dis. 2019;22(4):609–616. doi: 10.1038/s41391-019-0149-y
- Tamada T, Kido A, Yamamoto A, et al. Comparison of biparametric and multiparametric MRI for clinically significant prostate cancer detection with PI-RADS Version 2.1. J Magnetic Resonance Imaging. 2021;53(1):283–291. doi: 10.1002/jmri.27283
- Wallström J, Geterud K, Kohestani K, et al. Bi- or multiparametric MRI in a sequential screening program for prostate cancer with PSA followed by MRI? Results from the Göteborg prostate cancer screening 2 trial. Eur Radiol. 2021;31(11):8692–8702. doi: 10.1007/s00330-021-07907-9
- Kuhl CK, Bruhn R, Krämer N, et al. Abbreviated biparametric prostate MR imaging in men with elevated prostate-specific antigen. Radiology. 2017;285(2):493–505. doi: 10.1148/radiol.2017170129
- Abuladze LR, Semenov DS, Panina OV, Vasil AA. Optimized protocol of biparametric magnetic resonance imaging for prostate. Digital Diagnostics. 2022;3(3):166–177. doi: 10.17816/DD108484
- Schoots IG, Barentsz JO, Bittencourt LK, et al. PI-RADS committee position on MRI without contrast medium in biopsy-naive men with suspected prostate cancer: Narrative review. Am J Roentgenol. 2021;216(1):3–19. doi: 10.2214/AJR.20.24268
- Gleason DF. Classification of prostatic carcinomas. Cancer Chemother Rep. 1966;50(3):125–128.
- Zawaideh JP, Sala E, Shaida N, et al. Diagnostic accuracy of biparametric versus multiparametric prostate MRI: Assessment of contrast benefit in clinical practice. Eur Radiol. 2020;30(7):4039–4049. doi: 10.1007/s00330-020-06782-0
- Kang Z, Min X, Weinreb J, et al. Abbreviated biparametric versus standard multiparametric MRI for diagnosis of prostate cancer: A systematic review and meta-analysis. Am J Roentgenol. 2019;212(2):357–365. doi: 10.2214/AJR.18.20103
- Niu XK, Chen XH, Chen ZF, et al. Diagnostic performance of biparametric MRI for detection of prostate cancer: A systematic review and meta-analysis. Am J Roentgenol. 2018;211(2):369–378. doi: 10.2214/AJR.17.18946
- Ahmed HU, El-Shater Bosaily A, Brown LC, et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): A paired validating confirmatory study. Lancet. 2017;389(10071):815–822. doi: 10.1016/S0140-6736(16)32401-1
- McDonald RJ, Levine D, Weinreb J, et al. Gadolinium retention: A research roadmap from the 2018 NIH/ACR/RSNA workshop on gadolinium chelates. Radiology. 2018;289(2):517–534. doi: 10.1148/radiol.2018181151
- Ploussard G, Epstein JI, Montironi R, et al. The contemporary concept of significant versus insignificant prostate cancer. Eur Urol. 2011;60(2):291–303. doi: 10.1016/j.eururo.2011.05.006
- Loeb S, Vellekoop A, Ahmed HU, et al. Systematic review of complications of prostate biopsy. Eur Urol. 2013;64(6):876–892. doi: 10.1016/j.eururo.2013.05.049
- Campli ED, Pizzi DA, Seccia B, et al. Diagnostic accuracy of biparametric vs multiparametric MRI in clinically significant prostate cancer: Comparison between readers with different experience. Eur J Radiol. 2018;(101):17–23. doi: 10.1016/j.ejrad.2018.01.028
- Gatti M, Faletti R, Calleris G, et al. Prostate cancer detection with biparametric magnetic resonance imaging (bpMRI) by readers with different experience: Performance and comparison with multiparametric (mpMRI). Abdominal Radiol (New York). 2019;44(5):1883–1893. doi: 10.1007/s00261-019-01934-3
补充文件