膀胱癌的传统和创新成像技术:技术与应用
- 作者: Masino F.1, Eusebi L.2, Muscatella G.1, Montatore M.1, Sortino G.2, Giannubilo W.3, Guglielmi G.1,4,5
-
隶属关系:
- Foggia University School of Medicine
- Carlo Urbani Hospital
- Civitanova Marche Hospital
- Dimiccoli Hospital
- IRCCS Casa Sollievo della Sofferenza Hospital
- 期: 卷 5, 编号 2 (2024)
- 页面: 318-333
- 栏目: 科学评论
- ##submission.dateSubmitted##: 27.11.2023
- ##submission.dateAccepted##: 06.02.2024
- ##submission.datePublished##: 20.09.2024
- URL: https://jdigitaldiagnostics.com/DD/article/view/623889
- DOI: https://doi.org/10.17816/DD623889
- ID: 623889
如何引用文章
详细
这篇叙述性综述旨在描述成像技术在膀胱癌评估中的现状,其中考虑到了超声检查(US)、计算机断层扫描尿路造影(CTU)和磁共振成像(MRI)等传统技术,以及对比增强超声检查(CEUS)和双能量计算机断层扫描(DECT)等新型技术。文章首先介绍了膀胱的解剖结构,以了解正常的影像学表现,并结合流行病学、临床、分类和治疗介绍了膀胱癌的主要特征。随后,文章讨论了成像技术的作用,并解释了每种成像方式在膀胱癌评估中的技术和应用。影像学在膀胱癌的检测和分期中起着至关重要的作用。尤其是磁共振成像的作用正在不断扩大,因为它能利用膀胱成像报告和数据系 统(VI-RADS)以及 CTU 和 US 等传统技术区分肌层浸润性膀胱癌和非肌层浸润性膀胱癌。为确保对肿瘤患者采取正确的治疗方法,CEUS 和 DECT 代表了具有特殊优势的新兴模式。本综述最后介绍了正电子发射断层扫描(PET)/CT 和 PET/MRI 等综合成像模式,它们是膀胱癌分期的理想方法。
全文:
膀胱解剖
膀胱是位于骨盆中的一中空肌肉器官,起着储存尿液并让尿液排出的作用。这个容易变形的器官位于骨盆腔内,耻骨联合后方,腹膜旁下方。膀胱的大小和形状根据其容纳的尿液量(总体积高达500毫升)和其他器官施加的压力而变化。特别是,膀胱充盈时呈圆形或椭圆形[1]。
膀胱的解剖结构复杂。从宏观上看,膀胱分为四个部分:顶部或圆顶(面向前方和向上)、膀胱体、膀胱底和膀胱颈(位于下方)。膀胱底部有三个开口,形成一个三角形。其中两个开口属于输尿管,它们斜着穿过膀胱壁。第三个开口是尿道开口,位于膀胱颈部,恰好在三角区的下角。尿液通过它从膀胱排出[2, 3]。
从显微镜下看,膀胱具有类似输尿管的层状结构。膀胱内膜由过渡上皮(即尿路上皮)组成,由数层细胞构成。在放松状态下,尿路上皮有 5-7 层细胞厚,它可以拉伸以容纳更多的尿液。尿路上皮下面是固有层或粘膜下层,这是一种上皮下结缔组织,含有不同排列的肌纤维。其次是肌肉层,由逼尿肌组成(由内纵肌、中圆肌和外纵肌组成)。这种平滑肌负责收缩并将尿液排出膀胱。膀胱壁由浆膜覆盖,浆膜是一层薄薄的结缔组织,与腹膜后空间连通并包含血管。在没有浆膜的地方,膀胱被一层疏松的结缔组织覆盖[4, 5]。
膀胱癌
膀胱癌(BC)是一种全球常见的侵袭性恶性肿瘤,继发于前列腺癌,被认为是泌尿生殖系统肿瘤[6]。根据国际癌症研究机构的记录,以下风险因素与膀胱癌有关:吸烟;某些职业接触(如铝和橡胶生产、油漆、消防);接触各种染料(如紫馨和金胺)或染料中间体(如 4-氨基联苯)。环境因素,包括 X 射线、伽马射线和砷,以及特定药物(环磷酰胺)、吸食鸦片和感染血吸虫,也会影响 膀胱癌的发病。其他风险因素,如饮食要素、肠道菌群紊乱、基因与环境的相互作用、接触柴油废气和盆腔放疗,也与 膀胱癌的发病有关 [7]。
膀胱癌最常见的症状是无症状性大血尿或小血尿,即所谓的 “无痛性血尿”,约有 85% 的患者会出现这种症状。为了确定出血的来源,必须仔细将血尿分为初始、终末期和完全血尿[8]。膀胱癌的其他常见症状与膀胱刺激症(尿频、尿急和排尿困难)有关。输尿管梗阻时会出现侧腹疼痛。较少见的症状是下肢肿胀和骨盆可触及的肿块。在晚期病例中,由于远处转移,患者会出现体重减轻、腹部或骨骼疼痛 [9, 10]。
尿路上皮癌(UC)是 膀胱癌最常见的亚型,其次是鳞状细胞癌、肉瘤、淋巴瘤和腺癌。三分之二的病例为非肌层浸润性 膀胱癌(NMIBC),三分之一为肌层浸润性 膀胱癌(MIBC),与转移风险增加和预后显着恶化有关[7]。膀胱癌的形态因肿瘤的生长和进展而异。例如,水平生长是原位癌(CIS)的特征,而外生性息肉样肿块或无梗浸润性病变则是浸润型的典型特征[6, 8]。
膀胱癌根据恶性肿瘤 TNM 标准分类系统进行分期。与其他中空器官一样,T 符号表示膀胱各层受侵的深度。其中,pTa 指乳头状癌(非肌层浸润型 膀胱癌),表现为外生肿块病变;pTis 指鳞状 原位癌(非肌层浸润型 膀胱癌)。在 T1 期,肿瘤侵犯了自身的薄层,通常通过经尿道电切和辅助膀胱内化疗来治疗。在 T2 期,肿瘤会浸润到膀胱逼尿肌(一种肌肉浸润性 膀胱癌);在 T3 期,肿瘤会浸润到膀胱周围的脂肪组织;在 T4 期,肿瘤会浸润到周围器官。T2 期及以上肿瘤需要更积极的治疗,如根治性膀胱切除术[11]。
符号 N 表示淋巴结受累。在 N1 和 N2 期,分别观察到骨盆中的一个或多个结节受累。在 N3 期,转移灶到达髂总淋巴结。
M1 期表示存在转移:区域淋巴结未受累(M1a)和存在其他远处转移(M1b)[5, 12]。
可视化技术
影像学技术包括超声波、计算机断层扫描尿路造影(CTU)和磁共振成像(MRI)在 膀胱癌的诊断和分期中发挥着重要作用。这些技术对于检测 膀胱癌以及区分 T1 和 T2 肿瘤至关重要,因为这两个阶段患者的治疗策略有很大不同[13]。
从超声到 CTU,膀胱癌的检测灵敏度不断提高,磁共振成像(的检测灵敏度非常高。磁共振成像是区分非肌肉浸润性和肌肉浸润性 膀胱癌的重要方法,因此越来越多地使用磁共振成像。
根据国际建议,诊断可疑肿瘤(如无痛性血尿)的第一步应是超声检查,而不排除体格检查,需要膀胱镜检查和随后的活检才能做出最终诊断 [8]。
放射性核素诊断,包括正电子发射断层扫描(PET)结合计算机断层扫描(PET/CT)和磁共振成像(PET/MRI),在 膀胱癌分期方面也很有前景,特别是在检测受影响的淋巴结和远处转移方面。混合成像方法比传统 CT 更准确。
本综述还包括双能量计算机断层扫描(DECT)和对比增强超声波(对比增强超声波)等成像方式,这些成像方式不包括在标准检查方案中,但在某些情况下可能有用。
超声波检查
技术
检查前,患者应饮用 300-500 毫升水,以确保膀胱充分膨胀和充盈。膀胱膨胀不足会导致难以评估膀胱壁的情况,因为它们的增厚或病灶可能会被高估,而过度膨胀则可能会导致患者不适,并减少患者与医生之间的合作。
经腹超声检查是最常见的检查方法,本综述将对此进行讨论。在女性中,如有必要,可进行经阴道超声检查以提高空间分辨率,而对于男性,如果经腹方法受限,则可进行经直肠超声检查。检查时患者仰卧,必要时以侧卧位进行。
建议使用凸面传感器(4.5-6 MHz)进行超声波检查,并将其预先设置为腹部/肾脏检查。传感器应放置在耻骨联合正上方,并向尾部倾斜,以便对器官进行正确评估。扫描应在两个正交平面上以斜投影方式进行。这样,在检查过程中膀胱将始终位于视野中心。
膀胱壁呈分层状,在与浆膜和粘膜相对应的两个高回声层之间有低回声肌。侧壁和后壁在超声波中清晰可见,而前壁受混响现象的影响,可通过时域增益补偿进行控制。高频线性传感器(>7.5 MHz)可用于选择性检查前壁和膀胱穹隆。为评估输尿管排尿(正常且周期性的尿液从输尿管流出到膀胱),必须进行后壁三角彩色多普勒检查,以排除输尿管完全梗阻。
超声波可评估膀胱容量和残余尿量。尿量是通过在两个正交平面上进行三次测量,并应用包含校正因子(k)的自动公式估算得出的,该公式考虑到了膀胱的复杂形状[11, 14]。
应用
经腹超声的有效性受到各种因素的影响,包括膀胱充盈程度、患者体质、肿瘤大小和扩散以及既往治疗(放疗、化疗或手术)[13]。 超声的灵敏度为63%,但它可以随着前列腺肥大而降低,通常表明膀胱底部壁的不均匀性。 相反,在憩室中肿瘤定位的情况下,与膀胱镜检查相比,敏感性可能会增加,因为膀胱镜检查期间膀胱狭窄颈部的评估是困难的[14]。
通常,如果定位于膀胱侧壁和后壁,膀胱癌很容易被检测到。 因此,尿路上皮癌通常定位于后壁并且具有大尺寸,这是影响超声诊断灵敏度的最重要因素。 肿瘤只有在其最大直径超过5毫米时才能被检测到。较大的肿瘤通常与其他体征有关,如壁僵硬和膀胱不对称拉伸。 肿瘤的位置是影响敏感性的不太重要的因素,尽管由于技术原因,某些区域(圆顶,前壁和膀胱底部)更难以评估[11]。
膀胱中的形成物通常是回声的,具有不规则的形状,例如类似花椰菜,并且在膀胱壁上或壁的部分中发现厚度不均匀增加。 然而,在超声检查中,膀胱癌的迹象可能因肿瘤的形态而异,表现为乳头状,或浸润性,或具有乳头状和浸润性形成的混合迹象。乳头状的形状看起来像是从膀胱壁发出并突出到腔内的小回声结构,当大于2-3毫米时很容易发现。相反,如果肿瘤是浅表癌,则只能通过壁软组织增厚来识别。壁软组织有正常的回声结构,没有入侵的迹象。 浸润性肿瘤具有典型的小乳头元件。 它们的特征在于低发性,不像回声膀胱壁和膀胱周围脂肪组织[11, 13, 14]。
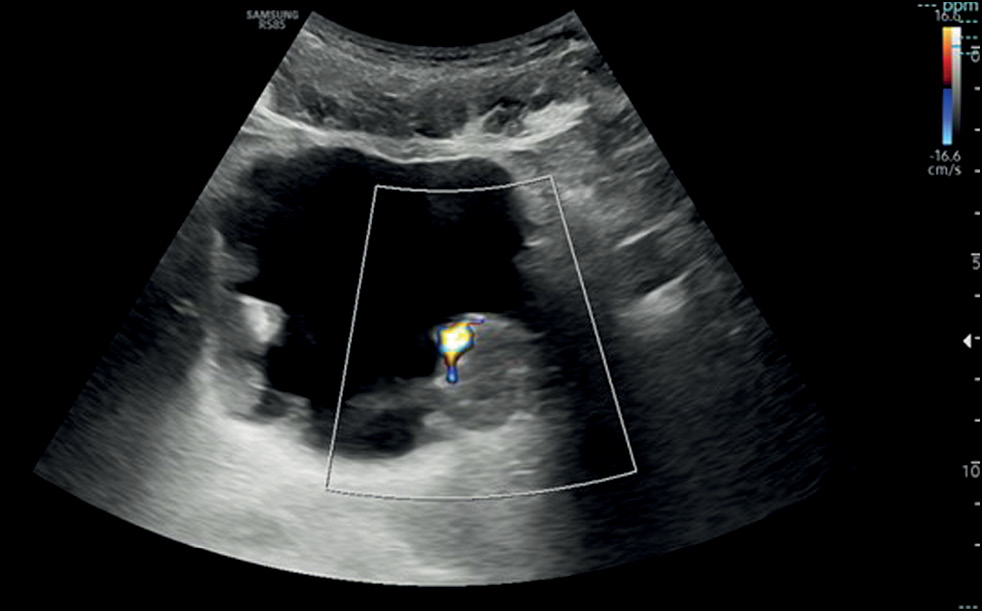
如果在超声图像上发现灶性肿块,则需要进一步检查是否存在其他病变,因为三分之一的肿瘤通常是多灶性的。此外,还应做进一步的多普勒超声评估,这有助于识别有明显血流信号或星状形态的内部血管,并区分潜在的肿瘤和血栓。后一种选择可以通过要求患者从仰卧位改为侧卧位,以评估血栓特征的病变移动性,或进行膀胱冲洗,然后重复超声检查来排除[11](图 1)。
图 1. 膀胱横断面超声图像显示,膀胱壁弥漫性不规则增厚,并伴有多个肿块和腔内发育。最大回声肿块位于左侧膀胱后壁,彩色多普勒成像显示肿瘤内有血管化。
对比增强超声波
技术
对比增强超声波是一种利用超声造影剂 (UCA) 客观显示组织灌注情况的新技术。在常规超声检查中,膀胱应适度膨胀。最初,在进行超声+CU检查之前,应先进行完整的基线超声检查。最常用的超声造影剂是六氟化硫(SonoVue;意大利,Bracco),它是一种不超出血管的示踪剂,可用于血液微循环灌注的实时动态成像。
使用 21 G 外周插管静脉注射 2.4 毫升该物质,然后再注射约 5 毫升生理溶液。超声造影剂在血液中停留的时间足以到达靶向器官,并提供动脉和静脉相位的充分解释。研究在低机械指数的基础 B 模式下进行,以降低微泡破裂的发生率。
正常膨胀的膀胱壁薄约 2 毫米,圆二色性信号微乎其微,在使用造影剂的初始阶段几乎检测不到。信号会在大约 2 分钟内逐渐增强[15]。
应用
对比增强超声波基于生物学原理,根据该原理,肿瘤的特征是明显的新血管形成,这导致造影剂的冲洗和注射时间与非肿瘤情况相比发生变化。对比增强超声波的一个主要优势是可以实时进行。CT 或磁共振成像必须精确确定最佳图像采集时间,才能更好地将肿瘤与周围的膀胱壁区分开来,而 对比增强超声波则不需要这样做,因为不同患者的增强模式可能会因心血管状况或 膀胱癌的微血管化程度等因素而有所不同。对比增强超声波可以持续进行实时动态增益评估。
此外,膀胱癌造影剂的长期造影剂增强使得只需一次超声造影剂剂量就能对膀胱壁进行全面检查,这使得它对多中心癌症的多病灶检测很有用。动脉新生血管是 膀胱癌的常见特征,乳头状和无柄肿瘤或小病灶增厚的信号增强立即显现出来。该过程类似于在尿路造影的动脉期中观察到的过程。 信号放大通常均匀地发生,除了更广泛的,高度恶性的侵袭性肿瘤。 在在这种情况下,信号增强可能是不均匀的,尤其是在肿瘤的坏死区域[16]。
在快速的动脉期和 超声造影剂积累之后,大多数肿瘤都会出现缓慢的冲洗,但在静脉期,这一过程会因肿瘤大小和细胞分化情况而有所不同。对比增强超声波有助于鉴别诊断,使您能够将肿瘤形成与其他可能模拟肿瘤的膀胱壁病理区分开来。这些病变可能是膀胱内血块、粘连性结石、与前列腺肥大相关的良性增厚或炎症过程引起的膀胱壁增厚。病灶或淋巴结的对比度增强表示肿瘤。
使用 对比增强超声波诊断 膀胱癌的依据是检测膀胱壁局灶性增厚区域或突出到膀胱腔内的肿块。在超声波中使用造影剂可提高 膀胱癌的检出率,特别是当传统超声可能因膀胱膨胀不足、膀胱手术史、肥胖或膀胱内导管的存在等因素而效果不佳时。
膀胱壁受累的深度、恶性肿瘤的组织学分级以及肿瘤向膀胱外的扩散是 膀胱癌预后和治疗的主要决定因素。虽然核磁共振成像和 CT 是局部分期的首选成像方法,但 对比增强超声波可以通过检查膀胱壁病变区域的对比度增强模式来帮助评估膀胱壁病变。这种方法可根据有无低糜烂层以及动脉期后的增强模式来区分非浸润性膀胱癌和浸润性癌 [15]。
恶性膀胱肿瘤与良性膀胱肿瘤在造影剂增强模式上有所不同,因此 对比增强超声波成为区分恶性膀胱肿瘤和提高诊断准确性的重要工具。对比增强超声波可实时观察膀胱肿瘤的血流情况。然而,与 CT 和磁共振成像相比,对比增强超声波其在浸润癌分期中的用途有限,因为它不能评估膀胱周围脂肪组织和腹膜后淋巴结的浸润情况(图 2)[16]。
图 2. 矢状切面的对比增强超声图像显示,左侧膀胱壁上有一个体积较大的肿块,在 B 型图像中轮廓不清。
CT 尿路造影
造影技术
CTU 是一种尿路 CT 扫描,属于原位扫描。静脉注射造影剂后,进行多相扫描,以获得一组显示完全阴影和扩张的肾内集合系统、输尿管和膀胱的图像[17]。此外,CTU 方案还包括对腹部和盆腔器官进行原位扫描。静脉注射造影剂后,可区分以下增强阶段:超声造影剂注射后 30-40 秒为皮质-髓质期,随后进入动脉期,100 秒后进入肾造影期,8~12 分钟后进入排泄期。
然而,多阶段研究方案的主要限制是25至35 mSv的高辐射负荷。因此,我们为年轻患者提供了分次注射造影剂(split-bolus)的方案,其中包括非强化扫描的两阶段方案,先进行一次非强化扫描,然后分两次静脉注射造影剂,剂量分别约为 80 毫升和 40 毫升。第一次注射后,20 秒后进行皮质-髓质扫描。延迟 8 分钟后,注射第二部分 超声造影剂,然后在 100 秒后进行扫描,以获得排泄期。扫描应在颅尾方向进行,Z 轴延伸应从膈穹隆开始,到达膀胱耻骨联合,特别是在无造影增强扫描和肾造影时,而皮质髓质增强阶段可从肾脏上极开始[18]。
这两种方案都可以在皮质-髓质扫描前 2~3 分钟静脉注射 10 毫克呋塞米,以达到充分扩张上尿路和膀胱的目的。膨胀不足的膀胱可能会出现增厚,尤其是沿着前壁,膀胱腔内未被遮盖的尿液和造影剂可能会不完全混合,这将导致尿液的对比水平增加,因为其比重高于造影剂的比重[17]。
应用
腹部 CTU 是最常用的技术,因为它有许多优点,如广泛的可用性、快速扫描和创建具有后处理能力的多平面三维重建图像。对于疑似或确诊为 膀胱癌的患者,CTU 可用于癌症检测和分期,特别是评估局部和远处肿瘤扩散情况。
CTU 方案的每个步骤都有各自的优势。非增强CT用于测量肿瘤区域的基础信号衰减,然后与造影剂增强后的信号进行比较,以确定是否存在结石、钙化、出血和血栓。皮质-髓质期用于评估可疑的血管异常或动脉增强。肾造影阶段可以检测肾脏肿块并确定其特征。排泄期用于评估尿路上皮,因为当膀胱被致密造影剂充盈时,腔内软组织病变会表现为充盈缺损[19]。
膀胱癌可表现为膀胱壁局灶性增厚,晚期病例可表现为肿块突入膀胱腔或扩散至邻近组织。如果膀胱膨胀不足,则应检查增厚的不对称性。通常,肿瘤的特征是软组织中的信号减弱,并可能被细小的钙化物覆盖。
CTU 的准确性最高。例如,在 膀胱癌的检测和分期中,综合灵敏度为 92%,综合特异度为 95%。T分期不能区分非肌肉浸润性膀胱癌和肌肉浸润性膀胱癌,但可以区分T3和T4肿瘤。N 分期可反映淋巴结形态和大小。如果盆腔、腹腔和腹膜后淋巴结短轴超过 8-10 毫米,则应怀疑为恶性肿瘤。就形态学标准而言,融合淋巴结或中心坏死的淋巴结的存在被认为是转移的明确标志。在淋巴结检查中,CTU 的特点是高估和低估疾病的严重程度。高估发生在约 30% 的反应性淋巴腺疾病病例中,即淋巴结短轴超过 10 毫米。如果淋巴结是恶性的,但大小正常,则有可能被低估。至于M期,膀胱癌最常转移到盆腔和腹膜后淋巴结。 膀胱癌最常见的远处转移部位是骨。大多数骨病变表现为硬化,但也可能是溶解性或混合性溶解硬化。在实体器官中,转移灶最常出现在肝脏和肺部,其他器官受影响的情况要少得多[11]。
诊断程序结束后,如果发现需要进一步评估的可疑肿块,可要求进行内窥镜检查+活检,以确诊并确定尿路肿瘤的数量、范围和位置[18]。
双能量计算机断层扫描
技术
双能量计算机断层扫描是一种新的成像技术,它使用两种类型的X射线和两个具有不同电压(低能级和高能级)的X射线管。双能量计算机断层扫描图像可在后期处理过程中进行二次重建。
考虑到研究的目的,即检测 膀胱癌或其分期,最有用的图像类型是虚拟单色(VMC)和虚拟非对比(VNC)图像,以及碘图和原子图。
虚拟单色 图像的质量与传统单能量 CT 相似,但能提供更可靠的信号衰减值。由于碘吸收导致的高信号衰减,较低的电压可增加附近结构的对比度。因此,在这种情况下,更容易识别顶叶区域的病变。电压越高,对金属结构产生的噪音和伪影的敏感度越低。在 虚拟单色 图像的基础上比较两种不同的模式,可以构建信号衰减的光谱曲线,这是能量的函数。后者所具有的特性有助于改善命中特征。
虚拟非对比图像是一种无对比度图像,在对比后获得的扫描中观察到的碘吸收被抑制。虚拟非对比 图像也被称为无碘图像。在这种情况下,由于不对患者进行预先扫描,辐射量会更低。碘图是一种特定材料的图像,与碘减影图像不同,它能显示所有碘吸收区域。它是一种彩色图谱,可以用毫克/毫升表示碘吸收的数量。此外,碘图还能让我们根据主动脉中的碘填充量来区分血管病变和新生血管病变。
有效原子序数的估算是一种定量方法,可用于区分不同类型的材料和确定辐射的衰减系数[3]。
应用
双能量计算机断层扫描有助于克服 CT 的主要缺点,如过度暴露于电离辐射,这在接受多次检查和密集监视的癌症患者中很常见。
此外,通过后处理图像,双能量计算机断层扫描还能更好地确定病灶的特征。
虚拟非对比 扫描可提供真正的无对比度图像,可以排除结石、钙化和新鲜血液的存在。后者在典型的基底扫描中以及在测量后续对比后扫描的信号衰减参考值时会出现高密度。
在膀胱壁增厚的情况下,频谱曲线会从较低的电压值开始上升。
在低电压下获得的 虚拟单色 图像与附近的结构相比,肿瘤的对比度更高,检测肿瘤的灵敏度也更高。此外,当定量碘含量相对于肾造影期的主动脉进行归一化处理时,当达到≥3.0 mg/ml 的阈值时,这种类型的图像显示出增加的特异性,并且允许您使用以下公式区分血管化病变和非血管化病变:|I|归一化 = |I|病灶/|I|主动脉[20,21]。
双能量计算机断层扫描的优势也适用于 膀胱癌分期,因为碘图可以更快地检测膀胱壁浸润,包括在区分非肌肉浸润性和肌肉浸润性 膀胱癌时检测肌肉层,以及评估淋巴结受累情况和是否存在转移。
这项技术的使用可能对治疗策略的选择至关重要,因为它能更好地评估肿瘤与血管之间的关系,而在较低电压下进行 虚拟单色成像所获得的更高对比度是一个重要参数(图 3 和图 4)[22]。
图 3. 多平面碘图像显示多灶性肿块有不同程度的信号衰减,主要肿块位于左后壁。病灶的平均值与腔内值不同。通过光谱曲线(左上),我们可以识别出不同衰减曲线的物质。
图 4. 彩色碘图的多平面图像,显示多灶性肿块有不同程度的信号衰减,主要肿块位于左后壁。病灶的平均值与腔内值不同。通过光谱曲线(左上),我们可以识别出不同衰减曲线的材料。
磁共振成像
技术
要进行充分的 磁共振成像检查,患者的初步准备非常重。膀胱应适度膨胀。患者应在核磁共振成像扫描前约 2.5 小时排尿并饮水 500 毫升。
使用定位器的定向扫描允许专家在膀胱足够充盈时开始手术。
如上所述,膀胱膨胀对于评估 膀胱癌非常重要。膀胱壁可能会出现增厚,膨胀不足可能会导致误诊。相反,过度膨胀可能会导致患者不适,他们可能会在检测到假象时变得活跃,甚至在无法憋住大量尿液时中止检查。
通常情况下,检查本身使用 1.5 特斯拉核磁共振成像扫描仪进行,患者取仰卧位。以下序列用于正确评估膀胱:
- 轴向 T1 加权(T1W)涡轮自旋回波;
- T2-加权(T2W)序列,在轴向、矢状或冠状面上具有高分辨率和窄视野,并抑制脂肪组织信号;
- 扩散加权成像(DWI)和测量扩散系数(ADC);
- 动态对比磁共振成像、T1-W 三维梯度回波和三点狄克逊法。
对女性而言,图像不仅应包括膀胱,还应包括子宫、卵巢和阴道,对男性而言,图像应该包括前列腺[5]。
应用
磁共振成像主要用于 膀胱癌局部肿瘤分期,因为它可以确定是否存在肌肉浸润,从而区分非肌肉浸润性 膀胱癌和肌肉浸润性 膀胱癌,以及 T1 和 T2 分期。
膀胱壁具有多层结构,尿路上皮和固有层只有在注射造影剂后的早期阶段才会在动态对比增强磁共振成像上显示为一条高强度线。肌层在 T2 加权图像上表现为一条低信号强度线,在具有 测量扩散系数 比值的 扩散加权成像 图像上表现为中等强度,而在具有动态对比度的磁共振成像图像上则表现为一条晚期信号逐渐增强的线[5]。
VI-RADS 系统有助于规范经尿道膀胱切除术确诊为 膀胱癌患者的磁共振成像结果的获取、解释和报告方法。分值从 1 到 5 不等,反映了侵入逼尿肌的风险不断增加[6]。T2W、扩散加权成像/测量扩散系数 和 DCE 序列用于更准确地反映病变情况,每种序列分为 1-5 级。T1 加权图像对区分非肌肉浸润性 膀胱癌和肌肉浸润性膀胱癌没有价值,因为在排尿肌中存在中间信号强度,意味着恶性过程[23]。
在分析 T2W 结构数据时,应首先评估肌层的完整性。肌层信号应均匀低强,而膀胱内容物则呈高强信号。然后评估 扩散加权成像/测量扩散系数 和 DCE 序列的信号。在肿瘤中,信号在 扩散加权成像 模式中呈高密度,在 测量扩散系数 图中呈低密度,膀胱壁内层早期信号增强。在获得每个序列的信息后,对不同的评分组合进行比较,并计算出最终的 VI-RADS 评分。
当 T2W 上与肌肉层相对应的强信号线出现中断时,则属于 VI-RADS 1 类。病灶的最大尺寸(无柄或植物状)不应超过 1 厘米。VI-RADS 1 提示存在非肌肉浸润性 膀胱癌。当强信号线中断,但肿瘤直径大于 1 厘米时,也可划分为 VI-RADS 2 类。病变可能与水肿有关,表现为线增厚,肿瘤浸润的可能性增加。VI-RADS 3 表示怀疑肿瘤侵犯肌肉层:T2W 上肌肉层的低强度信号没有明显中断。VI-RADS 4 表示肿瘤侵犯肌肉层,VI-RADS 5 表示肿瘤侵犯肌肉层并累及周围脂肪组织。
如果结果存在差异,可使用 扩散加权成像/测量扩散系数 和 DCE 图谱对病灶进行降级和升级[5]。
磁共振成像对于评估 膀胱癌患者治疗后的变化也很重要。磁共振成像可用于评估新辅助化疗和免疫疗法后的患者,这些疗法是治疗 膀胱癌的革命性疗法。治疗后,可使用 T2W、扩散加权成像/测量扩散系数 和 DCE 序列研究肿瘤状态。此外,还要评估对治疗的反应,包括部分反应、完全反应或无反应。在这方面,VI-RADS 已显示出良好的效果[24]。
总之,磁共振成像正在成为诊断 膀胱癌、评估治疗反应和长期随访的主要成像方式。此外,磁共振成像在手术和放疗的治疗计划中也发挥着重要作用。然而,确定肿瘤的恶性程度需要经尿道切除活检,这是磁共振成像无法替代的(图 5 和图 6)。
图 5. 膀胱磁共振成像:a - T2W 模式下的多平面图像显示左侧膀胱后壁一个大于1cm的肿块,中间有肌层信号(VI-RADS 4);b - 扩散加权成像 序列和 测量扩散系数 图显示病变扩散明显受限,并侵入肌层,测量扩散系数 比值低至 0.9×10-3 mm2/s,提示恶性(VI-RADS 4);c - DCE 序列显示病灶早期异质信号放大,并侵入肌肉层(VI-RADS 4)。VI-RADS 总分为 4 分。图片来源:Eusebi Laura, Masino Federica, Gifuni Rossella, Fierro Davide, Michele Bertolotto, Cova Maria Assunta, Giuseppe Guglielmi. Role of Multiparametric-MRI in Bladder Cancer. Current Radiology Reports 11, 69–80 (2023).
https://doi.org/10.1007/s40134-023-00412-5. 本文属于公共领域,根据 Creative Commons Attribution (CC BY) 4.0 许可条款发布 (http://creativecommons.org/licenses/by/4.0/)。
图 6. 膀胱磁共振成像: a - T2W 模式下的多平面图像显示,右侧膀胱穹隆外侧壁上有一个超过 1 厘米的肿块,其间有肌肉层信号,并侵入膀胱周围脂肪组织(VI-RADS 5); b - 扩散加权成像 和 测量扩散系数 图显示病变呈明显局限的弥漫性,侵犯肌肉层和膀胱周围脂肪组织(VI-RADS 5);c - DCE 序列显示病变早期不均匀信号增强,侵犯肌肉层和膀胱周围脂肪组织(VI-RADS 5)。VI-RADS 量表的总分是 5 分。图片来源:Eusebi Laura, Masino Federica, Gifuni Rossella, Fierro Davide, Michele Bertolotto, Cova Maria Assunta, Giuseppe Guglielmi. Role of Multiparametric-MRI in Bladder Cancer. Current Radiology Reports 11, 69–80 (2023). https://doi.org/10.1007/s40134-023-00412-5. 本文属于公共领域,根据 Creative Commons Attribution (CC BY) 4.0 许可条款发布 (http://creativecommons.org/licenses/by/4.0/)。
联合混合放射性核素成像
PET/CT 将 PET 和 CT 结合为一种单一的成像方法。2-氟-18F-2-脱氧-D-葡萄糖(FDG)是肿瘤学中最常见的放射性药物,因此使用 FDG 的 PET/CT 被广泛应用于多种癌症的临床实践中 [25,26]。
作为葡萄糖的类似物,18F-FDG 通过 GLUT 转运蛋白和其他转运蛋白进入肿瘤细胞,在细胞内被己糖激酶磷酸化,但不会进一步代谢,导致细胞内蓄积。PET/CT 可对代谢活动进行高灵敏度扫描,并对肿瘤进行精确的解剖定位[27]。
近年来,这种混合成像技术越来越多地被用于检测 膀胱癌患者根治性膀胱切除术后的复发情况[25, 26]。
鉴于尿路肿瘤对 FDG 的摄取量较高,这种药物随尿液排泄可以掩盖尿路所有部分的肿瘤,尤其是膀胱肿瘤。因此,人们研究并测试了几种降低尿液中 FDG 活性的方法,如大量吸水、利尿剂和导尿。然而,导尿过程中的灌洗和逆行膀胱充盈可能会增加先天性尿路感染的风险,从而延长住院时间。鉴于这一局限性,可在 FDG 排泄和在膀胱内蓄积之前的早期阶段通过动态成像对肿瘤进行评估[25]。
目前,不建议将 FDG PET/CT 作为初始诊断方式或主要分期工具,因为该技术被认为无法在显微镜水平上评估膀胱周围脂肪组织的侵犯程度和邻近器官的损害。不过,PET/CT 可用来评估对治疗的反应、检测残留或复发情况以及区分疤痕组织和活动性肿瘤[26]。
PET/MRI 是另一种混合成像模式,它结合了 PET 提供的功能信息和磁共振成像提供的详细解剖图像。PET 使用 FDG 作为示踪剂,可以识别代谢活性增加的区域,这通常表明存在癌组织。相比之下,磁共振成像结合使用可提供高对比度的软组织。
鉴于这些先决条件,PET/MRI 可以克服 PET/CT 在评估肿瘤局部范围方面的固有局限性,因为高质量的磁共振成像图像可以评估周围脂肪组织和肌肉层(28)。然而,由于肾脏排泄 FDG 的特异性,PET/MRI 诊断 膀胱癌早期阶段的灵敏度仍然很低。因此,膀胱壁的小病灶可能不会被发现[29]。
结论
影像学检查对 膀胱癌的评估至关重要,尤其是在癌症肿瘤的检测和分期方面。传统的超声波技术,尤其是 CTU,现在正得到 磁共振成像检查结果的补充。反过来,磁共振成像也越来越受欢迎,因为它可以通过 VI-RADS 区分非肌肉浸润性 膀胱癌和肌肉浸润性 RRM。PET/CT 和 PET/MRI 等联合成像模式也是对 膀胱癌进行分期的有前途的工具。对比增强超声波和双能量计算机断层扫描等新的成像模式并不属于典型的诊断和分期方案,但却在某些情况下得到应用,可为临床医生和放射科医生提供有用的信息,确保为癌症患者提供正确的治疗方法,并着眼于未来越来越个性化的医疗。
ADDITIONAL INFORMATION
Funding source. This study was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
作者简介
Federica Masino
Foggia University School of Medicine
Email: federicamasino@gmail.com
ORCID iD: 0009-0004-4289-3289
MD
意大利, FoggiaLaura Eusebi
Carlo Urbani Hospital
Email: lauraeu@virgilio.it
ORCID iD: 0000-0002-4172-5126
MD
意大利, JesiGianmichele Muscatella
Foggia University School of Medicine
Email: muscatella94@gmail.com
ORCID iD: 0009-0004-3535-5802
MD
意大利, FoggiaManuela Montatore
Foggia University School of Medicine
Email: manuela.montatore@unifg.it
ORCID iD: 0009-0002-1526-5047
MD
意大利, FoggiaGiuseppe Sortino
Carlo Urbani Hospital
Email: giuseppesortino@live.it
ORCID iD: 0000-0002-8804-1805
MD
意大利, JesiWilly Giannubilo
Civitanova Marche Hospital
Email: willygiannubilo@virgilio.it
MD
意大利, Civitanova MarcheGiuseppe Guglielmi
Foggia University School of Medicine; Dimiccoli Hospital; IRCCS Casa Sollievo della Sofferenza Hospital
编辑信件的主要联系方式.
Email: giuseppe.guglielmi@unifg.it
ORCID iD: 0000-0002-4325-8330
Professor
意大利, Foggia; Barletta; San Giovanni Rotondo参考
- Hill WG. Control of Urinary Drainage and Voiding. Clin J Am Soc Nephrol. 2015;10(3):480–492. doi: 10.2215/CJN.04520413
- Glassock RJ, Rule AD. Aging and the Kidneys: Anatomy, Physiology and Consequences for Defining Chronic Kidney Disease. Nephron. 2016;134(1):25–29. doi: 10.1159/000445450
- Montatore M, Muscatella G, Eusebi L, et al. Current Status on New Technique and Protocol in Urinary Stone Disease. Curr Radiol Rep. 2023;11(12):1–16. doi: 10.1007/s40134-023-00420-5
- Sam P, Nassereddin A, LaGrange CA. Anatomy, Abdomen and Pelvis: Bladder Detrusor Muscle. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2023.
- Eusebi L, Masino F, Gifuni R, et al. Role of Multiparametric-MRI in Bladder Cancer. Curr Radiol Rep. 2023;11(5):69–80. doi: 10.1007/s40134-023-00412-5
- Nicola R, Pecoraro M, Lucciola S, et al. VI-RADS score system — A primer for urologists. Int Braz J Urol. 2022;48(4):609–622. doi: 10.1590/s1677-5538.ibju.2021.0560
- Jubber I, Ong S, Bukavina L, et al. Epidemiology of Bladder Cancer in 2023: A Systematic Review of Risk Factors. Eur Urol. 2023;84(2):176–190. doi: 10.1016/j.eururo.2023.03.029
- Messina E, Pecoraro M, Pisciotti ML, et al. Seeing is Believing: State of the Art Imaging of Bladder Cancer. Semin Radiat Oncol. 2023;33(1):12–20. doi: 10.1016/j.semradonc.2022.10.002
- Compérat E, Amin MB, Cathomas R, et al. Current best practice for bladder cancer: a narrative review of diagnostics and treatments. Lancet. 2022;400(10364):1712–1721. doi: 10.1016/S0140-6736(22)01188-6
- Ahmadi H, Duddalwar V, Daneshmand S. Diagnosis and Staging of Bladder Cancer. Hematol Oncol Clin North Am. 2021;35(3):531–541. doi: 10.1016/j.hoc.2021.02.004
- Wentland AL, Desser TS, Troxell ML, Kamaya A. Bladder cancer and its mimics: a sonographic pictorial review with CT/MR and histologic correlation. Abdom Radiol. 2019;44(12):3827–3842. doi: 10.1007/s00261-019-02276-w
- Wong VK, Ganeshan D, Jensen CT, Devine CE. Imaging and Management of Bladder Cancer. Cancers. 2021;13(6):1396. doi: 10.3390/cancers13061396
- Messina E, Pisciotti ML, Pecoraro M, et al. The use of MRI in urothelial carcinoma. Curr Opin Urol. 2022;32(5):536–544. doi: 10.1097/MOU.0000000000001011
- Schallom M, Prentice D, Sona C, et al. Accuracy of Measuring Bladder Volumes With Ultrasound and Bladder Scanning. Am J Crit Care. 2020;29(6):458–467. doi: 10.4037/ajcc2020741
- Ahmadi H, Duddalwar V, Daneshmand S. Diagnosis and Staging of Bladder Cancer. Hematol Oncol Clin North Am. 2021;35(3):531–541. doi: 10.1016/j.hoc.2021.02.004
- Liu Q, Gong H, Zhu H, Yuan C, Hu B. Contrast-Enhanced Ultrasound in the Bladder: Critical Features to Differentiate Occupied Lesions. Comput Math Methods Med. 2021;2021:1–5. doi: 10.1155/2021/1047948
- Fouladi DF, Shayesteh S, Fishman EK, Chu LC. Imaging of urinary bladder injury: the role of CT cystography. Emerg Radiol. 2020;27(1):87–95. doi: 10.1007/s10140-019-01739-3
- Renard-Penna R, Rocher L, Roy C, et al. Imaging protocols for CT urography: results of a consensus conference from the French Society of Genitourinary Imaging. Eur Radiology. 2020;30(3):1387–1396. doi: 10.1007/s00330-019-06529-6
- Abuhasanein S, Hansen C, Vojinovic D, et al. Computed tomography urography with corticomedullary phase can exclude urinary bladder cancer with high accuracy. BMC Urol. 2022;22(1):60. doi: 10.1186/s12894-022-01009-4
- Bicci E, Mastrorosato M, Danti G, et al. Dual-Energy CT applications in urinary tract cancers: an update. Tumori. 2023;109(2):148–156. doi: 10.1177/03008916221088883
- Parakh A, Lennartz S, An C, et al. Dual-Energy CT Images: Pearls and Pitfalls. RadioGraphics. 2021;41(1):98–119. doi: 10.1148/rg.2021200102
- Toia GV, Mileto A, Wang CL, Sahani DV. Quantitative dual-energy CT techniques in the abdomen. Abdom Radiol (NY). 2022;47(9):3003–3018. doi: 10.1007/s00261-021-03266-723
- Lai AL, Law YM. VI-RADS in bladder cancer: Overview, pearls and pitfalls. Eur J Radiol. 2023;160:110666. doi: 10.1016/j.ejrad.2022.110666
- Panebianco V, Pecoraro M, Del Giudice F, et al. VI-RADS for Bladder Cancer: Current Applications and Future Developments. J Magn Reson Imaging. 2022;55(1):23–36. doi: 10.1002/jmri.27361
- Bouchelouche K. PET/CT in Bladder Cancer: An Update. Semin Nucl Med. 2022;52(4):475–485. doi: 10.1053/j.semnuclmed.2021.12.004
- Kim SK. Role of PET/CT in muscle-invasive bladder cancer. Transl Androl Urol. 2020;9(6):2908–2919. doi: 10.21037/tau.2020.03.31
- Omorphos NP, Ghose A, Hayes JDB, et al. The increasing indications of FDG-PET/CT in the staging and management of Invasive Bladder Cancer. Urol Oncol. 2022;40(10):434–441. doi: 10.1016/j.urolonc.2022.05.017
- Zhang-Yin J, Girard A, Marchal E, et al. PET Imaging in Bladder Cancer: An Update and Future Direction. Pharmaceuticals (Basel). 2023;16(4):606. doi: 10.3390/ph16040606
- Muin D, Laukhtina E, Hacker M, Shariat SF. PET in bladder cancer imaging. Curr Opin Urol. 2023;33(3):206–210. doi: 10.1097/MOU.0000000000001090
补充文件