双能计算机断层扫描用于头和颈癌
- 作者: Petrovichev V.S.1, Neklyudova M.V.1, Sinitsyn V.Е.2, Nikitin I.G.1
-
隶属关系:
- Radiology Department, National Medical Research Treatment and Rehabilitation Centre of the Ministry of Health of Russia
- Lomonosov Moscow State University
- 期: 卷 2, 编号 3 (2021)
- 页面: 343-355
- 栏目: 科学评论
- ##submission.dateSubmitted##: 03.03.2021
- ##submission.dateAccepted##: 15.06.2021
- ##submission.datePublished##: 15.10.2021
- URL: https://jdigitaldiagnostics.com/DD/article/view/62572
- DOI: https://doi.org/10.17816/DD62572
- ID: 62572
如何引用文章
详细
对使用双能计算机断层扫描 (DECT) 诊断头颈癌的出版物进行了审查; 研究了通过 DECT 方法获得的数据的定性和定量分析结果,并在该定位的肿瘤中进行了静脉对比增强; 显示了构建碘图以获得额外诊断信息的重要性; 描述了在牙种植体伪影的背景下改善口咽区域可视化的方面。 文章中介绍的许多科学作品强调了当前的技术水平和“原始数据”DECT 后处理的作用,获得了一系列头颈部肿瘤和其他病理变化的单色图像,包括将 DECT 与静脉造影增强和常规计算机断层扫描在减少患者辐射负荷方面进行比较,特别是由于在后处理期间从 DECT 体积的对比系列中获取虚拟原生诊断图像。 除了最新的相关科学数据外,该评论还包括对 DECT 作为一种方法的发展历史的著作的参考。 简要概述了 DECT 的物理原理和该方法的发展前景。
全文:
绪论
头颈癌早期诊断的相关性是由于该病理学在全世界恶性肿瘤发病结构中的主导地位[1]。俄罗斯,首次发现头部和颈部恶性肿瘤的患者数量稳步增长[2]。
显然,临床和内镜检查可以评估口腔和舌头、喉部和喉部粘膜的状况。然而,这两个部门仍然没有被列入名单。扁平细胞癌既可能具有外源性,也可能具有内生性生长,但多为混合型。如果原发性或复发性肿瘤是在粘膜上发现的,我们无法可靠地估计其亚粘膜成分(仅间接触诊 )[3,4]。放化疗后,会形成玻璃体水肿区,改变正常的解剖结构,以及粘膜的外观和密度。 舌根、咽旁和食管旁间隙、喉部和喉咽部增厚、体积增大,可引起吞咽困难和呼吸困难,使内镜检查复杂化[5]。 头颈部鳞状细胞癌免疫治疗后,可能出现假性进展,尤其是肿瘤的大小和范围的增加,需要严格的动态控制,以排除疾病的真正进展[6, 7] 。所有这些都需要使用客观的动态控制方法,例如计算机断层扫描 (CT) 和磁共振成像 (MRI) 断层扫描。 混合成像技术(正电子发射或单光子发射计算机断层扫描与计算机断层扫描相结合)不太可用,因为扫描仪数量不足,无法覆盖人群,而且研究成本较高。 此外,治疗过程中混合诊断的时间限制:为了更好地区分疗程后炎症和肿瘤的变化化疗和手术必须至少进行3个月[8,9]。
MRI是诊断头颈肿瘤的有效方法。采用现代基本脉冲序列解决了多种诊断问题。因此,T1、具有对比度增强的 T1、T2 加权序列和具有脂肪抑制的序列最适合于可视化炎症变化、分期肿瘤病变和检测发育中的胚胎肿瘤。 血管和灌注序列用于排除血管畸形和评估组织灌注的微循环参数。扩散加权图像可能有助于胆管瘤成像,以及评估恶性和治疗反应,头颈癌复发性或残留性肿瘤的检测[10,11]。除了方法的明显优点外,众所周知,包括不同脉冲序列在内的完整MR研究的运行时间,与CT相比持续时间更长,这限制了扫描仪的吞吐量和白天可能进行的研究数量。
现代双能成像技术
X射线与物质相互作用的物理方法,提供了双能量扫描,是一种光电效应,康普顿效应和汤姆森散射。
双能量计算机断层扫描(DECT)的基本原理是根据X射线的能量,不同的解剖结构和组织可能有相同或不同的密度,其影响范围介于高千瓦和低千瓦之间。利用双能系统的一个关键优势是能够将图像分解或分解成其核心材料。这种情况下,各种阻尼的配准发生在不同的 X 射线辐射能量下。 这允许您显示图像的特定体素中存在的每种材质的数量。这为后处理产生的大量图像提供了更广泛的可能性(图)。例如,可以构建虚拟非对比图像、减去骨骼结构和分析不透射线的结石。此外,还可以通过获取碘的孤立图像来构建碘地图。
DECT方法本身在CT时代开始就广为人知,但其应用主要限于骨矿物质密度的评估 [12, 13]。 最近DECT开始被引入到检查患有头颈部恶性肿瘤的患者的临床实践中。 这种方法要么使用具有两个能源的扫描仪,要么在扫描过程中在断层摄影仪的X射线管上应用快速电流开关。
头颈部双能量断层扫描
早期的一项科学研究中,双能量(管上电流为80和140千瓦)和常规多层计算机断层扫描(MSCT;管上电流为120千瓦)在头颈部解剖图像的质量上没有发现显著差异。同时,DECT患者的辐射负荷较低[14]。同时,自2010年以来,许多研究致力于评估双能量计算机血管造影对短头动脉病理学的可能性[15–25]。根据A.Schwahofer和合著者[26],在DECT体积后处理过程中获得的单能重建的使用使得只有当口腔金属的密度不超过4.5 克/立方厘米(例如,钛或铝)时,才有可能减少口腔金属的伪影。这对于计算总的局部剂量几乎没有用处,但在规划放射治疗时,它可以用于描绘感兴趣区域的解剖标志。对于源密度大于4.5 克/立方厘米的牙齿金属伪影,仅观察到伪影的轻微抑制。本研究中的大多数患者都有金属义齿或其他密度更高(>10 克/立方厘米)的牙科硬件。由此我们可以得出结论,考虑到计划放射治疗的任务,单能重建不是减少金属伪影的通用工具[26]。
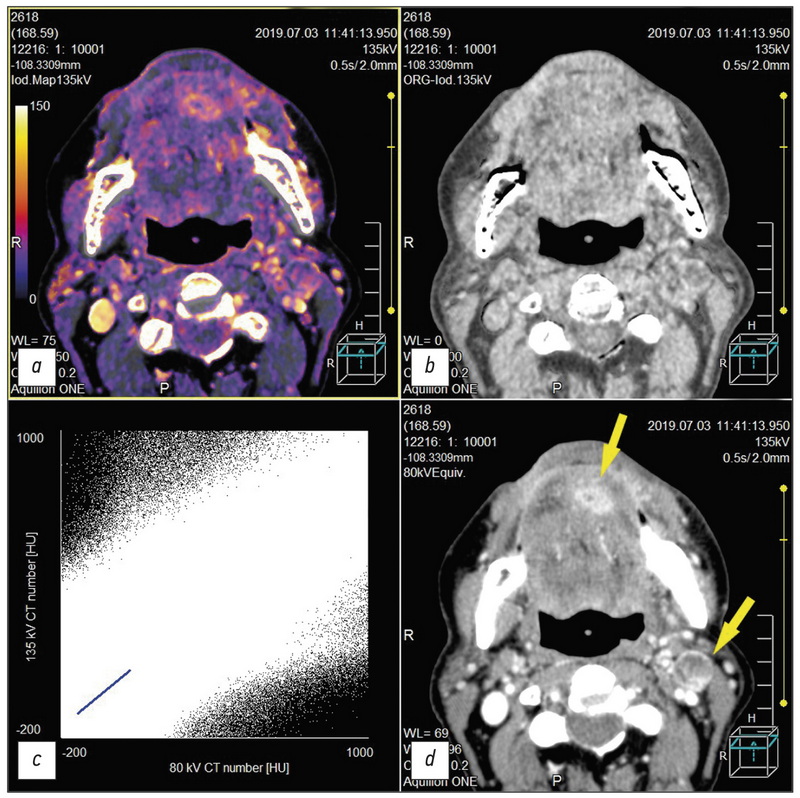
图口底鳞状细胞癌延伸至舌的放化疗后的双能计算机断层扫描。舌下表面残留肿胀和转移,分解为左侧下颌下淋巴结(黄色箭头)。 a - 碘卡; b - 虚拟非对比图像; c - 高和低kV值之间单独切片的像素分布图; d - 低值等于 80 kV 的单色图像。
相反,根据J.Weiβ和合著者[27],金属伪影抑制(IMAR)模式改善了口腔和周围解剖结构在牙科植入伪影背景下的可视性。图像及其诊断价值在Likert量表上定性评估,在Hounsfield单位(HU)上定量评估。研究发现,在30例患者中,在金属伪影抑制的情况下,图像的信息量比未使用该模式时更丰富(分别为3.8±0.5和2.6±0.5;p<0.0001)。使用HU单位对伪影程度的测量进行量化得到了相关结果。与标准重建相比,在抑制金属伪影方面获得的数据明显较少(分别为0.9±1.6和20±47;p<0.05)[27]。
根据 N. Groβe Hokamp和合著者的研究结果[28] 与传统CT(CI)图像相比,具有高keV(keV)值的虚拟单能图像(virtual monoenergetic images, VMI)中的低衰减和高衰减伪影显示HU值(CI / VMI200 keV: -218 , 7 / -174.4 HU, p = 0.1, 和 309.8 / 119.2, p = 0.05)。 具有高 keV 值的虚拟单能图像中,脂肪中的伪影也减少了(CI / VMI200kEv:23.9 / 16.4,p = 0.05)。 具有高密度的虚拟单能图像中揭示了超密集伪影的质量减少 - ≥100 - 由 keV 的值决定(例如 CI / VMI200kEv: 2 (1-3) / 3 (1-5), p = 0.05)。 降低伪影的严重程度,从而改善软腭和脸颊的可视化 (例如,CI/VMI200kEv:2(1-4)/3(1-5)和另外2(1-5)/3(1-5),p≤0.05)。 一般来说,在 DECT 体积的后处理过程中获得的虚拟单能图像降低了牙种植体伪影的严重程度,改善了周围软组织的诊断 [28]。
根据另一项研究的结果,使用高能VMI可以降低伪影的严重程度,同时削弱肿瘤组织中含碘造影剂的可视性。一般来说,高能VMI(<100 keV)在维持足够的含碘造影剂成像的同时,可适度减少伪影,为评估头颈癌提供有用的额外诊断图像[29]。E. Liao [30] 的研究数据证实了这一点,根据该数据,DECT改善了头部、颈部和脊柱在金属植入物伪影背景下的可视化。 根据许多其他作者的说法,光谱 CT 方法提高了头颈部恶性肿瘤的放射诊断 [31-36]。
A.M.Tawfik和合著者[37]的研究工作的目的是改善头颈部肿瘤的可视化。这包括对80千瓦和140千瓦的不同加权因子(0.3;0.6;0.8)获得的图像进行评估,以及对肿瘤病灶轮廓的评估。这项研究包括35名头颈部恶性肿瘤患者,他们来自60名疑似癌症患者。他们的工作中,作者比较了不同头颈图像集的信噪比、信号衰减测量和客观噪声等参数。结果由两名独立的放射科医生分析,他们评估了以下参数:病变轮廓、图像清晰度、主观噪声。评估采用五分制。科学家得出结论,使用0.6的加权因子(80 kW数据的60%)混合在80和140 kW的管电流下获得的DECT诊断数据,可以提高肿瘤病灶的信噪比,主观上提高包括肿瘤边界在内的整体图像质量。该加权系数显示了比系数0.3更多的诊断信息,该系数模拟了120 kW管子上的电流值,并尽可能接近标准MSCT的图像[37]。
根据M.Li和合著者[38],结合使用DECT重建的单色图像分析材料的成分对于甲状腺结节的鉴别诊断和明确其恶性程度具有很大的潜力。
评估喉癌的局部患病率时,确定甲状腺软骨的浸润程度非常重要。致力于这一诊断问题的研究中,有人提出以五点量表评估侵袭程度:真正的侵袭开始于侵蚀(3点),结束于软骨侵袭(5点)。对这些数据进行碘卡和加权平均图像分析。加权访问图像和碘卡评估甲状腺软骨发芽的敏感性、特异性和准确性达到100%。只有在一例病例中,在加权平均图像上,喉癌甲状腺软骨的完全萌发被忽略了,但在碘地图上明确了患病率[39]。
许多研究中描述了该方法评估喉软骨骨架的可能性。R.Forghani和合著者[40]注意到虚拟单色图像上信号衰减的差异(≥95keV)的头部和颈部的头细胞,与喉的简单甲状腺软骨相比。另一项研究中,一组来自日本和美国的科学家对MRI和DECT进行了比较,以评估整个喉的软骨骨架和甲状腺软骨的损伤,特别是与头颈部的头癌的损伤。DECT显示出比MRI更高的特异性。这些数据是关于整个软骨喉体的侵犯(MRI为84%,DECT为98%,p<0.004)和甲状腺软骨的侵犯(分别为64%和100%,p<0.001)。曲线下的平均面积(0.94对0.95,p=0.70)。解决类似问题的方法对整个软骨-喉尸体(MRI为97%,DECT为81%,p=0.16)和甲状腺软骨(分别为100%和89%,p=0.50)的敏感性无显著差异。然而,MRI的敏感性有更高的趋势。DECT有助于避免重新评估软骨喉部的侵犯,这可能是炎症变化的结果。这是通过使用适当的加权平均图像(WA)和碘图(IO)诊断标准来实现的,无论是精确的还是未固定的软骨喉部。同时,使用DEKT,可以忽略一个小肿瘤对沉积的软骨喉部的调用,在没有重新评估软骨性喉体的侵袭程度的情况下,该方法具有精确的价值,因此有助于增加治疗喉癌的器官破裂方法的数量[41]。
J.L. Wichmann和合著者 [42] DECT评估170例头部和颈部各种病理学中的ECT图像系列(80 kW和线性混合120 kW)的诊断准确性。 随后的分析由三个独立的放射科医生进行,该学家具有转介研究,包括临床理由。 其他数据,包括其他诊断方式,专家无法使用。 结论与医学文件进行了比较,结论CT和组织学结论。 对每个研究人员分别计算敏感性,特异性,阳性预后显着性和阴性预后显着性。 使用胞内相关系数估计专家放射科医师之间的协议。 诊断组中制备以下临床乳药:扁平挤奶癌(n = 107;对初级/复发性扁平癌的存在/不存在),淋巴瘤(n = 40;初级/复发性淋巴瘤的存在/不存在)和良性疾病(n = 23;例如,脓肿)。 累积敏感性,特异性,阳性预后值和阴性预后值和120 kW的线性混合图像的120 kW的含量为94.8; 93.0; 分别为95.9和91.1%。 一组患有平面症状癌症的患者患者的结果(%)也非常高:94.8 / 95.3; 89.1 / 89.1; 94.3 / 94.4; 90.1 / 91.0; 与淋巴瘤相关的疾病类似的图片和疾病:95.0; 100.0; 100.0; 95.2%,适用于80/120 kW的一系列图像。 研究人员之间的协议几乎是理想的(阶级系数相关的系数0.82; 0.80; 95%DI 0.76-0.74,0.86-0.85)。 标准120 kW扫描相比,扫描长度上的吸收剂量几乎降低了80千瓦(135.5与282.2mg / cm)。 研究人员得出结论,低千伏(80 kW)的CT具有高分辨率,为常规临床实践提供良好的诊断准确性,也可以显着降低患者的辐射负担[42]。
相关数据表明,与低能量和高能量下的线性混合图像相比,在使用两种能量源对DECT数据进行后处理时,头颈部原发癌的可视化程度有所提高-80/140 kW[43]。根据S. Lam和合著者 [44],最良好的虚拟单色图像上的头部和颈部区域的软组织的可视化 - 通过65 keV,而对比度噪声的最佳比率可视化平面碳癌为40 keV。 这是由于来自肿瘤的信号的衰减与未受影响的周围软组织(p = 0.03)之间的差异。
来自中国的科学家小组研究了DECT在鉴别和鉴别诊断转移性受累颈部淋巴结、头颈部平缝癌和各种淋巴增生性疾病中的可能性。他们得出结论,在70 keV的单级图像上实现了受影响的淋巴结的最佳可视化。该工作的设计还考虑了根据KW [45]的值的碘分子软组织的X射线渗透率的光谱曲线的斜率。 根据F. Fu和合著者 [46]虚拟非对比度图像当在DECT后处理中获得的宫颈淋巴结时可视化宫颈淋巴结,在具有全面的本地研究的质量上是可比的。这种情况下,与标准本机研究相比,这种图像具有较低的患者辐照剂量(p<0.05)。 DECT与静脉内对比度的组合和随后的虚拟本地图像的结构使得可以确保具有较低患者径向载荷的第二次淋巴结的充分可视化[46]。
来自加拿大R. Forghani [47]的作者,将重建和后处理能力与一个能量和快速切换的X射线管和与两个能量源的DECT进行了一个能量和快速切换,建议使用后处理以获得最佳软颈组织的可视化。 对于颈部区域的所有实施例的虚拟单体重建 - 通过65和40keV最小,以诊断喉肿瘤 - 类似的重建和建立碘盘,以及95keV(或更高值)的虚拟单体重建以诊断喉肿瘤。 除碘卡外,上述所有内容,作者提出用于可视化口腔肿瘤和旋转,减少牙科伪影[47]。类似的数据导致另一个科学家团队[48]。
国际作者组织的工作中提供了在特殊治疗中排除差异或复制肿瘤的差异诊断。 因此,根据H. Yamauchi和合著者一个小队列研究 [49],当比较虚拟单体重建于40和70keV时,首先允许您更好地通过治疗来实现复发性或残留肿瘤的差异诊断。 根据L. Yang和合著者[50]标记 碘,水和倾斜患者患者患者患者患者的浓度差异,即甲状腺和唾液腺,淋巴瘤和扁平癌癌的癌症。
M.S. May和合著者[51]实施在头部和颈部恶性疾病的患者中对DECT扫描仪进行两能源和单能扫描(70 kW)的比较:首先让您更好地可视化肿瘤的边界构建单声道 - 40 keV的再生重建。 通过70 kW执行单能扫描的执行是建议在口腔中存在金属植入物存在的伪影。 类似的结果比较平静的平细胞头和颈部癌症患者的两能量和标准CT扫描,从加拿大接受了一组科学家[52]。
根据R.Forghani和合著者[53-55],各种DECT重建与随后的定量分析组合可以潜在地改善组织评估和肿瘤的可视化的特征,包括将过程侵入到解剖结构中,这可能影响患者的策略。 L. Yang和合著者[56]在DECT的帮助下,评估了两组患有喉癌和交替缓解的两组患者的化学疗法的治疗反应进行了评估。 根据残留肿瘤的存在或不存在,光谱曲线具有不同的斜率。 进行诊断效率的ROC分析显示,曲线下的一个区域为0.83。 这组其他科学家们评估了食管癌癌症前后的疗效,建议在后处理DECT期间建造碘盘允许您在这两种情况下评估碘的浓度。 这使得可以评估化学疗法的效果,同时避免治疗过程中的辐射剂量增加[57]。
由于测量附着于叶酸作为接头的金纳米颗粒的浓度,通过DECT评估鼻咽癌的有趣方法。 DECT特征是分解所研究的材料,其允许分离和识别在研究中的组织中的各种元素,特别是金纳米颗粒。 这种诊断方法实际上是鼻咽癌细胞的可视化[58]。
最近,当癌症有头部和颈部区域时,“机器学习”的重要性。 一组作者描述了与单个单能重建分析相比,对所有系列图像的软组织进行自动多能纹理分析预测淋巴结局部区域转移病变的优势[59]。另一组科学家利用机器学习研究了DECT在评估颈部淋巴结各种肿瘤病变(包括淋巴增生性疾病)中的可能性[60]。这一方向具有科学性和实用性,需要进一步研究。
结论
因此,与通常的对比MSCT相比,通过静脉推注对比剂对怀疑患有DECT头颈部癌症的患者进行检查,可以获得更详细的信息。DEKT方法允许您在基础材料上分解生成的图像,特别是接收感兴趣区域的分离和混合碘图-肿瘤和区域淋巴结。这些信息可能对特殊抗肿瘤治疗后的患者动态检查具有诊断价值,特别是远程放疗、化疗和免疫治疗。
附加信息
资金来源。作者声明,在进行搜索和分析工作以及编写出版物时,缺乏外部资金。
利益冲突。作者声明没有明显的和潜在的利益冲突相关的发表这篇文章。
作者贡献。V.S. Petrovic - 文学资料,文学撰写和编辑文章的文学,收集和分析综述; M.V. Nezlyudova - 文章的文学,准备和写作概述; V.E. Sinitsyn - 文学资源的文学,收集和分析,制定和编辑文章的审查; I.G. Nikitin - 文学资源的收集和分析,编辑文章。 所有作者都确认其作者符合国际ICMJE标准(所有作者为文章的概念,研究和准备工作做出了重大贡献,并在发表前阅读并批准了最终版本)。
谢意的表示。作者感谢Natalia Georgievna Pokrovskaya帮助文章编辑文章的文本。
作者简介
Victor S. Petrovichev
Radiology Department, National Medical Research Treatment and Rehabilitation Centre of the Ministry of Health of Russia
Email: petrovi4ev@gmail.com
ORCID iD: 0000-0002-8391-2771
SPIN 代码: 7730-7420
MD, Cand. Sci. (Med.)
俄罗斯联邦, 3 Ivan’kovskoe shosse, 125367, MoscowMarina V. Neklyudova
Radiology Department, National Medical Research Treatment and Rehabilitation Centre of the Ministry of Health of Russia
Email: mneklyudova@med-rf.ru
ORCID iD: 0000-0003-4224-2975
SPIN 代码: 7450-6800
MD, Cand. Sci. (Med.)
俄罗斯联邦, 3 Ivan’kovskoe shosse, 125367, MoscowValentin Е. Sinitsyn
Lomonosov Moscow State University
Email: vsini@mail.ru
ORCID iD: 0000-0002-5649-2193
SPIN 代码: 8449-6590
MD, Dr. Sci. (Med.), Professor
俄罗斯联邦, MoscowIgor G. Nikitin
Radiology Department, National Medical Research Treatment and Rehabilitation Centre of the Ministry of Health of Russia
编辑信件的主要联系方式.
Email: igor.nikitin.64@mail.ru
ORCID iD: 0000-0003-1699-0881
SPIN 代码: 3595-1990
MD, Dr. Sci. (Med.), Professor
俄罗斯联邦, 3 Ivan’kovskoe shosse, 125367, Moscow参考
- Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 2018;68(6):394–424. doi: 10.3322/caac.21492
- Socially significant diseases of the Russian population in 2018. Statistical materials. Moscow; 2019. Р. 15–17. (In Russ).
- Pynnonen MA, Gillespie MB, Roman B, et al. Clinical practice guideline: evaluation of the neck mass in adults. Otolaryngol Head Neck Surg. 2017;157(2 Suppl):S1–S30. doi: 10.1177/0194599817722550
- Mannelli G, Cecconi L, Gallo O. Laryngeal preneoplastic lesions and cancer: challenging diagnosis. Qualitative literature review and meta-analysis. Critical Reviews in Oncology Hematology. 2016;106:64–90. doi: 10.1016/j.critrevonc.2016.07.004
- Hinther A, Samson N, Lau H, et al. Volumetric changes in pharyngeal structures following head and neck cancer chemoradiation therapy. The Laryngoscope. 2020;130(3):597–602. doi: 10.1002/lary.28164
- Baxi SS, Dunn LA, Burtness BA. Amidst the excitement: A cautionary tale of immunotherapy, pseudoprogression and head and neck squamous cell carcinoma. Oral Oncology. 2016;62:147–148. doi: 10.1016/j.oraloncology. 2016.10.007
- Szturz P, Vermorken JB. Immunotherapy in head and neck cancer: aiming at EXTREME precision. BMC Med. 2017;15(1):110. doi: 10.1186/s12916-017-0879-4
- Abgral R, Querellou S, Potard G, et al. Does 18f-fdg pet/ct improve the detection of posttreatment recurrence of head and neck squamous cell carcinoma in patients negative for disease on clinical follow-up? Journal of Nuclear Medicine. 2008;50(1):24–29. doi: 10.2967/jnumed.108.055806
- Greven KM, Williams DW, Keyes JW, et al. Positron emission tomography of patients with head and neck carcinoma before and after high dose irradiation. Cancer. 1994;74(4):1355–1359. doi: 10.1002/1097-0142(19940815)74:4<1355::aid-cncr2820740428>3.0.co;2-i
- Widmann G, Henninger B, Kremser C, Jaschke W. MRI sequences in head & neck radiology – state of the art. Fortschr Röntgenstr. 2017;189(05):413–422. doi: 10.1055/s-0043-103280
- Dai YL, King AD. State of the art MRI in head and neck cancer. Clinical Radiology. 2018;73(1):45–59. doi: 10.1016/j.crad.2017.05.020
- Genant HK, Boyd D. Quantitative bone mineral analysis using dual energy computed tomography. Investigative Radiology. 1977;12(6):545–551. doi: 10.1097/00004424-197711000-00015
- Raymakers JA, Hoekstra O, van Putten J, et al. Fracture prevalence and bone mineral mass in osteoporosis measured with computed tomography and dual energy photon absorptiometry. Skeletal Radiol. 1986;15(3):191–197. doi: 10.1007/BF00354059
- Tawfik AM, Kerl JM, Razek AA, et al. Image quality and radiation dose of dual-energy ct of the head and neck compared with a standard 120-kvp acquisition. AJNR Am J Neuroradiol. 2011;32(11):1994–1999. doi: 10.3174/ajnr.A2654
- Deng K, Liu C, Ma R, et al. Clinical evaluation of dual-energy bone removal in CT angiography of the head and neck: comparison with conventional bone-subtraction CT angiography. Clinical Radiology. 2009;64(5):534–541. doi: 10.1016/j.crad.2009.01.007
- Lell MM, Kramer M, Klotz E, et al. Carotid computed tomography angiography with automated bone suppression: a comparative study between dual energy and bone subtraction techniques. Investigative Radiology. 2009;44(6):322–328. doi: 10.1097/RLI.0b013e31819e8ad9
- Thomas C, Korn A, Krauss B, et al. Automatic bone and plaque removal using dual energy CT for head and neck angiography: Feasibility and initial performance evaluation. European Journal of Radiology. 2010;76(1):61–67. doi: 10.1016/j.ejrad.2009.05.004
- Lell MM, Hinkmann F, Nkenke E, et al. Dual energy CTA of the supraaortic arteries: Technical improvements with a novel dual source CT system. European Journal of Radiology. 2010;76(2):e6–e12. doi: 10.1016/j.ejrad.2009.09.022
- Chen Y, Xue H, Liu W, et al. [Dual-energy computed tomographic angiography of head and neck arteries with different contrast material doses in second generation dual-source computed tomography system]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao. 2010;32(6):628–633. doi: 10.3881/j.issn.1000.503X.2010.06.008
- Korn A, Fenchel M, Bender B, et al. High-pitch dual-source CT angiography of supra-aortic arteries: assessment of image quality and radiation dose. Neuroradiology. 2013;55(4):423–430. doi: 10.1007/s00234-012-1120-y
- Chen Y, Xue H, Jin Z, et al. 128-slice acceletated-pitch dual energy ct angiography of the head and neck: comparison of different low contrast medium volumes. PLoS ONE. 2013;8(11):e80939. doi: 10.1371/journal.pone.0080939
- Korn A, Bender B, Schabel C, et al. Dual-source dual-energy ct angiography of the supra-aortic arteries with tin filter. Academic Radiology. 2015;22(6):708–713. doi: 10.1016/j.acra.2015.01.016
- Kaemmerer N, Brand M, Hammon M, et al. Dual-energy computed tomography angiography of the head and neck with single-source computed tomography: a new technical (Split filter) approach for bone removal. Invest Radiol. 2016;51(10):618–623. doi: 10.1097/RLI.0000000000000290
- Ma G, Yu Y, Duan H, et al. Subtraction CT angiography in head and neck with low radiation and contrast dose dual-energy spectral CT using rapid kV-switching technique. BJR. 2018;20170631. doi: 10.1259/bjr.20170631
- Wu Q, Shi D, Cheng T, et al. Improved display of cervical intervertebral discs on water (Iodine) images: incidental findings from single-source dual-energy CT angiography of head and neck arteries. Eur Radiol. 2019;29(1):153–160. doi: 10.1007/s00330-018-5603-z
- Schwahofer A, Bär E, Kuchenbecker S, et al. The application of metal artifact reduction (Mar) in CT scans for radiation oncology by monoenergetic extrapolation with a DECT scanner. Zeitschrift für Medizinische Physik. 2015;25(4):314–325. doi: 10.1016/j.zemedi.2015.05.004
- Weiß J, Schabel C, Bongers M, et al. Impact of iterative metal artifact reduction on diagnostic image quality in patients with dental hardware. Acta Radiol. 2017;58(3):279–285. doi: 10.1177/0284185116646144
- Große Hokamp N, Laukamp KR, Lennartz S, et al. Artifact reduction from dental implants using virtual monoenergetic reconstructions from novel spectral detector CT. European Journal of Radiology. 2018;104:136–142. doi: 10.1016/j.ejrad.2018.04.018
- Nair JR, DeBlois F, Ong T, et al. Dual-energy ct: balance between iodine attenuation and artifact reduction for the evaluation of head and neck cancer. Journal of Computer Assisted Tomography. 2017;41(6):931–936. doi: 10.1097/RCT.0000000000000617
- Liao E, Srinivasan A. Applications of dual-energy computed tomography for artifact reduction in the head, neck, and spine. Neuroimaging Clinics of North America. 2017;27(3):489–497. doi: 10.1016/j.nic.2017.04.004
- Vogl TJ, Schulz B, Bauer RW, et al. Dual-energy ct applications in head and neck imaging. American Journal of Roentgenology. 2012;199(5 Suppl):S34–S39. doi: 10.2214/AJR.12.9113
- Srinivasan A, Parker RA, Manjunathan A, et al. Differentiation of benign and malignant neck pathologies: preliminary experience using spectral computed tomography. Journal of Computer Assisted Tomography. 2013;37(5):666–672. doi: 10.1097/RCT.0b013e3182976365
- Tawfik AM, Razek AA, Kerl JM, et al. Comparison of dual-energy CT-derived iodine content and iodine overlay of normal, inflammatory and metastatic squamous cell carcinoma cervical lymph nodes. Eur Radiol. 2014;24(3):574–580. doi: 10.1007/s00330-013-3035-3
- Kuno H, Onaya H, Fujii S, et al. Primary staging of laryngeal and hypopharyngeal cancer: CT, MR imaging and dual-energy CT. European Journal of Radiology. 2014;83(1):e23–e35. doi: 10.1016/j.ejrad.2013.10.022
- Toepker M, Czerny C, Ringl H, et al. Can dual-energy CT improve the assessment of tumor margins in oral cancer? Oral Oncology. 2014;50(3):221–227. doi: 10.1016/j.oraloncology.2013.12.001
- Ginat DT, Mayich M, Daftari-Besheli L, Gupta R. Clinical applications of dual-energy CT in head and neck imaging. Eur Arch Otorhinolaryngol. 2016;273(3):547–553. doi: 10.1007/s00405-014-3417-4
- Tawfik AM, Kerl JM, Bauer RW, et al. Dual-energy CT of head and neck cancer: average weighting of low- and high-voltage acquisitions to improve lesion delineation and image quality –initial clinical experience. Investigative Radiology. 2012;47(5):306–311. doi: 10.1097/RLI.0b013e31821e3062
- Li M, Zheng X, Li J, et al. Dual-energy computed tomography imaging of thyroid nodule specimens: comparison with pathologic findings. Investigative Radiology. 2012;47(1):58–64. doi: 10.1097/RLI.0b013e318229fef3
- Kuno H, Onaya H, Iwata R, et al. Evaluation of cartilage invasion by laryngeal and hypopharyngeal squamous cell carcinoma with dual-energy CT. Radiology. 2012;265(2):488–496. doi: 10.1148/radiol.12111719
- Forghani R, Levental M, Gupta R, et al. Different spectral hounsfield unit curve and high-energy virtual monochromatic image characteristics of squamous cell carcinoma compared with nonossified thyroid cartilage. AJNR Am J Neuroradiol. 2015;36(6):1194–1200. doi: 10.3174/ajnr.A4253
- Kuno H, Sakamaki K, Fujii S, et al. Comparison of MR imaging and dual-energy CT for the evaluation of cartilage invasion by laryngeal and hypopharyngeal squamous cell carcinoma. AJNR Am J Neuroradiol. 2018;39(3):524–531. doi: 10.3174/ajnr.A5530
- Wichmann JL, Kraft J, Nöske EM, et al. Low-tube-voltage 80-kvp neck ct: evaluation of diagnostic accuracy and interobserver agreement. AJNR Am J Neuroradiol. 2014;35(12):2376–2381. doi: 10.3174/ajnr.A4052
- Scholtz JE, Hüsers K, Kaup M, et al. Non-linear image blending improves visualization of head and neck primary squamous cell carcinoma compared to linear blending in dual-energy CT. Clinical Radiology. 2015;70(2):168–175. doi: 10.1016/j.crad.2014.10.018
- Lam S, Gupta R, Levental M, et al. Optimal virtual monochromatic images for evaluation of normal tissues and head and neck cancer using dual-energy CT. AJNR Am J Neuroradiol. 2015;36(8):1518–1524. doi: 10.3174/ajnr.A4314
- Wang X, Zhao Y, Wu N, et al. [Application of single-source dual-energy spectral CT in differentiating lymphoma and metastatic lymph nodes in the head and neck]. Zhonghua Zhong Liu Za Zhi. 2015;37(5):361–366.
- Fu F, He A, Zhang Y, et al. Dua-energy virtual noncontrast imaging in diagnosis of cervical metastasis lymph nodes. J Can Res Ther. 2015;11(6):202. doi: 10.4103/0973-1482.168185
- Forghani R. Advanced dual-energy CT for head and neck cancer imaging. Expert Review of Anticancer Therapy. 2015;15(12):1489–1501. doi: 10.1586/14737140.2015.1108193
- Lam S, Gupta R, Kelly H, et al. Multiparametric evaluation of head and neck squamous cell carcinoma using a single-source dual-energy CT with fast kVp switching: state of the art. Cancers. 2015;7(4):2201–2216. doi: 10.3390/cancers7040886
- Yamauchi H, Buehler M, Goodsitt MM, et al. Dual-energy CT-based differentiation of benign posttreatment changes from primary or recurrent malignancy of the head and neck: comparison of spectral hounsfield units at 40 and 70 kev and iodine concentration. American Journal of Roentgenology. 2016;206(3):580–587. doi: 10.2214/AJR.15.14896
- Yang L, Luo D, Li L, et al. Differentiation of malignant cervical lymphadenopathy by dual-energy CT: a preliminary analysis. Sci Rep. 2016;6(1):31020. doi: 10.1038/srep31020
- May MS, Bruegel J, Brand M, et al. Computed tomography of the head and neck region for tumor staging – comparison of dual-source, dual-energy and low-kilovolt, single-energy acquisitions. Invest Radiol. 2017;52(9):522–528. doi: 10.1097/RLI.0000000000000377
- Forghani R, Kelly H, Yu E, et al. Low-energy virtual monochromatic dual-energy computed tomography images for the evaluation of head and neck squamous cell carcinoma: a study of tumor visibility compared with single-energy computed tomography and user acceptance. Journal of Computer Assisted Tomography. 2017;41(4):565–571. doi: 10.1097/RCT.0000000000000571
- Forghani R, Kelly HR, Curtin HD. Applications of dual-energy computed tomography for the evaluation of head and neck squamous cell carcinoma. Neuroimaging Clinics of North America. 2017;27(3):445–459. doi: 10.1016/j.nic.2017.04.001
- Pérez-Lara A, Forghani R. Spectral computed tomography. Magnetic Resonance Imaging Clinics of North America. 2018;26(1):1–17. doi: 10.1016/j.mric.2017.08.001
- Forghani R, Mukherji SK. Advanced dual-energy CT applications for the evaluation of the soft tissues of the neck. Clinical Radiology. 2018;73(1):70–80. doi: 10.1016/j.crad.2017.04.002
- Yang L, Luo D, Yi J, et al. Therapy effects of advanced hypopharyngeal and laryngeal squamous cell carcinoma: evaluated using dual-energy CT quantitative parameters. Sci Rep. 2018;8(1):9064. doi: 10.1038/s41598-018-27341-0
- Ge X, Yu J, Wang Z, et al. Comparative study of dual energy CT iodine imaging and standardized concentrations before and after chemoradiotherapy for esophageal cancer. BMC Cancer. 2018;18(1):1120. doi: 10.1186/s12885-018-5058-2
- Khademi S, Sarkar S, Shakeri-Zadeh A, et al. Dual-energy CT imaging of nasopharyngeal cancer cells using multifunctional gold nanoparticles. IET nanobiotechnol. 2019;13(9):957–961. doi: 10.1049/iet-nbt.2019.0067
- Forghani R, Chatterjee A, Reinhold C, et al. Head and neck squamous cell carcinoma: prediction of cervical lymph node metastasis by dual-energy CT texture analysis with machine learning. Eur Radiol. 2019;29(11):6172–6181. doi: 10.1007/s00330-019-06159-y
- Seidler M, Forghani B, Reinhold C, et al. Dual-energy CT texture analysis with machine learning for the evaluation and characterization of cervical lymphadenopathy. Computational and Structural Biotechnology Journal. 2019;17:1009–1015. doi: 10.1016/j.csbj.2019.07.004
补充文件