MRT评估前列腺癌和乳腺癌骨骨治疗骨转移有效性的客观标准:系统评论和核心分析
- 作者: Ripp V.O.1, Berezovskaya T.P.1, Ivanov S.A.1
-
隶属关系:
- A. Tsyb Medical Radiological Research Center — branch of the National Medical Research Radiological Center of the Ministry of Health of the Russian Federation
- 期: 卷 2, 编号 3 (2021)
- 页面: 289-300
- 栏目: 系统评价
- ##submission.dateSubmitted##: 03.08.2021
- ##submission.dateAccepted##: 02.09.2021
- ##submission.datePublished##: 15.10.2021
- URL: https://jdigitaldiagnostics.com/DD/article/view/77311
- DOI: https://doi.org/10.17816/DD77311
- ID: 77311
如何引用文章
详细
论证转移性前列腺癌(PC)和乳腺癌(BC)的个体化治疗需要客观的方法来评估对骨骼病灶治疗的反应。经过验证的高效MRT在骨骼中鉴定与没有电离辐射的组合的鉴定产生的前提是使用该方法在监测基于评估治疗效果的客观标准治疗治疗方法时的先决条件。
目标是估计客观定量和半定量MRT标准的可能性,用于确定患有PC和BC患者的临床研究中使用的骨骼中的治疗的有效性(无线电,化学 - 激素和靶向治疗)。
材料与方法Embase,PubMed数据库,Cochrane Central寄存器(中央),Elibrary通过关键词“磁共振成像”,“MRI”,“DWI”,“治疗反应”,“前列腺”癌症“,”乳腺癌“, 英语和俄语”骨转移“。 概述仅包括在骨架的转移病变期间对任何类型治疗效果(外科除外)有效性的客观MRT评估的研究。
结果。根据分析选自312次来源的11项研究,4组客观MRI标准,用于估算PC和BC患者骨骼的转移损伤期间的治疗效果,包括尺寸的动态; 扩散加权图像上的信号强度; 测量扩散系数(MDC)的数值; 总肿瘤载荷。 所有作品中,这些定量和半定量指标的变化在唯一的例外,虽然它们具有相同的焦点,但它们的数值不同。 鉴于治疗前后的ICD值的统计学上显着的异质性(p <0,1 对于χ2标准和I2> 40%)进行治疗前后的MDC值,用于分析随机效应的模型。 治疗导致的 CDI 变化平均为 +0.35 [+0.12; +0.49] × 10-3 平方毫米/秒治疗前平均 ADC 值 0.83 [0.71; 1.03] × 10-3平方毫米/秒, 处理后 - 1.18 [0.83; 1.49] × 10-3 平方毫米/秒。
结论MRI 是一种基于定量和半定量标准客观评估前列腺癌和乳腺癌患者骨转移对治疗反应的信息技术,具有作为监测转移性骨骼病变治疗效果的诊断工具的巨大潜力。
全文:
略语表
GT - 激素疗法
DWI - 扩散加权图像
MDC - 测量扩散系数
IP - 信号强度
MRI - 磁共振断层扫描
PET-CT - 正电子发射断层扫描,与计算机断层扫描相结合
BC - 乳癌
PC - 前列腺癌
RT- 放射疗法
T1-WI - T1作加权像
TT - 靶向治疗
HT - 化疗
tDV (tumor total diffusion volume) ―总肿瘤荷载
绪论
骨架的转移性病变通常在前列腺癌(PC)和乳腺癌(BC)的传播中发现,在70-80%的尸检事件中发现,有时是远程转移的唯一定位。 超过50%的患者,远程转移开始于骨损伤[1-3]。
骨转移的出现会导致患者的身体、功能和情绪状态恶化,并缩短预期寿命。如果通过根治性治疗和治疗可以进行根治性治疗,那么对于播散过程的预测要糟糕得多,并且治疗主要是姑息性的,旨在改善此类患者的总体生活质量。通过改进化疗和激素治疗,积极的多模式治疗的发展使得个体化治疗成为可能,并在对达到的治疗效果进行评估的基础上进行调整[4, 5]。
磁共振成像(MRI)是一种识别转移性骨骼病变的有效方法,其灵敏度和特异性指标(分别为90.5%和95%)高于闪烁扫描(分别为72.9%和93.9%),至少与胆碱的正电子发射和计算机断层扫描(PET-CT)相比较(89.7%和96%)[6-8]。利用常规图像上磁共振信号大小和强度的动力学,利用磁共振成像评估骨转移瘤治疗效果的可能性开始研究相当长的时间。随着弥散加权成像(DWI)和全身MRI的出现,出现了评估骨骼病灶治疗反应的新标准。然而,迄今为止,MRTI评估骨转移治疗有效性的单一方法是基于客观标准的,关于反应病灶的MRI符号学的数据是相互矛盾的[9-12]。
本研究的目的是评估客观定量和半定量MRI标准在确定PC和BC患者临床研究中使用的骨转移治疗(放疗、化疗和激素治疗、靶向治疗)有效性方面的可能性。
研究方法
这项工作是根据PRISMA标准编写的(系统评价和荟萃分析的首选报告参数)[13]。
遵从准则
纳入标准根据PICOS原理选择合适的出版物[14]。 患者(P):18岁以上,具有组织学证实的PC或BC,具有转移性骨损伤。 干预类型(I):MRI作为单独的区域和所有机构; MRI协议应包括标准解剖脉冲序列(T1-,T2加权图像,STIR)和/或DWI,其具有测量的扩散系数(MDC)的图谱。 比较组(C):无结果(O):在开始抗肿瘤治疗前不早于一周和开始抗肿瘤治疗后1-6个月进行骨转移扫描;使用实验室诊断方法(测定血液中前列腺特异性抗原水平)、仪器研究结果(螺旋计算机断层扫描、骨骼和PET-CT闪烁扫描)进行参考反应评估,以与MRI数据进行比较,以及组织学研究,以评估肿瘤的愈合。研究类型(S):在抗肿瘤治疗开始1-6个月之前和之后进行MRI检查的工作。对患者获得的治疗类型(化学疗法、激素疗法、靶向疗法、放射疗法)没有限制。
排除标准:接受骨转移病灶外科治疗的患者。
考虑到MRI领域的技术发展,选择了研究,包括:
1) 2010年1月1日之后发表的DWI和DWI评估;
2) 1998年1月1日之后发布的标准解剖序列
排除标准:文章不以俄语和英语编写; 论文,临床病例的描述; 动物研究。
信息来源
搜索和选择出版物在EMBASE电子数据库中 Embase, PubMed, Cochrane Central Register of Controlled trials (CENTRAL), eLibrary实施。 2021年6月1号实施最后搜索。
研究结果。该搜索是在前瞻性和回顾性临床研究中进行的,使用以下网格库条款和关键词进行随机对照研究: «Magnetic resonance imaging», «DWI», «treatment», «response», «prostate cancer», «breast cancer», «bone metastasis».
选择研究。搜索和随后的选择由两个独立审稿人进行。任何需要讨论的分歧或问题都由首席研究员解决。 第一阶段审查了标题/论题/解题,以确定是否符合审查的主题以及是否有可能获得必要的数据。第二阶段根据列入和删除标准对出版物进行了全面分析。
数据收集为了数据收集,开发了一个表格。以下信息由两位评审员提取:发表标题、发表年份、作者、DOI、主要焦点、患者群体、治疗方法、研究时间、使用的脉冲序列、参考方法、MR符号学、治疗前MDC值和信号强度、MR符号学、治疗后MDC值和信号强度。
系统错误的风险。为了评估选定研究中的偏倚和偏倚风险,使用了QUADAS-2 (Quality Assessment of Diagnostic Accuracy Studies) 清单 [15]。 出版物的文本根据以下标准进行评估:一组患者、研究的技术、参考技术、研究和参考技术之间的时间间隔。 由于不需要,QUADAS-2 列表中的某些问题没有使用(例如,在评估MDC的论文中,没有使用与研究口译员盲法相关的问题,因为MDC是一种客观评估)。 两名评审员对每项研究进行偏倚风险分析后,生成直方图。
统计分析
根据包括MDC测定在内的研究异质性评估结果,选择数据分析和分组方法(随机效应模型或固定效应模型),采用χ2标准和I2异质性指数。 研究的异质性在χ2检验的 p<0.1和I2>40%时被认为具有统计学意义。
结果
选择研究
在 Embase、PubMed、Cochrane Central Register of Controlled trial (CENTRAL) 和 eLibrary 中发现的 312 项来源中,有 11 项研究被纳入本研究(图 1)。
图 1本研究的 PRISMA 框图。
第一阶段,在筛选出重复(31 个)和动物研究(8 个)之后,剩下 273 个来源。 此外,在筛选阶段,在对摘要和摘要进行评估后,筛选出181篇出版物。 检查作品的全文版本是否符合纳入标准后,仍有 11 个来源,它们被纳入本次审查(表)。
表格纳入系统评价和荟萃分析的研究特征
序号 | 作者 | 年纪 | 疾病分类学 | 治疗类型 | 研究间隔 | 磁场感应,T (特斯拉) | 型号, MRI 制造商 | 客观标准 |
1 | Byun和合著者[5] | 2002 | BC(90%) | РТ | 6个月 | 1.5 | 无 | MDC, IP(DWI) |
2 | Messiou 和合著者[9] | 2011 | PC | HT | 3个月 | 1.5 | Avanto, Siemens | MDC |
3 | Reischauer和合著者[10] | 2010 | PC | GT | 1-3个月 | 1.5 | Achieva, Philips | MDC |
4 | Perez-Lopez和合著者[11] | 2016 | PC | TT | 3个月 | 1.5 | Avanto, Siemens | MDC, tDV |
5 | Blackledge和合著者[12] | 2014 | PC,BC | HT,GT,RT, TT | 10-38个星期 | 1.5 | Avanto, Aera, Siemens | MDC, tDV |
6 | Sergeev和合著者[16] | 2016 | PC,BC (90%) | HT,GT,RT | 2-8个月 | 1.5 | Excelart, Toshiba | MDC, IP(DWI) |
7 | Çiray和合著者[17] | 2001 | BC | HT,GT | 3-6个月 | 0.5 | Gyroscan T5, Philips | 大小 |
8 | Brown和合著者[18] | 1998 | BC | GT,HT,RT | 6;9个月 | 1.5 | Vision, Siemens | 大小 |
9 | Tombal和合著者[19] | 2005 | PC | HT | 6个月 | 1.5 | Intera, Philips | 大小 |
10 | Cappabianca 和合著者[20] | 2014 | PC,BC(90%) | РТ | 1;2个月 | 1.5 | Symphony, Siemens | MDC, IP(DWI) |
11 | Kotlyarov 和合著者[20] | 2006 | PC,BC(75%) | HT,GT,RT | 2-8个月 | 0.5 | Proview Open, Philips | 大小 |
注意:MRI- 磁共振断层扫描;BC - 乳癌;PC - 前列腺癌 ;HT - 化疗;GT - 激素疗法;RT- 放射疗法;TT - 靶向治疗 ;MDC - 测量扩散系数;IP - 信号强度 ;DWI - 扩散加权图像;tDV ―总肿瘤荷载

共纳入 370 名患者,其中 147 名对治疗有反应。 三个来源 [5, 16, 17] 缺乏有关受访者数量的数据。 每项纳入研究的样本量范围为 10 至 87 名患者。 七项研究 [9-12, 17-19] 中,样本仅包括主要病灶在前列腺或乳腺的患者;在四项研究 [5, 16, 20, 21] 中,这些定位为 85-95%整个样本。 患者的平均年龄为 47 至 73 岁。
根据用于评估对全身治疗反应的标准,将出版物分为 4 组:
六项研究中 [9-11, 16, 17, 20],CT、骨骼闪烁扫描、前列腺特异性抗原(在前列腺癌患者中)被用作参考测试;在两项研究中,除了上述方法外,PET [12] 和活检 [5]。三篇出版物 [18、19、21] 中,未指明所用参考方法的数据。
扫描选项
不同研究中使用T1-SE序列时的扫描参数TR和TE值差异不显着(分别为400至600ms和5至16ms)。 只有在一份出版物 [10] 中,T1-VI 参数显着不同,分别为 1000 和 3.7 毫秒。 使用DWI的五项研究 [5, 10-12, 16] 中,b 因子的数量为 2-3,初始值和最高值分别为 0-50 和 800-900。一项工作 [9] 中,b 因子的数量为 4 (0; 50; 250; 750),在另一项 [20] - 6 (0; 50; 100; 250; 500; 750) 中,而在两者中,与其他研究相比,MDC值更高,这可能是由于扫描参数的变化。 所有研究中,T1-WI 和DWI的切片厚度均在 4-6毫米 之内。
文献中使用的客观评价标准的分类
骨转移治疗反应的第一个新标准是病变大小的变化。 应该注意的是,建议在 T1-WI 上测量骨骼中的病灶,因为它们对比度更高,轮廓更清晰,灶周水肿不那么明显 [6, 22]。 我们选择的11篇论文中有4篇使用了这个标准。
评估反应的第二个标准是对DWI信号强度的半定量测定,这在11项研究中的3项中发现。 由于信号强度不是物理量,其数值在不同的MRI扫描仪和不同的扫描参数下可能不同,因此,使用转移瘤的信号强度与肌肉的信号强度比 (signal intensity ratio, SIR)。
评估治疗反应的第三个标准是肿瘤病灶MDC数值的变化,该数值是根据MDC和多个b因子值计算和绘制的。这一标准近年来已成为最普遍的标准,在11篇论文中有7篇采用了这一标准。然而,应当注意,MDC值取决于图像参数。
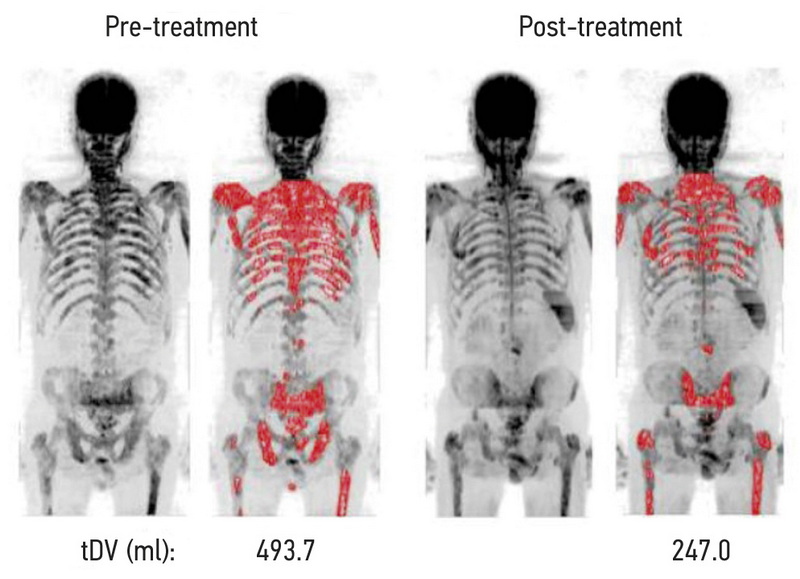
图 2对全身治疗有明显反应的患者治疗前后总肿瘤负荷的可视化和数值 [12]。
第四个也是最新的标准是确定总肿瘤负荷 (total diffusion volume, tDV)。根据最大强度投影 (MIP) 自动计算肿瘤负荷的体积(以毫升为单位),通过计算给定信号强度范围内的体素数量,具有半自动构建和手动校正的 3D 掩模的 DWI(图 2)。 对应于响应、无响应和可疑病灶的MDC范围的体素数量分布可以表示为直方图 [11, 12, 23]。
偏倚风险
由于抗癌治疗应用方法的差异以及治疗开始前后 MRI 之间的时间间隔不同,存在偏倚风险,尽管在 50% 的出版物中间隔为 2-3 个月。 根据 QUADAS-2 标准,偏倚风险的要点是参考方法的选择(图 3)。
图 3根据QUADAS-2的偏倚风险。
5篇文献中,针对不同患者的不同影像学技术作为参考[5, 12]或者只是闪烁扫描[16, 17, 20],MRI的诊断价值较差,不具备必要的敏感性和特异性值接近 100%。 三篇出版物中,完全没有参考方法 [18, 19, 21],对治疗反应的评估由前列腺特异性抗原水平和临床数据控制。 两项工作中 [17, 18],所研究的方法是在磁场强度为 0.5 T 的 MR 断层扫描仪上进行的,这也可能成为系统误差的来源。
评估骨病灶对全身治疗反应的结果
大小四篇文献 [17-19, 21] 评估了 T1-WI 大小的变化,其中三篇显示个体反应灶 [18, 19, 21] 和总肿瘤大小(tumor mass index, TMI ) ,作为二维中所有转移灶大小求和的结果 [17],以及 B. Tombal和合著者 [19] 甚至在两种情况下观察到转移灶完全消失。 但是,应该记住,他们在 6 个月后进行了第二次研究,而不是像其他出版物那样在 2-3 个月后进行。 A.L. Brown和合著者 [18] 77% 的响应病灶没有大小变化,23% 的病灶甚至有所增加。
图 4。基于研究结果的森林图,这些研究确定了对治疗有反应的骨转移中测量的扩散系数值的变化。
DWI 上的信号强度。 三项研究 [5, 16, 20] 包含 DWI 上骨转移信号强度变化的数据作为全身治疗的结果。 所有研究中,作者都得出明确的结论,即治疗后信号强度显着降低。 然而,只有Cappabianca和合著者 [20] 呈现的数值表明对放射治疗有反应的病变的信号强度降低了 35%。
MDCMDC的定量值的评估和分析在七部作品中进行[5, 9-12, 16, 20]。 N.I. Sergeyev和合著者[16] 没有提供每个患者或病变的数据,但表明 CDI 总体增加 25%,以响应成骨细胞病变的治疗,而溶骨性病变则减少 25%。 六篇论文 [5, 9–12, 20] 给出了治疗前后MDC的确切值。 所有作者都注意到对治疗有反应的骨转移的MDC值增加,这反映在森林图(图 4)中,使用随机效应模型构建,考虑到结果的统计显着异质性的存在(χ2 检验 p <0.1,I2> 40%)。
治疗导致的MDC变化平均为 +0.35 [+0.12; +0.49] × 10-3 平方毫米/秒。 所有六篇论文的基线和治疗后 CDI 值的范围如图 5 所示,平均治疗前和治疗后 CDI 值为 0.83 [0.71; 1.03] 和 1.18 [0.83; 1.49] × 10-3平方毫米/秒 ,分别。 尽管存在重叠值,但可以看出反应患者的 CDI 普遍高于治疗前。
tDV.两项研究 [11, 12] 中,tDV是使用特殊软件通过 DWI 评估的。 根据 R. Perez-Lopez和合著者 [11]有反应患者的平均 tDV 值下降了 59%。 根据 M.D. Blackledge 和和合著者 [12]下降了 42,3%。
图 5治疗前(boxplot)和治疗开始后 1-6 个月(淡紫色)测量的骨转移扩散系数的箱线图,绘制时考虑了出版物中包含的所有响应病灶(n = 156)的值。
讨论
这篇系统评价证明了使用 MRI 评估转移性骨病变治疗反应的可能性,基于诸如病变大小、DWI 上的相对信号强度、MDC 的数值和tDV。
这个问题的相关性是由于全身 MRI 在前列腺癌和乳腺癌患者骨转移病变的初步诊断中的使用迅速增加 [7, 8, 24, 25],他们随后接受了各种全身治疗选择和放射治疗,需要评估其有效性。
很长一段时间已经使用了骨转移大小作为系统疗法有效性的客观指标。 为此目的使用 RECIST 1.1标准(Response Evaluation Criteria in Solid Tumours), 根据该测量的骨病变仅包括骨溶解的焦点,其尺寸为至少10毫米的软组织组分。 弥漫性骨损伤和骨细胞灶被认为是无法估量的[26, 27]。 尽管存在局限性, 对于整个身体的MRI [6] 对于骨头的焦点的RECIST 1.1 标准包含在MET-RADSP 建议中(METastasis Reporting and Data System for Prostate Cancer),并且与MDC一起用于评估转移PC期间的响应[1]。
MDA标准专门用于评估安德森大学肿瘤中骨骼的转移 (bone-specific response criteria at The University of Texas MD Anderson Cancer Center)[27]允许您根据动态评估任何类型的焦点它们的数量,尺寸和结构特征。 MDA标准适用于用于射线照相和CT,然而,对于MRI,它们接受了与RECIST 1.1相比的较小分布。
T1-VI [17-19, 21]对骨转移动力学的评估表明他们对特定治疗的响应还原。 只有在一项研究数据中才与其他作品的结果相反。 A.L. Brown和合著者[18]标出从系统性治疗开始时6-9个月后T1-V响应焦点的增加。 这项研究中,所有患者接受了全身或局部放射治疗,其中17个另外化疗或激素治疗。 对这些患者进行治疗的反应的评估是全面使用临床,生物化学,放射学和闪烁标准进行的。 这种结果的原因可能是治疗的特殊性,导致形成明显的持久性周围水肿,这给了T1-W的催眠信号,并根据Met-rads的实际建议,可以导致响应焦点的大小的假阳性增加[6]。 因此,响应特定治疗的骨转移的动态具有诊断意义,但结果可能取决于治疗时间,并在不同的治疗方法和转移性焦点的性质上不同,这表明通过其他目标补充该标准的可行性数据。
通过半异常计算DWI的信号强度的动态作为来自骨骼中的信号强度与来自正常肌肉的信号强度的信号强度的比率,可以被视为评估响应的客观标准[5, 16, 20]。 所有出版物中作者观察到患者的受访者中焦点的信号的强度降低,但是,鉴于数值仅在一个工作中表示[20],而且,在所有三个出版物中,没有考虑到焦点的特征和系统性治疗的类型,进一步研究了从上述条件的DWI上的信号强度变化的依赖性必要的。
MDC的数值的定义具有高潜力作为客观评估标准,并且是符合全身MRI的MET-RADS建议的关键之一。 对这七项研究的分析[5, 9-12, 16, 20]表明MDC在响应患者中的统计学显着增加。 此同时,在所有作品中,单一的MDC下降的案例都是对治疗的良好反应。这些案件作者与治疗的纤维化或硬化的发展有关。根据C. Messiou和合著者的观察 [9]可以在进展的患者中观察到MDC的增加,但比回答的人更加明显。 所有七种出版物N.I. Sergeev和合著者 [16]比较了MDC在响应焦点性质和接受多向变化的患者中的价值观:骨细胞骨质焦点中的MDC增加25%,骨溶解的降低25%。 考虑到这一数据,缺乏关注在其他研究中的骨溶解和卵面观可能是MDC在响应患者的价值观中差异的原因,以及限制这些作品的结果的解释,这表明需要进一步研究包含均质的焦点组。
估计总肿瘤体积(tDV)[11, 12]的研究中,获得了一致的结果。 这两个出版物中,作者在响应特定治疗时结束了tDV的显着下降。 然而,这种方法具有许多限制。 首先,对所获得的扩散加权图像的质量敏感,可以导致TDV在伪影存在下的变化或来自周围组织的信号的不充分抑制。 其次,在这两个出版物中,它在第4-5宫颈椎骨上方手动取出信号,以消除来自大脑,唾液腺和大量淋巴结的tDV潜在的假增加,这可能导致焦点的激情这些领域。第三,时间的方法是时间,因为 包含手动处理步骤,仍然防止其在临床实践中广泛使用。
因此,MRI方法提供了一种物理标准的复杂性,以估计PC和BC患者骨骼易溶性病变的治疗的有效性,但对于临床实践中广泛使用,需要额外的研究来阐明方法论和方法各种转移性焦点评价标准的定量值。
研究的局限性
应该指出,解释这一系统审查的结果应该要小心,给出一些限制,如少数包括的研究,工作的回顾性质,没有标准化的参考技术,不同类型的特异性治疗可以影响微观结构变化的性质,导致响应焦点的差异MP特征。
系统审查和元分析中的研究中,扫描参数略有不同,特别是不同的数量和不同的B因子值,这可能影响MDC的最终值。
结论
MRI是对骨转移对患者患者患者的响应进行客观评估的信息,基于定量和半定量标准。 目前,当评估治疗的有效性时,有必要主要关注T1模式中的焦点尺寸的动态和MDC值的动态,并且尚未开发精确的定量评估标准。 最有前途的是基于MOD的参数,但这并不排除使用传统的RECIST 1.1 和MDA标准。
因此,全身MRI是识别和随后监测BC和PC患者骨骼的转移性病变的潜在有效的诊断工具。
附加信息
资金来源。这项研究是在没有赞助商支持的情况下进行的。
利益冲突。作者声明没有明显的和潜在的利益冲突相关的发表这篇文章。
作者贡献。V.O. Ripp - 文学的搜索和分析,文学数据和写作文本,工作设计的发展;T.P. Berezovskaya - 开发概念和设计审查,搜查和分析文献,写作文本; S.A. Ivanov - 专家评估和审查的最终调整。 所有作者都确认其作者符合国际ICMJE标准(所有作者为文章的概念,研究和准备工作做出了重大贡献,并在发表前阅读并批准了最终版本)。
作者简介
Vladislav O. Ripp
A. Tsyb Medical Radiological Research Center — branch of the National Medical Research Radiological Center of the Ministry of Health of the Russian Federation
Email: rippnba@gmail.com
ORCID iD: 0000-0001-8970-4212
Radiologist of the MRI Department
俄罗斯联邦, 4 Korolev street, Obninsk, 249036Tatyana P. Berezovskaya
A. Tsyb Medical Radiological Research Center — branch of the National Medical Research Radiological Center of the Ministry of Health of the Russian Federation
Email: berez@mrrc.obninsk.ru
ORCID iD: 0000-0002-3549-4499
MD, Senior Research Associate, Dr. Sci. (Med.), Professor
4 Korolev street, Obninsk, 249036Sergey A. Ivanov
A. Tsyb Medical Radiological Research Center — branch of the National Medical Research Radiological Center of the Ministry of Health of the Russian Federation
编辑信件的主要联系方式.
Email: oncourolog@gmail.com
ORCID iD: 0000-0001-7689-6032
MD, Dr. Sci. (Med.), Professor
俄罗斯联邦, 4 Korolev street, Obninsk, 249036参考
- Lecouvet FE, Larbi A, Pasoglou V, et al. MRI for response assessment in metastatic bone disease. Eur Radiol. 2013;23(7): 1986–1997. doi: 10.1007/s00330-013-2792-3
- Padhani AR, Makris A, Gall P, et al. Therapy monitoring of skeletal metastases with whole-body diffusion MRI. J Magn Reson Imaging. 2014;39(5):1049–1078. doi: 10.1002/jmri.24548
- Woolf DK, Padhani AR, Makris A. Assessing response to treatment of bone metastases from breast cancer: what should be the standard of care? Ann Oncol. 2015;26(6):1048–1057. doi: 10.1093/annonc/mdu558
- Padhani AR, Gogbashian A. Bony metastases: assessing response to therapy with whole-body diffusion MRI. Cancer Imaging. 2011;11(1A):S129–S145. doi: 10.1102/1470-7330.2011.9034
- Byun WM, Shin SO, Chang Y, et al. Diffusion-weighted MR imaging of metastatic disease of the spine: assessment of response to therapy. AJNR Am J Neuroradiol. 2002;23(6):906–912.
- Padhani AR, Lecouvet FE, Tunariu N, et al. METastasis reporting and data system for prostate cancer: practical guidelines for acquisition, interpretation, and reporting of whole-body magnetic resonance imaging-based evaluations of multiorgan involvement in advanced prostate cancer. Eur Urol. 2017;71(1):81–92. doi: 10.1016/j.eururo.2016.05.033
- Zugni F, Ruju F, Pricolo P, et al. The added value of whole-body magnetic resonance imaging in the management of patients with advanced breast cancer. PLoS One. 2018;13(10):e0205251. doi: 10.1371/journal.pone.0205251
- Yang HL, Liu T, Wang XM, et al. Diagnosis of bone metastases: a meta-analysis comparing ¹⁸FDG PET, CT, MRI and bone scintigraphy. Eur Radiol. 2011;21(12):2604–2617. doi: 10.1007/s00330-011-2221-4
- Messiou C, Collins DJ, Giles S, et al. Assessing response in bone metastases in prostate cancer with diffusion weighted MRI. Eur Radiol. 2011;21(10):2169–2177. doi: 10.1007/s00330-011-2173-8
- Reischauer C, Froehlich JM, Koh DM, et al. Bone metastases from prostate cancer: assessing treatment response by using diffusion-weighted imaging and functional diffusion maps ― initial observations. Radiology. 2010;257(2):523–531. doi: 10.1148/radiol.10092469
- Perez-Lopez R, Mateo J, Mossop H, et al. Diffusion-weighted imaging as a treatment response biomarker for evaluating bone metastases in prostate cancer: a pilot study. Radiology. 2017;283(1):168–177. doi: 10.1148/radiol.2016160646
- Blackledge MD, Collins DJ, Tunariu N, et al. Assessment of treatment response by total tumor volume and global apparent diffusion coefficient using diffusion-weighted MRI in patients with metastatic bone disease: a feasibility study. PLoS One. 2014; 9(4):e91779. doi: 10.1371/journal.pone.0091779
- Liberati A, Altman DG, Tetzlaff J, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. PLoS Med. 2009;6(7):e1000100. doi: 10.1371/journal.pmed.1000100
- Amir-Behghadami M, Janati A. Population, Intervention, Comparison, Outcomes and Study (PICOS) design as a framework to formulate eligibility criteria in systematic reviews. Emerg Med J. 2020;37(6):387. doi: 10.1136/emermed-2020-209567
- Whiting PF. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011;155(8): 529–536. doi: 10.7326/0003-4819-155-8-201110180-00009
- Sergeev NI, Kotlyarov PM, Solodkii VA. Diffusion-weighted magnetic resonance imaging in the assessment of chemoradiation treatment of metastatic lesions of bone structures. Bulletin of the Russian Scientific Center of Radiology of the Ministry of Health of the Russian Federation. 2016;16(3):2. (In Russ).
- Çiray I, Lindman H, Åström KGO, et al. Early response of breast cancer bone metastases to chemotherapy evaluated with mr imaging. Acta Radiologica. 2001;42(2):198–206. doi: 10.1080/028418501127346503
- Brown AL, Middleton G, Macvicar AD, et al. T1-weighted magnetic resonance imaging in breast cancer vertebral metastases: Changes on treatment and correlation with response to therapy. Clin Radiol. 1998;53(7):493–501. doi: 10.1016/s0009-9260(98)80168-2
- Tombal B, Rezazadeh A, Therasse P, et al. Magnetic resonance imaging of the axial skeleton enables objective measurement of tumor response on prostate cancer bone metastases. Prostate. 2005;65(2):178–187. doi: 10.1002/pros.20280
- Cappabianca S, Capasso R, Urraro F, et al. Assessing response to radiation therapy treatment of bone metastases: short-term followup of radiation therapy treatment of bone metastases with diffusion-weighted magnetic resonance imaging. J Radiotherapy. 2014. doi: 10.1155/2014/698127
- Kotlyarov PM, Sergeev NI, Fedina ON. MRI in the diagnosis of metastatic lesions of the skeleton and in assessing the effectiveness of treatment. Radiology Practice. 2006;6:10–15.
- Lecouvet FE, Talbot JN, Messiou C, et al. Monitoring the response of bone metastases to treatment with Magnetic Resonance Imaging and nuclear medicine techniques: A review and position statement by the European Organisation for Research and Treatment of Cancer imaging group. Eur J Cancer. 2014;50(15):2519–2531. doi: 10.1016/j.ejca.2014.07.002
- Grimm R, Padhani AR. Whole-body diffusion-weighted MR image analysis with syngo.via frontier MR total tumor. Magn Flash. 2017;68(2):73–75.
- Jambor I, Kuisma A, Ramadan S, et al. Prospective evaluation of planar bone scintigraphy, SPECT, SPECT/CT, 18F-NaF PET/CT and whole body 1.5T MRI, including DWI, for the detection of bone metastases in high risk breast and prostate cancer patients: SKELETA clinical trial. Acta Oncol. 2016;55(1):59–67. doi: 10.3109/0284186X.2015.1027411
- Heusner TA, Kuemmel S, Koeninger A, et al. Diagnostic value of diffusion-weighted magnetic resonance imaging (DWI) compared to FDG PET/CT for whole-body breast cancer staging. Eur J Nucl Med Mol Imaging. 2010;37(6):1077–1086. doi: 10.1007/s00259-010-1399-z
- Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45(2):228–247. doi: 10.1016/j.ejca.2008.10.026
- Costelloe CM, Chuang HH, Madewell JE, et al. Cancer response criteria and bone metastases: RECIST 1.1, MDA and PERCIST. J Cancer. 2010;1:80–92. doi: 10.7150/jca.1.80
补充文件