Objective criteria for MRI evaluation of the effectiveness of treatment of bone metastases in patients with prostate cancer and breast cancer: systematic review and meta-analysis
- Authors: Ripp V.O.1, Berezovskaya T.P.1, Ivanov S.A.1
-
Affiliations:
- A. Tsyb Medical Radiological Research Center — branch of the National Medical Research Radiological Center of the Ministry of Health of the Russian Federation
- Issue: Vol 2, No 3 (2021)
- Pages: 289-300
- Section: Systematic reviews
- Submitted: 03.08.2021
- Accepted: 02.09.2021
- Published: 15.10.2021
- URL: https://jdigitaldiagnostics.com/DD/article/view/77311
- DOI: https://doi.org/10.17816/DD77311
- ID: 77311
Cite item
Abstract
BACKGROUND: The possibility of a personalized approach to the treatment of metastatic prostate cancer and breast cancer requires objective methods for the evaluation of the response of foci treatment in the skeleton. The proven high efficiency of MRI in detecting bone metastases, in combination with the absence of ionizing radiation, has laid the groundwork for using this method in monitoring the treatment course based on objective criteria for evaluation of the therapeutic outcome.
AIM: To assess the possibilities of quantitative and semi-quantitative parameters of MRI-evaluation of treatment efficacy (radiation, chemotherapy, hormone therapy, and targeted therapy) of bone metastases that were used in prostate and breast cancer clinical trials.
MATERIALS AND METHODS: We searched the databases Embase, PubMed, Cochrane Central Register of Controlled Trials (CENTRAL), eLibrary until April 1, 2021, using the following keywords: magnetic resonance imaging, MRI, DWI, treatment response, prostate or breast cancer, and bone metastasis. We only included studies related to the MRI-evaluation of treatment efficacy of any type of therapeutic intervention (with the exception of surgery) for metastatic skeletal lesions in this review.
RESULTS: We selected and analyzed 11 out of 312 sources found as a result of the search. It allowed us to identify four groups of objective MRI criteria for evaluating the therapeutic effect in metastatic bone lesions in patients with prostate and breast cancer, including the dynamics of sizes, signal intensity on DWI, ADC, and tumor total diffusion volume (tDV). Changes in these quantitative and semi-quantitative indicators, with only one exception, had the same direction, although they differed in numerical values. A random-effects model was used for analysis considering the presence of statistically significant heterogeneity (p <0,1 for χ2 test; I2 >40%),. The change in ADC as a result of treatment averaged +0.35 [+0.12; +0.49] ×10−3 mm2/s, with average values of ADC before treatment ― 0.83 [0.71; 1.03] ×10−3 mm2/s, after treatment ― 1.18 [0.83; 1.49] ×10−3 mm2/s.
CONCLUSION: MRI is an informative technique for the objective evaluation of the response of bone metastases to therapy in patients with prostate cancer and breast cancer based on quantitative and semi-quantitative parameters. It has significant potential as a diagnostic test instrument for monitoring the effectiveness of treatment of metastatic skeletal lesions.
Full Text
Abbreviations
HT ― hormone therapy
DWI ― diffusion-weighted imaging
ADC ― apparent diffusion coefficient
SI ― signal intensity
MRI ― magnetic resonance imaging
PET-CT ― positron emission tomography combined with computed tomography
BC ― breast cancer
PC ― prostate cancer
RT ― radiotherapy
Т1-WI ― Т1- weighted image
ТТ ― targeted therapy
CT ― chemotherapy
tDV — tumor total diffusion volume
INTRODUCTION
Metastatic skeletal lesions are common in disseminated prostate cancer (PC) and breast cancer (BC) and are found in 70%–80% of autopsies, sometimes the only localized distant metastases. In over 50% of patients, distant metastases begin with bone lesions [1–3].
Bone metastases lead to deterioration in the physical, functional, and emotional state of patients as well as a shortening in life expectancy. Although oligometastatic lesions can possibly be treated through radical therapy, the prognosis is much worse in disseminated lesions, with treatment becomes palliative (aimed at improving the overall quality of life of patients). Advancements in chemotherapy, hormone therapy and aggressive multimodal therapy allow for individualization and standardization on the assessment of the achieved therapeutic effect [4, 5].
Magnetic resonance imaging (MRI) is an effective method of detecting metastatic skeletal lesions with higher sensitivity and specificity rates (90.5% and 95%, respectively) compared with scintigraphy (72.9% and 93.9%), and comparable to combined choline positron emission tomography and computed tomography ([PET-CT] 89.7% and 96%) [6–8]. The MRI potential to assess the efficiency of bone metastasis treatment has been studied long enough by using the dynamics of the MR signal size and intensity on conventional images. The advent of diffusion-weighted imaging (DWI) and whole-body MRI has led to the generation of new criteria for assessing the response to the treatment of skeletal lesions. However, no unified approach has been developed for MRI assessment of the treatment efficiency of bone metastases based on objective criteria, and data on MRI findings of the responding lesions are contradictory [9–12].
The aim was to assess the possibilities of quantitative and semi-quantitative parameters of MRI-evaluation of treatment efficacy (radiation, chemotherapy, hormone therapy, and targeted therapy) of bone metastases that were used in PC and BC clinical trials.
METHODS
This paper is written according to the PRISMA criteria (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) [13].
Eligibility criteria
inclusion criteria: Eligible papers were selected according to the Population, Intervention, Comparison, Outcomes and Study principle [14]. Patients: 18 years of age or older with histologically confirmed BC or PC and metastatic bone lesions. Intervention: MRI of both individual areas and the whole body. The MRI protocol included standard anatomical pulse sequences (T1- and T2-weighted images and STIR) and/or DWI with apparent diffusion coefficient (ADC) mapping. Comparison group: None. Outcome: Bone metastases were scanned at least one week before and 1–6 months after the start of anticancer treatment; reference assessment of the treatment response was performed by comparing MRI data using laboratory diagnostic methods (blood prostate-specific antigen level), results of instrumental studies (spiral CT, skeletal scintigraphy, and PET-CT), and histological examination with assessment of therapeutic tumor pathomorphosis. Studies: Studies in which MRI was performed before and after 1–6 months from the start of anticancer treatment. No restrictions on the type of received therapy (chemical, hormonal, targeted, and radiotherapy) were used.
Non-inclusion criteria: Patients who received surgical treatment for metastatic bone lesions.
With regard to the technical MRI developments, the following studies were selected, including: DWI and ADC assessments that were published after January 1, 2010; and standard anatomic sequences that were published after January 1, 1998.
Exclusion criteria: Papers not written in Russian or English, conference abstracts, descriptions of clinical cases, and animal studies.
Sources of information
Publications were searched and selected from Embase, PubMed, Cochrane Central Register of Controlled Trials (CENTRAL), and eLibrary electronic databases. Last search was on June 01, 2021.
Search: The search was conducted among prospective and retrospective clinical studies and randomized controlled studies using the following MeSH library terms and keywords: “Magnetic resonance imaging,” “DWI,” “treatment,” “response,” “prostate cancer,” “breast cancer,” and “bone metastasis.”
Study selection: The search and subsequent selection were conducted by two independent reviewers. Any discrepancies were resolved by the principal investigator. At the first stage, titles/proceedings/abstracts were reviewed for relevance to the review topic and the presence of necessary data. The second stage involved a full analysis of publications according to the inclusion and exclusion criteria.
Data collection: A tabular form was developed for data collection. Data was extracted by two reviewers including: title of the article, year of publication, authors, DOI, primary lesion, population, treatment, study duration, pulse sequen-ces, reference method, MR semiotics, and ADC and signal intensity values before and after treatment.
Risk of bias: The QUADAS-2 (Quality Assessment of Diagnostic Accuracy Studies) questionnaire was used to assess the risk of bias in individual studies [15]. The texts of articles were assessed according to the following criteria: patient enrollment, studied methods, reference methods, and time intervals between the study and reference methods. Certain questions from the QUADAS-2 checklist were not employed due to lack of necessity (for example, in the papers assessing the ADC, no question related to the study interpreter’s blinding was used, since the ADC is an objective assessment). Finally, a histogram was generated after analyzing each study for the risk of bias.
Statistical analysis
The method for analyzing and grouping data (random-effects or fixed-effects model) was selected according to the results of heterogeneity assessment of studies that included ADC determination, which was performed using the χ2 criterion and I2 heterogeneity index. Heterogeneity of studies was considered significant at p < 0.1 for the χ2 criterion and at I2 > 40%.
RESULTS
Study selection
The present study included 11 studies from 312 sources from Embase, PubMed, CENTRAL, and eLibrary databases (Fig. 1).
Fig. 1. PRISMA diagram of this study
At the first stage, 273 sources were selected after sorting out duplicates (31) and animal studies (8). Next, 181 publications were sorted out after assessment of proceedings and abstracts at the screening stage. After checking full-text versions of the papers for inclusion criteria, 11 sources were remained and included in this review (Table).
Table. Characteristics of studies included in the systematic review and meta-analysis
No. | Authors | Year | Nosology | Treatment | Interval between studies | Magnetic field induction, T | MRI model and manufacturer | Objective criteria |
1 | Byun et al. [5] | 2002 | BC (90%) | RT | 6 months | 1.5 | Not specified | ADC, SI (DWI) |
2 | Messiou et al. [9] | 2011 | PC | CT | 3 months | 1.5 | Avanto, Siemens | ADC |
3 | Reischauer et al. [10] | 2010 | PC | HT | 1–3 months | 1.5 | Achieva, Philips | ADC |
4 | Perez-Lopez et al. [11] | 2016 | PC | TT | 3 months | 1.5 | Avanto, Siemens | ADC, tDV |
5 | Blackledge et al. [12] | 2014 | PC, BC | CT, HT, RT, ТТ | 10–38 weeks | 1.5 | Avanto, Aera, Siemens | ADC, tDV |
6 | Sergeev et al. [16] | 2016 | BC, PC (90%) | CT, HT, RT | 2–8 months | 1.5 | Excelart, Toshiba | ADC, SI (DWI) |
7 | Çiray et al. [17] | 2001 | BC | CT, HT | 3–6 months | 0.5 | Gyroscan T5, Philips | Size |
8 | Brown et al. [18] | 1998 | BC | HT, CT, RT | 6, 9 months | 1.5 | Vision, Siemens | Size |
9 | Tombal et al. [19] | 2005 | PC | CT | 6 months | 1.5 | Intera, Philips | Size |
10 | Cappabianca et al. [20] | 2014 | PC, BC (90%) | RT | 1, 2 months | 1.5 | Symphony, Siemens, | ADC, SI (DWI) |
11 | Kotlyarov et al. [21] | 2006 | BC, PC (75%) | CT, HT, RT | 2–8 months | 0.5 | Proview Open, Philips | Size |
Note. MRI, magnetic resonance imaging; BC, breast cancer; PC, prostate cancer; CT, chemotherapy; HT, hormone therapy; RT, radiotherapy; TT, targeted therapy; ADC, apparent diffusion coefficient; SI, signal intensity; DWI, diffusion-weighted images; tDV, tumor total diffusion volume.
We included 370 patients; among these, 147 patients responded to treatment. Three sources did not provide relevant information on the number of responders [5, 16, 17]. The sample size of each of the included studies ranged from 10 to 87 patients. Seven studies included only patients with a primary lesion in the prostate or mammary gland; four studies [5, 16, 20, 21] included these localizations in 85%–95% of the entire sample. The mean age of the patients was 47–73 years.
The participants in the papers were divided into four groups according to the criteria which were used to assess the response to systemic therapy. These include size of metastatic lesions, DWI signal intensity, ADC, total tumor volume [5, 9–12, 16, 17, 20].
CT, skeletal scintigraphy, and prostate-specific antigen (in PC patients) were used as reference test [9–11, 16, 17, 20], whereas PET and biopsy were used in addition to these methods [5, 12]. Three papers did not contain data on the reference methods used [18, 19, 21].
Scanning parameters
The scanning parameters when using T1-SE-sequencing in different studies had slight differences in TR and TE values (400–600 ms and 5–16 ms, respectively). Only one paper had significantly different T1-WI parameters of 1000 ms and 3.7 ms. The number of b-factors was 2–3 with initial and highest values of 0–50 and 800–900, respectively [5, 10, 12, 13]. In one study [9], the number of b-factors was 4 (0, 50, 250, and 750), and in another study [20], it accounted for 6 (0, 50, 100, 250, 500, and 750), with obtaining higher ADC values compared with the other studies, which may result from changes in scanning parameters. The slice thickness in all studies was within 4–6 mm for both T1-WI and DWI images.
Classification of objective assessment criteria used in the literature
The first criterion for the therapeutic response of bone metastases was the change in the lesion size. Remarkably, bone lesions are recommended for measurements on T1-WI due to higher contrast, clearer contours, and less pronounced perifocal edema [6, 22]. This criterion was used in 4 of 11 selected studies.
The second criterion for response assessment was semi-quantitative determination of DWI signal intensity, which was found in 3 of these papers. Since signal intensity is not a physical quantity, its numerical value may differ with different MRI scanners and at different scanning parameters. Therefore, the signal intensity ratio in metastases to the signal intensity in muscles was used.
The third criterion for assessing the response to treatment is the change in the numerical ADC value of the lesion. This criterion has been most widely used recently, including 7 of 11 selected papers; however, ADC values depend on imaging parameters.
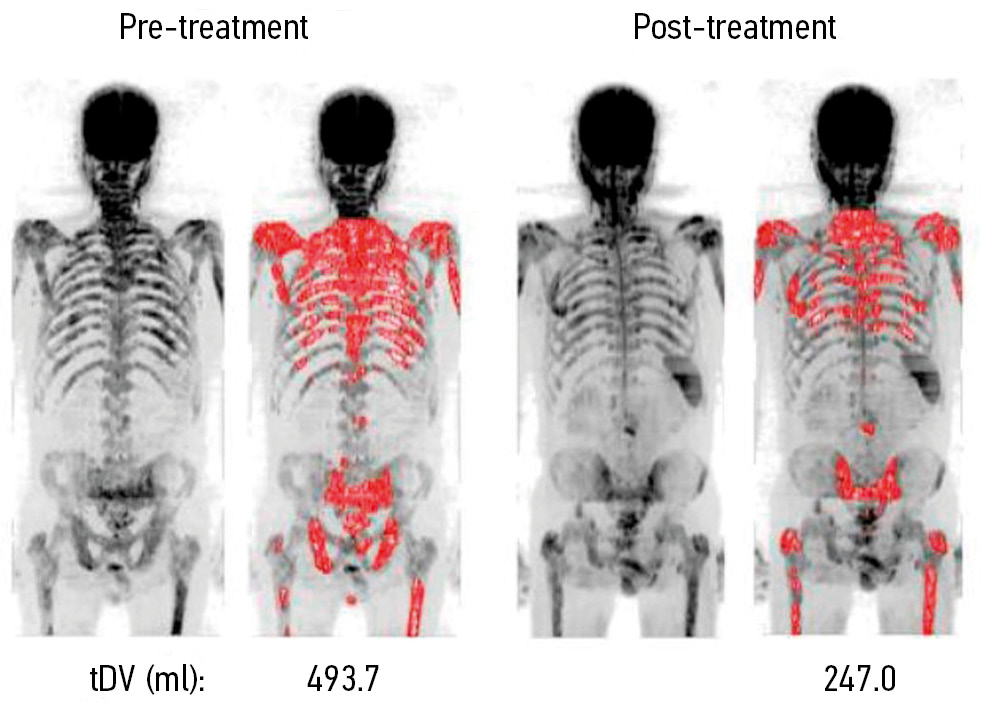
Fig. 2. Visualization and values of the total tumor volume before and after treatment in a patient with a significant response to systemic therapy
The fourth and most novel criterion is the determination of the total diffusion volume (tDV), which is automatically calculated (in mL) using the maximum DWI intensity projection with a semi-automated and manually corrected 3D-mask by counting the number of voxels in a given range of signal intensities (Fig. 2). The distribution of the number of voxels over the ADC ranges, which correspond to responding, non-responding, and doubtful lesions, represented in a histogram [11, 12, 23].
Risk of bias
The risk of bias arises from differences in anticancer therapies and the time intervals between MRI before and after treatment. According to the QUADAS-2 criteria, the main point of the risk of bias was the selection of the reference methods (Fig. 3).
Fig. 3. Risk of bias according to QUADAS-2
Five papers used different imaging techniques for different patients as a reference [5, 12], or scintigraphy was used as a single method [16, 17, 20], which is inferior in diagnostic value to MRI and lacks the necessary values of sensitivity and specificity. The reference method was completely absent in three papers [18, 19, 21], and the assessment of the response to therapy was controlled by the level of prostate-specific antigen and clinical data. MR tomographs were used with a magnetic field intensity of 0.5 T, which might be an additional source of bias [17, 18].
Assessment results of bone lesion response to systemic therapy
Size: Changes in T1-WI size were assessed in four papers [17–19, 21]; among these, three showed a significant decrease in individual responding lesions and in tumor mass index, which was obtained as a result of sum of all metastatic lesion sizes in two dimensions. Moreover, B. Tombal et al. observed complete disappearance of metastatic lesions in two cases. However, the authors repeated the study after 6 months as opposed to a 2–3 -month follow-up in other publications. On the contrary, Brown et al. reported constant sizes in 77% as opposed to an increased size in 23% of patients with responding lesions.
DWI signal intensity: Three studies contain data on DWI signal intensity changes in bone metastases as a result of systemic therapy [5, 16, 20]. In all studies, the authors came to the unequivocal conclusion that the signal intensity decreased significantly in response to treatment. However, only one presented numerical values that indicated a 35% signal intensity reduction in lesions that responded to radiotherapy [20].
ADC: The assessment and analysis of quantitative ADC values were performed in seven papers [5, 9–12, 16, 20]. Sergeev et al. did not provide data for each patient or lesion; they demonstrated a 25% overall ADC increase in response to treatment of osteoblastic lesions and a 25% decrease in osteolytic lesions. Six papers presented accurate ADC values before and after treatment [5, 9–12, 20]. All authors noted increased ADC values in response to treatment of bone metastases, as reflected by the forest plot (Fig. 4) constructed using a random-effects model, given the presence of significant heterogeneity of the results (p < 0.1 for the χ2 test and I2 > 40%).
Fig. 4. Forest plot based on the results of studies that determined the changes in the apparent diffusion coefficient values in patients with bone metastases that responded to treatment
The ADC changes after treatment averaged + 0.35 [+ 0.12; + 0.49] × 10−3 mm2/s. The range of baseline and post-therapy ADC values from all six papers is shown in Fig. 5 with mean ADC values before and after treatment, which accounted for 0.83 [0.71, 1.03] and 1.18 [0.83, 1.49] × 10−3 mm2/s, respectively. Despite partially overlapping values, the ADC was generally higher in responding patients as compared to values before treatment.
Fig. 5. Boxplot of the apparent diffusion coefficient values of bone metastases before treatment (gray) and after 1–6 months from the start of therapy (lilac), which was constructed according to the values of all included responding lesions (n = 156)
tDV: In two studies, tDV was assessed by DWI using special software [11, 12]. Mean tDV values in responding patients decreased by 59% according to Perez-Lopez et al. [11] and by 42.3% according to Blackledge et al. [12].
DISCUSSION
This systematic review demonstrates the assessment potential in the evaluation of the response to therapy of metastatic bone lesions based on the dynamics of objective criteria such as lesion size, relative DWI signal intensity, and ADC and tDV numerical values.
The relevance of this issue is due to the rapidly growing use of whole-body MRI for the primary diagnosis of bone metastases in patients with PC and BC [7, 8, 24, 25], who subsequently receive systemic therapy and radiotherapy and need to assess the treatment efficiency.
Assessment of the size of bone metastases as an objective indicator of the systemic therapy efficiency has long been used. RECIST 1.1 (Response Evaluation Criteria in Solid Tumors) criteria are most commonly used for this purpose, according to which only osteolytic and mixed lesions with a soft tissue component of at least 10 mm are considered measurable bone lesions, whereas diffuse and osteoblastic lesions are considered unmeasurable [26, 27]. Despite existing limitations, the RECIST 1.1 criteria for bone lesions are included in the MET-RADSP (METastasis Reporting and Data System for Prostate Cancer) recommendations for whole-body MRI and are used along with the ADC to assess response in metastatic PC [1, 6].
The MDA criteria were developed specifically for the bone metastasis assessment at the University of Texas MD Anderson Cancer Center to assess any type of lesions based on the dynamics of their number, size, and structural features [27]. These criteria are applicable to both radiography and computed tomography, and MRI; however, they are less common compared with RECIST 1.1.
Assessment of the dynamics of bone metastasis size on T1-WI showed a reduction in response to specific therapy [17–19, 21]. Only one study obtained data that contradicted the results of other works. Brown et al. noted an increase in responding lesions on T1-WI after 6–9 months from the start of systemic treatment [18]. In this study, all patients received systemic or local radiotherapy; of these, 17 patients received additional chemotherapy or hormone therapy. The response to therapy in these patients was assessed comprehensively using clinical, biochemical, radiological, and scintigraphic criteria. The findings might result from the treatment peculiarities that led to the formation of a pronounced and long-term persisting perifocal edema, which gives a hypointense signal on T1-WI leading to false-positive increased sizes of responding lesions according to the practical Met-RADS recommendations [6]. Thus, the dynamics of bone metastasis sizes in response to specific treatment has diagnostic value; however, the result may depend on the time of therapy, different therapeutic approaches and the nature of metastatic lesions. This indicates the necessity for supplementing this criterion with other objective data.
The dynamics of DWI signal intensity could be regarded as an objective criterion for response assessment [5, 16, 20]. The authors of all papers observed a decreased intensity of signal lesion in patients who responded to systemic therapy. However, given that numerical values are presented only in one work [20], and the nature of lesions and type of systemic therapy were not considered in all three papers, further study of the DWI signal intensity change dependence on the aforementioned conditions is necessary.
Determination of numerical ADC values has high potential as an objective assessment criterion and is one of the main ones in the Met-RADS recommendations for the whole-body MRI analysis. Data analysis from seven studies indicated a significant increase in ADC in responding patients [5, 9–12, 16, 20]. Concurrently, all the studies described single cases of ADC decrease with a good response to treatment. These cases were associated with the development of fibrosis or sclerosis in response to therapy. In addition, Messiou et al. demonstrated an increase in ADC in patients with progression; however, these values were less pronounced compared with those in responding patients. Among all seven publications, only one compared ADC values in responding patients with the lesion nature and obtained diverse changes: a 25% increase in ADC in osteoblastic lesions and a 25% decrease in osteolytic lesions [16]. Other studies did not divide lesions into osteolytic and osteoblastic types, thereby resulting in the discrepancy of ADC values in responding patients and clouding the interpretation of these results. These indicate the need for further studies with inclusion of homogeneous groups of lesions.
In studies that assessed tDV, similar results were obtained [11, 12]. They concluded that tDV decreased significantly in response to specific therapy. However, this approach has several limitations. First, these parameters were sensitive to the quality of the DWI, which may lead to tDV changes in the presence of artifacts or insufficient signal reduction by the surrounding tissues. Second, the signal above the 4th–5th cervical vertebrae was manually removed to eliminate a possibly false tDV increase from the brain, salivary glands, and large numbers of lymph nodes, leading to missed lesions in these areas. Third, this method is time-consuming due to a manual processing stage, thereby limiting its widespread use in clinical practice.
Thus, MRI offers a set of objective criteria allowing for the assessment of the efficiency of treating disseminated metastatic skeletal lesions in patients with PC and BC. However, additional studies are required to clarify the methodological aspects and quantitative values of the assessment criteria for different types of metastatic lesions in order to implement widely in clinical practice.
Study limitations
The results of this systematic review call for careful interpretation as we encountered some limitations, such as a small number of included studies, the retrospective nature of some studies, the lack of standardized reference methods, and different types of specific therapy, which may influence the microstructural changes and result in different MR characteristics of responding lesions.
In the reviewed studies and meta-analysis, scanning parameters slightly differ, in particular, different number and values of b-factors are used, which may affect the final ADC values.
CONCLUSIONS
MRI is an informative technique for objective assessment of the response to therapy of bone metastases in patients with PC and BC based on quantitative and semi-quantitative criteria. Currently, when assessing the treatment efficiency, the dynamics of lesion size in T1 mode and ADC values should be primarily analyzed as precise quantitative assessment criteria have not been developed yet. DWI-based parameters are the most promising; however, this does not exclude the use of traditional RECIST 1.1 and MDA criteria.
Thus, whole-body MRI is a potentially effective diagnostic tool for revealing and monitoring of metastatic skeletal lesions in patients with PC and BC.
ADDITIONAL INFORMATION
Funding source. This study was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. V.O. Ripp ― search and analysis of literature, interpretation of literary data and writing of text, development of work design; T.P. Berezovskaya ― development of the concept and design of the review, search and analysis of literature, text writing; S.A. Ivanov ― expert assessment and final editing of the literature review. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
About the authors
Vladislav O. Ripp
A. Tsyb Medical Radiological Research Center — branch of the National Medical Research Radiological Center of the Ministry of Health of the Russian Federation
Email: rippnba@gmail.com
ORCID iD: 0000-0001-8970-4212
Radiologist of the MRI Department
Russian Federation, 4 Korolev street, Obninsk, 249036Tatyana P. Berezovskaya
A. Tsyb Medical Radiological Research Center — branch of the National Medical Research Radiological Center of the Ministry of Health of the Russian Federation
Email: berez@mrrc.obninsk.ru
ORCID iD: 0000-0002-3549-4499
MD, Senior Research Associate, Dr. Sci. (Med.), Professor
4 Korolev street, Obninsk, 249036Sergey A. Ivanov
A. Tsyb Medical Radiological Research Center — branch of the National Medical Research Radiological Center of the Ministry of Health of the Russian Federation
Author for correspondence.
Email: oncourolog@gmail.com
ORCID iD: 0000-0001-7689-6032
MD, Dr. Sci. (Med.), Professor
Russian Federation, 4 Korolev street, Obninsk, 249036References
- Lecouvet FE, Larbi A, Pasoglou V, et al. MRI for response assessment in metastatic bone disease. Eur Radiol. 2013;23(7): 1986–1997. doi: 10.1007/s00330-013-2792-3
- Padhani AR, Makris A, Gall P, et al. Therapy monitoring of skeletal metastases with whole-body diffusion MRI. J Magn Reson Imaging. 2014;39(5):1049–1078. doi: 10.1002/jmri.24548
- Woolf DK, Padhani AR, Makris A. Assessing response to treatment of bone metastases from breast cancer: what should be the standard of care? Ann Oncol. 2015;26(6):1048–1057. doi: 10.1093/annonc/mdu558
- Padhani AR, Gogbashian A. Bony metastases: assessing response to therapy with whole-body diffusion MRI. Cancer Imaging. 2011;11(1A):S129–S145. doi: 10.1102/1470-7330.2011.9034
- Byun WM, Shin SO, Chang Y, et al. Diffusion-weighted MR imaging of metastatic disease of the spine: assessment of response to therapy. AJNR Am J Neuroradiol. 2002;23(6):906–912.
- Padhani AR, Lecouvet FE, Tunariu N, et al. METastasis reporting and data system for prostate cancer: practical guidelines for acquisition, interpretation, and reporting of whole-body magnetic resonance imaging-based evaluations of multiorgan involvement in advanced prostate cancer. Eur Urol. 2017;71(1):81–92. doi: 10.1016/j.eururo.2016.05.033
- Zugni F, Ruju F, Pricolo P, et al. The added value of whole-body magnetic resonance imaging in the management of patients with advanced breast cancer. PLoS One. 2018;13(10):e0205251. doi: 10.1371/journal.pone.0205251
- Yang HL, Liu T, Wang XM, et al. Diagnosis of bone metastases: a meta-analysis comparing ¹⁸FDG PET, CT, MRI and bone scintigraphy. Eur Radiol. 2011;21(12):2604–2617. doi: 10.1007/s00330-011-2221-4
- Messiou C, Collins DJ, Giles S, et al. Assessing response in bone metastases in prostate cancer with diffusion weighted MRI. Eur Radiol. 2011;21(10):2169–2177. doi: 10.1007/s00330-011-2173-8
- Reischauer C, Froehlich JM, Koh DM, et al. Bone metastases from prostate cancer: assessing treatment response by using diffusion-weighted imaging and functional diffusion maps ― initial observations. Radiology. 2010;257(2):523–531. doi: 10.1148/radiol.10092469
- Perez-Lopez R, Mateo J, Mossop H, et al. Diffusion-weighted imaging as a treatment response biomarker for evaluating bone metastases in prostate cancer: a pilot study. Radiology. 2017;283(1):168–177. doi: 10.1148/radiol.2016160646
- Blackledge MD, Collins DJ, Tunariu N, et al. Assessment of treatment response by total tumor volume and global apparent diffusion coefficient using diffusion-weighted MRI in patients with metastatic bone disease: a feasibility study. PLoS One. 2014; 9(4):e91779. doi: 10.1371/journal.pone.0091779
- Liberati A, Altman DG, Tetzlaff J, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. PLoS Med. 2009;6(7):e1000100. doi: 10.1371/journal.pmed.1000100
- Amir-Behghadami M, Janati A. Population, Intervention, Comparison, Outcomes and Study (PICOS) design as a framework to formulate eligibility criteria in systematic reviews. Emerg Med J. 2020;37(6):387. doi: 10.1136/emermed-2020-209567
- Whiting PF. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011;155(8): 529–536. doi: 10.7326/0003-4819-155-8-201110180-00009
- Sergeev NI, Kotlyarov PM, Solodkii VA. Diffusion-weighted magnetic resonance imaging in the assessment of chemoradiation treatment of metastatic lesions of bone structures. Bulletin of the Russian Scientific Center of Radiology of the Ministry of Health of the Russian Federation. 2016;16(3):2. (In Russ).
- Çiray I, Lindman H, Åström KGO, et al. Early response of breast cancer bone metastases to chemotherapy evaluated with mr imaging. Acta Radiologica. 2001;42(2):198–206. doi: 10.1080/028418501127346503
- Brown AL, Middleton G, Macvicar AD, et al. T1-weighted magnetic resonance imaging in breast cancer vertebral metastases: Changes on treatment and correlation with response to therapy. Clin Radiol. 1998;53(7):493–501. doi: 10.1016/s0009-9260(98)80168-2
- Tombal B, Rezazadeh A, Therasse P, et al. Magnetic resonance imaging of the axial skeleton enables objective measurement of tumor response on prostate cancer bone metastases. Prostate. 2005;65(2):178–187. doi: 10.1002/pros.20280
- Cappabianca S, Capasso R, Urraro F, et al. Assessing response to radiation therapy treatment of bone metastases: short-term followup of radiation therapy treatment of bone metastases with diffusion-weighted magnetic resonance imaging. J Radiotherapy. 2014. doi: 10.1155/2014/698127
- Kotlyarov PM, Sergeev NI, Fedina ON. MRI in the diagnosis of metastatic lesions of the skeleton and in assessing the effectiveness of treatment. Radiology Practice. 2006;6:10–15.
- Lecouvet FE, Talbot JN, Messiou C, et al. Monitoring the response of bone metastases to treatment with Magnetic Resonance Imaging and nuclear medicine techniques: A review and position statement by the European Organisation for Research and Treatment of Cancer imaging group. Eur J Cancer. 2014;50(15):2519–2531. doi: 10.1016/j.ejca.2014.07.002
- Grimm R, Padhani AR. Whole-body diffusion-weighted MR image analysis with syngo.via frontier MR total tumor. Magn Flash. 2017;68(2):73–75.
- Jambor I, Kuisma A, Ramadan S, et al. Prospective evaluation of planar bone scintigraphy, SPECT, SPECT/CT, 18F-NaF PET/CT and whole body 1.5T MRI, including DWI, for the detection of bone metastases in high risk breast and prostate cancer patients: SKELETA clinical trial. Acta Oncol. 2016;55(1):59–67. doi: 10.3109/0284186X.2015.1027411
- Heusner TA, Kuemmel S, Koeninger A, et al. Diagnostic value of diffusion-weighted magnetic resonance imaging (DWI) compared to FDG PET/CT for whole-body breast cancer staging. Eur J Nucl Med Mol Imaging. 2010;37(6):1077–1086. doi: 10.1007/s00259-010-1399-z
- Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45(2):228–247. doi: 10.1016/j.ejca.2008.10.026
- Costelloe CM, Chuang HH, Madewell JE, et al. Cancer response criteria and bone metastases: RECIST 1.1, MDA and PERCIST. J Cancer. 2010;1:80–92. doi: 10.7150/jca.1.80
Supplementary files