Традиционные и инновационные методы визуализации при раке мочевого пузыря: технология выполнения и применение
- Авторы: Masino F.1, Eusebi L.2, Muscatella G.1, Montatore M.1, Sortino G.2, Giannubilo W.3, Guglielmi G.1,4,5
-
Учреждения:
- Foggia University School of Medicine
- Carlo Urbani Hospital
- Civitanova Marche Hospital
- Dimiccoli Hospital
- IRCCS Casa Sollievo della Sofferenza Hospital
- Выпуск: Том 5, № 2 (2024)
- Страницы: 318-333
- Раздел: Обзоры
- Статья получена: 27.11.2023
- Статья одобрена: 06.02.2024
- Статья опубликована: 20.09.2024
- URL: https://jdigitaldiagnostics.com/DD/article/view/623889
- DOI: https://doi.org/10.17816/DD623889
- ID: 623889
Цитировать
Аннотация
В статье описаны современные методы визуализации при оценке рака мочевого пузыря с учётом традиционных технологий (ультразвуковое исследование, компьютерно-томографическая урография и магнитно-резонансная томография), а также новых технологий, таких как ультразвуковое исследование с контрастным усилением и двухэнергетическая компьютерная томография.
В начале статьи представлены общие данные об анатомии мочевого пузыря для понимания его нормального внешнего вида при визуализации, а также основные особенности рака мочевого пузыря с учётом эпидемиологии, клинической картины, классификации и лечения. Затем обсуждается роль каждого метода визуализации с объяснением техники выполнения процедуры и применения в оценке рака мочевого пузыря.
Визуализация играет важнейшую роль в выявлении и стадировании рака мочевого пузыря. В частности, в последнее время возрастает роль магнитно-резонансной томографии, которая, дополняя результаты компьютерно-томографической урографии и ультразвукового исследования, позволяет дифференцировать мышечно-инвазивный рак мочевого пузыря от немышечно-инвазивного с помощью системы отчётности и данных о визуализации (VI-RADS). Ультразвуковое исследование с контрастным усилением и двухэнергетическая компьютерная томография — новые методы визуализации, которые обладают особыми преимуществами и обеспечивают правильный подход к пациенту с онкологическими заболеваниями. В конце обзора представлены комбинированные методы визуализации, включающие позитронно-эмиссионную томографию, совмещённую с компьютерной или магнитно-резонансной томографией, которые также перспективны при стадировании рака мочевого пузыря.
Полный текст
АНАТОМИЯ МОЧЕВОГО ПУЗЫРЯ
Мочевой пузырь — расположенный в малом тазу полый мышечный орган, который служит резервуаром для мочи и обеспечивает её отток. Этот легко деформируемый орган находится в полости таза, позади лобкового симфиза, под париетальной брюшиной. Размер и форма мочевого пузыря меняются в зависимости от количества мочи, которое он вмещает (общий объём до 500 мл), и давления, оказываемого другими органами. В частности, в наполненном состоянии мочевой пузырь приобретает круглую или овальную форму [1].
Анатомическое строение мочевого пузыря сложное. Макроскопически он делится на четыре части: верхушку или купол (обращённые вперёд и вверх), тело, дно и шейку (расположенную ниже). Дно мочевого пузыря имеет три отверстия, образуя тригон. Два отверстия принадлежат мочеточникам, которые в косом направлении проходят через стенки мочевого пузыря. Третье отверстие — уретральное — расположено у шейки мочевого пузыря, точно у нижнего угла тригона. Через него моча выводится из мочевого пузыря [2, 3].
Микроскопически мочевой пузырь имеет слоистую структуру, подобную мочеточникам. Внутренняя выстилка состоит из переходного эпителия, известного как уротелий, образованного несколькими слоями клеток. В расслабленном состоянии толщина уротелия составляет 5–7 слоёв клеток, однако он может растягиваться, чтобы вместить больший объём мочи. Под уротелием располагается собственная пластинка или подслизистая оболочка, которая представляет собой подэпителиальную соединительную ткань, содержащую мышечные волокна с различным расположением. Далее следует мышечный слой, который состоит из детрузора (мышцы, включающей внутренний продольный, средний циркулярный и наружный продольный слои). Эта гладкая мышца отвечает за сокращение и выведение мочи из мочевого пузыря. Стенки мочевого пузыря покрыты серозой — тонким соединительнотканным слоем, который сообщается с забрюшинным пространством и содержит кровеносные сосуды. В местах, где нет серозы, мочевой пузырь покрывает адвентиция — слой рыхлой соединительной ткани [4, 5].
РАК МОЧЕВОГО ПУЗЫРЯ
Рак мочевого пузыря (РМП) — агрессивная злокачественная опухоль, распространённая во всём мире, вторичная по отношению к раку предстательной железы и рассматриваемая как опухоль мочеполовой системы [6]. Международное агентство по изучению рака документально подтвердило, что с РМП связаны следующие факторы риска: табакокурение, определённые профессиональные воздействия (такие, как производство алюминия и резины, малярные работы, пожаротушение), воздействие различных красителей (например, фуксина и аурамина) или промежуточных продуктов для красителей (например, 4-аминобифенила). На развитие РМП влияют и факторы окружающей среды, включая рентгеновское излучение, гамма-излучение и мышьяк, а также специфические лекарства (циклофосфамид), употребление опия, а также инфекция, вызываемая трематодами рода Schistosoma. Другие факторы риска, в частности, элементы рациона питания, нарушения кишечной флоры, взаимодействие «ген–среда», воздействие выхлопных газов дизельных двигателей и лучевая терапия тазовых органов, также связаны с развитием РМП [7].
Наиболее частый признак РМП — бессимптомная макро- или микрогематурия, известная как «безболевая гематурия», которая встречается примерно у 85% пациентов. Чтобы определить происхождение кровотечения, гематурия должна быть тщательно охарактеризована как начальная, конечная и полная [8]. Другие частые симптомы РМП связаны с раздражительностью мочевого пузыря (частота мочеиспускания, ургентность и дизурия). При обструкции мочеточника появляется боль в боку. Менее распространённые симптомы — отёк нижних конечностей и пальпируемые образования в области таза. В запущенных случаях у пациентов наблюдается потеря массы тела и боли в животе или костях из-за отдалённых метастазов [9, 10].
Уротелиальная карцинома (УК) — наиболее распространённый подтип РМП, за которым следуют плоскоклеточная карцинома, саркома, лимфома и аденокарцинома. Две трети всех случаев составляют немышечно-инвазивный РМП, одна треть — мышечно-инвазивные РМП, которые связаны с повышенным риском метастазирования и значительно худшим прогнозом [7]. Морфология РМП может меняться в зависимости от роста и прогрессии опухоли. Например, горизонтальный рост характерен для карциномы in situ (CIS), тогда как экзофитные полипоидные образования или сидячие инфильтративные поражения типичны для инвазивных форм [6, 8].
РМП стадируется по стандартной системе классификации злокачественных опухолей TNM. Как и в случае с другими полыми органами, символом T фиксируется глубина инвазии слоёв мочевого пузыря. В частности, pTa относится к папиллярной карциноме (тип немышечно-инвазивного РМП), которая проявляется в виде экзофитного массового поражения, pTis — к плоскому CIS (немышечно-инвазивный РМП). На стадии Т1 опухоль поражает собственную пластинку и обычно лечится трансуретральной резекцией и адъювантной внутрипузырной химиотерапией. На стадии Т2 опухоль проникает в мышцу детрузора (тип мышечно-инвазивного РМП), на стадии Т3 — в перивезикальную жировую клетчатку, на стадии Т4 поражает окружающие органы. Опухоли стадии Т2 и выше требуют более агрессивного лечения, например, радикальной цистэктомии [11].
Символом N обозначается поражение лимфатических узлов. На стадиях N1 и N2 наблюдается вовлечение одного или нескольких узлов в малом тазу соответственно. На стадии N3 метастазы достигают общего подвздошного лимфатического узла.
Стадия M1 указывает на наличие метастазов: отсутствие поражения регионарных лимфатических узлов (M1a) и наличие других отдалённых метастазов (M1b) [5, 12].
МЕТОДЫ ВИЗУАЛИЗАЦИИ
Методы визуализации, включая ультразвуковое исследование (УЗИ), компьютерно-томографическую урографию (КТУ) и магнитно-резонансную томографию (МРТ), играют важную роль в диагностике и стадировании РМП. Эти методы имеют решающее значение для выявления РМП и дифференциации между опухолями Т1 и Т2, поскольку тактика лечения пациентов на этих двух стадиях значительно разнится [13].
Чувствительность обнаружения РМП увеличивается от УЗИ к КТУ, достигая очень высокого показателя при МРТ. Последний метод находит всё более широкое применение, поскольку он необходим для дифференциации между немышечно-инвазивным и мышечно-инвазивным РМП.
Согласно международным рекомендациям, первым шагом в диагностике подозрительной опухоли, как и в случае безболевой гематурии, должно быть УЗИ, не исключая физикального обследования, а для постановки окончательного диагноза требуется цистоскопия и последующая биопсия [8].
Радионуклидная диагностика, включая позитронно-эмиссионную томографию (ПЭТ), совмещённую с компьютерной (ПЭТ/КТ) и магнитно-резонансной (ПЭТ/МРТ) томографией, также перспективна при стадировании РМП, особенно при выявлении поражённых лимфатических узлов и отдалённых метастазов. Гибридные методы визуализации обладают большей точностью, чем традиционная КТ.
Данный обзор также включает такие методы визуализации, как двухэнергетическая компьютерная томография (ДЭКТ) и ультразвуковое исследование с контрастным усилением (УЗИ+КУ), которые не включаются в протокол стандартного обследования, но могут быть полезны в определённых случаях.
Ультразвуковое исследование
Техника выполнения
Перед исследованием пациент должен выпить 300–500 мл воды, что обеспечит адекватное растяжение и наполнение мочевого пузыря. При недостаточном растяжении оценка состояния стенок мочевого пузыря будет затруднена, поскольку их утолщение или очаговое образование могут быть переоценены, а чрезмерное растяжение, напротив, может вызвать дискомфорт у пациента и снизить уровень сотрудничества между пациентом и врачом.
Чаще всего выполняется трансабдоминальное УЗИ, о котором и пойдёт речь в данном обзоре. У женщин для улучшения пространственного разрешения при необходимости выполняется трансвагинальное УЗИ, у мужчин при ограниченности трансабдоминального подхода — трансректальное УЗИ. Исследование проводится в положении пациента лёжа на спине, при необходимости — в положении лёжа на боку.
УЗИ рекомендуется проводить выпуклым датчиком (4,5–6 МГц) и предварительно настроить его на исследование брюшной полости/почек. Для правильной оценки органа датчик должен располагаться чуть выше лобкового симфиза и под углом в каудальном направлении. Сканирование должно проводиться в двух ортогональных плоскостях, в косой проекции. Таким образом, во время исследования мочевой пузырь всегда будет находиться в центре поля зрения.
Стенка мочевого пузыря выглядит слоистой, с гипоэхогенной мышцей между двумя гиперэхогенными слоями, соответствующими серозе и слизистой оболочке. Боковые и задние стенки хорошо визуализируются на УЗИ, а на переднюю стенку влияют реверберационные явления, которые можно регулировать с помощью компенсации усиления по времени. Для выборочного исследования передней стенки и купола мочевого пузыря можно использовать высокочастотный линейный датчик (>7,5 МГц). Для оценки мочеточникового выброса (нормальный и периодический отток мочи из мочеточника в мочевой пузырь) необходимо провести цветную допплерографию тригона со стороны задней стенки, чтобы исключить полную обструкцию мочеточника.
УЗИ позволяет оценить ёмкость мочевого пузыря и объём остаточной мочи. Объём мочи оценивается путём снятия трёх измерений в двух ортогональных плоскостях и применения автоматизированной формулы, включающей поправочный коэффициент (k), который учитывает сложную форму мочевого пузыря [11, 14].
Применение
На результативность трансабдоминального УЗИ влияют различные факторы, включая степень наполнения пузыря, телосложение пациента, размер и распространение опухоли, а также предшествующее лечение (радиотерапевтическое, химиотерапевтическое или хирургическое) [13]. Чувствительность УЗИ составляет 63%, но может снижаться при гипертрофии простаты, часто указывая на неровность стенок дна мочевого пузыря. И напротив, чувствительность может увеличиваться по сравнению с цистоскопией в случае локализации опухоли в дивертикуле, поскольку оценка узкой шейки мочевого пузыря при цистоскопии затруднительна [14].
Как правило, РМП легко обнаруживается в случае локализации на боковых и задних стенках мочевого пузыря. Так, зачастую УК локализуется на задних стенках и имеет большие размеры, что является наиболее важным фактором, влияющим на диагностическую чувствительность УЗИ. Опухоли могут быть обнаружены только в том случае, если их максимальный диаметр составляет более 5 мм. Опухоль большего размера часто ассоциируется с другими признаками, такими как ригидность стенок и асимметричное растяжение мочевого пузыря. Место возникновения опухоли — менее важный фактор, влияющий на чувствительность, хотя некоторые области (купол, передняя стенка и дно мочевого пузыря) сложнее оценить по техническим причинам [11].
Образования в мочевом пузыре обычно эхогенны, имеют неправильную форму, например, напоминающую цветную капусту, и обнаруживаются либо на стенке мочевого пузыря, либо в участках стенок с неравномерно увеличенной толщиной. Однако при УЗИ признаки РМП могут отличаться в зависимости от морфологии опухоли и проявляться как папиллярные, инфильтрирующие или инвазивные, либо иметь смешанные признаки папиллярных и инфильтрирующих образований. Папиллярные формы выглядят как небольшие эхогенные образования, исходящие из стенки мочевого пузыря и выступающие в его просвет, которые легко обнаруживаются при размере более 2–3 мм. И наоборот, если опухоль является поверхностной карциномой, её можно распознать только по утолщению мягких тканей стенки, которая имеет нормальную эхоструктуру без признаков инвазии. Инфильтрирующие опухоли имеют типичные мелкие папиллярные элементы. Они отличаются гипоэхогенностью, в отличие от эхогенных стенок пузыря и перивезикальной жировой клетчатки [11, 13, 14].
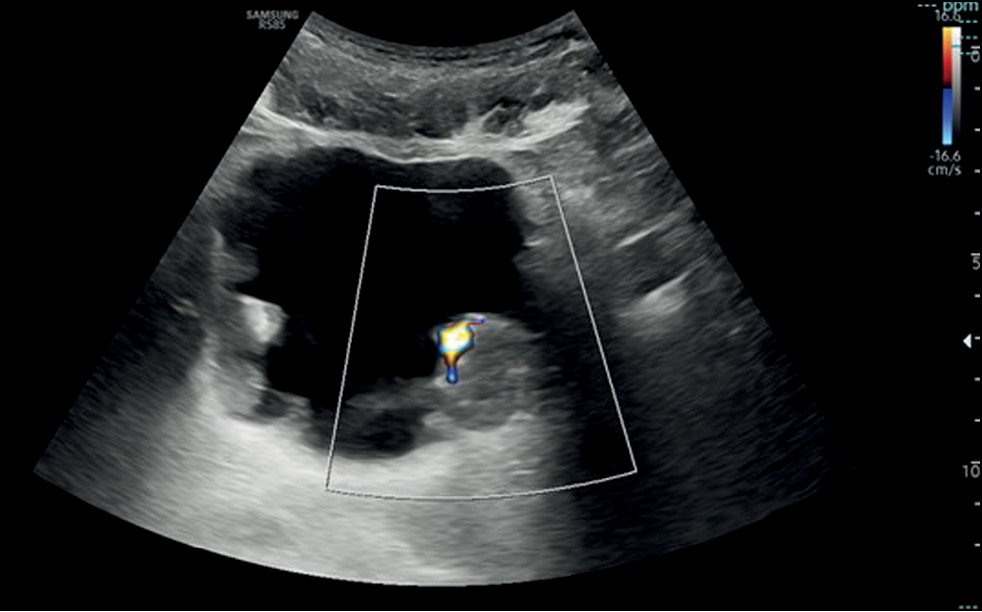
При обнаружении очагового образования на ультразвуковом изображении необходимо проверить наличие дополнительных поражений, поскольку одна треть опухолей, как правило, мультифокальна. Кроме того, необходимо провести дополнительную оценку с помощью допплерографии, которая помогает выявить внутренние сосуды с выраженным сигналом кровотока или звёздчатой морфологией и дифференцировать потенциальную опухоль от тромба. Последний вариант можно исключить, попросив пациента изменить положение с лежачего на боковое, чтобы оценить подвижность поражения, характерную для тромба, или провести орошение мочевого пузыря и затем повторить УЗИ [11] (рис. 1).
Рис. 1. Ультразвуковое изображение мочевого пузыря в поперечном срезе показывает диффузное неравномерное утолщение стенки с множественными образованиями и эндолюминальным развитием. Цветная допплерография самого крупного эхогенного образования, локализованного на задней стенке мочевого пузыря слева, выявила васкуляризацию внутри опухоли.
Ультразвуковое исследование с контрастным усилением
Техника выполнения
УЗИ+КУ — новая технология, которая объективно отображает перфузию тканей с помощью ультразвукового контрастного вещества (УКВ). При обычном УЗИ мочевой пузырь должен быть умеренно растянут. Изначально перед проведением УЗИ+КУ необходимо провести полное базовое УЗИ. Наиболее часто используемое УКВ — гексафторид серы (SonoVue; Bracco, Италия), который представляет собой трассирующее вещество, не выходящее за пределы кровеносного сосуда, и может использоваться для динамической визуализации перфузии микроциркуляции крови в режиме реального времени. Это вещество вводится внутривенно в объёме 2,4 мл с помощью периферической канюли 21-G, после чего вводится около 5 мл физиологического раствора. УКВ остаётся в крови в течение периода, достаточного для достижения целевого органа и обеспечения адекватной интерпретации артериальной и венозной фаз. Исследование проводится в базальном В-режиме с низким механическим индексом, чтобы снизить частоту разрыва микропузырьков.
Нормально растянутый мочевой пузырь имеет тонкую стенку около 2 мм, с незначительным сигналом кругового дихроизма, и практически незаметен в начальной фазе введения контрастного вещества. Усиление сигнала происходит постепенно примерно в течение 2 мин [15].
Применение
В основе УЗИ+КУ лежит биологический принцип, согласно которому опухоли характеризуются выраженной неоваскуляризацией, что приводит к изменению времени вымывания и введения контрастного вещества по сравнению с неопухолевыми состояниями. Ключевое преимущество УЗИ+КУ — возможность проведения исследования в режиме реального времени. В отличие от КТ или МРТ, где необходимо точно определять оптимальное время получения изображения для лучшей дифференциации опухолей от окружающей стенки мочевого пузыря, при УЗИ+КУ нет такой необходимости, поскольку картина усиления может варьировать у разных пациентов из-за таких факторов, как состояние сердечно-сосудистой системы или степень микроваскуляризации при РМП. С помощью УЗИ+КУ можно непрерывно проводить динамическую оценку усиления в режиме реального времени.
Более того, длительное контрастное усиление при РМП позволяет всесторонне исследовать стенки мочевого пузыря с помощью всего одной дозы УКВ, что делает его полезным для выявления множественных очагов при мультицентрическом раке. При артериальной неоваскуляризации, являющейся общей особенностью РМП, усиление сигнала в папиллярных и сидячих опухолях или небольших очаговых утолщениях становится заметным сразу. Этот процесс аналогичен тому, который наблюдается в артериальной фазе уротомографии. Усиление сигнала, как правило, происходит равномерно, за исключением более обширных, высокозлокачественных инвазивных опухолей. В таких случаях усиление сигнала может быть неоднородным, особенно в некротических участках опухоли [16].
После быстрой артериальной фазы и накопления УКВ происходит медленное его вымывание в большинстве опухолей, хотя в венозную фазу этот процесс может варьировать в зависимости от размера опухоли и клеточной дифференцировки. УЗИ+КУ полезно для дифференциальной диагностики, позволяя отличить неопластические образования от других патологий стенки мочевого пузыря, которые могут имитировать опухоли. Это могут быть внутрипузырные сгустки, адгезивный литиаз, доброкачественное утолщение, связанное с гипертрофией предстательной железы, или утолщение стенки мочевого пузыря, вызванное воспалительными процессами. Усиление контраста в очаговом поражении или лимфатических узлах указывает на неоплазию.
Диагностика РМП с помощью УЗИ+КУ основана на выявлении участков очагового утолщения стенок мочевого пузыря или объёмных образований, выступающих в его просвет. Использование контрастного вещества при УЗИ повышает эффективность выявления РМП, особенно в тех случаях, когда традиционное УЗИ может быть недостаточно результативным из-за таких факторов, как недостаточное растяжение мочевого пузыря, операции на мочевом пузыре в анамнезе, ожирение или наличие внутрипузырного катетера.
Глубина поражения стенок мочевого пузыря, гистологическая степень злокачественности и распространение опухоли за пределы мочевого пузыря — основные факторы, определяющие прогноз и тактику лечения РМП. Хотя МРТ и КТ являются предпочтительными методами визуализации для локального стадирования, УЗИ+КУ может помочь в оценке поражения стенок мочевого пузыря путём изучения картины контрастного усиления в этой области. Этот метод позволяет отличить неинвазивную УК от инфильтрирующей карциномы на основании наличия или отсутствия гипоэхогенного слоя и картины усиления после артериальной фазы [15].
Злокачественные опухоли мочевого пузыря отличаются от доброкачественных по характеру усиления контраста, что делает УЗИ+КУ ценным инструментом для их дифференциации и повышения точности диагностики. УЗИ+КУ позволяет в режиме реального времени наблюдать кровоток в опухолях мочевого пузыря. Однако по сравнению с КТ и МРТ его польза в стадировании инфильтрирующих карцином ограничена, поскольку этот метод не позволяет оценить инфильтрацию перивезикальной жировой клетчатки и забрюшинных лимфатических узлов (рис. 2) [16].
Рис. 2. Ультразвуковые изображения в сагиттальной проекции с контрастным усилением показывают объёмное образование в стенке мочевого пузыря слева, плохо определяемое в В-режиме, как видно на снимке с левой стороны.
Компьютерно-томографическая урография
Техника выполнения
КТУ — КТ-исследование мочевыводящих путей, которое представляет собой нативное сканирование. После внутривенного введения контрастного вещества проводится многофазное сканирование с целью получения набора изображений, на которых видны полностью затенённая и расширенная внутрипочечная собирательная система, мочеточники и мочевой пузырь [17]. Кроме того, протокол КТУ включает также нативное сканирование органов брюшной полости и таза. После внутривенного введения контрастного вещества различают следующие фазы усиления: кортико-медуллярная фаза наступает через 30–40 с после введения УКВ, что приводит к артериальной фазе, затем через 100 с наступает нефрографическая фаза, и через 8–12 мин — экскреторная фаза.
Однако основным ограничением многофазного протокола исследования является высокая лучевая нагрузка, составляющая от 25 до 35 мЗв. По этой причине молодым пациентам, в частности, предлагается раздельное болюсное введение контрастного вещества (сплит-болюс), который включает двухфазный протокол с неинтенсивным сканированием, за которым следуют две внутривенные инъекции контрастного вещества объёмом примерно 80 и 40 мл. После первого введения через 20 с выполняется кортико-медуллярное сканирование. После 8-минутной задержки вводится вторая порция УКВ, затем через 100 с выполняется сканирование для получения экскреторной фазы. Сканирование должно проводиться в краниокаудальном направлении, а расширение по оси Z должно начинаться от диафрагмального купола и достигать лобкового симфиза мочевого пузыря, особенно при сканировании без контрастного усиления и нефрографии, тогда как кортико-медуллярная фаза усиления может начинаться от верхнего полюса почки [18].
Оба протокола могут быть дополнены внутривенным введением 10 мг фуросемида за 2–3 мин до кортико-медуллярного сканирования, чтобы добиться адекватного растяжения верхних мочевых путей и мочевого пузыря. Недостаточно растянутый мочевой пузырь может выглядеть утолщённым, особенно по передней стенке, а в его просвете может наблюдаться неполное смешивание незатенённой мочи и контрастного вещества, что приведёт к повышению уровня контрастности мочи, поскольку её удельный вес выше, чем удельный вес контрастного вещества [17].
Применение
КТУ брюшной полости — наиболее часто используемый метод благодаря его многочисленным преимуществам, таким как широкая доступность, быстрое сканирование и создание мультипланарных трёхмерных реконструированных изображений с возможностью постпроцессинговой обработки. У пациентов с подозрением на РМП или с уже установленным диагнозом КТУ проводится для выявления и стадирования рака, а именно для оценки локорегионарного и отдалённого распространения опухоли.
Каждый этап протокола КТУ имеет свои преимущества. КТ без усиления используется для измерения базального ослабления сигнала в области опухоли, чтобы затем сравнить его с сигналом после контрастного усиления и определить наличие камней, кальцификатов, кровоизлияний и тромбов. Кортико-медуллярная фаза используется для оценки предполагаемых сосудистых аномалий или артериального усиления. Нефрографическая фаза позволяет обнаружить и охарактеризовать почечные образования. Экскреторная фаза используется для оценки уротелия, поскольку при заполнении мочевого пузыря плотным контрастным веществом эндолюминальное поражение мягких тканей будет выглядеть как дефект заполнения [19].
РМП может проявляться как очаговое утолщение стенки мочевого пузыря или как образование, выступающее в просвет мочевого пузыря либо же распространяющееся на соседние ткани в запущенных случаях. Если растяжение мочевого пузыря недостаточное, необходимо исследовать асимметрию утолщения. Как правило, новообразования характеризуются ослаблением сигнала в мягких тканях и могут быть покрыты мелкими кальцификатами.
КТУ обладает наивысшей точностью. Так, при выявлении и стадировании РМП объединённая чувствительность составляет 92%, объединённая специфичность — 95%. Т-стадия не позволяет отличить немышечно-инвазивный РМП от мышечно-инвазивного, но позволяет различать опухоли Т3 и Т4. Стадия N свидетельствует о морфологии и размере лимфатических узлов. Подозрение на злокачественность возникает, если размер тазовых, брюшных и забрюшинных лимфатических узлов превышает 8–10 мм по короткой оси. Что касается морфологического критерия, то наличие сливающихся лимфатических узлов или узлов с некротическим центром считается явным признаком метастазирования. При исследовании лимфатических узлов для КТУ характерна как переоценка, так и недооценка серьёзности заболевания. Переоценка происходит примерно в 30% случаев при реактивных лимфаденопатиях, когда размер лимфатических узлов превышает 10 мм по короткой оси. Недооценка возможна в том случае, если лимфатические узлы злокачественны, но имеют размеры в пределах нормы. Что касается М-стадии, то РМП чаще всего метастазирует в тазовые и забрюшинные лимфоузлы. Наиболее частая локализация отдалённых метастазов при РМП — кости. Большинство поражений кости выглядят склеротическими, но могут быть также литическими или смешанными литико-склеротическими. В солидных органах метастазы обнаруживаются наиболее часто в печени и лёгких, другие органы поражаются гораздо реже [11].
После проведения диагностических процедур в случае выявления подозрительных образований, требующих дальнейшего обследования, может быть назначена эндоскопия + биопсия для подтверждения диагноза и определения количества, степени и локализации уротелиальных опухолей [18].
Двухэнергетическая компьютерная томография
Техника выполнения
ДЭКТ — это новая технология визуализации, в которой используются два типа рентгеновских лучей и две рентгеновские трубки с разным напряжением (низкого и высокого энергетического уровня). Изображения ДЭКТ могут подвергаться вторичной реконструкции в процессе постобработки.
Учитывая цель исследования, а именно выявление РМП или его стадирование, наиболее полезными типами изображений будут виртуальные монохроматические (VMC) и виртуальные неконтрастные изображения (VNC), а также йодная и атомная карта.
VMC-изображения сходны по качеству с изображениями, получаемыми при обычной одноэнергетической КТ, однако позволяют получить более достоверные значения ослабления сигнала. Более низкое напряжение может повысить контрастность близлежащих структур благодаря высокому ослаблению сигнала при поглощении йодом. Следовательно, в таком случае легче распознать поражение париетальной области. При более высоком напряжении уменьшается чувствительность к шуму и артефактам от металлических конструкций. Сравнение двух различных режимов на основе VMC-изображений позволяет построить спектральную кривую ослабления сигнала, которая является функцией энергии. Последней приписываются свойства, которые полезны для улучшения характеристик поражения.
VNC-изображения — это бесконтрастные изображения, на которых подавляется поглощение йода, наблюдаемое на сканах, полученных после контрастирования. VNC-изображения также известны как изображения без йода. В этом случае степень облучения будет более низкой, поскольку пациент не подвергается предварительному сканированию.
Йодная карта — это материал-специфическое изображение, где отображаются все области с поглощением йода, в отличие от изображений с вычитанием йода. Это цветная карта, которая позволяет количественно оценить поглощение йода, выразив его в мг/мл. Более того, йодная карта позволяет отличить васкуляризированное поражение от неоваскуляризированного, исходя из количества йода, заполняющего аорту.
Оценка эффективных атомных чисел — это количественный метод дифференциации материалов и определения коэффициентов ослабления излучения в зависимости от его типа [3].
Применение
ДЭКТ помогает преодолеть основные недостатки КТ, такие как переоблучение ионизирующим излучением, характерное для пациентов с онкологическими заболеваниями, которые подвергаются многократным исследованиям и плотному наблюдению.
Кроме того, ДЭКТ позволяет лучше охарактеризовать очаг поражения благодаря постпроцессинговой обработке изображений.
VNC-снимки обеспечивают истинное бесконтрастное изображение, позволяя исключить наличие камней, кальцификатов и свежего кровотечения. Последнее выглядит гиперденсивным при типичном базальном сканировании и при измерении референсного значения ослабления сигнала для последующих постконтрастных сканирований.
Спектральная кривая в случае утолщения стенки мочевого пузыря имеет тенденцию к увеличению от более низких значений напряжения.
VMC-изображения, полученные при низком напряжении, обеспечивают лучший контраст опухоли по сравнению с близлежащими структурами и обладают повышенной чувствительностью при обнаружении опухоли. Более того, при нормализации количественного содержания йода по отношению к аорте в нефрографической фазе этот тип изображения показывает повышенную специфичность при достижении порогового значения ≥3,0 мг/ мл и позволяет отличить васкуляризированное поражение от неваскуляризированного с помощью следующей формулы: |I| нормализация = |I| очаг поражения/|I| аорта [20, 21].
Преимущества ДЭКТ также касаются стадирования РМП, поскольку йодные карты позволяют быстрее обнаружить инфильтрацию стенки мочевого пузыря, в том числе мышечного слоя при дифференциации между немышечно-инвазивным и мышечно-инвазивным РМП, а также оценить поражение лимфатических узлов и наличие метастазов.
Применение этой технологии может иметь решающее значение при выборе тактики лечения, поскольку она позволяет лучше оценить взаимосвязь между опухолью и сосудистой структурой, при этом повышенный контраст, полученный с помощью VMC-изображений при более низком напряжении, является важным параметром (рис. 3 и рис. 4) [22].
Рис. 3. Мультипланарные изображения йодной карты, показывающие различное ослабление сигнала в мультифокальных образованиях, основное из которых локализовано на левой задней стенке. Средние значения в очагах поражения отличаются от эндолюминальных значений. Спектральная кривая (вверху слева) позволила идентифицировать материалы, где каждый из них имеет свою кривую затухания.
Рис. 4. Мультипланарные изображения цветной йодной карты, показывающие различное ослабление сигнала в мультифокальных образованиях, основное из которых локализовано на левой задней стенке. Средние значения в очагах поражения отличаются от эндолюминальных значений. Спектральная кривая (вверху слева) позволила идентифицировать материалы, где каждый из них имеет свою кривую затухания.
Магнитно-резонансная томография
Техника выполнения
Для адекватного МРТ-обследования очень важна предварительная подготовка пациента. Мочевой пузырь должен быть умеренно растянут. Пациент должен помочиться и выпить 500 мл воды примерно за 2,5 часа до проведения МРТ.
Целенаправленное сканирование с помощью локализатора позволяет специалисту начать процедуру тогда, когда мочевой пузырь будет достаточно наполнен.
Как уже говорилось, растяжение мочевого пузыря имеет важное значение для оценки РМП. Стенка мочевого пузыря может казаться утолщённой, и недостаточное растяжение может привести к ошибочному диагнозу. И наоборот, чрезмерное растяжение может вызвать дискомфорт у пациентов, которые могут начать активно двигаться во время обнаружения артефактов или даже прервать исследование в случае невозможности удерживать большое количество мочи.
Как правило, само исследование проводится с использованием 1,5 Тл МРТ-сканера, пациент находится в положении лёжа. Для правильной оценки состояния мочевого пузыря применяются следующие последовательности:
- взвешенная по Т1 (T1W) турбо спин-эхо в аксиальной плоскости;
- взвешенная по Т2 (T2W) последовательность с высоким разрешением и узким полем зрения в аксиальной, сагиттальной или корональной плоскости и подавлением сигнала от жировой ткани;
- диффузионно-взвешенные изображения (DWI) и измеряемый коэффициент диффузии (ADC);
- МРТ с динамическим контрастированием, T1-W 3D градиентным эхо и трёхточечным методом Диксона.
У женщин изображения должны включать не только мочевой пузырь, но и матку, яичники и влагалище, а у мужчин — простату [5].
Применение
МРТ в основном применяется для локального стадирования опухоли при РМП, поскольку позволяет определить наличие или отсутствие мышечной инфильтрации, и, следовательно, провести дифференциацию между немышечно-инвазивным и мышечно-инвазивным РМП, а также стадиями Т1 и Т2.
Стенка мочевого пузыря имеет многослойную структуру, при этом уротелий и собственная пластинка визуализируются в виде гиперинтенсивной линии только после введения контрастного вещества в ранней фазе при МРТ с динамическим контрастированием. Мышечный слой выглядит как линия низкой интенсивности сигнала на T2-взвешенных изображениях, средней интенсивности на DWI-изображениях с коэффициентом ADC, а также линией с поздним и постепенным усилением сигнала при МРТ с динамическим контрастированием [5].
Система VI-RADS помогает стандартизировать подход к получению, интерпретации и представлению результатов МРТ у пациентов с диагнозом РМП в результате трансуретральной резекции мочевого пузыря. При оценке количество баллов варьирует от 1 до 5 и отражает возрастающий риск инвазии в мышцу детрузора [6]. Для более точной картины поражения используются последовательности T2W, DWI/ADC и DCE, каждая из которых оценивается в 1–5 баллов. T1-взвешенные изображения не представляют ценности для дифференциации между немышечно-инвазивным и мышечно-инвазивным РМП, поскольку в детрузоре наблюдается промежуточная интенсивность сигнала, что означает злокачественность процесса [23].
Вначале необходимо проанализировать структурные данные на Т2W, оценив целостность мышечного слоя. Сигнал от мышечного слоя должен быть равномерно гипоинтенсивным в отличие от содержимого мочевого пузыря, которое даёт гиперинтенсивный сигнал. Затем необходимо оценить сигнал в последовательностях DWI/ADC и DCE. При опухолях сигнал будет гиперинтенсивным в режиме DWI и гипоинтенсивным на карте ADC, при этом наблюдается раннее усиление сигнала от внутреннего слоя стенки мочевого пузыря. После получения информации по каждой последовательности различные комбинации баллов сравниваются и рассчитывается окончательная оценка по шкале VI-RADS.
Категория VI-RADS 1 присваивается при наличии прерывания линии интенсивного сигнала, соответствующего мышечному слою на Т2W. Максимальный размер поражения (сидячего или вегетирующего) не должен превышать 1 см. VI-RADS 1 позволяет предположить наличие немышечно-инвазивного РМП. Категория VI-RADS 2 присваивается также при прерывании линии интенсивного сигнала, но при диаметре опухоли более 1 см. Поражение может быть связано с отёком, проявляться линией утолщения и быть связано с повышением вероятности опухолевой инвазии. VI-RADS 3 свидетельствует о подозрении на прорастание опухоли в мышечный слой: нет чёткого прерывания сигнала низкой интенсивности от мышечного слоя на Т2W. Категория VI-RADS 4 присваивается при наличии инвазии в мышечную ткань, а VI-RADS 5 означает инвазию в мышечный слой с вовлечением перивезикальной жировой клетчатки.
В случае расхождений в результатах для понижения и повышения класса поражения используются карты DWI/ADC и DCE [5].
МРТ также имеет важное значение для оценки посттерапевтических изменений у пациентов с РМП. С помощью МРТ можно оценить состояние пациентов после неоадъювантной химиотерапии и иммунотерапии, которые являются революционными методами лечения РМП. После лечения состояние опухоли изучается с помощью последовательностей T2W, DWI/ADC и DCE. Кроме того, оценивается ответ на терапию, который может быть частичным, полным или вовсе отсутствовать. В этом контексте система VI-RADS показала многообещающие результаты [24].
В заключение следует отметить, что МРТ становится ведущим методом визуализации в диагностике РМП, оценке ответа на терапию и долгосрочном наблюдении. Кроме того, МРТ играет важную роль в планировании лечения при хирургическом вмешательстве и лучевой терапии. Тем не менее для определения степени злокачественности опухоли требуется проведение трансуретральной резекционной биопсии, которую МРТ заменить не может (рис. 5 и рис. 6).
Рис. 5. Магнитно-резонансная томография мочевого пузыря: a — мультипланарные изображения в режиме T2W показывают образование на задней стенке мочевого пузыря слева, размером более 1 см, с промежуточным сигналом мышечного слоя (VI-RADS 4); b — последовательность DWI и карты ADC указывают на очаг поражения со значительно ограниченной диффузией и инвазией в мышечный слой, низкое значение коэффициента ADC 0,9×10–3 мм2/с указывает на злокачественность (VI-RADS 4); c — последовательность DCE демонстрирует раннее и неоднородное усиление сигнала от поражения с инвазией в мышечный слой (VI-RADS 4). Общая оценка по шкале VI-RADS составила четыре балла. Источник изображения: Eusebi Laura, Masino Federica, Gifuni Rossella, Fierro Davide, Michele Bertolotto, Cova Maria Assunta, Giuseppe Guglielmi. Role of Multiparametric-MRI in Bladder Cancer. Current Radiology Reports 11, 69–80 (2023). https://doi.org/10.1007/s40134-023-00412-5. Эта статья находится в открытом доступе и распространяется на условиях лицензии Creative Commons Attribution (CC BY) 4.0. (http://creativecommons.org/licenses/by/4.0/)
Рис. 6. Магнитно-резонансная томография мочевого пузыря: a — мультипланарные изображения в режиме T2W показывают образование размером более 1 см на латеральной стенке купола мочевого пузыря справа с промежуточным сигналом мышечного слоя и инвазией в перивезикальную жировую ткань (VI-RADS 5); b — в режиме DWI и на карте ADC визуализируется значительно ограниченное диффузное поражение с инвазией в мышечный слой и перивезикальную жировую ткань (VI-RADS 5); c — последовательность DCE демонстрирует раннее и неоднородное усиление сигнала от поражения с инвазией в мышечный слой и перивезикальную жировую ткань (VI-RADS 5). Общая оценка по шкале VI-RADS составила пять баллов. Источник изображения: Eusebi Laura, Masino Federica, Gifuni Rossella, Fierro Davide, Michele Bertolotto, Cova Maria Assunta, Giuseppe Guglielmi. Role of Multiparametric-MRI in Bladder Cancer. Current Radiology Reports 11, 69–80 (2023). https://doi.org/10.1007/s40134-023-00412-5. Эта статья находится в открытом доступе и распространяется на условиях лицензии Creative Commons Attribution (CC BY) 4.0. (http://creativecommons.org/licenses/by/4.0/)
Комбинированная гибридная радионуклидная визуализация
ПЭТ/КТ объединяет ПЭТ и КТ в единый метод визуализации. 2-фтор-18F-2-дезокси-D-глюкоза (ФДГ) — самый распространённый радиоактивный препарат в онкологии, поэтому ПЭТ/КТ с использованием ФДГ широко используется в клинической практике при многих видах рака [25, 26].
Являясь аналогом глюкозы, 18F-ФДГ попадает в опухолевые клетки через транспортёр GLUT и другие переносчики, где фосфорилируется затем гексокиназой, но не подвергается дальнейшему метаболизму, что приводит к внутриклеточному накоплению. ПЭТ/КТ обеспечивает высокочувствительное сканирование метаболической активности с точной анатомической локализацией опухоли [27].
В последние годы этот гибридный метод визуализации всё чаще используется для выявления рецидивов после радикальной цистэктомии у пациентов с РМП [25, 26].
Учитывая, что уротелиальные опухоли отличаются высоким поглощением ФДГ, выведение этого препарата с мочой может маскировать опухоли во всех отделах мочевыводящих путей, особенно в мочевом пузыре. В связи с этим было изучено и опробовано несколько способов снижения активности ФДГ в моче, в частности обильное поглощение воды, приём мочегонных средств и катетеризация. Однако катетеризация, включающая промывание и ретроградное наполнение мочевого пузыря, может повысить риск ятрогенной инфекции мочевыводящих путей и, соответственно, увеличить время госпитализации. Учитывая данное ограничение, оценку опухоли можно проводить с помощью динамических изображений в ранней фазе до выведения и накопления ФДГ в мочевом пузыре [25].
В настоящее время ПЭТ/КТ с использованием ФДГ не рекомендуется в качестве первоначального диагностического метода или первичного инструмента стадирования, поскольку предполагается, что эта технология не позволяет оценить степень инвазии в перивезикальную жировую ткань на микроскопическом уровне и поражение соседних органов. Тем не менее ПЭТ/КТ можно применять для оценки ответа на терапию, выявления остаточных или рецидивирующих явлений и дифференциации рубцовой ткани от активных опухолей [26].
ПЭТ/МРТ — это ещё один гибридный метод визуализации, сочетающий функциональную информацию, предоставляемую ПЭТ, и подробные анатомические изображения, получаемые с помощью МРТ. ПЭТ с использованием ФДГ в качестве трассера, позволяет выявить участки с повышенной метаболической активностью, что часто свидетельствует о наличии раковой ткани. МРТ в этом сочетании, напротив, обеспечивает высокую контрастность мягких тканей. Учитывая эти предпосылки, ПЭТ/МРТ может преодолеть внутреннее ограничение ПЭТ/КТ в оценке локальной распространённости опухоли, поскольку качественные МРТ-изображения позволяют оценить поражение перивезикальной жировой клетчатки и мышечного слоя [28]. Тем не менее чувствительность ПЭТ/МРТ в диагностике ранних стадий РМП остаётся крайне низкой из-за особенностей почечной экскреции ФДГ. Следовательно, небольшие очаги в стенке мочевого пузыря могут остаться незамеченными [29].
ЗАКЛЮЧЕНИЕ
Визуализация имеет решающее значение для оценки РМП, особенно при выявлении и стадировании раковых опухолей. Традиционные ультразвуковые технологии, в частности КТУ, в настоящее время дополняются результатами МРТ. В свою очередь, МРТ приобретает всё большую популярность, поскольку позволяет дифференцировать немышечно-инвазивный РМП от мышечно-инвазивного по шкале VI-RADS. Комбинированные методы визуализации, такие как ПЭТ/КТ и ПЭТ/МРТ, также являются перспективными инструментами стадирования РМП. Новые методы визуализации, такие как УЗИ+КУ и ДЭКТ, не входят в типичный протокол диагностики и стадирования, но находят применение при определённых состояниях и могут предоставить полезную информацию как клиницистам, так и радиологам, гарантируя правильный подход к пациентам с онкологическими заболеваниями, с прицелом на всё более персонализированную медицину в будущем.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
ADDITIONAL INFORMATION
Funding source. This study was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
Об авторах
Federica Masino
Foggia University School of Medicine
Email: federicamasino@gmail.com
ORCID iD: 0009-0004-4289-3289
MD
Италия, ФоджаLaura Eusebi
Carlo Urbani Hospital
Email: lauraeu@virgilio.it
ORCID iD: 0000-0002-4172-5126
MD
Италия, ЕзиGianmichele Muscatella
Foggia University School of Medicine
Email: muscatella94@gmail.com
ORCID iD: 0009-0004-3535-5802
MD
Италия, ФоджаManuela Montatore
Foggia University School of Medicine
Email: manuela.montatore@unifg.it
ORCID iD: 0009-0002-1526-5047
MD
Италия, ФоджаGiuseppe Sortino
Carlo Urbani Hospital
Email: giuseppesortino@live.it
ORCID iD: 0000-0002-8804-1805
MD
Италия, ЕзиWilly Giannubilo
Civitanova Marche Hospital
Email: willygiannubilo@virgilio.it
MD
Италия, Чивитанова-МаркеGiuseppe Guglielmi
Foggia University School of Medicine; Dimiccoli Hospital; IRCCS Casa Sollievo della Sofferenza Hospital
Автор, ответственный за переписку.
Email: giuseppe.guglielmi@unifg.it
ORCID iD: 0000-0002-4325-8330
Professor
Италия, Фоджа; Барлетта; San Giovanni Rotondo
Список литературы
- Hill W.G. Control of Urinary Drainage and Voiding // Clin J Am Soc Nephrol. 2015. Vol. 10, N 3. P. 480–492. doi: 10.2215/CJN.04520413
- Glassock R.J., Rule A.D. Aging and the Kidneys: Anatomy, Physiology and Consequences for Defining Chronic Kidney Disease // Nephron. 2016. Vol. 134, N 1. P. 25–29. doi: 10.1159/000445450
- Montatore M., Muscatella G., Eusebi L., et al. Current Status on New Technique and Protocol in Urinary Stone Disease // Curr Radiol Rep. 2023. Vol. 11, N 12. P. 1–16. doi: 10.1007/s40134-023-00420-5
- Sam P., Nassereddin A., LaGrange C.A. Anatomy, Abdomen and Pelvis: Bladder Detrusor Muscle. In: StatPearls. Treasure Island (FL) : StatPearls Publishing, 2023.
- Eusebi L., Masino F., Gifuni R., et al. Role of Multiparametric-MRI in Bladder Cancer // Curr Radiol Rep. 2023. Vol. 11, N 5. P. 69–80. doi: 10.1007/s40134-023-00412-5
- Nicola R., Pecoraro M., Lucciola S., et al. VI-RADS score system — A primer for urologists // Int Braz J Urol. 2022. Vol. 48, N 4. P. 609–622. doi: 10.1590/s1677-5538.ibju.2021.0560
- Jubber I., Ong S., Bukavina L., et al. Epidemiology of Bladder Cancer in 2023: A Systematic Review of Risk Factors // Eur Urol. 2023. Vol. 84, N 2. P. 176–190. doi: 10.1016/j.eururo.2023.03.029
- Messina E., Pecoraro M., Pisciotti M.L., et al. Seeing is Believing: State of the Art Imaging of Bladder Cancer // Semin Radiat Oncol. 2023. Vol. 33, N 1. P. 12–20. doi: 10.1016/j.semradonc.2022.10.002
- Compérat E., Amin M.B., Cathomas R., et al. Current best practice for bladder cancer: a narrative review of diagnostics and treatments // Lancet. 2022. Vol. 400, N 10364. P. 1712–1721. doi: 10.1016/S0140-6736(22)01188-6
- Ahmadi H., Duddalwar V., Daneshmand S. Diagnosis and Staging of Bladder Cancer // Hematol Oncol Clin North Am. 2021. Vol. 35, N 3. P. 531–541. doi: 10.1016/j.hoc.2021.02.004
- Wentland A.L., Desser T.S., Troxell M.L., Kamaya A. Bladder cancer and its mimics: a sonographic pictorial review with CT/MR and histologic correlation // Abdom Radiol. 2019. Vol. 44, N 12. P. 3827–3842. doi: 10.1007/s00261-019-02276-w
- Wong V.K., Ganeshan D., Jensen C.T., Devine C.E. Imaging and Management of Bladder Cancer // Cancers. 2021. Vol. 13, N 6. P. 1396. doi: 10.3390/cancers13061396
- Messina E., Pisciotti M.L., Pecoraro M., et al. The use of MRI in urothelial carcinoma // Curr Opin Urol. 2022. Vol. 32, N 5. P. 536–544. doi: 10.1097/MOU.0000000000001011
- Schallom M., Prentice D., Sona C., et al. Accuracy of Measuring Bladder Volumes With Ultrasound and Bladder Scanning // Am J Crit Care. 2020. Vol. 29, N 6. P. 458–467. doi: 10.4037/ajcc2020741
- Ahmadi H., Duddalwar V., Daneshmand S. Diagnosis and Staging of Bladder Cancer // Hematol Oncol Clin North Am. 2021. Vol. 35, N 3. P. 531–541. doi: 10.1016/j.hoc.2021.02.004
- Liu Q., Gong H., Zhu H., Yuan C., Hu B. Contrast-Enhanced Ultrasound in the Bladder: Critical Features to Differentiate Occupied Lesions // Comput Math Methods Med. 2021. Vol. 2021. P. 1–5. doi: 10.1155/2021/1047948
- Fouladi D.F., Shayesteh S., Fishman E.K., Chu L.C. Imaging of urinary bladder injury: the role of CT cystography // Emerg Radiol. 2020. Vol. 27, N 1. P. 87–95. doi: 10.1007/s10140-019-01739-3
- Renard-Penna R., Rocher L., Roy C., et al. Imaging protocols for CT urography: results of a consensus conference from the French Society of Genitourinary Imaging // Eur Radiology. 2020. Vol. 30, N 3. P. 1387–1396. doi: 10.1007/s00330-019-06529-6
- Abuhasanein S., Hansen C., Vojinovic D., et al. Computed tomography urography with corticomedullary phase can exclude urinary bladder cancer with high accuracy // BMC Urol. 2022. Vol. 22, N 1. P. 60. doi: 10.1186/s12894-022-01009-4
- Bicci E., Mastrorosato M., Danti G., et al. Dual-Energy CT applications in urinary tract cancers: an update // Tumori. 2023. Vol. 109, N 2. P. 148–156. doi: 10.1177/03008916221088883
- Parakh A., Lennartz S., An C., et al. Dual-Energy CT Images: Pearls and Pitfalls // RadioGraphics. 2021. Vol. 41, N 1. P. 98–119. doi: 10.1148/rg.2021200102
- Toia G.V., Mileto A., Wang C.L., Sahani D.V. Quantitative dual-energy CT techniques in the abdomen // Abdom Radiol (NY). 2022. Vol. 47, N 9. P. 3003–3018. doi: 10.1007/s00261-021-03266-723
- Lai A.L., Law Y.M. VI-RADS in bladder cancer: Overview, pearls and pitfalls // Eur J Radiol. 2023. Vol. 160. P. 110666. doi: 10.1016/j.ejrad.2022.110666
- Panebianco V., Pecoraro M., Del Giudice F., et al. VI-RADS for Bladder Cancer: Current Applications and Future Developments // J Magn Reson Imaging. 2022. Vol. 55, N 1. P. 23–36. doi: 10.1002/jmri.27361
- Bouchelouche K. PET/CT in Bladder Cancer: An Update // Semin Nucl Med. 2022. Vol. 52, N 4. P. 475–485. doi: 10.1053/j.semnuclmed.2021.12.004
- Kim S.K. Role of PET/CT in muscle-invasive bladder cancer // Transl Androl Urol. 2020. Vol. 9, N 6. P. 2908–2919. doi: 10.21037/tau.2020.03.31
- Omorphos N.P., Ghose A., Hayes J.D.B., et al. The increasing indications of FDG-PET/CT in the staging and management of Invasive Bladder Cancer // Urol Oncol. 2022. Vol. 40, N 10. P. 434–441. doi: 10.1016/j.urolonc.2022.05.017
- Zhang-Yin J., Girard A., Marchal E., et al. PET Imaging in Bladder Cancer: An Update and Future Direction // Pharmaceuticals (Basel). 2023. Vol. 16, N 4. P. 606. doi: 10.3390/ph16040606
- Muin D., Laukhtina E., Hacker M., Shariat S.F. PET in bladder cancer imaging // Curr Opin Urol. 2023. Vol. 33, N 3. P. 206–210. doi: 10.1097/MOU.0000000000001090
Дополнительные файлы