Prediction of the efficacy of neoadjuvant chemoradiotherapy in patients with rectal cancer based on a texture analysis of T2-weighted magnetic resonance tumor image obtained at primary staging
- Authors: Dayneko Y.A.1, Berezovskaya T.P.1, Mirzeabasov O.A.2, Starkov S.O.2, Myalina S.A.1, Nevolskikh A.A.1, Ivanov S.А.1,3, Kaprin A.D.3,4,5
-
Affiliations:
- A.F. Tsyb Medical Radiology Research Centre, National Medical Research Radiological Center
- National Research Nuclear University MEPhI (Moscow Engineering Physics Institute)
- Peoples’ Friendship University of Russia
- P.A. Herzen Moscow Research Institute of Oncology, National Medical Research Radiological Center
- National Medical Research Radiological Centre
- Issue: Vol 5, No 3 (2024)
- Pages: 421-435
- Section: Original Study Articles
- Submitted: 03.03.2024
- Accepted: 24.04.2024
- Published: 04.12.2024
- URL: https://jdigitaldiagnostics.com/DD/article/view/628304
- DOI: https://doi.org/10.17816/DD628304
- ID: 628304
Cite item
Full Text
Abstract
BACKGROUND: Recently, significant efforts have been undertaken to find potential noninvasive biomarkers for predicting the response of locally advanced rectal cancer to neoadjuvant chemoradiotherapy.
AIM: To assess the texture characteristics of locally advanced rectal cancer in primary T2-weighted imaging (T2-WI) as a potential predictor for the efficacy of standard neoadjuvant chemoradiotherapy and develop a prediction system for the efficacy of neoadjuvant chemoradiotherapy based on them.
MATERIALS AND METHODS: The retrospective study enrolled 82 patients with locally advanced rectal cancer who received combination treatment with neoadjuvant chemoradiotherapy. Patient data were divided into the training (n=58) and control (n=24) sets. For texture analysis, primary high-resolution T2-WI at the level of the tumor center, oriented perpendicular to the intestinal wall, was used. The texture analysis was performed by second-order statistics based on the gray-level co-occurrence matrices using MAZDA ver. 4.6 featuring the calculation of 11 texture parameters. In the training set, based on the morphological assessment of surgical specimens, significantly different texture analysis parameters were found for two groups of patients: neoadjuvant chemoradiotherapy responders (good prognosis group) and nonresponders (poor prognosis group). Accordingly, a scoring system was created for assessing the efficacy of neoadjuvant chemoradiotherapy. The system was tested on the control set, and diagnostic efficacy parameters were determined.
RESULTS: In the training set, the good and poor prognosis groups differed significantly in five texture parameters: AngScMom (p=0.021), SumofSqs (p=0.003), SumEntrp (p=0.003), Entropy (p=0.038), and SumVarnc (p=0.015), for which the cutoff points were found. These parameters were applied to create the scoring system (excluding the Entropy parameter, which had a strong direct correlation with SumEntrp and the lowest area under the curve, and SumofSqs, which had low reproducibility). The diagnostic efficiency of the scoring system for predicting the response had sensitivity, specificity, positive-predictive value, and negative- predictive value of 72%, 69%, 70%, and 71% for the training set and 80%, 64%, 62%, and 82% for the control set, respectively. The areas under the ROC curve were 0.77 and 0.72 for the training and control sets, respectively.
CONCLUSIONS: Texture analysis of the primary T2-WI of tumors in patients with locally advanced rectal cancer allows for predicting the efficacy of neoadjuvant chemoradiotherapy with moderate diagnostic efficiency. The results suggest good prospects for further research in this area.
Full Text
ОБОСНОВАНИЕ
Неоадъювантная химиолучевая терапия с последующей тотальной мезоректумэктомией является стандартной схемой лечения местнораспространённого рака прямой кишки. Вместе с тем данные литературы свидетельствуют о гетерогенности результатов неоадъювантного лечения [1–3]. У большинства пациентов с местнораспространённым раком прямой кишки неоадъювантная химиолучевая терапия приводит к значительному сокращению размеров опухоли и снижению стадии заболевания, а у 15–27% пациентов удаётся достичь полного патоморфологического ответа (pathologic complete response, pCR), что ассоциировано с хорошей выживаемостью [4]. Однако от 7% до 30% пациентов не отвечают на неоадъювантную химиолучевую терапию, то есть после лечения у них не наблюдается регресса опухоли, а в некоторых случаях даже происходит прогрессирование заболевания [5].
Нельзя не учитывать и возможное развитие побочных эффектов (в том числе со стороны системы кроветворения, желудочно-кишечного тракта, мочеполовых органов, кожи), которые могут перевесить ожидаемый положительный эффект лечения, не улучшая клинический исход для этих пациентов и затягивая выполнение хирургического вмешательства [6]. Именно поэтому крайне важно уже на этапе планирования лечения больных местнораспространённым раком прямой кишки иметь возможность прогнозировать вероятность получения эффекта от нео-адъювантной химиолучевой терапии и индивидуализировать предлагаемое лечение.
В последнее время прилагаются значительные усилия по поиску потенциальных неинвазивных биомаркёров для прогнозирования ответа на неоадъювантную химио-лучевую терапию, включая экспрессию генов, мутации и молекулярные метаболиты.
Магнитно-резонансная томография (МРТ) признана оптимальным методом визуализации для определения результатов неоадъювантной химиолучевой терапии, при котором используют различные оценочные подходы: МРТ-рестадирование, mrTRG (magnetic resonance tumor regression grade ― магнитно-резонансная оценка регрессии опухоли), МРТ-волюметрия, анализ паттернов МРТ-изображений. В последнее время активно развивается радиомный анализ медицинских изображений. Радиомика представляет собой неинвазивный высокотехнологичный метод постобработки, позволяющий извлечь большой набор количественных характеристик из стандартных медицинских изображений [7, 8].
На основе распределения и взаимосвязи уровней серого на изображении опухоли получают радиомные признаки, позволяющие выявить визуально не определяемую информацию. Результатом радиомного анализа является создание вычислительных моделей (radiomic signatures ― радиомных сигнатур), позволяющих прогнозировать особенности течения заболевания и ответа на лечение [9, 10].
Ранее мы протестировали радиомный подход на основе текстурного анализа посттерапевтических Т2-взвешенных изображений (Т2-ВИ), показавший высокую эффективность в разграничении пациентов, ответивших и не ответивших на неоадъювантную химиолучевую терапию [11]. Неоднородность текстуры изображения связана с неоднородностью строения опухоли и микроокружением опухолевых клеток, а следовательно, может характеризовать фенотип опухоли [12–14]. Исходя из предположения, что гетерогенность первичной опухоли потенциально может определять её ответ на лечение и прогноз, так как гетерогенные опухоли склонны к более агрессивному течению и более устойчивы к терапии [15], мы решили апробировать радиомный подход для прогнозирования эффективности неоадъювантной химиолучевой терапии до начала лечения, используя МРТ-изображение опухоли при первичном стадировании. Основываясь на уже имеющихся многообещающих результатах применения текстурного анализа в онкологии, мы предположили, что текстурный анализ первичного Т2-ВИ имеет хороший диагностический потенциал для прогнозирования резистентности местнораспространённого рака прямой кишки к неоадъювантной химиолучевой терапии.
Цель исследования ― изучить текстурные характеристики местнораспространённого рака прямой кишки на первичном Т2-ВИ в качестве потенциального фактора прогноза эффективности стандартной неоадъювантной химиолучевой терапии и разработать на их основе систему прогнозирования эффективности такого лечения.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
В ретроспективное наблюдательное одноцентровое неконтролируемое исследование вошли 82 пациента с диагнозом «местнораспространённый рак прямой кишки», находившихся на обследовании и лечении в клинике Медицинского радиологического научного центра имени А.Ф. Цыба ― филиале Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр радиологии» Министерства здравоохранения Российской Федерации в период с 2012 по 2017 год. Всем пациентам было проведено комбинированное лечение с использованием пролонгированного курса неоадъювантной химиолучевой терапии. Радикальное хирургическое лечение выполнено в объёме тотальной мезоректумэктомии с последующим патоморфологическим исследованием операционных препаратов, послужившим референтным методом для радиомного прогнозирования эффективности неоадъювантной химиолучевой терапии. Патоморфологический ответ опухоли на терапию характеризовали степенью лечебного патоморфоза по Лушникову: I степень (слабый ответ) ― дистрофические изменения отдельных опухолевых клеток; II степень (умеренный ответ) ― появление очагов некроза и дистрофические изменения опухолевых клеток; III степень (выраженный ответ) ― обширные поля некроза, резко выраженные дистрофические изменения опухолевых клеток, немногочисленные опухолевые клетки, сохраняющие жизнеспособность; IV степень (pCR) ― отсутствие опухолевых элементов [16].
Все пациенты на основе посттерапевтического патоморфоза опухоли были разделены на две группы: группу хорошего прогноза (те, кто ответил на неоадъювантную химиолучевую терапию, III и IV степень патоморфоза) и группу плохого прогноза (те, кто не ответил, I и II степень патоморфоза).
Критерии соответствия
Критерии включения: наличие в базе данных отделения МРТ первичных Т2-ВИ опухоли с высоким разрешением; морфологически подтверждённый диагноз аденокарциномы прямой кишки; полностью завершённое комбинированное лечение с данными гистологического исследования операционного препарата.
Критерии исключения: наличие на МР-изображениях муцинозного варианта опухоли; низкое качество МР-изображений; рецидивные опухоли прямой кишки; первично-множественные опухоли прямой кишки.
Методы регистрации исходов
Магнитно-резонансная томография
МРТ проводилась на 1,5 Tл томографе MAGNETOM Symphony (Siemens, Германия); протокол исследования включал Т2-ВИ высокого разрешения в косо-аксиальной плоскости перпендикулярно стенке кишки на уровне опухоли; использовали импульсную последовательность FSE (fast-spin-echo ― быстрое спиновое эхо) с параметрами: TR (repetition time ― время повторения) 4020 мс, TE (echotime ― эхо-время) 97 мс, толщина среза/шаг 3,0/0,3 мм, FoV (field-of-view ― поле обзора) 199×250 мм, матрица 286×512. Обучающая выборка была сформирована из 58 пациентов, случайным образом отобранных из общего числа вошедших в исследование; контрольную (тестовую) выборку составили 24 пациента.
Текстурный анализ
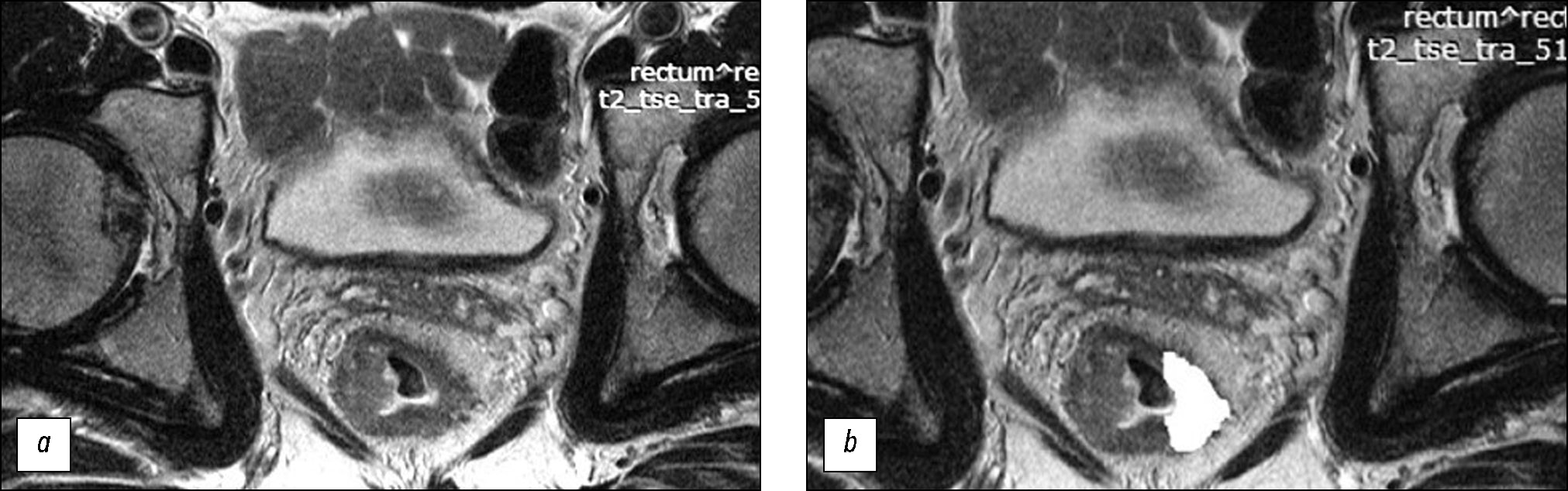
Анализ Т2-ВИ проводили ретроспективно, без информации о степени патоморфоза. Для расчёта параметров текстурного анализа врач-рентгенолог с 6-летним опытом абдоминальной визуализации отбирал первичное Т2-ВИ высокого разрешения на уровне центра опухоли и вручную выполнял 2D-сегментацию по наружному контуру опухоли, включая экстрамуральный компонент (рис. 1), после чего рассчитывались параметры текстуры второго порядка методом матрицы совместной встречаемости уровней серого (grey level co-occurrence matrices, GLCM) в компьютерной программе Mazdaver. 4.61. Отдельно лежащие опухолевые депозиты в область интереса не включали.
Рис. 1. Магнитно-резонансная томография малого таза, T2-ВИ, косо-аксиальный срез, опухоль нижнеампулярного отдела прямой кишки: a ― до неоадъювантной химиолучевой терапии; b ― после сегментации (белым цветом выделена область для автоматического расчёта параметров текстуры).
Определение параметров текстурного анализа проводили на расстоянии 2 пикселей и в четырёх разных направлениях (0°, 45°, 90°, 135°) с усреднением полученных значений. Было рассчитано одиннадцать параметров текстуры: AngScMom (angular second moment ― второй угловой момент), InvDfMom (inverse difference moment ― однородность), Contrast (контраст), Correlat (correlation — корреляция), SumofSqs (sumofsquares ― дисперсия), SumAverg (sumaverage ― суммарное среднее), Entropy (энтропия), SumVarnc (sumvariance ― суммарная дисперсия), SumEntrp (sumentropy ― суммарная энтропия), DifVarnc (difference variance ― дифференциальная дисперсия), DifEntrp (difference entropy ― дифференциальная энтропия).
Этическая экспертиза
Все пациенты подписали разрешение на использование их клинических данных в научных целях и информированное согласие на анонимную публикацию данных. Все персональные данные пациентов, включённых в исследование, были закодированы и обезличены для защиты прав пациентов и предотвращения разглашения личной информации. Исследователи имели доступ к электронной базе данных, содержащей только информацию о демографических и клинических характеристиках пациентов, которую анализировали и представляли в обобщённом виде, обеспечивая тем самым её конфиденциальность.
Исследование одобрено этическим комитетом МРНЦ им. А.Ф. Цыба (протокол №14 от 19.09.2022).
Статистический анализ
Определение параметров текстурного анализа первичного Т2-ВИ, достоверно различающихся в группах хорошего и плохого прогноза в обучающей выборке, выполнено с использованием U-критерия Манна–Уитни. Распределение признаков хорошего и плохого прогноза, корреляционная зависимость между ними и визуализация полученных данных проводились с использованием среды для статистических вычислений R-версии 4.2.2 (R Foundation for Statistical Computing, Вена, Австрия). Исследование корреляционной связи между показателями текстурного анализа и характером ответа на неоадъювантную химиолучевую терапию в обучающей выборке выполнено с помощью непараметрического метода корреляционного анализа Спирмена. Для определения точек разделения отобранных параметров текстурного анализа использовали ROC-анализ (receive roperating characteristic), выполненный с помощью пакета прикладных программ Statistica 10.
Балльная система оценки разработана с учётом числовых значений точек разделения и направления корреляционной связи. Для оценки надёжности (воспроизводимости) параметров текстурного анализа проводилась повторная сегментация Т2-ВИ вторым лучевым диагностом.
Проверка эффективности балльной системы на независимых данных, которые не использовались при её разработке, выполнена в контрольной выборке. Расчёт параметров диагностической эффективности балльной системы в обеих выборках включал чувствительность, специфичность, прогностичность положительного результата и прогностичность отрицательного результата и проводился с помощью четырёхпольных таблиц сопряжённости, общую точность характеризовали площадью под ROC-кривой (area under curve, AUC).
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Согласно степени патоморфоза, из 58 пациентов обучающей выборки 30 было с хорошими 28 с плохим прогнозомна неоадъювантную химиолучевую терапию. В тестовую (контрольную) выборку вошло 24 пациента, в том числе 13 с хорошим и 11 с плохим прогнозом на неоадъювантную химиолучевую терапию.
Основные результаты исследования
Распределение численных значений для 11 параметров текстурного анализа исходных изображений опухоли в группах пациентов с хорошим и плохим прогнозом на неоадъювантную химиолучевую терапию приведено на рис. 2. Значения некоторых параметров в обучающей выборке, как видно из рис. 2, заметно отличались для разных групп прогнозируемого ответа на неоадъювантную химиолучевую терапию. Различия оказались статистически достоверными для пяти параметров: AngScMom, SumOfSqs, SumVarnc, SumEntrp, Entropy (табл. 1). При оценке корреляции этих исходных параметров текстурного анализа с ответом на неоадъювантную химиолучевую терапию была установлена умеренная обратная корреляционная связь между вариантом ответа и показателями, характеризующими гетерогенность [SumofSqs (rs-0,499326), SumVarnc (rs-0,449162), SumEntrp (rs-0,544423), Entropy (rs-0,463936)], и умеренная прямая корреляция с показателем однородности [AngScMom (rs0,47725)].Ни один из перечисленных параметров текстурного анализа не показал значимой прямой корреляции с другими отобранными параметрами, за исключением SumEntrop, который сильно положительно коррелировал с параметром Entrop, и оба эти параметра имели сильную обратную корреляционную связь с AngScMom (рис. 3).
Рис. 2. Распределение количественных значений параметров текстурного анализа местнораспространённого рака прямой кишки в группах пациентов с хорошим и плохим прогнозом на неоадъювантную химиолучевую терапию в обучающей выборке.
Таблица 1. Уровень значимости различий для показателей текстурного анализа исходного Т2-ВИ в группах хорошего/плохого ответа на неоадъювантную химиолучевую терапию (по U-критерию Манна–Уитни) в обучающей выборке
Показатель текстурного анализа | р |
AngScMom | 0,021203* |
Contrast | 0,810911 |
Correlat | 0,231598 |
SumofSqs | 0,002842* |
InvDfMom | 0,605660 |
SumAverg | 0,969866 |
SumVarnc | 0,015087* |
SumEntrp | 0,003085* |
Entropy | 0,037737* |
DifVarnc | 0,553964 |
DifEntrp | 0,989953 |
* Отмечены уровни значимости, соответствующие достоверным различиям.
Рис. 3. Корреляция между параметрами текстурного анализа в обучающей выборке. Градацией оранжевого цвета обозначена сила прямой корреляционной связи, градацией синего ― сила обратной корреляционной связи (более интенсивный цвет соответствует большей силе связи).
Оценка диагностической эффективности методом характеристических кривых (ROC-анализ) для каждого из отобранных пяти параметров текстурного анализа представлена на рис. 4, величина площади под характеристической кривой (AUC) составила: AngScMom ― 0,70; SumofSqs ― 0,77; SumVarnc ― 0,72; SumEntrp ―0,77; Entropy ― 0,69.
Рис. 4. ROC-кривые для параметров текстурного анализа в обучающей выборке: a ― для AngScMom; b ― для Entropy, SumEntrp, SumofSqs, SumVarnc.
Для оценки воспроизводимости параметров текстурного анализа у 25 пациентов обучающей выборки повторно была выполнена сегментация Т2-ВИ вторым рентгенологом. Сравнительный анализ этих данных проводился с использованием непараметрического метода Вилкоксона для двух зависимых (связанных) групп. Нулевая гипотеза (об отсутствии различий средних) здесь и в дальнейшем отклонялась при уровне значимости p <0,05 и принималась альтернативная ей гипотеза о существовании различий среднего (табл. 2).
Таблица 2. Уровень значимости различий параметров текстуры опухоли, полученных по результатам первой и повторной сегментации
Показатель текстурного анализа | р |
AngScMom | 0,676637 |
Contrast | 0,562928 |
Correlat | 0,443173 |
SumofSqs | 0,004927* |
InvDfMom | 0,411840 |
SumAverg | 0,443173 |
SumVarnc | 0,099482 |
SumEntrp | 0,087528 |
Entropy | 0,527183 |
DifVarnc | 0,840072 |
DifEntrp | 0,777543 |
* Отмечены уровни значимости, соответствующие достоверным различиям.
В соответствии с полученными данными параметр SumofSqs, имевший низкую надёжность, в дальнейшем был исключён при создании балльной системы. Кроме того, из двух параметров с сильной положительной корреляцией ― SumEntrp и Entropy ― последний был исключён, так как имел меньшую AUC. Таким образом, в балльную систему было включено три параметра текстурного анализа (табл. 3). Выбор точки разделения для каждого из них осуществлялся с помощью ROC-анализа на основе оптимального соотношения чувствительности и специфичности. Присвоение «1» или «0» баллов каждому из отобранных параметров текстурного анализа проводилось с учётом точки разделения и направления корреляционной связи.
Таблица 3. Параметры текстурного анализа первичного Т2-ВИ, включённые в систему прогнозирования эффективности неоадъювантной химиолучевой терапии при раке прямой кишки
Параметр | Текстурный анализ | ||
Параметр текстурного анализа | AngScMom | SumVarnc | SumEntrp |
Ранговый коэффициент корреляции Спирмена (rS) | 0,47725 | -0,449162 | -0,544423 |
Площадь под ROC-кривой (AUC) | 0,70 | 0,72 | 0,77 |
Значение точки разделения (чувствительность и специфичность, %) | 0,0016 (77,60) | 277,51 (70,60) | 1,81 (75,68) |
Значения для присвоения балла «1» | ≥0,0016 | ≤277,51 | ≤1,81 |
Для прогнозирования ответа на неоадъювантную химиолучевую терапию система балльной оценки параметров текстурного анализа показала умеренную диагностическую эффективность c AUC 0,76 (рис. 5). Оптимальный результат отбора пациентов с хорошим прогнозом достигался при сумме баллов ≥2. Результаты прогнозирования ответа в обучающей выборке представлены в табл. 4; параметры диагностической эффективности, рассчитанные на их основе, ― в табл. 5. Полученные результаты свидетельствуют об умеренных диагностических возможностях разработанной балльной системы прогнозирования ответа опухоли на основе параметров текстурного анализа первичного Т2-ВИ.
Рис. 5. ROC-кривая для балльной системы прогнозирования ответа на неоадъювантную химиолучевую терапию на основе текстурного анализа Т2-ВИ в обучающей выборке, AUC=0,76.
Таблица 4. Распределение больных местнораспространённым раком прямой кишки в зависимости от прогноза на основе текстурного анализа первичного Т2-ВИ и лечебного патоморфоза опухоли в обучающей выборке
Группа | Данные патоморфоза | Всего | |
Ответившие | Не ответившие | ||
Группа хорошего прогноза | 21 | 9 | 30 |
Группа плохого прогноза | 8 | 20 | 28 |
Итого | 29 | 29 | 58 |
Таблица 5. Диагностическая эффективность системы прогнозирования ответа на неоадъювантную химиолучевую терапию на основе текстурного анализа первичного Т2-ВИ опухоли в обучающей выборке
Параметры диагностики | Значение, % |
Чувствительность | 72,4 |
Специфичность | 69 |
Прогностичность положительного результата | 70 |
Прогностичность отрицательного результата | 71,4 |
Валидация балльной системы в контрольной выборке проводилась тем же врачом-рентгенологом, который участвовал в её разработке. Он не был информирован о достигнутом лечебном патоморфозе. Разделение пациентов на группы хорошего и плохого прогноза, полученное в контрольной выборке, приведено в табл. 6, а полученные на его основе параметры диагностики ― в табл. 7 и на рис. 6. Результаты тестирования балльной системы показали умеренную диагностическую эффективность для прогнозирования ответа пациентов на неоадъювантную химиолучевую терапию.
Таблица 6. Распределение больных местнораспространённым раком прямой кишки в соответствии с прогнозируемым ответом на неоадъювантную химиолучевую терапию на основе балльной системы оценки текстурного анализа Т2-ВИ и достигнутым лечебным патоморфозом опухоли в контрольной выборке
Группа | Данные патоморфоза | Всего | |
Ответившие | Не ответившие | ||
Группа хорошего прогноза | 8 | 5 | 13 |
Группа плохого прогноза | 2 | 9 | 11 |
Итого | 10 | 14 | 24 |
Таблица 7. Диагностическая эффективность балльной системы оценки текстурного анализа Т2-ВИ в прогнозировании ответа опухоли на неоадъювантную химиолучевую терапию в контрольной выборке
Параметры диагностики | Значение, % |
Чувствительность | 80 |
Специфичность | 64,3 |
Прогностичность положительного результата | 61,6 |
Прогностичность отрицательного результата | 81,8 |
Рис. 6. ROC-кривая для балльной системы прогнозирования ответа опухоли на неоадъювантную химиолучевую терапию на основе текстурного анализа исходного Т2-ВИ в контрольной выборке, AUC=0,72.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
В нашем исследовании изучалась возможность спро-гнозировать до начала лечения хороший или плохой ответ опухоли на неоадъювантную химиолучевую терапию у больных местнораспространённым раком прямой кишки. Нами представлены результаты разработки и тестирования балльной системы на основе параметров текстурного анализа, извлечённых из первичного Т2-ВИ с помощью матрицы GLCM после ручной 2D-сегментации опухоли на уровне её центра, свидетельствующие об умеренной диагностической эффективности предлагаемой системы. Разделение пациентов на тех, у кого неоадъювантная химиолучевая терапия потенциально даст положительный эффект, и тех, кому она не принесёт пользы, имеет важное значение для индивидуализации плана лечения пациентов с местнораспространённым раком прямой кишки.
Обсуждение основного результата исследования
Мы рассматриваем наше исследование как первый шаг в разработке предиктивной радиомной сигнатуры на основе МРТ-изображения первичной опухоли у пациентов с местнораспространённым раком прямой кишки, как первый этап, определяющий направление дальнейших исследований в этой области.
Необходимо учитывать, что на сегодняшний день чётко не определены стандарты проведения и анализа радиомных исследований, а данные литературы свидетельствуют об отсутствии единого подхода не только в выборе типа и количества диагностических изображений, способа их предварительной обработки и сегментации, но и в методах выбора параметров для создания прогностических радиомных сигнатур.
Как показал анализ литературы, оцениваемое нами Т2-ВИ высокого разрешения чаще всего выбирается исследователем для текстурного анализа, так как оно является основным при первичном стадировании опухоли прямой кишки, обеспечивает оптимальный тканевой контраст и пространственное разрешение, при этом наименее подвержено артефактам [17–20]. Вместе с тем есть ряд исследований, в которых для извлечения параметров текстурного анализа используется набор мультипараметрических МРТ-изображений, включающих, помимо Т2-ВИ, диффузионно-взвешенные изображения, карты измеряемого коэффициента диффузии, постконтрастное Т1-ВИ [21–24], а иногда и мультмодальные изображения [25].
Сегментация изображения может выполняться вручную, полуавтоматическим или автоматическим способом. В обзоре, посвящённом радиомным исследованиям при раке предстательной железы, П.Б. Гележе и соавт. [26] показали, что в большинстве публикаций сегментация была выполнена ручным способом на одиночном аксиальном срезе. На сегодняшний день отсутствуют достоверные доказательства того, насколько репрезентативной может быть информация, полученная из одного среза опухоли. Трёхмерное сегментирование изображения, позволяющее извлечь информацию из всего объёма опухоли, потенциально может быть более надёжным для характеристики опухоли, однако является трудоёмким и времязатратным процессом, иногда при сопоставимом конечном результате [27]. Именно поэтому в значительном количестве исследований приводятся результаты текстурного анализа на основе 2D-сегментации изображений.
Срез на уровне центра опухоли, на наш взгляд, является оптимальным для определения текстурных характеристик местнораспространённого рака прямой кишки, определяющих ответ на неоадъювантную химиолучевую терапию, таких как показатели гетерогенности и однородности. Кроме того, следует отметить, что аналогичное ограничение присуще и гистологическому анализу биопсийного образца опухоли, анализ которого также используют для прогнозирования результата лечения. Вместе с тем следует отметить, что число работ, применяющих 3D-сегментацию опухолей прямой кишки, в последнее время увеличивается [28]. Недавно опубликованное исследование X. Zhou и соавт. [23], проводивших сравнение результатов сегментации изображения, выполненной вручную и с использованием искусственного интеллекта на основе глубокого обучения, показало превосходство последнего подхода.
Выбранный нами подход на основе статистических признаков второго порядка, извлечённых с помощью GLCM матрицы Харалика [29], не является единственно возможным методом получения и представления данных текстурного анализа. Мы исходили из информации, что такой подход может превосходить другие по надёжности и менее зависим от вариабельности параметров МРТ-изображений [30]. Однофакторный анализ показал превосходство прогнозирования с использованием параметров GLCM над признаками формы и параметрами GLSZM [31]. Важно подчеркнуть, что увеличение количества анализируемых признаков требует увеличения объёма выборки для снижения вероятности ошибки первого рода. Рекомендуется, чтобы количество параметров было в 10–15 раз меньше, чем количество анализируемых случаев [9]. В нашей работе при объёме обучающей выборки 58 пациентов из 11 параметров матрицы GLCM нами было выделено три значимых воспроизводимых параметра, которые могут служить потенциальным визуализационным маркёром на основе Т2-ВИ для предсказания эффективности планируемой неоадъювантной химиолучевой терапии опухоли.
Оценивая диагностическую эффективность моделей прогнозирования результата неоадъювантной химиолучевой терапии, приводимую в литературе, нужно отметить, что она сильно варьирует. Так, модель, основанная на мультипараметрической МРТ, показала AUC 0,84; 0,81 и 0,79 для обучающей, тестовой выборок и внешней валидации соответственно [32]. Модель прогноза эффективности неоадъювантной химиолучевой терапии A.H. Yardimci и соавт. [33] из восьми радиомных признаков показала результат с AUC 0,75 и 0,70 для обучающей и тестовой выборок соответственно. Наши результаты прогнозирования с помощью балльной системы на основе трёх параметров текстурного анализа Т2-ВИ обеспечили AUC 0,77 в обучающей выборке и 0,72 ― в тестовой. Близкие к нашим результаты (AUC 0,73) получили L. Wen и соавт. [18] при построении комбинированной модели, включающей клинические и радиомные признаки.
Выявленная нами способность параметров текстуры второго порядка, извлечённых из Т2-ВИ на уровне центра опухоли, прогнозировать эффективность планируемой неоадъювантной химиолучевой терапии, согласуется с данными литературы и позволяет утверждать, что существенные различия в исходных изображениях опухоли, присутствующие до лечения, могут быть полезными для прогнозирования ответа на неоадъювантную химиолучевую терапию, однако требуются дальнейшие широкомасштабные исследования надёжности радиомных сигнатур, прежде чем можно будет говорить о внедрении радиомики в клиническую практику.
Ограничения исследования
Наше исследование имеет ряд ограничений. Во-первых, ретроспективный дизайн исследования, выполненного в одном учреждении с небольшой выборкой пациентов, может сказаться на точности разработанной системы прогнозирования. Во-вторых, мы применяли метод 2D-сегментации, который не включал весь объём опухоли. Наконец, для построения модели прогноза эффективности лечения мы не использовали возможности искусственного интеллекта и машинного обучения, что планируем сделать в дальнейшем.
ЗАКЛЮЧЕНИЕ
Радиомный подход на основе текстурного анализа Т2-ВИ первичной опухоли у пациентов с местнораспространённым раком прямой кишки имеет существенный диагностический потенциал для прогноза эффективности планируемой неоадъювантной химиолучевой терапии, что, по нашему мнению, делает целесообразным проведение проспективного мультицентрового исследования по изучению надёжности радиомных сигнатур и возможности последующего внедрения их в клиническую практику.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: Я.А. Дайнеко ― дизайн исследования, сбор и обработка материала, написание текста; Т.П. Березовская ― концепция и дизайн исследования, сбор материала, написание текста; О.А. Мирзеабасов, С.О. Старков ― обработка материала, написание текста; С.А. Мялина ― сбор материала, написание текста; А.А. Невольских ― клинический анализ материала, написание текста; С.А. Иванов ― написание и финальное редактирование текста; А.Д. Каприн ― написание текста, утверждение финальной версии рукописи.
ADDITIONAL INFORMATION
Funding source. This study was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. Ya.A. Dayneko ― study design, collection and processing of materials, writing of the text; T.P. Berezovskaya ― study concept and design, collection of materials, writing of the text; O.A. Mirzeabasov, S.O. Starkov ― processing of materials, writing of the text; S.A. Myalina ― collection of materials, writing of the text; A.A. Nevolskikh ― clinical analysis of the material, writing of the text; S.A. Ivanov ― writing and final editing of the text; A.D. Kaprin ― writing of the text, approval of the final version of the manuscript.
1 Режим доступа: https://qmazda.p.lodz.pl/
About the authors
Yana A. Dayneko
A.F. Tsyb Medical Radiology Research Centre, National Medical Research Radiological Center
Author for correspondence.
Email: vorobeyana@gmail.com
ORCID iD: 0000-0002-4524-0839
SPIN-code: 1841-7759
MD, Cand. Sci. (Medicine)
Russian Federation, ObninskTatiana P. Berezovskaya
A.F. Tsyb Medical Radiology Research Centre, National Medical Research Radiological Center
Email: tberezovska@yahoo.com
ORCID iD: 0000-0002-3549-4499
SPIN-code: 5837-3465
MD, Dr. Sci. (Medicine), Professor
Russian Federation, ObninskOleg A. Mirzeabasov
National Research Nuclear University MEPhI (Moscow Engineering Physics Institute)
Email: oami@yandex.ru
ORCID iD: 0000-0001-5587-2795
SPIN-code: 3820-4320
MD, Assistant Professor
Russian Federation, ObninskSergey O. Starkov
National Research Nuclear University MEPhI (Moscow Engineering Physics Institute)
Email: sergeystarkov56@mail.ru
ORCID iD: 0000-0002-0420-7856
Dr. Sci. (Physical and Mathematical), Professor
Russian Federation, ObninskSofiya A. Myalina
A.F. Tsyb Medical Radiology Research Centre, National Medical Research Radiological Center
Email: samyalina@mail.ru
ORCID iD: 0000-0001-6686-5419
SPIN-code: 9668-3834
Russian Federation, Obninsk
Aleksey A. Nevolskikh
A.F. Tsyb Medical Radiology Research Centre, National Medical Research Radiological Center
Email: editor@omnidoctor.ru
ORCID iD: 0000-0001-5961-2958
SPIN-code: 3787-6139
MD, Dr. Sci. (Medicine)
Russian Federation, ObninskSergey А. Ivanov
A.F. Tsyb Medical Radiology Research Centre, National Medical Research Radiological Center; Peoples’ Friendship University of Russia
Email: oncourolog@gmail.com
ORCID iD: 0000-0001-7689-6032
SPIN-code: 4264-5167
MD, Dr. Sci. (Medicine), Professor, corresponding member of the Russian Academy of Sciences
Russian Federation, Obninsk; MoscowAndrey D. Kaprin
Peoples’ Friendship University of Russia; P.A. Herzen Moscow Research Institute of Oncology, National Medical Research Radiological Center; National Medical Research Radiological Centre
Email: contact@nmicr.ru
ORCID iD: 0000-0001-8784-8415
SPIN-code: 1759-8101
MD, Dr. Sci. (Medicine), Professor, academician of the Russian Academy of Sciences
Russian Federation, Moscow; Moscow; MoscowReferences
- Berdov BA, Erigin DV, Nevolskykh AA, et al. Multidiciplinary approach to the treatment of rectal cancer. Oncology Bulletin Volga region. 2015;(4):21–28. EDN: UKTSNJ
- Maistrenko NA, Galkin VN, Erygin DV, Sazonov AA. Neoadjuvant chemoradiotherapy in combined treatment of patients with rectal cancer. Grekov’s Bulletin Surg. 2017;176(4):31–38. EDN: ZDQHMV doi: 10.24884/0042-4625-2017-176-4-31-38
- Berdov BA, Erygin DV, Nevolskikh AA, et al. Neoadjuvant therapy for locally advanced rectal cancer. P.A. Herzen J Oncology. 2018;3(7):9–15. EDN: XSLIJN doi: 10.17116/onkolog2018739
- Maas M, Nelemans PJ, Valentini V, et al. Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: A pooled analysis of individual patient data. Lancet Oncol. 2010;11(9):835–844. doi: 10.1016/S1470-2045(10)70172-8
- Petresc B, Lebovici A, Caraiani C, et al. Pre-treatment T2-WI based radiomics features for prediction of locally advanced rectal cancer non-response to neoadjuvant chemoradiotherapy: A preliminary study. Cancers (Basel). 2020;12(7):1894. doi: 10.3390/cancers12071894
- Huh JW, Kim HC, Kim SH, et al. Tumor regression grade as a clinically useful outcome predictor in patients with rectal cancer after preoperative chemoradiotherapy. Surgery. 2019;165(3):579–585. doi: 10.1016/j.surg.2018.08.026
- Lambin P, Leijenaar RT, Deist TM, et al. Radiomics: The bridge between medical imaging and personalized medicine. Nat Rev Clin Oncol. 2017;14(12):749–762. doi: 10.1038/nrclinonc.2017.141
- Mayerhoefer ME, Materka A, Langs G, et al. Introduction to radiomics. J Nucl Med. 2020;61(4):488–495. doi: 10.2967/jnumed.118.222893
- Papanikolaou N, Matos C, Koh DM. How to develop a meaningful radiomic signature for clinical use in oncologic patients. Cancer Imaging. 2020;20(1):33. EDN: ROFXND doi: 10.1186/s40644-020-00311-4
- Schick U, Lucia F, Dissaux G, et al. MRI-derived radiomics: Methodology and clinical applications in the field of pelvic oncology. Br J Radiol. 2019;92(1104):20190105. doi: 10.1259/bjr.20190105
- Berezovskaya TP, Dayneko YaA, Nevolskikh AA, et al. A system for evaluating the effectiveness of neoadjuvant chemoradiotherapy in patients with colorectal cancer based on a texture analysis of post-therapeutic t2-wi magnetic resonance imaging. REJR. 2020;10(3):92–101. EDN: DCXHXG doi: 10.21569/2222-7415-2020-10-3-92-101
- Lubner MG, Smith AD, Sandrasegaran K, et al. CT texture analysis: Definitions, applications, biologic correlates, and challenges. Radiographics. 2017;37(5):1483–1503. doi: 10.1148/rg.2017170056
- Rogers W, Thulasi Seetha S, Refaee TA, et al. Radiomics: From qualitative to quantitative imaging. Br J Radiol. 2020;93(1108):20190948. doi: 10.1259/bjr.20190948
- Capobianco E, Dominietto M. From medical imaging to radiomics: Role of data science for advancing precision health. J Pers Med. 2020;10(1):15. doi: 10.3390/jpm10010015
- Dagogo-Jack I, Shaw AT. Tumour heterogeneity and resistance to cancer therapies. Nat Rev Clin Oncol. 2018;15(2):81–94. doi: 10.1038/nrclinonc.2017.166
- Lušnikov EF. Therapeutic pathomorphosis of tumors. In: Kraevskiy NA, Smolyannikova AV, Sarkisova DS, editors. Pathoanatomical diagnosis of human tumors. Moscow: Meditsina; 1993. (In Russ.)
- Miranda J, Horvat N, Assuncao AN, et al. MRI-based radiomic score increased mrTRG accuracy in predicting rectal cancer response to neoadjuvant therapy. AbdomRadiol (NY). 2023;48(6):1911–1920.EDN: IYPGFF doi: 10.1007/s00261-023-03898-x
- Wen L, Liu J, Hu P, et al. MRI-based radiomic models outperform radiologists in predicting pathological complete response to neoadjuvant chemoradiotherapy in locally advanced rectal cancer. AcadRadiol. 2023;30(Suppl. 1):S176–S184. EDN: TYUIWX doi: 10.1016/j.acra.2022.12.037
- Tomaszewski MR, Dominguez-Viqueira W, Ortiz A, et al. Heterogeneity analysis of MRI T2 maps for measurement of early tumor response to radiotherapy. NMR Biomed. 2021;34(3):e4454.EDN: NWLELG doi: 10.1002/nbm.4454
- Stanzione A, Verde F, Romeo V, et al. Radiomics and machine learning applications in rectal cancer: Current update and future perspectives. World J Gastroenterol. 2021;27(32):5306–5321. doi: 10.3748/wjg.v27.i32.5306
- Cui Y, Yang X, Shi Z, et al. Radiomics analysis of multiparametric MRI for prediction of pathological complete response to neoadjuvant chemoradiotherapy in locally advanced rectal cancer. Eur Radiol. 2019;29(3):1211–1220. EDN: ATAEHX doi: 10.1007/s00330-018-5683-9
- Huang H, Han L, Guo J, et al. Multiphase and multiparameter MRI-based radiomics for prediction of tumor response to neoadjuvant therapy in locally advanced rectal cancer. Radiat Oncol. 2023;18(1):179. EDN: ICLFRG doi: 10.1186/s13014-023-02368-4
- Zhou X, Yu Y, Feng Y, et al. Attention mechanism based multi-sequence MRI fusion improves prediction of response to neoadjuvant chemoradiotherapy in locally advanced rectal cancer. Radiat Oncol. 2023;18(1):175. EDN: DIHCZQ doi: 10.1186/s13014-023-02352-y
- Santini D, Danti G, Bicci E, et al. Radiomic features are predictive of response in rectal cancer undergoing therapy. Diagnostics. 2023;13(15):2573. EDN: CWBCMS doi: 10.3390/diagnostics13152573
- Giannini V, Mazzetti S, Bertotto I, et al. Predicting locally advanced rectal cancer response to neoadjuvant therapy with 18F-FDG PET and MRI radiomics features. Eur J Nucl Med Mol Imaging. 2019;46(4):878–888. EDN: PVETLQ doi: 10.1007/s00259-018-4250-6
- Gelezhe PB, Blokhin IA, Semenov SS, Caruso D. Magnetic resonance imaging radiomics in prostate cancer radiology: What is currently known? Digital Diagnostics. 2021;2(4):441−452.EDN: FFFGWI doi: 10.17816/DD70170
- Tibermacine H, Rouanet P, Sbarra M, et al. GRECCAR Study Group. Radiomics modelling in rectal cancer to predict disease-free survival: Evaluation of different approaches. Br J Surg. 2021;108(10):1243–1250. doi: 10.1093/bjs/znab191
- Miranda J, Wang L, Wu X, et al. MRI-based pre-radiomics and delta-radiomics models accurately predict the post-treatment response of rectal adenocarcinoma to neoadjuvant chemoradiotherapy. Front Oncol. 2023;(13):1133008. EDN: XYMVTJ doi: 10.3389/fonc.2023.1133008
- Haralick RM. Statistical and structural approaches to texture. IEEE. 1979;67(5):768–804. doi: 10.1109/PROC.1979.11328
- Mayerhoefer ME, Szomolanyi P, Jirak D, et al. Effects of MRI acquisition parameter variations and protocol heterogeneity on the results of texture analysis and pattern discrimination: An application-oriented study. Med Phys. 2009;36(4):1236–1243. doi: 10.1118/1.3081408
- Shayesteh S, Nazari M, Salahshour A, et al. Treatment response prediction using MRI-based pre-, post-, and delta-radiomic features and machine learning algorithms in colorectal cancer. Med Phys. 2021;48(7):3691–3701. doi: 10.1002/mp.14896
- Song M, Li S, Wang H, et al. MRI radiomics independent of clinical baseline characteristics and neoadjuvant treatment modalities predicts response to neoadjuvant therapy in rectal cancer. Br J Cancer. 2022;127(2):249–257. EDN: BCDXXD doi: 10.1038/s41416-022-01786-7
- Yardimci AH, Kocak B, Sel I, et al. Radiomics of locally advanced rectal cancer: Machine learning-based prediction of response to neoadjuvant chemoradiotherapy using pre-treatment sagittal T2-weighted MRI. JPN J Radiol. 2023;41(1):71–82. EDN: PSFYUW doi: 10.1007/s11604-022-01325-7
Supplementary files