The role of radiomics in diagnosing gastrointestinal stromal tumors: a review
- Authors: Martirosyan E.A.1,2, Karmazanovsky G.G.1,3, Kondratyev E.V.1, Sokolova E.A.1, Nechaev V.A.2, Kuzmina E.S.2, Galkin V.N.2, Glotov A.V.1
-
Affiliations:
- A.V. Vishnevsky National Medical Research Center of Surgery
- S.S. Yudin City Clinical Hospital
- The Russian National Research Medical University named N.I. Pirogov
- Issue: Vol 6, No 1 (2025)
- Pages: 143-155
- Section: Reviews
- Submitted: 21.05.2024
- Accepted: 20.06.2024
- Published: 25.03.2025
- URL: https://jdigitaldiagnostics.com/DD/article/view/631596
- DOI: https://doi.org/10.17816/DD631596
- ID: 631596
Cite item
Full Text
Abstract
Gastrointestinal stromal tumors are the most common mesenchymal neoplasms of the gastrointestinal tract originating from the interstitial cells of Cajal, accounting for approximately 80% of all primary gastric tumors. Despite their widespread use, traditional diagnostic methods for gastrointestinal stromal tumors, such as computed tomography, endoscopic examination, endoscopic ultrasound, and fine-needle aspiration biopsy, have several limitations, including diagnostic uncertainty and limited capabilities of biopsy.
Radiomics, which involves analyzing texture features in medical images, is considered an innovative approach, with the potential to enhance diagnostic accuracy in gastrointestinal stromal tumors detection. This method allows for the interpretation of tissue changes through the mathematical processing of images, revealing information beyond the human eye’s ability to detect, which can be beneficial for the early detection of tumors.
This article assesses the advantages and disadvantages of current methods for diagnosing gastrointestinal stromal tumors and the potential of radiomics to improve diagnostic outcomes. The review allows to determine the best applications and promising directions for future research in this crucial field.
Full Text
ВВЕДЕНИЕ
Гастроинтестинальные стромальные опухоли (ГИСО) относят к наиболее распространённой группе мезенхимальных опухолей желудочно-кишечного тракта (ЖКТ), формирующихся из интерстициальных клеток Кахаля, с частотой встречаемости от 10 до 20 случаев на миллион человек в год [1]. Наиболее типичной их локализацией является желудок (50–60%), далее следуют тонкая кишка (30–40%), ободочная и прямая кишка (5–10%), редко — пищевод (менее 1%) [2].
Большинство ГИСО связаны с активацией мутации в гене, кодирующем тирозинкиназный рецептор III типа (c-KIT), или гене, кодирующем рецептор тромбоцитарного фактора роста α (PDGFRα). Более 70% случаев мутация в гене с-KIT затрагивает 11 экзон (с-KIT-11), который кодирует внутриклеточный околомембранный домен рецептора. В 7–10% случаев ГИСО имеет мутацию в 9 экзоне данного гена (c-KIT-9), её часто встречают в опухолях, возникающих в тонкой или толстой кишке, и редко наблюдают при локализации их в желудке. Также существует так называемый «дикий тип» (10–15%), когда мутации не обнаруживают ни в одном из вышеперечисленных генов [3].
ГИСО имеют вариабельную клиническую картину, зависящую от размеров опухоли и её локализации. Наиболее распространённым симптомом является кровотечение из верхних отделов ЖКТ, проявляющееся в виде рвоты кровью или мелены у 40–65% пациентов. Другие симптомы могут включать дискомфорт в брюшной полости, раннее чувство насыщения, вздутие живота, боль в животе, кишечную непроходимость и перфорацию. В ряде случаев течение заболевания бессимптомное, а опухоль — случайная находка [4]. К моменту обнаружения у 15–50% пациентов существуют признаки отдалённого метастазирования [5].
ГИСО — клинически неоднородная группа опухолей с различной степенью злокачественного потенциала. Их биологическое поведение варьирует от клинически доброкачественного до злокачественного течения. Различают несколько систем стратификации риска ГИСО, которые помогают определить риск рецидива, прогноз и наиболее подходящую тактику лечения. Критерии Национального института здоровья США (NIH) и критерии, разработанные институтом патологии вооружённых сил США (AFIP), относят к наиболее известным системам [6].
Многие исследования подтвердили, что локализация и размер опухоли, количество митозов и разрыв опухоли относят к независимым предикторам ГИСО [1]. H. Joensuu и соавт. [7] предложили модифицированную версию критериев NIH, которая объединяет эти четыре прогностических фактора в систему оценки и классифицирует ГИСО с выделением четырёх категорий риска: очень низкий, низкий, средний и высокий. Эту систему называют стандартом клинической оценки для прогнозирования риска рецидива опухоли. Однако её применение возможно только после оперативного вмешательства при получении патоморфологического материала.
Компьютерная томография (КТ) является методом выбора для предоперационной диагностики и стадирования опухоли, а также последующего наблюдения и контроля за лечением [8]. Она обладает высокой чувствительностью при обнаружении опухолей, поэтому позволяет эффективно идентифицировать опухоли различных размеров, что важно для ранней диагностики и лечения [9–12]. Особенности изображений опухоли по данным КТ с контрастным усилением, такие как гомогенное или гетерогенное накопление контрастного препарата, а также отсутствие или наличие некротических зон, относят к важными маркёрам дифференциальной диагностики опухолей [13–18]. Кроме того, КТ позволяет определить размеры опухоли, её локализацию и распространение в окружающие ткани и органы, что необходимо для определения стадии опухоли и планирования лечения [19].
В то же время ГИСО малых размеров, максимальный размер которых менее 2 см, способны вызывать диагностическую проблему. Несмотря на то что КТ остаётся основным методом обнаружения и оценки опухолей, образования малых размеров обладают менее характерными признаками на изображениях, что усложняет их распознавание. Они часто имеют недостаточную контрастность, затрудняющую визуализацию, особенно на фоне окружающих тканей. В некоторых случаях малые ГИСО ошибочно идентифицируют в качестве других опухолей или даже как неизменённую стенку желудка [16].
Ограничения существующих методов диагностики, таких как КТ и тонкоигольная аспирационная биопсия, оказывают значительное влияние на точность дифференциальной диагностики ГИСО. Например, несмотря на широкое использование КТ для обнаружения опухолей ЖКТ, её ограниченная чувствительность приводит к пропуску мелких образований или неправильной интерпретации неспецифических характеристик, что затрудняет дифференциальную диагностику различных типов субэпителиальных образований [16]. С другой стороны, тонкоигольная аспирационная биопсия, являясь стандартным методом получения образцов ткани для гистологического анализа, имеет свои недостатки, а именно ограниченное количество ткани, доступной для дальнейшей гистологической оценки. Это вызывает недостаточную репрезентативность образца и неопределённость в диагнозе, что также затрудняет правильную дифференциальную диагностику и выбор оптимального лечения. Кроме того, при её выполнении есть вероятность диагностической ошибки из-за «щита» в виде нормальной слизистой оболочки [20].
В свете этих ограничений возникает необходимость разработки и внедрения новых, более точных и эффективных методов диагностики ГИСО.
Радиомика представляет собой перспективное направление, которое может улучшить точность диагностики ГИСО. Её подходы, основанные на анализе текстурных характеристик опухолей, могут предоставить дополнительную информацию о структуре опухоли, что позволит более точно различать разные типы опухолей и определить лучшие стратегии лечения.
Методология поиска
Мы использовали несколько поисковых систем, а именно PubMed, Google Scholar и eLibrary, с целью обеспечения всестороннего обзора текущих знаний в области радиомики ГИСО. Поиск литературы осуществляли с применением ключевых слов и сочетаний терминов, связанных с радиомикой, ГИСО и диагностикой опухолей ЖКТ: «гастроинтестинальная стромальная опухоль», «диагностика», «радиомика», «компьютерная томография», «radiomics», «gastrointestinal stromal tumors», «GIST», «diagnosis», «computed tomography», «endoscopic biopsy» и их синонимы.
Для включения в обзор мы рассматривали статьи на русском и английском языках, опубликованные в научных журналах за последние 5 лет.
В результате нашего поиска и отбора мы включили в литературный обзор 25 оригинальных научных статей, содержащих последние исследования и достижения в области радиомики ГИСО.
МЕТОД РАДИОМИКИ
В последние десятилетия радиомика стала одним из наиболее активно развивающихся направлений в медицинской диагностике, особенно в контексте диагностики опухолевых заболеваний [21]. Она объединяет в себе технологии обработки изображений, машинного обучения и статистического анализа для извлечения информации из медицинских изображений, полученных с помощью визуализационных методов исследования, таких как КТ, магнитно-резонансная томография (МРТ) и позитронно-эмиссионная томография [22]. Радиогеномика предоставляет информацию о связи визуализационных характеристик опухолей с их генотипами [23].
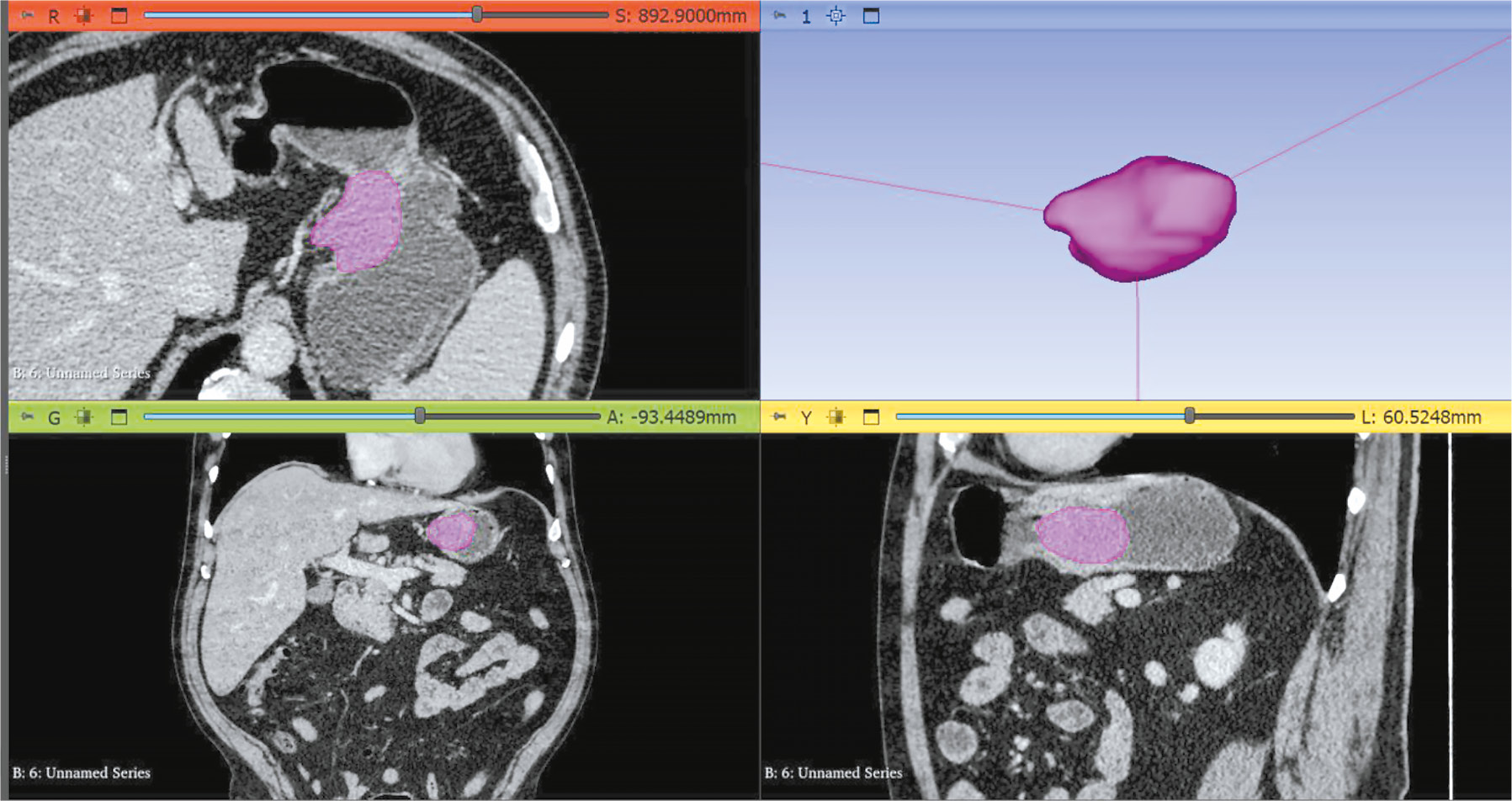
Одной из ключевых особенностей радиомики является возможность неинвазивного анализа данных, полученных с помощью различных методов визуализации (рис. 1) [24]. Эти методы обеспечивают высокое пространственное разрешение и предоставляют детальную информацию о структуре и функциях органов ЖКТ, что делает их ценным инструментом для диагностики и мониторинга ГИСО [25].
Рис. 1. Пример сегментации опухоли с использованием программного обеспечения для текстурного анализа (Slicer 3D): результат компьютерной томографии в венозную фазу сканирования у пациента с гастроинтестинальной стромальной опухолью желудка.
Существует растущий интерес к применению радиомики в диагностике ГИСО, основанный на надёжных научных доказательствах и результатах клинических исследований [26]. Данная обзорная статья направлена на анализ и систематизацию последних достижений в области радиомики с акцентом на её потенциале в диагностике ГИСО. В частности, мы рассмотрим различные методы анализа изображений, связь радиомических признаков с молекулярными и генетическими характеристиками опухолей, мультимодальный подход и перспективы стандартизации и валидации методов радиомики [27].
ОБЛАСТИ ПРИМЕНЕНИЯ РАДИОМИКИ В ДИАГНОСТИКЕ ГАСТРОИНТЕСТИНАЛЬНЫХ СТРОМАЛЬНЫХ ОПУХОЛЕЙ
Существующие исследования по применению радиомики в области диагностики ГИСО отражены в Приложении 1.
Проанализированные исследования выполнены с использованием различной методологии и способов получения изображений, различных радиомических признаков и методов статистического анализа. Большинство исследований проводили ретроспективно. Количество включённых случаев ГИСО варьировало от 41 до 1143. В преобладающем количестве исследований использовали результаты КТ для извлечения признаков (20), в трёх исследованиях оценку радиомических признаков производили с помощью анализа изображений МРТ, и всего в двух — с помощью результатов ультразвуковых исследований (УЗИ). Радиомический анализ осуществляли посредством оценки изображений КТ: в венозную фазу — 9 исследований (36%); в условиях комбинации двух и трёх фаз — 8 исследований (32%); в нативную фазу — 2 исследования (8%). Объёмный анализ (3D ROI) проведён в 80% случаев, в то время как двухмерное изображение (2D ROI) использовали в 20% случаев, в одной статье отсутствовали упоминания о сегментации опухолей.
РАДИОГЕНОМИКА. ОПРЕДЕЛЕНИЕ МУТАЦИОННОГО СТАТУСА
Мутация с-KIT-11. Она составляет более 70% всех мутаций c-KIT и инициирует развитие ГИСО. Опухоли с первичной мутацией c-KIT-11 демонстрируют наиболее эффективный ответ на терапию иматинибом мезилатом [28]. Таким образом, определение мутационного профиля имеет важное значение для пациентов с ГИСО, которым возможно проведение молекулярно-целевой терапии с использованием ингибиторов тирозинкиназы. К тому же наличие мутации с-KIT-11 связано с худшим прогнозом заболевания [29]. Однако анализ генных мутаций требует генотипирования, для которого необходимы образцы ткани, полученные хирургическим путём, что обычно является дорогостоящим процессом. Высокая стоимость и инвазивность процедуры генотипирования ограничивают её широкое применение среди большинства пациентов [30].
Исследование, проведённое F. Xu и соавт. в 2018 году [31], продемонстрировало значимый потенциал анализа текстуры изображений КТ для дифференциальной диагностики ГИСО без мутации с-KIT-11. Авторы выяснили, что текстурный показатель стандартного отклонения (stdDeviation) может служить потенциальным независимым предиктором для определения ГИСО без данной мутации. Несмотря на значительный вклад рассматриваемого исследования в развитие методик визуализации, следует отметить, что оно охватывало относительно небольшую выборку — 69 случаев в обучающей группе и 17 — в валидационной, включая всего четыре случая ГИСО без мутации с-KIT-11 в валидационной группе, что могло существенно повлиять на результаты. Кроме того, исследование ограничено анализом только 30 радиомических характеристик, что способствует снижению его информативность.
Эти ограничения рассмотрены в последующем исследовании X. Liu и соавт. [30], где была более репрезентативная выборка пациентов и проанализировано большее количество радиомических признаков, а также изучены семантические характеристики изображений КТ. Однако данное исследование всё же имело ряд недостатков, включая ретроспективный анализ данных, разнородный характер изображений (выполняли на 3 различных томографах), отсутствие препроцессинга, что могло повлиять на воспроизводимость данных.
C. Guo и соавт. [32] в 2023 году использовали метод перевыборки (оверсэмплинга) с целью увеличения объёма группы для сбалансирования выборки пациентов с ГИСО без мутации в гене с-KIT-11. В результате создана радиомическая номограмма, демонстрирующая высокую точность в валидационной когорте, со значением площади под кривой (AUC) выше 0,8, указывающим на эффективное различие между типами мутаций.
Q.W. Zhang и соавт. [33] использовали уже в своём исследовании значительно большую выборку пациентов, чем в описанных ранее работах. С помощью контрастных изображений КТ извлечены радиомические признаки, которые затем оценивали на предмет способности предсказывать различные генотипы мутации с-KIT-11. Результаты подчеркнули, что радиомическая модель показала сильную предсказательную производительность, особенно для идентификации делеций с-KIT-11 557/558. Обучающая когорта демонстрировала значения AUC в диапазоне от 0,759 до 0,956 для различных мутаций, в то время как валидационная когорта имела значения AUC от 0,688 до 0,870. Среди ограничений данного исследования выделяли использование ретроспективного анализа данных, а также отсутствие корреляционной зависимости между данными, полученными посредством КТ с контрастированием у пациентов с наличием мутации c-KIT-11 c клиническими механизмами этой корреляции.
Понимание ограничений каждого исследования и признание их вклада в развитие научного поля являются важными для определения направлений с целью дальнейшего изучения и улучшения методик в будущих работах. Это не уменьшает значимость проведённых исследований, а подчёркивает необходимость продолжения научного поиска в области радиомики и радиогеномики для повышения точности диагностических и прогностических методов в онкологии.
Мутация с-KIT-9. Она является менее распространённой в сравнении с мутацией в 11 экзоне и составляет примерно 9% всех ГИСО [34]. Опухоли с мутацией в данном экзоне отличаются большей степенью агрессивности и инвазивности, чем опухоли с мутацией с-KIT-11. Клинические исследования показали, что ГИСО с мутацией с-KIT-9 реагируют на лечение иначе по сравнению с более распространённой мутацией в 11 экзоне [35]. Таким образом, её своевременное выявление у пациентов с ГИСО крайне важно для точной диагностики и оптимизации лечебной тактики. В 2023 году Y. Wei и соавт. [36] разработали радиомическую номограмму, показывающую высокую прогностическую точность в определении статуса мутации с-KIT-9 — AUC 0,902 для обучающей выборки и 0,907 для тестовой выборки. В эту номограмму интегрировали Rad-Score с клиническими факторами риска (например, расположение вне желудка, отдалённые метастазы). Однако ретроспективный характер исследования и ручная сегментация изображений могли способствовать предвзятости в отношении полученных данных, а редкость данной мутации привела к формированию относительно небольшой выборки пациентов.
СТРАТИФИКАЦИЯ РИСКА
Риск злокачественного потенциала ГИСО классифицируют как: очень низкий, низкий, средний и высокий в соответствии с критериями NIH 2008 года. Данная классификация является стандартом клинической стратификации для прогнозирования риска рецидива с относительно высокой практичностью [7].
Обычно ГИСО с очень низким или низким риском относят к потенциально злокачественным, что клинически оценивают как доброкачественные опухоли. ГИСО со средним и высоким риском определяют как злокачественные. Их терапия включает в себя применение иматиниба мезилата и других препаратов до или после операции для предотвращения рецидива или метастазирования [37].
«Золотым стандартом» диагностики злокачественности ГИСО считают патоморфологическое исследование, позволяющее оценить: размер и локализацию опухоли; количество митозов, указывающее на риск злокачественности по материалам пункционной биопсии. Однако данный метод является инвазивным, поэтому может привести к диссеминации опухолевых клеток, а также сопряжён с риском кровотечения. В связи с этим стратифицировать риск опухоли следует как можно раньше для выбора корректной тактики лечения [38].
В исследовании, проведённом L. Zhang и соавт. [39], проанализировано 140 изображений КТ в артериальную фазу с верифицированными ГИСО. Результаты показали высокую диагностическую ценность для предоперационного прогнозирования опухолей высокого и среднего риска — AUC 0,935 и 0,809 соответственно, что свидетельствует о возможности стратификации риска по четырём категориям.
В 2019 году C. Wang и соавт. [40] объединили категории риска в две группы — с низким (от очень низкого до среднего риска) и высоким (высокий риск) злокачественным потенциалом. Помимо этого, пациенты с митотическим индексом ≤5 в 50 полях зрения классифицированы как группа с низким митотическим количеством, а >5 — с высоким митотическим количеством. Созданы две основные радиомические модели: одна для прогнозирования малигнизации, а другая для определения митотического индекса ГИСО. Эти модели показали хорошую прогностическую эффективность с высокими значениями AUC, указывающими на сильную дискриминационную способность между различными категориями риска опухолей.
Многие исследования также предполагают значительный потенциал анализа текстуры изображений КТ для предоперационного прогнозирования риска злокачественности ГИСО [41, 42].
Комбинированные модели. В клинической практике субъективные симптомы и данные КТ могут помочь специалистам в прогнозировании риска ГИСО. Семиотические признаки, определяемые по данным КТ, такие как размер опухоли, локализация, контур, кровоизлияние и некроз, используют для оценки риска ГИСО. В ряде исследований предпринимали попытку предсказать стратификацию риска с помощью результатов предоперационной КТ с внутривенным болюсным контрастным усилением [43–45]. Обнаружено, что такие КТ-параметры, как размер, характер роста или увеличенное количество питающих сосудов, характерны для опухолей высокого риска.
В исследовании другой группы авторов из Китая для создания номограммы использованы радиомические признаки и такие клинически значимые характеристики, как размер опухоли и наличие изъязвления. Значения AUC тренировочной и валидационной когорт, полученные для номограммы, составили 0,930 и 0,931 соответственно, что выше значений, полученных для радиомической и клинической модели [46].
Вызывает интерес исследование Y. Wang и соавт. [47], поскольку они сравнили между собой 4 разработанные модели: две радиомические модели на основе изображений КТ, полученных в артериальную и венозную фазы; модель на основе клинических показателей — размер опухоли и наличие некроза в ней; и клиническая модель на основе стандартных признаков по результатам КТ (оценивали пять врачей-рентгенологов). Анализ показал, что радиомические признаки, полученные из изображений КТ в артериальную и венозную фазы, предсказывали риск злокачественности, демонстрируя хорошую диагностическую точность со значениями AUC, значительно превышающими те, что получены только с использованием традиционных клинических показателей.
В другом исследовании создана комбинированная номограмма для стратификации риска с использованием дополнительных клинических данных — размера опухоли и митотического индекса, достигнув почти эквивалентной производительности к установленным клиническим стандартам с показателем AUC около 0,965 [48].
В одном из недавних исследований, выполненном P. Wang и соавт. [49], впервые построена комбинированная модель, включающая общие данные, результаты КТ, биомаркёры радиомического анализа и иммуногистохимические характеристики, для прогнозирования степени риска ГИСО. Номограмма включает четыре радиомических признака: пол пациента, маркёр пролиферативной активности опухолевой клетки (ki-67), форму поражения и наличие некроза. Она хорошо сработала как для обучающей когорты, так и для валидационной (AUC 0,921 и 0,913 соответственно).
Таким образом, комплексный анализ с комбинированием радиомических, клинических и КТ-признаков позволяет учитывать больше аспектов заболевания, таких как размеры опухоли, её локализация, визуальные характеристики и биологическое поведение. Это обеспечивает более глубокое и комплексное понимание особенностей опухоли. Клинические и КТ-признаки предоставляют не всегда очевидную информацию, в то время как радиомический анализ помогает выявлять предикторы, используемые для более точной диагностики. Например, размер опухоли и наличие некроза относят к важным предикторам злокачественности и они могут напрямую влиять на риск рецидива или метастазирования.
Также интеграция различных типов данных улучшает точность прогностических моделей за счёт уменьшения возможных ошибок, связанных с односторонним анализом. Комбинированные модели более эффективно интерпретируют данные, что повышает их способность к корректному классифицированию случаев с различным риском.
Модели, включающие разнообразные данные, более устойчивы к изменениям в популяции пациентов и условиях изображений. Это делает их более надёжными при использовании в различных клинических условиях.
Применение множественных источников данных помогает снизить риск переобучения, которому подвержены модели, обученные только на радиомических признаках, особенно при небольшом объёме данных.
Магнитно-резонансная томография. МРТ предоставляет больше информации об опухоли с помощью различных последовательностей при оценке её биологического поведения. Диффузионно-взвешенные изображения (ДВИ) отражают ограничение дисперсии и движения молекул воды. Некоторые исследования показали, что особенности текстуры ДВИ возможно использовать в качестве биологического показателя для оценки неоднородности и прогноза метастатических ГИСО [50].
L. Yang и соавт. [51] первыми разработали диагностическую модель, основанную на радиомических данных для прогнозирования митотического индекса у пациентов с ГИСО. Номограмма включала комбинацию радиомических признаков с максимальным диаметром и локализацией опухоли, которая обеспечила хорошую дискриминацию в тренировочной (AUC 0,878) и валидационной когортах (AUC 0,903).
H. Mao и соавт. [52] создали радиомические модели, основанные на комбинации трёх МРТ-последовательностей [ДВИ с расчётом карт исчисляемого коэффициента диффузии (ADC), T2-взвешенное изображение (ВИ), T1-ВИ], являющиеся неинвазивными методами оценки риска злокачественности ГИСО. Показано, что ADC превосходит последовательности T1- и T2-ВИ в выявлении группы высокого риска (AUC 0,85), что указывает на высокую эффективность для идентификации риска злокачественности.
Кроме того, L. Yang и соавт. [53] провели первоначальные исследования по созданию гибридной модели, основанной на радиомике и глубоком обучении по изображениям МРТ, для прогнозирования митотического индекса, которая показала хорошую прогностическую ценность как в обучающей выборке, так и в тестируемой группе. Возможно, это связано с тем, что МРТ имеет более высокую мягкотканную контрастность по сравнению с КТ, поэтому изображения содержать больше информации, а извлечённые функции глубокого обучения имеют лучшую дискриминационную способность.
Ультразвуковое исследование. Радиомика расширяет диагностические возможности всех методов, используемых для диагностики ГИСО. Например, впечатляющие результаты получены исследователями из Китая, M. Zhuo и соавт. [54]. Они разработали первую радиомическую модель, основанную на 2D трансабдоминальных ультразвуковых изображениях, для прогнозирования стратификации риска злокачественности ГИСО. Построена номограмма на основе радиомических и ультразвуковых предикторов (максимального диаметра опухоли). Радиомический анализ ультразвуковых изображений значительно коррелировал со злокачественным потенциалом ГИСО. Разработанная радиомическая номограмма превзошла клиническую ультразвуковую номограмму и радиомическую модель, достигнув AUC 0,90 в валидационной когорте.
X. Jia и соавт. [55] продемонстрировали в своём исследовании результаты, показывающие, что признаки высокого риска злокачественности ГИСО по данным КТ и эндоскопического ультразвукового исследования не могли достоверно предсказать злокачественный потенциал ГИСО с размером 1–2 см, тогда как радиомическая модель, основанная на контрастных изображениях КТ, позволила идентифицировать ГИСО 1–2 см с высоким потенциалом злокачественности.
Ki-67. Антиген ki-67, ассоциированный с пролиферацией клеток, признан в качестве маркёра и его применяют в клинической практике для прогнозирования исходов при агрессивных формах онкологических заболеваний, включая рак лёгких, молочной железы и глиому [56]. В метаанализе J. Li и соавт. [57] выявили прямую корреляционную зависимость между риском злокачественности и уровнем гиперэкспрессии ki-67. Это говорит о том, что ki-67 возможно использовать в качестве дополнительного предиктора для прогнозирования риска злокачественности ГИСО.
Q. Zhang и соавт. [58] разработали и проверили радиомическую номограмму, основанную на данных нативной КТ, для предоперационного прогнозирования уровня ki-67 у пациентов с ГИСО. Авторы применили многоцентровую когорту пациентов для анализа и валидации радиомических признаков. В результате установлено, что комбинированная номограмма, интегрирующая радиомический признак и клинический параметр — размер опухоли, показала высокую прогностическую точность, подтверждённую полученными значениями AUC на различных этапах валидации (в обучающей группе — 0,801, в группе внутренней валидации — 0,828 и в группе внешней валидации — 0,784).
В 2022 году Q. Feng и соавт. [59] разработали номограмму, основанную на данных КТ с контрастным усилением (артериальная и венозная фазы). В исследовании проводили сегментацию опухолей и извлечение радиомических признаков, которые анализировали с помощью многомерной логистической регрессии в сочетании с КТ-признаками (размер опухоли, характер роста и изъязвление) и получением комбинированной модели. Однако авторы не выявили значительной разницы между моделью на основе только радиомических признаков (AUC 0,772) и комбинированной моделью (AUC 0,760).
M. Liu и соавт. [60] провели многофакторный анализ, показавший, что максимальный размер опухоли является фактором риска, независимым от уровня ki-67. В этом исследовании многомерная логистическая модель определила размер опухоли и разработанную радиомическую модель как независимые факторы риска для высокой экспрессии ki-67. Эти два фактора применяли при разработке радиомической номограммы. AUC разработанной радиомической модели с использованием трёх фаз контрастного усиления в ходе проведения КТ была выше, чем с использованием только данных артериальной и венозной фаз. В предыдущем исследовании [58] авторы использовали только данные нативной фазы для извлечения предикторов, а также 2D ROI для сегментации опухоли, что могло повлиять на потерю информации о гетерогенности опухоли.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Желудок является наиболее частой локализацией ГИСО, поэтому их дифференциальную диагностику необходимо проводить с другими мезенхимальными опухолями (например, лейомиомами и шванномами).
X. Zhang и соавт. [61] в своём исследовании разработали комбинированную модель для дифференциальной диагностики ГИСО и других опухолей желудка (лейомиомы и шванномы) на основе двухмерных эндоскопических ультразвуковых изображений и радиомических данных. Данная модель имела высокую чувствительность и специфичность до 91 и 90,6% соответственно. Примечательным в этом исследовании является то, что чувствительность и специфичность модели для диагностики субэпительных образований менее 20 мм достигли более 91%, а AUC — 0,96. Таким образом, данная модель эффективна для дифференциальной диагностики ГИСО, что помогает избегать необоснованной резекции.
В одном из исследований, проведённом в Нидерландах, выполнена попытка дифференциальной диагностики ГИСО с другими внутрибрюшными опухолями любых локализаций. Диагностическая эффективность полученных моделей повышалась при сочетании данных текстурных характеристик с клиническими, такими как возраст, пол и локализация опухоли (AUC 0,84) [62], что в очередной раз доказывает необходимость использования комбинированных моделей.
ОЦЕНКА ОТВЕТА ГАСТРОИНТЕСТИНАЛЬНОЙ СТРОМАЛЬНОЙ ОПУХОЛИ НА ТЕРАПИЮ
F.H. Wang и соавт. [63] провели построение радиомической номограммы для прогнозирования безрецидивной выживаемости у пациентов из группы среднего и высокого риска, получающих адъювантную химиотерапию. AUC модели для прогнозирования 3-, 5- и 7-летней безрецидивной выживаемости в обучающей — 0,80, 0,84, 0,76 соответственно и валидационной когортах — 0,78, 0,80, 0,76 соответственно. Построенная радиомическая номограмма была более точной, чем клинико-патологическая номограмма для прогнозирования безрецидивной выживаемости у пациентов с ГИСО [C-индекс: 0,864 (95% ДИ 0,817–0,911) против 0,733 (95% ДИ 0,675–0,791)].
W. Ao и соавт. [64] в своём исследовании построили комбинированную модель для прогнозирования риска рецидива/метастазирования (номограмма) на основе клинических и радиомических признаков, которая продемонстрировала высокую прогностическую ценность с AUC в обучающей когорте 0,833 и валидационной — 0,937.
ЗАКЛЮЧЕНИЕ
Несмотря на то что интерес к радиомике как инструменту для улучшения диагностики и стратификации риска злокачественности при ГИСО и других внутрибрюшных опухолях растёт, количество научных работ по этой теме всё ещё довольно невелико. Большинство исследований сосредоточено на отдельных аспектах применения радиомики, таких как оценка митотического индекса, прогнозирование риска или определение злокачественного потенциала ГИСО. Радиомика обладает огромным потенциалом в отношении улучшения результатов диагностики и лечения данных опухолей, однако необходимы дополнительные многоцентровые и мультидисциплинарные исследования для более широкой валидации и стандартизации радиомических подходов.
Радиомика позволяет оценить микроскопические изменения в тканях, которые невозможно увидеть при стандартной оценке лучевых изображений. Однако, несмотря на обнадёживающие результаты первоначальных исследований, необходимо проведение большего количества систематических научных работ с использованием унифицированных протоколов и алгоритмов с целью обобщения и подтверждения полученных данных. Важным направлением дальнейших исследований является разработка международных стандартов для радиомических исследований, что обеспечит возможность использования полученных результатов в различных клинических условиях, их сопоставления и обобщения.
Данный подход может также помочь в определении генетических и молекулярных особенностей опухолей, что является ключевым фактором в отношении принятия решений о необходимости и выборе тактики лечения. Возможности радиомики предоставляют более глубокие и детализированные данные о морфологии опухоли, что открывает перспективы для развития персонализированных подходов к лечению пациентов. Это позволяет различать ГИСО от других опухолей, а также более достоверно оценивать риск их злокачественности.
Таким образом, радиомика демонстрирует значительный потенциал в дифференциальной диагностике и стратификации риска ГИСО, превосходя классические подходы в диагностике. Однако для более широкого её применения с целью сравнения с другими внутрибрюшными опухолями необходимы дополнительные исследования, направленные на улучшение методологии, стандартизацию и внедрение радиомических моделей в клиническую практику.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Приложение 1. Резюме исследований по применению радиомики в диагностике гастроинтестинальных стромальных опухолей. doi: 10.17816/DD631596-4232090
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении поисковоаналитической работы.
Раскрытие интересов. Авторы заявляют об отсутствии отношений, деятельности и интересов (личных, профессиональных или финансовых), связанных с третьими лицами (коммерческими, некоммерческими, частными), интересы которых могут быть затронуты содержанием статьи, а также иных отношений, деятельности и интересов за последние три года, о которых необходимо сообщить.
Вклад авторов. Э.А. Мартиросян — обзор литературы, сбор и анализ литературных источников, написание и редактирование статьи; Г.Г. Кармазановский — концепция работы, утверждение окончательного варианта статьи, редактирование статьи, ответственность за целостность всех частей статьи; Е.В. Кондратьев, Е.А. Соколова, В.А. Нечаев — редактирование статьи; В.Н. Галкин, — утверждение окончательного варианта статьи; Е.С. Кузьмина — утверждение окончательного варианта статьи, консультативная поддержка; А.В. Глотов — консультативная поддержка. Все авторы одобрили рукопись (версию для публикации), а также согласились нести ответственность за все аспекты работы и гарантировали, что вопросы, связанные с точностью или добросовестностью любой части работы, будут должным образом рассмотрены и решены.
ADDITIONAL INFORMATION
Appendix 1. Summary of studies on the use of radiomics in the diagnosis of gastrointestinal stromal tumors. doi: 10.17816/DD631596-4232091
Funding source. This article was not supported by any external sources of funding.
Disclosure of interests. The authors declare that they have no relationships, activities or interests (personal, professional or financial) with third parties (commercial, non-commercial, private) whose interests may be affected by the content of the article, as well as no other relationships, activities or interests over the past three years that must be reported.
Authors’ contribution. E.A. Martirosyan — literature review, collection and analysis of literary sources, writing and editing the article; G.G. Karmazanovsky — research conception and design, approval of the final manuscript, editing the article, responsibility for the integrity of all parts of the article; E.V. Kondratyev, E.A. Sokolova, V.A. Nechaev — editing the article; V.N. Galkin — approval of the final manuscript; E.S. Kuzmina — approval of the final manuscript, advisory support; A.V. Glotov — advisory support. Thereby, all authors provided approval of the version to be published and agree to be accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
About the authors
Elina A. Martirosyan
A.V. Vishnevsky National Medical Research Center of Surgery; S.S. Yudin City Clinical Hospital
Author for correspondence.
Email: robatik2009@mail.ru
ORCID iD: 0000-0002-1854-9638
SPIN-code: 8006-8917
Russian Federation, Moscow; Moscow
Grigory G. Karmazanovsky
A.V. Vishnevsky National Medical Research Center of Surgery; The Russian National Research Medical University named N.I. Pirogov
Email: karmazanovsky@ixv.ru
ORCID iD: 0000-0002-9357-0998
SPIN-code: 5964-2369
MD, Dr. Sci. (Medicine), Professor, academician of the Russian Academy of Sciences
Russian Federation, Moscow; MoscowEvgeny V. Kondratyev
A.V. Vishnevsky National Medical Research Center of Surgery
Email: kondratev@ixv.ru
ORCID iD: 0000-0001-7070-3391
SPIN-code: 2702-6526
MD, Cand. Sci. (Medicine)
Russian Federation, MoscowElena A. Sokolova
A.V. Vishnevsky National Medical Research Center of Surgery
Email: elena83.sokolova@yandex.ru
ORCID iD: 0000-0002-5667-7833
SPIN-code: 9197-6568
Russian Federation, Moscow
Valentin A. Nechaev
S.S. Yudin City Clinical Hospital
Email: nechaevva1@zdrav.mos.ru
ORCID iD: 0000-0002-6716-5593
SPIN-code: 2527-0130
MD, Cand. Sci. (Medicine)
Russian Federation, MoscowEvgeniya S. Kuzmina
S.S. Yudin City Clinical Hospital
Email: kuz011@mail.ru
ORCID iD: 0009-0007-2856-5176
SPIN-code: 9668-5733
Russian Federation, Moscow
Vsevolod N. Galkin
S.S. Yudin City Clinical Hospital
Email: galkinvn2@zdrav.mos.ru
ORCID iD: 0000-0002-6619-6179
SPIN-code: 3148-4843
MD, Dr. Sci. (Medicine), Professor
Russian Federation, MoscowAndrey V. Glotov
A.V. Vishnevsky National Medical Research Center of Surgery
Email: andrew.glotov@mail.ru
ORCID iD: 0000-0002-6904-9318
SPIN-code: 4947-4382
Russian Federation, Moscow
References
- Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Seminars in Diagnostic Pathology. 2006;23(2):70–83. doi: 10.1053/j.semdp.2006.09.001
- Søreide K, Sandvik OM, Søreide JA, et al. Global epidemiology of gastrointestinal stromal tumours (GIST): a systematic review of population-based cohort studies. Cancer Epidemiology. 2016;40:39–46. doi: 10.1016/j.canep.2015.10.031
- Corless CL, Barnett CM, Heinrich MC. Gastrointestinal stromal tumours: origin and molecular oncology. Nature Reviews Cancer. 2011;11(12):865–878. doi: 10.1038/nrc3143
- Menge F, Jakob J, Kasper B, et al. Clinical presentation of gastrointestinal stromal tumors. Visceral Medicine. 2018;34(5):335–340. doi: 10.1159/000494303
- Korzheva IYu, Chernekhovskaya NE, Volova AV, et al. Gastrointestinal stromal tumors — treatment and diagnostic algorithm. Experimental and Clinical Gastroenterology. 2023;(5):108–113. doi: 10.31146/1682-8658-ecg-213-5-108-113 EDN: KEHFAO
- Fletcher CDM, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Human Pathology. 2002;33(5):459–465. doi: 10.1053/hupa.2002.123545
- Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Human Pathology. 2008;39(10):1411–1419. doi: 10.1016/j.humpath.2008.06.025
- Hong X, Choi H, Loyer EM, et al. Gastrointestinal stromal tumor: role of CT in diagnosis and in response evaluation and surveillance after treatment with Imatinib. RadioGraphics. 2006;26(2):481–495. doi: 10.1148/rg.262055097
- Inoue A, Ota S, Yamasaki M, et al. Gastrointestinal stromal tumors: a comprehensive radiological review. Japanese Journal of Radiology. 2022;40(11):1105–1120. doi: 10.1007/s11604-022-01305-x EDN: DJOHPD
- Dimitrakopoulou-Strauss A, Ronellenfitsch U, Cheng C, et al. Imaging therapy response of gastrointestinal stromal tumors (GIST) with FDG PET, CT and MRI: a systematic review. Clinical and Translational Imaging. 2017;5(3):183–197. doi: 10.1007/s40336-017-0229-8 EDN: YEZTPW
- Bano S, Puri SK, Upreti L, et al. Gastrointestinal stromal tumors (GISTS): an imaging perspective. Japanese Journal of Radiology. 2011;30(2):105–115. doi: 10.1007/s11604-011-0020-0 EDN: XAZRKK
- Horton KM, Juluru K, Montogomery E, Fishman EK. Computed tomography imaging of gastrointestinal stromal tumors with pathology correlation. Journal of Computer Assisted Tomography. 2004;28(6):811–817. doi: 10.1097/00004728-200411000-00014
- Martirosyan EA, Karmazanovsky GG, Sokolova EA, et al. Submucosal gastric lesions: a CECT-based tool for differential diagnosis between gastrointestinal stromal tumor and leiomyoma. Medical Visualization. 2020;24(4):27–41. doi: 10.24835/1607-0763-2020-4-27-41 EDN: NDYYRO
- Choi YR, Kim SH, Kim S-A, et al. Differentiation of large (≥5 cm) gastrointestinal stromal tumors from benign subepithelial tumors in the stomach: radiologists’ performance using CT. European Journal of Radiology. 2014;83(2):250–260. doi: 10.1016/j.ejrad.2013.10.028
- Xu JX, Ding QL, Lu YF, et al. A scoring model for radiologic diagnosis of gastric leiomyomas (GLMs) with contrast-enhanced computed tomography (CE-CT): differential diagnosis from gastrointestinal stromal tumors (GISTs). European Journal of Radiology. 2021;134:109395. doi: 10.1016/j.ejrad.2020.109395 EDN: UNDSRT
- Yan M, Liu Y, You H, et al. Differentiation of small gastrointestinal stromal tumor and gastric leiomyoma with contrast-enhanced CT. Journal of Healthcare Engineering. 2023;2023:1–6. doi: 10.1155/2023/6423617 EDN: YWPQDU
- Chen Z, Yang J, Sun J, Wang P. Gastric gastrointestinal stromal tumours (2–5 cm): correlation of CT features with malignancy and differential diagnosis. European Journal of Radiology. 2020;123:108783. doi: 10.1016/j.ejrad.2019.108783 EDN: PEEWLT
- Iannicelli E, Carbonetti F, Federici GF, et al. Evaluation of the relationships between computed tomography features, pathological findings, and prognostic risk assessment in gastrointestinal stromal tumors. Journal of Computer Assisted Tomography. 2017;41(2):271–278. doi: 10.1097/rct.0000000000000499
- Joensuu H, Fletcher C, Dimitrijevic S, et al. Management of malignant gastrointestinal stromal tumours. The Lancet Oncology. 2002;3(11):655–664. doi: 10.1016/s1470-2045(02)00899-9
- Hunt GC, Smith PP, Faigel DO. Yield of tissue sampling for submucosal lesions evaluated by EUS. Gastrointestinal Endoscopy. 2003;57(1):68–72. doi: 10.1067/mge.2003.34
- Park JE, Kim D, Kim HS, et al. Quality of science and reporting of radiomics in oncologic studies: Room for improvement according to radiomics quality score and TRIPOD statement. European Radiology. 2020;30(1):523–536. doi: 10.1007/s00330-019-06360-z EDN: RYQMNX
- Aerts HJWL, Velazquez ER, Leijenaar RT, et al. Corrigendum: Decoding tumour phenotype by noninvasive imaging using a quantitative radiomics approach. Nature Communications. 2014;5:4644. doi: 10.1038/ncomms5644
- Scapicchio C, Gabelloni M, Barucci A, et al. A deep look into radiomics. La radiologia medica. 2021;126(10):1296–1311. doi: 10.1007/s11547-021-01389-x EDN: CFTFXK
- Gillies RJ, Kinahan PE, Hricak H. Radiomics: images are more than pictures, they are data. Radiology. 2016;278(2):563–577. doi: 10.1148/radiol.2015151169
- Lambin P, Leijenaar RTH, Deist TM, et al. Radiomics: the bridge between medical imaging and personalized medicine. Nature Reviews Clinical Oncology. 2017;14(12):749–762. doi: 10.1038/nrclinonc.2017.141
- Yip SS, Aerts HJ. Applications and limitations of radiomics. Physics in Medicine and Biology. 2016;61(13):R150–R166. doi: 10.1088/0031-9155/61/13/R150
- Ganeshan B, Abaleke S, Young RC, et al. Texture analysis of non-small cell lung cancer on unenhanced computed tomography: initial evidence for a relationship with tumour glucose metabolism and stage. Cancer Imaging. 2010;10(1):137–143. doi: 10.1102/1470-7330.2010.0021
- Bachet JB, Hostein I, Le Cesne A, et al. Prognosis and predictive value of KIT exon 11 deletion in GISTs. British Journal of Cancer. 2009;101(1):7–11. doi: 10.1038/sj.bjc.6605117 EDN: NXUXXL
- Wang M, Xu J, Zhao W, et al. Prognostic value of mutational characteristics in gastrointestinal stromal tumors: a single-center experience in 275 cases. Medical Oncology. 2013;31(1):819. doi: 10.1007/s12032-013-0819-x EDN: AAFFTP
- Liu X, Yin Y, Wang X, et al. Gastrointestinal stromal tumors: associations between contrast-enhanced CT images and KIT exon 11 gene mutation. Annals of Translational Medicine. 2021;9(19):1496–1496. doi: 10.21037/atm-21-3811 EDN: XKKHIX
- Xu F, Ma X, Wang Y, et al. CT texture analysis can be a potential tool to differentiate gastrointestinal stromal tumors without KIT exon 11 mutation. European Journal of Radiology. 2018;107:90–97. doi: 10.1016/j.ejrad.2018.07.025
- Guo C, Zhou H, Chen X, Feng Z. Computed tomography texture-based models for predicting KIT exon 11 mutation of gastrointestinal stromal tumors. Heliyon. 2023;9(10):e20983. doi: 10.1016/j.heliyon.2023.e20983 EDN: OMPRCQ
- Zhang QW, Zhang RY, Yan ZB, et al. Personalized radiomics signature to screen for KIT-11 mutation genotypes among patients with gastrointestinal stromal tumors: a retrospective multicenter study. Journal of Translational Medicine. 2023;21(1):726. doi: 10.1186/s12967-023-04520-w EDN: MZEKJH
- Künstlinger H, Huss S, Merkelbach-Bruse S, et al. Gastrointestinal stromal tumors with KIT exon 9 mutations. American Journal of Surgical Pathology. 2013;37(11):1648–1659. doi: 10.1097/pas.0b013e3182986b88
- Gastrointestinal Stromal Tumor Meta-Analysis Group (MetaGIST). Comparison of two doses of Imatinib for the treatment of unresectable or metastatic gastrointestinal stromal tumors: a meta-analysis of 1 640 patients. Journal of Clinical Oncology. 2010;28(7):1247–1253. doi: 10.1200/JCO.2009.24.2099
- Wei Y, Lu Z, Ren Y. Predictive value of a radiomics nomogram model based on contrast-enhanced computed tomography for KIT exon 9 gene mutation in gastrointestinal stromal tumors. Technology in Cancer Research & Treatment. 2023;22:153303382311812. doi: 10.1177/15330338231181260 EDN: XTXBRZ
- Serrano C, Álvarez R, Carrasco JA, et al. SEOM-GEIS clinical guideline for gastrointestinal stromal tumors (2022). Clinical and Translational Oncology. 2023;25(9):2707–2717. doi: 10.1007/s12094-023-03177-7 EDN: AKQBYR
- Jakob J, Salameh R, Wichmann D, et al. Needle tract seeding and abdominal recurrence following pre-treatment biopsy of gastrointestinal stromal tumors (GIST): results of a systematic review. BMC Surgery. 2022;22(1):202. doi: 10.1186/s12893-022-01648-2 EDN: ACKOXX
- Zhang L, Kang L, Li G, et al. Computed tomography-based radiomics model for discriminating the risk stratification of gastrointestinal stromal tumors. La radiologia medica. 2020;125(5):465–473. doi: 10.1007/s11547-020-01138-6 EDN: QGFJNL
- Wang C, Li H, Jiaerken Y, et al. Building CT radiomics-based models for preoperatively predicting malignant potential and mitotic count of gastrointestinal stromal tumors. Translational Oncology. 2019;12(9):1229–1236. doi: 10.1016/j.tranon.2019.06.005
- Chen T, Ning Z, Xu L, et al. Radiomics nomogram for predicting the malignant potential of gastrointestinal stromal tumours preoperatively. European Radiology. 2019;29(3):1074–1082. doi: 10.1007/s00330-018-5629-2 EDN: RGIYYW
- Chu H, Pang P, He J, et al. Value of radiomics model based on enhanced computed tomography in risk grade prediction of gastrointestinal stromal tumors. Scientific Reports. 2021;11(1):12009. doi: 10.1038/s41598-021-91508-5 EDN: UBTXKP
- Zhou C, Duan X, Zhang X, et al. Predictive features of CT for risk stratifications in patients with primary gastrointestinal stromal tumour. European Radiology. 2015;26(9):3086–3093. doi: 10.1007/s00330-015-4172-7 EDN: YZBWHO
- O’Neill AC, Shinagare AB, Kurra V, et al. Assessment of metastatic risk of gastric gist based on treatment-naïve CT features. European Journal of Surgical Oncology (EJSO). 2016;42(8):1222–1228. doi: 10.1016/j.ejso.2016.03.032
- Li H, Ren G, Cai R, et al. A correlation research of ki67 index, CT features, and risk stratification in gastrointestinal stromal tumor. Cancer Medicine. 2018;7(9):4467–4474. doi: 10.1002/cam4.1737
- Yang L, Ma CF, Li Y, et al. Application of radiomics in predicting the preoperative risk stratification of gastric stromal tumors. Diagnostic and Interventional Radiology. 2022;28(6):532–539. doi: 10.5152/dir.2022.21033 EDN: DOWKAB
- Wang Y, Wang Y, Ren J, et al. Malignancy risk of gastrointestinal stromal tumors evaluated with noninvasive radiomics: a multi-center study. Frontiers in Oncology. 2022;12:966743. doi: 10.3389/fonc.2022.966743 EDN: DICNWT
- Lin JX, Wang FH, Wang ZK, et al. Prediction of the mitotic index and preoperative risk stratification of gastrointestinal stromal tumors with CT radiomic features. La radiologia medica. 2023;128(6):644–654. doi: 10.1007/s11547-023-01637-2 EDN: PBJVAL
- Wang P, Yan J, Qiu H, et al. A radiomics-clinical combined nomogram-based on non-enhanced CT for discriminating the risk stratification in GISTS. Journal of Cancer Research and Clinical Oncology. 2023;149(14):12993–13003. doi: 10.1007/s00432-023-05170-7 EDN: SCPQMA
- Fu J, Fang M, Dong D, et al. Heterogeneity of metastatic gastrointestinal stromal tumor on texture analysis: DWI texture as potential biomarker of overall survival. European Journal of Radiology. 2020;125:108825. doi: 10.1016/j.ejrad.2020.108825 EDN: QLLUWS
- Yang L, Zheng T, Dong Y, et al. MRI texture-based models for predicting mitotic index and risk classification of gastrointestinal stromal tumors. Journal of Magnetic Resonance Imaging. 2021;53(4):1054–1065. doi: 10.1002/jmri.27390 EDN: CHGAIP
- Mao H, Zhang B, Zou M, et al. MRI-based Radiomics models for predicting risk classification of gastrointestinal stromal tumors. Frontiers in Oncology. 2021;11:631927. doi: 10.3389/fonc.2021.631927 EDN: DHDMQA
- Yang L, Du D, Zheng T, et al. Deep learning and radiomics to predict the mitotic index of gastrointestinal stromal tumors based on multiparametric MRI. Frontiers in Oncology. 2022;12:948557. doi: 10.3389/fonc.2022.948557 EDN: NGMQKM
- Zhuo M, Guo J, Tang Y, et al. Ultrasound radiomics model-based nomogram for predicting the risk stratification of gastrointestinal stromal tumors. Frontiers in Oncology. 2022;12:905036. doi: 10.3389/fonc.2022.905036 EDN: TZAWCU
- Jia X, Wan L, Chen X, et al. Risk stratification for 1- to 2-cm gastric gastrointestinal stromal tumors: visual assessment of CT and EUS high-risk features versus CT radiomics analysis. European Radiology. 2022;33(4):2768–2778. doi: 10.1007/s00330-022-09228-x EDN: TJNIGC
- Seidal T., Edvardsson H. Expression of c-KIT (CD117) and KI67 provides information about the possible cell of origin and clinical course of gastrointestinal stromal tumours. Histopathology. 1999;34(5):416–424. doi: 10.1046/j.1365-2559.1999.00643.x
- Li J, Wang AR, Chen XD, et al. Ki67 for evaluating the prognosis of gastrointestinal stromal tumors: a systematic review and meta-analysis. Oncology Letters. 2022;23(6):189. doi: 10.3892/ol.2022.13309 EDN: YOADXG
- Zhang Q, Gao Y, Zhang R, et al. Personalized CT-based radiomics nomogram preoperative predicting ki-67 expression in gastrointestinal stromal tumors: a multicenter development and validation cohort. Clinical and Translational Medicine. 2020;9(1):12. doi: 10.1186/s40169-020-0263-4 EDN: GQEWHE
- Feng Q, Tang B, Zhang Y, Liu X. Prediction of the ki-67 expression level and prognosis of gastrointestinal stromal tumors based on CT radiomics nomogram. International Journal of Computer Assisted Radiology and Surgery. 2022;17(6):1167–1175. doi: 10.1007/s11548-022-02575-6 EDN: WMCKNC
- Liu M, Bian J. Radiomics signatures based on contrast-enhanced CT for preoperative prediction of the ki-67 proliferation state in gastrointestinal stromal tumors. Japanese Journal of Radiology. 2023;41(7):741–751. doi: 10.1007/s11604-023-01391-5 EDN: MGYVDQ
- Zhang XD, Zhang L, Gong T, et al. A combined radiomic model distinguishing GISTs from leiomyomas and schwannomas in the stomach based on endoscopic ultrasonography images. J Appl Clin Med Phys. 2023;24(7):e14023. doi: 10.1002/acm2.14023 EDN: GVPUPG
- Starmans MP, Timbergen MJ, Vos M, et al. Differential diagnosis and molecular stratification of gastrointestinal stromal tumors on CT images using a radiomics approach. Journal of Digital Imaging. 2022;35(2):127–136. doi: 10.1007/s10278-022-00590-2 EDN: FZSWKG
- Wang FH, Zheng HL, Li JT, et al. Prediction of recurrence-free survival and adjuvant therapy benefit in patients with gastrointestinal stromal tumors based on radiomics features. La radiologia medica. 2022;127(10):1085–1097. doi: 10.1007/s11547-022-01549-7 EDN: MDONPE
- Ao W, Cheng G, Lin B, et al. A novel CT-based radiomic nomogram for predicting the recurrence and metastasis of gastric stromal tumors. American journal of cancer research. 2021;11(6):3123–3134.
Supplementary files