Imaging techniques in diagnosing acute pulmonary thromboembolism
- Authors: Oganesyan A.A.1, Sinitsyn V.E.2, Mershina E.A.2, Pershina E.S.1
-
Affiliations:
- Pirogov Municipal Clinical Hospital No. 1
- Lomonosov Moscow State University
- Issue: Vol 6, No 1 (2025)
- Pages: 130-142
- Section: Reviews
- Submitted: 27.07.2024
- Accepted: 21.11.2024
- Published: 25.03.2025
- URL: https://jdigitaldiagnostics.com/DD/article/view/634639
- DOI: https://doi.org/10.17816/DD634639
- ID: 634639
Cite item
Full Text
Abstract
Pulmonary thromboembolism is the occlusion of the pulmonary arteries by thrombi of any origin, which commonly originates in the large veins of the legs and pelvis. This article provides an overview of existing imaging techniques used in diagnosing this pathology. A review of scientific studies by Russian and international authors is provided. Moreover, the article discusses diagnostic algorithms and the characteristics and challenges of risk stratification in patients with suspected acute pulmonary thromboembolism. The key imaging aspects for this pathology and criteria for assessing its severity are highlighted. The contribution of relatively new perfusion tomography methods, such as dual-energy and subtraction computed tomography pulmonary angiography, and magnetic resonance pulmonary angiography is demonstrated. Despite the presence of established methods for diagnosing acute pulmonary embolism, there is growing interest in additional and alternative imaging techniques, which have been more integrated into routine clinical practice. Special attention is given to subtraction computed tomography pulmonary angiography, which has the ability to generate iodine maps for indirect perfusion assessment, and its application in clinical practice. The feasibility of using various imaging techniques in diagnosing acute pulmonary thromboembolism is discussed, highlighting their advantages and prospects in emergency medical care.
Full Text
ВВЕДЕНИЕ
Несмотря на разнообразие методов лечения, смертность при тромбоэмболии лёгочной артерии (ТЭЛА) в мире составляет около 30%. В Соединённых Штатах Америки от 100 до 180 тыс. человек ежегодно умирают от данной патологии и её осложнений [1]. Согласно международному регистру ТЭЛА (International Cooperative Pulmonary Embolism Registry), общий коэффициент смертности пациентов с данной патологией в течение 3 мес. составляет 45,1% [2], при этом смертность среди пациентов с ТЭЛА высокого риска — 52,4, а у остальных — 14,7% [3]. С помощью адекватной лечебной тактики возможно снижать летальность до 2–8% [4]. В 95% случаев причиной ТЭЛА является тромбоз глубоких вен нижних конечностей, в 2% — тромбозы в системе верхней полой вены [5].
По данным Фремингемского исследования сердца (The Framingham Heart Study), на долю ТЭЛА отводят 15,6% случаев всех внутригоспитальных смертей. Необходимо отметить, что в указанном исследовании высокая летальность на госпитальном этапе отмечена среди пациентов стационаров терапевтического профиля — 82% случаев фатальных ТЭЛА, при этом на пациентов хирургического профиля — 18% [6]. М.Б. Суханова и соавт. [7] провели исследование, результаты которого показали, что причиной смерти при аутопсии в многопрофильных стационарах является ТЭЛА в 7,2% случаев.
В России её распространённость варьирует от 35 до 40 случаев на 100 тыс. человек, при этом смертность от ТЭЛА в течение 30 дней после развития тромбоза глубоких вен достигает 6%. Кроме того, развитие тяжёлой хронической постэмболической лёгочной гипертензии (ХПЭЛГ) в течение 5 лет приводит к смерти 10–15% пациентов, перенёсших массивную ТЭЛА [8].
По данным А.Л. Вёрткина и соавт. [1], ТЭЛА диагностируют при аутопсии в 14% случаев, тем не менее почти у каждого десятого пациента данный диагноз не верифицирован прижизненно. ТЭЛА составляет более 15% летальных исходов и является самой частой причиной расхождения диагнозов.
Следует отметить, что ТЭЛА считают универсальным осложнением различных по этиологии и характеру заболеваний. Именно поэтому ранняя постановка диагноза и своевременно начатое лечение крайне важны для прогноза [9]. Более того, у трети пациентов, перенёсших ТЭЛА, в течение 10 лет наблюдают рецидивы заболевания [10].
Не стоит забывать, что прижизненный диагноз ТЭЛА устанавливают в <70% случаев, что повышает роль настороженности и своевременного использования диагностических алгоритмов [1, 11].
ДИАГНОСТИЧЕСКИЙ АЛГОРИТМ ПРИ ПОДОЗРЕНИИ НА ОСТРУЮ ТРОМБОЭМБОЛИЮ ЛЁГОЧНОЙ АРТЕРИИ
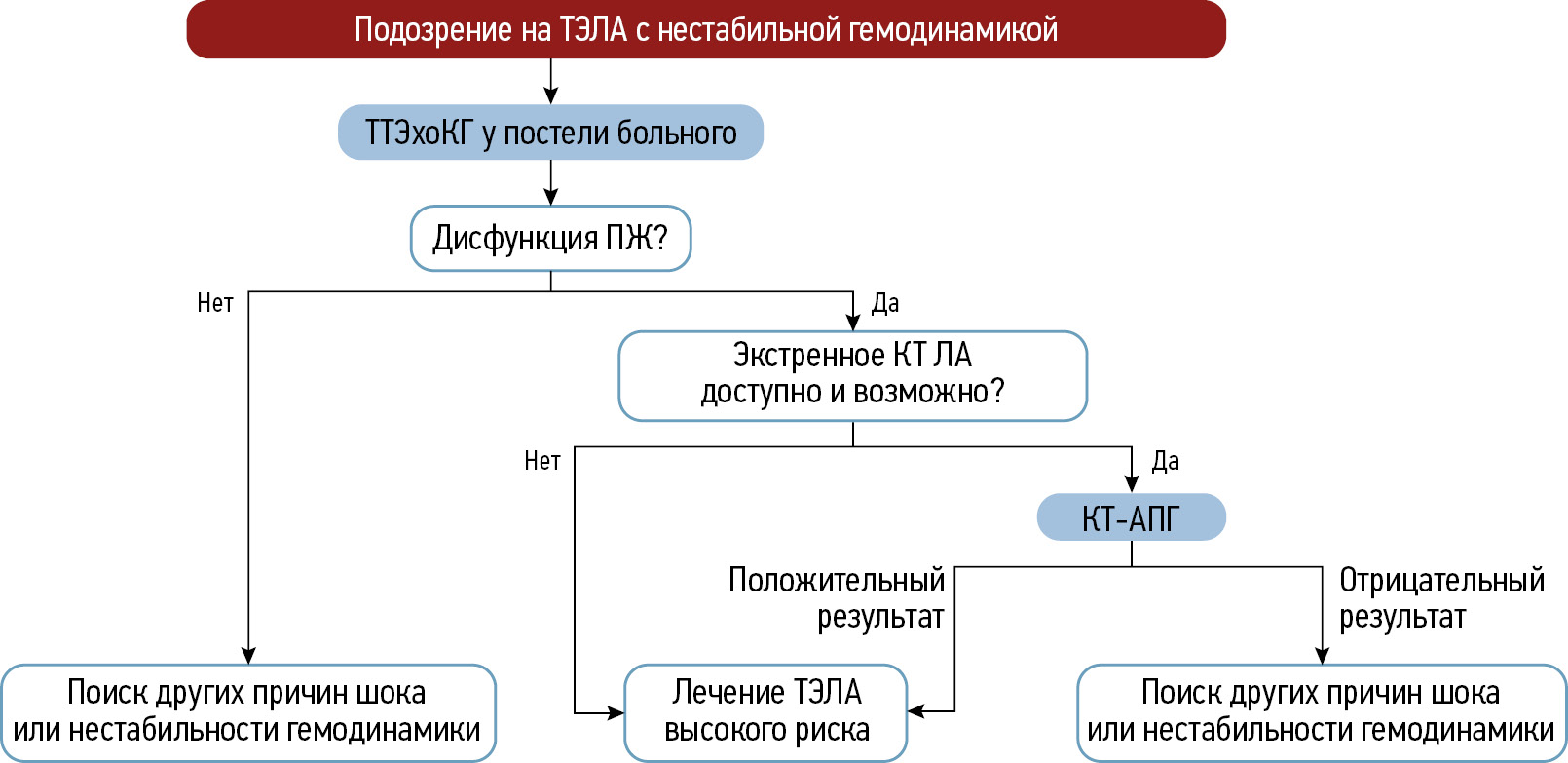
Наиболее распространённый алгоритм ведения пациентов с подозрением на острую ТЭЛА опубликован в 2019 году Европейским обществом кардиологов (ЕОК). Её клинические проявления неспецифичны и могут маскироваться большим количеством заболеваний. Диагностический алгоритм рекомендовано начинать с оценки клинической вероятности ТЭЛА с использованием специальных шкал, учитывающих клинику (одышка, кашель, хрипы и др.) и наличие факторов риска повышенного тромбообразования (возраст, хирургическое вмешательство, анамнез и т. д.). Наибольшее распространение в клинической практике получили шкалы Wells и Geneva в виде двух- или трёхуровневых схем — вероятная и маловероятная либо ТЭЛА низкой, промежуточной и высокой вероятности. Согласно указанным шкалам, к категории высокой степени риска массивной ТЭЛА относят пациентов с нестабильной гемодинамикой и признаками шока, при котором предусмотрен алгоритм диагностики в соответствии с рекомендациями ЕОК (рис. 1). При отсутствии признаков нестабильной гемодинамики основным моментом выбора диагностической тактики является определение клинической вероятности ТЭЛА (рис. 2) [12].
Рис. 1. Диагностический алгоритм для пациентов с подозрением на тромбоэмболию лёгочной артерии высокого риска с признаками нестабильной гемодинамики. ТЭЛА — тромбоэмболия лёгочной артерии; ТТЭхоКГ — трансторакальная эхокардиография; ПЖ — правый желудочек; КТ — компьютерная томография; ЛА — лёгочная артерия; КТ-АПГ — компьютерно-томографическая ангиопульмонография. Адаптировано из [12]. Публикуется с разрешения правообладателя.
Рис. 2. Диагностический алгоритм для пациентов с подозрением на тромбоэмболию лёгочной артерии высокого риска без признаков нестабильной гемодинамики. ТЭЛА — тромбоэмболия лёгочной артерии; КТ-АПГ — компьютерно-томографическая ангиопульмонография. Адаптировано из [12]. Публикуется с разрешения правообладателя.
E. Ceriani и соавт. [13] провели метаанализ и установили, что процент пациентов с ТЭЛА в группе низкой вероятности ~10, промежуточной — 30, высокой — 65%. При использовании двухуровневой шкалы данный показатель в группах высокого и низкого риска составляет ~12%. Несмотря на то что шкалы Geneva и Wells значительно облегчают диагностику ТЭЛА, важной проблемой остаётся недооценка диагноза у каждого 8–10 пациента [14]. В группе высокого риска целесообразно подтверждать диагноз с помощью лучевых методов диагностики, однако в случае критического состояния пациента решение о начале реперфузионной терапии, заключающейся в тромболизисе, интервенционных и хирургических методах лечения, можно принять на основании косвенных признаков, а именно — признаков перегрузки правых отделов сердца по данным эхокардиографии (ЭхоКГ) [12].
У пациентов с низкой и промежуточной вероятностью ТЭЛА следующим этапом диагностического алгоритма является определение концентрации D-димера — продукта распада фибрина. Специфичность данного анализа при подозрении на ТЭЛА снижается с возрастом и составляет менее 10% у пациентов старше 80 лет [15]. Именно поэтому прогностическая роль повышенного содержания D-димера низкая, а его высокое значение не подтверждает диагноз ТЭЛА. Увеличение концентрации D-димера можно наблюдать не только при тромбозе глубоких вен и ТЭЛА, но и при ряде других состояний, таких как инфекционные и воспалительные процессы, геморрагии, что указывает на низкую специфичность данного анализа [16]. Таким образом, в случае повышенной концентрации D-димера, а также высокой клинической вероятности ТЭЛА, даже при нормальном содержании D-димера, необходимо подтверждать диагноз.
Показатели дисфункции правых отделов сердца и стратификация риска
Основной причиной смерти при ТЭЛА является острая сердечная недостаточность, развившаяся вследствие декомпенсации правых отделов сердца, поэтому стратификация риска неблагоприятного прогноза основана на оценке таких критериев, как гемодинамический статус, дисфункция камер сердца либо степень обструкции лёгочной артерии по данным компьютерно-томографической ангиографии [17]. Для упрощения оценки риска неблагоприятного исхода ТЭЛА разработаны такие шкалы, как Qanadli [18], PESI (Pulmonary Embolism Severity Index), sPESI (simplified Pulmonary Embolism Severity Index) и др. [19].
Острая недостаточность правого желудочка сердца является предиктором высокой вероятности ранней смерти и требует безотлагательных терапевтических мероприятий. У пациентов с массивной ТЭЛА, острой недостаточностью правого желудочка и артериальной гипотензией летальность достигает ~32% [7].
При развитии острой недостаточности правого желудочка с целью выявления пациентов с низким и промежуточным риском неблагоприятного исхода используют шкалы PESI и sPESI [19]. Тем не менее следует помнить о трудностях при установлении промежуточного риска в условиях нормотензии.
Основным методом диагностики недостаточности правых отделов сердца является ЭхоКГ, результаты которой демонстрируют признаки дилатации правого желудочка у пациентов с ТЭЛА в ~25% случаев [20]. Среди преимуществ данного метода выделяют следующие:
- быстрота проведения;
- отсутствие требований в отношении специальной подготовки пациента;
- возможность многократного повторного проведения у постели пациента.
Существенным недостатком считают зависимость от специалиста, проводящего исследование, что часто обусловливает неоднозначные результаты и трудности в дифференциальной диагностике поражений правого желудочка, например вследствие инфаркта миокарда. Таким образом, применение ЭхоКГ в условиях невысокого риска ТЭЛА не позволяет исключить диагноз. С другой стороны, при наличии признаков нестабильности гемодинамики, что подразумевает высокий риск ТЭЛА, данный метод помогает уточнить характер изменений правых отделов сердца и провести дифференциальную диагностику с тампонадой сердца, диссекцией и гиповолемическим шоком [20].
МЕТОДЫ ДИАГНОСТИКИ ТРОМБОЭМБОЛИИ ЛЁГОЧНОЙ АРТЕРИИ
Компьютерно-томографическая ангиопульмонография
Компьютерно-томографическая ангиография лёгочной артерии (КТ-ангиопульмонография) является «золотым стандартом» диагностики ТЭЛА [21]. По данным исследования PIOPED II (Prospective Investigation On Pulmonary Embolism Diagnosis II), чувствительность и специфичность метода составляет 83 и 96% соответственно [22]. В случае высокой вероятности ТЭЛА, повышенной концентрации D-димера или нестабильной гемодинамики необходимо проводить КТ-ангиопульмонографию в целях подтверждения либо исключения данного диагноза. Её применение относят к классу рекомендаций I1 с уровнем доказательности А2 [23–30].
Данный метод диагностики позволяет судить о характере структурных изменений в лёгких и распространённости тромботического поражения, но не предоставляет информации о перфузионных нарушениях [12].
КТ-ангиопульмонографию считают важным методом диагностики нарушений гемодинамики при острой ТЭЛА с целью определения пациентов с наличием или отсутствием угрозы смертельного исхода. Классификация состояния гемодинамики при ТЭЛА основана на наличии признаков недостаточности правых отделов сердца, количественном определении плотности тромба и измерении лёгочной перфузии [6, 31, 32].
Существуют трудности в диагностике ТЭЛА при обструкции средних и мелких ветвей лёгочной артерии. Именно поэтому в данной ситуации наблюдают позднюю госпитализацию и отложенное начало терапии [33].
КТ-ангиопульмонография является методом выбора в дифференциальной диагностике ТЭЛА, поскольку позволяет не только исключить или подтвердить её наличие с одновременной оценкой объёма тромбоэмболического поражения сосудистого русла и характера его осложнений, но и выявить другие заболевания, имеющие сходные с ТЭЛА проявления [34]. Согласно результатам двух крупных клинических исследований, изображения, полученные с помощью КТ-ангиопульмонографии, с низкими техническими характеристиками вследствие артефактов, обусловленных движением пациента или недостаточным контрастированием лёгочных сосудов, отмечают в 5–8% случаев [35, 36]. КТ-ангиопульмонография теряет свою диагностическую ценность по мере уменьшения калибра поражённых лёгочных сосудов [37, 38]. Более того, в диагностике перенесённой ТЭЛА в позднем периоде и такого осложнения, как ХПЭЛГ, для которого в ряде случаев характерно смещение тромботических масс более дистально, её роль ещё ниже.
Вентиляционно-перфузионная сцинтиграфия лёгких
Вентиляционно-перфузионная сцинтиграфия лёгких — метод, сочетающий оценку микроциркуляторного русла с предварительной оценкой бронхоальвеолярного комплекса лёгких и клинической вероятностью ТЭЛА. Вентиляционная сцинтиграфия отражает региональную и сегментарную вентиляцию и её проводят с применением вдыхаемого аэрозоля, содержащего технеций (100 МБк3 99mTc-аэрозоль), и дальнейшим немедленным сканированием. Перфузионная сцинтиграфия основана на микроэмболизации лёгочного микроциркуляторного русла радиоактивными соединениями на основе 99mTc, что предоставляет возможность определять бассейн окклюзированной лёгочной артерии любого калибра. Совместная оценка вентиляционной и перфузионной способностей лёгких помогает провести дифференциальную диагностику ТЭЛА и бронхогенных изменений лёгких, в частности лёгочного фиброза и пневмонии [39].
В связи со сложностью и трудоёмкостью методики часто используют редуцированный вариант теста в виде отдельного перфузионного исследования без ингаляционного введения препарата.
Преимуществом вентеляционно-перфузионной сцинтиграфии является высокая прогностическая ценность отрицательных и положительных результатов у пациентов с низкой и высокой вероятностью ТЭЛА соответственно [40]. Проведение вентиляционного сканирования обусловлено повышенной специфичностью: при острой ТЭЛА наблюдают нормальную вентиляцию в областях с нарушением перфузии [41, 42]. Однако возникают трудности при использовании данного исследования в ургентных ситуациях, поскольку его длительность достигает ~20 минут.
Немаловажным является отсутствие единого принятого подхода к оценке и трактовке результатов. Исследование актуально в случае высокой вероятности ТЭЛА и наличия противопоказаний к проведению КТ-ангиопульмонографии (например, анафилактические реакции на контрастные агенты в анамнезе, значительное снижение скорости клубочковой фильтрации вне критических состояний) либо при повышении содержания D-димера. Данный метод обладает диагностической ценностью у 30–50% пациентов с подозрением на ТЭЛА и его считают «золотым стандартом» в оценке перфузии лёгких, а также для многократного контроля лечения в силу малой эффективной дозы излучения [20]. Известно, что у большей части пациентов с предполагаемой ТЭЛА результаты сцинтиграфии соответствуют промежуточной или низкой вероятности, что не позволяет ни исключить, ни подтвердить данный диагноз в реальной клинической практике и требует проведения дальнейших диагностических мероприятий [9].
Двухэнергетичекая компьютерно-томографическая ангиопульмонография
Концепция использования множественных энергетических уровней в компьютерной томографии предложена более 40 лет назад, но в связи с отсутствием подходящего технического оснащения её долгое время не реализовывали на практике [44].
Визуализация с помощью двухэнергетической КТ-ангиопульмонографии позволяет идентифицировать ткани на основе их различной способности к поглощению рентгеновских лучей. Использование данного метода даёт возможность одновременно получить изображения с двойной энергией в одной и той же фазе контрастирования. Суть метода состоит в сканировании при разном напряжении тока на трубке (60–90 кВ, 140–160 кВ) в условиях внутривенного контрастирования с дальнейшим построением перфузионных карт [28].
Следует отметить, что изображения, полученные с помощью двухэнергетической КТ-ангиопульмонографии, не предоставляют данные о динамической перфузии, поскольку отображают распределение йода только в определённое время (йодные карты лёгочной микроциркуляции) [44]. Перфузионные изображения, полученные с помощью данного метода, хорошо коррелируют с данными сцинтиграфии и позволяют визуализировать дефекты перфузии (рис. 3) [45–47].
Рис. 3. Цветные йодные карты перфузии, полученные с помощью двухэнергетической компьютерно-томографической ангиопульмонографии: a — дефекты перфузии нижней доли справа, локальный дефект перфузии нижней доли слева (белые стрелки); b — дефект перфузии средней доли, участок гипоперфузии S2 и S6 (белые стрелки). Публикуется с разрешения правообладателя. © ФГАУ «Лечебно-реабилитационный центр», 2018.
Йодные карты предоставляют возможность дифференцировать физиологические и патологические нарушения перфузии. Так, при гемодинамически значимой обструкции сосуда на йодных картах определяют дефекты перфузии клиновидной формы. Физиологическое снижение перфузии наблюдают при гравитационном распределении кровотока, вдоль междолевых листков плевры, в зонах артефактов от контрастного препарата в подключичной и верхней полой венах, а также в областях экскурсии диафрагмы и движения сердца. В данных ситуациях форма дефектов перфузии будет линейной или серповидной [27].
Важной особенностью двухэнергетической КТ-ангиопульмонографии является способность демонстрировать зоны гипоперфузии при отсутствии инфарктпневмонии, что выгодно отличает данный метод от традиционной компьютерной томографии. При инфаркте в периферических отделах определяют зоны отсутствия контрастирования клиновидной формы с уплотнением лёгкого, визуализируемые в лёгочном окне. Участки сниженного контрастирования на перфузионных изображениях при ТЭЛА без развития инфаркт-пневмонии определяют без сопутствующего уплотнения в лёгочном окне [28].
Относительно редким осложнением ТЭЛА является развитие ХПЭЛГ. Выявление соответствия или несоответствия дефектов перфузии локализации окклюзионностенотического поражения лёгочной артерии — один из важнейших вопросов при принятии решения об оперативном и интервенционном лечении пациентов с данным осложнением [48].
Существуют немногочисленные работы, в которых с целью предупреждения двусмысленности заключения при сравнении результатов, полученных с помощью двух-энергетической и традиционной КТ-ангиопульмонографии, предварительно вводили аэрозоль ксенона [26, 49]. Перед выполнением исследования пациенты предварительно вдыхали 30% стабильный ксенон на протяжении 80 с, а спустя 5 минут осуществляли повторное сканирование. Как и при проведении венциляционноперфузионной сцинтиграфии, ТЭЛА подтверждали в случае несоответствия перфузионных и вентиляционных изображений. Подобная оценка показала более высокую эффективность по сравнению с традиционной методикой КТ-ангиопульмонографии [49].
Таким образом, возможно одновременно оценивать изменения сосудистого русла и лёгочной перфузии с сопоставлением анатомо-функциональной картины [50]. Следует ещё раз отметить, что чувствительность и специфичность двухэнергетической КТ-ангиопульмонографии выше, чем традиционной [49, 51].
Субтракционная компьютерно-томографическая ангиопульмонография
Ещё одним методом оценки микроциркуляторного русла является субтракционная КТ-ангиопульмонография с дальнейшим построением йодных карт. Метод основан на вычитании неконтрастных изображений из изображений с контрастированием, что позволяет визуализировать сосудистую систему лёгких. Сканирование пациента проводят два раза с помощью одноэнергетической компьютерной томографии: первое — нативное; второе — с введением контрастного препарата. Лучевая нагрузка составляет в среднем 11,2±4,7 мГр [52]. С целью снижения лучевой нагрузки первое сканирование можно проводить в низкодозовом режиме. Субтракционные йодные изображения позволяют осуществлять диагностику ХПЭЛГ в некоторых медицинских учреждениях стран Европы и Азии. L. Shahin и cоавт. [52] утверждают, что с их помощью возможно определить йод в паренхиме с большей чувствительностью, чем при двухэнергетическом сканировании. Цветовая шкала на йодных субтракционных изображениях имеет диапазон по умолчанию от 0 до 100 HU4. Чёрные участки соответствуют отсутствию перфузии, а тёмносиние — снижению перфузии (рис. 4).
Рис. 4. Перфузионные йодные карты, полученные с помощью субтракционной компьютерно-томографической ангиопульмонографии: a — клиновидные дефекты перфузии во фронтальной проекции (белые стрелки); b — клиновидный дефект перфузии в сагиттальной проекции (белые стрелки). Публикуется с разрешения правообладателя. © ФГАУ «Лечебно-реабилитационный центр», 2018.
Хорошие результаты получены в научном исследовании при сравнении мультидетекторной и субтракционной КТ-ангиопульмонографии с получением йодных изображений, при этом за референсные значения принимали результаты сцинтиграфии лёгких [25]. Субтракционные изображения показали более высокие диагностические характеристики (чувствительность и специфичность — 95 и 84% соответственно) по сравнению с одноэнергетической компьютерной томографией без оценки перфузионных изображений (чувствительность и специфичность — 65 и 61% соответственно) [52].
В большинстве случаев доля ложноположительных и ложноотрицательных результатов составляет ~2% общего количества исследований. Согласно ретроспективным данным, основная причина несоответствия связана с различием в интерпретации участков гипоперфузии и их локализации [25]. Артефакты от контрастированной верхней полой вены и движений пациента визуально определяют как дефекты перфузии. Во фронтальной проекции они выглядят как чёрные радиальные либо горизонтальные полосы, распространяющиеся также на другие структуры — средостение, рёбра и т. д., помимо лёгочной паренхимы.
На изображениях с выделением сосудов отчётливо визуализируются лёгочные артерии с высокой контрастностью и меньшим шумом, что позволяет идентифицировать артерии мелкого калибра. На реконструкциях с выделением лёгочной паренхимы сосуды определяют как тёмные участки, соответствующие бассейнам окклюзированных артерий (рис. 5).
Рис. 5. Субтракционные изображения паренхимы и сосудов: a — тёмный участок в правом лёгком, визуализируемый в режиме Sub-Lung, соответствует пониженной перфузии в лёгких; b — нитевидные лёгочные артерии, визуализируемые в режиме Sub-VSL. Публикуется с разрешения правообладателя. © ФГАУ «Лечебно-реабилитационный центр», 2018.
Магнитно-резонансная томография
Возможности магнитно-резонансной томографии необоснованно редко используют у пациентов с ТЭЛА. Данный метод позволяет оценивать морфологию и функцию сердца, а также неинвазивно измерить кровоток в лёгочных сосудах за счёт фазово-контрастного метода без использования контрастного препарата.
Магнитно-резонансная ангиопульмонография (МР-ангиопульмонография) особенно ценна у пациентов с ХПЭЛГ [19]. Некоторые трудности при проведении исследования вызывают артефакты от дыхания, движения пациента, неравномерного потока крови, влекущие за собой необходимость повторного сканирования. МР-ангиопульмонографию следует проводить в профильных центрах, где существует опыт успешного выполнения данного исследования и анализа полученных результатов. N. Tsuchiya и соавт. [53] проводили сравнительную оценку диагностической точности МР-ангиопульмонографии и мультиспиральной компьютерной томографии и получили схожие данные в отношении эффективности. Особый интерес представляет применение данного метода у беременных и пациентов с непереносимостью йодных контрастных препаратов. Чувствительность магнитно-резонансной томографии с контрастированием и синхронизацией дыхания составляет 73%, в то же время чувствительность и специфичность бесконтрастной МР-ангиопульмонографии — 67 и 100% соответственно [54].
При тромботическом повреждении артерий наибольшие трудности возникают при визуализации дистальных отделов, пристеночного и фрагментарного расположения. С помощью динамического контрастирования возможна оценка микроциркуляторного русла (рис. 6). Бассейн сосудистого русла тромботически поражённой артерии представлен в виде участка с обеднением сосудистого рисунка пониженной интенсивности. Существуют работы, подтверждающие успешное применение МР-ангиопульмонографии в диагностике ТЭЛА у пациентов с промежуточным и высоким риском развития ТЭЛА по данным ЭхоКГ [53, 54]. Таким образом, проведение МР-ангиопульмонографии позволяет избегать применение вентиляционно-перфузионной сцинтиграфии, а также йодной и лучевой нагрузки.
Рис. 6. Результаты магнитно-резонансной ангио-пульмонографии: на изображении во фронтальной проекции определяются расширенные и деформированные лёгочные артерии с пристеночными дефектами контрастирования. Публикуется с разрешения правообладателя. © ФГАУ «Лечебно-реабилитационный центр», 2018.
ЗАКЛЮЧЕНИЕ
ТЭЛА является грозным и жизнеугрожающим заболеванием в клинической практике. Разработаны алгоритмы, позволяющие подтверждать диагноз и своевременно выполнять лечебные мероприятия. Следует отметить, что основным методом установления диагноза является КТ-ангиопульмонография. Тем не менее её возможности имеют ряд ограничений:
- противопоказания к использованию контрастного препарата;
- ТЭЛА мелких ветвей;
- отсроченная диагностика, в том числе развитие ХПЭЛГ.
В этом случае планарная вентиляцинно-перфузионная сцинтиграфия остаётся основным методом для визуализации ХПЭЛГ, обладая высокой чувствительностью и специфичностью. Однако ограниченная доступность оборудования и квалифицированного персонала в ряде лечебных учреждений может затруднить использование данного метода.
Важно также отметить, что существующие алгоритмы не всегда учитывают различия в оснащённости медицинских учреждений России. Именно поэтому они могут испытывать трудности с реализацией рекомендованных диагностических методов. В таких случаях необходимо направлять пациентов в специализированные экспертные центры, где доступны более современные методы диагностики и высококвалифицированные специалисты.
Современные лучевые методы диагностики, в том числе двухэнергетическая и субтракционная КТ-ангиопульмонография, а также МР-ангиопульмонография, способны расширить возможности выявления ТЭЛА. Однако не стоит забывать, что доступность данных методов варьирует в зависимости от региона и конкретного медицинского учреждения. Именно поэтому возникает необходимость в адаптации существующих алгоритмов с учётом реальной оснащённости лечебно-профилактических учреждений.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении поисковоаналитической работы.
Раскрытие интересов. Авторы заявляют об отсутствии отношений, деятельности и интересов (личных, профессиональных или финансовых), связанных с третьими лицами (коммерческими, некоммерческими, частными), интересы которых могут быть затронуты содержанием статьи, а также иных отношений, деятельности и интересов за последние три года, о которых необходимо сообщить.
Вклад авторов. А.А. Оганесян, Е.С. Першина — сбор и анализ литературных источников, написание и редактирование статьи; В.Е. Синицын — анализ литературных источников, подготовка и написание текста статьи; Е.А. Мершина — сбор и анализ литературных источников, подготовка и написание текста статьи. Все авторы одобрили рукопись (версию для публикации), а также согласились нести ответственность за все аспекты работы и гарантировали, что вопросы, связанные с точностью или добросовестностью любой части работы, будут должным образом рассмотрены и решены.
ADDITIONAL INFORMATION
Funding source. This article was not supported by any external sources of funding.
Disclosure of interests. The authors declare that they have no relationships, activities or interests (personal, professional or financial) with third parties (commercial, non-commercial, private) whose interests may be affected by the content of the article, as well as no other relationships, activities or interests over the past three years that must be reported.
Authors’ contribution. А.А Oganesyan, E.S. Pershina: collection and analysis of literary sources, writing and editing the article; V.E. Sinitsyn: analysis of literary sources, preparation and writing the article; E.A. Mershina: collection and analysis of literary sources, preparation and writing the article. Thereby, all authors provided approval of the version to be published and agree to be accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
1 Класс рекомендаций I — доказано, что данный вид лечения или диагностики полезен и эффективен.
2 Уровень доказательности A — данные многочисленных рандомизированных клинических исследований или метаанализов.
3 Мегабеккерель (МБк) — единица измерения радиоактивности в Международной системе единиц, кратная беккерелю.
4 Единица Хаунсфилда (HU) — единица измерения количественной шкалы рентгеновской плотности (радиоденсивности).
About the authors
Anait A. Oganesyan
Pirogov Municipal Clinical Hospital No. 1
Author for correspondence.
Email: talilen@mail.ru
ORCID iD: 0000-0003-1896-023X
SPIN-code: 6531-2957
Russian Federation, Moscow
Valentin E. Sinitsyn
Lomonosov Moscow State University
Email: vsini@mail.ru
ORCID iD: 0000-0002-5649-2193
SPIN-code: 8449-6590
MD, Dr. Sci. (Medicine), Professor
Russian Federation, MoscowElena A. Mershina
Lomonosov Moscow State University
Email: Elena_Mershina@mail.ru
ORCID iD: 0000-0002-1266-4926
SPIN-code: 6897-9641
MD, Cand. Sci. (Medicine), Assistant Professor
Russian Federation, MoscowEkaterina S. Pershina
Pirogov Municipal Clinical Hospital No. 1
Email: pershina@mail.ru
ORCID iD: 0000-0002-3952-6865
SPIN-code: 7311-9276
MD, Cand. Sci. (Medicine)
Russian Federation, MoscowReferences
- Vertkin AL, Gritsanchuk AM. Tromboembolism: an epidemic that everyone is silent about. The Russian Archives of Internal Medicine. 2014;(1):33–39. (In Russ.) doi: 10.20514/2226-6704-2014-0-1-33-39 EDN: TBCLKL
- Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). The Lancet. 1999;353(9162):1386–1389. doi: 10.1016/S0140-6736(98)07534-5 EDN: DAROEL
- Kucher N, Rossi E, De Rosa M, Goldhaber SZ. Massive pulmonary embolism. Circulation. 2006;113(4):577–582. doi: 10.1161/CIRCULATIONAHA.105.592592
- Bajc M, Schümichen C, Grüning T, et al. EANM guideline for ventilation/perfusion single-photon emission computed tomography (SPECT) for diagnosis of pulmonary embolism and beyond. European Journal of Nuclear Medicine and Molecular Imaging. 2019;46(12):2429–2451. doi: 10.1007/s00259-019-04450-0 EDN: QGKIJW
- Mukhametshina GA, Amirov NB, Frolova EB, et al. The qustion of pulmonary artery tromboembolism. The Bulletin of Contemporary Clinical Medicine. 2013;6(4):67–73. EDN: RCKYBF
- Zhuravkov YuL, Koroleva AA. Modern principles of diagnosis and treatment of the acute pulmonary thromboembolism. Military Medicine. 2014;3(32):112–116. EDN: SLQPTP
- Sukhova MB, Trofimova TN. Modern aspects of MSCT diagnostics of acute massive pulmonary embolism. Diagnostic radiology and radiotherapy. 2021;12(4):7–14. doi: 10.22328/2079-5343-2021-12-4-7-14 EDN: OHOTRM
- Bokeriya LA, Zatevakhin II, Kirienko AI, et al. Russian clinical guidelines for the diagnosis, treatment and prevention of venous thromboembolic complications (VTEC). Flebologiya. 2015;9(4-2):1–52 (In Russ.) EDN: XIOPYZ
- Tyurin IE. Pulmonary embolism: possibilities of radiological diagnostics. Atmosfera. Pul'monologiya i allergologiya. 2005;(4):20–24 (In Russ.) EDN: OOPMTF
- Heit JA. Venous thromboembolism epidemiology: implications for prevention and management. Seminars in thrombosis and hemostasis. 2002;28 Suppl. 2:3–13. doi: 10.1055/s-2002-32312
- Sweet PH 3rd, Armstrong T, Chen J, et al. Fatal pulmonary embolism update: 10 years of autopsy experience at an academic medical center. JRSM Short Reports. 2013;4(9):2042533313489824. doi: 10.1177/2042533313489824
- Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonaryembolism developed in collaboration with the European Respiratory Society (ERS). Russian Journal of Cardiology. 2020;25(8):180–239. doi: 10.15829/1560-4071-2020-3848 EDN: NXTZZJ
- Ceriani E, Combescure C, Le Gal G, et al. Clinical prediction rules for pulmonary embolism: a systematic review and meta-analysis. Journal of Thrombosis and Haemostasis. 2010;8(5):957–970. doi: 10.1111/j.1538-7836.2010.03801.x
- Quezada CA, Bikdeli B, Barrios D, et al. Meta-analysis of prevalence and short-term prognosis of hemodynamically unstable patients with symptomatic acute pulmonary embolism. The American Journal of Cardiology. 2019;123(4):684–689. doi: 10.1016/j.amjcard.2018.11.009
- Singh R, Nie RZ, Homayounieh F, et al. Quantitative lobar pulmonary perfusion assessment on dual-energy CT pulmonary angiography: applications in pulmonary embolism. European Radiology. 2020;30(5):2535–2542. doi: 10.1007/s00330-019-06607-9 EDN: QVXDOT
- Tafur AJ, Shamoun FE, Patel SI, et al. Catheter-directed treatment of pulmonary embolism: a systematic review and meta-analysis of modern literature. Clinical and Applied Thrombosis/Hemostasis. 2016;23(7):821–829. doi: 10.1177/1076029616661414
- Kröger JR, Hickethier T, Pahn G, et al. Influence of spectral detector CT based monoenergetic images on the computer-aided detection of pulmonary artery embolism. European Journal of Radiology. 2017;95:242–248. doi: 10.1016/j.ejrad.2017.08.034
- Qanadli S, El Hajjam M, Vieillard-Baron A, et al. New CT index to quantify arterial obstruction in pulmonary embolism. American Journal of Roentgenology. 2001;176(6):1415–1420. doi: 10.2214/ajr.176.6.1761415
- Frank Peacock W, Coleman CI, Diercks DB, et al. Emergency department discharge of pulmonary embolus patients. Academic Emergency Medicine. 2018;25(9):995–1003. doi: 10.1111/acem.13451
- Torbicki A, Perrier A, Konstantinides S, et al. Guidelines on the diagnosis and management of acute pulmonary embolism: the task force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). European Heart Journal. 2008;29(18):2276–2315. doi: 10.1093/eurheartj/ehn310
- Giordano J, Khung S, Duhamel A, et al. Lung perfusion characteristics in pulmonary arterial hypertension (PAH) and peripheral forms of chronic thromboembolic pulmonary hypertension (pCTEPH): dual-energy CT experience in 31 patients. European Radiology. 2017;27(4):1631–1639. doi: 10.1007/s00330-016-4500-6 EDN: WXUBJW
- Pietersen PI, Goyard C, Gill T, et al. The CT revolution: the role of PIOPED II in establishing CT pulmonary angiography as the reference standard for pulmonary embolism diagnosis. Breathe (Sheff). 2024; 20(1):230228. doi: 10.1183/20734735.0228-2023 EDN: LNAYLM
- Viteri-Ramírez G, García-Lallana A, Simón-Yarza I, et al. Low radiation and low-contrast dose pulmonary CT angiography: comparison of 80 kVp/60 ml and 100 kVp/80 ml protocols. Clinical Radiology. 2012;67(9):833–839. doi: 10.1016/j.crad.2011.11.016
- Gietema HA, Walraven KHM, Posthuma R, et al. Dual-energy computed tomography compared to lung perfusion scintigraphy to assess pulmonary perfusion in patients screened for endoscopic lung volume reduction. Respiration. 2021;100(12):1186–1195. doi: 10.1159/000517598 EDN: HCPPYM
- Im DJ, Hur J, Han K, et al. Prognostic value of dual-energy CT-based iodine quantification versus conventional CT in acute pulmonary embolism: a propensity-match analysis. Korean Journal of Radiology. 2020;21(9):1095. doi: 10.3348/kjr.2019.0645 EDN: ZLWQQL
- Zhang LJ, Zhou CHSH, Schoepf UJ, et al. Dual-energy CT lung ventilation/perfusion imaging for diagnosing pulmonary embolism. European Radiology. 2013;23(10):2666–2675. doi: 10.1007/s00330-013-2907-x EDN: HTDZSY
- Yang GF, Yang X, Zhang LJ, et al. Pulmonary enhancement imaging with dual energy CT for the detection of pulmonary embolism in a rabbit model. Academic Radiology. 2011;18(5):605–614. doi: 10.1016/j.acra.2010.12.012
- Nikolaou K, Tiem S, Sommer W, et al. Diagnosing pulmonary embolism: new computed tomography applications. Journal of Thoracic Imaging. 2010;25(2):151–160. doi: 10.1097/RTI.0b013e3181d9ca1d
- Zhang LJ, Wang ZJ, Zhou CS, et al. Evaluation of pulmonary embolism in pediatric patients with nephrotic syndrome with dual energy CT pulmonary angiography. Academic Radiology. 2012;19(3):341–348. doi: 10.1016/j.acra.2011.11.002
- Ruggiero A, Screaton NJ. Imaging of acute and chronic thromboembolic disease: state of the art. Clinical Radiology. 2017;72(5):375–388. doi: 10.1016/j.crad.2017.02.011
- Otrakji A, Digumarthy SR, Lo Gullo R, et al. Dual-energy CT: spectrum of thoracic abnormalities. RadioGraphics. 2016;36(1):38–52. doi: 10.1148/rg.2016150081
- Rassouli N, Etesami M, Dhanantwari A, Rajiah P. Detector-based spectral CT with a novel dual-layer technology: principles and applications. Insights into Imaging. 2017;8(6):589–598. doi: 10.1007/s13244-017-0571-4 EDN: RIGZBG
- Ermolaev VL, Stolin AV, Shurygina EP, et al. Capabilities of traditional integrated approach to diagnosis and management of acute pulmonary embolism. Ural Medical Journal. 2010;7(72):58–62. EDN: MWJYVB
- Zabavskaya OA, Sharifullin FA, Kokov LS. Capabilities of multispiral computer tomography in differential diagnosis of pulmonary embolism. In: Proceedings of the scientific and practical conference «New technologies in emergency and urgent medical care». Suzdal, 2016 Apr 21–22. Moscow: N.V. Sklifosovsky Research Institute of Emergency Care. P. 131–132. (In Russ.)
- Perrier A, Howarth N, Didier D, et al. Performance of helical computed tomography in unselected outpatients with suspected pulmonary embolism. Annals of Internal Medicine. 2001;135(2):88. doi: 10.7326/0003-4819-135-2-200107170-00008
- Van Strijen MJ, De Monye W, Kieft GJ, et al. Accuracy of single-detector spiral CT in the diagnosis of pulmonary embolism: a prospective multicenter cohort study of consecutive patients with abnormal perfusion scintigraphy. Journal of Thrombosis and Haemostasis. 2005;3(1):17–25. Corrected and republished from: Journal of Thrombosis and Haemostasis. 2005;3(3):622. doi: 10.1111/j.1538-7836.2004.01064.x
- Mullins MD, Becker DM, Hagspiel KD, Philbrick JT. The role of spiral volumetric computed tomography in the diagnosis of pulmonary embolism. Archives of Internal Medicine. 2000;160(3):293–298. doi: 10.1001/archinte.160.3.293
- Prokop M, Galanski M, editors. Spiral and multislice computer tomography of the body. New York: Thieme; 2003.
- Kelly AM. Imaging in thromboembolic disease. Imaging Med. 2011;3(1):31–50.
- Gottschalk A, Sostman HD, Coleman RE, et al. Ventilation-perfusion scintigraphy in the PIOPED study. Part II. Evaluation of the scintigraphic criteria and interpretations. J Nucl Med. 1993;34(7):1119–1126.
- Waterstram-Rich KM, Gilmore D. Respiratory system. In: Gilmore D, Waterstram-Rich KM. Nuclear Medicine and PET/CT: technology and techniques. 8th ed. St. Louis, MO: Mosby Elsevier; 2016. P. 475–487.
- Chan K, Ioannidis S, Coghlan JG, et al. Pulmonary arterial hypertension with abnormal V/Q single-photon emission computed tomography. JACC: Cardiovascular Imaging. 2018;11(10):1487–1493. doi: 10.1016/j.jcmg.2017.07.026 EDN: RDHSTD
- Yu L, Leng S, McCollough CH. Dual-energy CT–based monochromatic imaging. American Journal of Roentgenology. 2012;199(suppl. 5):S9–S15. doi: 10.2214/AJR.12.9121
- Lenga L, Trapp F, Albrecht MH, et al. Single- and dual-energy CT pulmonary angiography using second- and third-generation dual-source CT systems: comparison of radiation dose and image quality. European Radiology. 2019;29(9):4603–4612. doi: 10.1007/s00330-018-5982-1 EDN: YGLIHW
- Weidman EK, Plodkowski AJ, Halpenny DF, et al. Dual-energy CT angiography for detection of pulmonary emboli: incremental benefit of iodine maps. Radiology. 2018;289(2):546–553. doi: 10.1148/radiol.2018180594
- Masy M, Giordano J, Remy J, et al. Dual-energy CT (DECT) lung perfusion in pulmonary hypertension: concordance rate with V/Q scintigraphy in diagnosing chronic thromboembolic pulmonary hypertension (CTEPH). European Radiology. 2018;28(12):5100–5110. doi: 10.1007/s00330-018-5467-2 EDN: HBNJYG
- Takx RAP, Henzler T, Schoepf UJ, et al. Predictive value of perfusion defects on dual energy CTA in the absence of thromboembolic clots. Journal of Cardiovascular Computed Tomography. 2017;11(3):183–187. doi: 10.1016/j.jcct.2017.04.005
- Mershina EA, Sinitsyn VE, Plotnikova ML,et al. Use of dual-energy computed tomographic angiopulmonography in patients with chronic thromboembolic pulmonary hypertension before and after pulmonary artery thromboendarterectomy. Journal of Radiology and Nuclear Medicine. 2013;2:27–31. EDN: RGQWTT
- Ohno Y, Ozawa Y, Nagata H, et al. Area-detector computed tomography for pulmonary functional imaging. Diagnostics. 2023;13(15):2518. doi: 10.3390/diagnostics13152518 EDN: LXLBNJ
- Hong YJ, Shim J, Im DJ, et al. Dual-energy CT for pulmonary embolism: current and evolving clinical applications. Korean Journal of Radiology. 2021;22(9):1555–1568. doi: 10.3348/KJR.2020.1512 EDN: EFSHLY
- Tamura M, Yamada Y, Kawakami T, et al. Diagnostic accuracy of lung subtraction iodine mapping CT for the evaluation of pulmonary perfusion in patients with chronic thromboembolic pulmonary hypertension: correlation with perfusion SPECT/CT. International Journal of Cardiology. 2017;243:538–543. doi: 10.1016/j.ijcard.2017.05.006
- Shahin Y, Johns C, Karunasaagarar K, et al. IodiNe subtraction mapping in the diagnosis of pulmonary chronIc thRomboEmbolic disease (INSPIRE): rationale and methodology of a cross-sectional observational diagnostic study. Contemporary Clinical Trials Communications. 2019;15:100417. doi: 10.1016/j.conctc.2019.100417
- Tsuchiya N, van Beek EJR, Ohno Y, et al. Magnetic resonance angiography for the primary diagnosis of pulmonary embolism: a review from the international workshop for pulmonary functional imaging. World Journal of Radiology. 2018;10(6):52–64. doi: 10.4329/wjr.v10.i6.52
- Fu Q, Cheng Q, Kong X, et al. Diagnostic accuracy of true fast imaging with steady-state precession, MR pulmonary angiography and volume-interpolated body examination for pulmonary embolism compared with CT pulmonary angiography. Experimental and Therapeutic Medicine. 2020;21(1):42. doi: 10.3892/etm.2020.9474 EDN: VLQMDT
Supplementary files