Prospects of machine learning applications in affective disorders
- Authors: Mosolova E.S.1, Alfimov A.E.2, Kostyukova E.G.1, Mosolov S.N.1,3
-
Affiliations:
- V. Serbsky National Medical Research Centre for Psychiatry and Narcology
- Sechenov First Moscow State Medical University
- Russian Medical Academy of Continuous Professional Education
- Issue: Vol 6, No 1 (2025)
- Pages: 97-115
- Section: Reviews
- Submitted: 06.08.2024
- Accepted: 06.12.2024
- Published: 25.03.2025
- URL: https://jdigitaldiagnostics.com/DD/article/view/634885
- DOI: https://doi.org/10.17816/DD634885
- ID: 634885
Cite item
Full Text
Abstract
Mental disorders are a significant medical and social issue globally. Currently, approximately 970 million individuals suffer from mental disorders, with over 300 million diagnosed with depression or bipolar disorder. Recently, there has been significant advancement in digital technologies, particularly in artificial intelligence, encompassing machine learning and deep learning. Given the growing interest in their use in psychiatry and the need to develop new approaches to psychiatric care. This review explores the current and promising directions for the application of artificial intelligence technologies in clinical practice, focusing on patients with depression and bipolar disorder.
A literature search was conducted from January to February 2024 in the databases PubMed, Google Scholar, and eLibrary using the following keywords: «психиатрия» ("psychiatry"), «психическое здоровье» ("mental health"), «психическое расстройство» ("psychiatric disorder"), «депрессия» ("depression"), «депрессивный эпизод» ("depressive episode"), «рекуррентное депрессивное расстройство» ("recurrent brief depression"), «биполярное расстройство» ("bipolar disorder"), «машинное обучение» ("machine learning"), «глубокое обучение» ("deep learning"), «искусственный интеллект» ("artificial intelligence"); "psychiatry", "mental health", "psychiatric disorder", "depression", "depressive episode", "major depressive disorder", "bipolar disorder", "machine learning", "deep learning", "artificial intelligence". Studies on the use of artificial intelligence technologies in patients with depression and bipolar disorders and review articles discussing the difficulties of their application in psychiatry were excluded. Publications in Russian and English in the past 10 years were selected.
The most commonly used machine learning models for diagnosing patients with affective disorders utilize neuroimaging data (primarily magnetic resonance imaging and electroencephalography), text, audio, and video data and data from electronic devices, molecular-genetic markers, and clinical indicators. The models were trained using mono- or multimodal datasets. Notably, many of the reviewed studies have significant limitations, making the implementation of artificial intelligence technologies in clinical practice challenging. These include small sample sizes, low representativeness and standardization, inclusion of “noise” and correlated variables, and absence of validation using independent datasets.
Studies on machine learning methods have demonstrated promising results in the early diagnosis of affective episodes and in predicting treatment responses. However, their clinical application is limited, owing to insufficient validation. Well-designed prospective cohort studies and the creation of extensive, high-quality datasets and models capable of uncovering new relationships between variables are required to address this limitation.
Full Text
ВВЕДЕНИЕ
Психические расстройства входят в число важнейших медико-социальных проблем как отечественного, так и мирового здравоохранения. В России около 40% населения имеют признаки нарушения психического здоровья [1], а в мире примерно каждый восьмой житель и в общей сложности около 970 млн человек страдают психическим расстройством [2]. Из них около 280 млн имеют диагноз депрессия, а около 40 млн — биполярное расстройство (БР)1. В то же время именно психиатрия является одной из немногих областей медицины, где ещё практически отсутствуют методы объективной биологической оценки [3], что затрудняет своевременную и точную постановку диагноза, а лечение эффективно далеко не во всех случаях [4]. Например, до установления верного диагноза БР в среднем проходит около 5–10 лет [5], а также известно, что лишь 1/3 пациентов с депрессией достигают ремиссии после назначения первой линии терапии [6, 7].
Одновременно с этим в разных областях медицины всё больше применяют новые технологии для улучшения диагностики и лечения заболеваний [8]. Использование телемедицины, расцвет которой совпадает с периодом пандемии коронавирусной инфекции2, позволяет собирать массивы данных текстового, аудио- и видеоформата на постоянной основе, что раньше происходило только в рамках контролируемых клинических исследований. Накопление массива качественно различающихся между собой медицинских данных, или больших данных (big data), обработка и управление которыми посредством традиционных статистических методов невозможна [9], а также недавние достижения в области технологий обработки языка, речи и видеоанализа, обусловливают особенный интерес к использованию и активное развитие передовых вычислительных методов, таких как машинное и глубокое обучение [10]. За последние 10 лет количество публикаций в поисковой системе PubMed по ключевым словам «artificial intelligence», «machine learning», «psychiatry», «mental health» возросло приблизительно в 50 раз и сегодня насчитывает более 2 тыс. Использование новых методов обработки данных может помочь объединить массивы информации разных типов с целью более точного определения риска, диагностики, подбора лечения и предсказания рецидивов психических расстройств, а также установить новые взаимосвязи между данными для более тонкого и дифференцированного подхода к диагностике и классификации психических расстройств [3, 10, 11]. Предполагают, что с помощью технологий искусственного интеллекта (ИИ) будет возможно адаптировать методы диагностики и лечения к индивидуальным характеристикам пациента, что является предметом рассмотрения точной психиатрии [12]. Всё больше внимания к применению технологий ИИ проявляют врачи-клиницисты, которые, с одной стороны, возлагают надежду на то, что их внедрение в клиническую практику позволит проводить более точную диагностику и подбор лечения, а также избавит от бумажной работы [13]. С другой стороны, они выражают опасение в отношении потери работы, если ИИ будет способен заменить их [14]. Несмотря на большое количество исследований на тему применения технологий ИИ в области психиатрии, реальные перспективы их использования в клинической практике остаются до конца неясными и некоторые авторы скептически относятся к возможности массового применения данных технологий [15, 16].
В связи с возрастающим интересом к цифровым технологиям в психиатрии и актуальностью разработки новых подходов к организации психиатрической помощи, решено продемонстрировать текущие и перспективные направления развития и применения технологий ИИ в клинической практике на примере пациентов c депрессией и БР. В обсуждении также приведена критическая оценка потенциальных преимуществ и недостатков включённых в обзор публикаций.
Методология поиска
Поиск публикаций осуществляли в период с января по февраль 2024 года с помощью поисковых систем PubMed, Google Scholar, eLibrary, а также комбинаций ключевых слов и словосочетаний: «психиатрия», «психическое здоровье», «психическое расстройство», «депрессия», «депрессивный эпизод», «рекуррентное депрессивное расстройство», «биполярное расстройство», «машинное обучение», «глубокое обучение», «искусственный интеллект»; «psychiatry», «mental health», «psychiatric disorder», «depression», «depressive episode», «major depressive disorder», «bipolar disorder», «machine learning», «deep learning», «artificial intelligence». Дополнительно выполняли поиск публикаций, рассматривающих использование каждого типа данных у пациентов с депрессией и БР, с помощью анализа списков литературы.
В обзор выключены публикации на русском или английском языках за последние 10 лет (систематические и нарративные обзоры, метаанализы, оригинальные исследования), посвящённые использованию технологий ИИ с целью диагностики пациентов с депрессией и БР, а также обзорные статьи, рассматривающие трудности их применения в психиатрии. Последние поисковые запросы выполнили 15 февраля 2024 года. Мы не включили в обзор работы, посвящённые применению технологий ИИ у детей и подростков (<18 лет), а также исследования, полный текст которых не найден.
В результате проведённого поиска и анализа литературных источников в обзор включено 114 публикаций, описывающих результаты 72 оригинальных исследований, а также 35 нарративных и 7 систематических литературных обзоров.
ИСКУССТВЕННЫЙ ИНТЕЛЛЕКТ, МАШИННОЕ И ГЛУБОКОЕ ОБУЧЕНИЕ
ИИ — алгоритм, который может обосновывать, обучаться, планировать и выполнять действия, имитируя интеллектуальную деятельность человека. Данный термин охватывает машинное и глубокое обучение [17, 18]. Машинное обучение — раздел ИИ, оно предполагает разработку модели, которая «обучается», распознавая новые закономерности на основе предоставленного набора данных, а также использует это обучение для прогнозирования свойств новых данных.
Различают контролируемое, полуконтролируемое и неконтролируемое машинное обучение. Отдельные методы, используемые в каждом варианте обучения, представлены в табл. 1. Термин контролируемое обучение подразумевает наличие меток в наборе данных, от которых зависит непосредственно процесс обучения [19, 20]. Данный вид обучения является наиболее распространённым в медицинских исследованиях и включает методы классификации и регрессии [19, 21, 22]. Например, контролируемую классификацию считают более подходящим методом для диагностики и оценки прогноза (предсказание наличия или отсутствия психического расстройства, а также типа его течения) [23], ответа на лечение и возникновения рецидива психического расстройства. Регрессионные модели, в свою очередь, можно использовать для прогнозирования выраженности различных симптомов в ходе заболевания [24] и их изменений в процессе лечения [25].
Таблица 1. Категории машинного обучения, их принципы работы, методы и потенциальные возможности применения [10, 41]
Категория обучения | Принцип работы | Методы | Применение |
Контролируемое обучение | Данные предоставляют с метками, на которых модель обучается самостоятельно | · Методы классификации: – классификатор Байеса; – метод опорных векторов; – метод «случайного леса»; – адаптивный бустинг. · Методы регрессии: – линейная регрессия; – метод k-ближайших соседей | · Определение наличия психического расстройства · Дифференциальная диагностика · Оценка прогноза ответа на лечение или рецидива |
Неконтролируемое обучение | Данные предоставляют без меток, модель определяет закономерности самостоятельно | · Иерархическая кластеризация · Метод k-средних · Анализ главных компонент · Канонический корреляционный анализ | · Определение подтипов заболеваний · Выявление клинических и нейробиологических особенностей психических расстройств |
Полуконтролируемое обучение | Данные предоставляют как с метками, так и без них | · Регуляризация Лапласа · Полуконтролируемая кластеризация | · Мультимодальный анализ · Типирование и диагностика заболеваний · Прогнозирование на неполных данных |
Глубокое обучение | Набор методов, использующих искусственные нейронные сети с многоуровневой архитектурой, может быть как контролируемым, так и неконтролируемым | · Свёрточная нейронная сеть · Глубокие автокодировщики · Граф-свёрточные сети · Рекуррентные нейронные сети · Долгая краткосрочная память · Генеративно-состязательные сети · Многоэкземплярное обучение · Многослойные нейронные сети прямого распространения | · Обработка массивов генетических, нейровизуализационных и других типов данных с целью определения новых взаимодействий между ними |
Схожим является подход полуконтролируемого обучения, при котором модель тренируют как на размеченном, так и неразмеченном наборе данных [20, 26]. Стоит отметить, что этот подход влечёт за собой некоторые риски, поскольку имеющиеся в размеченных данных неточности могут «тиражироваться» системой [27]. Несмотря на то, что в медицине часто используют методы контролируемого обучения, в одной из недавних работ показана высокая эффективность полуконтролируемого обучения для диагностики рецидива БР на основе аудиоданных [28].
При неконтролируемом обучении, в свою очередь, данные предоставляют без меток и модель находит закономерности самостоятельно. Такой подход эффективен в отношении поиска схожих особенностей у пациентов с разными психическими расстройствами [19, 20, 26]. Например, неконтролируемая кластеризация полезна для выявления подтипов заболеваний и анализа клинической и биологической гетерогенности психических расстройств [29, 30]. Стоит отметить, что данный метод машинного обучения является более сложным с точки зрения понимания механизмов классификации, а также проверки точности и надёжности полученных результатов [31].
Глубокое обучение — это вид машинного обучения, где в качестве модели используют искусственные нейронные сети с многоуровневой архитектурой, которые включают взаимосвязанные узлы с разным количеством слоев [10, 17]. Существует ряд методик, позволяющих применять глубокое обучение на выборках менее 10 тыс. человек [32], а также происходит накопление всё большего количества генетических, нейровизуализационных и других наборов данных [33], что даёт возможность использовать его в психиатрии [32]. Некоторые авторы предполагают, что методы глубокого обучения позволят выявить новые взаимосвязи и нейробиологические механизмы развития психических расстройств и их классификации с большей эффективностью и точностью, чем стандартные методы машинного обучения [34–36]. Однако несмотря на преимущества использования этого вида обучения, рациональность и достоверность его результатов нельзя полностью проверить, поскольку зачастую невозможно установить логику их генерации моделью [37], поэтому некоторые исследователи выступают против использования методов глубокого обучения в медицине [38].
Сам процесс разработки моделей машинного обучения является непрерывным превращением наборов различных данных в конечный результат, например вывод о наличии психического расстройства, и включает ряд последовательных этапов [39–41]. Первый шаг — сбор данных с последующей предварительной обработкой, включая исследовательский анализ, оценку корреляций и классового дисбаланса, обработку пропущенных значений, сокращение «шумов» и артефактов [42], отбор наиболее значимых переменных для прогноза и качества модели [41], а также преобразование данных с помощью различных технологий в зависимости от их характера, таких как обработка текстовых данных посредством анализа естественного языка (Natural Language Processing, NLP) [36]. Следующий шаг включает обучение модели с помощью выбранного одного или нескольких алгоритмов машинного обучения. Вне зависимости от метода работа с набором данных подразумевает его разделение на следующие типы:
- обучающий, используемый для тренировки модели;
- проверочный — для предварительной оценки полученной модели;
- тестовый — для финальной оценки.
Если в результате тестирования качество модели недостаточное, то исследователь может вмешаться, увеличив набор данных, изменив гипотезу или характеристики, а также модифицировав выбранные алгоритмы [21]. После этапа тестирования необходимо проверить работу модели на репрезентативной крупной независимой выборке в клинической практике [43].
НЕЙРОВИЗУАЛИЗАЦИОННЫЕ ДАННЫЕ
Наиболее распространёнными методами нейровизуализации, используемые в исследованиях с применением методов машинного обучения, являются электроэнцефалография (ЭЭГ) и магнитно-резонансной томография (МРТ) [10]. На основе результатов данных методов исследования создают модели для выявления пациентов с высоким риском, диагностики и типологизации психических расстройств, а также прогнозирования эффекта терапии [44].
Большинство исследований посвящены диагностике психических расстройств с использованием метода контролируемой классификации, самым распространённым из которых является метод опорных векторов [44]. Так, S. Gao и соавт. [25] в своём обзоре рассмотрели 63 исследования, в которых использовали данные МРТ и методы машинного обучения для выявления биомаркёров большого депрессивного расстройства. Точность моделей для диагностики депрессии у пациентов на основе данных структурной МРТ варьировала от 68 до 90%, а на основе результатов функциональной МРТ — от 56 до 100%. Наибольшая точность модели получена L.L. Zeng и соавт. [45]. Авторы оценивали параметры результатов функциональной МРТ покоя у 24 пациентов с тяжёлой степенью рекуррентного депрессивного расстройства (РДР) и 29 здоровых добровольцев и достигли 100% чувствительности с помощью классификатора, полученного методом опорных векторов. К сожалению, большинство моделей тестировали на небольших выборках, что могло существенно повлиять на оценку их точности [44]. Для диагностики депрессии также широко используют данные ЭЭГ. Так, Y. Liu и соавт. [46] включили в систематический обзор 36 исследований, в которых применяли методы машинного обучения и наборы данных, содержащих информацию о результатах ЭЭГ, для диагностики депрессии, при этом точность моделей варьировала от 76 до 99,5%. Как и в исследованиях с использованием результатов МРТ, большинство работ проведено на небольших выборках. Самое крупное исследование включало 400 человек (200 — с установленным диагнозом РДР и 200 здоровых добровольцев), в котором при обучении методом опорных векторов точность на тестовом и обучающем наборе данных составила 84,16 и 91,07% соответственно [47].
L.A. Claude и соавт. [48] проанализировали 47 исследований, из которых в 25 применяли методы машинного обучения с целью классификации пациентов с БР и здоровых добровольцев, точность моделей варьировала от 57 до 100%. Следует отметить, что в 14 исследованиях использовали данные только структурной МРТ: в 9 — оценивали характеристики серого вещества (точность от 50 до 90,7%), в 4 — как серого, так и белого вещества (точность от 63 до 73%). Показатели функциональной МРТ анализировали в 8 исследованиях (точность от 52,8 до 83,5%) и только в двух работах использовали данные диффузионнотензорной томографии. Точность моделей в этих исследованиях составила 78,12 и 100% [49, 50]. N.F. Jie и соавт. [51] разработали подход к выявлению биомаркёров, основанный на методе опорных векторов со стратегией поиска вперёд-назад, по данным структурной и функциональной МРТ в состоянии покоя. Дискриминационные признаки, полученные с помощью двух модальностей, позволили получить классификацию БР и большого депрессивного расстройства с точностью до 92,1%. Размеры выборок в исследованиях, включённых в обзор, варьировали от 23 до 3020, при этом только в двух многоцентровых исследованиях участвовали более 1 тыс. человек. Примечательно, что точность моделей, полученных в этих исследованиях, достигала 65,23%, что ниже средней точности всех моделей — 66% [48], а значение площади под кривой (Area Under Curve, AUC) составило 0,6653 [52, 53]. Четыре исследования в рассматриваемом обзоре посвящены выявлению пациентов с высоким риском развития БР [48]. При этом наилучшие показатели получили K. Lin и соавт. [54] в своей работе, в которой модель классифицировала лиц с высоким генетическим риском без симптомов БР (34 человека) и с высоким риском БР с такими субсиндромальными симптомами, как гипоманиакальные, депрессивные, психотические, дефицита внимания и гиперактивности (38 человек), с точностью 83,21% на основе биомаркёров, полученных из данных МРТ.
Ряд работ использовал также методы машинного обучения для классификации с целью дифференциальной диагностики психических расстройств. Так, L.A. Claude и соавт. [48] обнаружили 11 исследований, в которых классифицировали пациентов с БР и шизофренией, точность полученных моделей варьировала от 50 до 96,2%. В 16 исследованиях предприняты попытки отличить пациентов с БР от пациентов с РДР, в которых показатели точности варьировали от 49,5 до 93,1% [48]. Наибольшей точностью (90%) обладала модель на основе паттернов, полученных из данных функциональной МРТ. Небольшой размер выборки может обусловливать её высокую точность, поскольку авторы рассматриваемого пилотного исследования включили в него по 10 пациентов с БР и РДР, а также 10 здоровых добровольцев [55]. B. Vai и соавт. [56] с помощью комбинации методов нейровизуализации выявляли биомаркёры с целью дифференциальной диагностики униполярной и биполярной депрессии, точность модели составила 73,65%.
Перспективным направлением является использование данных нейровизуализации для прогнозирования терапевтического эффекта. В метаанализ, проведённый D. Watts и соавт. [57] в 2022 году, включено 15 исследований, в которых с помощью методов машинного обучения и наборов данных, содержащих информацию о результатах ЭЭГ, прогнозировали эффект антидепрессантов у пациентов с РДР. Совокупная точность моделей всех исследований составила 83,93% [95% ДИ (доверительный интервал) 78,90–89,29]. При анализе подгрупп наиболее высокую эффективность прогнозирования ответа на лечение наблюдали при применении ритмической транскраниальной магнитной стимуляции (объединённая точность 85,70% [95% ДИ 77,45–94,83]) и антидепрессантов (объединённая точность 81,41% [95% ДИ 77,45–94,83]). С целью прогнозирования эффекта терапии также используют данные МРТ [44]. Так, F. Liu и соавт. [58] использовали данные функциональной МРТ 35 пациентов c РДР (18 — с резистентным к лечению, 17 — с хорошим эффектом терапии), а также 17 здоровых добровольцев. Точность моделей, которые позволяла оценивать эффекты используемой терапии, варьировала от 85,7 до 91,2% в зависимости от рассматриваемых параметров. Однако стоит отметить высокую степень клинической гетерогенности и небольшой размер выборки, что не позволяет достоверно оценить точность используемых авторами моделей. R. Jiang и соавт. [59] изучали эффективность электросудорожной терапии у пациентов с РДР в зависимости от показателей объёма серого вещества мозга по данным МРТ и разработали модель с точностью 90%. В обзоре L. Claude и соавт. [48] присутствовало только два исследования, в которых использовали методы машинного обучения для прогнозирования ответа на лечение у пациентов с БР. Так, B.S.C. Wade и соавт. [60] прогнозировали эффект от электросудорожной терапии у пациентов с депрессивным эпизодом (45 пациентов с РДР и 8 — с БР) с помощью классификатора, полученного посредством метода опорных векторов, с использованием набора данных, содержащего результаты МРТ (точность 89%). D.E. Fleck и cоавт. [61] применяли классификационную модель для оценки эффективности терапии литием на основе совмещённых данных функциональной МРТ и протонной магнитно-резонансной спектроскопии, её точность на обучающем и тестовом наборе данных составила 88 и 80% соответственно (n=20).
Существуют также исследования, в которых используют методы неконтролируемого обучения. Так, A.T. Drysdale и соавт. [62] выделили четыре разных нейрофизиологических биотипа депрессии с помощью данных функциональной МРТ покоя. Полученные биотипы ассоциированы с разными профилями клинических симптомов и ответом на терапию. M.J. Wu и соавт. [63] c помощью метода k-средних получили две однородные подгруппы пациентов с БР в соответствии с результатами нейрокогнитивных тестов, в основе классификации лежали параметры МРТ и критерии тяжести БР.
Значительно меньше исследований посвящено прогнозированию повторной госпитализации или рецидивов психических расстройств [10]. В одной из работ с использованием смешанных данных 380 пациентов, а именно: клинических, генетических, лабораторных и МРТ, с помощью метода опорных векторов разработана модель, позволяющая прогнозировать повторную госпитализацию в течение двух лет после первого депрессивного эпизода (AUC=67,74) [64].
N.R. Winter и соавт. [65] оценивали возможности машинного обучения в отношении выявления биомаркёров большого депрессивного расстройства. Для проведения исследования авторы отобрали 856 пациентов с РДР и 945 здоровых добровольцев, они обучили и протестировали 2,4 млн моделей машинного обучения с помощью данных нейровизуализации, полигенного риска депрессии и ряда клинических показателей, а именно: баллов опросника детских травмирующих переживаний, опросника социальной поддержки и индекса лекарственной нагрузки, однако их точность не превосходила 62%. Полученные результаты значительно ниже показателей, представленных в небольших исследованиях. Авторы связывают этот результат в первую очередь с большим размером тестового набора данных, что не даёт возможности искусственно завысить показатели точности, а также с устранением гетерогенности. Кроме того, в отличие от большинства работ, они использовали большое количество методов машинного обучения и тщательно отбирали гиперпараметры моделей и включаемые предикторы, а также применяли структурированное интервью для установления наличия РДР. Стоит отметить, что в данном исследовании использовали лишь классические методы машинного обучения. Однако авторы отмечают, что нелинейные взаимодействия, влияющие на точность моделей глубоко обучения, как правило, удаётся установить на выборках, превышающих 10 000 человек, поэтому их использование скорее всего не улучшило бы полученные показатели [66].
ТЕКСТОВЫЕ, АУДИО- И ВИДЕОДАННЫЕ
Психопатология мышления и речи является одним из ключевых аспектов диагностики большинства психических расстройств [67]. В основе преобразования текста, являющегося одной из основных единиц речи, для машинного обучения лежит анализ естественного языка, посредством которого осуществляют превращение текстовых в числовые данные [36]. Модели с его использованием применяют как для обработки данных пациентов, включая их записи в социальных сетях и стенограммы клинических бесед, так и электронных медицинских карт [67].
Первые работы, в которых методы машинного обучения применяли к текстовым данным, проведены ещё в 2013–2017 годах. В них авторы пытались установить наличие депрессии с помощью анализа записей в социальных сетях [68–70], а сегодня насчитывают десятки подобных моделей [36]. В одном из исследований с помощью анализа таких записей 683 пациентов модель машинного обучения предсказывала наличие депрессии за 6 месяцев до установления клинического диагноза у 114 из них (AUC=0,72) [71]. M. Squires и соавт. [36] в своём обзоре анализировали 14 исследований, посвящённых созданию моделей глубокого обучения с помощью текстовых наборов данных. Наибольшая точность модели для диагностики депрессии по записям в социальных сетях составила 99%, её создали с помощью методов свёрточной нейронной сети и долгой краткосрочной памяти [72]. В другой работе проанализированы 27 308 записей 146 пользователей, а точность полученной модели диагностики депрессии с помощью метода свёрточных нейронных сетей составила 89%. Однако неизвестны методы установления диагноза депрессии в данном исследовании [73].
Для создания моделей машинного обучения с целью диагностики аффективных расстройств широко используют также данные медицинской документации. Так, сводные данные электронной медицинской карты 4687 пациентов с диагнозом РДР применяли для прогнозирования повторной госпитализации c помощью метода опорных векторов (AUC=0,784) [74]. J. Edgcomb и соавт. [75] при ретроспективном анализе данных электронных медицинских карт 552 пациентов с БР с помощью «дерева решений» предсказали повторную госпитализацию в течение 30 дней после выписки из стационара с точностью 88%.
Помимо анализа данных социальных сетей и электронных медицинских карт, для моделей машинного обучения используют стенограммы клинических интервью. Например, на основе расшифровки записей 1864 клинических интервью модель машинного обучения достаточно корректно оценивала суицидальный риск (AUC=0,82) в сравнении с анализом, проведённым врачами [76].
Анализ аудиоданных позволяет оценивать не только содержание клинической беседы, но и другие её характеристики, такие как тон, громкость, тембр и выразительность речи пациента [36]. Установлено, что диапазон звучания голоса меняется при ряде психических расстройств [77], например при депрессии наблюдается усиление дрожания [78]. Так, с помощью методов глубокого обучения по данным характеристик речи 189 аудиозаписей установлен диагноз депрессии в соответствии со шкалой оценки здоровья пациента PHQ-83 с точностью ~70% [79]. С помощью модели машинного обучения на основе аудиозаписей 56 пациентов с БР проведена дифференциальная диагностика депрессии и её смешанной формы (F14=0,83 и 0,86 соответственно), а также гипомании и её смешанной формы (F14=0,86 и 0,75 соответственно) [80].
Помимо текстовых и аудиоданных в ряде работ также используют видеоданные. К инструментам обработки визуальных данных относят такую технологию, как OpenFace, которая способна определять ориентиры лица, оценивать положение головы, движения мимических мышц и взгляд пациента [81]. Например, пациенты, страдающие депрессией, реже улыбаются и двигают бровями, чаще хмурятся, имеют более ограниченные движения губ, реже моргают и двигают руками [82, 83]. На основе анализа видеозаписей интервью с помощью глубокого обучения получена модель для прогнозирования тяжести депрессии в соответствии со шкалой депрессии Бека (MAE5=7,47, RMSE6=9,55) [84], а с помощью анализа походки по данным видеозаписей 200 студентов другая его модель достигла точности 85,45% [83].
В некоторых работах использовали модели, полученные с помощью мультимодальных наборов данных — аудио-, видео- и текстовые данные. Так, M.L. Birnbaum и соавт. [85] разработали модель по данным движения лица и аудио-записей, позволяющую дифференцировать пациентов с шизофренией (n=41) и БР (n=21) — AUС=0,73. Модель, созданная при комбинированном использовании текстовых и аудиоданных (глубокие сети: одномерные свёрточные нейронные сети), для диагностики депрессии (n=189) показала большую точность, чем в случае применения мономодальных наборов данных (текстовые и аудиоданные по отдельности) — 0,91 против 0,78 и 0,82 соответственно [86]. H. Dibeklioglu и соавт. [87] с помощью методов глубокого обучения создали модель для диагностики депрессии (n=57) на основе комплекса аудио- и видеоданных (динамика движений лица, головы и голоса). Модель, полученная с помощью мультимодального набора данных, показала большую точность (79%) по сравнению с моделями, включавшими мономодальные данные.
ДАННЫЕ ЭЛЕКТРОННЫХ УСТРОЙСТВ
Данные «умных» носимых устройств («умные» часы, фитнес-браслеты, трекеры физической активности) и смартфонов также могут быть полезны для оценки состояния пациентов с аффективной патологией [88]. Например, с помощью электронных устройств можно оценивать показатели двигательной активности, данные о местоположении, а также показатели активности использования девайса (количество SMS-сообщений, журнал вызовов, использование Интернета, онлайн-покупки, прослушивание музыки, использование изображений и календаря). Носимые устройства позволяют пассивно собирать данные о ряде биологических показателей, таких как частота сердечных сокращений, вариабельность сердечного ритма, кожно-гальваническая проводимость, температура, артериальное давление, актиметрия, основные фазы сна и др. [89]. J. Seppälä и соавт. [90] в своём систематическом обзоре проанализировали 33 публикации, описывающие исследования, в которых оценивали данные, полученные с помощью сенсоров электронных устройств, носимых пациентами с шизофренией, БР, РДР, а также условно здоровых добровольцев с симптомами депрессии и тревоги. Среди пациентов с БР, по данным девяти исследований, установлена связь между выраженностью симптомов депрессии, а также мании и показателями физической активности, временем пользования смартфона, местоположением, особенностями набора текста. Только в двух исследованиях участвовали пациенты с депрессией и 18 условно здоровых добровольцев с симптомами депрессии или тревоги [90]. Авторы установили корреляцию между выраженностью симптомов депрессии и показателями геолокации, физической активности и временем пользования смартфона [91, 92]. Поскольку данные датчиков с электронных девайсов многообразны, обширны и легкодоступны, они дают возможность построить различные модели машинного обучения. Систематический обзор, проведённый в 2022 году, показал, что модели машинного обучения, основанные на мономодальных наборах данных, для диагностики аффективных расстройств обладают точностью от 70 до 91% (n=9). При этом точность моделей, полученных с помощью мультимодальных наборов данных, варьировала от 76 до 98% (n=6) [89].
Существуют исследования, в которых использовали данные смартфона для диагностики аффективных расстройств. Так, K. Opoku Asare и соавт. [93] создали наборы данных, включающие информацию о времени расхода батареи, часовом поясе, использовании приложений и Интернета, блокировке экрана, демографических показателях 629 человек. Лучший алгоритм машинного обучения, натренированный с помощью созданных наборов данных, обладал точность 92,51%. Однако авторы полагают, что наличие депрессии в исследовании оценивали субъективно с помощью шкалы PHQ-83 и не осуществляли клиническую оценку, поэтому точность модели у пациентов с клинически установленным диагнозом депрессии может отличаться. В другой работе с использованием метода «случайного леса» (random forest) и показателей продолжительности звонков и количества текстовых сообщений разработана модель для диагностики биполярной депрессии с точностью 81,1% (n=412) [94]. При использовании данных приложений (почта, социальные сети, видео, аудио, игры, покупки, учёба) модель для прогнозирования депрессии обладала точностью 80% (n=79) [95].
Информативными могут быть и данные о местоположении. Так, в одном исследовании создали модель машинного обучения с помощью набора данных, включающих информацию о частоте изменения геолокации 28 пациентов, для выявления развития депрессивной фазы с точностью 86,5% [96].
Наиболее часто для построения моделей ранней диагностики аффективных фаз как при РДР, так и при БР использовали данные актиметрии. Например, с помощью набора данных, содержащих информацию о недельной актиметрии, разработали модель для дифференциальной диагностики пациентов с меланхолической депрессией (n=8) и другой структурой депрессивного синдрома (n=7) (AUC=0,84) [97]. С помощью метода адаптивного бустинга и набора данных, включающих информацию о параметрах актиметрии в течение двух недель, разработали модель, позволяющую классифицировать пациентов с депрессией (15 с РДР и 8 с БР) и здоровых добровольцев (n=32), её точность достигла 78% [98]. Посредством метода «случайного леса» и набора данных, содержащих параметры актиметрии в течение 90 дней 25 пациентов с БР и 25 здоровых добровольцев, создали модель с точностью 88% (чувствительность и специфичность — 85 и 91% соответственно) [99]. В самом крупном исследовании с использованием данных пациентов с РДР (n=24 229) и здоровых добровольцев (n=4124) для модели классификации AUC составила 0,68 [95% ДИ 0,67–0,69]. Модель также дифференцировала пациентов в типичными (n=18 722) и атипичными (n=958) симптомами депрессии (гиперсомния, набор массы тела) — AUC 0,74 [95% ДИ 0,71–0,77]. Среди ключевых предикторов выделяли: трудности с пробуждением, бессонницу, храп, малоподвижность в течение дня, а также снижение утренней активности (в 8:00) [100]. P. Jakobsen и соавт. [101] с помощью методов глубокого обучения и набора данных, содержащих информацию об актиметрии 23 пациентов с БР или РДР и 32 здоровых добровольцев, создали модель для классификации с точностью 84% [101].
Известно, что между показателями вариабельности сердечного ритма и тяжестью депрессии, а также интенсивностью руминаций существует отрицательная корреляционная связь [102], что некоторые авторы связывают с активацией парасимпатической нервной системы [103]. В нескольких исследованиях этот факт использован для разработки моделей машинного обучения. Так, S. Byun и соавт. [104] с помощью метода опорных векторов и набора данных, содержащих информацию о параметрах вариабельности сердечного ритма 33 пациентов с РДР и 33 здоровых добровольцев, создали модель для выявления депрессии с точностью 70%. Большая точность диагностики депрессии у пациентов с РДР на основе показателей вариабельности сердечного ритма получена с помощью классификатора Байеса и составила 86,4% [105].
Существуют исследования, в которых использовали мультимодальные данные электронных девайсов [89]. Самое крупное исследование, участниками которого стали 415 человек (около 80% с РДР), провели S. Nickels и соавт. [106]. С помощью специального приложения авторы оценивали 34 показателя, 11 из которых значимо коррелировали с общим баллом по шкале PHQ-97. Данные показатели включали:
- характеристики аудиодневников — их длительность, количество пауз, использование определённых слов, отражающих настроение;
- продолжительность сна;
- выраженность окружающего шума;
- количество звонков и скорость ответа на них;
- характеристики геолокации — посещение новых мест, их разнообразие, время, проведённое дома;
- показатели заряда батареи;
- время зарядки телефона;
- количество смайлов и слов, отражающих настроение в SMS-сообщениях;
- экранное время;
- громкость;
- частота использования приложений для общения.
На основе этих данных разработана модель логистической регрессии (средняя AUC=0,656).
В небольшом исследовании с участием 20 пациентов с различной степенью выраженности депрессии в соответствии с PHQ-97 и с использованием методов опорных векторов и «случайного леса» создали модель машинного обучения для автоматической классификации категории депрессии. С целью получения данных использовали приложения для смартфонов и «умных» часов, которые позволили оценить пять кластеров её симптомов: физическую и социальную активность, настроение, сон и приём пищи. Авторы создали модель с точностью 96% [107]. C.H. Cho и соавт. [108] провели проспективное обсервационное когортное исследование с участием 55 пациентов с большим депрессивным расстройством и БР I и II типа. В исследовании применяли приложение для смартфона с целью самостоятельной записи ежедневных оценок настроения, а установленный датчик фиксировал воздействие света. С помощью трекеров активности собраны данные цифрового журнала активности, сна и частоты сердечных сокращений. Авторы разработали алгоритм прогнозирования настроения при использовании метода «случайного леса» с точностью предсказания изменений настроения на ближайшие три дня 65%. Точность определения эпизода — текущая ремиссия, депрессивный, маниакальный и гипоманиакальный эпизод составила 85,3, 87, 94, и 91,2% соответственно.
ЛАБОРАТОРНЫЕ И МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ ДАННЫЕ
Омиксные технологии являются одной из наиболее активно развивающихся областей точной медицины, в частности психиатрии. С каждым днём растёт количество молекулярных биомаркёров, которые связаны с возникновением психических расстройств, а также терапевтическим ответом. Одновременно с этим появление методов секвенирования нового поколения (Next Generation Sequencing, NGS) стимулировало разработку новых методов биоинформатики и машинного обучения для сбора и использования массивов этих данных. С помощью методов машинного обучения возможно интегрировать наборы фармакогеномных, эпигенетических, метаболомных, транскриптомных и протеомных данных для сопоставления конкретных нейробиологических субстратов с разными кластерами симптомов, что может в дальнейшем лечь в основу классификации и диагностики заболеваний, а также прогнозирования результатов терапии и подбора лечения с индивидуальным подходом [40].
Наиболее часто для построения моделей машинного обучения используют различия в отдельных однонуклеотидных полиморфизмах (Single Nucleotide Polymorphisms, SNPs). В одной из таких работ с помощью метода опорных векторов точность определения ремиссии во время терапии дулоксетином составила 52%, а чувствительность и специфичность — 58 и 46% соответственно (n=186) [109]. При использовании модели «случайного леса» для прогнозирования ремиссии при лечении циталопрамом или эсциталопрамом (n=398) на протяжении 8 недель точность прогноза составила 69% (AUC >0,7) [110]. A.R. Eugene и соавт. [111] с помощью «дерева решений» и метода «случайного леса» разработали модели для предсказания ответа на лечение литием у пациентов с БР. В модели для мужчин в качестве предикторов использовали экспрессию генов RBPMS2 и LILRA5, а для женщин — гены ABRACL, FHL3 и NBPF14, их чувствительность составила 96 и 92% соответственно.
B. Qi и соавт. [112] в качестве предикторов использовали показатели микроРНК 168 пациентов с РДР. Модель машинного обучения, полученная с помощью методов контролируемой классификации, идентифицировала пациентов с депрессией и здоровых добровольцев (AUC=0,97), пациентов с депрессией лёгкой и тяжёлой степени по шкале Монтгомери–Асберг (AUC=0,63), а также прогнозировала ответ на терапию (AUC=0,57).
Существуют исследования, в которых для построения диагностических моделей с помощью методов машинного обучения использовали мультимодальные наборы данных, содержащие комбинацию генетических, демографических или клинических показателей. Так, E. Lin и соавт. [113] провели исследование с участием 455 пациентов с РДР с целью создания моделей глубокого обучения для прогнозирования эффекта селективных ингибиторов обратного захвата серотонина. Авторы использовали многослойные нейронные сети прямого распространения (MFNNs) и разнотипные данные:
- 10 SNPs;
- демографические показатели;
- общий балл по шкале депрессии Гамильтона;
- количество аффективных эпизодов;
- количество суицидальных попыток в анамнезе.
Для модели с двумя скрытыми слоями значение AUC составило 0,82 с чувствительностью и специфичностью — 75 и 69% соответственно. Большая точность (84%) получена для модели машинного обучения с использованием нейровизуализационных и генетических данных, параметров метилирования ДНК, а также демографических показателей (n=121) [114].
Найдено 5 исследований, посвящённых диагностике БР с помощью методов машинного обучения [115] с использованием молекулярно-генетических данных. В одном из них использовали несколько методов классификации на наборах данных полногеномного поиска ассоциаций (Genome-wide association studies, GWAS), полученных от 2191 пациентов с диагнозом БР и 1434 здоровых добровольцев. Лучший результат достигнут с помощью классификатора Байеса — AUC составила 0,56 [116]. При этом все другие методы оказались менее точными, чем метод расчёта полигенных рисков [117]. Несколько большая точность (74%) получена в исследовании с использованием метода «случайного леса», однако выборка была меньше и включала 604 пациента с БР и 1767 здоровых добровольцев [118]. S. Laksshman и соавт. [119] с помощью cвёрточных нейроных сетей и набора данных, содержащих информацию о генотипе при БР, создали модель глубокого обучения (DeepBipolar) со значением AUC 0,65.
Реже в качестве предикторов используют лабораторные показатели. Например, B. Wollenhaupt-Aguiar и соавт. [120] создали модели машинного обучения для классификации пациентов с биполярной (n=54) и униполярной депрессией (n=54) (AUC=0,69, чувствительность и специфичность — 62 и 66% соответственно). В качестве предикторов использовали три биомаркёра — интерлейкин-4, реагирующие с кислотой вещества и интерлейкин-10. Для классификации биполярной депрессии и здоровых добровольцев использовали модель с пятью предикторами — интерлейкин-6, интерлейкин-4, реагирующие с тиобарбитуровой кислотой вещества, анализ на карбонильные соединения и интерлейкин-17А. Её значение AUC составило 0,70, чувствительность и специфичность 62 и 70% соответственно. При сравнении пациентов с униполярной депрессией и контрольной группы использовали семь параметров — интерлейкин-6, анализ на карбонильные соединения, нейротрофический фактор мозга, интерлейкин-10, интерлейкин-17А, интерлейкин-4 и фактор некроза опухоли-α. Значение AUC данной модели составило 0,74, а чувствительность и специфичность — 68 и 70% соответственно.
ПРЕИМУЩЕСТВА И НЕДОСТАТКИ ПРИМЕНЕНИЯ МЕТОДОВ МАШИННОГО ОБУЧЕНИЯ У ПАЦИЕНТОВ С АФФЕКТИВНЫМИ РАССТРОЙСТВАМИ
В нашем обзоре представлены основные работы, посвящённые разработке моделей машинного обучения для пациентов с РДР и БР с использованием в качестве предикторов нейровизуализационных, текстовых, аудио- и видеоданных, а также параметров, собираемых с помощью электронных устройств, омиксных биомаркёров и других лабораторных показателей. Их можно использовать на разных этапах диагностики и лечения психических расстройств, включая:
- определение группы риска с повышением настороженности в отношении развития психического расстройства;
- диагностику расстройства с определением степени тяжести, типа и прогноза течения заболевания;
- индивидуальный подбор потенциально наиболее эффективного лечения;
- прогнозирование эффекта терапии;
- прогнозирование вероятности развития рецидива.
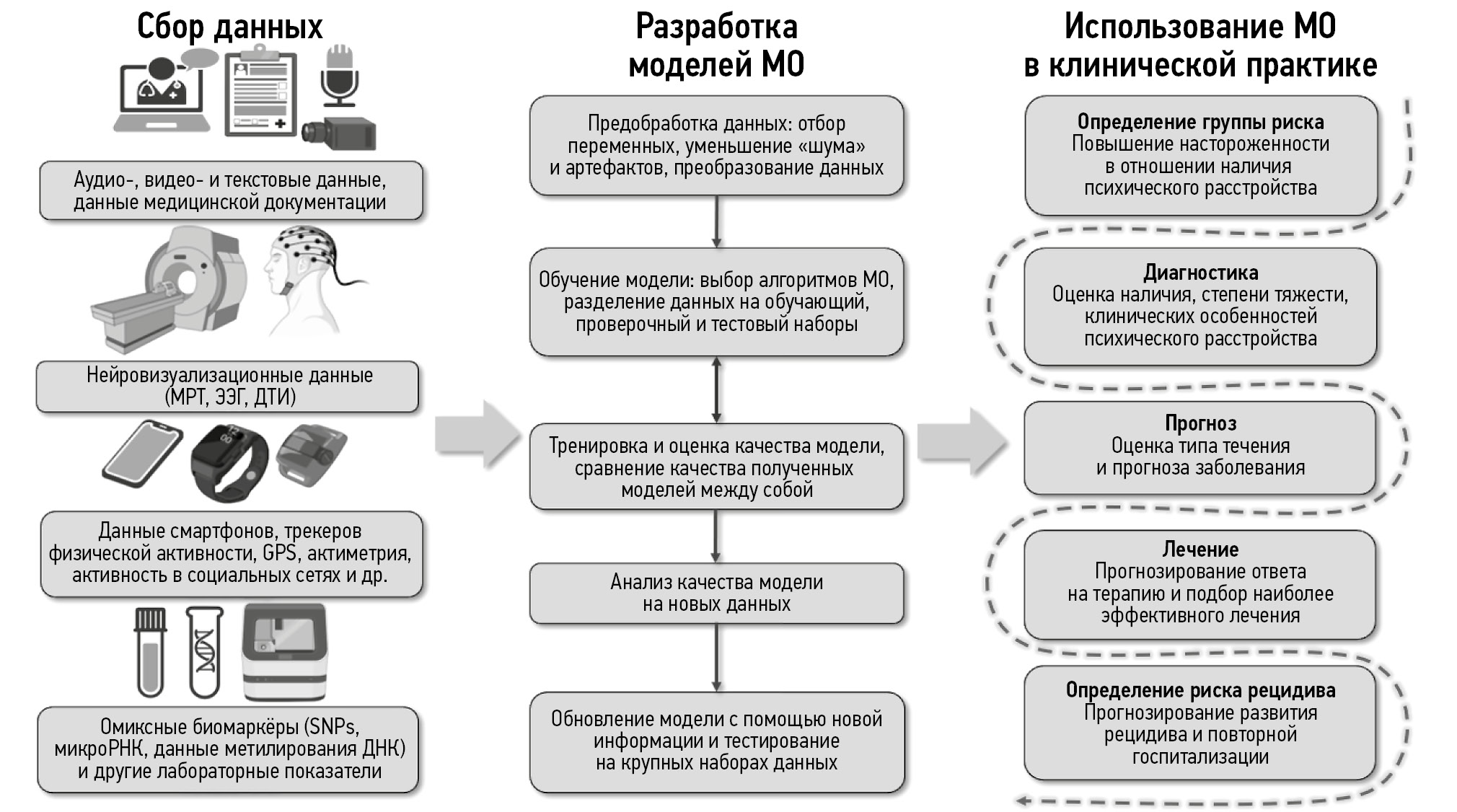
На рис. 1 представлена схема, обобщающая информацию об используемых типах данных, этапах разработки моделей машинного обучения, а также областях применения полученных результатов в клинической практике у пациентов с аффективными расстройствами.
Рис. 1. Этапы разработки и применения методов машинного обучения в клинической практике у пациентов с аффективными расстройствами. МРТ — магнитно-резонансная томография; ЭЭГ — электроэнцефалография; ДТИ — диффузионно-тензорная томография; GPS (Global Positioning System) — глобальная навигационная спутниковая система; SNPs (Single Nucleotide Polymorphisms) — однонуклеотидные полиморфизмы; РНК — рибонуклеиновая кислота; ДНК — дезоксирибонуклеиновая кислота; МО — машинное обучение.
Использование технологий ИИ в психиатрии имеет ряд преимуществ, одним из которых является возможность применения данных разного типа. Объединение параметров может позволить повысить точность моделей, а также более глубоко понять тонкости взаимодействия показателей, включённых в них [121]. В последние десятилетия большие усилия направлены на разработку методов машинного обучения для создания мультимодальных наборов данных [10]. Лишь в некоторых работах, представленных в нашем обзоре, использовали подобные модели [55, 86, 87]. В ряде исследований были получены более высокие показатели точности для моделей машинного обучения, которые созданы с помощью мультимодальных наборов данных [86, 87]. Тем не менее N.R. Winter и соавт. [65], проанализировав 2,4 млн моделей машинного обучения, полагают, что использование мультимодальных наборов данных не улучшает их диагностическую и прогностическую точность. Они связывают это с тем, что модели либо имели настолько мало качественных предикторов, что их объединение не имело значения, либо, что более вероятно, имели сильную корреляцию между параметрами. Однако всё ещё необходима разработка новых легко интерпретируемых методов машинного обучения для объединения данных с последующей оценкой их качества на крупных выборках.
К другим преимуществам использования технологий ИИ относят тот факт, что они, как правило, не требуют вмешательства медицинского специалиста. Именно поэтому можно осуществлять диагностику заболевания или подбор лечения уже до начала приёма врача, в то время как к моменту консультации специалист будет обладать необходимой информацией, включая вероятность наличия того или иного расстройства и варианты потенциально наиболее эффективного лечения. Теоретически это может значительно сократить время приёма врача-психиатра, повысить точность диагностики и восполнить дефицит кадров [122]. Более того, в отличие от клинициста, на ИИ не влияют субъективные факторы, такие как сбои в работе, стресс и усталость [18]. Однако несмотря на потенциальные преимущества использования технологий ИИ в клинической практике, их невозможно рассматривать в качестве альтернативы квалифицированному специалисту, что связано с рядом ограничений.
Одним из основных недостатков исследований, представленных в обзоре, является небольшой размер выборки, что может способствовать «переобучению» модели и приводить к искусственному завышению показателей точности. Другим ограничением считают низкую репрезентативность изучаемых выборок, что затрудняет генерализацию полученных результатов. Кроме того, дефицит стандартизации на этапе сбора и обработки данных может искажать полученные показатели и препятствовать воспроизводимости исследований [123, 124]. Следует отметить, что в большинстве исследований депрессию устанавливали с помощью самоопросников вместо диагностических интервью, поэтому точность модели на популяции пациентов с установленным диагнозом может существенно отличаться. Помимо этого, включение в модели избыточной информации или «шума» также может искажать показатели её точности. Эффективность модели возможно повысить, если данные, используемые для её обучения и тестирования, имеют корреляцию, которая не всегда очевидна [43]. Таким примером может служить информация о сопутствующих заболеваниях. Ещё одним важным недостатком представленных исследований является отсутствие проверки качества полученной модели в независимых выборках, в то время как данный этап является необходимым условием перед применением моделей в клинической практике [125]. Путь к внедрению технологий ИИ должен включать проверку внутри набора данных, проверку на независимых данных, а также в рамках контролируемого клинического исследования [126].
Всё это указывает на необходимость разработки стандартов проведения исследований с использованием технологий ИИ и проверки их качества до внедрения в клиническую практику [127]. Более того, необходимо формирование крупных баз нейровизуализационных, генетических и клинических наборов данных, а также аудио- и видеоформата. Сегодня количество таких баз постепенно растёт, например база данных ENIGMA8, создаваемая более 500 учёными из 35 стран, включает нейровизуализационные (более 30 000 изображений МРТ), генетические и клинические параметры пациентов с заболеваниями мозга [33]. Это, в свою очередь, сопровождается возникновением этических вопросов, адресованных учёным. Необходимо понимание аспектов, связанных с сохранением конфиденциальности, информированием пациентов о том, что будет происходить с их данными и получением информированного согласия. Существует острая потребность разработки единых этических стандартов применения технологий ИИ в медицине в целом [128], в частности в психиатрии [129, 130].
Преградой для использования методов машинного обучения в психиатрии выступает и ряд концептуальных трудностей, таких как отсутствие чётких критериев диагностики психических расстройств, субъективная оценка симптомов, их низкая специфичность и высокий полиморфизм клинической картины на индивидуальном уровне [10]. Всё это затрудняет разработку единых алгоритмов, которые могут лечь в основу построения моделей машинного обучения для диагностики психических расстройств, в отличие от других областей медицины [131]. Смещение фокуса с диагноза на прогноз и исход заболевания, а также альтернативные способы обработки данных и модели машинного обучения, позволяющие выявлять новые взаимосвязи, по-видимому, могут повысить точность результатов [65]. Более того, использование подходов нормативного моделирования, позволяющих фокусироваться на особенностях каждого пациента [132], теории динамических систем [133], сетевой теории психических расстройств [134] также могут стать новыми направлениями, которые лягут в основу применения технологий ИИ у пациентов с аффективными расстройствами [30]. Однако эффективность их применения через призму данных подходов пока не имеет подтверждения.
Необходимо упомянуть и ряд ограничений данного обзора, основным из которых является отсутствие систематического анализа со статистической обработкой данных, что в первую очередь обусловлено отсутствием однородного массива информации об использовании технологий ИИ у пациентов с аффективными расстройствами. В соответствии с целью обзора критерии включения намеренно выбраны широкими. С целью сокращения объёма, мы отобрали лишь основные, на наш взгляд, исследования, поэтому ряд работ мог быть пропущен. Кроме того, обзор включал исследования, в которых участвовали пациенты только с РДР и БР. В обзоре также не упомянуты вопросы, связанные с применением технологий ИИ для планирования исследований и формирования гипотез в области психиатрии [135], в мобильных приложениях [136], при использовании методов нейростимуляции с обратной связью [137], а также чата GPT (Chat Generative Pre-trained Transformer, ChatGPT) [138].
ЗАКЛЮЧЕНИЕ
Таким образом, рассмотрены актуальные методы машинного и глубокого обучения, этапы создания моделей, а также приведены основные исследования с использованием машинного обучения в диагностике пациентов с РДР и БР с опорой на разные типы используемых данных в качестве предикторов. Наиболее часто для создания моделей машинного обучения, предназначенных для пациентов с аффективными расстройствами, используют нейровизуализационные (МРТ и ЭЭГ), текстовые, аудио- и видеоданные, данные электронных устройств, генетические, клинические и лабораторные показатели, а также их комбинации.
Исследования методов машинного обучения показали перспективные результаты для ранней диагностики аффективных эпизодов, а также при прогнозировании ответа на длительную нормотимическую терапию [139]. Несмотря на потенциальные преимущества использования технологий ИИ в психиатрии, их применение в клинической практике затрудненно в связи с рядом технических и концептуальных проблем. С технической точки зрения недостаточное качество моделей связано с небольшим размером выборок, их низкой репрезентативностью и стандартизацией, с включением в модели «шума» (посторонних факторов) и коррелирующих между собой переменных, отсутствием проверки моделей в независимых выборках пациентов. Кроме того, недостаток объективной оценки в психиатрии может создавать трудности для создания точных моделей с помощью методов машинного обучения. С целью повышения производительности алгоритмов ИИ необходимо создавать обширные и качественные базы с наборами данных, разработать критерии качества исследований с использованием технологий ИИ и этические нормы. Помимо этого, существует потребность в разработке моделей, созданных с помощью мультимодальных наборов данных и методов машинного обучения, способных устанавливать новые взаимосвязи между переменными. Для этого важно наладить тесное взаимодействие программистов, учёных и врачейклиницистов. Крайне важно заниматься распространением новых знаний, вовлекать общественность и пациентов в процесс усовершенствования технологий ИИ, а также повышать их осведомлённость о потенциальных преимуществах и недостатках использования современных технологий.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена в рамках темы Государственного задания ФГБУ «Национальный медицинский исследовательский центр психиатрии и наркологии имени В.П. Сербского» Минздрава России, (ЕГИСУ: № 124020800062-5).
Раскрытие интересов. Авторы заявляют об отсутствии отношений, деятельности и интересов (личных, профессиональных или финансовых), связанных с третьими лицами (коммерческими, некоммерческими, частными), интересы которых могут быть затронуты содержанием статьи, а также иных отношений, деятельности и интересов за последние три года, о которых необходимо сообщить.
Вклад авторов. Е.С. Мосолова — концепция работы, сбор и анализ литературных данных, написание текста рукописи; А.Е. Алфимов — научное редактирование рукописи; Е.Г. Костюкова — редактирование рукописи; С.Н. Мосолов — концепция работы, редактирование рукописи. Все авторы одобрили рукопись (версию для публикации), а также согласились нести ответственность за все аспекты работы и гарантировали, что вопросы, связанные с точностью или добросовестностью любой части работы, будут должным образом рассмотрены и решены.
ADDITIONAL INFORMATION
Funding source. This article was carried out within the framework of the topic of the state assignment by State grant of V. Serbsky National Medical Research Centre for Psychiatry and Narcology of Ministry of Health of the Russian Federation, (USIS No 124020800062-5).
Disclosure of interests. The authors declare that they have no relationships, activities or interests (personal, professional or financial) with third parties (commercial, non-commercial, private) whose interests may be affected by the content of the article, as well as no other relationships, activities or interests over the past three years that must be reported.
Author’s contribution. E.S. Mоsolova: concept of the work, collection and analysis of literary data, writing the manuscript; A.E. Alfimov: scientific editing of the manuscript; E.G. Kostyukova editing of the manuscript; S.N. Mosolov: concept of the work, editing of the manuscript. Thereby, all authors provided approval of the version to be published and agree to be accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
1 Institute of Health Metrics and Evaluation [Internet]. Global Health Data Exchange (GHDx); 2021. Режим доступа: https://vizhub.healthdata.org/gbd-results Дата обращения: 14.02.2024.
2 Bestsennyy O., Gilbert G., Harris A., Rost J. Telehealth: a quarter-trillion-dollar post-COVID-19 reality?; [около 15 страниц]. В: McKinsey and Company [Internet]. 2021–2023. Режим достуа: https://www.mckinsey.com/industries/healthcare/our-insights/telehealth-a-quarter-trillion-dollar-post-covid-19-reality Дата обращения: 15.01.2024.
3 PHQ-8 (Patient Health Questionnaire) — версия опросника PHQ-9 без последнего вопроса (о мыслях о смерти или самоповреждении) для оценки депрессии, основанного на диагностических критериях DSM-5.
4 F1-score — метрика в машинном обучении, обеспечивающая сбалансированную оценку точности модели, учитывая как точность, так и отзыв.
5 Mean Absolute Error (MAE) — средняя абсолютная ошибка, характеризующаяся степенью несоответствия между фактическими и прогнозируемыми значениями.
6 Root Mean Squared Error (RMSE) — корень средней квадратичной ошибки, один из основных показателей эффективности для модели прогнозирования регрессии.
7 PHQ-9 (Patient Health Questionnaire) — это опросник, содержащий 9 вопросов, для оценки депрессии, основанный на диагностических критериях DSM-5.
8 ENIGMA [Internet]. The ENIGMA Consortium; 2009–2024. Режим доступа: http://enigma.ini.usc.edu Дата обращения: 14.02.2024.
About the authors
Ekaterina S. Mosolova
V. Serbsky National Medical Research Centre for Psychiatry and Narcology
Email: kata_mosolova@mail.ru
ORCID iD: 0000-0003-2324-2814
SPIN-code: 6077-3386
Russian Federation, Moscow
Alexander E. Alfimov
Sechenov First Moscow State Medical University
Email: alex.alfimov@gmail.com
ORCID iD: 0000-0002-9064-7881
SPIN-code: 4354-7081
MD, Cand. Sci. (Medicine)
Russian Federation, MoscowElena G. Kostyukova
V. Serbsky National Medical Research Centre for Psychiatry and Narcology
Email: ekostukova@gmail.com
ORCID iD: 0000-0002-9830-1412
SPIN-code: 6510-3969
MD, Cand. Sci. (Medicine)
Russian Federation, MoscowSergey N. Mosolov
V. Serbsky National Medical Research Centre for Psychiatry and Narcology; Russian Medical Academy of Continuous Professional Education
Author for correspondence.
Email: profmosolov@mail.ru
ORCID iD: 0000-0002-5749-3964
SPIN-code: 3009-9162
MD, Dr. Sci. (Medicine), Professor
Russian Federation, Moscow; MoscowReferences
- Oleynikova TA, Barybina ES. Regional differences in indicators of general and primary mental disorders in Russia. Current problems of health care and medical statistics. 2022;(3): 679–692. doi: 10.24412/2312-2935-2022-3-679-692 EDN: ODCFHO
- World Health Organisation. World mental health report: transforming mental health for all [Internet]. Geneva: WHO; 2022 [cited 2024 Jun 5]. Available from: https://iris.who.int/bitstream/handle/10665/356119/9789240049338-eng.pdf?sequence=1
- Chekroud AM, Bondar J, Delgadillo J, et al. The promise of machine learning in predicting treatment outcomes in psychiatry. World Psychiatry. 2021;20(2):154–170. doi: 10.1002/wps.20882 EDN: WODVXR
- Rush AJ, Trivedi MH, Wisniewski SR, et al. Acute and longer-term outcomes in depressed outpatients requiring one or several treatment steps: a STAR*D report. American Journal of Psychiatry. 2006;163(11):1905–1917. doi: 10.1176/ajp.2006.163.11.1905 EDN: IVQWHF
- Hirschfeld RM. Differential diagnosis of bipolar disorder and major depressive disorder. Journal of Affective Disorders. 2014;169(Suppl. 1):S12–S16. doi: 10.1016/S0165-0327(14)70004-7
- Trivedi MH, Rush AJ, Wisniewski SR, et al; STAR*D Study Team. Evaluation of outcomes with citalopram for depression using measurement-based care in STAR*D: implications for clinical practice. American Journal of Psychiatry. 2006;163(1):28–40. doi: 10.1176/appi.ajp.163.1.28
- Souery D, Serretti A, Calati R, et al. Switching antidepressant class does not improve response or remission in treatment-resistant depression. Journal of Clinical Psychopharmacology. 2011;31(4):512–516. doi: 10.1097/JCP.0b013e3182228619 EDN: ZUCAGB
- years of precision medicine in oncology. The Lancet. 2021;397(10287):1781. doi: 10.1016/S0140-6736(21)01099-0 EDN: MWXXOM
- Tsvetkova LA, Cherchenko OV. Big data technology in medicine and healthcare in Russia and in the world. Medical Doctor and IT. 2016;(3):60–73. EDN: WMPOXN
- Chen ZhS, Kulkarni PP, Galatzer-Levy IR, et al. Modern views of machine learning for precision psychiatry. Patterns. 2022;3(11):100602. doi: 10.1016/j.patter.2022.100602 EDN: IQJLGK
- Koutsouleris N, Hauser TU, Skvortsova V, De Choudhury M. From promise to practice: towards the realisation of AI-informed mental health care. The Lancet Digital Health. 2022;4(11):e829–e840. doi: 10.1016/S2589-7500(22)00153-4 EDN: WQOPTS
- Passos IC, Ballester P, Rabelo-da-Ponte FD, Kapczinski F. Precision psychiatry: the future is now. The Canadian Journal of Psychiatry. 2021;67(1):21–25. doi: 10.1177/0706743721998044 EDN: TEGSTI
- Doraiswamy PM, Blease Ch, Bodner K. Artificial intelligence and the future of psychiatry: Insights from a global physician survey. Artificial Intelligence in Medicine. 2020;102:101753. doi: 10.1016/j.artmed.2019.101753 EDN: HCXKRN
- Rogan J, Bucci S, Firth J. Health care professionals’ views on the use of passive sensing, AI, and machine learning in mental health care: systematic review with meta-synthesis. JMIR Mental Health. 2024;11:e49577. doi: 10.2196/49577 EDN: GISVDP
- Monteith S, Glenn T, Geddes JR, et al. Artificial intelligence and increasing misinformation. The British Journal of Psychiatry. 2023;224(2):33–35. doi: 10.1192/bjp.2023.136 EDN: AHHPXI
- Harris E. Machine learning algorithms failed to find depression biomarker. JAMA. 2024;331(7):554. doi: 10.1001/jama.2023.28339 EDN: JYXHQB
- Sahoo JP, Narayan BN, Santi NS. The future of psychiatry with artificial intelligence: can the man-machine duo redefine the tenets? Consortium Psychiatricum. 2023;4(3):72–76. doi: 10.17816/CP13626 EDN: KTPGMU
- Ray A, Bhardwaj A, Malik YK, et al. Artificial intelligence and psychiatry: an overview. Asian Journal of Psychiatry. 2022;70:103021. doi: 10.1016/j.ajp.2022.103021 EDN: GBXYZG
- Goodfellow I, Bengio Y, Courville A. Deep learning. Cambridge, MA: MIT Press; 2016.
- Chollet F. Deep learning with python. New York: Manning Publications; 2017.
- Shalev-Shwartz S, Ben-David S. Understanding machine learning: from theory to algorithms. New York: Cambridge University Press; 2014. doi: 10.1017/CBO9781107298019
- Orrù G, Monaro M, Conversano C, et al. Machine Learning in Psychometrics and Psychological Research. Frontiers in Psychology. 2020;10:. doi: 10.3389/fpsyg.2019.02970 EDN: SUIVNX
- Nielsen AN, Barch DM, Petersen SE, et al. Machine Learning With Neuroimaging: Evaluating Its Applications in Psychiatry. Biological Psychiatry: Cognitive Neuroscience and Neuroimaging. 2020;5(8):791–798. doi: 10.1016/j.bpsc.2019.11.007 EDN: OXBXJE
- Janssen RJ, Mourão-Miranda J, Schnack HG. Making Individual Prognoses in Psychiatry Using Neuroimaging and Machine Learning. Biological Psychiatry: Cognitive Neuroscience and Neuroimaging. 2018;3(9):798–808. doi: 10.1016/j.bpsc.2018.04.004 EDN: VFTDSS
- Gao S, Calhoun VD, Sui J. Machine learning in major depression: From classification to treatment outcome prediction. CNS Neuroscience & Therapeutics 2018;24(11):1037–1052. doi: 10.1111/cns.13048 EDN: YIYUHJ
- Choi RY, Coyner AS, Kalpathy-Cramer J, et al. Introduction to machine learning, neural networks, and deep learning. Transl Vis Sci Technol. 2020;9(2):14. doi: 10.1167/tvst.9.2.14
- Chapelle O, Scholkopf B, Zien A. Semi-supervised learning. London: The MIT press; 2006. doi: 10.7551/mitpress/9780262033589.001.0001
- Casalino G, Castellano G, Hryniewicz O, et al. Semi-supervised vs. supervised learning for mental health monitoring: a case study on bipolar disorder. International Journal of Applied Mathematics and Computer Science. 2023;33(3):419–428. doi: 10.34768/amcs-2023-0030 EDN: GOPANB
- Zhang YJ, Hu LSh. Fault propagation inference based on a graph neural network for steam turbine systems. Energies. 2021;14(2):309. doi: 10.3390/en14020309 EDN: NNNPCK
- Pelin H, Ising M, Stein F, et al. Identification of transdiagnostic psychiatric disorder subtypes using unsupervised learning. Neuropsychopharmacology. 2021;46(11):1895–1905. doi: 10.1038/s41386-021-01051-0 EDN: UJLLNA
- James G, Witten D, Hastie T, et al. Unsupervised Learning. In: James G, Witten D, Hastie T, et al. An introduction to statistical learning: with applications in Python. Switzerland: Springer; 2023. P. 503–556. doi: 10.1007/978-3-031-38747-0_12
- Koppe G, Meyer-Lindenberg A, Durstewitz D. Deep learning for small and big data in psychiatry. Neuropsychopharmacology 2020;46(1):176–190. doi: 10.1038/s41386-020-0767-z EDN: ZLJVOQ
- Thompson PM, Andreassen OA, Arias-Vasquez A, et al. ENIGMA and the individual: predicting factors that affect the brain in 35 countries worldwide. NeuroImage. 2017;145(Pt B):389–408. doi: 10.1016/j.neuroimage.2015.11.057 EDN: YUUHXZ
- Abrol A, Fu Z, Salman M, et al. Deep learning encodes robust discriminative neuroimaging representations to outperform standard machine learning. Nature Communications. 2021;12(1):353. doi: 10.1038/s41467-020-20655-6 EDN: IKGWJA
- Quaak M, van de Mortel L, Thomas RM, van Wingen G. Deep learning applications for the classification of psychiatric disorders using neuroimaging data: systematic review and meta-analysis. NeuroImage: Clinical. 2021;30:102584. doi: 10.1016/j.nicl.2021.102584 EDN: HPDNMR
- Squires M, Tao X, Elangovan S, et al. Deep learning and machine learning in psychiatry: a survey of current progress in depression detection, diagnosis and treatment. Brain Informatics. 2023;10(1):10. doi: 10.1186/s40708-023-00188-6 EDN: TPRDEE
- Castelvecchi D. Can we open the black box of AI? Nature. 2016;538(7623):20–23. doi: 10.1038/538020a
- Rudin C. Stop explaining black box machine learning models for high stakes decisions and use interpretable models instead. Nature Machine Intelligence. 2019;1(5):206–215. doi: 10.1038/s42256-019-0048-x
- Briganti G. Artificial intelligence in psychiatry. Psychiatria Danubina. 2023;35(Suppl. 2):15–19.
- Lin E, Lin ChH, Lane HYu. Precision psychiatry applications with pharmacogenomics: artificial intelligence and machine learning approaches. International Journal of Molecular Sciences. 2020;21(3):969. doi: 10.3390/ijms21030969 EDN: ZHSDMD
- Sajno E, Bartolotta S, Tuena C, et al. Machine learning in biosignals processing for mental health: a narrative review. Frontiers in Psychology. 2023;13: doi: 10.3389/fpsyg.2022.1066317 EDN: LJZGQV
- Meisler SL, Kahana MJ, Ezzyat Y. Does data cleaning improve brain state classification? Journal of Neuroscience Methods. 2019;328:108421. doi: 10.1016/j.jneumeth.2019.108421 EDN: ETRDMP
- Bzdok D, Meyer-Lindenberg A. Machine learning for precision psychiatry: opportunities and challenges. Biological Psychiatry: Cognitive Neuroscience and Neuroimaging. 2018;3(3):223–230. doi: 10.1016/j.bpsc.2017.11.007
- Brossollet I, Gallet Q, Favre P, Houenou J. Machine learning and brain imaging for psychiatric disorders: new perspectives. In: Colliot O, editor. Machine learning for brain disorders. New York: Human New York; 2023. P. 1009–1036. doi: 10.1007/978-1-0716-3195-9_32
- Zeng LL, Shen H, Liu L, et al. Identifying major depression using whole-brain functional connectivity: a multivariate pattern analysis. Brain. 2012;135(5):1498–1507. doi: 10.1093/brain/aws059
- Liu Yu, Pu Ch, Xia Sh, et al. Machine learning approaches for diagnosing depression using EEG: a review. Translational Neuroscience. 2022;13(1):224–235. doi: 10.1515/tnsci-2022-0234 EDN: RCXDYH
- Wu CT, Huang HC, Huang S, et al. Resting-State EEG Signal for major depressive disorder detection: a systematic validation on a large and diverse dataset. Biosensors. 2021;11(12):499. doi: 10.3390/bios11120499 EDN: KVWWIN
- Claude LA, Houenou J, Duchesnay E, Favre P. Will machine learning applied to neuroimaging in bipolar disorder help the clinician? A critical review and methodological suggestions. Bipolar Disorders. 2020;22(4):334–355. doi: 10.1111/bdi.12895 EDN: KEDUAL
- Mwangi B, Wu MJ, Bauer IE, et al. Predictive classification of pediatric bipolar disorder using atlas-based diffusion weighted imaging and support vector machines. Psychiatry Research: Neuroimaging. 2015;234(2):265–271. doi: 10.1016/j.pscychresns.2015.10.002
- Besga A, Termenon M, Graña M, et al. Discovering Alzheimer's disease and bipolar disorder white matter effects building computer aided diagnostic systems on brain diffusion tensor imaging features. Neuroscience Letters. 2012;520(1):71–76. doi: 10.1016/j.neulet.2012.05.033
- Jie NF, Zhu MH, Ma XY, et al. Discriminating bipolar disorder from major depression based on SVM-FoBa: efficient feature selection with multimodal brain imaging data. IEEE Transactions on Autonomous Mental Development. 2015;7(4):320–331. doi: 10.1109/TAMD.2015.2440298
- Nunes A, Schnack HG, Ching CRK, et al; for the ENIGMA Bipolar Disorders Working Group. Using structural MRI to identify bipolar disorders – 13 site machine learning study in 3020 individuals from the ENIGMA bipolar disorders working group. Molecular Psychiatry. 2018;25(9):2130–2143. doi: 10.1038/s41380-018-0228-9 EDN: LBYLFZ
- Schwarz E, Doan NT, Pergola G, et al; The IMAGEMEND Consortium, Karolinska Schizophrenia Project (KaSP) Consortium. Reproducible grey matter patterns index a multivariate, global alteration of brain structure in schizophrenia and bipolar disorder. Translational Psychiatry. 2019;9(1):12. doi: 10.1038/s41398-018-0225-4 EDN: RIAGYN
- Lin K, Shao R, Geng X, et al. Illness, at-risk and resilience neural markers of early-stage bipolar disorder. Journal of Affective Disorders. 2018;238:16–23. doi: 10.1016/j.jad.2018.05.017
- Grotegerd D, Suslow T, Bauer J, et al. Discriminating unipolar and bipolar depression by means of fMRI and pattern classification: a pilot study. European Archives of Psychiatry and Clinical Neuroscience. 2012;263(2):119–131. doi: 10.1007/s00406-012-0329-4 EDN: UDZFEB
- Vai B, Parenti L, Bollettini I, et al. Predicting differential diagnosis between bipolar and unipolar depression with multiple kernel learning on multimodal structural neuroimaging. European Neuropsychopharmacology. 2020;34:28–38. doi: 10.1016/j.euroneuro.2020.03.008 EDN: FFHKXU
- Watts D, Pulice RF, Reilly J, et al. Predicting treatment response using EEG in major depressive disorder: a machine-learning meta-analysis. Translational Psychiatry. 2022;12(1):1–18. doi: 10.1038/s41398-022-02064-z EDN: JQTPLK
- Liu F, Guo W, Yu D, et al. Classification of different therapeutic responses of major depressive disorder with multivariate pattern analysis method based on structural MR scans. PLoS ONE. 2012;7(7):e40968. doi: 10.1371/journal.pone.0040968
- Jiang R, Abbott CC, Jiang T, et al. SMRI biomarkers predict electroconvulsive treatment outcomes: accuracy with independent data sets. Neuropsychopharmacology. 2017;43(5):1078–1087. doi: 10.1038/npp.2017.165
- Wade BSC, Joshi SH, Njau S, et al. Effect of electroconvulsive therapy on striatal morphometry in major depressive disorder. Neuropsychopharmacology. 2016;41(10):2481–2491. doi: 10.1038/npp.2016.48
- Fleck DE, Ernest N, Adler CM, et al. Prediction of lithium response in first-episode mania using the LITHium intelligent agent (LITHIA): pilot data and proof-of-concept. Bipolar Disorders. 2017;19(4):259–272. doi: 10.1111/bdi.12507
- Drysdale AT, Grosenick L, Downar J, et al. Resting-state connectivity biomarkers define neurophysiological subtypes of depression. Nature Medicine. 2016;23(1):28–38. doi: 10.1038/nm.4246
- Wu MJ, Mwangi B, Bauer IE, et al. Identification and individualized prediction of clinical phenotypes in bipolar disorders using neurocognitive data, neuroimaging scans and machine learning. NeuroImage. 2017;145(Pt B):254–264. doi: 10.1016/j.neuroimage.2016.02.016 EDN: YVYGFJ
- Cearns M, Opel N, Clark S, et al. Predicting rehospitalization within 2 years of initial patient admission for a major depressive episode: a multimodal machine learning approach. Translational Psychiatry. 2019;9(1):285. doi: 10.1038/s41398-019-0615-2 EDN: LXKHGX
- Winter NR, Blanke J, Leenings R, et al. A systematic evaluation of machine learning–based biomarkers for major depressive disorder. JAMA Psychiatry. 2024;81(4):386. doi: 10.1001/jamapsychiatry.2023.5083 EDN: KSKMUN
- Schulz MA, Yeo BTT, Vogelstein JT, et al. Different scaling of linear models and deep learning in UKBiobank brain images versus machine-learning datasets. Nature Communications. 2020;11(1):1–15. doi: 10.1038/s41467-020-18037-z EDN: RMGYTD
- Le Glaz A, Haralambous Ya, Kim-Dufor DH, et al. Machine learning and natural language processing in mental health: systematic review. Journal of Medical Internet Research. 2021;23(5):e15708. doi: 10.2196/15708 EDN: AYMEHT
- De Choudhury M, Gamon M, Counts S, Horvitz E. Predicting depression via social media. Proceedings of the International AAAI Conference on Web and Social Media. 2021;7(1):128–137. doi: 10.1609/icwsm.v7i1.14432 EDN: ZCZNTB
- Reece AG, Reagan AJ, Lix KLM, et al. Forecasting the onset and course of mental illness with Twitter data. Scientific Reports. 2017;7(1):13006. doi: 10.1038/s41598-017-12961-9
- Tsugawa S, Kikuchi Y, Kishino F, et al. Recognizing depression from Twitter activity. In: Proceedings of the 33rd Annual ACM Conference on Human Factors in Computing Systems. New York, 2015. New York: Association for Computing Machinery; 2015. P. 3187–3196. doi: 10.1145/2702123.2702280
- Eichstaedt JC, Smith RJ, Merchant RM, et al. Facebook language predicts depression in medical records. Proceedings of the National Academy of Sciences. 2018;115(44):11203–11208. doi: 10.1073/pnas.1802331115 EDN: ZJVQWC
- Ahmad Wani M, ELAffendi MA, Shakil KA, et al. Depression screening in humans with AI and deep learning techniques. IEEE Transactions on Computational Social Systems. 2023;10(4):2074–2089. doi: 10.1109/TCSS.2022.3200213 EDN: TWZLUP
- Rosa RL, Schwartz GM, Ruggiero WV, Rodriguez DZ. A knowledge-based recommendation system that includes sentiment analysis and deep learning. IEEE Transactions on Industrial Informatics. 2019;15(4):2124–2135. doi: 10.1109/TII.2018.2867174
- Rumshisky A, Ghassemi M, Naumann T, et al. Predicting early psychiatric readmission with natural language processing of narrative discharge summaries. Translational Psychiatry. 2016;6(10):e921. doi: 10.1038/tp.2015.182
- Edgcomb J, Shaddox T, Hellemann G, Brooks JO. High-risk phenotypes of early psychiatric readmission in bipolar disorder with comorbid medical illness. Psychosomatics. 2019;60(6):563–573. doi: 10.1016/j.psym.2019.05.002
- Bantilan N, Malgaroli M, Ray B, Hull TD. Just in time crisis response: suicide alert system for telemedicine psychotherapy settings. Psychotherapy Research. 2020;31(3):289–299. doi: 10.1080/10503307.2020.1781952 EDN: LNBXVO
- Low DM, Bentley KH, Ghosh SS. Automated assessment of psychiatric disorders using speech: a systematic review. Laryngoscope Investigative Otolaryngology. 2020;5(1):96–116. doi: 10.1002/lio2.354 EDN: DGKCIS
- Cummins N, Scherer S, Krajewski J, et al. A review of depression and suicide risk assessment using speech analysis. Speech Communication. 2015;71:10–49. doi: 10.1016/j.specom.2015.03.004
- Vázquez-Romero A, Gallardo-Antolín A. Automatic detection of depression in speech using ensemble convolutional neural networks. Entropy. 2020;22(6):688. doi: 10.3390/e22060688 EDN: VAJJXC
- Weiner L, Guidi A, Doignon-Camus N, et al. Vocal features obtained through automated methods in verbal fluency tasks can aid the identification of mixed episodes in bipolar disorder. Translational Psychiatry. 2021;11(1):415. doi: 10.1038/s41398-021-01535-z EDN: LPQQSW
- Baltrusaitis T, Zadeh A, Lim YC, Morency LP. OpenFace 2.0: facial behavior analysis toolkit. In: 2018 13th IEEE International Conference on Automatic Face & Gesture Recognition (FG 2018). Xi’an, 2018 May 15–19. Xi’an: IEEE; 2018. P. 59–66. doi: 10.1109/FG.2018.00019
- Ray A, Kumar S, Reddy R, et al. Multi-level attention network using text, audio and video for depression prediction. In: Proceedings of the 9th International on Audio/Visual Emotion Challenge and Workshop. Nice, 2019 Oct 21. New York: Association for Computing Machinery; 2019. P. 81–88. doi: 10.1145/3347320.3357697
- Shao W, You Zh, Liang L, et al. A multi-modal gait analysis-based detection system of the risk of depression. IEEE Journal of Biomedical and Health Informatics. 2022;26(10):4859–4868. doi: 10.1109/JBHI.2021.3122299 EDN: ZGDNXA
- Zhu Y, Shang Y, Shao Z, Guo G. Automated depression diagnosis based on deep networks to encode facial appearance and dynamics. IEEE Transactions on Affective Computing. 2018;9(4):578–584. doi: 10.1109/TAFFC.2017.2650899
- Birnbaum ML, Abrami A, Heisig S, et al. Acoustic and facial features from clinical interviews for machine learning-based psychiatric diagnosis: algorithm development. JMIR Mental Health. 2022;9(1):e24699. doi: 10.2196/24699 EDN: MMIGWG
- Lam G, Dongyan H, Lin W. Context-aware deep learning for multi-modal depression detection. In: ICASSP 2019 - 2019 IEEE International Conference on Acoustics, Speech and Signal Processing (ICASSP). Brightone, 2018 May 12–17. Brightone: IEEE; 2019. P. 3946–3950. doi: 10.1109/ICASSP.2019.8683027
- Dibeklioglu H, Hammal Z, Cohn JF. Dynamic multimodal measurement of depression severity using deep autoencoding. IEEE Journal of Biomedical and Health Informatics. 2018;22(2):525–536. doi: 10.1109/JBHI.2017.2676878
- Garcia-Ceja E, Riegler M, Nordgreen T, et al. Mental health monitoring with multimodal sensing and machine learning: a survey. Pervasive and Mobile Computing. 2018;51:1–26. doi: 10.1016/j.pmcj.2018.09.003 EDN: VJHZEI
- Maatoug R, Oudin A, Adrien V, et al. Digital phenotype of mood disorders: a conceptual and critical review. Frontiers in Psychiatry. 2022;13:1–13. doi: 10.3389/fpsyt.2022.895860 EDN: GUKWZR
- Seppälä J, De Vita I, Jämsä T, et al; M-RESIST Group. Mobile phone and wearable sensor-based mHealth approaches for psychiatric disorders and symptoms: systematic review. JMIR Mental Health. 2019;6(2):e9819. doi: 10.2196/mental.9819
- Renn BN, Pratap A, Atkins DC, et al. Smartphone-based passive assessment of mobility in depression: challenges and opportunities. Mental Health and Physical Activity. 2018;14:136–139. doi: 10.1016/j.mhpa.2018.04.003
- Place S, Blanch-Hartigan D, Rubin C, et al. Behavioral indicators on a mobile sensing platform predict clinically validated psychiatric symptoms of mood and anxiety disorders. Journal of Medical Internet Research. 2017;19(3):e75. doi: 10.2196/jmir.6678
- Opoku Asare K, Terhorst Ya, Vega Ju, et al. Predicting depression from smartphone behavioral markers using machine learning methods, hyperparameter optimization, and feature importance analysis: exploratory study. JMIR mHealth and uHealth. 2021;9(7):e26540. doi: 10.2196/26540 EDN: RJIIAK
- Razavi R, Gharipour A, Gharipour M. Depression screening using mobile phone usage metadata: a machine learning approach. Journal of the American Medical Informatics Association. 2020;27(4):522–530. doi: 10.1093/jamia/ocz221 EDN: IEEJUL
- Yue C, Ware S, Morillo R, et al. Automatic depression prediction using Internet traffic characteristics on smartphones. Smart Health. 2020;18:100137. doi: 10.1016/j.smhl.2020.100137 EDN: JTSCUZ
- Saeb S, Zhang M, Karr CJ, et al. Mobile phone sensor correlates of depressive symptom severity in daily-life behavior: an exploratory study. Journal of Medical Internet Research. 2015;17(7):e175. doi: 10.2196/jmir.4273
- Tonon AC, Fuchs DFP, Barbosa Gomes W, et al. Nocturnal motor activity and light exposure: objective actigraphy-based marks of melancholic and non-melancholic depressive disorder. Brief report. Psychiatry Research. 2017;258:587–590. doi: 10.1016/j.psychres.2017.08.025
- Schulte A, Breiksch T, Brockmann J, Bauer N. Machine learning based classification of depression using motor activity data and autoregressive model. Studies in Health Technology and Informatics. 2022;296:25–32. doi: 10.3233/SHTI220800
- Schneider J, Bakštein E, Kolenič M, et al. Motor activity patterns can distinguish between interepisode bipolar disorder patients and healthy controls. CNS Spectrums. 2020;27(1):82–92. doi: 10.1017/S1092852920001777 EDN: HIYLDA
- Lyall LM, Sangha N, Zhu X, et al. Subjective and objective sleep and circadian parameters as predictors of depression-related outcomes: a machine learning approach in UK biobank. Journal of Affective Disorders. 2023;335:83–94. doi: 10.1016/j.jad.2023.04.138 EDN: MEFDLM
- Jakobsen P, Garcia-Ceja E, Riegler M, et al. Applying machine learning in motor activity time series of depressed bipolar and unipolar patients compared to healthy controls. PLOS ONE. 2020;15(8):e0231995. doi: 10.1371/journal.pone.0231995 EDN: WPAFQM
- Carnevali L, Thayer JF, Brosschot JF, Ottaviani C. Heart rate variability mediates the link between rumination and depressive symptoms: a longitudinal study. International Journal of Psychophysiology. 2018;131:131–138. doi: 10.1016/j.ijpsycho.2017.11.002 EDN: YFCYHZ
- Chen X, Yang R, Kuang D, et al. Heart rate variability in patients with major depression disorder during a clinical autonomic test. Psychiatry Research. 2017;256:207–211. doi: 10.1016/j.psychres.2017.06.041
- Byun S, Kim AY, Jang EH, et al. Entropy analysis of heart rate variability and its application to recognize major depressive disorder: a pilot study. Technology and Health Care. 2019;27(Suppl. 1):407–424. doi: 10.3233/THC-199037
- Kuang D, Yang R, Chen X, et al. Depression recognition according to heart rate variability using Bayesian Networks. Journal of Psychiatric Research. 2017;95:282–287. doi: 10.1016/j.jpsychires.2017.09.012 EDN: VPNRAD
- Nickels S, Edwards MD, Poole SF, et al. Toward a mobile platform for real-world digital measurement of depression: user-centered design, data quality, and behavioral and clinical modeling. JMIR Mental Health. 2021;8(8):e27589. doi: 10.2196/27589 EDN: YIRTSR
- Narziev N, Goh H, Toshnazarov K, et al. STDD: short-term depression detection with passive sensing. Sensors. 2020;20(5):1396. doi: 10.3390/s20051396 EDN: PYUQKL
- Cho CH, Lee T, Kim MG, et al. Mood prediction of patients with mood disorders by machine learning using passive digital phenotypes based on the circadian rhythm: prospective observational cohort study. Journal of Medical Internet Research. 2019;21(4):e11029. doi: 10.2196/11029
- Maciukiewicz M, Marshe VS, Hauschild AC, et al. GWAS-based machine learning approach to predict duloxetine response in major depressive disorder. Journal of Psychiatric Research. 2018;99:62–68. doi: 10.1016/j.jpsychires.2017.12.009
- Athreya AP, Neavin D, Carrillo-Roa T, et al. Pharmacogenomics-driven prediction of antidepressant treatment outcomes: a machine-learning approach with multi-trial replication. Clinical Pharmacology & Therapeutics. 2019;106(4):855–865. doi: 10.1002/cpt.1482
- Eugene AR, Masiak J, Eugene B. Predicting lithium treatment response in bipolar patients using gender-specific gene expression biomarkers and machine learning. F1000Research. 2018;7:474. doi: 10.12688/f1000research.14451.3
- Qi B, Fiori LM, Turecki G, Trakadis YJ. Machine learning analysis of blood microRNA data in major depression: a case-control study for biomarker discovery. International Journal of Neuropsychopharmacology. 2020;23(8):505–510. doi: 10.1093/ijnp/pyaa029 EDN: AFSOEL
- Lin E, Kuo PH, Liu YL, et al. A deep learning approach for predicting antidepressant response in major depression using clinical and genetic biomarkers. Frontiers in Psychiatry. 2018;9:1–10. doi: 10.3389/fpsyt.2018.00290
- Chang B, Choi Y, Jeon M, et al. ARPNet: antidepressant response prediction network for major depressive disorder. Genes. 2019;10(11):907. doi: 10.3390/genes10110907
- Bracher-Smith M, Crawford K, Escott-Price V. Machine learning for genetic prediction of psychiatric disorders: a systematic review. Molecular Psychiatry. 2020;26(1):70–79. doi: 10.1038/s41380-020-0825-2 EDN: WJVOFG
- Pirooznia M, Seifuddin F, Judy J, et al. Data mining approaches for genome-wide association of mood disorders. Psychiatric Genetics. 2012;22(2):55–61. doi: 10.1097/YPG.0b013e32834dc40d
- Thompson DJ, Well D, Selzam S, et al. UK Biobank release and systematic evaluation of optimised polygenic risk scores for 53 diseases and quantitative traits. medRxiv. 2022. doi: 10.1101/2022.06.16.22276246
- Acikel C, Aydin Son Y, Celik C, Gul H. Evaluation of novel candidate variations and their interactions related to bipolar disorders: analysis of GWAS data. Neuropsychiatric Disease and Treatment. 2016;12:2997–3004. doi: 10.2147/NDT.S112558 EDN: XZHYZF
- Laksshman S, Bhat RR, Viswanath V, Li X. DeepBipolar: identifying genomic mutations for bipolar disorder via deep learning. Human Mutation. 2017;38(9):1217–1224. doi: 10.1002/humu.23272
- Wollenhaupt-Aguiar B, Librenza-Garcia D, Bristot G, et al. Differential biomarker signatures in unipolar and bipolar depression: a machine learning approach. Australian & New Zealand Journal of Psychiatry. 2019;54(4):393–401. doi: 10.1177/0004867419888027
- Lahat D, Adali T, Jutten C. Multimodal data fusion: an overview of methods, challenges, and prospects. Proceedings of the IEEE. 2015;103(9):1449–1477. doi: 10.1109/JPROC.2015.2460697 EDN: VEUIZL
- Sun J, Dong QX, Wang SW, et al. Artificial intelligence in psychiatry research, diagnosis, and therapy. Asian Journal of Psychiatry. 2023;87:103705. doi: 10.1016/j.ajp.2023.103705 EDN: MIEUPR
- Zhou L, Pan S, Wang J, Vasilakos AV. Machine learning on big data: opportunities and challenges. Neurocomputing. 2017;237:350–361. doi: 10.1016/j.neucom.2017.01.026
- Yamada H, Abe O, Shizukuishi T, et al. Efficacy of distortion correction on diffusion imaging: comparison of FSL eddy and eddy_correct using 30 and 60 directions diffusion encoding. PLoS ONE. 2014;9(11):e112411. doi: 10.1371/journal.pone.0112411
- Birkenbihl C, Emon MA, Vrooman H, et al; Alzheimer’s Disease Neuroimaging Initiative. Differences in cohort study data affect external validation of artificial intelligence models for predictive diagnostics of dementia — lessons for translation into clinical practice. EPMA Journal. 2020;11(3):367–376. doi: 10.1007/s13167-020-00216-z EDN: AUZVYR
- Fröhlich H, Balling R, Beerenwinkel N, et al. From hype to reality: data science enabling personalized medicine. BMC Medicine. 2018;16(1):1–15. doi: 10.1186/s12916-018-1122-7 EDN: BPHVWT
- Riley P. Three pitfalls to avoid in machine learning. Nature. 2019;572(7767):27–29. doi: 10.1038/d41586-019-02307-y
- Jobin A, Ienca M, Vayena E. The global landscape of AI ethics guidelines. Nature Machine Intelligence. 2019;1(9):389–399. doi: 10.1038/s42256-019-0088-2 EDN: HDVOGB
- Fiske A, Henningsen P, Buyx A. Your robot therapist will see you now: ethical implications of embodied artificial intelligence in psychiatry, psychology, and psychotherapy. Journal of Medical Internet Research. 2019;21(5):e13216. doi: 10.2196/13216
- Mosolov SN. Ethical-deontological problems of therapy of mental disorders. S.S. Korsakov Journal of neurology nd psychiatry. 2023;123(9):7–14. doi: 10.17116/jnevro20231230917 EDN: BYVVTE
- Podoplelova ES. Analysis of artificial intelligence methods applied to solving psychiatry problems. Izvestiya SFedU. Engineering sciences. 2022;2(226):180–189. doi: 10.18522/2311-3103-2022-2-180-189 EDN: IMHTOB
- Rutherford S, Kia SM, Wolfers T, et al. The normative modeling framework for computational psychiatry. Nature Protocols. 2022;17(7):1711–1734. doi: 10.1038/s41596-022-00696-5 EDN: OBZNLJ
- Huys QJM, Browning M, Paulus MP, Frank MJ. Advances in the computational understanding of mental illness. Neuropsychopharmacology. 2020;46(1):3–19. doi: 10.1038/s41386-020-0746-4 EDN: SPYYXJ
- Borsboom D. A network theory of mental disorders. World Psychiatry. 2017;16(1):5–13. doi: 10.1002/wps.20375
- Briganti G. On the use of Bayesian artificial intelligence for hypothesis generation in psychiatry. Psychiatria Danubina. 2022;34(Suppl. 8):201–206.
- Ewbank MP, Cummins R, Tablan V, et al. Understanding the relationship between patient language and outcomes in internet-enabled cognitive behavioural therapy: a deep learning approach to automatic coding of session transcripts. Psychotherapy Research. 2020;31(3):300–312. doi: 10.1080/10503307.2020.1788740 EDN: LQUCCR
- Gao Q, Naumann M, Jovanov I, et al. Model-based design of closed loop deep brain stimulation controller using reinforcement learning. In: 2020 ACM/IEEE 11th International Conference on Cyber-Physical Systems (ICCPS). Sydney, 2020 Apr 21–25. Sydney: IEEE; 2020. P. 108–118. doi: 10.1109/ICCPS48487.2020.00018
- Boscardin CK, Gin B, Golde PB, Hauer KE. ChatGPT and generative artificial intelligence for medical education: potential impact and opportunity. Academic Medicine. 2023;99(1):22–27. doi: 10.1097/ACM.0000000000005439 EDN: IAULYR
- Mosolov SN. Comparative efficacy of preventive use of lithium carbonate, carbamazepine and sodium valproate in affective and schizoaffective psychoses. Zhurnal Nevropatologii i Psikhiatrii Imeni S.S.Korsakova. 1991;91(4):78–83. (In Russ) EDN: QZCENT
Supplementary files