Роль двухэнергетической компьютерной томографии в диагностике подагры и других кристаллических артропатий: обзор литературы
- Авторы: Онойко М.В.1, Мершина Е.А.1, Георгинова О.А.1, Плотникова М.Л.1, Панюкова А.В.1, Синицын В.Е.1
-
Учреждения:
- Московский государственный университет имени М.В. Ломоносова
- Выпуск: Том 4, № 2 (2023)
- Страницы: 197-213
- Раздел: Обзоры
- Статья получена: 08.04.2023
- Статья одобрена: 11.05.2023
- Статья опубликована: 12.07.2023
- URL: https://jdigitaldiagnostics.com/DD/article/view/322758
- DOI: https://doi.org/10.17816/DD322758
- ID: 322758
Цитировать
Аннотация
В статье обсуждается принцип работы двухэнергетической компьютерной томографии, её диагностическая точность, наиболее часто встречаемые виды артефактов. Рассматривается возможная зависимость наличия депозитов моноурата натрия при выполнении двухэнергетической компьютерной томографии от других клинических данных, значение двухэнергетической компьютерной томографии в диагностике подагры, её роль в дифференциальной диагностике кристаллических артропатий.
Метод двухэнергетической компьютерной томографии имеет ряд преимуществ по сравнению с диагностическим артроцентезом, являющимся золотым стандартом в диагностике подагры: неинвазивность, скорость выполнения, многократное снижение риска ятрогенных осложнений. Выявление подагры, контроль эффективности лечения, возможность проведения дифференциальной диагностики ― все эти задачи могут реализоваться с помощью двухэнергетической компьютерной томографии.
Полный текст
ВВЕДЕНИЕ
Подагра ― системное ревматологическое заболевание, при котором в результате повышения уровня мочевой кислоты (гиперурикемии) в сыворотке крови происходит отложение кристаллов моноурата натрия в суставной, костной, хрящевой или мягких тканях, и в зависимости от типа поражения могут развиться как подагрический артрит, так и подагрическая нефропатия или уратный нефролитиаз.
ПОДАГРА: СИСТЕМНОЕ ТОФУСНОЕ ЗАБОЛЕВАНИЕ
В последнее десятилетие накоплено большое количество данных, позволяющих относиться к гиперурикемии не только как к маркеру подагры и мочекаменной болезни. Известно, что гиперурикемия играет определённую роль в возникновении и развитии ряда метаболических и гемодинамических заболеваний, в том числе метаболического синдрома, хронической сердечной недостаточности, гипертонии, атеросклероза, ранних инфарктов и инсультов, сахарного диабета.
Для диагностики подагры используются классификационные критерии Американской (American College of Rheumatology, ACR) и Европейской (European Alliance of Associations for Rheumatology, EULAR) ассоциаций ревматологов (2015 г.), включающие как клинические, так лабораторные и инструментальные критерии [1]. Чувствительность и специфичность разработанных критериев составляет 92% и 89% соответственно [1].
Применение данных критериев возможно, если у пациента имеется «входной признак»: как минимум 1 приступ болезненности и отёчности периферического сустава или суставной сумки. Достаточным критерием для установки диагноза «Подагра» является определение при поляризационной микроскопии в синовиальной жидкости или тофусной ткани (макроскопические конгломераты моноурата натрия, окружённые гранулематозным воспалением) кристаллов моноурата натрия, что позволяет считать данный метод золотым стандартом. В случае отсутствия достаточного критерия необходимо переходить к клиническим (типичные клинические симптомы подагры, обнаружение тофусов, временная характеристика приступа), лабораторным (сывороточный уровень мочевой кислоты, анализ суставной жидкости) и инструментальным методам диагностики (ультразвуковое исследование поражённого сустава, двухэнергетическая компьютерная томография) [1]. Каждому из критериев в зависимости от степени специфичности присваивается определённое количество баллов. Согласно классификационным критериям ACR/EULAR-2015, визуальное определение признаков депозитов уратов при проведении двухэнергетической компьютерной томографии (ДЭКТ) оценивается в 4 балла; для верификации диагноза «Подагра» достаточно 8 из 23 баллов. Таким образом, ДЭКТ ― это достаточно весомая часть в верификации диагноза.
Пункция сустава с аспирацией суставной жидкости является инвазивным и болезненным методом, сопряжённым с рядом ограничений и осложнений, что требует поиска дополнительных методов диагностики для установки достоверного диагноза [2, 3]. Одним из альтернативных диагностических инструментов может быть ДЭКТ ― неинвазивный метод, при котором уратные отложения могут быть отделены от окружающих тканей с высокой степенью чувствительности и специфичности [4].
Гиперурикемия, кристаллы моноурата натрия
Подагра ― системное тофусное заболевание, которое характеризуется отложением в различных тканях кристаллов моноурата натрия, в связи с чем развивается воспаление у лиц с гиперурикемией, обусловленной внешнесредовыми и/или генетическими факторами [5].
Вне зависимости от наследственной предрасположенности подагру необходимо рассматривать как стадийно протекающее заболевание [6], где отправной точкой является гиперурикемия ― клиническое состояние, при котором уровень мочевой кислоты в сыворотке крови увеличивается выше 420 мкмоль/л или выше 6 мг/дл и происходит образование кристаллов моноурата натрия [7].
Согласно клинико-лабораторным и инструментальным данным, в течение подагры выделяют четыре последовательные стадии, которые, однако, не всегда переходят из одной в другую: (а) гиперурикемия без симптомов или анамнеза подагры и с отсутствием депозитов кристаллов уратов; (б) бессимптомная гиперурикемия с признаками депозитов кристаллов уратов; (в) гиперурикемия с текущим или предшествующим эпизодом подагрического артрита; (г) гиперурикемия с наличием тофусов, хроническим артритом, эрозивным артритом [5].
При отсутствии адекватной уратснижающей терапии наблюдается прогрессирование заболевания. Вначале происходит формирование конгломератов кристаллов моноурата натрия, которое наблюдается в определённых тканях и зависит от условий окружающей среды. Растворимость моноурата натрия в физиологическом растворе при 37°C составляет 7 мг/дл (416 мкмоль/л), при повышении концентрации моноурата натрия в синовиальной жидкости наблюдается последующее её осаждение на поверхности хряща с дальнейшим его разрушением и проникновением кристаллов моноурата натрия в субхондральную кость [8], что, в конечном итоге, приводит к активному костному ремоделированию. Длительное насыщение синовиальной жидкости кристаллами моноурата натрия приводит к образованию макроскопических отложений моноурата натрия, окружённых гранулематозным воспалением ― тофусами [9]. Чаще всего они обнаруживаются в тканях, богатых протеогликанами (капсула сустава, трубчатые кости, сухожилия и кожа), но могут (относительно редко) встречаться и в тканях паренхиматозных органов. Реакция ткани на отложение моноурата натрия носит характер хронической воспалительной реакции, в которой участвуют как врождённый, так и адаптивный иммунитет [10].
В случае развития хронической подагры увеличиваются частота, продолжительность и тяжесть приступов, происходит формирование тофусов, тяжёлых деформирующих артропатий, наблюдается прогрессирование коморбидной патологии.
Распространённость гиперурикемии, согласно последним эпидемиологическим исследованиям, постепенно увеличивается среди взрослого населения. Так, в Европе и Америке повышенный уровень мочевой кислоты встречается в 0,68–3,9% случаев, а в некоторых частях Китая имеет диапазон от 6,4 до 21,04% [11]. В России данный показатель составляет 16,8% [7], при этом у 5–8% населения гиперурикемия долгое время может протекать бессимптомно. Известно, что гиперурикемия повышает риск развития хронической болезни почек, ожирения, сахарного диабета 2-го типа, сердечно-сосудистого риска и смерти [12, 13].
Методы диагностики подагры
Для установки диагноза «Подагра» необходимо наличие хотя бы одного эпизода артрита сустава (первый плюснефаланговый сустав, голеностопный сустав или средний отдел стопы) или воспаления синовиальной сумки. Вторым достаточным критерием для установки диагноза является определение уровня мочевой кислоты в сыворотке крови и анализ синовиальной жидкости воспалённого сустава или аспират тофуса для определения кристаллов моноурата натрия с использованием поляризационной световой микроскопии [14]. Пунктировать суставы в диагностических целях можно как в острый, так и в межприступный период, однако необходимо помнить, что обработка, длительное хранение синовиальной жидкости, применение уратснижающей терапии в некоторых случаях могут повлиять на достоверность анализа и чувствительность метода обнаружения моноурата натрия [15]. Уровень мочевой кислоты в сыворотке крови повышается периодически у всех пациентов с подагрой, но у 30% больных гиперурикемией не диагностируется даже в период острого подагрического приступа [16], в связи с чем диагноз подагры не следует ставить на основании только уровня мочевой кислоты в сыворотке. У пациентов с нетипичным клиническим течением воспалительной артропатии с целью дифференциальной диагностики, в том числе в отсутствии возможности проведения поляризационной микроскопии синовиальной жидкости, рекомендуется использовать различные методы визуализации для диагностики подагры: рентгенографию, ультразвуковую диагностику и ДЭКТ.
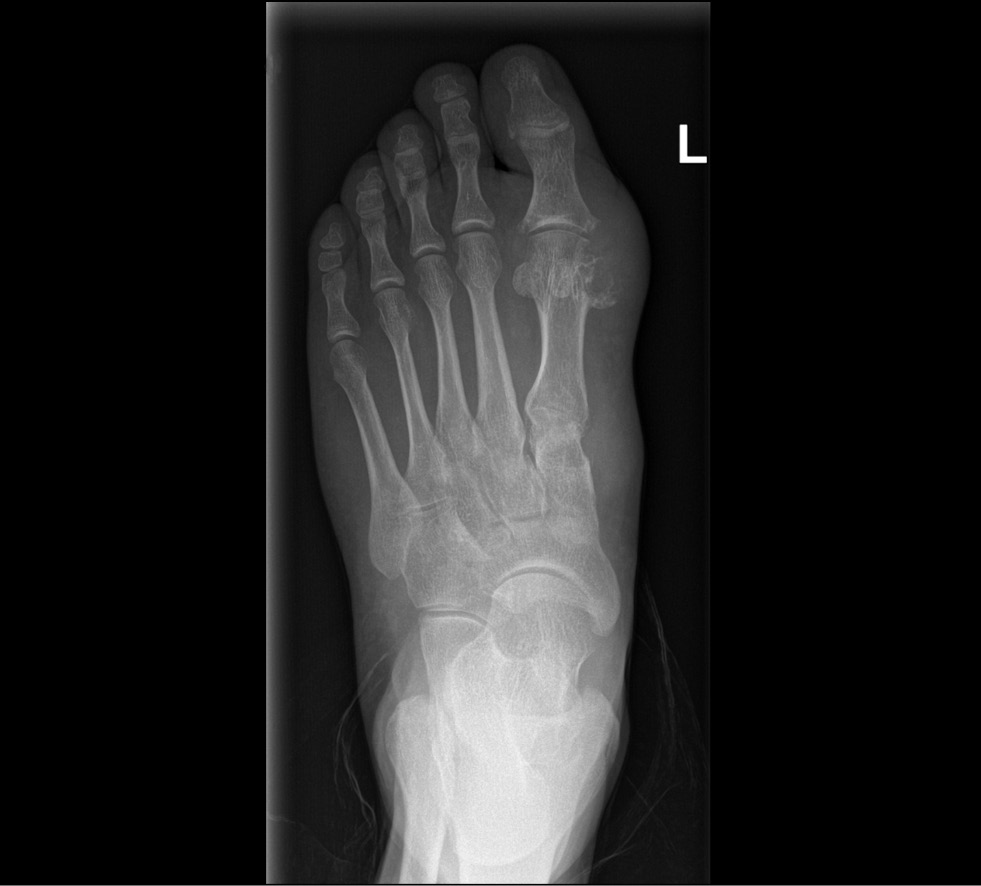
Типичными рентгенологическими признаками подагры являются костные эрозии в виде «пробойников» со склеротическими контурами и нависающими краями, иногда называемыми эрозиями по типу «крысиного укуса» или «крыла чайки» (рис. 1).
Рис. 1. Костные эрозии у пациента с диагнозом подагры (данные рентгенологического исследования МНОЦ МГУ).
При хронической подагре можно выявить суставные тофусы, выглядящие как неоднородные уплотнения мягких тканей. Рентгенологические изменения определяются спустя несколько лет от дебюта подагры и могут быть полезными в верификации диагноза на более поздних стадиях болезни [16, 17].
ДВУХЭНЕРГЕТИЧЕСКАЯ КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ: АЛЬТЕРНАТИВНЫЙ МЕТОД ИНСТРУМЕНТАЛЬНОЙ ДИАГНОСТИКИ ПОДАГРЫ
Альтернативным методом инструментальной диагностики подагры являются ультразвуковое исследование суставов и ДЭКТ, позволяющие определить отложение уратов, тофусы и эрозию кости.
При ультразвуковом исследовании сустава депозиты уратов могут быть выявлены на поверхности суставного хряща в виде гиперэхогенной прерывистой полоски, не зависящей от угла осмотра (эффект двойного контура); или в суставной жидкости в виде плавающих гипер-эхогенных гетерогенных очагов, имеющих вид «снежной бури», а также в виде гиперэхогенных агрегатов, визуализируемых в суставном пространстве или вдоль сухожилий [18].
ДЭКТ имеет преимущество при проведении дифференциальной диагностики, например, между подагрой и септическим артритом или накоплением моноурата натрия и отложением пирофосфата кальция (псевдоподагра, хондрокальциноз) [19, 20]. ДЭКТ позволяет подробно исследовать различные анатомические области, неинвазивно выявляя в них отложения кристаллов моноурата натрия [21–23].
Принцип работы двухэнергетической компьютерной томографии
ДЭКТ представляет собой современный и весьма перспективный метод исследования, заключающийся в спектральной дифференцировке материалов с помощью сканирования определённого участка тела двумя разными типами рентгеновского излучения, отличающимися по энергии. В таких условиях вещества имеют различные коэффициенты поглощения сигнала, что позволяет отличить их по химическому составу. При низком напряжении в рентгеновской трубке (20–50 кВ) рентгеновское излучение полностью поглощается веществом (преобладает фотоэлектрический эффект), а при высоком (50–150 кВ) ― преобладает комптоновское рассеивание, что ведёт к ослаблению сигнала [24, 25]. Вклад фотоэлектрических и комптоновских эффектов для каждого соединения определяется электронной плотностью вещества и атомным номером [24, 26]: чем выше атомный номер и чем ниже электронная плотность (например, йод, кальций, барий, ксенон), тем большее влияние оказывает фотоэлектрическое поглощение, а элементы с малым атомным номером, где электронная плотность выше (углерод, азот, водород, кислород), зависят в большей степени от эффекта Комптона [24]. Так, у таких элементов, как йод, кальций, барий, наблюдается появление К-edge ― спайка сигнала, характеризующего процесс поглощения фотона и выброса фотоэлектрона с К-оболочки. Именно этот феномен лежит в основе ДЭКТ. Благодаря наличию чётко выраженных K-edge у некоторых элементов увеличивается разница между величинами коэффициентов поглощения у исследуемых веществ при разных энергиях, что делает возможным их дифференцировку.
Существует несколько разновидностей ДЭКТ: с двумя перпендикулярно расположенными источниками и детекторами; с одной системой источник–детектор, в которой происходит быстрое переключение напряжения; набор из одного источника рентгеновского излучения и многослойного sandwich-детектора [26]. Обработка данных происходит с помощью методов трёхматериальной (three-material decomposition analysis) или двухматериальной (two-material decomposition analysis) декомпозиции. В случае применяемого в программе для диагностики подагры метода двухматериальной декомпозиции разложение производят по двум составляющим ― мочевой кислоте и кальцию. Мягкие ткани являются «точкой отсчёта», относительно которой алгоритмом будет приниматься решение о наличии кальция либо моноурата натрия в исследуемой области. В результате появляется возможность построить карту по материальной плотности (material density map, MD-карта), на которой каждому компоненту присваивается цветовая кодировка. В варианте ДЭКТ-систем производства Siemens кортикальная кость будет иметь синий цвет, губчатая кость ― розовый, а кристаллы моноурата натрия ― зелёный. В программах обработки других производителей могут использоваться иные цветовые шкалы.
Помимо качественной возможно проведение количественной оценки интересующего химического вещества. В программе Dual Energy Gout автоматически производится вычисление суммарного объёма депозитов моноурата натрия в поле обзора [23]. Необходимо учесть, что в суммарный объём включаются артефакты, поэтому знание об их типах и возможной локализации крайне важно. Используя инструмент обрезки, можно удалить участки зелёного цвета, соответствующие артефактам. Суммарный объём депозитов моноурата натрия будет автоматически пересчитан после выполнения данной операции.
Стоит отметить, что можно выполнять трёхмерную реконструкцию (Volume Rendering Technique, VRT image) с цветовой кодировкой и использовать другие алгоритмы реконструкции, применяемые в исследованиях с иными целями (рис. 2).
Рис. 2. Трёхмерная реконструкция, смешанное изображение и изображение с цветовой кодировкой (область правого голеностопного сустава и мелких суставов стопы): синий цвет ― кортикальная кость; розовый ― губчатая кость; зелёный ― кристаллы моноурата натрия (данные двухэнергетической компьютерной томографии МНОЦ МГУ).
Основным преимуществом ДЭКТ по сравнению с другими методами диагностики является возможность определения химического состава объекта путём сканирования на двух энергетических уровнях, количественной оценки интересующего химического вещества. Неинвазивность, быстрота исследования, отсутствие ятрогенных осложнений ― всё это неоспоримые достоинства ДЭКТ.
Существует ошибочное мнение, что лучевая нагрузка, которую получает пациент при сканировании двумя энергиями, в 2 раза превышает нагрузку, получаемую при сканировании одной энергией. Однако, согласно результатам многочисленных исследований, лучевая нагрузка и качество изображений при выполнении ДЭКТ и одноэнергетической компьютерной томографии сопоставимы [27–29]. Это достигается не только вследствие технических особенностей аппарата, но и благодаря применению методов, снижающих дозу облучения, к которым относят возможность независимой установки силы тока, итеративную реконструкцию и другие современные алгоритмы, использование VNC-изображений (Virtual Non-Contrast image), ограничение размеров FOV (field of view) областью интереса и др. [30, 31].
Благодаря ДЭКТ можно произвести реконструкцию виртуальных монохроматических изображений (Virtual Monochromatic Image, VMC image), которые представляют собой продукт теоретического сканирования с применением монохроматического излучения. Данная программа помогает повысить контрастность, снизить количество артефактов от металлических конструкций [32].
К недостаткам можно отнести маленькое поле обзора (FOV, field of view) для двухэнергетических изображений, которое представляет собой окружность всего 33–35 см в диаметре для разных поколений томографов, возможность ложноположительных и ложноотрицательных результатов, перекрёстное рассеивание (когда фотоны, испускаемые одним источником, попадают в детектор, предназначенный для фотонов другого источника) [33, 34]. Указанные технические несовершенства могут привести к потере данных (рис. 3, a).
Диагностическая точность двухэнергетической компьютерной томографии
Согласно результатам A.N. Baer и соавт. [35], чувствительность ДЭКТ при тофусной форме подагры составляет 100%, а при отсутствии тофусов ― 64%. Чувствительность и специфичность ДЭКТ, по результатам метаанализа A. Ogdie и соавт. [20], составляют 87% и 84% соответственно, что превышает эти же параметры для ультразвукового исследования. В работе T. Bongartz и соавт. [36] чувствительность и специфичность были оценены как 90% и 83% соответственно. Если обратиться к результатам исследования A. Huppertz и соавт. [37], то ДЭКТ оказывается менее чувствительным методом, чем ультразвуковое исследование (100% в сравнении с 84,6%), ввиду более низкой разрешающей способности.
Из вышеуказанных данных следует, что методика ДЭКТ в целом обладает высокой диагностической точностью. Различие результатов у разных исследовательских групп, вероятно, можно объяснить различными областями сканирования, что может иметь значение в определении точности метода, а также различной продолжительностью заболевания у пациентов в некоторых работах [38].
Тем не менее, как и в любом другом методе исследования, наличие ложноположительных и ложноотрицательных результатов неизбежно. Обнаружение объектов, имитирующих кристаллы моноурата натрия, возможно в области ногтевого ложа, кожных мозолей (см. рис. 3, b). Данный ложноположительный результат связан с тем, что двухэнергетический индекс (dual-energy index) кератина совпадает с таковым у моноурата натрия, что на исследовании проявляется одинаковой цветовой кодировкой [39]. Интересно отметить, что наличие данных артефактов более характерно для области стоп, чем кистей рук [39, 40]. Кожа над коленными и локтевыми суставами, как правило, не даёт подобных артефактов.
Металлические конструкции, плотные участки кортикальной кости создают артефакты увеличения жёсткости излучения, которые можно принять за депозиты моноурата натрия [40]. Дело в том, что в случае использования полихроматического излучения происходит увеличение жёсткости излучения (beam hardening), в результате чего фотоны с низкой энергией поглощаются быстрее, а с высокой энергией ― медленнее, что приводит к увеличению общей энергии рентгеновского излучения. Поскольку пучок становится жёстче, ослабление излучения уменьшается, и интенсивность на детекторах растёт, поэтому регистрируемый профиль поглощения будет отличаться от идеального. Таким образом, артефакт проявляется на изображении в виде впадин и тёмных полос между плотными объектами (см. рис. 3, c).
При низком соотношении сигнал/шум (SNR, signal-to-noise ratio) наблюдается появление мелких точечных вкраплений зелёного цвета, мимикрирующих под кристаллы моноурата натрия (см. рис. 3, d), тем не менее необходимо рассмотреть случай истинного отложения моноурата натрия, если зелёные мелкоточечные очаги наблюдаются вдоль какой-либо анатомической структуры, например вдоль ахиллова сухожилия [39].
Рис. 3. Артефакты при выполнении двухэнергетической компьютерной томографии: a ― потеря данных по причине неправильной укладки пациента; b ― артефакт от ногтевого ложа; c ― артефакт увеличения жёсткости излучения от обручального кольца; d ― множественные мелкоточечные артефакты (данные двухэнергетической компьютерной томографии МНОЦ МГУ).
Ложноотрицательный результат возможен при наличии микрокристаллов моноурата натрия менее 2 мм в диаметре, при визуализации тофусов, в которых концентрация моноурата натрия слишком мала, а также при неверной установке технических параметров. Однако артефакты достаточно типичны и в большинстве случаев хорошо распознаются опытным рентгенологом. Существуют способы устранения артефактов, в частности использование различных алгоритмов реконструкции изображений, например кернель, и верная настройка параметров изображения на рабочей станции, таких как «Air Distance», «Resolution», «Minimum [HU]», «Ratio» (для программного обеспечения Syngo.via VB20A_HF06 класса Dual Energy Gout).
Кернель (фильтр реконструкции) ― это математический алгоритм реконструкции компьютерно-томографических изображений [41].
Использование параметра «Air Distance» (расстояние от кристаллов моноурата натрия до воздуха и кости, измеряемое в вокселях) позволяет уменьшить артефакты в области ногтевого ложа и кожи. В результате данной операции все элементы зелёного цвета будут удалены в пределах заданного значения от поверхности кожи, за исключением тех, которые находятся в то же время рядом с костными структурами на расстоянии не более установленного значения.
Параметр «Ratio» представляет собой двухэнергетическое отношение (dual energy ratio), равное отношению плотности материала в единицах Хаундсфилд (HU) на низкой энергии к плотности материала на высокой энергии. Этот параметр крайне важен для отличия кальция от уратов при обработке данных с помощью метода двухматериальной декомпозиции. Увеличение значения «Ratio» ведёт к повышению чувствительности ДЭКТ-исследования по отношению к кристаллам моноурата натрия за счёт снижения его специфичности [39].
Параметр «Minimum [HU]» устанавливает пороговый уровень единиц Хаундсфилд на смешанных изображениях (mixed images), которые, по сути своей, эквивалентны изображениям, полученным при сканировании с напряжением 120 кВ [42]. Для объектов с плотностью меньше заданного значения двухэнергетический индекс рассчитан не будет, им автоматически присваивается значение «0» HU на MD-картах, и, следовательно, для них не будет определена цветовая кодировка [39].
Показатель «Resolution» определяет минимальное число пикселей зелёного цвета, которое будет приниматься программой за отложение моноурата натрия. Если количество таких пикселей в данной области меньше установленного значения, то визуализироваться они не будут.
Наличие дополнительного оловянного фильтра позволяет отсечь фотоны с низкой энергией, уменьшая лучевую нагрузку и улучшая качество изображений.
Сопоставление клинических данных с результатами двухэнергетической компьютерной томографии
В исследовании J.S. Lee и соавт. [43] акцентировано внимание на факторах, которые с большей вероятностью являются предикторами наличия депозитов моноурата натрия на ДЭКТ. В группу таких параметров входят уровень мочевой кислоты в сыворотке крови, наличие почечной недостаточности и продолжительность заболевания. Так, диагностическая ценность ДЭКТ ограничена, если она проводится у пациента с впервые случившимся приступом подагрического артрита, а вероятность положительного результата ДЭКТ повышается у пациентов, страдающих подагрой уже длительное время. E. Jia и соавт. [44] установили, что чувствительность ДЭКТ увеличивается при более продолжительном течении заболевания. Чувствительность ДЭКТ составляла 35,7% на первичном визите по поводу подагры, 61,5% ― в группе пациентов, страдающих подагрой менее двух лет, и 92,9% ― у страдающих подагрой более двух лет. Согласно альтернативным данным, у 15–24% пациентов с асимптомной гиперурикемией наблюдаются отложения моноурата натрия на ДЭКТ, а при первом приступе подагрического артрита ― у 32,8% [43]. Данный факт можно объяснить недостаточным для визуализации объёмом и концентрацией моноурата натрия у больных с впервые случившимся приступом подагрического артрита [45]. Таким образом, можно предположить, что применение методики ДЭКТ представляет больший интерес для динамического наблюдения, нежели для первичной диагностики, в то время как ультразвуковой метод может оказаться полезным именно в случае впервые случившегося подагрического приступа.
Хроническая болезнь почек и подагра являются коморбидными состояниями. Снижение экскреторной функции почек способствует задержке уратов в организме, что повышает вероятность отложения кристаллов моно-урата натрия в суставах и других тканях. С другой стороны, в исследовании J. Shang и соавт. [46] не было выявлено значимой связи между наличием почечной недостаточности и объёмом депозитов моноурата натрия на ДЭКТ.
Предположение о том, что высокая концентрация мочевой кислоты в сыворотке крови коррелирует с положительными результатами исследования ДЭКТ, не всегда является верным. Дело в том, что при гипоурикемической терапии концентрация мочевой кислоты в сыворотке крови будет снижаться, что в дальнейшем приведёт к растворению депозитов моноурата натрия. При выполнении исследования в определённый временной промежуток возможна визуализация ещё не растворившихся кристаллов моноурата натрия при достаточно низкой концентрации мочевой кислоты. Таким образом, наблюдение за абсорбцией отложения уратов с помощью ДЭКТ даёт возможность оценивать эффективность проводимой терапии, а наглядность динамики способствует большей комплаентности пациентов. К тому же, не у всех пациентов с одинаково высоким уровнем мочевой кислоты в крови можно обнаружить депозиты моноурата натрия, следовательно, существуют и другие факторы, влияющие на положительный результат ДЭКТ, такие как генетическая предрасположенность и возраст [47].
В исследовании S. Bayat и соавт. [23] была разработана полуколичественная система оценки отложения кристаллов моноурата натрия (DECT urate scoring system) для наиболее поражаемой зоны ― области стоп: исследуемая область делится на 4 части (первый плюснефаланговый сустав, остальные суставы стопы, лодыжки и сухожилия в области стоп и лодыжек), которым в зависимости от количества и характера депозитов присваиваются баллы и затем суммируются. С помощью полученного результата возможно установить наличие подагры, а также отследить эффективность гипоурикемической терапии. По сравнению с автоматическим подсчётом объёма депозитов моноурата натрия данная методика занимает меньше времени и облегчает работу в участках, где измерение затруднительно. Но данную систему оценки можно применить исключительно для поражений, локализованных в области стоп.
В работе J. Shang и соавт. [46], где использовался полуколичественный метод «DECT urate scoring system», корреляции между балльной оценкой и концентрацией мочевой кислоты в сыворотке крови обнаружено не было, однако была подтверждена связь между количеством моноурата натрия в тканях и длительным периодом заболевания, наличием эрозий и тофусов. Причиной несоответствия между результатами ДЭКТ и уровнем мочевой кислоты может являться и время проведённого исследования. В частности, установлен факт повышенной экскреции мочевой кислоты с мочой во время приступа подагрического артрита [48].
Однако имеются исследования с подтверждённой корреляцией между уровнем мочевой кислоты в сыворотке крови и наличием депозитов моноурата натрия на ДЭКТ. Например, N. Dalbeth и соавт. [49] сообщают, что у 90,0% пациентов с уровнем мочевой кислоты в крови ≥360 мМ и пальпируемыми тофусами были обнаружены отложения уратов, а у пациентов с непальпируемыми тофусами и более низкими данными лабораторного анализа депозиты моноурата натрия визуализировались только в 46,9% случаев. Стоит отметить, что все участники исследования принимали аллопуринол в дозировке 300 мг и более. Данная работа продемонстрировала также больший объём кристаллов моноурата натрия и количество эрозий в группе пациентов с уровнем мочевой кислоты в крови ≥360 мМ и пальпируемыми тофусами в сравнении с больными другой группы.
Возможности двухэнергетической компьютерной томографии в дифференциальной диагностике микрокристаллических артропатий, ассоциированных с отложением солей кальция
К группе микрокристаллических артропатий, помимо подагрического артрита, относятся артриты, возникшие в результате отложения кристаллов пирофосфата кальция и гидроксиапатита кальция.
Болезнь депонирования кристаллов пирофосфата кальция ― это заболевание, при котором происходит накопление кристаллов, в основном пирофосфата кальция, преимущественно в волокнистых и гиалиновых хрящах. Факторами риска являются возраст, травмы сустава, наследственность и наличие таких заболеваний, как гемо-хроматоз, первичный гиперпаратиреоидизм, гипофосфатазия, гипомагниемия [50].
Болезнь депонирования кристаллов пирофосфата кальция достаточно часто симулирует другие состояния, что приводит специалистов различных областей медицины в затруднение при постановке диагноза, а также может сочетаться с другими воспалительными артритами. Например, вероятность развития болезни депонирования кристаллов пирофосфата кальция выше у пациентов, страдающих подагрой или ревматоидным артритом [51]. Ввиду вышеперечисленных причин поиск подходящего метода диагностики для дифференциального диагноза становится необходимостью.
Клинически острый кристаллический артрит, ассоциированный с отложением пирофосфата кальция, достаточно похож на острый артрит, характерный для подагрического приступа, с единственным отличием в его продолжительности. Острый артрит, ассоциированный с отложением пирофосфата кальция, может длиться в течение недель и даже месяцев [52, 53].
Зачастую хронический кристаллический артрит, ассоциированный с отложением пирофосфата кальция, протекает как дегенеративный остеоартрит с признаками механической суставной боли, периодическими клиническими вспышками острого артрита, ассоциированными с отложением пирофосфата кальция [52]. Чаще всего поражаются межфаланговые, второй и третий пястно-фаланговые суставы, коленные суставы [52–54].
Возможно отложение кристаллов пирофосфата кальция по ходу крестообразной связки атланта, что проявляется синдромом «коронованного зуба» (crowned dens syndrome). Клиническая картина неспецифична и заключается в наличии острой боли в области шеи, повышенной температуры, ригидности мышц шеи, затылочной головной боли [55]. В данном случае дифференциальный диагноз проводят с менингитом, гигантоклеточным артериитом, ревматоидным артритом и др.
Иногда кристаллический артрит, ассоциированный с отложением пирофосфата кальция, может проявляться в форме полиартрита и, таким образом, имитировать ревматоидный артрит. Клинически отличия заключаются в том, что поражение суставов ввиду наличия кристаллов пирофосфата кальция возникает последовательно и менее симметрично, чем в случае ревматоидного артрита [53]. Тем не менее ориентироваться на данный клинический параметр достаточно проблематично. Артрит, ассоциированный с отложением пирофосфата кальция, может имитировать не только ревматологические состояния, но и неврологические, онкологические и др. Развитие новых инструментальных методов крайне важно для однозначной и оперативной дифференциальной диагностики.
Для диагностики артрита, ассоциированного с отложением пирофосфата кальция, информативность показателей крови минимальна. Более значимый вклад вносят поляризационная световая микроскопия синовиальной жидкости и инструментальные методы исследования, такие как рентгенологическое, ультразвуковое исследование и компьютерная томография.
На сегодняшний день наиболее часто применяемым методом диагностики в рутинной практике, на основании которого ставится диагноз болезни депонирования кристаллов пирофосфата кальция, считается рентгенологическое исследование, в то время как поляризационная световая микроскопия синовиальной жидкости, согласно рекомендациям Европейской антиревматической лиги (EULAR), является золотым стандартом. Как обсуждалось ранее, данный метод имеет ограничения и недостатки, которые зачастую не поддаются коррекции.
При рентгенологическом исследовании ключевым признаком болезни депонирования кристаллов пирофосфата кальция является наличие хондрокальциноза, которому чаще всего подвергаются мениски, треугольный хрящ в треугольном фиброзно-хрящевом комплексе, лобковый симфиз. Хондрокальциноз визуализируется в виде линейных зон уплотнения, параллельных поверхности кортикальной части кости, либо вкраплений спикулообразной формы, расположенных вдоль хрящевой структуры, либо облаковидных наложений по контуру синовиальной оболочки [56]. Данный метод имеет неоспоримые преимущества, а именно неинвазивность, отсутствие ятрогенных осложнений, скорость выполнения и невысокая стоимость. В то же время рентгенография не является высокочувствительным и абсолютно специфичным методом по отношению к болезни депонирования кристаллов пирофосфата кальция, так как аналогичная картина возможна при отложении в хрящах гидроксиапатита кальция [50]. По данным K.A. Lee и соавт. [57], специфичность и чувствительность данного метода составили 96,9% и 44,2% соответственно.
Отличить остеоартрит, ассоциированный с отложением пирофосфата кальция, от дегенеративного остеоартрита с помощью рентгенологического метода исследования достаточно сложно, так как используемые признаки дифференциальной диагностики не являются абсолютными. К ним относятся наличие более выраженных остеофитов и субхондральных кист, деструкция костной ткани, локализация поражений и клиническая картина воспаления [50, 53, 54, 58]. Так, для дегенеративного остеоартрита менее характерно вовлечение в процесс плечевого сустава, суставов кисти и пястно-фаланговых суставов, чем для остеоартрита, ассоциированного с отложением пирофосфата кальция [53]. Более крупные субхондральные кисты и выраженная деструкция костной ткани чаще наблюдаются при остеоартрите, ассоциированном с пирофосфатом кальция [54]. Стоит также обратить внимание на кальцинированные сухожилие четырёхглавой мышцы и ахиллово сухожилие при наличии признаков хондрокальциноза, что, вероятнее всего, свидетельствует о диагнозе болезни депонирования кристаллов пирофосфата кальция [56].
Ультразвуковое исследование становится всё более популярным благодаря низкой стоимости, мобильности оборудования и удобности в использовании. B. Frediani и соавт. [59] описали три типа ультразвуковых признаков, обнаруживаемых у пациентов, страдающих болезнью депонирования кристаллов пирофосфата кальция. Один из них ― наличие гиперэхогенных линейных полос, параллельных поверхности хряща. Данная картина чаще встречается при отложении пирофосфата кальция в гиалиновых хрящах. Другой признак более характерен для депонирования пирофосфата кальция в волокнистых хрящах и заключается в наличии точечных гипер-эхогенных включений по ходу хрящевой ткани. Реже всего визуализировалась гиперэхогенная взвесь, содержащая подвижные агрегаты кристаллов пирофосфата кальция округлой и/или овальной формы, в полости сустава. По данным K.A. Lee и соавт. [57], специфичность и чувствительность ультразвукового метода составили 77,1% и 74,4% соответственно. Важно обратить внимание на то, что с помощью данного метода, возможно, будет сложно отличить друг от друга ультразвуковые признаки, характерные для подагры и для болезни депонирования кристаллов пирофосфата кальция, особенно врачам, которые не являются специалистами в области ультразвуковой диагностики. К недостаткам метода можно отнести сильную зависимость результатов от оператора. К тому же при выраженных остеофитах на крайних стадиях остеоартрита могут возникнуть трудности в исследовании из-за наличия акустической тени от костной ткани [60].
Компьютерная томография используется в основном в случаях локализации процесса в осевом скелете: при синдроме «коронованного зуба», поражении межпозвоночных дисков [61]. Достаточно чётко визуализируется в атланто-аксиальном суставе обызвествление поперечной связки, крыловидных связок, апикальной связки, крестообразной связки; встречается обызвествление жёлтой связки в виде нодулярных очагов [62].
Роль ДЭКТ в диагностике болезни депонирования кристаллов пирофосфата кальция до сих пор однозначно не определена. На изображениях с цветовой кодировкой, полученных с помощью ДЭКТ в классе «Dual Energy Gout», отложения, содержащие кальций, будут окрашены в синий цвет, что позволяет однозначно отличить их от депозитов моноурата натрия. Стоит отметить, что кортикальная кость кодируется аналогично депозитам пирофосфата кальция и гидроксиапатита ввиду высокого содержания кальция (рис. 4).
Рис. 4. Двухэнергетические изображения с цветовой кодировкой в коронарной и сагиттальной проекциях (область левого коленного сустава). Кальциноз медиального мениска (данные двухэнергетической компьютерной томографии МНОЦ МГУ).
По данным D. Kravchenko и соавт. [63], чувствительность и специфичность ДЭКТ при обнаружении кристаллов пирофосфата кальция составили 55% и 92% соответственно (при длительности заболевания в среднем 1 месяц и с использованием стандартизированных протоколов сканирования для подагры). H. Tanikawa и соавт. [60] установили, что чувствительность и специфичность ДЭКТ при обнаружении кристаллов пирофосфата кальция в менисках ex vivo составили 77,8% и 93,8% соответственно.
В настоящее время не существует специального протокола для болезни депонирования кристаллов пирофосфата кальция, вследствие чего невозможно произвести расчёт объёма депозитов пирофосфата кальция, а в некоторых случаях даже достоверно отличить их от костной ткани. Группой исследователей S.K. Tedeschi и соавт. [64] были модифицированы параметры реконструкции изображений для подагры путём увеличения значения показателя «Iodine Ratio», в результате чего отмечалось увеличение чувствительности метода до 90–100% по отношению к кристаллам пирофосфата кальция. В то же время была потеряна возможность дифференциальной диагностики между кристаллами моноурата натрия и пирофосфата кальция.
К преимуществам ДЭКТ можно отнести способность различать депозиты гидроксиапатита кальция и пирофосфата кальция. Известно, что отложения гидроксиапатита кальция в типичном случае откладываются вдоль сухожилий, но, к сожалению, этот признак не является абсолютным для дифференциальной диагностики. Рентгенологически соли кальция определяются как хондрокальциноз, что тоже не помогает в определении химического состава депозитов. Значения плотности при мультиспиральной компьютерной томографии тоже не могут являться однозначным ориентиром.
С помощью ДЭКТ возможно проведение спектрального анализа депозитов гидроксиапатита кальция и пирофосфата кальция с использованием значений двухэнергетического индекса и эффективного атомного номера (Zeff), которые являются продуктом математической обработки результатов ДЭКТ-сканирования. Данные параметры помогают отличить два типа кристаллов друг от друга [65]. Хотя применение двухэнергетического индекса и Zeff для дифференциальной диагностики депозитов солей кальция ещё не вошло в рутинную практику, это направление достаточно перспективно и интересно для дальнейшего исследования.
ЗАКЛЮЧЕНИЕ
ДЭКТ является перспективным и многообещающим методом диагностики кристаллических артропатий, который имеет ряд преимуществ в сравнении с такими методами исследования, как поляризационная микроскопия, ультразвуковое и рентгенологическое исследование, компьютерная томография. К положительным сторонам ДЭКТ относятся скорость выполнения, исключение риска ятрогенных осложнений, возможность качественной и количественной оценки материала и динамического наблюдения. Этот метод лучевой диагностики решает многие задачи, в частности контроль эффективности проводимой терапии при подагре, возможность проведения дифференциальной диагностики кристаллических артропатий.
Несмотря на то, что данная методика не лишена недостатков, существуют способы, которые помогают достичь корректной интерпретации результатов ДЭКТ.
ДЭКТ мог бы упростить верификацию артритов, ассоциированных с отложением разных типов кристаллов, с нетипичной симптоматикой, однако остаются вопросы, касающиеся диагностики подагры на ранней стадии, возможности достоверного отличия кристаллов пирофосфата кальция и гидроксиапатита кальция, определения их объёма, что требует дальнейших исследований в этой области.
ДОПОЛНИТЕЛЬНО
Источник финансирования. Работа выполнена в рамках государственного задания Московского государственного университета имени М.В. Ломоносова.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: М.В. Онойко ― поиск публикаций по теме статьи, написание текста рукописи; Е.А. Мершина ― экспертная оценка информации, редактирование текста рукописи, утверждение финальной версии; О.А. Георгинова ― экспертная оценка информации, редактирование текста рукописи, утверждение финальной версии; М.Л. Плотникова ― редактирование статьи; А.В. Панюкова ― редактирование статьи; В.Е. Синицын ― экспертная оценка информации, утверждение финальной версии.
ADDITIONAL INFORMATION
Funding source. The work was conducted within the framework of the state assignment of the Lomonosov Moscow State University.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. M.V. Onoyko ― search for publications on the article topic, writing the text of the manuscript; E.A. Mershina ― expert evaluation of information, editing of the text of the manuscript, final version approval; O.A. Georginova ― expert evaluation of information, editing of the text of the manuscript, final version approval; M.L. Plotnikova ― editing of the text of the manuscript; A.V. Panyukova ― editing of the text of the manuscript; V.E. Sinitsin ― expert evaluation of information, final version approval.
Об авторах
Мария Викторовна Онойко
Московский государственный университет имени М.В. Ломоносова
Email: onoykomary@gmail.com
ORCID iD: 0000-0002-7727-3360
Россия, Москва
Елена Александровна Мершина
Московский государственный университет имени М.В. Ломоносова
Email: elena_mershina@mail.ru
ORCID iD: 0000-0002-1266-4926
SPIN-код: 6897-9641
канд. мед. наук, доцент
Россия, МоскваОльга Анатольевна Георгинова
Московский государственный университет имени М.В. Ломоносова
Email: olga.georginova@gmail.com
ORCID iD: 0000-0002-7542-8189
SPIN-код: 8331-3656
канд. мед. наук, доцент
Россия, МоскваМария Леонидовна Плотникова
Московский государственный университет имени М.В. Ломоносова
Email: maria_plotnikova@inbox.ru
ORCID iD: 0000-0001-7533-9867
Россия, Москва
Александра Вадимовна Панюкова
Московский государственный университет имени М.В. Ломоносова
Email: panyukovaalexandra@gmail.com
ORCID iD: 0000-0002-5367-280X
Россия, Москва
Валентин Евгеньевич Синицын
Московский государственный университет имени М.В. Ломоносова
Автор, ответственный за переписку.
Email: vsini@mail.ru
ORCID iD: 0000-0002-5649-2193
SPIN-код: 8449-6590
д-р мед. наук, профессор
Россия, МоскваСписок литературы
- Neogi T., Jansen T.L., Dalbeth N., et al. 2015 Gout classification criteria: An American college of rheumatology / European league against rheumatism collaborative initiative // Arthritis Rheumatol. 2015. Vol. 67, N 10. P. 2557–2568. doi: 10.1002/art.39254
- Taylor W.J., Fransen J., Dalbeth N., et al. Diagnostic arthrocentesis for suspicion of gout is safe and well tolerated // J Rheumatol. 2016. Vol. 43, N 1. P. 150–153. doi: 10.3899/jrheum.150684
- Сикилинда Д.В., Алабут А.В. Протоколы техники пункций суставов и лечебных блокад при травмах и ортопедических заболеваниях опорно-двигательного аппарата // Главный врач Юга России. 2018. Т. 2, № 60. С. 14–20.
- Stauder S.K., Peloso P.M. Dual-Energy computed tomography has additional prognostic value over clinical measures in gout including tophi: A systematic literature review // J Rheumatol. 2022. Vol. 49, N 11. P. 1256–1268. doi: 10.3899/jrheum.211246
- Федеральные клинические рекомендации. Подагра. Общероссийская общественная организация Ассоциация ревматологов России, 2014.
- Dalbeth N., Phipps-Green A., Frampton C., et al. Relationship between serum urate concentration and clinically evident incident gout: An individual participant data analysis // Ann Rheum Dis. 2018. Vol. 77, N 7. P. 1048–1052. doi: 10.1136/annrheumdis-2017-212288
- Переверзев А.П., Остроумова О.Д. Лекарственно-индуцированные гиперурикемия/подагра. Часть 2: отдельные лекарственные средства, прием которых ассоциирован с повышенным риском развития этих заболеваний // Терапия. 2021. Т. 7, № 6. С. 136–145. doi: 10.18565/therapy.2021.7.159-169
- Chhana A., Lee G., Dalbeth N. Factors influencing the crystallization of monosodium urate: a systematic literature review // BMC Musculoskelet Disord. 2015. Vol. 16, N 1. P. 1–11. doi: 10.1186/s12891-015-0762-4
- Fiddis R.W., Vlachos N., Calvert P.D. Studies of urate crystallisation in relation to gout // Ann Rheum Dis. 1983. Vol. 42, Suppl. 1. P. 12. doi: 10.1136/ard.42.suppl_1.12
- Dalbeth N., Pool B., Gamble G.D., et al. Cellular characterization of the gouty tophus: A quantitative analysis // Arthritis Rheum. 2010. Vol. 62, N 5. P. 1549–1556. doi: 10.1002/art.27356
- Butler F., Alghubayshi A., Roman Y. The epidemiology and genetics of hyperuricemia and gout across major racial groups: A literature review and population genetics secondary database analysis // J Personalized Med. 2021. Vol. 11, N 3. P. 231. doi: 10.3390/jpm11030231
- Meneses-Leon J., Denova-Gutiérrez E., Castañón-Robles S., et al. Sweetened beverage consumption and the risk of hyperuricemia in Mexican adults: A cross-sectional study // BMC Public Health. 2014. Vol. 14, N 1. P. 1–11. doi: 10.1186/1471-2458-14-445
- Bae J., Chun B.Y., Park P.S., et al. Higher consumption of sugar-sweetened soft drinks increases the risk of hyperuricemia in Korean population: The Korean multi-rural communities cohort study // Semin Arthritis Rheum. 2014. Vol. 43, N 5. P. 654–661. doi: 10.1016/j.semarthrit.2013.10.008
- Zhang W., Doherty M., Pascual E., et al. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the standing committee for international clinical studies including therapeutics (ESCISIT) // Ann Rheum Dis. 2006. Vol. 65, N 10. P. 1301–1311. doi: 10.1136/ard.2006.055251
- Kienhorst L.B., Janssens H.J., Eijgelaar R.S., et al. The detection of monosodium urate crystals in synovial fluid after long-term and varying storage conditions // Joint Bone Spine. 2015. Vol. 82, N 6. P. 470–471. doi: 10.1016/j.jbspin.2014.10.020
- Секреты ревматологии / под ред. С.Д. Уэст. Пер. с англ. под ред. О.М. Лесняк. Москва: ГЭОТАР-Медиа, 2021. 756 с.
- Malik A., Schumacher H.R., Dinnella J.E., Clayburne G.M. Clinical diagnostic criteria for gout: Comparsion with the gold standard of synovial fluid crystal analysis // J Clin Rheumatol. 2009. Vol. 15, N 1. P. 22–24. doi: 10.1097/RHU.0b013e3181945b79
- Pascal Z., Valcov R., Fabreguet I., et al. A prospective evaluation of ultrasound as a diagnostic tool in acute microcrystalline arthritis // Arthritis Res Ther. 2015. Vol. 17, N 1. P. 1–8. doi: 10.1186/s13075-015-0701-7
- Omoumi P., Becce F., Racine D., et al. Dual-Energy CT: Basic principles, technical approaches, and applications in musculoskeletal imaging (Part 1) // Semin Musculoskelet Radiol. 2015. Vol. 19, N 5. P. 431–437. doi: 10.1055/s-0035-1569253
- Ogdie A., Taylor W.J., Weatherall M., et al. Imaging modalities for the classification of gout: Systematic literature review and meta-analysis // Ann Rheum Dis. 2015. Vol. 74, N 10. P. 1868–1874. doi: 10.1136/annrheumdis-2014-205431
- Sapsford M., Gamble G.D., Aati O., et al. Relationship of bone erosion with the urate and soft tissue components of the tophus in gout: A dual energy computed tomography study // Rheumatology (Oxford). 2017. Vol. 56, N 1. P. 129–133. doi: 10.1093/rheumatology/kew383
- Towiwat P., Doyle A.J., Gamble G.D., et al. Urate crystal deposition and bone erosion in gout: “Inside-out” or “outside-in”? A dual-energy computed tomography study // Arthritis Res Ther. 2016. Vol. 18, N 1. P. 208. doi: 10.1186/s13075-016-1105-z
- Bayat S., Aati O., Rech J., et al. Development of a dual-energy computed tomography scoring system for measurement of urate deposition in gout // Arthritis Care Res (Hoboken). 2016. Vol. 68, N 6. P. 769–775. doi: 10.1002/acr.22754
- Rajiah P., Sundaram M., Subhas N. Dual-energy CT in musculoskeletal imaging: What is the role beyond gout? // AJR Am J Roentgenol. 2019. Vol. 213, N 3. P. 493–505. doi: 10.2214/AJR.19.21095
- Климкова М.М., Синицын В.Е., Мазуренко Д.А., и др. Перспективы применения двухэнергетической компьютерной томографии в диагностике мочекаменной болезни и определении химического состава мочевых камней (обзор литературы) // Медицинская визуализация. 2016. № 6. C. 84–92.
- McCollough C.H., Leng S., Yu L., et al. Principles, technical approaches, and clinical applications // Radiology. 2015. Vol. 276, N 3. P. 637–653. doi: 10.1148/radiol.2015142631
- Sodickson A.D., Keraliya A., Czakowski B., et al. Dual energy CT in clinical routine: How it works and how it adds value // Emerg Radiol. 2021. Vol. 28, N 1. P. 103–117. doi: 10.1007/s10140-020-01785-2
- Megibow A.J., Kambadakone A., Ananthakrishnan L. Dual-energy computed tomography: Image acquisition, processing, and workflow // Radiol Clin North Am. 2018. Vol. 56, N 4. P. 507–520. doi: 10.1016/j.rcl.2018.03.001
- Forghani R., De Man B., Gupta R. Dual-energy computed tomography: Physical principles, approaches to scanning, usage, and implementation: Part 2 // Neuroimaging Clin N Am. 2017. Vol. 27, N 3. P. 385–400. doi: 10.1016/j.nic.2017.03.002
- Henzler T., Fink C., Schoenberg S.O., et al. Radiation dose aspects // AJR Am J Roentgenol. 2012. Vol. 199, N 5. P. S16–S25. doi: 10.2214/AJR.12.9210
- Borges A.P., Antunes C., Curvo-Semedo L. Pros and cons of dual-energy CT systems: “One does not fit all” // Tomography. 2023. Vol. 9, N 1. P. 195–216. doi: 10.3390/tomography9010017
- Parakh A., Lennartz S., An C., et al. Dual-energy CT images: Pearls and pitfalls // Radiographics. 2021. Vol. 41, N 1. P. 98–119. doi: 10.1148/rg.2021200102
- Gosangi B., Mandell M.C., Weaver M.J., et al. Bone marrow edema at dual-energy CT: A game changer in the emergency department // Radiographics. 2020. Vol. 40, N 3. P. 859–874. doi: 10.1148/rg.2020190173
- Goo H.W., Goo J.M. Dual-energy CT: New horizon in medical imaging // Korean J Radiol. 2017. Vol. 18, N 4. P. 555–569. doi: 10.3348/kjr.2017.18.4.555
- Baer A.N., Kurano T., Thakur U.J., et al. Dual-energy computed tomography has limited sensitivity for non-tophaceous gout: A comparison study with tophaceous gout // BMC Musculoskelet Disord. 2016. Vol. 17, N 1. P. 1–9. doi: 10.1186/s12891-016-0943-9
- Bongartz T., Glazebrook K.N., Kavros S.J., et al. Dual-energy CT for the diagnosis of gout: An accuracy and diagnostic yield study // Ann Rheum Dis. 2015. Vol. 74, N 6. P. 1072–1077. doi: 10.1136/annrheumdis-2013-205095
- Huppertz A., Hermann A., Diekhoff T., et al. Systemic staging for urate crystal deposits with dual-energy CT and ultrasound in patients with suspected gout // Rheumatol Int. 2014. Vol. 3. P. 763–771. doi: 10.1007/s00296-014-2979-19
- Strobl S., Halpern E.J., Abd Ellah M., et al. Acute gouty knee arthritis: Ultrasound findings compared with dual-energy CT findings // AJR Am J Roentgenol. 2018. Vol. 210, N 6. P. 1323–1329. doi: 10.2214/AJR.17.19199
- Mallinson P.I., Coupal T., Reisinger C., et al. Artifacts in dual-energy CT gout protocol: A review of 50 suspected cases with an artifact identification guide // AJR Am J Roentgenol. 2014. Vol. 203, N 1. P. 103–109. doi: 10.2214/AJR.13.11396
- Omoumi P., Zufferey P., Malghem J., So A. Imaging in gout and other crystal-related arthropathies // Rheum Dis Clin North Am. 2016. Vol. 42, N 4. P. 624–644. doi: 10.1016/j.rdc.2016.07.005
- Lee S.M., Lee J.G., Lee G., et al. CT image conversion among different reconstruction kernels without a sinogram by using a convolutional neural network // Korean J Radiol. 2019. Vol. 20, N 2. P. 295–303. doi: 10.3348/kjr.2018.0249
- Alavandar E., Arunachalam V.K., Narappulan N., et al. Principles and available hardware in dect // J Gastrointestinal Abdominal Radiol. 2022. Vol. 5, N 6. doi: 10.1055/s-0042-1742772
- Lee J.S., Seo W.J. What is the diagnostic value of dual-energy computed tomography in patients with clinical diagnosis of gout? // Adv Rheumatol. 2021. Vol. 61, N 1. P. 1–7. doi: 10.1186/s42358-021-00198-0
- Jia E., Zhu J., Huang W., et al. Dual-energy computed tomography has limited diagnostic sensitivity for short-term gout // Clin Rheumatol. Vol. 37, N 3. P. 773–777. doi: 10.1007/s10067-017-3753-z
- Ramon A., Ornetti P. Dual energy computed tomography: A breakthrough for gout? // Joint Bone Spine. 2020. Vol. 87, N 4. P. 289–291. doi: 10.1016/j.jbspin.2019.12.002
- Shang J., Li X.H., Lu S.Q., et al. Gout of feet and ankles in different disease durations: Diagnostic value of single-source DECT and evaluation of urate deposition with a novel semi-quantitative DECT scoring system // Adv Rheumatol. 2021. Vol. 61, N 1. P. 1–14. doi: 10.1186/s42358-021-00194-4
- Wang P., Smith S.E., Garg R., et al. Identification of monosodium urate crystal deposits in patients with asymptomatic hyperuricemia using dual-energy CT // RMD Open. 2018. Vol. 4, N 1. P. 593–597. doi: 10.1136/rmdopen-2017-000593
- Urano W., Yamanaka H., Tsutani H., et al. The inflammatory process in the mechanism of decreased serum uric acid concentrations during acute gouty arthritis // J Rheumatol. 2002. Vol. 29, N 9. P. 1950–1953.
- Dalbeth N., Nicolaou S., Baumgartner S., et al. Presence of monosodium urate crystal deposition by dual-energy CT in patients with gout treated with allopurinol // Ann Rheum Dis. 2018. Vol. 77, N 3. P. 364–370. doi: 10.1136/annrheumdis-2017-212046
- Zhang W., Doherty M., Bardin T., et al. European league against rheumatism recommendations for calcium pyrophosphate deposition. Part I: Terminology and diagnosis // Ann Rheum Dis. 2011. Vol. 70, N 4. P. 563–570. doi: 10.1136/ard.2010.139105
- Sabchyshyn V., Konon I., Ryan L.M., Rosenthal A.K. Concurrence of rheumatoid arthritis and calcium pyrophosphate deposition disease: A case collection and review of the literature // Semin Arthritis Rheum. 2018. Vol. 48, N 1. P. 9–11. doi: 10.1016/j.semarthrit.2017.11.009
- Williams C.J., Rosenthal A.K. Pathogenesis of calcium pyrophosphate deposition disease // Best Pract Res Clin Rheumatol. 2021. Vol. 35, N 4. P. 101718. doi: 10.1016/j.berh.2021.101718
- Abhishek A. Calcium pyrophosphate deposition // Br J Hosp Med (Lond). 2014. Vol. 75, N 4. P. 61–64. doi: 10.12968/hmed.2014.75.sup4.c61
- Miksanek J., Rosenthal A.K. Imaging of calcium pyrophosphate deposition disease // Curr Rheumatol Rep. 2015. Vol. 17, N 3. P. 20. doi: 10.1007/s11926-015-0496-1
- Godfrin-Valnet M., Godfrin G., Godard J., et al. Eighteen cases of crowned dens syndrome: Presentation and diagnosis // Neurochirurgie. 2013. Vol. 59, N 3. P. 115–120. doi: 10.1016/j.neuchi.2013.03.003
- Cipolletta E., Filippou G., Scirè C.A., et al. The diagnostic value of conventional radiography and musculoskeletal ultrasonography in calcium pyrophosphate deposition disease: A systematic literature review and meta-analysis // Osteoarthritis Cartilage. 2021. Vol. 29, N 5. P. 619–632. doi: 10.1016/j.joca.2021.01.007
- Lee K.A., Lee S.H., Kim H.R. Diagnostic value of ultrasound in calcium pyrophosphate deposition disease of the knee joint // Osteoarthritis Cartilage. 2019. Vol. 27, N 5. P. 781–787. doi: 10.1016/j.joca.2018.11.013
- Neame R.L., Carr A.J., Muir K., Doherty M. UK community prevalence of knee chondrocalcinosis: Evidence that correlation with osteoarthritis is through a shared association with osteophyte // Ann Rheum Dis. 2003. Vol. 62, N 6. P. 513–518. doi: 10.1136/ard.62.6.513
- Frediani B., Filippou G., Falsetti P., et al. Diagnosis of calcium pyrophosphate dihydrate crystal deposition disease: Ultrasonographic criteria proposed // Ann Rheum Dis. 2005. Vol. 64, N 4. P. 638–640. doi: 10.1136/ard.2004.024109
- Tanikawa H., Ogawa R., Okuma K., et al. Detection of calcium pyrophosphate dihydrate crystals in knee meniscus by dual-energy computed tomography // J Orthop Surg Res. 2018. Vol. 13, N 1. P. 73. doi: 10.1186/s13018-018-0787-0
- Rosales-Alexander J.L., Aznar J.B., Magro-Checa C. Calcium pyrophosphate crystal deposition disease: Diagnosis and treatment // Open Access Rheumatol. 2014. Vol. 6. P. 39–47. doi: 10.2147/OARRR.S39039
- Sekijima Y., Yoshida T., Ikeda S.I. CPPD crystal deposition disease of the cervical spine: A common cause of acute neck pain encountered in the neurology department // J Neurol Sci. 2010. Vol. 296, N 1-2. P. 79–82. doi: 10.1016/j.jns.2010.05.028
- Kravchenko D., Karakostas P., Kuetting D., et al. The role of dual energy computed tomography in the differentiation of acute gout flares and acute calcium pyrophosphate crystal arthritis // Clin Rheumatol. 2022. Vol. 41, N 1. P. 223–233. doi: 10.1007/s10067-021-05949-4
- Tedeschi S.K., Solomon D.H., Yoshida K., et al. A prospective study of dual-energy CT scanning, US and X-ray in acute calcium pyrophosphate crystal arthritis // Rheumatology (Oxford). 2020. Vol. 59, N 4. P. 900–903. doi: 10.1093/rheumatology/kez431
- Pascart T., Norberciak L., Legrand J., et al. Dual-energy computed tomography in calcium pyrophosphate deposition: Initial clinical experience // Osteoarthritis Cartilage. 2019. Vol. 27, N 9. P. 1309–1314. doi: 10.1016/j.joca.2019.05.007
Дополнительные файлы