双能量计算机断层扫描在诊断痛风和其他结晶性关节病中的作用:文献综述
- 作者: Onoyko M.V.1, Mershina E.A.1, Georginova O.A.1, Plotnikova M.L.1, Panyukova A.V.1, Sinitsyn V.E.1
-
隶属关系:
- Lomonosov Moscow State University
- 期: 卷 4, 编号 2 (2023)
- 页面: 197-213
- 栏目: 科学评论
- ##submission.dateSubmitted##: 08.04.2023
- ##submission.dateAccepted##: 11.05.2023
- ##submission.datePublished##: 12.07.2023
- URL: https://jdigitaldiagnostics.com/DD/article/view/322758
- DOI: https://doi.org/10.17816/DD322758
- ID: 322758
如何引用文章
详细
本文讨论了双能量计算机断层扫描的操作原理、其诊断准确性以及最常见的伪影类型。考虑了在双能量计算机断层扫描过程中,单钠尿酸盐沉积的存在对其他临床数据的可能依赖性,双能量计算机断层扫描在诊断痛风中的意义以及其在结晶性关节病的鉴别诊断中的作用。
与作为诊断痛风金标准的诊断性关节穿刺术相比,双能量计算机断层扫描有几个优点:无创性、执行速度、医源性并发症风险的多次减少。痛风的检测、治疗效果的监测、鉴别诊断的可能性,都是可以通过双能量计算机断层扫描来实现的。
全文:
绪论
痛风是一种全身性类风湿病,由于血清尿酸水平升高(高尿酸血症),单尿酸钠晶体沉积在关节、骨骼、软骨或软组织中。根据不同的病变类型,可能会出现痛风性关节炎和痛风性肾病或尿酸性肾石病。
痛风:一种全身性痛风石性疾病
在过去的十年中,已经积累了大量的数据,这些数据使我们不仅能将高尿酸血症作为痛风和泌尿系结石病的标志物。众所周知,高尿酸血症在一些代谢性和血液动力学疾病的发生和发展中起着重要作用,这些疾病包括代谢综合征、慢性心力衰竭、高血压、动脉粥样硬化、早期梗塞和中风、糖尿病等。
美国风湿病学会(American College of Rheumatology,ACR)和欧洲风湿病协会联 盟(European Alliance of Associations for Rheumatology,EULAR)的分类标准(2015年)被用于诊断痛风,该标准包括临床、实验室和仪器标准[1]。所制定标准的灵敏度和特异度分别为92%和89%[1]。
如果患者有“初始征兆”:至少有一次外周关节或关节囊的病态和浮肿,就可以应用这些标准。诊断痛风的充分标准是通过偏振显微镜在滑液或痛风石性组织(单尿酸钠的宏观聚集体,周围有肉芽肿性炎症)中发现到单尿酸钠晶体。因此,这种方法被视为金标准。如果没有充分标准,则有必要采用临床标准(痛风的典型临床症状、痛风石的检测、发作的时间特征)、实验室标准(血清尿酸水平、关节液化验)和仪器诊断方法(损坏关节的超声检查、双能量计算机断层扫描)[1]。根据特异度的程度,每项标准都有一定的分值。根据ACR/EULAR-2015分类标准,在进行双能量计算机断层扫描时尿酸盐沉积物的迹象肉眼测定估计为4分;23分中的8分足以验证 “痛风”的诊断。因此,双能量计算机断层扫描是核实诊断的重要部分。
抽取关节液的关节穿刺术是一种侵入性和痛苦的方法,这种方法有一系列局限性和并发症,因此有必要寻找其他诊断方法来确定可靠的诊 断[2,3]。双能量计算机断层扫描可能是一种非侵入性诊断方法,可将尿酸盐沉积物从周围组织中分离出来,具有高度的灵敏度和特异 度[4]。
高尿酸血症、单尿酸钠晶体
痛风是一种全身性痛风石性疾病,其特征是单尿酸钠晶体沉积在各种组织中,因此,由于外在环境和/或遗传因素,高尿酸血症的患者中会发生炎症[5]。
无论有没有遗传倾向,痛风都应被视为一种分阶段的疾病[6]。起点是高尿酸血症,这是一种血清尿酸水平超过420 µmol/L或超过6 mg/dL并形成单尿酸钠晶体的临床症状[7]。
根据临床实验室和仪器数据,痛风的病程可分为四个连续的阶段,但这些阶段并不总是从一个阶段发展到另一个阶段:(1)无痛风症状或病史、无尿酸盐晶体沉积的高尿酸血症;(2)有尿酸盐晶体沉积征候的无症状高尿酸血症;(3 ) 痛风性关节炎正在发作或已发作的高尿酸血症;(4 )存在痛风石、慢性关节炎和侵蚀性关节炎的高尿酸血症[5]。
如果没有适当的降尿酸盐治疗,病情就会发展。一开始,单尿酸钠晶体形成聚集体,在某些组织中出现,并取决于环境条件。单尿酸钠在37ºC生理溶液中的溶解度为7 mg/dl(416 µmol/L),如果滑液中单尿酸钠的浓度增加,其随后就会沉积在软骨表面,并进一步破坏软骨和渗透到软骨下骨中[8]。这最终会导致活动性骨骼重塑。单尿酸钠晶体在滑液中长期饱和会导致单尿酸钠宏观沉积的形成,这些沉积物被肉芽肿性炎症(痛风石)包围[9]。它们最常出现在富含蛋白聚糖的组织(关节囊、管状骨、肌腱和皮肤)中,但也可能(相对较少)出现在实质器官组织中。单尿酸钠沉积引起的组织反应具有慢性炎症反应的特征,先天性免疫和适应性免疫都参与了这种反应[10]。
在慢性痛风发展的情况下,发作的频率、持续时间和严重程度都会增加,痛风石开始形成,会出现重变形性关节病,并发症增多。
根据最近的流行病学研究,高尿酸血症在成年人群中的发病率正在逐渐上升。在欧洲和美国,0.68-3.9%的病例会出现尿酸水平升高,而在中国的一些地区,尿酸水平升高的比例为6.4-21.04%[11]。在俄罗斯,这一指数为16.8%[7] ,5-8%的人长期无症状。众所周知,高尿酸血症会增加慢性肾脏疾病、肥胖、2 型糖尿病、心血管疾病和死亡的风险[12,13]。
诊断痛风的方法
痛风的诊断要求至少有一次关节炎发作(第一跖趾关节、踝关节或中足)或滑液囊炎。确定诊断的第二个充分标准是测定血清尿酸水平和化验发炎关节的滑液,或使用偏振光显微镜的吸引活组织检查测定单尿酸钠晶体[14]。用于诊断目的,关节穿刺术可是在急性期和发作间期进行的,但需要注意的是,滑液的处理、长期储存和降尿酸盐治疗的使用在某些情况下可能会对化验的可靠性和单尿酸钠检测方法的灵敏度产生影响[15]。所有痛风患者的血清尿酸水平都会周期地升高,但30%的高尿酸血症患者中即使在痛风急性发作时也未被诊断出来 [16]。因此,痛风的诊断不应仅依据血清尿酸水平。如果炎症性关节病的临床过程不典型,建议使用不同的影像学检查方法(如射线照相术、超声检查和双能量计算机断层扫描)来诊断痛风,包括使用,以达到鉴别诊断的目的,甚至在没有机会进行滑液偏振显微镜检查的情况下。
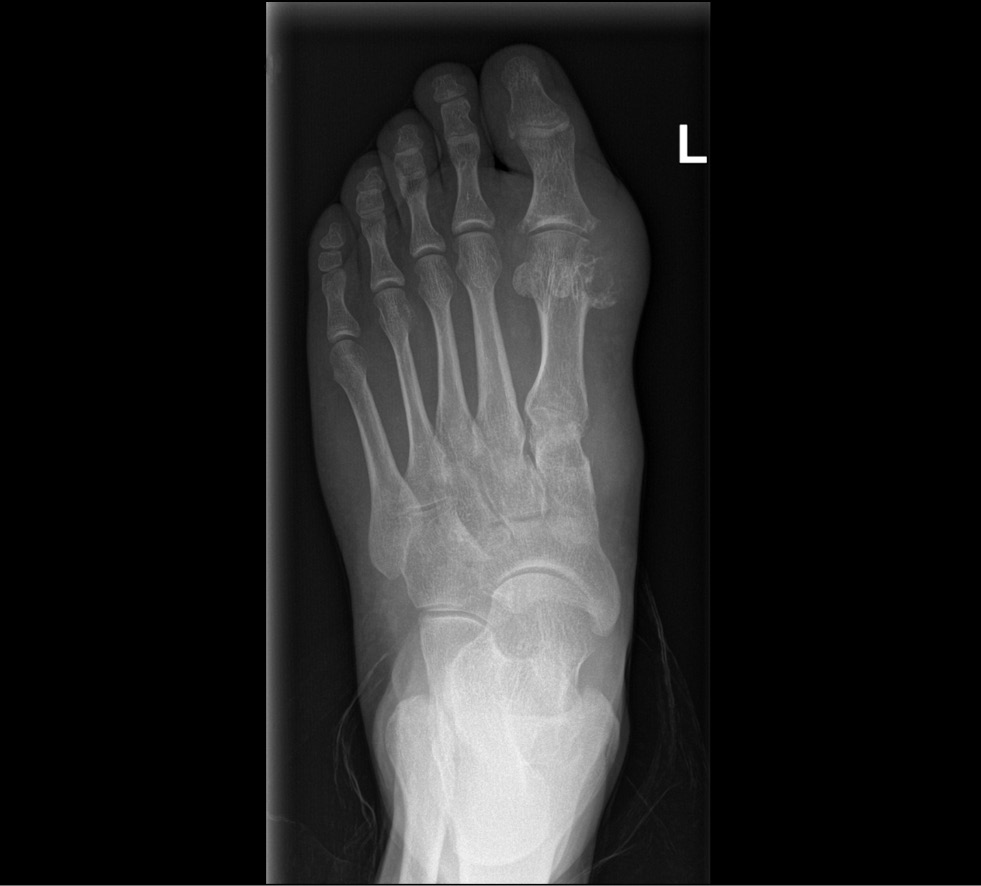
痛风的典型影像学征象是“冲孔”骨侵蚀,具有硬化性轮廓硬化和悬空边缘,有时被称为 “鼠咬”或“鸥翼”侵蚀(图1)。
图1。一名被诊断为痛风患者的骨侵蚀(数据来自莫斯科国立大学医学教育研究中心的放射学检查)。
在慢性痛风中,可以发现以非同性软组织实变形式出现的关节痛风石。痛风发病数年后才会出现放射性变化,这些变化可能有助于在疾病晚期验证诊断[16,17]。
双能量计算机断层扫描:痛风器械诊断的另一种方法
关节超声检查和双能量计算机断层扫描是痛风器械诊断的另一种方法,它们允许检测到尿酸盐沉积、痛风石和骨侵蚀。
在关节超声检查中,尿酸盐沉积物可是在关节软骨表面以高回声间歇条纹的形式检测到的,不受视角影响(双轮廓效应);或是在关节液中以浮动的高回声异质病灶的形式检测到的,呈“暴风雪”状;也可是在关节间隙或肌腱上以高回声聚集的形式检测到的[18]。
双能量计算机断层扫描在鉴别诊断方面具有优势,例如,在痛风与败血性关节炎或单尿酸钠积聚与焦磷酸钙沉积(假痛凤、软骨钙质沉着症)之间[19,20]。双能量计算机断层扫描允许详细地检查各种解剖区域,无创检测其中的单尿酸钠晶体沉积[21-23]。
双能量计算机断层扫描的工作原理
双能量计算机断层扫描是一种非常有前途的现代检查方法。这种方法在于使用两种能量不同的X射线辐射来扫描人体的某一区域,从而对物质进行光谱区分。在这种条件下,物质具有不同的信号吸收系数。这样就可以按化学成分将物质区分开来。在X射线管中的低电压下(20-50 kV) ,X射线辐射会被物质完全吸收(光电效应占主导地位);在高电压下(50-150 kV),康普顿散射占主导地位,这会导致信号衰减[24,25]。光电效应和康普顿效应对每种化合物的影响取决于物质的电子密度和原子序数[24,26]:原子序数越高、电子密度越低(如碘、钙、钡、氙),光电吸收的影响就越大,而原子序数低、电子密度高的元素(碳、氮、氢、氧)则更依赖于康普顿效应[24]。在碘、钙、钡等元素中,可以观察到K-edge(即尖峰信号)的出现,该信号是光子吸收和从K壳层的光电子发射过程的特征。这一现象正是双能量计算机断层扫描的核心所在。由于某些元素中存在明显的K-edge,被研究的物质在不同能量下的吸收系数值之间的差异会增大,从而使其区分成为可能。
双能量计算机断层扫描有一些类型:两个垂直排列的光源和探测器;单光源探测器系统(需要快速电压切换);一套单X射线源和多层夹层探测器[26]。为了处理数据,要采用三物质分解 法(three-material decomposition analysis)或双物质分解法(two-material decomposition analysis)。如果在痛风诊断程序中使用双物质分解法,则分解以尿酸和钙两种成分为基础。软组织是“参考点”,根据这个参考点,算法将判断在检查区域中是否存在钙或单尿酸钠。因此,可以构建一个物质密度图(material density map,MD-map)。在这种地图上,每种成分都有一个颜色编码。在西门子双能量计算机断层扫描系统中,皮质骨为蓝色,松质骨为粉色,单尿酸钠晶体为绿色。其他制造商的处理软件可能会使用不同的色标。
除定性评估外,还可对相关化学物质进行定量评估。Dual Energy Gout程序会自动计算视野中单尿酸钠沉积物的总体积[23]。需要注意的是,总体积包括伪影,因此了解伪影的类型和可能的定位极为重要。使用剪切工具可以去除与伪影相对应的绿色区域。操作完成后,程序将自动重新计算单尿酸钠沉积物的总体积。
值得注意的是,可以使用彩色编码进行三维重建(Volume Rendering Technique,VRT image)及其他重建算法,后者也可以被用于具有其他目的的研究中(图2)。
图2。三维重建、混合图像和彩色编码图像(右踝关节和足部小关节区域):蓝色——皮质骨;粉色——松质骨;绿色——单尿酸钠晶体(数据来自莫斯科国立大学医学教育研究中心的双能量计算机断层扫描)。
与其他诊断方法相比,双能量计算机断层扫描的主要优势在于两个事实:可以通过两种能量水平的扫描来确定物体的化学成分,并且可以对相关化学物质进行定量评估。无创性、检查迅速、无医源性并发症都是双能量计算机断层扫描无可否认的优势。
有一种误解认为,双能量扫描的辐射量是单能量扫描的2倍。然而,大量研究结果表明,双能量计算机断层扫描和单能量计算机断层扫描的辐射量和图像质量相当[27-29]。这不仅得益于设备的技术特点,并且得益于采用减少辐射剂量的方法,这些方法包括独立设置电流强度、迭代重建和其他现代算法、使用VNC图像(Virtual Non-Contrast image)、将FOV(field of view)大小限制在感兴趣区内等[30,31]。
使用双能量计算机断层扫描可以进行虚拟单色图像(Virtual Monochromatic Image,VMC image)重建。这些图像是使用单色辐射进行理论扫描的产物。该程序有助于提高对比度,减少金属结构造成的伪影[32]。
其缺点包括:双能量图像的视场(FOV,field of view)较小,不同年代的断层扫描仪的视场直径仅为33-35 cm;可能出现假阳性和假阴性;交叉散射(一个光源发射的光子撞击到另一个光源光子的探测器上)[33,34]。这些技术缺陷会导致数据丢失(图3,a)。
图3。双能量计算机断层扫描过程中的伪影:a——由于患者定位不正确导致的数据丢失;b——甲床产生的伪影;c——婚戒产生的辐射硬度增加的伪影;d——多个小点伪影(数据来自莫斯科国立大学医学教育研究中心的双能量计算机断层扫描)。

双能量计算机断层扫描的诊断准确度
根据A.N.Baer等人[35],双能量计算机断层扫描对痛风石性痛风的灵敏度为100%,对无痛风石性痛风的灵敏度为64%。根据A.Ogdie等人的荟萃分析结果[20],双能量计算机断层扫描的灵敏度和特异度分别为87%和84%。这超过超声检查的相同参数。在T.Bongartz等人的研究[36]中,灵敏度和特异度分别为90%和83%。如果参考A.Huppertz等人的研究结果[37],由于分辨率更低,双能量计算机断层扫描的灵敏度似乎不如超声检查的(100%比84.6%)。
从上述数据可以看出,双能量计算机断层扫描技术总体上具有较高的诊断准确度。不同研究组之间结果的差异可能是由于扫描区域的不同(这可能是决定该方法准确度的重要因素)及一些研究中患者患病时间的不同所造成的[38]。
然而,与其他检查方法一样,假阳性和假阴性是不可避免的。在甲床、皮肤胼胝区域可以检测到模仿单尿酸钠晶体的物体(见图3,b)。这种假阳性是由于角蛋白的双能量指数(dual-energy index)与单尿酸钠的双能量指数相同,这在检查中以相同的颜色编码显示[39]。值得注意的是,脚部比手部更容易出现这些伪影[39,40]。膝关节和肘关节的皮肤通常不会出现此类伪影。
金属结构、骨皮质致密区域会造成辐射硬度增加的伪影,它们可能被误认为是单尿酸钠沉积物[40]。问题在于,在使用多色辐射的情况下,辐射硬度(beam hardening)会增加。因此,能量低的光子吸收更快,能量高的光子吸收更慢。这就导致X射线总能量的增加。随着光束变得坚硬,辐射的衰减会减小,探测器上的强度也会增加。因此,记录的吸收曲线会与理想曲线不同。于是,伪影在图像中表现为高密度物体之间的凹陷和暗带(见图3,c)。
在信噪比(signal-to-noise ratio,SNR)较低的情况下,可观察到模仿单尿酸钠晶体的绿色小点(见图3,d),但是,如果沿跟腱等解剖结构观察到绿色小点,就要考虑真正的单尿酸钠沉积[39]。
当存在直径小于2 mm的单尿酸钠微晶体、单尿酸钠浓度过低的痛风石成像以及技术参数设置错误时,可能会出现假阴性。不过,伪影是相当典型的现象,在大多数情况下,有经验的放射科医生都能很好地识别这些伪影。消除伪影的方法是存在的。例如,使用不同的图像重建算法,如内核,以及在工作站上正确设置图像参数,如“Air Distance”、“Resolution” 、 “Minimum [HU]”、“Ratio”(被用于Syngo.via VB20A_HF06软件Dual Energy Gout型)。
内核(重建滤波器)是一种用于重建电子计算机断层扫描图像的数学算法[41]。
使用“Air Distance”参数(单尿酸钠晶体到空气和骨头的距离,以体素为单位)允许减少甲床和皮肤区域的伪影。此操作将删除皮肤表面给定值范围内的所有绿色元素。但同时靠近骨骼结构且距离不超过设定值的元素除外。
“Ratio”参数表示双能量比率(dual energy ratio)。它等于以Houndsfield单位(HU)表示的低能量物质密度与高能量物质密度之比。在使用双物质分解法处理数据时,该参数对于区分钙和尿酸盐至关重要。增加“Ratio”值会提高双能量计算机断层扫描检查对单尿酸钠晶体的灵敏度,但会降低其特异度[39]。
“Minimum [HU]”参数设置混合图像上Houndsfield单位的阈值水平,混合图像基本上等同于进行电压为120 kV的扫描时获得的图像[42]。 如果对象的密度小于给定值,就不会计算双能量指数,它们在MD图上会被自动分配为“0”HU 值,因此不会为它们确定颜色编码[39]。
“Resolution”指标定义绿色像素的最小数量。软件会将这一数量视为单尿酸钠沉积物。如果该区域的像素数量少于设定值,就无法显示。
额外的锡滤波器有助于切断低能量的光子,减少辐射量并提高图像质量。
临床数据与双能量计算机断层扫描结果的比较
在J.S.Lee等人的研究[43]中,他们侧重于更有可能预测双能量计算机断层扫描上是否存在单尿酸钠沉积的因素。这些参数包括血清尿酸水平、肾功能不全的存在和患病时间。因此,如果对初次发作痛风性关节炎的患者进行双能量计算机断层扫描检查,其诊断准确度是有限的。E.Jia等人[44]发现了,病程越长,双能量计算机断层扫描的灵敏度越高。痛风初诊时,双能量计算机断层扫描的灵敏度为35.7%,对于痛风病程不足两年的一组患者,双能量计算机断层扫描的灵敏度为61.5%,对于痛风病程超过两年的患者,双能量计算机断层扫描的灵敏度为92.9%。根据其他数据,在15-24%的无症状高尿酸血症患者及32.8%的痛风性关节炎首次发作患者中在双能量计算机断层扫描上有单尿酸钠沉积[43]。这一事实可以解释为痛风性关节炎首次发作患者的单尿酸钠容量和浓度不足以显示[45]。因此,可以认为双能量计算机断层扫描技术被用于进行动态观察比被用于进行初诊更有意义。同时,在痛风首次发作的情况下,超声检查可能有用。
慢性肾脏疾病和痛风是并发症。肾脏排泄功能下降会导致尿酸盐潴留在体内。这增加单尿酸钠晶体在关节和其他组织中沉积的可能性。另一方面,在J.Shang等人的研究[46]中,在双能量计算机断层扫描上肾功能不全与单尿酸钠沉积量之间并无明显关联。
血清尿酸浓度高与双能量计算机断层扫描检查阳性相关的假设并不总是正确的。事实上,血清尿酸浓度会随着低尿酸血症性治疗而降低。这将进一步导致单尿酸钠沉积物的溶解。如果在特定的时间间隔内进行检查,就有可能在尿酸浓度足够低的情况下看到尚未溶解的单尿酸钠晶体。因此,使用双能量计算机断层扫观察尿酸盐沉积物的吸收情况允许评估治疗有效性。动态的直观性有助于提高患者的治疗依从性。此外,不能在所有血液中尿酸水平同样高的患者身上检测到单尿酸钠沉积物;因此,还有其他因素会对双能量计算机断层扫的阳性产生影响,如遗传易感性和年龄[47]。
在S.Bayat等人的研究[23]中,针对最受影响的部位(即足部区域)开发了一种半定量单尿酸钠晶体沉积评估系统(DECT urate scoring system)。检查区域分为4个部分:第一跖趾关节、足部的其他关节、脚踝以及足部和脚踝的肌腱。根据沉积物的数量和性质,给这些部位打分。然后将分数相加。得出的结果有助于确定痛风的存在,并监测低尿酸血症性治疗的有效性。与自动计数相比,这种计数单尿酸钠沉积物体积的技术耗时更短,更易于在测量困难的区域工作。不过,这种评估系统只能被用于足部局部病变。
在J.Shang等人的研究[46]中,他们使用了一种半定量方法 “DECT urate scoring system”。 没有发现评分与血清尿酸浓度之间存在相关性。但研究证实了,组织中单尿酸钠的含量与长病程、糜烂和痛风石的存在之间存在相关性。双能量计算机断层扫结果与尿酸水平之间存在差异的原因可能还与检查时间有关。特别是,痛风性关节炎发作时尿液中尿酸排泄增加的事实已经得到证实[48]。
不过,也有研究证实了,血清尿酸水平与双能量计算机断层扫上存在的单尿酸钠沉积物之间存在相关性。例如,N.Dalbeth等人[49]报告说,在90.0%的血尿酸水平≥360 mmol/l且可触及痛风石的患者中,发现了尿酸盐沉积。而在未触及痛风石且实验室检查结果较低的患者中,仅有46.9%的病例中能看到单尿酸钠沉积。值得注意的是,所有研究参与者都在服用300 mg或以上剂量的别嘌呤醇。这项研究还表明了,与其他组患者相比,血尿酸水平≥360 mmol/l且可触及痛风石的患者组中单尿酸钠晶体的体积更大,糜烂的数量也更多。
双能量计算机断层扫描在与钙盐沉积有关的微晶关节病鉴别诊断中的能力
除痛风性关节炎外,微晶关节病还包括焦磷酸钙和羟磷灰石钙晶体沉积引起的关节炎。
焦磷酸钙晶体沉积病是一种主要在纤维软骨和透明软骨中积聚晶体(主要是焦磷酸钙)的疾病。风险因素包括年龄、关节创伤、遗传以及血色素沉着病、原发性甲状旁腺功能亢进、低磷血症和低镁血症等疾病[50]。
焦磷酸钙晶体沉积病常常与其他疾病相似。这使得各医学领域的专家很难做出诊断。这种疾病可能与其他炎症性关节炎合并。例如,患有痛风或类风湿性关节炎的患者患病焦磷酸钙晶体沉积病的发病率更高[51]。由于上述原因,找到一种合适的诊断方法进行鉴别诊断就成为了一种必然。
在临床上,与焦磷酸钙沉积有关的急性晶体性关节炎与痛风发作时特有的急性关节炎非常相似。唯一的区别在于持续时间。焦磷酸钙沉积引起的急性晶体性关节炎可持续数周甚至数 月[52 ,53]。
与焦磷酸钙沉积有关的慢性晶体性关节炎通常表现为退变性骨关节炎,伴有机械性关节疼痛,与焦磷酸钙沉积有关的急性关节炎临床上周期性发作[52]。指间关节、第二和第三掌指关节以及膝关节最常受到影响[52-54]。
焦磷酸钙晶体可能沿着枢椎十字韧带的走向沉积,表现为齿状突加冠综合征(crowned dens syndrome)。临床表现无特异性,包括急性颈痛、发热、颈部肌肉强直和枕部头痛 [55]。在这种情况下,可与脑膜炎、巨细胞动脉炎、类风湿性关节炎等进行鉴别诊断。
偶尔,与焦磷酸钙沉积有关的晶体性关节炎可能表现为多关节炎,因此与类风湿性关节炎相似。与类风湿性关节炎相比,临床区别在于焦磷酸钙结晶导致的关节损坏是连续性的,且不那么对称[53]。然而,依靠这一临床参数是有问题的。与焦磷酸钙沉积相关的关节炎不仅可模拟风湿病,而且模拟神经病、肿瘤病和其他疾病。开发新的仪器方法对于明确并迅速的鉴别诊断极为重要。
对于与焦磷酸钙沉积有关的关节炎的诊断,血液参数的信息量微乎其微。对滑液的偏振光显微镜检查和放射学、超声和计算机断层扫描等仪器方法的作用更大。
放射学检查被认为是目前最常用的常规诊断方法。焦磷酸钙晶体沉积病的诊断就是根据这种检查做出的。根据欧洲风湿病协会联盟(EULAR)的建议,滑液偏振光显微镜检查是金标准。如前所述,这种方法有其局限性和缺点,而且往往无法纠正。
在放射学检查中,焦磷酸钙晶体沉积病的主要征象是软骨钙化。半月板、三角纤维软骨复合体中的三角软骨和耻骨联合最常受到软骨钙化的影响。软骨钙化表现为与骨皮质表面平行的线状增厚区,或沿软骨结构的针状点,或沿滑膜轮廓的云状沉积物[56]。这种方法具有不可否认的优点,包括无创性、医源性并发症、操作速度快、成本低。与此同时,放射摄影对于焦磷酸钙晶体沉积病并不是一种高灵敏度和绝对特异度的方法,因为软骨中的羟磷灰石钙沉积也可能出现类似的情况[50]。根据K.A.Lee等人的研究[57],该方法的特异度和灵敏度分别为96.9%和44.2%。
通过放射学检查很难将焦磷酸钙沉积引起的骨关节炎与退变性骨关节炎区分开来。所使用的鉴别诊断征象并不是绝对的。鉴别诊断征象包括更明显的骨刺和软骨下囊肿、骨组织破坏、病变定位和炎症的临床表现[50,53,54,58]。与焦磷酸钙沉积相关的骨关节炎相比,退变性骨关节炎较少累及肩关节、手关节和掌指关节[53]。在与焦磷酸钙有关的骨关节炎中更常观察到较大的软骨下囊肿和明显的骨组织破坏[54]。股四头肌腱和跟腱的钙化并伴有软骨钙沉着症也是值得注意的;这很可能表明焦磷酸钙晶体沉积病的诊断[56]。
由于成本低、设备移动性强且易于使用,超声检查越来越受欢迎。B.Frediani等人[59]描述了焦磷酸钙晶体沉积病患者的三种超声征象。一种是出现与软骨表面平行的高回声线状带。这种图像在透明软骨的焦磷酸钙沉积中更为常见。另一种征象是纤维软骨中焦磷酸钙沉积的特征性表现。它包括沿软骨组织走向出现的点状高回声包涵体。在关节腔中,最不常见的是带有圆形和/或椭圆形焦磷酸钙晶体移动聚集体的高回声悬浮物。根据K.A.Lee等人的研究[57],超声检查的特异度和灵敏度分别为77.1%和74.4%。需要注意的是,使用这种方法可能很难区分痛风和焦磷酸钙晶体沉积病的超声征象。这对于不是超声诊断专家的医生来说极其困难。该方法的缺点包括结果对操作者的依赖性很强。此外,在骨关节炎的极端阶段,如果出现明显的骨刺,由于骨组织声影的存在会给检查带来困难[60]。
电子计算机断层扫描主要被用于轴骨骼中的定位过程:齿状突加冠综合征、椎间盘病变[61]。在寰枢关节,横韧带、翼韧带、突尖韧带和十字韧带的钙化可清晰可见;黄韧带的钙化常见于结节状病灶[62]。
双能量计算机断层扫描在焦磷酸钙晶体沉积疾病诊断中的作用仍未确认。在“Dual Energy Gout”级双能量计算机断层扫描获得的彩色编码图像上,含钙沉积物将被染成蓝色。这样就能将它们与单尿酸钠沉积物明确区分开来。值得注意的是,由于钙含量高,皮质骨的编码与焦磷酸钙和羟磷灰石沉积物相似(图4)。
图4。冠状和矢状投影的彩色编码双能量图像(左膝关节区域)。内侧半月板钙化(数据来自莫斯科国立大学医学教育研究中心的双能量计算机断层扫描)。
根据D.Kravchenko等人的研究[63],双能量计算机断层扫描检测焦磷酸钙晶体的灵敏度和特异度分别为55%和92%(平均病程为1个月,采用痛风标准化扫描协议)。H.Tanikawa等人[60]发现了,双能量计算机断层扫描检测半月板外焦磷酸钙晶体的灵敏度和特异度分别为77.8%和93.8%。
目前,焦磷酸钙晶体沉积还没有具体的治疗方案,因此无法计算焦磷酸钙沉积物的体积,甚至在某些情况下无法将其与骨组织可靠地区分开来。一组研究人员S.K.Tedeschi等人[64]修改了痛风图像重建的参数,增加了“Iodine Ratio”指数值,从而使该方法对焦磷酸钙晶体的灵敏度提高(达到90%-100%)。与此同时,单尿酸钠和焦磷酸钙晶体之间的鉴别诊断也失去了可能性。
双能量计算机断层扫描的优势还在于能够区分羟磷灰石钙沉积物和焦磷酸钙沉积物。众所周知,在典型病例下羟磷灰石钙沉积通常沿肌腱沉积。但这一征象对于鉴别诊断并不是绝对的。在放射学上,钙盐被定义为软骨钙沉着症。这也无助于确定沉积物的化学成分。多螺旋计算机断层扫描的密度值也不能作为明确的指导。
通过双能量计算机断层扫描可以使用双能量指数和有效原子序数(Zeff)对羟基磷灰石钙沉积物和焦磷酸钙沉积物进行光谱分析,它们是双能量计算机断层扫描结果数学处理的产物。这些参数有助于区分这两类晶体[65]。虽然使用双能量指数和Zeff对钙盐沉积进行鉴别诊断尚未成为常规做法。但这一方向很有前途,值得进一步研究。
结论
双能量计算机断层扫描是诊断晶体性关节病的一种前途广阔的方法。与偏振显微镜检查、超声检查和放射检查以及电子计算机断层扫描等检查方法相比,双能量计算机断层扫描具有许多优点:操作速度快、排除医源性并发症的风险、可对物质进行定性和定量评估以及动态观察。这种放射诊断方法解决许多问题,特别是控制痛风的治疗有效性,以及对晶体性关节病进行鉴别诊断的可能性。
虽然这种技术具有缺陷,但还是有一些方法有助于正确解读双能量计算机断层扫描结果。
双能量计算机断层扫描可以简化对伴有不同类型晶体沉积、症状不典型的关节炎的验证。不过,在痛风的早期诊断、焦磷酸钙和羟磷灰石钙晶体的可靠区分以及体晶体积的确定等方面仍存在问题。这需要在这一领域开展进一步的研究。
ADDITIONAL INFORMATION
Funding source. The work was conducted within the framework of the state assignment of the Lomonosov Moscow State University.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. M.V. Onoyko ― search for publications on the article topic, writing the text of the manuscript; E.A. Mershina ― expert evaluation of information, editing of the text of the manuscript, final version approval; O.A. Georginova ― expert evaluation of information, editing of the text of the manuscript, final version approval; M.L. Plotnikova ― editing of the text of the manuscript; A.V. Panyukova ― editing of the text of the manuscript; V.E. Sinitsin ― expert evaluation of information, final version approval.
作者简介
Maria V. Onoyko
Lomonosov Moscow State University
Email: onoykomary@gmail.com
ORCID iD: 0000-0002-7727-3360
俄罗斯联邦, Moscow
Elena A. Mershina
Lomonosov Moscow State University
Email: elena_mershina@mail.ru
ORCID iD: 0000-0002-1266-4926
SPIN 代码: 6897-9641
MD, Cand. Sci. (Med), Associate Professor
俄罗斯联邦, MoscowOlga A. Georginova
Lomonosov Moscow State University
Email: olga.georginova@gmail.com
ORCID iD: 0000-0002-7542-8189
SPIN 代码: 8331-3656
MD, Cand. Sci. (Med), Assistant Professor
俄罗斯联邦, MoscowMaria L. Plotnikova
Lomonosov Moscow State University
Email: maria_plotnikova@inbox.ru
ORCID iD: 0000-0001-7533-9867
俄罗斯联邦, Moscow
Alexandra V. Panyukova
Lomonosov Moscow State University
Email: panyukovaalexandra@gmail.com
ORCID iD: 0000-0002-5367-280X
俄罗斯联邦, Moscow
Valentin E. Sinitsyn
Lomonosov Moscow State University
编辑信件的主要联系方式.
Email: vsini@mail.ru
ORCID iD: 0000-0002-5649-2193
SPIN 代码: 8449-6590
MD, PhD, Professor, Medical Research and Educational Center
俄罗斯联邦, Moscow参考
- Neogi T, Jansen TL, Dalbeth N, et al. 2015 Gout classification criteria: An American college of rheumatology / European league against rheumatism collaborative initiative. Arthritis Rheumatol. 2015;67(10):2557–2568. doi: 10.1002/art.39254
- Taylor WJ, Fransen J, Dalbeth N, et al. Diagnostic arthrocentesis for suspicion of gout is safe and well tolerated. J Rheumatol. 2016;43(1):150–153. doi: 10.3899/jrheum.150684
- Sikilinda V, Alabut A. Protocols of technique of punctions of joints and treatment blocades in trauma and orthopedic diseases of support-moving apparatus. Chief Physician South Russia. 2018;2 (60):14–20. (In Russ).
- Stauder SK, Peloso PM. Dual-Energy computed tomography has additional prognostic value over clinical measures in gout including tophi: A systematic literature review. J Rheumatol. 2022;49(11):1256–1268. doi: 10.3899/jrheum.211246
- Federal Clinical Guidelines. Gout. All-Russian Public Organization Association of Rheumatologists of Russia; 2014. (In Russ).
- Dalbeth N, Phipps-Green A, Frampton C, et al. Relationship between serum urate concentration and clinically evident incident gout: An individual participant data analysis. Ann Rheum Dis. 2018;77(7):1048–1052. doi: 10.1136/annrheumdis-2017-212288
- Pereverzev AP, Ostroumova OD. Drug-induced hyperuricemia/gout. Part I: Prevalence, pathophysiology, risk factors, clinical pattern. Therapy. 2021;7(6):136–145. (In Russ). doi: 10.18565/therapy.2021.7.159-169
- Chhana A, Lee G, Dalbeth N. Factors influencing the crystallization of monosodium urate: A systematic literature review. BMC Musculoskelet Disord. 2015;16(1):1–11. doi: 10.1186/s12891-015-0762-4
- Fiddis RW, Vlachos N, Calvert PD. Studies of urate crystallisation in relation to gout. Ann Rheum Dis. 1983;42(Suppl 1):12. doi: 10.1136/ard.42.suppl_1.12
- Dalbeth N, Pool B, Gamble GD, et al. Cellular characterization of the gouty tophus: A quantitative analysis. Arthritis Rheum. 2010;62(5):1549–1556. doi: 10.1002/art.27356
- Butler F, Alghubayshi A, Roman Y. The epidemiology and genetics of hyperuricemia and gout across major racial groups: A literature review and population genetics secondary database analysis. J Personalized Med. 2021;11(3):231. doi: 10.3390/jpm11030231
- Meneses-Leon J, Denova-Gutiérrez E, Castañón-Robles S, et al. Sweetened beverage consumption and the risk of hyperuricemia in Mexican adults: A cross-sectional study. BMC Public Health. 2014;14(1):1–11. doi: 10.1186/1471-2458-14-445
- Bae J, Chun BY, Park PS, et al. Higher consumption of sugar-sweetened soft drinks increases the risk of hyperuricemia in Korean population: The Korean multi-rural communities cohort study. Semin Arthritis Rheum. 2014;43(5):654–661. doi: 10.1016/j.semarthrit.2013.10.008
- Zhang W, Doherty M, Pascual E, et al. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the standing committee for international clinical studies including therapeutics (ESCISIT). Ann Rheum Dis. 2006;65(10):1301–1311. doi: 10.1136/ard.2006.055251
- Kienhorst LB, Janssens HJ, Eijgelaar RS, et al. The detection of monosodium urate crystals in synovial fluid after long-term and varying storage conditions. Joint Bone Spine. 2015;82(6):470–471. doi: 10.1016/j.jbspin.2014.10.020
- Secrets of rheumatology. Ed. by S.D. West. Trans. from English ed. by O.M. Lesnyak. Moscow: GEOTAR-Media; 2021. 756 p. (In Russ).
- Malik A, Schumacher HR, Dinnella JE, Clayburne GM. Clinical diagnostic criteria for gout: Comparsion with the gold standard of synovial fluid crystal analysis. J Clin Rheumatol. 2009;15(1):22–24. doi: 10.1097/RHU.0b013e3181945b79
- Pascal Z, Valcov R, Fabreguet I, et al. A prospective evaluation of ultrasound as a diagnostic tool in acute microcrystalline arthritis. Arthritis Res Ther. 2015;17(1):1–8. doi: 10.1186/s13075-015-0701-7
- Omoumi P, Becce F, Racine D, et al. Basic principles, technical approaches, and applications in musculoskeletal imaging (Part I). Semin Musculoskelet Radiol. 2015;19(5):431–437. doi: 10.1055/s-0035-1569253
- Ogdie A, Taylor WJ, Weatherall M, et al. Imaging modalities for the classification of gout: systematic literature review and meta-analysis. Ann Rheum Dis. 2015;74(10):1868–1874. doi: 10.1136/annrheumdis-2014-205431
- Sapsford M, Gamble GD, Aati O, et al. Relationship of bone erosion with the urate and soft tissue components of the tophus in gout: A dual energy computed tomography study. Rheumatology (Oxford). 2017;56(1):129–133. doi: 10.1093/rheumatology/kew383
- Towiwat P, Doyle AJ, Gamble GD, et al. Urate crystal deposition and bone erosion in gout: “Inside-out” or “outside-in”? A dual-energy computed tomography study. Arthritis Res Ther. 2016;18(1):208. doi: 10.1186/s13075-016-1105-z
- Bayat S, Aati O, Rech J, et al. Development of a dual-energy computed tomography scoring system for measurement of urate deposition in gout. Arthritis Care Res (Hoboken). 2016;68(6):769–775. doi: 10.1002/acr.22754
- Rajiah P, Sundaram M, Subhas N. Dual-energy CT in musculoskeletal imaging: What is the role beyond gout? AJR Am J Roentgenol. 2019;213(3):493–505. doi: 10.2214/AJR.19.21095
- Klimkova MM, Sinitsyn VE, Mazurenko DA, et al. Perspectives of dual-energy computed tomography in diagnostic of urinary stone disease for the determination of urinary calculi composition (review). Med Visualization. 2016;(6):84–92. (In Russ).
- McCollough CH, Leng S, Yu L, Fletcher JG. Dual- and multi-energy CT: Principles, technical approaches, and clinical applications. Radiology. 2015;276(3):637–653. doi: 10.1148/radiol.2015142631
- Sodickson AD, Keraliya A, Czakowski B, et al. Dual energy CT in clinical routine: How it works and how it adds value. Emerg Radiol. 2021;28(1):103–117. doi: 10.1007/s10140-020-01785-2
- Megibow AJ, Kambadakone A, Ananthakrishnan L. Dual-energy computed tomography: Image acquisition, processing, and workflow. Radiol Clin North Am. 2018;56(4):507–520. doi: 10.1016/j.rcl.2018.03.001
- Forghani R, De Man B, Gupta R. Dual-energy computed tomography: Physical principles, approaches to scanning, usage, and implementation: Part 2. Neuroimaging Clin N Am. 2017;27(3):385–400. doi: 10.1016/j.nic.2017.03.002
- Henzler T, Fink C, Schoenberg SO, et al. Radiation dose aspects. AJR Am J Roentgenol. 2012;199(5 Suppl):S16–S25. doi: 10.2214/AJR.12.9210
- Borges AP, Antunes C, Curvo-Semedo L. Pros and cons of dual-energy CT systems: “One does not fit all”. Tomography. 2023;9(1):195–216. doi: 10.3390/tomography9010017
- Parakh A, Lennartz S, An C, et al. Dual-energy CT images: Pearls and pitfalls. Radiographics. 2021;41(1):98–119. doi: 10.1148/rg.2021200102
- Gosangi B, Mandell MC, Weaver MJ, et al. Bone marrow edema at dual-energy CT: A game changer in the emergency department. Radiographics. 2020;40(3):859–874. doi: 10.1148/rg.2020190173
- Goo HW, Goo JM. Dual-energy CT. New horizon in medical imaging. Korean J Radiol. 2017;18(4):555–569. doi: 10.3348/kjr.2017.18.4.555
- Baer AN, Kurano T, Thakur UJ, et al. Dual-energy computed tomography has limited sensitivity for non-tophaceous gout: A comparison study with tophaceous gout. BMC Musculoskelet Disord. 2016;17(1):1–9. doi: 10.1186/s12891-016-0943-9
- Bongartz T, Glazebrook KN, Kavros SJ, et al. Dual-energy CT for the diagnosis of gout: an accuracy and diagnostic yield study. Ann Rheum Dis. 2015;74(6):1072–1077. doi: 10.1136/annrheumdis-2013-205095
- Huppertz A, Hermann A, Diekhoff T, et al. Systemic staging for urate crystal deposits with dual-energy CT and ultrasound in patients with suspected gout. Rheumatol Int. 2014;(3):763–771. doi: 10.1007/s00296-014-2979-1
- Strobl S, Halpern EJ, Abd Ellah M, et al. Acute gouty knee arthritis: Ultrasound findings compared with dual-energy CT findings. AJR Am J Roentgenol. 2018;210(6):1323–1329. doi: 10.2214/AJR.17.19199
- Mallinson PI, Coupal T, Reisinger C, et al. Artifacts in dual-energy CT gout protocol: A review of 50 suspected cases with an artifact identification guide. AJR Am J Roentgenol. 2014;203(1):103–109. doi: 10.2214/AJR.13.11396
- Omoumi P, Zufferey P, Malghem J, So A. Imaging in gout and other crystal-related arthropathies. Rheum Dis Clin North Am. 2016;42(4):624–644. doi: 10.1016/j.rdc.2016.07.005
- Lee SM, Lee JG, Lee G, et al. CT Image conversion among different reconstruction kernels without a sinogram by using a convolutional neural network. Korean J Radiol. 2019;20(2):295–303. doi: 10.3348/kjr.2018.0249
- Alavandar E, Arunachalam VK, Narappulan N, et al. Principles and available hardware in DECT. J Gastrointestinal Abdominal Radiology. 2022;5(6). doi: 10.1055/s-0042-1742772
- Lee JS, Seo WJ. What is the diagnostic value of dual-energy computed tomography in patients with clinical diagnosis of gout? Adv Rheumatol. 2021;61(1):1–7. doi: 10.1186/s42358-021-00198-0
- Jia E, Zhu J, Huang W, et al. Dual-energy computed tomography has limited diagnostic sensitivity for short-term gout. Clin Rheumatol. 2018;37(3):773–777. doi: 10.1007/s10067-017-3753-z
- Ramon A, Ornetti P. Dual energy computed tomography: A breakthrough for gout? Joint Bone Spine. 2020;87(4):289–291. doi: 10.1016/j.jbspin.2019.12.002
- Shang J, Li XH, Lu SQ, et al. Gout of feet and ankles in different disease durations: Diagnostic value of single-source DECT and evaluation of urate deposition with a novel semi-quantitative DECT scoring system. Adv Rheumatol. 2021;61(1):1–14. doi: 10.1186/s42358-021-00194-4
- Wang P, Smith SE, Garg R, et al. Identification of monosodium urate crystal deposits in patients with asymptomatic hyperuricemia using dual-energy CT. RMD Open. 2018;4(1):593–597. doi: 10.1136/rmdopen-2017-000593
- Urano W, Yamanaka H, Tsutani H, et al. The inflammatory process in the mechanism of decreased serum uric acid concentrations during acute gouty arthritis. J Rheumatol. 2002;29(9):1950–1953.
- Dalbeth N, Nicolaou S, Baumgartner S, et al. Presence of monosodium urate crystal deposition by dual-energy CT in patients with gout treated with allopurinol. Ann Rheum Dis. 2018;77(3):364–370. doi: 10.1136/annrheumdis-2017-212046
- Zhang W, Doherty M, Bardin T, et al. European league against rheumatism recommendations for calcium pyrophosphate deposition. Part I: Terminology and diagnosis. Ann Rheum Dis. 2011;70(4):563–570. doi: 10.1136/ard.2010.139105
- Sabchyshyn V, Konon I, Ryan LM, Rosenthal AK. Concurrence of rheumatoid arthritis and calcium pyrophosphate deposition disease: A case collection and review of the literature. Semin Arthritis Rheum. 2018;48(1):9–11. doi: 10.1016/j.semarthrit.2017.11.009
- Williams CJ, Rosenthal AK. Pathogenesis of calcium pyrophosphate deposition disease. Best Pract Res Clin Rheumatol. 2021;35(4):101718. doi: 10.1016/j.berh.2021.101718
- Abhishek A. Calcium pyrophosphate deposition. Br J Hosp Med (Lond). 2014;75(4):61–64. doi: 10.12968/hmed.2014.75.sup4.c61
- Miksanek J, Rosenthal AK. Imaging of calcium pyrophosphate deposition disease. Curr Rheumatol Rep. 2015;17(3):20. doi: 10.1007/s11926-015-0496-1
- Godfrin-Valnet M, Godfrin G, Godard J, et al. Eighteen cases of crowned dens syndrome: Presentation and diagnosis. Neurochirurgie. 2013;59(3):115–120. doi: 10.1016/j.neuchi.2013.03.003
- Cipolletta E, Filippou G, Scirè CA, et al. The diagnostic value of conventional radiography and musculoskeletal ultrasonography in calcium pyrophosphate deposition disease: a systematic literature review and meta-analysis. Osteoarthr Cartil. 2021;29(5):619–632. doi: 10.1016/j.joca.2021.01.007
- Lee KA, Lee SH, Kim HR. Diagnostic value of ultrasound in calcium pyrophosphate deposition disease of the knee joint. Osteoarthr Cartil. 2019;27(5):781–787. doi: 10.1016/j.joca.2018.11.013
- Neame RL, Carr AJ, Muir K, Doherty M. UK community prevalence of knee chondrocalcinosis: Evidence that correlation with osteoarthritis is through a shared association with osteophyte. Ann Rheum Dis. 2003;62(6):513–518. doi: 10.1136/ard.62.6.513
- Frediani B, Filippou G, Falsetti P, et al. Diagnosis of calcium pyrophosphate dihydrate crystal deposition disease: Ultrasonographic criteria proposed. Ann Rheum Dis. 2005;64(4):638–640. doi: 10.1136/ard.2004.024109
- Tanikawa H, Ogawa R, Okuma K, et al. Detection of calcium pyrophosphate dihydrate crystals in knee meniscus by dual-energy computed tomography. J Orthop Surg Res. 2018;13(1):73. doi: 10.1186/s13018-018-0787-0
- Rosales-Alexander JL, Aznar JB, Magro-Checa C. Calcium pyrophosphate crystal deposition disease: Diagnosis and treatment. Open Access Rheumatol. 2014;(6):39–47. doi: 10.2147/OARRR.S39039
- Sekijima Y, Yoshida T, Ikeda SI. CPPD crystal deposition disease of the cervical spine: A common cause of acute neck pain encountered in the neurology department. J Neurol Sci. 2010;296(1–2):79–82. doi: 10.1016/j.jns.2010.05.028
- Kravchenko D, Karakostas P, Kuetting D, et al. The role of dual energy computed tomography in the differentiation of acute gout flares and acute calcium pyrophosphate crystal arthritis. Clin Rheumatol. 2022;41(1):223–233. doi: 10.1007/s10067-021-05949-4
- Tedeschi SK, Solomon DH, Yoshida K, et al. A prospective study of dual-energy CT scanning, US and X-ray in acute calcium pyrophosphate crystal arthritis. Rheumatology (Oxford). 2020;59(4):900–903. doi: 10.1093/rheumatology/kez431
- Pascart T, Norberciak L, Legrand J, et al. Dual-energy computed tomography in calcium pyrophosphate deposition: Initial clinical experience. Osteoarthr Cartil. 2019;27(9):1309–1314. doi: 10.1016/j.joca.2019.05.007
补充文件