Лучевые методы в диагностике первичной и рецидивной злокачественной струмы яичников: клинический случай
- Авторы: Нуднов Н.В.1, Ивашина С.В.1, Аксенова С.П.1
-
Учреждения:
- Российский научный центр рентгенорадиологии
- Выпуск: Том 4, № 2 (2023)
- Страницы: 214-225
- Раздел: Клинические случаи и серии клинических случаев
- Статья получена: 12.04.2023
- Статья одобрена: 16.05.2023
- Статья опубликована: 12.07.2023
- URL: https://jdigitaldiagnostics.com/DD/article/view/322846
- DOI: https://doi.org/10.17816/DD322846
- ID: 322846
Цитировать
Аннотация
Представлено редкое клинико-диагностическое наблюдение первичной и рецидивной злокачественной струмы яичников.
Злокачественная струма правого яичника выявлена через 2 года после хирургического лечения первичной доброкачественной струмы левого яичника. Спустя полгода у пациентки выявлен рецидив заболевания, визуализируемый исключительно по данным радиоизотопных методов исследования. Визуализация рецидивных очагов по брюшине на ультразвуковом исследовании была отмечена на четвёртом году противоопухолевого лечения. По данным ультразвукового исследования, по брюшине малого таза на всём протяжении визуализировались множественные солидные опухолевые очаги изо-гипоэхогенной структуры с наличием локусов низко- и умеренно скоростного кровотока даже в мелких очагах: скорость кровотока (peak systolic velocity, PS) была в диапазоне от 2 до 9 см/сек, максимальный индекс сосудистого сопротивления (resistivity index, RI max) ― 0,53. На протяжении 4 лет пациентке проводилась радиойодтерапия 131I активностью 6,0 ГБк. Состояние пациентки на фоне проводимого лечения удовлетворительное.
Полный текст
ВВЕДЕНИЕ
Злокачественная струма яичников ― редкое заболевание, которое относится к группе монодермальных тератом и органоидных опухолей, которые формируются из дермоидных кист, согласно классификации Всемирной организации здравоохранения (WHO Classification of Tumours, 2020) [1].
Важные открытия по этому вопросу были сделаны ещё в конце XIX века. Так, присутствие ткани щитовидной железы в яичнике впервые описал Ричард Беттлин (Richard Böttlin) в 1889 году, а струму яичников ― Клеменс фон Кальден (Clemens von Kalden) в 1895 году. Термин «struma ovarii colloides» вошёл в обиход в 1903 году благодаря Юлиусу Роберту фон Майеру (Julius Robert von Meyer). Тогда же Людвиг Пик (Ludwig Pick) предположил, что тиреоидные элементы в «яичниковом зобе» могут подвергаться различной трансформации. Постепенно в яичниковой струме был описан весь спектр патологии щитовидной железы, включая узловой и токсический зоб, аутоиммунный тиреоидит, аденомы, карциномы [2, 3].
Струма яичника в 90–95% случаев является доброкачественным образованием, и карцинома в её структуре встречается крайне редко. Найденные клинико-диагностические наблюдения злокачественной струмы яичника носят преимущественно описательный характер [3–11].
Важность своевременной диагностики вида струмы яичника играет ключевую роль у пациенток репродуктивного периода, планирующих сохранение фертильности, так как объём проводимого хирургического лечения будет разным при разных гистологических вариантах данного заболевания. Если при доброкачественной струме яичника будут рассматриваться лапароскопическая техника овариоэктомии или резекция яичника, то злокачественная струма яичника потребует удаления матки с придатками, резекции большого сальника [8]. В научных публикациях показано, что средний временной интервал от первоначального диагноза струмы яичников (доброкачественной или злокачественной) до метастатической фазы злокачественной струмы составляет от 2 до 9 лет [2].
Учитывая, что зоб яичника является новообразованием, а не гипертрофией стромы яичника, как это наблюдается в щитовидной железе, его диссеминация и метастатический потенциал в другие органы подтверждают точку зрения, приведённую в последней классификации опухолей женских половых органов Всемирной организации здравоохранения 2020 года: «перитонеальные имплантаты высокодифференцированной ткани щитовидной железы у пациента с гистологически доброкачественной струмой яичника, известной как «струмоз», в настоящее время считаются метастазом высокодифференцированной фолликулярной карциномы, возникающей в струме яичника» [1, 12]. Отмечено также, что пятилетняя выживаемость пациенток, получающих лечение радиоактивным йодом (йод-131, 131I), была выше, чем у пациенток без лечения (94,9 против 64,8%) [4, 10].
Анализируя медицинские источники информации (Pubmed, Medline), найдены единичные исследования семиотики злокачественной струмы яичника и рецидивного перинонеального струмоза ультразвуковым (УЗИ) или методом магнитно-резонансной томографии (МРТ), при этом описательная картина заболеваний с особенностями перфузионных характеристик носит противоречивые данные, что и послужило поводом к написанию данной статьи.
ОПИСАНИЕ СЛУЧАЯ
О пациенте
В работе изучены особенности клинического случая первичной и рецидивной злокачественной струмы яичников стадии T3cN0M0 у пациентки Р. в возрасте 25 лет.
Пациентка Р. через месяц после родов была прооперирована по поводу доброкачественной струмы левого яичника, дермоидной кисты правого яичника в объёме левосторонней овариоэктомии и резекции правого яичника. В течение 2 лет патологии выявлено не было. В 2015 году в другом лечебном учреждении по поводу асцита и увеличения яичников проведены диагностическая лапароскопия, биопсия очагов по брюшине. В ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России (РНЦРР) проведён пересмотр стёкол препаратов (низкодифференцированная злокачественная струма яичников). В анализах крови от 2015 года тиреоглобулин 35 156 нг/ мл (норма 0–50); антитела к тиреоглобулину 0,52 Ед/мл; тиреотропный гормон 0,76 нг/мл (норма <0,2); тироксин 0,69 пмоль/л; белок СА-125 1339,5 Ед/мл; хорионический гонадотропин человека 1,2 нЕд/мл; альфафетопротеин 2,25 МЕ/мл.
Результаты инструментального исследования
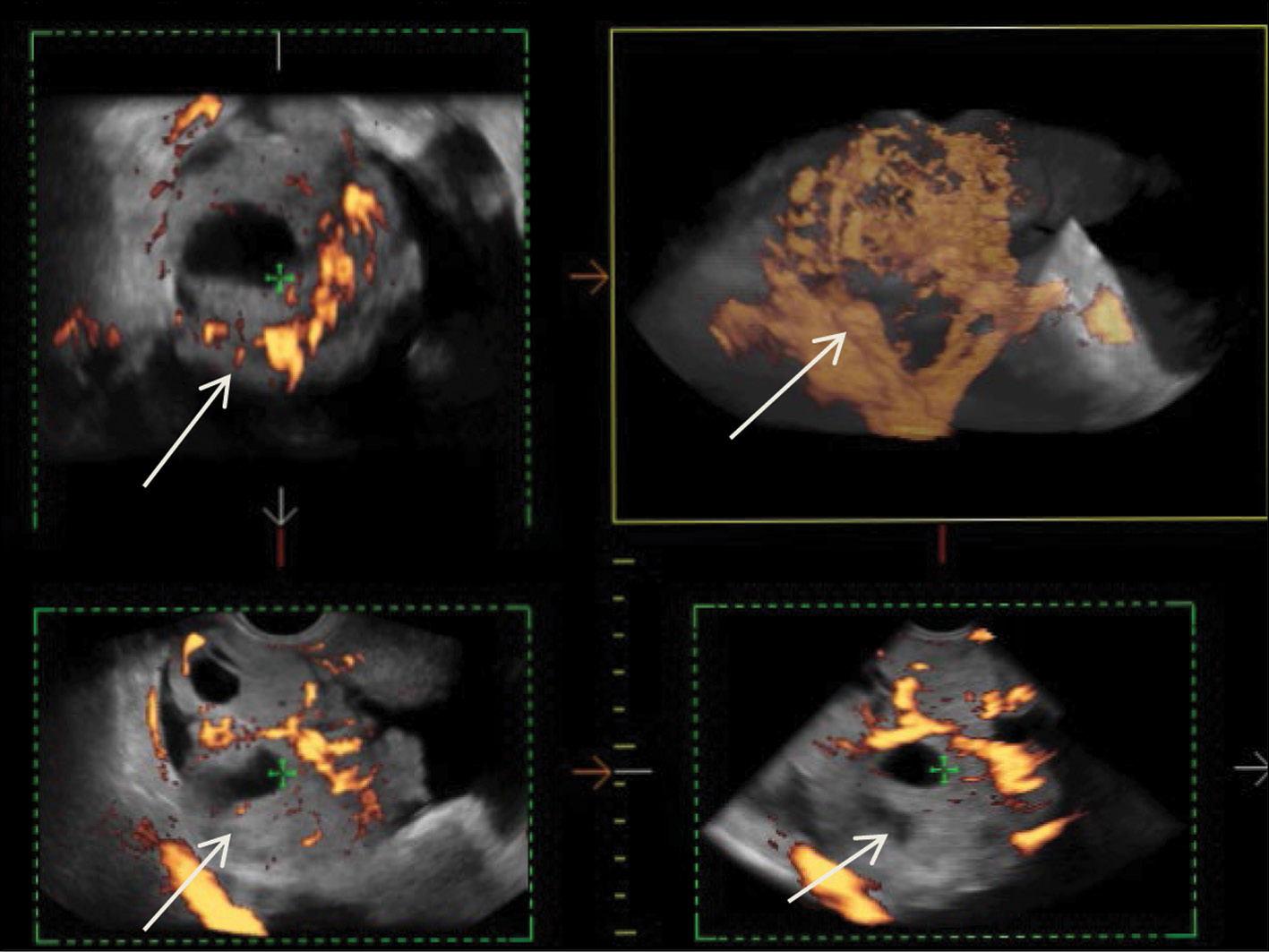
После диагностической лапароскопии и биопсии очагов по брюшине малого таза, выполненных в другом лечебном учреждении, в РНЦРР проведено комплексное УЗИ, по данным которого выявлены неоднородное изо-гипоэхогенное образование с зонами анэхогенной структуры неправильной и округлой формы в проекции правых придатков с выраженным патологическим кровотоком в структуре солидного компонента образования, асцит, канцероматоз брюшины малого таза. На рис. 1 представлена трёхмерная ангиография первичной злокачественной струмы правого яичника.
Рис. 1. 3D-ангиография низкодифференцированной злокачественной струмы правого яичника (стрелки).
УЗИ органов малого таза выполнено на ультразвуковом аппарате eSaote Pro (использованы трансвагинальный и объёмный трансвагинальный датчики). УЗИ выполняли в стандартном 2D-режиме, затем применяли высокотехнологические ультразвуковые методы (энергетическое допплеровское картирование, УЗ-томографию, 3D-ангиографию).
На рис. 2 визуализируется неравномерное утолщение брюшины малого таза, покрывающей переднюю стенку матки. Структура бластоматозно изменённой брюшины малого таза изо-гипоэхогенная, контуры на границе с телом матки нечёткие.
Рис. 2. Допплерограмма в энергетическом режиме. Злокачественная струма яичников. Канцероматоз брюшины малого таза кпереди от матки (стрелка). Опухолевый очаг на изображении имеет размер толщиной 6 мм.
Необходимо отметить выраженность кровотока в опухолевом очаге в дугласовом пространстве и его сглаженность в утолщённой (до 5–7 мм) брюшине малого таза (рис. 3).
Рис. 3. 3D-ангиография опухолевого очага злокачественной струмы по брюшине в позадиматочном пространстве (указан стрелкой).
В дополнение к УЗИ была проведена мультипараметрическая МРТ органов малого таза на высокопольном томографе с напряжённостью магнитного поля 1,5 Тесла. МР-исследование соответствовало рекомендациям Европейского общества урогенитальных радиологов (ESUR Guidlines, 2019) и включало несколько режимов: Т2-ВИ (Т2-взвешенные изображения), Т1-ВИ (Т1-взвешенные изображения), DWI (взвешенные по диффузии изображения; b=800, b=1400), T1 с динамическим контрастным усилением [13].
Первичная визуализация злокачественной струмы яичника на МРТ характеризовалась наличием объёмного предоминантно-солидного образования правого яичника с неровными нечёткими бугристыми контурами, участками множественных кистозных включений размером от 0,7 до 3 см с неоднородно повышенным МР-сигналом на Т1-ВИ, неоднородным (от гипер- до гипо-) МР-сигналом на Т2-ВИ, что соответствовало коллоидным узлам с разным по вязкости высокобелковым содержимым. Солидные участки опухоли характеризовались разными показателями рестрикции диффузии ― от 0,7 до 1,4 мм2/сек×10–3. Определялись также множественные узловые образования по брюшине малого таза и диффузное утолщение брюшины. Накопление парамагнетика в опухолевом узле, по брюшине и в узлах брюшины было резко повышенное на Т1-ВИ с подавлением сигнала от жировой ткани (рис. 4). В то же время на сагиттальных постконтрастных изображениях чётко видно отсутствие накопления парамагнетика в коллоидных узлах злокачественной струмы правого яичника (см. рис. 4, f).
Рис. 4. Магнитно-резонансная томография органов малого таза у пациентки Р. со злокачественной струмой правого яичника: а ― Т 2-FS-ВИ в аксиальной плоскости; b ― Т 1-ВИ в аксиальной плоскости; c ― DWI (b=1000); d ― ADC-карта; e ― Т 1-FS-ВИ + контраст в аксиальной плоскости; f ― Т 1-FS-ВИ + контраст в сагиттальной плоскости. Сплошной стрелкой отмечены коллоидные узлы в злокачественной струме яичника правого яичника; пунктирной стрелкой ― очаги по брюшине таза с повышенным накоплением парамагнетика и рестрикцией диффузии аналогично солидному компоненту основной опухоли.
По данным УЗИ, свободная жидкость в малом тазу в объёме 5–10 мл была выявлена через 3 месяца после проведённого хирургического этапа лечения: экстирпации матки с правыми придатками, оментэктомии, тиреоидэктомии. На протяжении 4 лет свободная жидкость, по результатам комплексного УЗИ, сохранялась на фоне проводимой радиойодтерапии (131I, 6.0 ГБк, суммарно 11 курсов), однако очагов не было выявлено. Первые очаги рецидива основного заболевания по брюшине малого таза, визуализируемые по данным УЗИ, появились через 4 года от начала комплексного лечения.
По данным УЗИ, рецидивные очаги злокачественной струмы яичника по брюшине малого таза, выявленные на фоне асцита, имели изо-гипоэхогенную структуру без чётких контуров и небольшой размер (от 4 до 12 мм). Брюшина малого таза вне очагов была толщиной менее 4 мм, однако при проведении 3D-ангиографии и УЗ-томографии было выявлено, что даже мелкие бластоматозные очаги были хорошо васкуляризированы. Кровоток регистрировался также в структуре брюшины малого таза, толщина которой была около 4–5 мм (рис. 5–7).
Рис. 5. Допплерограмма в энергетическом режиме. Рецидивные очаги злокачественной струмы яичников отмечены стрелкой.
Рис. 6. Ультразвуковая томография рецидивных очагов злокачественной струмы яичников.
Рис. 7. 3D-ангиография рецидивных очагов злокачественной струмы по брюшине малого таза на фоне асцита.
С целью выявления специфических семиотических УЗ-признаков злокачественной струмы яичника было проведено сравнение рецидивных опухолевых очагов по брюшине злокачественной струмы одного клинического случая с рецидивными очагами серозной аденокарциномы яичника 12 пациенток. Сравнивая опухолевые очаги в позадиматочном пространстве, необходимо отметить более выраженный неоангиогенез в опухолевом очаге злокачественной струмы яичников, где скорость кровотока (peak systolic velocity, PS) регистрировалась в малых очагах (от 4 до 12 мм) и была в диапазоне от 2 до 9 см/ сек, максимальный индекс сосудистого сопротивления (resistivity index, RI max) ― 0,53. Кровоток в рецидивных очагах по брюшине малого таза серозной аденокарциномы до 9 мм не регистрировался, а в очагах до 15–20 мм скорость кровотока варьировала в диапазоне от 2 до 4 см/сек и менее 2 см/сек (рис. 5, 8).
Рис. 8. Допплерограмма в энергетическом режиме опухолевого очага по брюшине в позадиматочном пространстве у пациентки с серозным раком яичников стадии IIIС.
Таким образом, обобщая вышесказанное, в представленном наблюдении сочетанная визуализация тиреоидной ткани (коллоидных узлов), зон ограничения диффузии и повышенного накопления парамагнетика в её солидном компоненте на МРТ могут быть проявлением злокачественной струмы яичника. Рецидивные очаги злокачественной струмы, даже мелкие (до 4–5 мм), хорошо васкуляризированы. Злокачественная струма правого яичника выявлена через 2 года после хирургического лечения первичной доброкачественной струмы левого яичника.
Соматическое состояние пациентки не усугубляется на фоне асцита и сохраняющихся рецидивных очагов в малом тазу.
ОБСУЖДЕНИЕ
Настоящая работа посвящена анализу семиотической УЗ- и МР-картины первичной и рецидивной злокачественной струмы яичника. Наши данные в целом совпадают в описанными в литературе единичными наблюдениями данного новообразования. Так, злокачественная струма яичника при УЗИ представлена мультикистозной опухолью с неправильными перегородками и неоднородными эхогенными солидными компонентами внутри. Результаты комплексного УЗИ (энергетическое допплеровское картирование, УЗ-томография, 3D-ангиография) показывают выраженный неоангиогенез как первичной злокачественной струмы, так и мелких рецидивных очагов злокачественной струмы яичника. Характерным признаком является наличие так называемых жемчужин струмы (struma pearl) ― очерченных округлых и солидных областей с ровными контурами, которые соответствуют богатой коллоидами ткани щитовидной железы [8, 14–17].
В нашем наблюдении опухоль не показала типичных семиотических МР-признаков для злокачественной струмы яичника, в то же время на МРТ можно заподозрить наличие включений коллоидных узлов в ткани щитовидной железы в структуре солидного компонента опухоли яичника. Отмечалось наличие разной степени выраженности ограничения диффузии в солидном компоненте опухоли и очагах по брюшине таза. Патогномоничным было крайне выраженное накопление парамагнетика на постконтрастных сериях в солидном компоненте опухоли и отсутствие накопления в коллоидных узлах. В исследовании R. Gil и соавт. [14] на МР-изображениях струмы яичников визуализировались как мультикистозные опухоли с солидными компонентами, часто с высокой интенсивностью сигнала на Т1-ВИ, в то время как кисты имели различную интенсивность сигнала на Т2-ВИ в зависимости от вязкости жидкости. В исследовании N. Tamura и соавт. [17], проанализировавших 18 случаев струмы яичников, лишь в 54% наблюдений на МРТ был выявлен солидный участок, который накапливал контрастный препарат и соответствовал злокачественному варианту опухоли, в то же время рестрикция диффузии установлена лишь в 11% наблюдений.
В нашем исследовании рестрикция диффузии была неоднородная, но всё же позволяла высказаться в пользу злокачественного характера процесса, как и перфузионные показатели в опухоли. Данные, аналогичные нашим, получены в исследовании S. Yamauchi и соавт. [7]: солидный компонент в злокачественной струме яичника характеризовался повышенным МР-сигналом на DWI и сниженным сигналом на ADC-картах. Так, при сопоставлении с патоморфологическим исследованием именно участки злокачественной папиллярной струмы яичника соответствовали зонам истинного ограничения диффузии на МРТ.
В настоящей работе нами было проведено сравнение рецидивных очагов злокачественной струмы и серозного рака яичников. Необходимо отметить, что по структуре рецидивные очаги злокачественной струмы были схожи с серозным раком яичников и имели изо-гипоэхогенную структуру, однако по данным УЗ-ангиографии и УЗ-томографии при серозном раке яичников в очагах 4–5 мм кровоток не регистрировался. Важно подчеркнуть, что при серозном раке яичников в структуре брюшины малого таза менее 4 мм мы не регистрировали локусы кровотока. В научной работе R. Ranade и соавт. [19] у пациентки через 6 лет после хирургического лечения струмы яичников при УЗИ выявлен перитонеальный струмоз (struma peritonei), при этом очаги имели смешанную структуру с наличием кальцинатов.
В научной публикации C. Brogsitter и соавт. [20] описан клинический случай перитонеального струмоза и указана роль гистологического исследования из-за схожести с карциномой яичника. Многие аспекты перитонеального струмоза остаются неизученными, однако авторы предполагают связь либо с разрывом зрелой тератомы яичника, либо с резекцией яичников по поводу зрелой тератомы яичника. Авторы отмечают также «вялое» течение перитонеального струмоза [20]. Немаловажно отметить, что и в нашем клиническом случае на протяжении 3 лет с момента выявления множественных очагов по брюшине не происходило ухудшения соматического состояния пациентки, несмотря на слабоположительную динамику на фоне радиойодтерапии. В исследованных базах данных не выявлено актуальных наблюдений рецидива злокачественной струмы яичника ― перитонеального струмоза ― по данным МРТ.
ЗАКЛЮЧЕНИЕ
Злокачественную струму яичника довольно сложно диагностировать на дооперационном этапе. Несмотря на то, что струму яичника трудно отличить от аденокарциномы яичника, использование УЗИ и МРТ может быть полезно для дифференциальной диагностики данных нозологий.
В заключение можно суммировать, что сочетанная визуализация тиреоидной ткани и зон ограничения диффузии в её солидном компоненте на МРТ могут быть проявлением злокачественной струмы яичника. Проведённое исследование показало, что даже небольшие рецидивные опухолевые очаги злокачественной струмы яичника по брюшине малого таза (размером до 4–5 мм) хорошо васкуляризированы, в отличие от серозного рака яичников, и могут быть выявлены с помощью методик ультразвуковой объёмной реконструкции изображения в ангиорежиме.
ДОПОЛНИТЕЛЬНО
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении поисково-аналитической работы.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: Нуднов Н.В. — концепция и дизайн работы; согласование окончательного варианта текста; Ивашина С.В. — написание текста статьи, анализ результатов, подготовка иллюстраций; Аксенова С.П. — написание текста статьи, анализ результатов, подготовка иллюстраций; редактирование рукописи.
Информированное согласие на публикацию. Авторы получили письменное согласие пациентки на публикацию медицинских данных и фотографий в журнале Digital Diagnostics.
ADDITIONAL INFORMATION
Funding source. This article was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. Nudnov N.V. — concept and design of the work; agreement on the final version of the text; Ivashina S.V. — writing the text of the article, analysis of the results, preparation of illustrations; Aksenova S.P. — writing the text of the article, analysis the results, preparing illustrations; manuscript editing.
Consent for publication. Written consent was obtained from the patient for publication of relevant medical information and all of accompanying images within the manuscript in Digital Diagnostics journal.
Об авторах
Николай Васильевич Нуднов
Российский научный центр рентгенорадиологии
Email: nvnudnov@rncrr.ru
ORCID iD: 0000-0001-5994-0468
SPIN-код: 3018-2527
д-р мед. наук, профессор
Россия, МоскваСветлана Вячеславовна Ивашина
Российский научный центр рентгенорадиологии
Email: s.ivashina@bk.ru
ORCID iD: 0000-0002-9287-2636
SPIN-код: 7829-2899
к.м.н., ст. науч. сотр.
Россия, МоскваСветлана Павловна Аксенова
Российский научный центр рентгенорадиологии
Автор, ответственный за переписку.
Email: fabella@mail.ru
ORCID iD: 0000-0003-2552-5754
SPIN-код: 4858-4627
к.м.н., науч. сотр.
Россия, МоскваСписок литературы
- Female Genital Tumours. WHO Classification of Tumours, 5th Edition, vol. 4. WHO Classification of Tumours Editorial Board, 2020. Режим доступа: https://publications.iarc.fr/Book-And-Report-Series/Who-Classification-Of-Tumours/Female-Genital-Tumours-2020. Дата обращения: 15.04.2023.
- Li S., Yang T., Li X. FIGO stage IV and age over 55 years as prognostic predicators in patients with metastatic malignant struma ovarii // Front Oncol. 2020. N 10. Р. 584917. doi: 10.3389/fonc.2020.584917
- Roth L.M., Karseladze A.I. Highly differentiated follicular carcinoma arising from struma ovarii: A report of 3 cases, a review of the literature, and a reassessment of so-called peritoneal strumosis // Int J Gynecol Pathol. 2008. Vol. 27, N 2. P. 213–222. doi: 10.1097/PGP.0b013e318158e958
- Ayhan S., Kilic F., Ersak B., et al. Malignant struma ovarii: From case to analysis // J Obstet Gynaecol Res. 2021. Vol. 47, N 9. Р. 3339–3351. doi: 10.1111/jog.14902
- Kanasugi M., Nishiyama H., Sanpei M., et al. Ovarian strumal carcinoid: A case report // Fukushima J Med Sci. 2023. Vol. 69, N 1. Р. 51–55. doi: 10.5387/fms.2022-22
- Smith L.P., Brubaker L.W., Wolsky R.J. It does exist! Diagnosis and management of thyroid carcinomas originating in struma ovarii // Surg Pathol Clin. 2023. Vol. 16, N 1. Р. 75–86. doi: 10.1016/j.path.2022.09.008
- Yamauchi S., Kokabu T., Kataoka H., et al. Computed tomography, magnetic resonance imaging, and positron emission tomography/computed tomography findings for the diagnosis of malignant struma ovarii: A case report // J Obstet Gynaecol Res. 2023. Vol. 49, N 5. Р. 1456–1461. doi: 10.1111/jog.15619
- Yazawa R., Yazawa H., Fukuda K., Ohara M. Struma ovarii with massive ascites mimicking ovarian carcinoma treated with conservative laparoscopic surgery: A case report // Fukushima J Med Sci. 2023. Vol. 69, N 1. Р. 37–43. doi: 10.5387/fms.2022-30
- Shou L., Lu J., Yang J., et al. Follicular carcinoma originating from struma ovarii: A case report // Medicine (Baltimore). 2023. Vol. 102, N 1. Р. e32658. doi: 10.1097/MD.0000000000032658
- Elshafie O., Hussein S., Al Kalbani M., et al. Papillary follicular variant thyroid cancer in a malignant struma ovarii: A report of a rare case // Endocrinol Diabetes Metab Case Rep. 2022. Vol. 2022. Р. 21-0169. doi: 10.1530/EDM-21-0169
- Антонова И.Б., Фомин Д.К., Бабаева Н.А., и др. Злокачественная струма яичников. Обзор литературы и собственное наблюдение редкого варианта опухоли // Трудный пациент. 2٠ 1٨. Т. 16, № 8-9. С. 16–18.
- Giovannopoulou E., Saliaris K., Kavoura E., et al. Highly differentiated follicular carcinoma of ovarian origin: A systematic review of the literature // Curr Oncol. 2022. Vol. 29, N 12. Р. 9105–9116. doi: 10.3390/curroncol29120712
- ResearchGate GmbH [интернет]. Alt C., Bharwani N., Brunesch L., et al.; ESUR Female Pelvis Imaging Working Group. Esur quick guide to female pelvis imaging [cite July 2019]. Режим доступа: https://www.esur.org/fileadmin/content/2019/ESUR_2019_ESUR_Quick_Guide_to_Female_Pelvis_Imaging.pdf. Дата обращения: 15.04.2023.
- Gil R., Cunha T.M., Rolim I. Mature cystic teratoma with high proportion of solid thyroid tissue: A controversial case with unusual imaging findings // J Radiol Case Rep. 2017. Vol. 11, N 7. Р. 20–30. doi: 10.3941/jrcr.v11i7.2853
- Озерская И.А., Чекалова М.А., Иванов В.А., Казарян Г.Г. Ультразвуковые признаки опухолей яичников по стандартизованному протоколу // Медицинская визуализация. 2023. Т. 27, № 2. С. 110– 124. doi: 10.24835/1607-0763-1144
- Fujiwara S., Tsuyoshi H., Nishimura T., et al. Precise preoperative diagnosis of struma ovarii with pseud-Meigs’ syndrome mimicking ovarian cancer with the combination of 131I scintigraphy and 18F-FDG PET: Case report and review of the literature // J Ovarian Res. 2018. Vol. 11, N 1. Р. 11. doi: 10.1186/s13048-018-0383-2
- Savelli L., Testa A.C., Timmerman D., et al. Imaging of gynecologic disease (4): Clinical and ultrasound characteristics of struma ovarii. Ultrasound Obstet Gynecol. 2008. Vol. 32, N 2. Р. 210–219. doi: 10.1002/uog.5396
- Tamura N., Murakami K., Ozaki R., et al. Current state of management of struma ovarii and preoperative imaging features: A retrospective case series study of 18 patients at a single institution // J Obstet Gynaecol Res. 2023. Vol. 49, N 3. Р. 1007–1011. doi: 10.1111/jog.15545
- Ranade R., Rachh S., Basu S. Late manifestation of struma peritonei and widespread functioning lesions in the setting of struma ovarii simulating highly differentiated follicular carcinoma // J Nucl Med Technol. 2015. Vol. 43, N 3. Р. 231–233. doi: 10.2967/jnmt.114.149294
- Brogsitter C., Wonsak A., Würl K., Kotzerke J. Peritoneal strumosis // Eur J Nucl Med Mol Imaging. 2004. Vol. 31, N 7. Р. 1057. doi: 10.1007/s00259-004-1548-3
Дополнительные файлы