放射治疗方法在原发性和复发性恶性卵巢甲状腺肿诊断中的应用:临床病例
- 作者: Nudnov N.V.1, Ivashina S.V.1, Aksenova S.P.1
-
隶属关系:
- Russian Scientific Center of Roentgenoradiology
- 期: 卷 4, 编号 2 (2023)
- 页面: 214-225
- 栏目: 临床病例及临床病例的系列
- ##submission.dateSubmitted##: 12.04.2023
- ##submission.dateAccepted##: 16.05.2023
- ##submission.datePublished##: 12.07.2023
- URL: https://jdigitaldiagnostics.com/DD/article/view/322846
- DOI: https://doi.org/10.17816/DD322846
- ID: 322846
如何引用文章
详细
本文介绍了一个罕见的原发性和复发性恶性卵巢甲状腺肿的临床诊断观察。
右侧卵巢的恶性甲状腺肿是在左侧卵巢的原发性良性甲状腺肿手术治疗2年后发现的。6 个月后,患者出现了只有放射性同位素技术数据才能观察到的疾病复发。在抗肿瘤治疗的第四年,超声检查发现了复发的腹膜病灶。根据超声检查,在全体盆腔腹膜上可以看到多个等渗及低回声结构的实体肿瘤病灶,存在低到中等速度的血流病灶,即使是小病灶:血流速度(peak systolic velocity,PS)在2到9cm/s之间,最大血管阻力指数(resistivity index,RI max)为0.53。患者曾接受放射性碘治疗131I,活性为6.0GBq,治疗了4年。在治疗的背景下,患者的情况是令人满意的。
全文:
绪论
恶性卵巢甲状腺肿是一种罕见的疾病,根据世界卫生组织的分类(WHO Classification of Tumours,2020年),它属于由皮样囊肿形成的单胚层畸胎瘤和器官样瘤组[1].
关于这个问题的重要发现是在19世纪末做出的。Richard Böttlin于1889年首次描述了甲状腺组织在卵巢中的存在,Clemens von Kalden于1895年描述了卵巢甲状腺肿。1903年,Julius Robert von Meyer提出了“struma ovarii colloides”这个术语。同时Ludwig Pick提出了,卵巢甲状腺肿中的甲状腺元素可能发生各种转变。卵巢甲状腺肿中的全部病理变化都渐渐被描述出来了,包括结节性和毒性甲状腺肿、自身免疫性甲状腺炎、腺瘤、恶性上皮肿瘤[2,3]。
卵巢甲状腺肿在90-95%的病例中是良性的,而恶性上皮肿瘤在其结构中极为罕见。恶性卵巢甲状腺肿的临床和诊断观察主要是描述性的[3-11] 。
及时诊断卵巢甲状腺肿的类型对计划保持生育能力的生育年龄患者起着关键作用,因为这种疾病的不同组织学变体的手术治疗程度会有所不同。腹腔镜卵巢切除术或卵巢切除术将被考虑用于良性卵巢甲状腺肿,而恶性卵巢甲状腺肿则将需要切除子宫及附件,切除大网膜[8]。科学出版物显示,从最初诊断卵巢甲状腺肿(良性或恶性)到恶性甲状腺肿的转移期的平均时间间隔为2至9年[2]。
要考虑到,卵巢甲状腺肿是一种肿瘤,而不是卵巢基质肥大,后者是在甲状腺中常见的,卵巢甲状腺肿的播散和向其他器官的转移潜力证实世界卫生组织在2020年最新的女性生殖器肿瘤分类中所表达的观点:“在组织学上为良性的卵巢甲状腺肿的患者中,高分化的甲状腺组织的腹膜植入物现在被认为是发生在卵巢甲状腺肿中的高分化滤泡癌的转移灶[1,12]。 并且指出,接受放射性碘(碘-131,131I)治疗的患者的五年生存率高于未治疗的患者(94.9% vs 64.8%)[4,10]。
分析医学信息来源(Pubmed, Medline),发现了通过超声检查或磁共振成像(MRI)对恶性卵巢甲状腺肿和复发性腹膜甲状腺肿的症状学进行的个别研究,同时在描述疾病和灌注特征方面的数据相互矛盾,这促使了本文的撰写。
临床病例描述
关于患者
本文研究了一例25岁的患者R的原发性和复发性恶性卵巢甲状腺肿T3cN0M0期的临床病例的特点。
患者R在产后一个月因左侧卵巢良性甲状腺肿、右侧卵巢皮样囊肿在左侧和右侧的卵巢切除术范围内进行手术。2年来未发现病变。2015年,因腹水和卵巢肿大在另一家医疗机构进行了诊断性腹腔镜检查和腹膜活检。在俄罗斯卫生部联邦国家预算机构俄罗斯放射学科学中心对标本玻璃盖玻片进行了重复观察(低分化恶性卵巢甲状腺肿)。2015年的血液检查显示了,甲状腺球蛋白为35 156 ng/ml(正常值为0-50);甲状腺球蛋白抗体为0.52 U/ml;甲状腺激素为0.76 ng/ml( 正常值为<0.2);甲状腺素为0.69 pmol/L;糖蛋白CA125为1339.5 U/ml;人绒毛膜促性腺激素为1.2 nU/ml;甲胎蛋白为2.25 IU/ml。
器械检查的结果
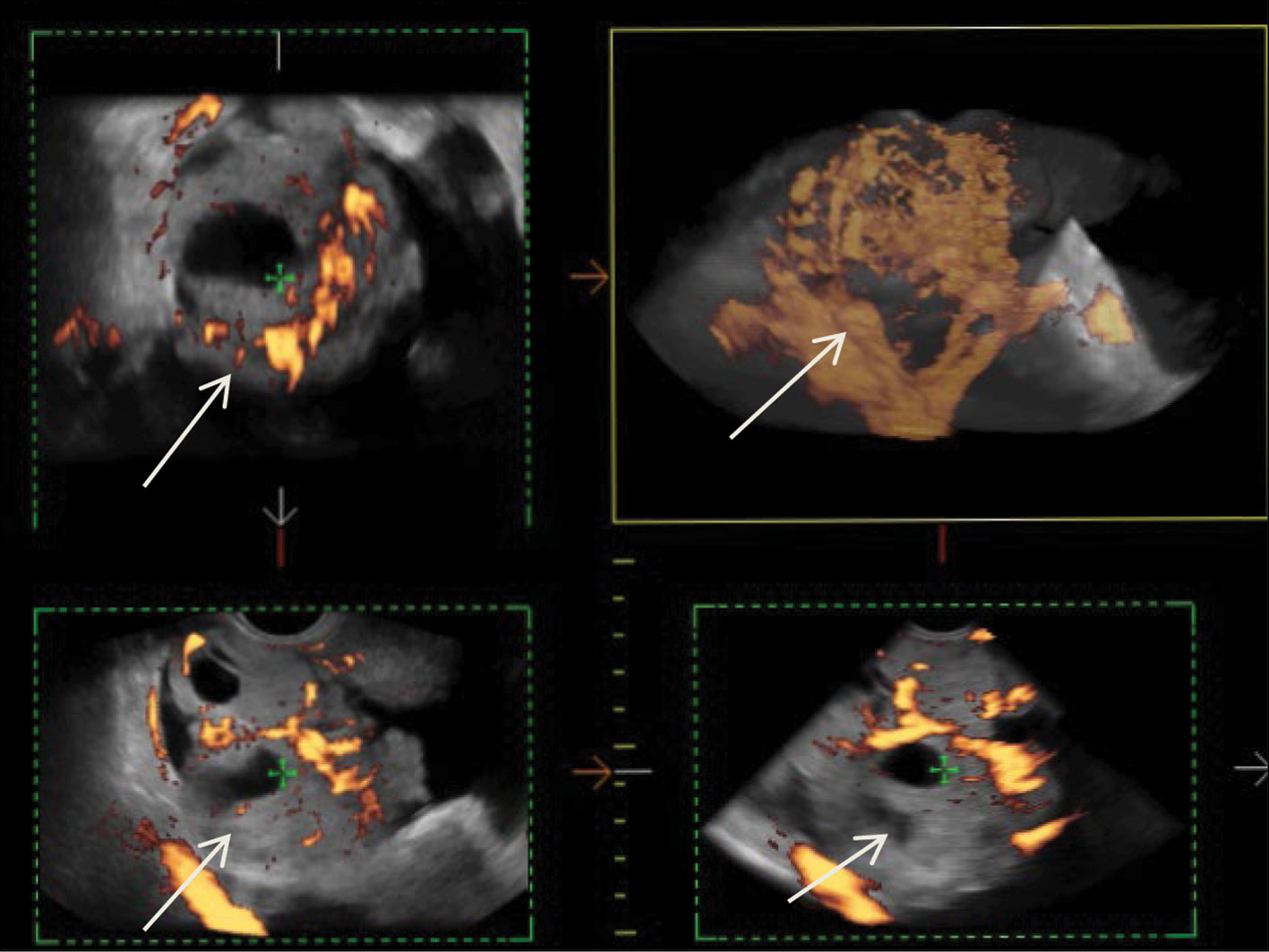
在另一家医疗机构对沿盆腔腹膜病灶进行诊断性腹腔镜检查和活检后,在俄罗斯放射学科学中心进行了全面的超声检查,发现了:异质性等低回声肿块,右侧附件投影有不规则和圆形的无回声结构区,肿块的固体成分结构中有明显的病理性血流,腹水,盆腔腹膜的癌变。图1给出右侧卵巢的原发性恶性甲状腺肿的三维血管造影。
图1。右侧卵巢的低分化恶性甲状腺肿的三维血管造影(箭头)。
盆腔内脏器的超声检查是在eSaote Pro超声机器上进行的(使用了经阴道和容积式经阴道探头)。超声检查是在标准的二维模式下进行的,然后高科技超声技术(功率多普勒成像、超声波断层扫描、三维血管造影)是使用的。
图2显示出覆盖子宫前壁的盆腔腹膜不均匀增厚。胚细胞瘤改变的盆腔腹膜的结构是等低回声的,子宫体边缘的轮廓不清晰。
图2。功率多普勒超声图像。恶性卵巢甲状腺肿。子宫前的盆腔腹膜恶性上皮肿瘤(箭头)。图像上的肿瘤结节厚度为6 mm。
值得注意的是,在道格拉斯腔的肿瘤病灶有明显的血流,而在厚(达到5-7 mm)盆腔腹膜的肿瘤病灶有平滑的血流(图3)。
图3。子宫后间隙沿腹膜的恶性甲状腺肿病灶的三维血管造影(箭头)。

除了超声检查外,还在高场断层扫描仪上进行了盆腔内脏器多参数MRI,磁场强度为1.5 T。MRI检查遵循了欧洲泌尿生殖放射学会的建议(ESUR Guidlines,2019年),包括几种成像方法:T2-WI(T2加权像)、T1-WI(T1加权像)、DWI(扩散加权成像;b=800,b=1400)、T1动态对比增强[13]。
MRI上恶性卵巢甲状腺肿的首次显像特征是右侧卵巢中存在一个体积较大的恶性前固体肿块、轮廓不规则及不清晰的肿块、大小为0.7至3 cm的多囊性包涵体区域,并且T1-WI的MR信号不均匀增加,T2-WI的MR信号不均匀(从高到低),这相当于不同粘度的高蛋白含量的胶质结节。肿瘤固体肿块的特点是不同的扩散受限指数,从0.7到1.4 mm2/s×10–3。并且发现了沿盆腔腹膜的多个结节和弥漫性腹膜增厚。肿瘤结节、腹膜和腹膜结节的顺磁体积聚在T1-WI上急剧升高,脂肪组织信号受到抑制(图4)。同时,矢状位对比后图像清楚地显示,右侧卵巢恶性甲状腺肿的胶质结节中没有顺磁体积聚(见图4f)。
图4。右侧卵巢恶性甲状腺肿患者R的盆腔内脏器磁共振成像:a——轴向平面的T٢-FS-WI;b——轴向平面的T١-WI;c——DWI(b=١٠٠٠);d——ADC图;e——轴向平面的T١-FS-WI+对比剂;f——矢状面的T١-FS-WI+对比剂。实箭头表示右侧卵巢恶性甲状腺肿中的胶质结节;虚线箭头表示沿盆腔腹膜的病灶,其顺磁体积聚是过高的,扩散受限,与主肿瘤的固体成分相似。

根据超声检查结果,在手术治疗3个月后发现了盆腔内有5-10 ml的游离液体:右侧附件与子宫切除术、网膜切除术、甲状腺切除术。根据超全面的声检查结果,在放射性碘治 疗(131I,6.0 GBq,共11个疗程)的背景下,游离液体保留了4年,但没有发现病灶。综合治疗开始4年后,超声检查显示了第一个沿盆腔腹膜的基础疾病的复发病灶。
根据超声检查结果,在腹水背景下发现的沿盆腔腹膜的复发性恶性卵巢甲状腺肿病灶具有轮廓清晰及尺寸不大(4至12 mm)的等低回声结构。病灶外的盆腔腹膜厚度小于4 mm,但三维血管造影和超声波断层扫描显示了,即使是小的胚细胞瘤病灶也有良好的血管。盆腔腹膜的结构中也有血流记录,其厚度约为4-5 mm(图5-7)。
图5。功率多普勒超声图像。恶性卵巢甲状腺肿的复发性病灶(箭头)。
图6。恶性卵巢甲状腺肿复发性病灶的超声波断层扫描。
图7。在腹水的背景下,沿盆腔腹膜的恶性甲状腺肿复发性病灶的三维血管造影。
为了确定恶性卵巢甲状腺肿的特定符号超声标志,我们将一个临床病例中的恶性甲状腺肿沿腹膜的复发性肿瘤病灶与12名患者的卵巢浆液性腺癌的复发性病灶进行了比较。比较子宫后间隙的肿瘤病灶,应注意到恶性卵巢甲状腺肿肿瘤病灶的新血管生成更为明显,小病灶(4至12 mm)的血流速度(peak systolic velocity,PS)被记录,范围为2至9 cm/s,最大血管阻力指 数(Resistivity Index,RI max)为0.53。沿盆腔腹膜的浆液性腺癌复发性病灶(小于9 mm)没有血流记录,对于15-20 mm以内的病灶来说,血流速度在2-4 cm/s之间,小于2 cm/s ( 图5,8)。
图٨。一个IIIC期浆液性卵巢癌患者的子宫后间隙沿腹膜的肿瘤病灶的功率多普勒超声图像。
因此,综上所述,在所提出的观察中,在MRI上综合观察到甲状腺组织(胶质结节)、扩散受限区和其固体成分中的过高顺磁体积聚,可能是恶性卵巢甲状腺肿的表现。恶性甲状腺肿的复发性病灶,即使很小(达到4-5 mm),也有良好的血管。右侧卵巢恶性甲状腺肿是在左侧卵巢原发性良性甲状腺肿的手术治疗2年后发现的。
患者的躯体状况并没有因腹水和持续的小盆腔复发性病灶而加重。
讨论
本研究分析了原发性和复发性恶性卵巢甲状腺肿的符号超声和MR成像。我们的发现与文献中描述的这种肿瘤的个别观察基本一致。因此,恶性卵巢甲状腺肿在超声检查上表现为多囊性肿瘤,内部有不规则的间隔和异质性的回声固体成分。全面超声(功率多普勒成像、超声波断层扫描、三维血管造影)的结果显示,原发性恶性甲状腺肿和恶性卵巢甲状腺肿的小复发性病灶都有明显的新血管生成。一个特征是存在所谓的甲状腺肿珍珠(struma pearl),即轮廓光滑的显然圆形和固体区域,相当于富含胶质的甲状腺组 织[8 ,14-17]。
在我们的观察中,肿瘤并没有显示出恶性卵巢甲状腺肿的典型符号MR征象,而MRI可以怀疑在卵巢肿瘤的固体成分中的甲状腺组织中存在胶质结节包涵体。肿瘤固体成分及沿盆腔腹膜的病灶中存在不同程度的扩散受限。肿瘤固体成分在对比后系列上有极其明显的顺磁体积聚,而在胶质结节中没有积聚,这都是特定的。在R.Gil等人研究[14]中的MR图像上卵巢甲状腺肿被成像为多囊性肿瘤,有固体成分,通常在T1-WI有高信号强度,而囊肿在T2-WI有不同的信号强度,取决于液体的粘度。在N.Tamura等人研究[17]中,他们分析了18个卵巢甲状腺肿病例,只有54%的MRI扫描显示了积累造影剂的固体区域,并与恶性肿瘤的变体一致,而只有11%的病例发现了有扩散受限。
在我们的研究中,扩散受限是异质性的,但仍表明该过程的恶性性质,肿瘤中的灌注指数也是如此。在S.Yamauchi等人研究[7]中也获得了与我们类似的数据:恶性卵巢甲状腺肿中的固体成分的特点是DWI上的MR信号增加,ADC图上的信号减少。因此,与病理形态学检查相比,恶性乳头状卵巢甲状腺肿的区域才对应于MRI上真正的扩散受限区域。
在本研究中,我们比较了恶性甲状腺肿复发性病灶和浆液性卵巢癌。应该注意的是,恶性甲状腺肿复发性病灶的结构与浆液性卵巢癌相似,具有等低回声结构,但根据超声血管造影和超声波断层扫描,浆液性卵巢癌的4-5 mm病灶中没有血流记录。需要强调的是,在浆液性卵巢癌中,我们没有记录沿盆腔腹膜结构中小于4 mm的血流病灶。在R.Ranade等人的科学研究[19]显示了,一名患者在手术治疗卵巢甲状腺肿6年后出现了腹膜甲状腺肿(struma peritonei),结构混合,存在钙化。
在C.Brogsitter等人的科学出版物[20]中,描述了一个腹膜甲状腺肿的临床病例,并明确了组织学检查的作用,因为它与卵巢癌有相似之处。腹膜甲状腺肿的许多方面仍未得到研究,但作者认为腹膜甲状腺肿与卵巢成熟畸胎瘤破裂或卵巢成熟畸胎瘤的卵巢切除术有联系。作者还指出,腹膜甲状腺肿的病程是“缓慢的”[20]。值得注意的是,在我们的临床病例中,也是如此,自发现腹膜多发病灶后的3年内,尽管放射性碘治疗的阳性病程较弱,但患者的躯体状况没有恶化。在所研究的数据库中,在MRI数据中没有发现恶性卵巢甲状腺肿——腹膜甲状腺肿——复发的现实观察。
结论
恶性卵巢甲状腺肿在术前是很难诊断的。虽然很难将卵巢甲状腺肿与卵巢腺癌区分开来,但使用超声检查和MRI检查对这些病症的鉴别诊断可能是合理的。
总之,可以说,在MRI上综合观察到甲状腺组织和其固体成分中的扩散受限区,可能是恶性卵巢甲状腺肿的表现。本研究显示了,即使是沿盆腔腹膜的恶性卵巢甲状腺肿的小复发性肿瘤病 灶(大小不超过4-5 mm)也有良好的血管,与浆液性卵巢癌相反,可以使用血管模式容积超声成像技术而发现的。
ADDITIONAL INFORMATION
Funding source. This article was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. Nudnov N.V. — concept and design of the work; agreement on the final version of the text; Ivashina S.V. — writing the text of the article, analysis of the results, preparation of illustrations; Aksenova S.P. — writing the text of the article, analysis the results, preparing illustrations; manuscript editing.
Consent for publication. Written consent was obtained from the patient for publication of relevant medical information and all of accompanying images within the manuscript in Digital Diagnostics journal.
作者简介
Nikolai V. Nudnov
Russian Scientific Center of Roentgenoradiology
Email: nvnudnov@rncrr.ru
ORCID iD: 0000-0001-5994-0468
SPIN 代码: 3018-2527
MD, Dr. Sci. (Med), Professor
俄罗斯联邦, MoscowSvetlana V. Ivashina
Russian Scientific Center of Roentgenoradiology
Email: s.ivashina@bk.ru
ORCID iD: 0000-0002-9287-2636
SPIN 代码: 7829-2899
MD, Cand. Sci. (Med), Senior Research Associate
俄罗斯联邦, MoscowSvetlana P. Aksenova
Russian Scientific Center of Roentgenoradiology
编辑信件的主要联系方式.
Email: fabella@mail.ru
ORCID iD: 0000-0003-2552-5754
SPIN 代码: 4858-4627
MD, Cand. Sci. (Med), Research Associate
俄罗斯联邦, Moscow参考
- Female Genital Tumours. WHO Classification of Tumours, 5th Edition, vol. 4. WHO Classification of Tumours Editorial Board; 2020. Available from: https://publications.iarc.fr/Book-And-Report-Series/Who-Classification-Of-Tumours/Female-Genital-Tumours-2020. Accessed: 15.04.2023.
- Li S, Yang T, Li X. FIGO stage IV and age over 55 years as prognostic predicators in patients with metastatic malignant struma ovarii. Front Oncol. 2020;(10):1983. doi: 10.3389/fonc.2020.584917
- Roth LM, Karseladze AI. Highly differentiated follicular carcinoma arising from struma ovarii: A report of 3 cases, a review of the literature, and a reassessment of so-called peritoneal strumosis. Int J Gynecol Pathol. 2008;27(2):213–222. doi: 10.1097/PGP.0b013e318158e958
- Ayhan S, Kilic F, Ersak B, et al. Malignant struma ovarii: From case to analysis J Obstet Gynaecol Res. 2021;47(9):3339–3351. doi: 10.1111/jog.14902
- Kanasugi M, Nishiyama H, Sanpei M, et al. Ovarian strumal carcinoid: A case report. Fukushima J Med Sci. 2023;69(1):51–55. doi: 10.5387/fms.2022-22
- Smith LP, Brubaker LW, Wolsky RJ. It does exist! Diagnosis and management of thyroid carcinomas originating in struma ovarii. Surg Pathol Clin. 2023;16(1):75–86. doi: 10.1016/j.path.2022.09.008
- Yamauchi S, Kokabu T, Kataoka H, et al. Computed tomography, magnetic resonance imaging, and positron emission tomography/computed tomography findings for the diagnosis of malignant struma ovarii: A case report. J Obstet Gynaecol Res. 2023;49(5):1456–1461. doi: 10.1111/jog.15619
- Yazawa R, Yazawa H, Fukuda K, Ohara M. Struma ovarii with massive ascites mimicking ovarian carcinoma treated with conservative laparoscopic surgery: A case report. Fukushima J Med Sci. 2023;69(1):37–43. doi: 10.5387/fms.2022-30
- Shou L, Lu J, Yang J, et al. Follicular carcinoma originating from struma ovarii: A case report. Medicine (Baltimore). 2023;102(1):e32658. doi: 10.1097/MD.0000000000032658
- Elshafie O, Hussein S, Al Kalbani M, et al. Papillary follicular variant thyroid cancer in a malignant struma ovarii: A report of a rare case. Endocrinol Diabetes Metab Case Rep. 2022;2022:21-0169. doi: 10.1530/EDM-21-0169
- Antonova IB, Fomin DK, Babaeva NA, et al. Malignant ovarian stroma. Literature review and own observation of a rare variant of the tumor. Difficult Patient. 2018;16(8-9):16–18. (In Russ).
- Giovannopoulou E, Saliaris K, Kavoura E, et al. Highly differentiated follicular carcinoma of ovarian origin: A systematic review of the literature. Curr Oncol. 2022;29(12):9105–9116. doi: 10.3390/curroncol29120712
- ResearchGate GmbH [Internet]. Alt C, Bharwani N, Brunesch L, et al.; ESUR Female Pelvis Imaging Working Group. Esur quick guide to female pelvis imaging [cite July 2019]. Available from: https://www.esur.org/fileadmin/content/2019/ESUR_2019_ESUR_Quick_Guide_to_Female_Pelvis_Imaging.pdf. Accessed: 15.04.2023.
- Gil R, Cunha TM, Rolim I. Mature cystic teratoma with high proportion of solid thyroid tissue: A controversial case with unusual imaging findings. J Radiol Case Rep. 2017;11(7):20–30. doi: 10.3941/jrcr.v11i7.2853
- Ozerskaya IA, Chekalova MA, Ivanov VA, Kazaryan GG. Ultrasound signs of ovarian tumors according to a standardized protocol. Medical Imaging. 2023;27(2):110–124. (In Russ). doi: 10.24835/1607-0763-1144
- Fujiwara S, Tsuyoshi H, Nishimura T, et al. Precise preoperative diagnosis of struma ovarii with pseud-Meigs’ syndrome mimicking ovarian cancer with the combination of 131I scintigraphy and 18F-FDG PET: Case report and review of the literature. J Ovarian Res. 2018.11(1):11. doi: 10.1186/s13048-018-0383-2
- Savelli L, Testa AC, Timmerman D, et al. Imaging of gynecologic disease (4): Clinical and ultrasound characteristics of struma ovarii. Ultrasound Obstet Gynecol. 2008;32(2):210–219. doi: 10.1002/uog.5396
- Tamura N, Murakami K, Ozaki R, et al. Current state of management of struma ovarii and preoperative imaging features: A retrospective case series study of 18 patients at a single institution. J Obstet Gynaecol Res. 2023;49(3):1007–1011. doi: 10.1111/jog.15545
- Ranade R, Rachh S, Basu S. Late Manifestation of struma peritonei and widespread functioning lesions in the setting of struma ovarii simulating highly differentiated follicular carcinoma. J Nucl Med Technol. 2015;43(3):231–233. doi: 10.2967/jnmt.114.149294
- Brogsitter C, Wonsak A, Würl K, Kotzerke J. Peritoneal strumosis. Eur J Nucl Med Mol Imaging. 2004;31(7):1057. doi: 10.1007/s00259-004-1548-3
补充文件