Дозиомика в анализе медицинских изображений и перспективы её использования в клинической практике
- Авторы: Солодкий В.А.1, Нуднов Н.В.1, Иванников М.Е.1, Шахвалиева Э.С.1, Сотников В.М.1, Смыслов А.Ю.1
-
Учреждения:
- Российский научный центр рентгенорадиологии
- Выпуск: Том 4, № 3 (2023)
- Страницы: 340-355
- Раздел: Систематические обзоры
- Статья получена: 15.05.2023
- Статья одобрена: 15.06.2023
- Статья опубликована: 26.09.2023
- URL: https://jdigitaldiagnostics.com/DD/article/view/420053
- DOI: https://doi.org/10.17816/DD420053
- ID: 420053
Цитировать
Аннотация
Обоснование. В последние годы увеличивается количество статей с использованием термина «дозиомика», однако литературные обзоры на русском языке по данной теме отсутствуют.
Цель настоящего обзора ― описать основные принципы дозиомики как направления радиомики и проанализировать исследования по оценке возможностей применения их в клинической практике.
Материалы и методы. Систематический поиск литературы был произведён в базе данных PubMed с поисковым запросом «dosiomics OR dosiomic», а также в базе данных eLibrary с поисковым запросом «дозиомика». По состоянию на апрель 2023 года были опубликованы 43 зарубежных исследования на тему использования дозиомики в клинической практике и одна отечественная работа с определением термина «дозиомика».
Результаты. Проанализированы 43 зарубежных исследования на тему использования дозиомики в клинической практике и 1 отечественная статья с определением термина «дозиомика». Проанализированные работы разделены на три группы согласно их тематике и составлены таблицы, описывающие результаты 27 исследований по прогнозированию клинических исходов.
Заключение. В настоящее время дозиомика является новым и перспективным направлением радиомики, применяемым в текстурном анализе медицинских изображений, связанных с лучевым лечением онкологических больных. Дозиомика может способствовать развитию более персонализированного подхода к планированию лучевой терапии, прогнозированию лучевых повреждений нормальных тканей и диагностике рецидивов.
Полный текст
ВВЕДЕНИЕ
Лучевая терапия является одним из наиболее широко используемых видов лечения онкологических больных. Лучевая терапия может применяться как самостоятельный метод лечения, так и в сочетании с хирургией или химиотерапией, однако риск развития постлучевых осложнений достаточно высок [1]. Именно поэтому оценка токсичности является важным аспектом планирования и проведения лучевой терапии [2].
Одним из способов решения данной задачи является индивидуальный подход к подбору дозы для каждого пациента (к примеру, увеличение дозы для пациентов с низким риском или оптимизация лечения для пациентов с высоким риском осложнений [2]), что осуществляется путём создания прогностических моделей оценки риска лучевых повреждений здоровых органов и тканей на основе различных показателей уже на этапе планирования лучевой терапии.
В настоящее время широкое распространение в области анализа данных рентгенологических исследований получила радиомика ― основанный на машинном обучении метод извлечения количественных характеристик из медицинских изображений (обычно описывающих форму, интенсивность и текстуру), которые можно использовать для построения прогностических моделей [3].
Радиомика широко используется для диагностики различных классов заболеваний органов грудной клетки: в области узловых образований и рака, обструктивных и рестриктивных заболеваний, а также инфильтративных заболеваний лёгких [4–7]. Кроме того, радиомика успешно применяется для прогнозирования побочных эффектов лечения, таких как пневмонит, вызванный лучевой и иммунотерапией, и дифференциации ятрогенных повреждений лёгких от рецидива опухоли [7]. Широкое распространение радиомика получила в сфере прогнозирования течения COVID-19 [8–10]. Применение радиомики может повысить эффективность диагностики, прогнозирования, лечения, последующего наблюдения и мониторинга ответа на лечение [11].
Кроме радиомики всё чаще используется понятие «дозиомики», которая представляет собой направление радиомики, применяемое к трёхмерному распределению дозы лучевой терапии с целью извлечения полезных признаков для прогнозирования результатов лучевой терапии [12–14]. В настоящее время обретает популярность комплексный подход к прогнозированию развития постлучевых повреждений на основе показателей дозиомики, радиомики и клинических данных пациентов [13].
Цель данного обзора ― описать основные принципы дозиомики как направления радиомики и проанализировать исследования, посвящённые оценке возможностей применения её в клинической практике.
Критерии поиска и включения литературных источников
Систематический поиск литературы произведён в базе данных PubMed с поисковым запросом «dosiomics OR dosiomic», а также в базе данных eLibrary с поисковым запросом «дозиомика». По состоянию на апрель 2023 года опубликованы 43 зарубежных и 1 отечественная работа.
Таким образом, проанализированы 43 зарубежных исследования на тему использования дозиомики в клинической практике и 1 отечественная статья с определением термина «дозиомика» [15]. Проанализированные работы были разделены на три группы согласно их тематике, и составлена сводная таблица, описывающая 27 исследований по прогнозированию клинических исходов.
ОСНОВЫ РАДИОМИКИ И ДОЗИОМИКИ: МЕТОДЫ ИЗВЛЕЧЕНИЯ ТЕКСТУРНЫХ ХАРАКТЕРИСТИК ИЗ КОМПЬЮТЕРНО-ТОМОГРАФИЧЕСКИХ ИЗОБРАЖЕНИЙ
Радиомика ― это технология, позволяющая установить взаимосвязь между многочисленными количественными характеристиками, извлечёнными из медицинских изображений органов и тканей, и клинической картиной заболевания посредством многомерного статистического анализа [16].
Показатели радиомики описывают текстурные особенности изображения тканей, что позволяет выявлять биомаркеры изображений и строить прогностические правила [17].
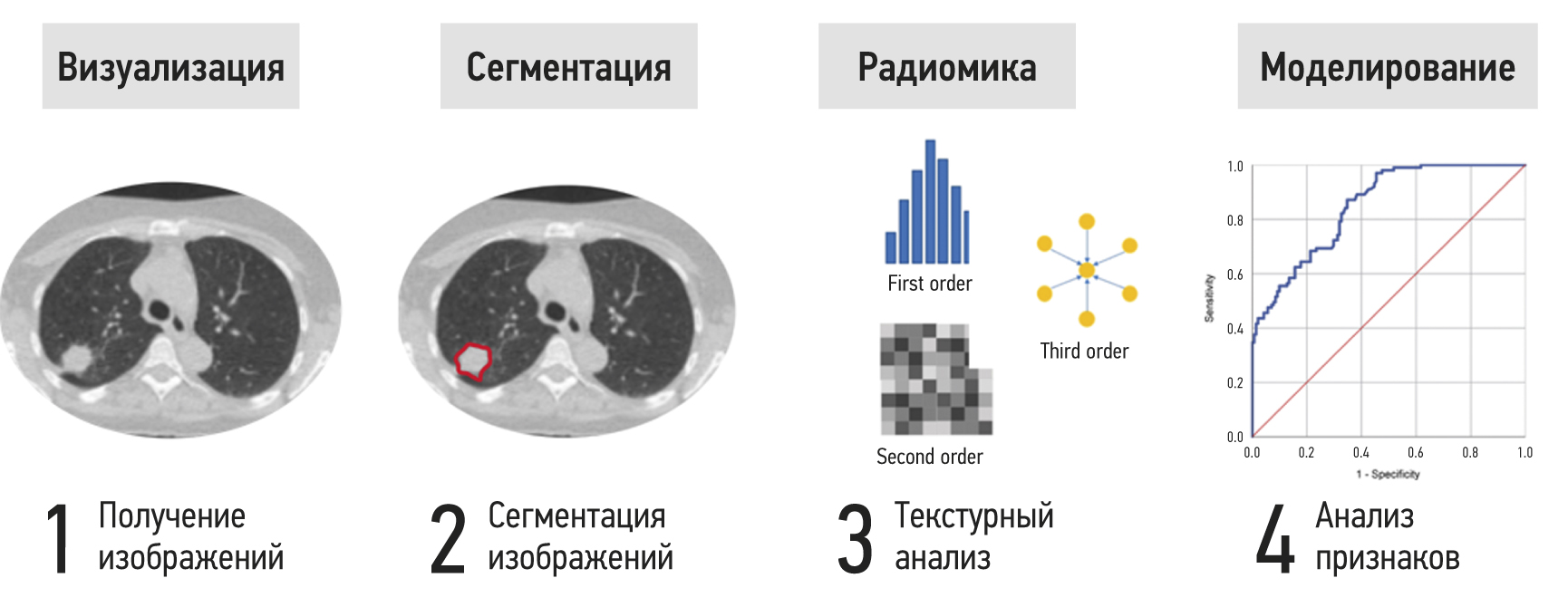
Этапы извлечения и анализа показателей радиомики на примере компьютерной томографии (КТ) лёгких представлены на рис. 1. После выполнения рентгенологического исследования производится сегментация области интереса ― действие, которое изолирует очаг поражения от окружающей здоровой ткани. Сегментация, выполненная в трёх измерениях (3D), может предоставить больше информации, особенно для очагов, которые пространственно неоднородны и имеют большой объём. Методы сегментации включают ручные, полуавтоматические и полностью автоматические методы [16, 18]. Далее с помощью математических алгоритмов рассчитываются показатели радиомики, недоступные визуальной оценке. Метрики обычно включают статистические показатели первого порядка, а также полутоновые матрицы смежности и равномерности. На последнем этапе следуют сокращение размерности выборки, статистический анализ и отбор наиболее значимых признаков с исключением коррелирующих величин, на основе которых с помощью методов машинного обучения строится решающее правило [18].
Рис. 1. Этапы извлечения и анализа показателей радиомики.
Основные показатели радиомики
Показатели радиомики извлекаются из медицинских изображений с помощью открытой библиотеки PyRadiomics. Радиомика включает две основные группы показателей: статистики первого порядка (First-order statistics) и текстурные матрицы смежности и равномерности. К ним относятся матрицы [16–18]:
- GLCM (Gray Level Co-occurrence Matrix) ― матрица совпадения уровней серого;
- GLRLM (Gray Level Run Length Matrix) ― матрица длин областей уровней серого;
- GLSZM (Gray Level Size Zone Matrix) ― матрицы зон интенсивности уровня серого;
- NGTDM (Neighbouring Gray Tone Difference Matrix) ― матрица разности соседних оттенков серого;
- GLDM (Gray Level Dependence Matrix) ― матрица зависимости уровня серого.
Статистики первого порядка описывают распределение частоты уровней серого по гистограмме интенсивности пикселей в заданной области интереса без учёта пространственных взаимосвязей между пикселями [19]. Поскольку эти признаки основаны на анализе одного пикселя или одного вокселя без учёта интенсивности окружающих их областей, они называются статистиками первого порядка.
Статистические меры следующих порядков учитывают взаимное расположение вокселей в пространстве, т.е. они способны описывать особенности текстуры. Наиболее распространёнными из них являются полутоновые матрицы смежности и равномерности: GLCM, GLRLM, GLSZM. Реже встречаются матрицы NGTDM и GLDM.
Матрица совпадения уровней серого (GLCM) представляет собой гистограмму уровней серого второго порядка [19]. Она фиксирует пространственные отношения пар пикселей или вокселей с предопределённой интенсивностью уровней серого в разных направлениях (по горизонтали, вертикали или диагонали для 2D-анализа и 13 направлений для 3D-анализа) и с предопределённым расстоянием между пикселями или вокселями (рис. 2; здесь и далее будет представлен принцип расчёта показателей матриц в двумерном пространстве) [20].
Рис. 2. Пример расчёта показателей матрицы GLCM: соседствующие пиксели с уровнем интенсивности 4 и 1 встречаются 3 раза (выделено зелёным).
GLRLM ― матрица длин областей уровней серого, описанная M.M. Galloway, ― предоставляет информацию о пространственном распределении векторов последовательных пикселей с одинаковым уровнем серого в одном или нескольких направлениях в двух или трёх измерениях (рис. 3) [19–22].
Рис. 3. Пример расчёта показателей GLRLM: три пикселя с одинаковым уровнем серого (3), располагающиеся последовательно, встречаются 1 раз (отмечено жёлтым).
GLSZM ― матрицы зон интенсивности уровня серого, количественно описывающие участки с одинаковым уровнем серого в изображении, состоящие из рядом расположенных вокселей. Согласно G. Thibault и соавт. [23], GLSZM основана на принципе, аналогичном GLRLM, но здесь основу для матрицы составляют подсчёты количества групп (так называемых зон) взаимосвязанных соседних пикселей или вокселей с одинаковым уровнем серого (рис. 4). Более однородная текстура приведёт к более широкой и плоской матрице. GLSZM не вычисляется для разных направлений, но может быть вычислена для разных расстояний между пикселями или вокселями, которые определяют окрестности. Характеристики GLSZM могут быть рассчитаны в двух (8 соседних пикселей) или трёх измерениях (26 соседних вокселей) [19].
Рис. 4. Пример расчёта показателей GLSZM: зона, состоящая из 4 пикселей с уровнем серого, равным 2, встречается 1 раз (выделено зелёным).
NGTDM ― матрица разности соседних оттенков серого. Текстурные характеристики данной матрицы отражают разницу в интенсивности между соседними вокселями [24].
GLDM ― матрица зависимости уровня серого (GLDM) количественно определяет зависимости уровня серого в изображении [19, 25].
Дозиомика
Дозиомика ― это новое направление в области радиомики, представляющее собой текстурный анализ планов распределения дозы облучения, используемого для планирования лучевой терапии.
Первые упоминания термина «дозиомика» в научных публикациях относятся к 2018 году, когда H.S. Gabryś и соавт. [26] применили данный метод для прогнозирования развития ксеростомии у 153 пациентов с раком головы и шеи, прошедших лучевую терапию.
Процесс получения показателей дозиомики включает два этапа.
- При 3D-планировании лучевой терапии используется серия параллельных сканов рентгеновской КТ, где анатомические структуры и планируемый объём мишени определяются на каждом из сканов вручную или с помощью автоматической математической программы оконтуривания в системе планирования [27, 28].
- После получения 3D-моделей распределения дозы на них накладываются маски радиомики с помощью открытого кода, реализованного на языке программирования Python, и вычисляются количественные текстурные характеристики области интереса. Данные показатели, извлечённые из моделей распределения доз, называются показателями дозиомики, т.е. описанные выше текстурные характеристики (статистики первого порядка и матрицы смежности и равномерности).
В работе L. Rossi и соавт. [29] представлен текстурный анализ 3D-модели распределения дозы облучения на область прямой кишки. После составления карт распределения дозы облучения на область интереса накладываются маски радиомики с дальнейшим извлечением текстурных характеристик. На рис. 5 представлены извлечённые из области интереса показатели дозиомики.
Рис. 5. Текстурный анализ 3D-модели распределения дозы облучения на область прямой кишки: а ― трёхмерное распределение дозы в прямой кишке; b ― гистограмма частоты уровней серого; c ― GLCM; d ― GLRLM; e ― GLSZM; f ― NGTDM.
Так как изучаемый массив данных зачастую характеризуется непропорционально большим количеством входных переменных, возникает проблема снижения размерности признакового пространства. Одним из наиболее распространённых правил соотношения между количеством признаков и наблюдений является правило 20 EPV. EPV (events per variable) ― это количество событий на независимую переменную, т.е. число пациентов в меньшей подгруппе, разделённое на количество входных характеристик, учитываемых при разработке модели прогнозирования [30].
На следующем этапе следует сокращение размерности признакового пространства одним из нескольких способов: например, методом главных компонент, линейным дискриминантным анализом, методом случайных лесов (функция Importance) и др. [31, 32]. Далее необходимо исключить сильно коррелирующие величины, на основе которых с помощью методов машинного обу-чения строится решающее правило [18]. На заключительном этапе проводится многомерный статистический анализ с выбором модели прогнозирования в зависимости от поставленной в исследовании задачи. Точность моделей бинарной классификации зачастую оценивается значением площади по характеристической кривой (receiver operating characteristic, ROC) и обозначается в исследованиях как AUC (Area Under the Curve). Кривая строится на основе чувствительности (доля истинно положительных результатов) и специфичности (доля истинно отрицательных результатов). Наиболее часто метрикой оценки работы моделей выживания является индекс конкордации (C-index) ― показатель ранговой корреляции между прогнозируемыми показателями риска и наблюдаемыми показателями в отдельные моменты времени, основанный на коэффициенте корреляции Кендалла.
ПРИМЕНЕНИЕ ДОЗИОМИКИ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
В проанализированных зарубежных литературных источниках можно выделить три основных направления исследовательской работы: использование показателей дозиомики для прогнозирования развития лучевых повреждений здоровых тканей; прогнозирование рецидивов новообразований и исследование стабильности и воспроизводимости дозиомических признаков. Встречались также литературные обзоры, к примеру, работы групп авторов под руководством R. Sun [33] и X. Zhang [34], в которых дозиомика описана как новое направление в текстурном анализе медицинских изображений.
Использование показателей дозиомики в прогнозировании лучевых повреждений здоровых тканей
Общим для всех исследований данного типа является создание моделей (правил) прогнозирования случаев лучевых повреждений у онкологических пациентов. Задачей большинства авторов стало сравнение эффективности прогностических правил, основанных на различных видах данных, таких как клинические факторы, гистограммы доза–объём (dose–volume histograms, DVH), показатели радиобиологических моделей вероятности контроля опухоли (tumor control probability, TCP) и вероятности возникновения лучевых повреждений в нормальных тканях (normal tissue complication probability, NTCP), показатели дозиомики, радиомики и дозиметрии.
Используемые исследователями наборы показателей, их комбинации и применяемые статистические методы значительно различаются от исследования к исследованию. Чаще всего в обозреваемых работах встречаются исследования по прогнозированию постлучевого пневмонита у онкологических пациентов, прошедших лучевую терапию. По данным литературы, встречаемость постлучевого пневмонита значительно варьирует (от 5 до 58%), являясь при этом одним из самых распространённых осложнений после лучевой терапии рака лёгкого [1]. Наиболее масштабное исследование в данной области провели Z. Zhang и соавт. в 2023 году [35], используя данные 314 ретроспективно собранных и 35 проспективно включённых пациентов с диагнозом рака лёгкого. Авторы построили модели на основе показателей радиомики, дозиомики, гистограммы доза–объём (DVH) и клинических факторов. Решающее правило, построенное путём интеграции показателей радиомики, дозиомики и клинических параметров, имело наилучшую прогностическую способность с площадью под кривой 0,855 (95% доверительный интервал 0,719–0,990) в выборке внешнего тестирования [35]. Исходя из результатов данного исследования, можно сделать вывод о более высокой точности моделей, построенных путём интеграции различных показателей.
Тот факт, что модель, включающая в себя комбинацию показателей дозиомики и радиомики, обладает наилучшей прогностической способностью, подтверждается и другими исследователями. Подобные результаты встречаются в исследованиях B. Li и соавт. [36, 37], которые извлекли показатели из специально сегментированных функциональных областей лёгкого, и Y. Huang и соавт. [2]. Так, созданная L. Zhou и соавт. [38] модель на основе распределения эквивалентной дозы облучения, продемонстрировала высокую прогностическую способность с площадью под характеристической кривой 0,799 в тестовой выборке. Интересно, что в исследовании K.M. Kraus и соавт. [39] прогностическая модель с той же комбинацией признаков, но основанная на распределении поглощённой дозы облучения, оказалась более эффективной. Подобные различия могут быть связаны с проблемой воспроизводимости и стабильности показателей дозиомики.
В ряде научных работ сравнивались модели на основе показателей дозиметрии и дозиомики. Так, в исследованиях групп авторов под руководством C. Puttanawarut [40] и B. Liang [13, 41] модели на основе показателей дозиомики оказались более эффективными, при этом, как показало исследование T. Adachi и соавт. [42], комбинирование показателей дозиомики и дозиметрии также являлось клинически значимым. Модели, комбинирующие показатели радиомики и дозиомики, показали высокую точность в прогнозировании не только постлучевого пневмонита, но и других постлучевых повреждений, к примеру значительной потери веса (более 5% за 2 месяца), что подтверждают исследования S.H. Lee [43] и P. Han [44]. Так, P. Han и соавт. создали в своей работе систему поддержки принятия врачебных решений, применение которой помогло врачам улучшить точность прогнозирования значительной потери веса. Результаты данных исследований демонстрируют реальную возможность внедрения решающих правил на основе дозиомики в клиническую практику. X. Zheng и соавт. [45], создав модель прогнозирования острого лучевого эзофагита у пациентов с раком лёгкого, получили наиболее высокие значения площади под ROC-кривой (0,801), используя комбинацию радиомических, дозиомических и клинических показателей.
На более высокую эффективность решающих правил на основе показателей дозиомики по сравнению с дозиметрическими моделями указывают результаты работы W. Ren и соавт. [46], в которой авторы прогнозировали развитие пострадиационного гипотиреоза у пациентов с диагнозом назофарингеальной карциномы. У группы пациентов с аналогичным диагнозом S.S. Yang и соавт. [47] прогнозировали появление лучевого повреждения височной доли. Модель на основе возраста пациента, дозиметрических и дозиомических показателей показала наилучший результат ― C-index 0,794 во внешней тестовой выборке.
Комбинирование клинических данных, показателей гистограммы доза–объём и дозиомики в работе L. Rossi и соавт. [29] помогло улучшить эффективность прогнозирования поздних осложнений лучевой терапии мочевого пузыря и прямой кишки, таких как никтурия, ректальное кровотечение, недержание кала. Особенный интерес вызывает работа под руководством S. Monti [48], в которой авторы исследовали взаимоотношения показателей дозиомики и геномики в развитии постлучевой лимфопении у 186 пациентов с диагнозом немелкоклеточного рака лёгкого, прошедших химиолучевую терапию. Авторы утверждают, что выявленные взаимосвязи помогут в разработке стратегий более эффективной индивидуальной лучевой терапии.
Как показывают результаты рассмотренных исследований, при включении в модели показателей дозиомики площадь под ROC-кривой возрастала, что свидетельствует о прогностической ценности этих показателей.
Результаты описанных исследований по прогнозированию лучевых повреждений нормальных тканей представлены в табл. 1.
Таблица 1. Результаты исследований по прогнозированию лучевых повреждений нормальных тканей
Исследование | Прогнозируемое лучевое повреждение | AUC модели на основе дозиомики | Модель с наивысшим AUC |
Zhang и соавт. [35] | Постлучевой пневмонит | 0,774 | R+D+C ― AUC=0,855 |
Li и соавт. [36] | Постлучевой пневмонит | - | R+Ds ― AUC=0,885 |
Li и соавт. [37] | Постлучевой пневмонит | 0,74 | R+D ― AUC=0,88 |
Huang и соавт. [2] | Постлучевой пневмонит | 0,8462 | R+D ― AUC=0,90 |
Zhou и соавт. [38] | Постлучевой пневмонит | - | R+DVH ― AUC=0,805 |
Kraus и соавт. [39] | Постлучевой пневмонит | 0,70 | R+D ― AUC=0,79 |
Puttanawarut и соавт. [40] | Постлучевой пневмонит | 0,71 | D ― AUC=0,71 |
Liang и соавт. [13] | Постлучевой пневмонит | 0,782 | D ― AUC=0,782 |
Liang и соавт. [41] | Постлучевой пневмонит | 0,782 | AUC=0,842 |
Adachi и соавт. [42] | Постлучевой пневмонит | 0,837 | Ds+D ― AUC=0,846 |
Lee и соавт. [43] | Потеря веса | - | R+D ― AUC=0,710 |
Han и соавт. [44] | Потеря веса | - | R+D ― точность=0,73; Врачи ― точность=0,54 |
Zheng и соавт. [45] | Острый лучевой эзофагит | 0,604 | C+R+D ― AUC=0,801 |
Ren и соавт. [46] | Пострадиационный гипотиреоз | 0,7 | D ― AUC=0,7 |
Yang и соавт. [47] | Лучевое повреждение височной доли | - | Возраст+DVH+D ― C-index=0,794 |
Rossi и соавт. [29] | Ректальное кровотечение | - | C+DVH+D ―AUC=0,73 |
Недержание кала | C+DVH+D ― AUC=0,73 | ||
Никтурия | C+D ― AUC=0,66 | ||
Недержание мочи | C+DVH+D ― AUC=0,73 |
Примечание. AUC (area under the curve) ― площадь по характеристической кривой; R ― показатели радиомики; D ― показатели дозиомики; Ds ― показатели дозиметрии; C ― клинические данные пациента; DVH (dose–volume histograms) ― гистограммы доза–объём.
Прогнозирование рецидива/прогрессирования опухолей
Общие принципы проведения исследований в этой группе совпадают с работами по прогнозированию лучевых повреждений. Так, в статьях H. Kamezawa и соавт. [49] и A. Wu и соавт. [14] по прогнозированию местного рецидива рака головы и шеи модели на основе показателей дозиомики оказались наиболее эффективными. Подобное исследование провели B. Wang и соавт. [50], построив модели прогнозирования общей выживаемости с использованием текстурных показателей, извлечённых из КТ, совмещённой с КТ позитронно-эмиссионной томографии (ПЭТ-КТ) и карт распределения дозы при планировании лучевой терапии. Комбинированная модель превзошла все остальные по эффективности прогнозирования.
Подходы групп авторов под руководством Y. Murakami [12] и G. Pirrone [51] относительно прогноза рецидива рака предстательной железы несколько различались. В первом случае авторы прогнозировали биохимический рецидив, обнаружив, что эффективней всего с данной задачей справлялась модель, комбинирующая клинические и дозиомические параметры. Во втором случае модель прогнозирования местного рецидива была основана на показателях радиомики и дозиомики, извлечённых из карт распределения биологически эффективной дозы, изображений КТ и ПЭТ-КТ.
G. Buizza и соавт. [52] и L. Morelli и соавт. [53] доказали эффективность дозиомических моделей в прогнозировании местного рецидива хордом основания черепа и сакральной локализации соответственно. Подобные решающие правила также продемонстрировали высокие показатели индекса конкордации (C-index) в работе C. Cai и соавт. [54] по прогнозированию рецидива и метастазирования назофарингеальной карциномы. Комбинированная модель D. Wang и соавт. [55], включающая показатели дозиомики, показала, что машинное обучение имеет потенциал в прогнозировании полной ремиссии рака прямой кишки после лучевой терапии.
S.K. Lam и соавт. [56] проанализировали компьютерные томографические и магнитно-резонансные изображения 135 пациентов с карциномой носоглотки для прогнозирования приемлемости адаптивной лучевой терапии до начала лечения. Особенностью данного исследования является впервые употреблённый термин «контуромика» ― метод, описывающий сложные геометрические отношения между четырьмя парами областей интереса (volume of interest, VOI). Наилучшими точностными характеристиками обладала модель на основе радиомики с площадью под кривой 0,927 (95% доверительный интервал 0,905–0,948).
Результаты данной группы исследований, как и в случае с прогнозом лучевых повреждений, показывают высокую точность моделей на основе показателей дозиомики. Результаты описанных исследований по прогнозированию рецидива или прогрессирования новообразований представлены в табл. 2.
Таблица 2. Результаты исследований по прогнозированию прогрессирования новообразований
Исследование | Прогнозируемая переменная | Точностная характеристика модели на основе дозиомики | Модель с наилучшей точностной характеристикой |
Kamezawa и соавт. [49] | Местный рецидив рака головы и шеи | AUC=0,81 | D ― AUC=0,81 |
Wu и соавт. [14] | Местный рецидив рака головы и шеи | C-index=0,66 | D ― C-index=0,66 |
Wang и соавт. [50] | Местный рецидив рака головы и шеи | - | R-ПЭТ+R-КТ+Ds ― C-index=0,873 |
Murakami и соавт. [12] | Рецидив рака предстательной железы | - | D+C ― C-index=0,67 |
Pirrone и соавт. [51] | Рецидив рака предстательной железы | AUC=0,68 | D ― AUC=0,68 |
Buizza и соавт. [52] | Рецидив хордом основания черепа | С-index=0,79 | R ― С-index=0,80 |
Morelli и соавт. [53] | Рецидив хордом сакральной локализации | С-index=0,86 | D ― C index=0,86 |
Cai и соавт. [54] | Рецидив и метастазирование назофарингеальной карциномы | C-index=0,822 для рецидива; C-index=0,786 для метастазирования | D ― C-index=0,822 для рецидива; D ― C-index=0,786 для метастазирования |
Wang и соавт. [55] | Ремиссия рака прямой кишки | - | AUC=0,828 |
Lam и соавт. [56] | Оценка лучевой терапии при карциноме носоглотки | AUC=0,811 | R ― AUC=0,927 |
Примечание. AUC (area under the curve) ― площадь по характеристической кривой; R ― показатели радиомики; D ― показатели дозиомики; Ds ― показатели дозиметрии; C ― клинические данные пациента; ПЭТ ― позитронно-эмиссионная томография; КТ ― компьютерная томография.
Воспроизводимость дозиомических признаков
Статистические модели и методы, применяемые в данной группе исследований, крайне разнообразны, однако их объединяет проблема стабильности и воспроизводимости показателей дозиомики. Данному вопросу были посвящены два исследования C. Puttanawarut и соавт. [57, 58]. В первой работе авторы изучали универсальность и применимость показателей радиомики и дозиомики, полученных при анализе изображений онкологических заболеваний различной локализации [57]. Для этой задачи была использована база данных, содержащая данные 101 пациента с раком пищевода и 93 пациентов с раком лёгких. Были разработаны четыре модели для прогнозирования развития постлучевого пневмонита в выборке пациентов с диагнозом рака пищевода и затем применены с той же целью в выборке пациентов с раком лёгкого. Модель, основанная на комбинации показателей дозиомики и радиомики, показала наилучший результат ― AUC=0,75 и AUC=0,68 в выборках пациентов с диагнозом рака пищевода и рака лёгкого соответственно. Подобные результаты могут указывать на ограниченность применения решающих правил при изменении локализации исследуемой патологии. Суть второй работы C. Puttanawarut и соавт. заключалась в оценке устойчивости показателей дозиомики при симулировании ошибок в планировании распределения доз [58]. Средние значения коэффициента внутриклассовой корреляции (ICC) 93 изученных показателей дозиомики были равны 0,9, что указывало на их стабильность, при этом 5 показателей обладали значением ниже 0,75, что указывало на низкую степень их воспроизводимости. Воспроизводимость показателей дозиомики при применении различных алгоритмов расчёта дозы была также оценена в работе T. Adachi и соавт. [59]. Среди 6808 изученных показателей 34,8% продемонстрировали высокую воспроизводимость при применении алгоритма Acuros XB, что указывает на ограниченность применения дозиомики при использовании различных типов расчёта дозы. При этом в работе L. Sun и соавт. [60] большинство дозиомных характеристик были стабильны по отношению к изменениям в расчёте дозы, но показатели гистограммы доза–объём (DVH) характеризовались меньшей вариабельностью, чем дозиомные признаки. L. Placidi и соавт. [61] выделили четыре группы стабильных показателей дозиомики для дальнейших исследований. В своей последующей работе авторы доказали значимость размера вокселя при извлечении дозиомических данных [62].
Действительно, вопрос нормализации, стабильности и воспроизводимости показателей остаётся достаточно важным аспектом для реализациии подобных исследований и требует дальнейшего изучения.
ОБСУЖДЕНИЕ
В приведённых исследованиях в качестве переменной для прогнозирования наиболее часто встречается постлучевой пневмонит ― 11 исследований. В 9 из них для построения решающего правила использовались показатели дозиомики без комбинации с другими признаками. Площадь под характеристической кривой (AUC), используемая в качестве точностной характеристики для таких моделей, располагалась в пределах от 0,67 до 0,84. Решающие правила на основе дозиомики имели также высокие точностные характеристики при прогнозировании рецидивов опухолей различной локализации (С-индекс >0,66). При построении комбинированных моделей, включающих показатели дозиомики, радиомики, дозиметрии и клинических данных пациента, точностные характеристики возрастают, что свидетельствует о высокой прогностической способности и перспективах их применения в клинической практике для индивидуального подхода к планированию лечения пациентов.
Несомненно, на момент написания данной статьи малое количество работ и преимущественно небольшие объёмы выборок свидетельствуют о необходимости дальнейшего изучении дозиомики и возможностей её применения. Дозиомика может быть потенциально включена в процесс планирования лучевой терапии. Стоит отметить, что в большинстве исследований дозиомика оказывается наиболее эффективной в комбинации с другими качественными и количественными признаками, поэтому на данный момент дозиомику стоит рассматривать именно как направление радиомики, позволяющее улучшить эффективность прогностических моделей. При этом необходимо указать, что значения показателей дозиомики и радиомики зависят от используемого программного обеспечения и могут сильно различаться от исследования к исследованию. Подобные проблемы стабильности и воспроизводимости показателей являются серьёзным препятствием на пути внедрения дозиомики в клиническую практику и требуют дальнейшего изучения.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящее время дозиомика является новым и перспективным направлением радиомики, применяемым в текстурном анализе медицинских изображений, связанных с лучевым лечением онкологических больных. Дозиомика может способствовать развитию более персонализированного подхода к планированию лучевой терапии, прогнозированию лучевых повреждений нормальных тканей и диагностике рецидивов.
ДОПОЛНИТЕЛЬНО
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: В.А. Солодкий ― общая концепция и утверждение окончательного варианта статьи; Н.В. Нуднов ― дизайн и диагностические аспекты исследования; М.Е. Иванников ― сбор и анализ данных; Э.С-А. Шахвалиева ― написание текста рукописи, создание иллюстраций; В.М. Сотников ― радиотерапевтические аспекты исследования, редактирование текста рукописи; А.Ю. Смыслов ― дозиметрические и физические аспекты исследования, редактирование текста рукописи.
ADDITIONAL INFORMATION
Funding source. This article was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. The major contributions were distributed as follows: V.A. Solodkiy — general concept and approval of the final version of the article; N.V. Nudnov — design and diagnostic aspects of the study; M.E. Ivannikov — data collection and analysis; E.S-A. Shakhvalieva — writing the manuscript text, preparation of illustrations; V.M. Sotnikov — radiotherapeutic aspects of the study, editing of the manuscript; A.Yu. Smyslov — dosimetric and physical aspects of the study, manuscript editing.
Об авторах
Владимир Алексеевич Солодкий
Российский научный центр рентгенорадиологии
Email: direktor@rncrr.ru
ORCID iD: 0000-0002-1641-6452
SPIN-код: 9556-6556
д-р мед. наук, профессор, академик РАН
Россия, МоскваНиколай Васильевич Нуднов
Российский научный центр рентгенорадиологии
Автор, ответственный за переписку.
Email: nudnov@rncrr.ru
ORCID iD: 0000-0001-5994-0468
SPIN-код: 3018-2527
д-р мед. наук, профессор
Россия, МоскваМихаил Евгеньевич Иванников
Российский научный центр рентгенорадиологии
Email: ivannikovmichail@gmail.com
ORCID iD: 0009-0007-0407-0953
Россия, Москва
Элина Саид-Аминовна Шахвалиева
Российский научный центр рентгенорадиологии
Email: shelina9558@gmail.com
ORCID iD: 0009-0000-7535-8523
Россия, Москва
Владимир Михайлович Сотников
Российский научный центр рентгенорадиологии
Email: vmsotnikov@mail.ru
ORCID iD: 0000-0003-0498-314X
SPIN-код: 3845-0154
д-р мед. наук, профессор
Россия, МоскваАлексей Юрьевич Смыслов
Российский научный центр рентгенорадиологии
Email: smyslov.ay@gmail.com
ORCID iD: 0000-0002-6409-6756
SPIN-код: 9341-0037
канд. тех. наук
Россия, МоскваСписок литературы
- Arroyo-Hernández M., Maldonado F., Lozano-Ruiz F., et al. Radiation-induced lung injury: Current evidence // BMC Pulm Med. 2021. Vol. 21, N 1. P. 1–12. doi: 10.1186/s12890-020-01376-4
- Huang Y., Feng A., Lin Y., et al. Radiation pneumonitis prediction after stereotactic body radiation therapy based on 3D dose distribution: Dosiomics and/or deep learning-based radiomics features // Radiat Oncol. 2022. Vol. 17, N 1. P. 188. doi: 10.1186/s13014-022-02154-8
- Morelli L., Parrella G., Molinelli S., et al. A dosiomics analysis based on linear energy transfer and biological dose maps to predict local recurrence in sacral chordomas after carbon-ion radiotherapy // Cancers. 2023. Vol. 15, N 1. P. 33. doi: 10.3390/cancers15010033
- Ryan S.M., Fingerlin T.E., Mroz M., et al. Radiomic measures from chest high-resolution computed tomography associated with lung function in sarcoidosis // Eur Respir J. 2021. Vol. 54, N 2. P. 1900371. doi: 10.1183/13993003.00371-2019
- Hooda R., Mittal A., Sofat S. Segmentation of lung fields from chest radiographs: A radiomic feature-based approach // Biomed Eng Lett. 2019. Vol. 9, N 1. P. 109–117. doi: 10.1007/s13534-018-0086-z
- Zhang B., Ni-Jia-Ti M.Y., Yan R., et al. CT-based radiomics for predicting the rapid progression of coronavirus disease 2019 (COVID-19) pneumonia lesions // Br J Radiol. 2021. Vol. 94, N 1122. P. 20201007. doi: 10.1259/bjr.20201007
- Avanzo M., Stancanello J., Pirrone G., et al. Radiomics and deep learning in lung cancer // Strahlenther Onkol. 2020. Vol. 196, N 10. P. 879–887. doi: 10.1007/s00066-020-01625-9
- Ji D., Zhang D., Xu J., et al. Prediction for progression risk in patients with COVID-19 pneumonia: The CALL score // Clin Infect Dis. 2020. Vol. 71, N 6. P. 1393–1399. doi: 10.1093/cid/ciaa414
- Chen H., Zeng M., Wang X., et al. A CT-based radiomics nomogram for predicting prognosis of coronavirus disease 2019 (COVID-19) radiomics nomogram predicting COVID-19 // Br J Radiol. 2021. Vol. 94, N 1117. P. 20200634. doi: 10.1259/bjr.20200634
- Wang D., Huang C., Bao S., et al. Study on the prognosis predictive model of COVID-19 patients based on CT radiomics // Sci Reports. 2021. Vol. 11, N 1. P. 11591. doi: 10.1038/s41598-021-90991-0
- Frix A.N., Cousin F., Refaee T., et al. Radiomics in lung diseases imaging: State of the art for clinicians // J Personal Med. 2021. Vol. 11, N 7. P. 602. doi: 10.3390/jpm11070602
- Murakami Y., Soyano T., Kozuka T., et al. Dose-Based radiomic analysis (dosiomics) for intensity modulated radiation therapy in patients with prostate cancer: Correlation between planned dose distribution and biochemical failure // Int J Radiat Oncol Biol Phys. 2022. Vol. 112, N 1. P. 247–259. doi: 10.1016/j.ijrobp.2021.07.1714
- Liang B., Yan H., Tian Y., et al. Dosiomics: Extracting 3D spatial features from dose distribution to predict incidence of radiation pneumonitis // Front Oncol. 2019. N 9. P. 269. doi: 10.3389/fonc.2019.00269
- Wu A., Li Y., Qi M., et al. Dosiomics improves prediction of locoregional recurrence for intensity modulated radiotherapy treated head and neck cancer cases // Oral Oncol. 2020. N 104. P. 104625. doi: 10.1016/j.oraloncology.2020.104625
- Андреев Д.А., Завьялов А.А. Критерии оценки качества лучевой терапии на примере рака предстательной железы (краткий обзор зарубежной литературы) // Проблемы социальной гигиены, здравоохранения и истории медицины. 2021. Т. 29, № S2. C. 1292–1297. doi: 10.32687/0869-866X-2021-29-s2-1292-1297
- Chen Q., Xia T., Zhang M., et al. Radiomics in stroke neuroimaging: Techniques, applications, and challenges // Aging Dis. 2021. Vol. 12, N 1. P. 143–154. doi: 10.14336/AD.2020.0421
- Mayerhoefer M.E., Materka A., Langs G., et al. Introduction to radiomics // J Nucl Med. 2020. Vol. 61, N 4. P. 488–495. doi: 10.2967/jnumed.118.222893
- Van Timmeren J.E., Cester D., Tanadini-Lang S., et al. Radiomics in medical imaging: “How-to” guide and critical reflection // Insights Imaging. 2020. Vol. 11, N 1. P. 91. doi: 10.1186/s13244-020-00887-2
- Radiomic Features: pyradiomics v3.0.1.post15+g2791e23 documentation [интернет]. Режим доступа: https://pyradiomics.readthedocs.io/en/latest/features.html#. Дата обращения: 21.04.2023.
- Al-Areqi F., Konyar M.Z. Effectiveness evaluation of different feature extraction methods for classification of COVID-19 from computed tomography images: A high accuracy classification study // Biomed Signal Process Control. 2022. N 76. P. 103662. doi: 10.1016/j.bspc.2022.103662
- Zwanenburg A., Vallières M., Abdalah M.A., et al. The image biomarker standardization initiative: Standardized quantitative radiomics for high-throughput image-based phenotyping // Radiology. 2020. Vol. 295, N 2. P. 328–338. doi: 10.1148/radiol.2020191145
- Galloway M.M. Texture analysis using gray level run lengths // Comput Graph Image Process. 1975. Vol. 4, N 2. P. 172–179. doi: 10.1016/s0146-664x(75)80008-6
- Thibault G., Angulo J., Meyer F. Advanced statistical matrices for texture characterization: application to cell classification // IEEE Trans Biomed Eng. 2014. Vol. 61, N 3. P. 630–637. doi: 10.1109/TBME.2013.2284600
- Chen S., Harmon S., Perk T., et al. Using neighborhood gray tone difference matrix texture features on dual time point PET/CT images to differentiate malignant from benign FDG-avid solitary pulmonary nodules // Cancer Imaging. 2019. Vol. 19, N 1. P. 56. doi: 10.1186/s40644-019-0243-3
- He J., Ren J., Niu G., et al. Multiparametric MR radiomics in brain glioma: Models comparation to predict biomarker status // BMC Med Imaging. 2022. Vol. 22, N 1. P. 137. doi: 10.1186/s12880-022-00865-8
- Gabryś H.S., Buettner F., Sterzing F., et al. Design and selection of machine learning methods using radiomics and dosiomics for normal tissue complication probability modeling of xerostomia // Front Oncol. 2018. N 8. P. 35. doi: 10.3389/fonc.2018.00035
- Леденев В.В., Нуднов Н.В., Сотников В.М., и др. Результаты количественной оценки постлучевых изменений в легких у онкологических пациентов, полученные с помощью новой методики анализа динамически выполненных РКТ-исследований органов грудной клетки // Вестник рентгенологии и радиологии. 2020. Т. 101, № 1. С. 30–38. doi: 10.20862/0042-4676-2020-101-1-30-38
- Леденев В.В., Солодкий В.А., Нуднов Н.В., и др. Количественные характеристики лучевого повреждения легочной ткани у онкологических пациентов при лучевой терапии на основании данных РКТ // Медицинская визуализация. 2022. Т. 26, № 4. С. 60–74. doi: 10.24835/1607-0763-1182
- Rossi L., Bijman R., Schillemans W., et al. Texture analysis of 3D dose distributions for predictive modelling of toxicity rates in radiotherapy // Radiother Oncol. 2018. Vol. 129, N 3. P. 548–553. doi: 10.1016/j.radonc.2018.07.027
- Liu J., Guo W., Zeng P., et al. Vertebral MRI-based radiomics model to differentiate multiple myeloma from metastases: Influence of features number on logistic regression model performance // Eur Radiol. 2021. Vol. 32, N 1. P. 572–581. doi: 10.1007/s00330-021-08150-y
- Dhir C.S., Lee S.Y. Discriminant independent component analysis // IEEE Trans Neural Netw. 2011. Vol. 22, N 6. P. 845–857. doi: 10.1109/TNN.2011.2122266
- Random Forest Feature Importance Computed in 3 Ways with Python / MLJAR [интернет]. Режим доступа: https://mljar.com/blog/feature-importance-in-random-forest/. Дата обращения: 21.04.2023.
- Sun R., Lerousseau M., Henry T., et al. Intelligence artificielle en radiothérapie: Radiomique, pathomique, et prédiction de la survie et de la réponse aux traitements // Cancer Radiothér. 2021. Vol. 25, N 6-7. P. 630–637. doi: 10.1016/j.canrad.2021.06.027
- Zhang X., Zhang Y., Zhang G., et al. Deep learning with radiomics for disease diagnosis and treatment: Challenges and potential // Front Oncol. 2022. N 12. P. 276. doi: 10.3389/fonc.2022.773840
- Zhang Z., Wang Z., Yan M., et al. Radiomics and dosiomics signature from whole lung predicts radiation pneumonitis: A model development study with prospective external validation and decision-curve analysis // Int J Radiat Oncol Biol Phys. 2023. Vol. 115, N 3. P. 746–758. doi: 10.1016/j.ijrobp.2022.08.047
- Li B., Ren G., Guo W., et al. Function-Wise Dual-Omics analysis for radiation pneumonitis prediction in lung cancer patients // Front Pharmacol. 2022. N 13. P. 3445. doi: 10.3389/fphar.2022.971849
- Li B., Zheng X., Zhang J., et al. Lung subregion partitioning by incremental dose intervals improves omics-based prediction for acute radiation pneumonitis in non-small-cell lung cancer patients // Cancers (Basel). 2022. Vol. 14, N 19. P. 4889. doi: 10.3390/cancers14194889
- Zhou L., Wen Y., Zhang G., et al. Machine learning-based multiomics prediction model for radiation pneumonitis // J Oncol. 2023. Vol. 2023. P. 5328927. doi: 10.1155/2023/5328927
- Kraus K.M., Oreshko M., Bernhardt D., et al. Dosiomics and radiomics to predict pneumonitis after thoracic stereotactic body radiotherapy and immune checkpoint inhibition // Front Oncol. 2023. N 13. P. 1056. doi: 10.3389/fonc.2023.1124592
- Puttanawarut C., Sirirutbunkajorn N., Khachonkham S., et al. Biological dosiomic features for the prediction of radiation pneumonitis in esophageal cancer patients // Radiat Oncol. 2021. Vol. 16, N 1. P. 220. doi: 10.1186/s13014-021-01950-y
- Liang B., Tian Y., Chen X., et al. Prediction of radiation pneumonitis with dose distribution: A convolutional neural network (CNN) based model // Front Oncol. 2020. N 9. P. 1500. doi: 10.3389/fonc.2019.01500
- Adachi T., Nakamura M., Shintani T., et al. Multi-institutional dose-segmented dosiomic analysis for predicting radiation pneumonitis after lung stereotactic body radiation therapy // Med Phys. 2021. Vol. 48, N 4. P. 1781–1791. doi: 10.1002/mp.14769
- Lee S.H., Han P., Hales R.K., et al. Multi-view radiomics and dosiomics analysis with machine learning for predicting acute-phase weight loss in lung cancer patients treated with radiotherapy // Phys Med Biol. 2020. Vol. 65, N 19. P. 195015. doi: 10.1088/1361-6560/ab8531
- Han P., Lee S.H., Noro K., et al. Improving early identification of significant weight loss using clinical decision support system in lung cancer radiation therapy // JCO Clin Cancer Inform. 2021. N 5. P. 944–952. doi: 10.1200/CCI.20.00189
- Zheng X., Guo W., Wang Y., et al. Multi-omics to predict acute radiation esophagitis in patients with lung cancer treated with intensity-modulated radiation therapy // Eur J Med Res. 2023. Vol. 28, N 1. P. 126. doi: 10.1186/s40001-023-01041-6
- Ren W., Liang B., Sun C., et al. Dosiomics-based prediction of radiation-induced hypothyroidism in nasopharyngeal carcinoma patients // Phys Medica. 2021. Vol. 89. P. 219–225. doi: 10.1016/j.ejmp.2021.08.009
- Yang S.S., OuYang P.Y., Guo J.G., et al. Dosiomics risk model for predicting radiation induced temporal lobe injury and guiding individual intensity-modulated radiation therapy // Int J Radiat Oncol Biol Phys. 2023. Vol. 115, N 5. P. 1291–1300. doi: 10.1016/j.ijrobp.2022.11.036
- Monti S., Xu T., Liao Z., et al. On the interplay between dosiomics and genomics in radiation-induced lymphopenia of lung cancer patients // Radiother Oncol. 2022. N 167. P. 219–225. doi: 10.1016/j.radonc.2021.12.038
- Kamezawa H., Arimura H. Recurrence prediction with local binary pattern-based dosiomics in patients with head and neck squamous cell carcinoma // Phys Eng Sci Med. 2022. Vol. 46, N 1. P. 99–107. doi: 10.1007/s13246-022-01201-8
- Wang B., Liu J., Zhang X., et al. Prognostic value of 18F-FDG PET/CT-based radiomics combining dosiomics and dose volume histogram for head and neck cancer // EJNMMI Res. 2023. Vol. 13, N 1. P. 14. doi: 10.1186/s13550-023-00959-6
- Pirrone G., Matrone F., Chiovati P., et al. Predicting local failure after partial prostate re-irradiation using a dosiomic-based machine learning model // J Pers Med. 2022. Vol. 12, N 9. P. 1491. doi: 10.3390/jpm12091491
- Buizza G., Paganelli C., D’Ippolito E., et al. Radiomics and dosiomics for predicting local control after carbon-ion radiotherapy in skull-base chordoma // Cancers. 2021. Vol. 13, N 2. P. 339. doi: 10.3390/cancers13020339
- Morelli L., Parrella G., Molinelli S., et al. A Dosiomics analysis based on linear energy transfer and biological dose maps to predict local recurrence in sacral chordomas after carbon-ion radiotherapy // Cancers (Basel). 2023. Vol. 15, N 1. P. 33. doi: 10.3390/cancers15010033
- Cai C., Lv W., Chi F., et al. Prognostic generalization of multi-level CT-dose fusion dosiomics from primary tumor and lymph node in nasopharyngeal carcinoma // Med Phys. 2023. Vol. 50, N 2. P. 922–934. doi: 10.1002/mp.16044
- Wang D., Lee S.H., Geng H., et al. Interpretable machine learning for predicting pathologic complete response in patients treated with chemoradiation therapy for rectal adenocarcinoma // Front Artif Intell. 2022. N 5. P. 1059033. doi: 10.3389/frai.2022.1059033
- Lam S.K., Zhang Y., Zhang J., et al. Multi-Organ omics-based prediction for adaptive radiation therapy eligibility in nasopharyngeal carcinoma patients undergoing concurrent chemoradiotherapy // Front Oncol. 2022. N 11. P. 792024. doi: 10.3389/fonc.2021.792024
- Puttanawarut C., Sirirutbunkajorn N., Tawong N., et al. Radiomic and dosiomic features for the prediction of radiation pneumonitis across esophageal cancer and lung cancer // Front Oncol. 2022. N 12. P. 768152. doi: 10.3389/fonc.2022.768152
- Puttanawarut C., Sirirutbunkajorn N., Tawong N., et al. Impact of interfractional error on dosiomic features // Front Oncol. 2022. N 12. P. 726896. doi: 10.3389/fonc.2022.726896
- Adachi T., Nakamura M., Kakino R., et al. Dosiomic feature comparison between dose-calculation algorithms used for lung stereotactic body radiation therapy // Radiol Phys Technol. 2022. Vol. 15, N 1. P. 63–71. doi: 10.1007/s12194-022-00651-9
- Sun L., Smith W., Kirkby C. Stability of dosiomic features against variations in dose calculation: An analysis based on a cohort of prostate external beam radiotherapy patients // J Appl Clin Med Phys. 2023. Vol. 24, N 5. P. e13904 doi: 10.1002/acm2.13904
- Placidi L., Gioscio E., Garibaldi C., et al. A multicentre evaluation of dosiomics features reproducibility, stability and sensitivity // Cancers (Basel). 2021. Vol. 13, N 15. P. 3835. doi: 10.3390/cancers13153835
- Placidi L., Cusumano D., Lenkowicz J., et al. On dose cube pixel spacing pre-processing for features extraction stability in dosiomic studies // Phys Medica. 2021. N 90. P. 108–114. doi: 10.1016/j.ejmp.2021.09.010
Дополнительные файлы