Сложность дифференциальной диагностики карциноматоза и туберкулёза брюшины у молодой пациентки с асцитом: описание случая
- Авторы: Нефедова Т.С.1, Шумская Ю.Ф.2, Юраж М.В.1, Панферов А.С.1, Сенчихин П.В.1,3, Грабарник А.Е.4, Щекотуров И.О.1, Мнацаканян М.Г.1
-
Учреждения:
- Первый Московский государственный медицинский университет имени И.М. Сеченова
- Научно-практический клинический центр диагностики и телемедицинских технологий
- Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний
- Московский городской научно-практический центр борьбы с туберкулёзом
- Выпуск: Том 4, № 4 (2023)
- Страницы: 643-652
- Раздел: Клинические случаи и серии клинических случаев
- Статья получена: 08.08.2023
- Статья одобрена: 07.11.2023
- Статья опубликована: 15.12.2023
- URL: https://jdigitaldiagnostics.com/DD/article/view/568134
- DOI: https://doi.org/10.17816/DD568134
- ID: 568134
Цитировать
Аннотация
Сложность дифференциальной диагностики между туберкулёзом брюшины и карциноматозом брюшины заключается в схожести клинической картины, а также данных лабораторных и инструментальных методов обследования. Туберкулёз брюшины, так же, как и карциноматоз брюшины, может сопровождаться развитием асцита, конгломератов лимфоузлов и петель кишечника.
В статье описано клиническое наблюдение молодой пациентки, которая после вторых родов отметила появление интенсивных болей в шее, между лопатками. В дальнейшем, через два месяца с начала симптомов, пациентка перенесла пневмонию с положительным ответом на антибактериальную терапию. Ещё через два месяца она впервые отметила появление рецидивирующего асцита и гастроинтестинальной симптоматики. При обследовании были выявлены изменения яичников и признаки карциноматоза брюшины, а также очаги в лёгких. Однако нетипичная для карциноматоза брюшины клиническая картина и специфическое поражение лёгких позволили заподозрить туберкулёз множественных локализаций. Диагноз был подтверждён по данным лапароскопии с биопсией поражённых тканей и последующим гистологическим и лабораторным подтверждением этиологической роли Mycobacterium tuberculosis.
Описанный случай показывает важность использования всех доступных методов диагностики в установлении причин асцита у молодых пациенток для дифференциальной диагностики между специфической и неопластической этиологией.
Полный текст
АКТУАЛЬНОСТЬ
Туберкулёз органов брюшной полости — это специ-фическое поражение печени, селезёнки, толстой и тонкой кишок, внутрибрюшных лимфатических узлов, органов малого таза и брюшины [1]. Туберкулёз брюшины может проявляться асцитом, формированием конгломератов лимфоузлов и кишечных петель, а также повышенной концентрацией опухолевого антигена СА-125, что требует проведения дифференциальной диагностики с карциноматозом брюшины вследствие прогрессирования рака яичников, особенно в рутинной клинической практике [2, 3]. Ситуацию усугубляет отсутствие неинвазивного «золотого стандарта» диагностики туберкулёзного перитонита [4].
Мы представляем клинический случай 21-летней женщины с туберкулёзом множественных локализаций, в клинической картине которого ведущее место занимал рецидивирующий асцит. Описание подготовлено в соответствии с рекомендациями CARE (CAse REports guidelines) [5].
ОПИСАНИЕ СЛУЧАЯ
Пациентка, 21 год, родившаяся и постоянно проживающая в республике Дагестан, обратилась к гастроэнтерологу в январе 2021 г. со следующими жалобами:
- увеличение живота;
- боли в гипогастрии, преимущественно справа, с иррадиацией в правую нижнюю конечность;
- диарея до трёх раз в сутки без патологических примесей;
- снижение аппетита;
- одышка при физической нагрузке;
- общая слабость.
Анамнез
В феврале 2020 г., через два дня после вторых срочных родов, отметила появление выраженных болей в шее, надплечье и лопаточной области слева, в том числе в ночное время, по этому поводу к врачу не обращалась.
В апреле 2020 г. появились боли в грудной клетке справа и в правом подреберье, повышение температуры тела до 39 ℃, при рентгенографии органов грудной клетки в поликлинике по месту жительства выявлена правосторонняя полисегментарная пневмония, осложнённая плевритом. Начата антибактериальная терапия (меропенем, азитромицин) с положительным клиническим эффектом. В связи с положительным клиническим ответом на антибактериальную терапию изменения в легких трактованы докторами по месту жительства как внебольничная неспецифическая бактериальная пневмония.
С июня 2020 г. на фоне снижения аппетита начала отмечать увеличение живота в объёме. Выполнено ультразвуковое исследование (УЗИ) органов брюшной полости, обнаружено умеренное количество свободной жидкости. Применение спиронолактона в дозе 50 мг в сутки эффекта не дало, объём живота продолжал нарастать.
В сентябре 2020 г. в стационаре по месту жительства выполнен лапароцентез, получено около 500 мл светлой жидкости, её анализ не проводился.
К декабрю 2020 г. вновь отмечено нарастание асцита. В анализах крови отмечалось повышение концентрации C-реактивного белка до 28,4 мг/л (при норме <5 мг/л) и увеличение скорости оседания эритроцитов до 48 мм/ч (при норме <20 мм/ч) на фоне лейкопении до 3 млн/ мкл (при норме 4–9 млн/мкл). По данным компьютерной томографии (КТ) органов грудной клетки и брюшной полости: картина двустороннего полисегментарного воспалительного поражения лёгких, гепатоспленомегалия, асцит, конгломерат из петель толстой и тонкой кишок в левой половине брюшной полости, забрюшинная лимфаденопатия. При выполнении УЗИ органов малого таза отмечено увеличение левого яичника и его кистозная трансформация, большое количество жидкости в малом тазу. Во время выполнения пункции дугласова пространства получено 1100 мл жидкости соломенного цвета, при цитологическом исследовании которой на фоне бесструктурного вещества определялись очаговые скопления нейтрофилов, редкие лимфоциты и мезотелиоциты; в посеве роста микрофлоры не выявлено. Начата терапия: амоксициллин + клавулановая кислота в дозе 875/125 мг 2 раза в сутки, спиронолактон в дозе 100 мг/сут. После начала терапии пациентка отметила появление диареи до 5–7 раз в день, анализ кала на токсины А и В Clostridium difficile — отрицательный.
В январе 2021 г. пациентка обратилась на приём к гастроэнтерологу с вышеупомянутыми жалобами и была госпитализирована в гастроэнтерологическое отделение Университетской клинической больницы Сеченовского Университета.
Результаты физикальной, лабораторной и инструментальной диагностики
В общем анализе крови на прежнем уровне сохранялось повышение концентрации C-реактивного белка и скорости оседания эритроцитов на фоне лейкопении.
При эзофагогастродуоденоскопии: патологии не выявлено.
При колоноскопии: слизистая интактна; выполнена биопсия, микроскопически в толстой и подвздошной кишках изменений не выявлено.
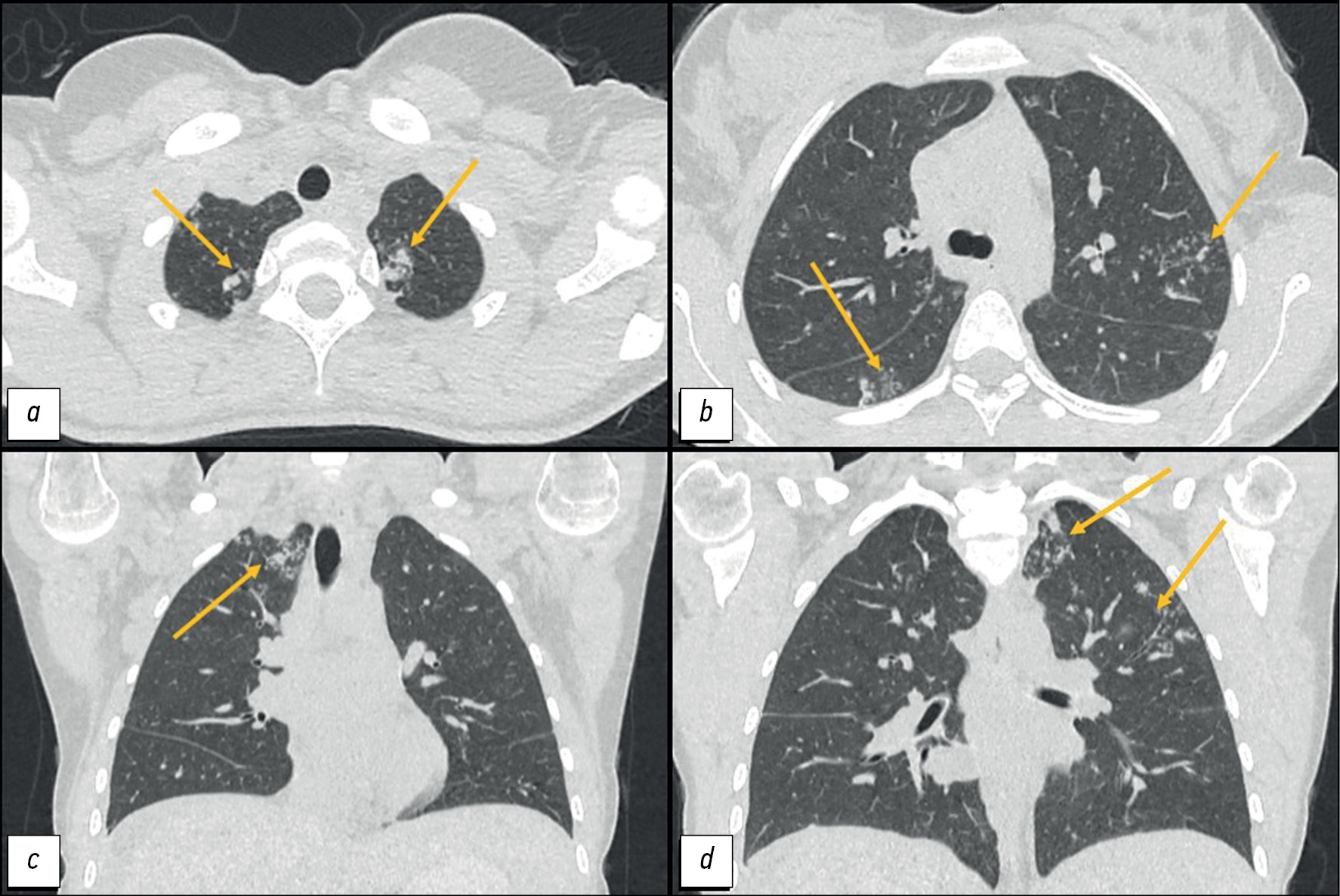
Выполнена КТ лёгких:
- в I, II и VI сегментах определяются структуры типа «дерева с почками» и перибронхиальные очаги размером до 8 мм с тенденцией к слиянию;
- в верхушке левого лёгкого субплеврально зона консолидации неправильной формы размером 15×11 мм;
- медиастинальная лимфаденопатия максимально до 12 мм (рис. 1).
Рис. 1. Компьютерная томография органов грудной клетки: a, d — аксиальная плоскость; b, c — корональная плоскость. Стрелками указаны перибронхиальные очаги, зоны консолидации в верхушках лёгких.
Выполнено УЗИ органов малого таза:
- контуры обоих яичников неровные за счёт мелких эхогенных разрастаний округлой формы с относительно чётким ровным контуром (максимальный диаметр 3 мм, кровоток не регистрируется);
- свободная жидкость в малом тазу;
- на фоне свободной жидкости рядом с яичниками с обеих сторон визуализируются эхогенные структуры вытянутой формы с чётким, относительно ровным контуром, протяжённостью около 56 мм, толщиной 15 мм, с локусами кровотока.
В связи с выявленными на предыдущих исследованиях изменениями выполнена КТ органов брюшной полости с внутривенным контрастированием:
- большое количество свободной жидкости;
- клетчатка брыжейки и большого сальника уплотнена, отёчна, в ней определяются лимфоузлы до 8 мм;
- яичники не увеличены, с неровными контурами, неоднородной структуры (рис. 2).
Рис. 2. Компьютерная томография органов брюшной полости и малого таза с контрастным усилением: a — корональная плоскость; b, c — аксиальная плоскость. Стрелками указано: a, b — яичники с неоднородной структурой и неровными контурами; c — инфильтрация и отёчность большого сальника.
Пациентка также прошла консультацию у гинеколога. Концентрация СА-125 в сыворотке крови — 268 МЕ/ мл (при норме <35 МЕ/мл), однако значения активности ангиотензинпревращающего фермента, и концентраций ракового эмбрионального антигена, β-субъединицы хорионического гонадотропина и онкомаркёра НЕ4 — в пределах референса.
Принимая во внимание анамнестические данные за наличие конгломерата из петель тонкой и толстой кишки, а также наличие кишечной симптоматики, было принято решение о выполнении магнитно-резонансной (МР) энтерографии. По данным МР-энтерографии было выявлено циркулярное гомогенное утолщение стенки и сужение просвета начальных отделов тонкой кишки до 12 мм на протяжении примерно 50 см с повышенным накоплением контрастного препарата, инфильтрация большого сальника по типу «пирога», а также большое количество свободной жидкости в брюшной полости (рис. 3).
Рис. 3. Магнитно-резонансная томография, Т2-взвешенные изображения: a, b — аксиальная плоскость; c — корональная плоскость; оранжевая стрелка — утолщённая стенка тощей кишки; жёлтая стрелка — уплотнённый и утолщённый большой сальник.
На консультации у фтизиатра было высказано предположение о специфической этиологии перитонита и воспалительного процесса в лёгких. Была повторно выполнена пункция брюшной полости, получена светлая жидкость, содержащая преимущественно лимфоциты, 58 г/л белка, 200 ммоль/л глюкозы и сывороточно-асцитический альбуминовый градиент 9,6 г/л. Кислотоустойчивые микобактерии обнаружены не были, но в полимеразной цепной реакции была выявлена ДНК Mycobacterium tuberculosis (микобактерии туберкулёза, МБТ).
Дальнейшее обследование пациентки проводилось в профильном стационаре, где был получен положительный результат теста T-SPOT.TB и асцитической жидкости, а при диагностической лапароскопии было выявлено диссеминированное поражение париетальной и висцеральной брюшины, инфильтративное поражение маточных труб. При изучении биоптатов брюшины и маточных труб с окраской по Цилю–Нильсену кислотоустойчивые микобактерии не выявлены, ДНК M. tuberculosis complex в них не обнаружена. Обращало внимание, что при гистологическом исследовании весь материал был представлен фрагментами грануляционной ткани с большим количеством макрофагально-эпителиоидно-гигантоклеточных гранулём, некоторые с участками казеозного некроза.
Диагноз
Таким образом, на основании данных обследования пациентке был установлен диагноз: «Туберкулёз множественных локализаций: диссеминированный туберкулёз лёгких в фазе инфильтрации, МБТ(–); туберкулёз внутригрудных лимфатических узлов в фазе инфильтрации; туберкулёз брюшины, активная фаза, МБТ(–), ДНК МБТ(+); туберкулёзный сальпингоофорит, активная фаза, МБТ(–); туберкулёз внутрибрюшных лимфоузлов в фазе инфильтрации. Асцит».
Лечение
Лечение проводилось в соответствии с клиническими рекомендациями, по следующей схеме:
- меропенем в дозе 1,0 г, 3 раза в день, внутривенно;
- изониазид 10%, 5,0 мл, внутривенно;
- моксифлоксацин в дозе 0,4 г, внутривенно;
- рифампицин в дозе 0,45 г, внутрь;
- пиразинамид в дозе 1,5 г.
Медикаментозное лечение проводилось на фоне гепатопротекторной и дезинтоксикационной терапии.
Динамика и исходы
На фоне лечения была отмечена положительная динамика: болевой синдром купирован, асцит полностью разрешился. Пациентка была выписана под наблюдение фтизиатра по месту жительства. При динамическом контроле через полгода на фоне курса специфической терапии пациентка чувствовала себя удовлетворительно, отмечалась стойкая нормотермия, болевой синдром не беспокоил, асцит не рецидивировал.
ОБСУЖДЕНИЕ
Сложность диагностики туберкулёза брюшины обусловлена неспецифичной клинической картиной и отсутствием релевантных диагностических маркёров. Туберкулёз брюшины крайне редко бывает первичным. Следовательно, при обследовании необходимо исключить признаки специфического поражения наиболее часто встречаемых локализаций, в частности лёгочной. Возможна контаминация брюшины при первичном поражении кишечника или маточных труб, в таком случае лёгочная ткань будет интактна [6].
В описанном нами случае неясно, какой очаг являлся первичным — лёгкое или тонкая кишка, вовлечение в патологический процесс которой выявлено по данным МР-энтерографии. Кроме того, стоит отметить, что особенностью современного течения туберкулёзного процесса является склонность к генерализации и увеличение частоты экссудативных форм. Повышение концентрации онкомаркёра СА-125 при туберкулёзе яичников создаёт определённые трудности в дифференциальной диагностике со злокачественными новообразованиями, как было и в нашем случае. I.H. Chen и соавт. в своей работе приводят данные, что при туберкулёзном процессе повышение СА-125 в 3–5 раз ниже, чем при злокачественных новообразованиях яичников [7], однако другие авторы указывают повышение уровня СА-125 до 18 554 ЕД/мл [8].
Для туберкулёза брюшины характерен рецидивирующий асцит, хотя возможны адгезивные (слипчивые) и казеозно-некротические формы. При исследовании асцитической жидкости характерны плеоцитоз за счёт лимфоцитоза и высокая концентрация белка с сывороточно-асцитическим альбуминовым градиентом <11 г/л, что также имело место в нашем случае. Во многих зарубежных работах приведены данные о высокой диагностической значимости определения аденозиндезаминазы в асцитической жидкости [9], но широкого распространения этот метод в настоящее время не имеет. Среди лабораторных методов наибольшей диагностической ценностью в отношении туберкулёза брюшнины обладают тесты высвобождения гамма-интерферона (IGRA), которые имеют чувствительность 91,18%, специ-фичность 83,33% и точность 90% для выявления этого заболевания [10]. Исходно IGRA были специально разработаны для замены туберкулиновых тестов в диагностике латентной туберкулёзной инфекции и не предназначались для активного туберкулёзного процесса, устанавливаемым только микробиологическим методом. Однако, согласно исследованию M.K. EL-Deeb и соавт., они показали высокую специфичность при диагностике именно активной формы туберкулёза и преимущества при диагностике латентной формы в группах высокого риска, что требует дальнейших исследований [10]. В нашем случае тест T-SPOT.TB показал положительный результат как в крови, так и в асцитической жидкости, при этом туберкулёзный процесс был активным.
Важную роль в дифференциальной диагностике туберкулёза и карциноматоза брюшины играют лучевые методы исследования. R.V. Ramanan и V. Venu описали выявляемый при КТ признак «сальникового пирога» (рентгенологическая картина диффузной инфильтрации сальника), помогающий, по мнению авторов, разграничить эти состояния [11]. Однако другие авторы указывают на недостаточную диагностическую ценность лучевых методов исследования в подобных клинических ситуациях. Например, J. Kattan и соавт. приводят наблюдения, в которых результаты КТ и магнитно-резонансной томографии не оставляли сомнения в карциноматозе брюшины, но выполнение лапароскопии с биопсией подтвердило туберкулёзный характер поражения [12]. Отмечено, что при абдоминальном туберкулёзе утолщение стенок преобладает в терминальной части подвздошной и слепой кишках [13]. Мы, в свою очередь, при проведении МР-энтерографии органов брюшной полости отметили гомогенное активно накапливающее контраст стенозирующее утолщение проксимальных отделов тонкой кишки, а также инфильтрацию сальника и мелкие образования брюшины, наталкивающие на мысль о милиарной диссеминации (см. рис. 1).
«Золотым стандартом» диагностики туберкулёза брюшины считается выполнение лапароскопического вмешательства с последующим гистологическим исследованием полученных в результате операции биоптатов. Диагноз считается подтверждённым при визуализации милиарного поражения и обнаружении специфических гранулём с казеозным некрозом [14]. При этом стоит отметить, что в исследовании B. Huang и соавт. показано отсутствие преимуществ проведения лапароскопии как самостоятельного метода перед комбинацией лабораторных тестов (CA-125, T-SPOT.TB и скорость оседания эритроцитов) для постановки диагноза [15].
ЗАКЛЮЧЕНИЕ
Проведение дифференциальной диагностики между туберкулёзом и карциноматозом брюшины требует использования всех доступных средств ввиду схожести клинической картины заболеваний. Туберкулёз брюшины необходимо рассматривать как одну из возможных этиологических причин асцита, в том числе у женщин с наличием патологических изменений брюшины и повышенной концентрации СА-125, даже если клиническая картина свидетельствует о злокачественной опухоли яичника с развитием карциноматоза.
ДОПОЛНИТЕЛЬНО
Источник финансирования. Данная статья подготовлена авторским коллективом в рамках научно-исследовательской работы «Оппортунистический скрининг социально значимых и иных распространённых заболеваний» (№ в Единой государственной информационной системе учёта: № 123031400009-1) в соответствии с Приказом от 21.12.2022 г. № 1196: «Об утверждении государственных заданий, финансовое обеспечение которых осуществляется за счёт средств бюджета города Москвы государственным бюджетным (автономным) учреждениям подведомственным Департаменту здравоохранения города Москвы, на 2023 год и плановый период 2024 и 2025 годов» Департамента здравоохранения города Москвы.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли вклад в разработку концепции, проведение работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: Т.С. Нефедова, Ю.Ф. Шумская — концепция, сбор и обработка материала, анализ полученных данных, написание текста рукописи; П.В. Сенчихин, М.В. Юраж — сбор и обработка материала, написание текста рукописи; А.С. Панферов — концепция, редактирование текста рукописи; И.О. Щекотуров — редактирование текста рукописи, подготовка иллюстративного материала; А.Е. Грабарник, М.Г. Мнацаканян — окончательное редактирование и одобрение рукописи.
Информированное согласие на публикацию. Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале Digital Diagnostics.
Об авторах
Тамара Сергеевна Нефедова
Первый Московский государственный медицинский университет имени И.М. Сеченова
Email: prosto.toma.22@gmail.com
ORCID iD: 0000-0002-6718-8701
SPIN-код: 3097-4977
Россия, Москва
Юлия Федоровна Шумская
Научно-практический клинический центр диагностики и телемедицинских технологий
Автор, ответственный за переписку.
Email: yu.shumskaia@npcmr.ru
ORCID iD: 0000-0002-8521-4045
SPIN-код: 3164-5518
Россия, Москва
Марта Валерьевна Юраж
Первый Московский государственный медицинский университет имени И.М. Сеченова
Email: yurazh_m_v@staff.sechenov.ru
ORCID iD: 0000-0001-6759-6820
SPIN-код: 4872-7130
Россия, Москва
Александр Сергеевич Панферов
Первый Московский государственный медицинский университет имени И.М. Сеченова
Email: panferov_a_s@staff.sechenov.ru
ORCID iD: 0000-0002-4324-7615
SPIN-код: 5747-9842
канд. мед. наук, доцент
Россия, МоскваПавел Владимирович Сенчихин
Первый Московский государственный медицинский университет имени И.М. Сеченова; Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний
Email: paulus200271@mail.ru
ORCID iD: 0000-0003-0496-4504
SPIN-код: 8293-6144
канд. мед. наук
Россия, Москва; МоскваАлексей Ефимович Грабарник
Московский городской научно-практический центр борьбы с туберкулёзом
Email: a.grabarnik@mail.ru
ORCID iD: 0009-0009-4885-3321
SPIN-код: 5923-8630
канд. мед. наук
Россия, МоскваИгорь Олегович Щекотуров
Первый Московский государственный медицинский университет имени И.М. Сеченова
Email: samaramail@bk.ru
ORCID iD: 0000-0002-2167-8908
SPIN-код: 6885-6834
канд. мед. наук
Россия, МоскваМарина Генриковна Мнацаканян
Первый Московский государственный медицинский университет имени И.М. Сеченова
Email: mnatsakanyan08@mail.ru
ORCID iD: 0000-0001-9337-7453
SPIN-код: 2015-1822
д-р мед. наук, профессор
Россия, МоскваСписок литературы
- Hopewell P.C., Jasmer R.M. Overview of clinical tuberculosis. In: Tuberculosis and the tubercle bacillus. 2004. P. 13–31. doi: 10.1128/9781555817657.ch2
- Oge T., Ozalp S.S., Yalcin O.T., et al. Peritoneal tuberculosis mimicking ovarian cancer // European Journal of Obstetrics & Gynecology and Reproductive Biology. 2012. Vol. 162, N 1. С. 105–108. doi: 10.1016/j.ejogrb.2012.02.010
- Nissim O., Ervin F.R., Dorman S.E., Jandhyala D. A Case of Peritoneal Tuberculosis Mimicking Ovarian Cancer in a Young Female // Case Reports in Obstetrics and Gynecology. 2022. Vol. 2022. doi: 10.1155/2022/4687139
- Zhou X.X., Liu Y.-L., Zhai K., Shi H.-Z., Tonga Z.-H. Body fluid interferon-γ release assay for diagnosis of extrapulmonary tuberculosis in adults: a systematic review and meta-analysis // Scientific Reports. 2015. Vol. 5, N 1. P. 15284. doi: 10.1038/srep15284
- Barber M.S., Aronson J.K., von Schoen-Angerer T., и др. Рекомендации CARE для описания случаев: разъяснения и уточнения // Digital Diagnostics. 2022. Т. 3, № 1. C. 16–42. doi: 10.17816/DD105291
- Gudu W. Isolated ovarian tuberculosis in an Immuno-competent woman in the post partum period: case report // Journal of Ovarian Research. 2018. Vol. 11. P. 1–4. doi: 10.1186/s13048-018-0472-2
- Chen I.H., Torng P.-L., Lee C.-Y., et al. Diagnosis of peritoneal tuberculosis from primary peritoneal cancer // International Journal of Environmental Research and Public Health. 2021. Vol. 18, N 19. P. 10407. doi: 10.3390/ijerph181910407
- Maheshwari A., Gupta S., Rai S., et al. Clinical and laboratory characteristics of patients with peritoneal tuberculosis mimicking advanced ovarian cancer // South Asian Journal of Cancer. 2021. Vol. 10, N 2. P. 102–106. doi: 10.1055/s-0041-1736030
- Zhou R., Qiu X., Ying J., et al. Diagnostic performance of adenosine deaminase for abdominal tuberculosis: A systematic review and meta-analysis // Frontiers in Public Health. 2022. Vol. 10. P. 938544. doi: 10.3389/fpubh.2022.938544
- EL-Deeb M., Malwany H.E.L., Khalil Y., Mourad S., et al. Interferon Gamma Release Assays (IGRA) in the Diagnosis of Active Pulmonary Tuberculosis // Journal of High Institute of Public Health. 2014. Vol. 44, N 1. P. 33–40. doi: 10.21608/JHIPH.2014.20355
- Ramanan R.V., Venu V. Differentiation of peritoneal tuberculosis from peritoneal carcinomatosis by the Omental Rim sign. A new sign on contrast enhanced multidetector computed tomography // European Journal of Radiology. 2019. Vol. 113. P. 124–134. doi: 10.1016/j.ejrad.2019.02.019
- Kattan J., Haddad F.Gh., Menassa-Moussa L., et al. Peritoneal tuberculosis: A forsaken yet misleading diagnosis // Case Reports in Oncological Medicine. 2019. Vol. 2019. doi: 10.1155/2019/5357049
- Debi U., Ravisankar V., Prasad K.K., et al. Abdominal tuberculosis of the gastrointestinal tract: revisited // World Journal of Gastroenterology. 2014. Vol. 20, N 40. P. 14831. doi: 10.3748/wjg.v20.i40.14831
- Purbadi S., Indarti J., Winarto H., et al. Peritoneal tuberculosis mimicking advanced ovarian cancer case report: Laparoscopy as diagnostic modality // International Journal of Surgery Case Reports. 2021. Vol. 88. P. 106495. doi: 10.1016/j.ijscr.2021.106495
- Huang B., Cui D.J., Ren Y., et al. Comparison between laparoscopy and laboratory tests for the diagnosis of tuberculous peritonitis // Turkish journal of medical sciences. 2018. Vol. 48, N 4. P. 711–715. doi: 10.3906/sag-1512-147
Дополнительные файлы