磁共振成像在原发性脑外肿瘤鉴别诊断中的应 用:放射组学研究综述
- 作者: Kapishnikov A.V.1, Surovcev E.N.1,2
-
隶属关系:
- Samara State Medical University
- Dr. Sergey Berezin Medical Institute (MIBS)
- 期: 卷 4, 编号 4 (2023)
- 页面: 529-542
- 栏目: 系统评价
- ##submission.dateSubmitted##: 07.09.2023
- ##submission.dateAccepted##: 19.10.2023
- ##submission.datePublished##: 15.12.2023
- URL: https://jdigitaldiagnostics.com/DD/article/view/569149
- DOI: https://doi.org/10.17816/DD569149
- ID: 569149
如何引用文章
详细
论证。磁共振成像数据分析是术前原发性脑外肿瘤鉴别诊断的主要方法。然而,仅凭对这些数据的目测评估很难准确区分不同的原发性脑外肿瘤。
放射组学是一种分析医学影像数据的定量方法。其允许确定成像数据与肿瘤表型和基因型特征之间的关系。
此前,一些分析性出版物总结了根据放射组学原理对原发性脑外肿瘤进行鉴别诊断的研究结果。随着新临床病例的迅速积累和相关研究的不断增加,有必要对其进行进一步分析和系统化。这就是本研究的基础。
该研究的目的是系统整理有关放射组学在原发性脑外肿瘤鉴别诊断方面潜力的现有数据。
材料与方法。我们搜索并分析了过去五年中用俄语和英语发表的出版物。搜索是在PubMed/Medline、Google Scholar和eLibrary数据库中进行。最终分析包括19篇关于原发性脑外肿瘤鉴别诊断的出版物。这些出版物包括用于肿瘤鉴别诊断的放射组学特征。
结果。所有研究都表明了,放射组学参数(纹理的和直方图的)与肿瘤类型之间存在相关性。通过放射组学模型对肿瘤进行鉴别诊断的效率优于放射科医生对肿瘤进行分类的效率。
为了创建肿瘤分类的模型,我们最常使用了以下算法:支持向量法、逻辑回归法和随机森林法。支持向量法和逻辑回归法显示出更好、更稳定的结果。
结论。放射组学概念在原发性脑外肿瘤鉴别诊断中的应用显示出良好效果。这一方向的进一步发展需要分割方法和特征集的标准化,以及有效的数学建模方法。
全文:
论证
原发性脑外肿瘤的术前鉴别诊断基于磁共振成像(MRI)符号学分析,最常见的包括一套标准的加权成像(weighted images,WI):T2加权成 像(T2WI)、T1加权成像(T1WI)、FLAIR、弥散加权成像(DWI)和增强后T1加权成像(T1-CE)[1–3]。
原发性脑外肿瘤是一种异质性肿瘤,包括脑 膜(脑膜瘤和间质瘤)和颅神经(神经瘤)的良性和恶性肿瘤[4]。
已对原发性脑外肿瘤的磁共振成像符号学进行了详细研究,并在常规指南中进行了描述;然而,非典型 磁共振成像模式的存在会导致仅凭目测很难对肿瘤进行鉴别诊断[5,6]。判断肿瘤类型的错误会导致患者治疗策略的错误选择[1,2,7,8]。在区分不同恶性程度的脑膜瘤、区分孤立性纤维瘤和脑膜瘤以及定位小脑桥小脑角原发性脑外肿瘤时最常遇到困难[9–12]。
分析医学影像的定量方法目前最常用“影像组学”一词来描述。影像组学旨在揭示诊断图像的数字特征与肿瘤的表型和基因型特征之间的关系[13]。
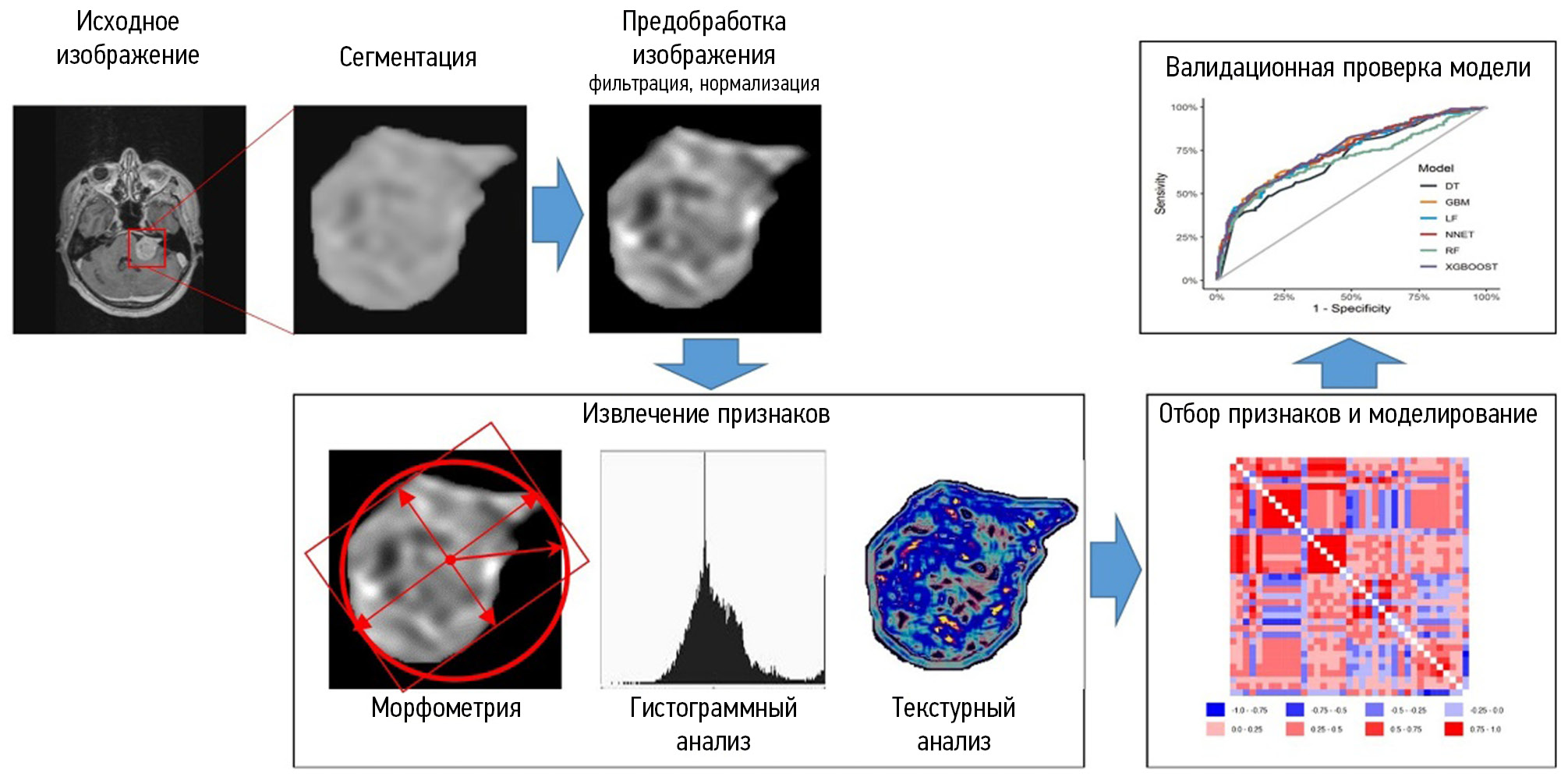
影像组学的基础是从图像中提取定量特征,以客观描述成像表型,并发现影像组学特征与肿瘤的遗传、分子和临床特征之间的关 系[14]。对分割的感兴趣区进行形态、直方图和纹理分析,以从图像中提取定量参数。直方图和纹理特征显示在视觉评估中无法识别的结构特 征[15]。影像组学研究的一个特点是使用各种数学建模和深度学习方法。在其帮助下获得的鉴别诊断和预后模型应在独立样本上进行验证测试。影像组学有可能成为一种强大的临床决策支持工具[16]。图1总结了影像组学分析的各个阶段。
图1。影像组学分析的各个阶段。
在此之前,一些分析性出版物总结了根据影像组学原理对原发性脑外肿瘤进行鉴别诊断的研究成果[13,17]。随着新临床案例的迅速积累和相关研究的不断增加,有必要对其进行进一步分析和系统化,这也是本综述的基础。
材料和方法
根据PRISMA标准(Preferred Reporting Items for Systematic Review and Meta-Analysis Protocols,2009年)对过去五年的研究进行了系统性综述。
研究材料来自Pubmed/Medline、Google Scholar和eLibrary书目数据库中最近五年的科学出版物。关键词:MRI、meningioma、neuroma、schwannoma、 solitary fibrous tumor、 radiomic、 texture、 МРТ(磁共振成像)、менингиома(脑膜瘤)、 невринома(神经瘤)、шваннома(神经鞘瘤)、солитарная фиброзная опухоль(孤立性纤维瘤)、радиомика(影 像组学)、текстура(纹理)。
通过分析所选文章的摘要,我们排除了未涉及原发性脑外肿瘤鉴别诊断的出版物。在对文献(包括研究的设计、目的、方法和结果)进行分析后,我们排除了未介绍用于肿瘤鉴别诊断的影像组学特征的论文。
因此,有19篇文献被纳入了本次综述。研究设计如图2所示。
图2。研究设计。
估计参数
在系统性综述中,根据以下参数对所选出版物进行了评估:
- 诊断问题;
- 患者人数;
- 肿瘤分割方法;
- 加权成像类型;
- 信息性鉴别诊断特征;
- 应用的数学建模方法;
- 数学分类模型的验证测试。
综述包括原始临床研究数据。
结果
一系列研究都对磁共振成像图像的影像组学特征在原发性脑外肿瘤鉴别诊断方面的有效性进行了研究。过去五年中,在Pubmed/Medline和Google Scholar书目数据库中搜 索“(meningioma or neuroma or schwannoma or solitary fibrous tumor)+(texture or radiomic)+MRI”,共找到121篇文献资料。通 过“МРТ、менингиома、невринома、шваннома、солитарная фиброзная опухоль、радиомика、текстура”(“磁 共振成像、脑膜瘤、神经瘤、神经鞘瘤、孤立性纤维瘤、影像组学、纹理”)等词的不同组合进行查询,在eLibrary数据库中仅找到一篇出版物。经过分析,19项英文和俄文研究被纳入综述。
表1列出了根据研究设计所选出版物的特点。
表1。使用放射组学分析在原发性脑外肿瘤鉴别诊断方面的诊断问题
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
作者 | 肿瘤类型 | 患者人数 | 分割 | 信息量最大的特征 | 建模方法 | 验证 (数量;%) | 诊断信息量 |
不同恶性程度脑膜瘤的鉴别诊断 | |||||||
Y.W.Park等人,2019年[18] | 良性脑膜瘤(Gr 1)/恶性脑膜瘤(Gr 2/3) | 136 | 半自动 | T1-CE(Histo,GLCM,GLRLM) ADC(Histo,GLCM,GLRLM) | RF,SVM | 58;42.6% | 最佳模型(SVM):AUC 0.86; Acc 89.7%;Sn 75%:Sp 93.5% 其他模型:AUC 0.74–0.85 |
K.R.Laukamp等人,2019年[19] | 良性脑膜瘤(Gr 1)/恶性脑膜瘤(Gr 2/3) | 71 | 半自动 | 形状 FLAIR(GLCM) ADC(GLSZM) | LR | 未进行 | 加权型模型:AUC 0.72–0.8 加权组合模型:AUC 0.91;Sn 79%; Sp 89% |
Y.Lu等人,2019年[20] | 脑膜瘤 Gr 1/2/3 | 152 | 手动 | ADC(Histo,GLCM,GLRLM, AU,Wav) | DT | 46;30.2% | 影像组学模型:Acc 79.51% 模型(符号学+临床数据): Acc 62.96 放射科医生分类:Acc 61%–62% |
C.Chen等人,2019年[21] | 脑膜瘤 Gr 1/2/3 | 150 | 手动 | 形状 T1-CE(GLCM,GLRLM,GLSZM) | LDA,SVM | 30;20% | 最佳模型(LDA):Acc 75.6% 其他模型:57.6%–73.3% |
Y.Zhu等人,2019年[22] | 良性脑膜瘤(Gr 1)/恶性脑膜瘤(Gr 2/3) | 181 | 手动 | 形状 T1-CE(GLCM,GLRLM,GLSZM) | SVM | 82;45.3% | 最佳模型:AUC 0.811; Sn 76.9%; Sp 89.8% |
O.Morin等人,2019年[23] | 良性脑膜瘤(Gr 1)/恶性脑膜瘤(Gr 2/3) | 303 | 无数据 | 形状 T1-CE(Histo,Wav GLCM,GLRLM,GLSZM) | RF | 85;28.1% | 符号学模型:AUC 0.68;Acc 62% 影像组学模型:AUC 0.71;Acc 65% |
X.Li等人,2019年[24] | 良性脑膜瘤(Gr 1)/恶性脑膜瘤(Gr 2/3) | 90 | 手动 | 形状 T2WI,T1WI和T1-CE(Histo) | LR | 28;31.1% | 单个加权类型模型:AUC 0.781–0.821 |
C.Ke等人,2020年[25] | 良性脑膜瘤(Gr 1)/恶性脑膜瘤(Gr 2/3) | 263 | 手动 | T2WI(GLCM,GLRLM,GLSZM) T1WI(GLCM) T1-CE(GLRLM,GLSZM) | SVM | 79;30% | 单一加权类型模型:AUC 0.67–0.75;Acc 68%–75%; Sn 42%–74%;Sp 67%–82% 加权组合模型:AUC 0.83; Acc 80%;Sn 84%;Sp 78% |
J.Hu等人,2020年[26] | 良性脑膜瘤(Gr 1)/恶性脑膜瘤(Gr 2/3) | 316 | 半自动 | 形状 T2WI和T1WI(Wav) T1-CE(Histo,LSZM,Wav) ADC(Histo,GLCM,Wav) SWI(GLCM,Wav) | RF | 未进行 | 模型(符号学+临床数据):AUC 0.7 模型(T2WI+T1WI+T1-CE):AUC 0.78; Acc 74%;Sn 65.5%;Sp 77.7% 模型(T2WI+T1WI+T1-CE+ADC+SWI):AUC 0.81;Acc 78%;Sn 66.7%;Sp 83% |
续表1
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
H.Chu等人,2021年[27] | 良性脑膜瘤(Gr 1)/恶性脑膜瘤(Gr 2/3) | 98 | 半自动 | 形状 T1-CE(Histo, GLCM,GLRLM,GLSZM) | LR | 30;30.6% | 影像组学模型:AUC 0.948; Acc 92.9%;Sn 91.7%;Sp 100% |
Y.Han等人,2021年[28] | 良性脑膜瘤(Gr 1)/恶性脑膜瘤(Gr 2/3) | 131 | 无数据 | 形状 Т1 FLAIR(Histo, GLRLM,GLSZM) | LR,RF, SVM,KNN, DT,XGB | 27;20.6% | T1 FLAIR模型:AUC 0.956;Sn 87%; Sp 92% 加权组合模型:AUC 0.922;Sn 87%; Sp 93% |
J.Zhang等人,2022年[29] | 脑膜瘤 Gr 1/2 | 242 | 手动 | T2WI(GLRLM,Wav) T1-CE(GLSZM,Wav) | LR | 73;30.2% | 单一加权类型模型:AUC 0.67–0.717;Acc 61.1%–69.4%;Sn 60.7%–75%;Sp 61.4%–65.9% 加权组合模型:AUC 0.734;Acc 72.2%;Sn 67.9%;Sp 75% |
脑膜瘤和孤立性纤维瘤的鉴别诊断 | |||||||
X.Li等人,2019年[30] | 良性脑膜瘤(Gr 1)/孤立性纤维瘤 | 67 | 手动 | FLAIR,DWI和T1-CE(GLRLM) | SVM | 20;29.9% | T1-CE模型:AUC 0.90;Acc 87.% 放射科医生分类:AUC至0.7;Acc至77.3% |
J.Dong等人,2020年[31] | 良性脑膜瘤(Gr 1)/孤立性纤维瘤 | 192 | 手动 | T2WI(GLCM,GLRLM,GLSZM) T1WI(Histo,GLCM,GLSZM) T1-CE(Histo,GLCM,GLRLM) | LR | 59;30.7% | 单一加权类型模型:AUC 0.772–0.864; Acc 69.5%–81.4%;Sn 60%–73.3%;Sp 79.3%–89.7% 加权组合模型:AUC 0.939; Acc 83.1%;Sn 90%;Sp 75.9% |
Y.Fan等人,2022年[32] | 良性脑膜瘤(Gr 1)/孤立性纤维瘤 | 220 | 无数据 | 符号学 T2WI(Histo,GLCM,GLRLM) T1-CE(GLRLM) | SVM,LR | 73;33.2% | 单一加权类型模型:AUC 0.75–0.85; Acc 69.9%–72.6%;Sn 68.5%–98%; Sp 13.6%–87.5% 加权组合模型:AUC 0.9;Acc 82.2%;Sn 79.6%;Sp 87.5% 模型(临床数据+符号学):AUC 0.79; Acc 76.7%;Sn 79.6%;Sp 70.8% |
J.Wei等人,2022年[33] | 脑膜瘤 Gr 1–3/孤立性纤维瘤 | 292 | 手动 | T2WI(Histo,GLCM,GLRLM,GLSZM,NGTDM,Wav) T1WI(GLCM,Wav,GLRLM)T1-CE(GLCM,Wav,GLSZM) | LR,DT, RF,SVM | 88;30.1% | 模型(临床数据+符号学):AUC 0.766;Acc 65.9%;Sn 67.4%;Sp 64.3% 单一加权类型模型:AUC 0.731–0.818;Acc 64.8%–71.6%;Sn 63%–89.1%;Sp 52.4%–66.7% 加权组合模型:AUC 0.902; Acc 81.8%;Sn 89.1%;Sp 73.8% |
脑膜瘤和其他原发性脑外肿瘤的鉴别诊断 | |||||||
Z.Tian等人,2020年[34] | 脑膜瘤/颅咽管瘤 | 127 | 手动 | 符号学 T2WI(Histo) T1-CE(Histo,GLCM) | LR | 未进行 | T1-CE的AUC模型:0.776 |
C.Wang等人,2022年[35] | 脑膜瘤/血管瘤 | 96 | 手动 | 形状 T2WI,T1-CE和ADC(Histo, Wav) T1WI(Histo,GLSZM,GLRLM, Wav) DWI(GLCM,Wav) | KNN,LR, RF,SVM, XGB,DT | 19;20% | 放射科医生分类:AUC 0.545–0.756 符号学模型:AUC 0.805 最佳模型(ADC,SVM):AUC 0.95 其他影像组学模型:AUC 0.73–0.94 |
E.N.Surovtsev等人,2023年[36] | 良性脑膜 瘤(Gr 1)/恶性脑膜瘤(Gr 2/3)/神经瘤 | 66 | 自动 | T2WI(GLCM,GLRLM,Wav) T1WI(GLCM,Wav) FLAIR(Wav) ADC(GLCM,GLRLM) T1-CE(Histo) | LDA | 27;40.9% | 符号学模型:AUC 0.78;Sn 50%–83.3%;Sp 75%–81% 影像组学模型:AUC 0.86;Sn 83.3%–100%;Sp 91.7%–100% |
注。表中采用的缩略语:
肿瘤:Gr——Grade。
特征:ADC——测量扩散系数图;SWI——磁敏感加权成像(susceptibility weighted imaging);Histo——直方图;GLCM——灰度共生矩阵(Gray Level Co–Occurrence Matrix);GLRLM——灰度级运行长度矩阵(Gray Level Run Length Matrix);GLSZM——灰度大小区域矩阵(Gray Level Size Zone Matrix);NGTDM——邻域灰度差矩 阵(Neighbouring Gray–Tone Difference Matrix);AU——自回归模型(Autoregressive Model);Wav——小波(Wavelet)。
数学建模方法:LR——逻辑回归;NB——朴素贝叶斯分类器;SVM——支持向量机;KNN——K-近邻法;DT——决策树;RF——随机森林;LDA——线性判别分析;XGB——极限梯度提升;MLP——多层感知器。
测试信息量参数:Acc——准确度;Sn——灵敏度;Sp——特异度;AUC——ROC曲线下面积(Area Under Curve)。
讨论
鉴别诊断问题
良性和恶性脑膜瘤的鉴别诊断在研究数量上占主导地位(12项研究)。脑膜瘤和孤立性纤维瘤的鉴别诊断是四项研究的任务。脑膜瘤和血管瘤/颅咽管瘤/神经瘤的鉴别诊断各有一项研究。
已进行的大多数研究都涉及两种原发性脑外肿瘤类型之间的“二元”分类[18,19,22–32,34,35]。鉴于所有原发性脑外肿瘤的符号学都很相似,能够在两种预先约定的肿瘤类型之间进行多类而不是二元分类的模型具有临床应用的优势。然而,只有四项研究对三种或三种以上原发性脑外肿瘤类型进行了鉴别诊断[20,21,33,36]。
目测评估与基于磁共振成像符号学特征或影像组学参数的模型的肿瘤分类性能比较
在两项研究[20,30]中对放射科医生和影像组学模型对肿瘤分类的有效性进行了比较。在这些研究中,肿瘤类型是根据放射科医生对磁共振成像图像的判断确定的,而不是根据成像特征建立数学模型。在这些情况下,影像组学模型的优势令人信服:其准确率高出10%–17%。
五项研究[20,23,32,33,36]比较了基于磁共振成像符号学特征和影像组学参数的模型对肿瘤分类的正确性。这些研究中的视觉符号学特征都是系统化和分层的,因此可以根据这些特征建立数学模型。
在我们看来,用符号学数学模型进行肿瘤分类比放射科医生更有优势,这是因为放射科医生在鉴别诊断时主要受经验和主观判断的指导。同时,磁共振成像符号学的特征评估系统化、统一化,增强了其信息量。
基于影像组学参数的肿瘤鉴别模型明显优于放射科医生的肿瘤分类,其信息量也高于符号学模型。
应该指出的是,将影像组学模型的信息量与磁共振成像符号学的视觉评估结果进行比较的研究成果具有最大的价值。同时,影像组学方法毋庸置疑的优势仍然是可以为计算机决策支持系统自动分析图像。
患者样本量和模型验证测试
大多数研究的受检患者人数相对较少:
- 少于100名患者:6篇文献[19,24,27,30,35,36];
- 100–200名患者:7篇文献[18,20–22,28,31,34];
- 200–300名患者:4篇文献[25,29,32,33];
- 超过300名患者:2篇文献[23,26]。
样本量最大是脑膜瘤鉴别诊断研究的典型特征。我们认为,样本量小的原因是不同原发性脑外肿瘤类型的发病率不均衡。其中大部分(超过80%)是良性脑膜瘤,而其他肿瘤则很少见[4],导致难以选择大量患者。
在84.2%的研究中进行了验证测试。大多数研究中的验证组约为患者总数的三分之一。值得注意的是,缺乏对验证样本的模型性能验证测试会降低鉴别诊断模型的临床意义。
肿瘤分割
肿瘤分割是影像组学分析的第一步,也是最基本的一步[14]。分割技术需要准确地将肿瘤组织与脑物质和外周水肿区分开来,以避免影像组学特征失真,并确保结果的可重复性。
大多数原发性脑外肿瘤的特征是增强后T1加权成像的磁共振成像信号强度明显增加,而邻近结构的磁共振成像信号保持等强度和低强度[9]。这一特征决定增强后的肿瘤与邻近结构之间存在明显的亮度差异,并肿瘤边缘成像的准确度。在被纳入综述的大多数研究中(63.2%),分割是在增强后T1加权成像上进行的[18,21–28,30,33,36]。
分割方法也会影响最终的建模结果。需要注意的是,与手动方法相比,自动和半自动方法提供更高的肿瘤边界检测的可重复性[37]。在已提交的研究中,最常采用的是不太受欢迎的手动分割 法[18–20,22,23,27-29,31–33]。只有五项研究使用了自动和半自动方法[18,19,26,27,36]。
影像组学信息性特征
影像组学研究的特点是有足够多的初始参数集,从中选择最有信息的参数来解决提出的问题。对原发性脑外肿瘤进行鉴别诊断最有参考价值的影像组学特征是肿瘤的直方图和纹理参数。
使用不同类型的加权成像扩大影像组学参数集,可提高影像组学模型在原发性脑外肿瘤鉴别诊断中的能力。七项研究[19,25,28,29,31–33]将基于一种加权成像类型的影像组学参数的模型与包含不同加权成像类型特征的模型进行了比较。在其中六项研究[19,25,29,31–33]中,对测试信息量的比较显示了后者的优势。只有一项研究(Y.Han等人[28])中,加权组合模型并不总是显示出更好的结果。
在比较J.Hu等人[26]研究中的两种组合模型时,包含扩展加权谱(T2加权成像、T1加权成像、增强后T1加权成像、测量扩散系数图(ADC)、磁敏感加权成 像(SWI))的模型略优于基于T2加权成像、T1加权成像、增强后T1加权成像的模型。
基于多种类型加权的模型的优势在于它们能反映肿瘤的不同方面。例如,T2加权成像和T1加权成像显示肿瘤的水化程度(液体量),增强后T1加权成像显示血脑屏障通透性,测量扩散系数图显示肿瘤的细胞性,磁敏感加权成像对出血和石化敏感。因此,将参数整合到模型中可以更全面地反映形态特征,从而获得更好的结果。
形状参数值有限,十项研究对这些参数的信息量进行了评估[21–23,26–28,31–33,35]。在以单一类加权成像为基础建模的研究中,形状参数被选为信息性参数[21–23,27,28,35]。有三项研究[31–33]表明了,在建立包括多种类型加权成像的模型时,形状参数没有参考价值。在J.Hu等人的研究[26]中,形状参数具有信息量并被纳入建模,但与直方图和纹理参数相比,其占有率并不高(模型包括17个直方图和纹理参数以及3个形态测量参数)。
数学建模方法
在介绍的文献中,使用了多种数学建模方法来建立模型。最常用的算法有:
- 支持向量机(SVM):9项研究[18,21,22,25, 28,30,32,33,35];
- 逻辑回归(LR):10项研究 [19,24,27-29,31–35];
- 随机森林(RF):6项研究[18,23,26,28,28, 33,35]。
三项研究[18,28,33]分析了基于这些方法的模型进行肿瘤分类的结果,结果相互矛盾。在Y.W.Park等人[18](随机森林和支持向量机算法)和J.Wei等人[33](逻辑回归、随机森林、支持向量机算法)的研究中,各种方法的信息量相当。然而,在Y.Han等人的研究[28]中,根据建模方法的不同,结果差异很大(测试的信息性参数之一,曲线下面积(Area Under Curve,AUC)从0.628到0.922不等),而支持向量机的结果更为稳定。
在所有建模方法中,逻辑回归[27]和支持向量 机[35]显示了最佳的信息性参数,其曲线下面积为0.95。
结论
影像组学概念的应用在原发性脑外肿瘤的鉴别诊断中显示出良好的效果。与此同时,在临床实践中实施影像组学研究需要更严格的方法:强制验证测试、分割方法标准化、必要特征集的确定以及数学建模方法的更合理选择。使用几种加权成像的直方图和纹理参数似乎有望进一步释放影像组学在鉴别识别原发性脑外肿瘤方面的潜力。
使用自动分割方法和扩大的加权成像类型集进行的前瞻性设计研究的结果,以及可提供原发性脑外肿瘤多类鉴别诊断的影像组学模型的建立,可以为创建强大的数字临床决策支持系统工具奠定基础,除其他外,该系统可提供最佳患者治疗策略的选择。
ADDITIONAL INFORMATION
Funding source. This study was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. The major contributions were distributed as follows: А.V. Kapishnikov — the concept of the study, approval of the final version; E.N. Surovcev — concept and design of the work, manuscript text writing and editing, collection and processing of materials, data analysis.
作者简介
Aleksandr V. Kapishnikov
Samara State Medical University
Email: a.v.kapishnikov@samsmu.ru
ORCID iD: 0000-0002-6858-372X
SPIN 代码: 6213-7455
Scopus 作者 ID: 6507900025
MD, Dr. Sci. (Med.), Professor
俄罗斯联邦, SamaraEvgeniy N. Surovcev
Samara State Medical University; Dr. Sergey Berezin Medical Institute (MIBS)
编辑信件的主要联系方式.
Email: evgeniisurovcev@mail.ru
ORCID iD: 0000-0002-8236-833X
SPIN 代码: 5252-5661
Scopus 作者 ID: 57224906215
俄罗斯联邦, Samara; Togliatti
参考
- Goldbrunner R, Stavrinou P, Jenkinson MD, et al. EANO guideline on the diagnosis and management of meningiomas. Neuro–Oncology. 2021;23(11):1821–1834. doi: 10.1093/neuonc/noab150
- Goldbrunner R, Weller M, Regis J, et al. EANO guideline on the diagnosis and treatment of vestibular schwannoma. Neuro–Oncology. 2020;22(1):31–45. doi: 10.1093/neuonc/noz153
- Shin DW, Kim JH, Chong S, et al. Intracranial solitary fibrous tumor/hemangiopericytoma: tumor reclassification and assessment of treatment outcome via the 2016 WHO classification. Journal of Neuro–Oncology. 2021;154:171–178. doi: 10.1007/s11060–021–03733–7
- Louis DN, Perry A, Wesseling P, et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro–Oncology. 2021;23(8):1231–1251. doi: 10.1093/neuonc/noab106
- Fountain DM, Young AMH, Santarius T. Malignant meningiomas. Handbook of Clinical Neurology. 2020;170:245–250. doi: 10.1016/B978–0–12–822198–3.00044–6
- Laviv Y, Thomas A, Kasper EM. Hypervascular Lesions of the Cerebellopontine Angle: The Relevance of Angiography as a Diagnostic and Therapeutic Tool and the Role of Stereotactic Radiosurgery in Management. A Comprehensive Review. World Neurosurgery. 2017;100:100–117. doi: 10.1016/j.wneu.2016.12.091
- Konar S, Jayan M, Shukla D, et al. The risks factor of recurrence after skull base hemangiopericytoma management: A retrospective case series and review of literature. Clinical Neurology and Neurosurgery. 2021;208:106866. doi: 10.1016/j.clineuro.2021.106866
- Kinslow CJ, Bruce SS, Rae AI, et al. Solitary–fibrous tumor/ hemangiopericytoma of the central nervous system: a population–based study. Journal of Neuro–Oncology. 2018;138(1):173–182. doi: 10.1007/s11060–018–2787–7
- Osborn AG, Salzman KL, Jhaveri MD. Diagnostic Imaging. Brain. Moscow: Izdatel’stvo Panfilova; 2018. (In Russ).
- Cohen–Inbar O. Nervous System Hemangiopericytoma. Canadian Journal of Neurological Sciences. 2020;47(1):18–29. doi: 10.1017/cjn.2019.311
- Zakhari N, Torres C, Castillo M, et al. Uncommon Cranial Meningioma: Key Imaging Features on Conventional and Advanced Imaging. Clinical Neuroradiology. 2017;27(2):135–144. doi: 10.1007/s00062–017–0583–y
- Hale AT, Wang L, Strother MK, et al. Differentiating meningioma grade by imaging features on magnetic resonance imaging. Journal of Clinical Neuroscience. 2018;48:71–75. doi: 10.1016/j.jocn.2017.11.013
- Ugga L, Spadarella G, Pinto L, et al. Meningioma Radiomics: At the Nexus of Imaging, Pathology and Biomolecular Characterization. Cancers (Basel). 2022;14(11):2605. doi: 10.3390/cancers14112605
- Aerts HJ. The Potential of Radiomic-Based Phenotyping in Precision Medicine: A Review. JAMA Oncology. 2016;2(12):1636–1642. doi: 10.1001/jamaoncol.2016.2631
- Gillies RJ, Kinahan PE, Hricak H. Radiomics: Images Are More than Pictures, They Are Data. Radiology. 2016;278(2):563–577. doi: 10.1148/radiol.2015151169
- Liu Z, Wang S, Dong D, et al. The Applications of Radiomics in Precision Diagnosis and Treatment of Oncology: Opportunities and Challenges. Theranostics. 2019;9(5):1303–1322. doi: 10.7150/thno.30309
- Kapishnikov AV, Surovcev EN, Udalov YuD. Magnetic Resonance Imaging of Primary Extra-Axial Intracranial Tumors: Diagnostic Problems and Prospects of Radiomics. Medical Radiology and Radiation Safety. 2022;67(4):49–56. (In Russ). doi: 10.33266/1024–6177–2022–67–4–49–56
- Park YW, Oh J, You SC, et al. Radiomics and machine learning may accurately predict the grade and histological subtype in meningiomas using conventional and diffusion tensor imaging. European Radiology. 2019;29(8):4068–4076. doi: 10.1007/s00330–018–5830–3
- Laukamp KR, Shakirin G, Baeßler B, et al. Accuracy of Radiomics–Based Feature Analysis on Multiparametric Magnetic Resonance Images for Noninvasive Meningioma Grading. World Neurosurgery. 2019;132:e366–e390. doi: 10.1016/j.wneu.2019.08.148.
- Lu Y, Liu L, Luan S, et al. The diagnostic value of texture analysis in predicting WHO grades of meningiomas based on ADC maps: an attempt using decision tree and decision forest. European Radiology. 2019;29(3):1318–1328. doi: 10.1007/s00330–018–5632–7
- Chen C, Guo X, Wang J, et al. The Diagnostic Value of Radiomics–Based Machine Learning in Predicting the Grade of Meningiomas Using Conventional Magnetic Resonance Imaging: A Preliminary Study. Frontiers in Oncology. 2019;9:1338. doi: 10.3389/fonc.2019.01338
- Zhu Y, Man C, Gong L, et al. A deep learning radiomics model for preoperative grading in meningioma. European Journal of Radiology. 2019;116:128–134. doi: 10.1016/j.ejrad.2019.04.022
- Morin O, Chen WC, Nassiri F, et al, Vasudevan HN, et al. Integrated models incorporating radiologic and radiomic features predict meningioma grade, local failure, and overall survival. Neuro–Oncology Advances. 2019;1(1):z11. doi: 10.1093/noajnl/vdz011
- Li X, Miao Y, Han L, et al. Meningioma grading using conventional MRI histogram analysis based on 3D tumor measurement. European Journal of Radiology. 2019;110:45–53. doi: 10.1016/j.ejrad.2018.11.016
- Ke C, Chen H, Lv X, et al. Differentiation Between Benign and Nonbenign Meningiomas by Using Texture Analysis From Multiparametric MRI. Journal of Magnetic Resonance Imaging. 2020;51(6):1810–1820. doi: 10.1002/jmri.26976
- Hu J, Zhao Y, Li M, et al. Machine learning–based radiomics analysis in predicting the meningioma grade using multiparametric MRI. European Journal of Radiology. 2020;131. doi: 10.1016/j.ejrad.2020.109251
- Chu H, Lin X, He J, et al. Value of MRI Radiomics Based on Enhanced T1WI Images in Prediction of Meningiomas Grade. Academic Radiology. 2021;28(5):687–693. doi: 10.1016/j.acra.2020.03.034
- Han Y, Wang T, Wu P, et al. Meningiomas: Preoperative predictive histopathological grading based on radiomics of MRI. Magnetic Resonance Imaging. 2021;77:36–43. doi: 10.1016/j.mri.2020.11.009
- Zhang J, Zhang G, Cao Y, et al. A Magnetic Resonance Imaging–Based Radiomic Model for the Noninvasive Preoperative Differentiation Between Transitional and Atypical Meningiomas. Frontiers in Oncology. 2022;12:811767. doi: 10.3389/fonc.2022.811767
- Li X, Lu Y, Xiong J, et al. Presurgical differentiation between malignant haemangiopericytoma and angiomatous meningioma by a radiomics approach based on texture analysis. Journal of Neuroradiology. 2019;46(5):281–287. doi: 10.1016/j.neurad.2019.05.013
- Dong J, Yu M, Miao Y, et al. Differential Diagnosis of Solitary Fibrous Tumor/Hemangiopericytoma and Angiomatous Meningioma Using Three–Dimensional Magnetic Resonance Imaging Texture Feature Model. BioMed Research International. 2020;2020. doi: 10.1155/2020/5042356
- Fan Y, Liu P, Li Y, et al. Non–Invasive Preoperative Imaging Differential Diagnosis of Intracranial Hemangiopericytoma and Angiomatous Meningioma: A Novel Developed and Validated Multiparametric MRI–Based Clini–Radiomic Model. Frontiers in Oncology. 2022;11:792521. doi: 10.3389/fonc.2021.792521
- Wei J, Li L, Han Y, et al. Accurate Preoperative Distinction of Intracranial Hemangiopericytoma From Meningioma Using a Multihabitat and Multisequence–Based Radiomics Diagnostic Technique. Frontiers in Oncology. 2020;10:534. doi: 10.3389/fonc.2020.00534
- Tian Z, Chen C, Zhang Y, et al. Radiomic Analysis of Craniopharyngioma and Meningioma in the Sellar/Parasellar Area with MR Images Features and Texture Features: A Feasible Study. Contrast Media & Molecular Imaging. 2020;2020. doi: 10.1155/2020/4837156
- Wang C, You L, Zhang X, et al. A radiomics–based study for differentiating parasellar cavernous hemangiomas from meningiomas. Scientific Reports. 2022;12. doi: 10.1038/s41598–022–19770–9
- Surovcev EN, Kapishnikov AV, Kolsanov AV. Comparative evaluation of the possibilities of radiomic analysis of magnetic resonance imaging in the differential diagnostics of primary extra-axial intracranial tumors. Research and Practical Medicine Journal. 2023;10(2):50–61. (In Russ). doi: 10.17709/2410-1893-2023-10-2-5
- Parmar C, Rios Velazquez E, Leijenaar R, et al. Robust Radiomics feature quantification using semiautomatic volumetric segmentation. PLoS One. 2014;9(7):e102107. doi: 10.1371/journal.pone.0102107
补充文件