磁共振成像诊断宫颈内膜腺癌的可能性和局限性
- 作者: Antonova I.B.1, Aksenova S.P.1, Nudnov N.V.1,2,3, Kriger A.V.1
-
隶属关系:
- Russian Scientific Center of Roentgenoradiology
- Peoples’ Friendship University of Russia
- Russian Medical Academy of Continuous Professional Education
- 期: 卷 5, 编号 2 (2024)
- 页面: 149-166
- 栏目: 原创性科研成果
- ##submission.dateSubmitted##: 19.09.2023
- ##submission.dateAccepted##: 04.12.2023
- ##submission.datePublished##: 20.09.2024
- URL: https://jdigitaldiagnostics.com/DD/article/view/585195
- DOI: https://doi.org/10.17816/DD585195
- ID: 585195
如何引用文章
详细
论证。近几十年来,宫颈腺癌的发病率从 5% 上升到 20%。已证实宫颈内膜腺癌的特点是病程较长,转移较早。由于宫颈腺癌细胞学诊断的困难,放射诊断在诊断和分期阶段发挥着关键作用。迄今为止,关于磁共振成像在宫颈腺癌诊断中的应用的研究还很少。
目的是确定磁共振成像在根据 T 标准对宫颈腺癌进行分期时的诊断信息量,以及在评估肿瘤侵入宫颈基质的深度时的诊断信息量,明确腺癌的符号标志和肿瘤在子宫内生长的特殊性。
材料和方法。2020 年至 2023 年间,123 名确诊为宫颈癌(C53)的患者接受了检查。我们详细分析了 22 名(18%)宫颈腺癌患者(平均年龄 56 岁)使用 1.5 特斯拉磁场强度断层扫描仪接受盆腔器官磁共振成像的结果。对 11/22 例(50%)患者的磁共振成像信息分析进行了评估,这些患者接受了第一阶段手术治疗,切除了子宫和附件。为了分析诊断的信息量,对磁共振成像数据和手术材料的病理形态学检查数据进行了比较。研究结果的统计处理使用 Microsoft Excel 和 JavaStat 软件应用程序进行。
结果。磁共振成像在评估宫颈内膜腺癌局部患病率方面的信息量(根据 T 标准)为(以下主要值后的括号中给出了 95% 的置信区间):灵敏度为 77.78%(39.99%-97.19%);特异性为 50.00%(1.26%-98.74%);阳性结果预测值为 87.50%(62.64%-96.69%);阴性结果预测值为 33.33%(7.30%-76.04%);准确度为 72.73%(39.03%-93.98%)。磁共振成像在评估肿瘤侵入宫颈基质深度方面的信息量为:机会比率为 3.500(0.145-84.694);灵敏度为 85.7%(0.757-0.993),特异性为 33.3%(0.018-0.0648),阳性结果预测值为 75%(0.673-0.883),阴性结果预测值为 50%(0.027-0.972)。
结论。本研究表明了,磁共振成像是检测宫颈内膜腺癌的良好工具,具有很高的诊断信息量。在磁共振成像数据分析过程中发现的宫颈腺癌肿瘤生长宏观结构的 4 种类型表明,肿瘤生长具有局部侵袭性,向子宫内膜脱落的频率较高。这样就能为放射科医生提供描述性的图片结构,在宫颈腺癌得到证实的情况下也是如此,从而为患者制定更好的治疗方案。
全文:
论证
尽管广泛采用了预防措施和细胞学筛查,并积极治疗癌前病变,但宫颈癌(CC)的发病率仍然居高不下。据世界卫生组织统计,宫颈癌在全球女性恶性肿瘤的患病率和死亡率中排名第四[1]。在发达国家,该病的发病率呈下降趋势[1, 2]。在俄罗斯,宫颈癌一直在癌症发病率结构中排名第五,在癌症死亡率结构中排名第十。与此同时,大多数新确诊病例都是育龄妇女(40-49 岁)。在过去十年中,这类患者的人数增加了 10%[3]。
根据 2011 年进行的一项荟萃分析,与人类乳头瘤病毒(HPV)16、18、31 型及其他类型相关的 宫颈癌病例数量有所增加。因此,在宫颈鳞状细胞癌(90% 的病例与 人类乳头瘤病毒 相关)中,16 型最为常见(占 59.3%)[4]。第二种最常见的宫颈癌组织学变异是腺癌(腺癌),75%的病例与 人类乳头瘤病毒 相关,根据国家不同,18 型或 16 型占主导地位。
在所有 人类乳头瘤病毒 阳性的 腺癌中,有 36.8% 检测出 人类乳头瘤病毒 18 型[5,6]。其他组织学类型的恶性肿瘤确诊率不超过 1%[7,8]。腺癌的组织学亚型具有显著的异质性。腺癌与人类乳头瘤病毒之间的关联是2018年新病理分类IE宫颈癌(国际宫颈内膜腺癌标准与分类)的基础。人类乳头瘤病毒相关的腺癌包括正常型、绒毛腺癌、粘液腺癌、肠癌、指状腺癌和人类乳头瘤病毒相关腺癌,没有进一步的具体说明。不依赖于 人类乳头瘤病毒 的 腺癌占 15-20%,包括胃癌、轻细胞癌、间质细胞癌、浆液性癌、子宫内膜样癌亚型,以及无进一步分类的腺癌[9,10]。
根据临床特征、肿瘤的不同生物学行为、不同的预后和对治疗的反应,将宫颈腺癌分为不同的组别(人类乳头瘤病毒相关组和独立组)。典型变异型是最常见的 人类乳头瘤病毒 相关性宫颈内膜腺癌,约占所有宫颈内膜腺癌的 75%[10]。粘液型宫颈内膜腺癌约占所有 人类乳头瘤病毒 相关宫颈内膜腺癌的 10%[9,11]。子宫内膜样型宫颈腺癌也很少见。根据严格的诊断标准,它只占所有 腺癌的不到 1%,而且是在子宫内膜异位症的背景下发生的 [9,11]。
由于开展了 宫颈癌筛查和预防工作,子宫颈浸润性鳞状细胞癌的发病率和死亡率不断下降。与此同时,近几十年来,腺癌的发病率从 5%增至 20% [4、10、12]。除了诊断困难外,腺癌的特点还包括病程更具侵袭性、早期转移、对放射和药物治疗的敏感性较低,是肿瘤妇科实践中的一个严重问题 [13-15]。腺癌在定位和病程上的特殊性以及明显的诊断问题导致了一种自然的结果,表现为在晚期发现肿瘤过程、高复发率和高死亡率[4, 12]。因此,成功治疗的基石是改进诊断措施和形成早期诊断这种疾病的算法。
目前,根据2019年国际妇产科联合会(FIGO)的分类,IA2、IB1和IIA1期被归为宫颈癌的局部形式,IB2和IIA2-IVA期被认为是局部晚期,有远处转移的肿瘤对应于肿瘤发生的晚期(IVB)[16]。根据2018年修订的FIGO分类,宫颈癌的临床分期,尤其是腺癌的临床分期,是建立在全面检查的基础上的,包括病史数据、体格检查、形态学验证以及放射诊断方法的结果:磁共振成像(MRI)、超声波、计算机断层扫描和正电子发射计算机断层扫描。首次确诊疾病的正确临床分期对进一步治疗的成功和预后具有决定性影响 [7,16]。局部 宫颈癌的分期基于肿瘤的大小,而对于已扩散至阴道、宫旁、输尿管和邻近器官的局部晚期肿瘤,宫颈原发部位的大小并不重要。虽然 宫颈癌分期考虑了原发肿瘤的大小,但 FIGO 最近的一份报告提到,宫颈基底层厚度超过 50%的浸润深度和基底层外环受累是预后不良的因素,会增加复发率[16]。
对于不是从腺鳞交界处(如宫颈鳞状细胞癌),而是从宫颈管深部隐窝处发展而来的 腺癌,应该指出的是,这一特点反映在肿瘤的生长类型上,即主要是内生型肿瘤,这与缺乏早期临床表现和肿瘤发现较晚有关。肿瘤发生在宫颈内口的深部,靠近宫颈咽部内侧,导致肿瘤同时向邻近的子宫峡部和子宫内膜扩散,并浸润宫颈基质和子宫肌层,模仿子宫内膜癌。当肿瘤在子宫体和宫颈同时受累的阶段进行成像(超声波、磁共振成像和计算机断层扫描)时,原发肿瘤病理鉴定和分期就变得极为困难。根据 FIGO 分级,在 宫颈癌中,肿瘤向子宫体的扩散不影响疾病的分期,而子宫内膜癌的宫颈受累则会使肿瘤从 T1 期转为 T2 期,这对治疗方法的选择和预后有很大影响。组织学和免疫组化检查将是这些病例最终诊断的关键检查。用于鉴别诊断的免疫组化标记为 p16 蛋白、雌激素和孕激素受体以及 p53 蛋白[17]。p16 蛋白阳性染色在典型类型的 人类乳头瘤病毒 相关宫颈内膜腺癌中更为典型,而雌激素和/或孕激素受体阳性反应在子宫内膜样内膜腺癌中更为常见,但在 腺癌中也可观察到部分阳性反应[17]。2022 年,J.Y. Song 领导的韩国研究人员利用人工智能进行了一项研究,训练人工智能来区分 宫颈癌和子宫体癌的不同亚型,结果表明所提出的算法具有很高的信息量(AUC--曲线下面积--S宫颈癌为 0.977,子宫内膜癌(EC)为 0.944,宫颈腺癌和子宫体癌的区分为 0.939)[18]。
2020 年的一项荟萃分析研究了不同成像模 式(磁共振成像、超声波、计算机断层扫描、正电子发射断层扫描)在评估新诊断 宫颈癌患者局部肿瘤扩散和淋巴结转移方面的诊断性能,结果显示,磁共振成像对 宫颈癌局部扩散的敏感性和特异性最高。要检测淋巴结转移,上述所有方法都有很高的特异性[19]。根据包括国内研究(N.A. Rubtsova 等人的研究)在内的多项研究数据,磁共振成像在确定浸润性宫颈癌分期方面的总体准确率为 77-90%[20,21]。磁共振成像对软组织有很好的分辨能力,能更准确地确定肿瘤的浸润深度和术前大小,特别是在 T2 加权图像上的可视化。然而,磁共振成像在评估宫旁侵犯方面的信息量至今仍存在争议,其敏感性较低(约 73%-76%),但假阳性率较高[22, 23]。利用 磁共振成像研究宫颈内膜腺癌可视化特性的研究很少。
目的
根据 T 标准确定 磁共振成像在对 宫颈癌进行分期时的诊断信息量,以及在评估宫颈内膜腺癌对宫颈基质的侵袭深度时的诊断信息量;阐明子宫腺癌的符号学特征和肿瘤生长特征。
材料和方法
研究材料 研究设计
本研究是一项单中心、回顾性、选择性研究。研究纳入了2020年至2023年期间在Russian Scientific Center of Rentgenology and Radiology接受评估和治疗的123名确诊为宫颈癌(C53)的女性患者,以确定第一阶段工作中腺癌发病率的趋势。
经组织学证实患有宫颈癌的患者被纳入研究范围。对腺癌患者进行了详细分析:我们分析了22名(18%)这种组织学变异癌症患者的检查结果。腺癌患者的平均年龄为56岁(最小35岁,最大74岁)。数据分析排除了鳞状细胞癌患者。
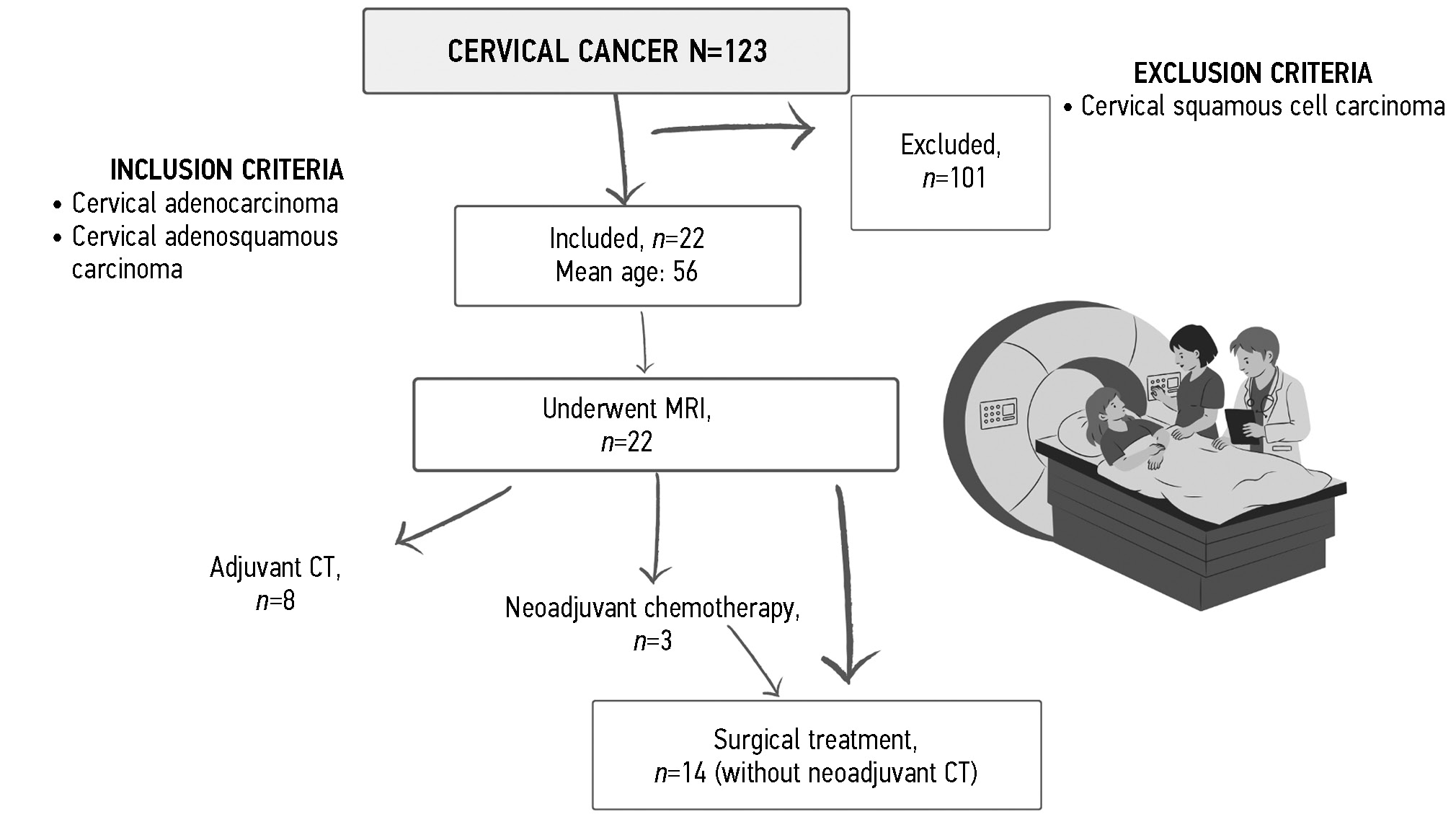
研究设计如图1所示。根据肿瘤组织学类型和分化程度划分的患者分布情况见表 1。根据国际妇产科医师联合会(FIGO)的分类,按疾病分期划分的患者分布情况见表 2。
图 1. 研究设计。MRI:磁共振成像;CT:化疗;CС:宫颈癌。
表 1. 根据肿瘤组织学类型和分化程度划分的患者分布情况
组织学类型 | 患者人数(n=22) | |
宫颈内膜腺癌 | 高度差异化 | 7 |
中度分化 | 4 | |
低度分化 | 2 | |
浆液性腺癌 | 3 | |
子宫内膜样腺癌 | 5 | |
腺鳞癌 | 1 | |
表 2. 根据国际妇产科联合会的疾病分期,患者的分布情况
阶段 | 患者人数(n=22) |
原位癌 | 2 |
IB | 4 |
IB1 | 3 |
IB2 | 1 |
IIA | 1 |
IIB | 2 |
IIIB | 1 |
IIIC | 1 |
IIIC1 | 3 |
IV | 2 |
IVB | 2 |
研究方法
妇产科医生对 123 名妇女进行了检查。患者检查包括收集主诉、病史、双手直肠阴道检查、阴道和宫颈镜检查、宫颈和宫颈管刮片细胞学检查以及宫颈活检组织学检查。
22名(18%)患者在磁场强度为1.5特斯拉的断层扫描上接受了盆腔器官多参数磁共振成像检查。该研究是在患者仰卧位使用柔性身体线圈进行的。多参数 磁共振成像方案包括 T1 和 T2 加权图像(WI)、STIR、b 因子为 0、800 和 1000 c/mm2 的弥散加权图像以及钆盐动态对比增强,符合 ESUR(欧洲泌尿生殖放射学会)方案对 磁共振成像的要求[24]。根据欧洲泌尿生殖放射学会的建议,b因子为1000 c/mm2足以诊断常规子宫病变。
T2-WI的磁共振成像数据评估了肿瘤侵入宫颈基质的大小和深度(测量示例如图2所示)、是否存在宫旁侵犯、咽内病变、子宫峡部病变、子宫内膜病变、子宫附件病变、淋巴结病变以及肿瘤中是否存在 “进食梗”。供血蒂 “被定义为肿瘤与子宫壁交界处的区域,根据我们的想法,肿瘤来自该区域,在动态对比增强的动脉和静脉阶段,可以看到肿瘤供血血管的结构。
14名患者(64%)接受了手术治疗,包括切除附件子宫和盆腔淋巴结切除术。3名患者(21%)在新辅助多化疗后进行了手术治疗。病理形态学专家分析了 11 名患者的 腺癌侵袭宫颈基质的大小和深度,这些患者的抗肿瘤治疗都是从手术开始的。我们还对取出的制备物进行了评估,包括肿瘤对宫颈基质的侵犯、肿瘤对阴道的侵犯、宫旁侵犯、子宫体损害(对子宫肌层的侵犯深度)、子宫附属物和淋巴结的损害。我们比较了 11 例患者在治疗前 1 个月内进行的术前 磁共振成像数据和术后病理形态学研究数据。8名患者(36%)接受了包括化疗和联合放疗在内的综合治疗。
研究结果的统计处理使用 Microsoft Excel(美国微软公司)和 JavaStat 软件应用程序进行。
伦理审查
Russian Scientific Center of Rentgenology and Radiology 独立伦理委员会的结论(2023 年 9 月 29 日第 9 次会议记录):“磁共振成像在诊断宫颈内膜腺癌方面的可能性和局限性 ”科学研究不需要独立伦理委员会的意见。
研究结果
在我们的研究中,2020-2023年间确诊的浸润性宫颈癌患者中有18%(123例中有22例)检测到了宫颈癌。
有 5 名患者(23%)是在常规妇科检查中偶然发现 腺癌的。13 名患者(59%)的生殖道有血性分泌物,2 名患者(9%)有浆液性分泌物,6 名患者(27%)表现为下腹部牵拉痛,1 名患者(5%)排尿时疼痛。
8名患者(36%)有宫颈背景疾病(外翻、糜烂、慢性宫颈炎)病史,3名患者(14%)有宫颈发育不良(I-III级)。有 11 名(50%)患者在确诊 腺癌之前未发现宫颈病变。妇科检查数据见表 3。
表3。 妇科检查结果
妇科检查结果 | 是 n (%) | 否 n (%) |
宫颈病变 | 10 (45) | 12 (55) |
延伸至子宫旁(临床上称为 “穹隆触痛”) | 11 (50) | 11 (50) |
扩散到阴道 | 11 (50) | 11 (50) |
根据磁共振成像数据(9%),肿瘤未在2名女性中可视化。 22例患者的磁共振成像数据的结果见表。 4. 在T2-WI上测量的平均肿瘤体积为25cm3(最小1cm3,最大71cm3)。 在第一阶段接受手术治疗的11名患者中,磁共振成像在评估腺癌局部患病率(根据T标准)方面的诊断信息性的计算显示出以下结果:
- 灵敏度 - 77.78%(95% 置信区间 - CI - 39.99%-97.19%);
- 特异性 - 50.00% (95% 置信区间 - 1.26%~98.74%);
- 阳性结果的预测值为 87.50%(95% 置信区间 - CI 62.64%~96.69%);
- 阴性结果的预测值 - 33.33% (95% CI 7.30%~76.04%);
- 准确率为 72.73% (95% CI 39.03%~93.98%)。
表4。 磁共振成像数据的结果
参数 | 是 n (%) | 否 n (%) |
宫颈基质受侵 | 17 (77) | 5 (23) |
副肾侵犯 | 9 (41) | 13 (59) |
子宫内咽部受损 | 12 (55) | 10 (45) |
峡部病变 | 9 (41) | 13 (59) |
子宫内膜损伤 | 6 (27) | 16 (73) |
子宫附件受损 | 4 (18) | 18 (82) |
淋巴结受累 | 9 (41) | 13 (59) |
存在中央供血血管 | 9 (41) | 13 (59) |
在8名患者(40%)中,宫颈肿瘤距离外咽有一段距离,平均距离为11毫米(最小4毫米,最大18毫米)。 因此,由于外咽完好无损,因此在妇科检查期间,肿瘤在视觉上无法进入。 在9名患者(45%)中注意到子宫颈阴道部分的浸润。 肿瘤中测量的扩散系数(MDC)的平均值为0.833×10-3毫米/秒(最小0.440×10-3毫米/秒,最大0.1282×10-3毫米/秒)。
我们确定了宫颈基质中肿瘤生长的两种形式:最常见的是内生性肿瘤(75%,n=15),其特点是宫颈弥漫性增大和桶状转变(图 3);外生性肿瘤在我们的研究中占 25%(n=5)。外生性肿瘤多位于宫颈阴道部,肿瘤块脱垂至阴道或宫颈管腔内(见图 3)。外生性肿瘤表现为不同的腺癌组织学亚型:
- 低度和中度分化的典型宫颈内膜腺癌(2 项观察结果);
- 低分化浆液性腺癌(1 例);
- 腺细胞癌(1 例);
- 子宫内膜样宫颈内膜腺癌(1 例)。
图3。 宫颈腺癌生长的形式。 上排图像由矢状平面中的T2加权图像表示,下排图像由轴向投影表示。
具有内生生长形式的肿瘤也具有高度多样性的组织学类型和分化。我们没有发现肿瘤生长形式与其组织学亚型之间有任何关联。
妇科医生和放射科医生在检测子宫腺癌的诊断过程中,关键是对原发肿瘤的位置进行鉴别诊断:子宫的影像学变化是过渡到子宫颈的子宫内膜癌,还是过渡到子宫内膜的 腺癌。所有有争议的诊断点,即肿瘤主要位于宫腔的诊断点,均由病理形态学专家进行了复查,所有患者都被确认为宫颈内腺癌,即宫颈肿瘤。因此,根据 磁共振成像和病理形态学检查显示的肿瘤主要位置,我们回顾性地指出并区分了四种类型的肿 瘤(图 4):
1) 肿瘤肿块主要位于宫颈(13 个,占 65%);
2)肿瘤肿块主要位于子宫体(2 例,10%);
3)宫颈内膜和子宫内膜的病变相同(2 例,10%);
4)经病理形态学和免疫组化研究证实,宫颈发生孤立病变,但宫腔(子宫内膜)存在 腺癌脱落 灶(3 例,15%)。
图4。 宫颈腺癌的宏观结构类型,矢状面 T2 加权图像。
值得注意的是,2、3 和 4 型肿瘤在 磁共振成像上被描述为子宫体癌,只有病理形态学检查才确认为原发性 腺癌。
根据病理形态学检查结果,腺癌侵入宫颈基质的平均深度为 8.2 毫米(min 2 mm, max 15 mm)。手术材料数据结果见表 5。
表5。 来自14名患者的手术材料的数据的结果
参数 | 是 n (%) | 否 n (%) |
宫颈基质受侵 | 13 (93) | 1 (7) |
副肾侵犯 | 0 (0) | 14 (100) |
子宫内膜损伤 | 4 (29) | 10 (71) |
子宫附件受损 | 2 (14) | 12 (86) |
淋巴结受累 | 2 (14) | 12 (86) |
对11例未接受新辅助化疗的患者进行了分析,比较了磁共振成像和术后病理形态学检查的侵袭深度(表6)。根据 磁共振成像,有 2 名患者(18%)在评估肿瘤侵入宫颈基质的深度时出现假阳性结果(过度诊断),1 名患者(9%)出现假阴性结果(过度诊断)。8名患者(73%)的 磁共振成像和病理形态学结果一致。由于磁共振成像切片的厚度(在T2-VI上进行测量)为4mm,因此将磁共振成像和病理形态数据之间的差异视为该方法的错误。
表6。 磁共振成像在宫颈腺癌诊断中的信息价值数据
参数 | 敏感性 | 特异性 | PPV | NPV |
评估肿瘤侵入宫颈基质的深度 | 85.7% (ДИ 0.757~0.993) | 33.3% (ДИ 0.018~0.0648) | 75% (ДИ 0.673~0.883) | 50% (ДИ 0.027~0.972) |
T 标准肿瘤分期评估 | 77.78% (ДИ 39.99~97.19) | 50.00% (ДИ 1.26~98.74) | 87.50% (ДИ 62.64~96.69) | 33.33% (ДИ 7.30~76.04) |
注。CI:95% 置信区间;PPV:阳性结果的预测值;NPV:阴性结果的预测值。
因此,磁共振成像在评估 腺癌侵袭宫颈基质的深度方面的信息量为:
- 几率比 - 3.500 (95% CI 0.145~84.694);
- 敏感性-85.7%(95% CI 0.757~0.993);
- 特异性 - 33.3% (95% CI 0.018~0.0648);
- 阳性结果的预测值- 75% (95% CI 0.673~0.883);
- 阴性结果的预测值为 50%(95% CI 0.027~0.972)。
在分析进入子宫内膜的 腺癌脱落物时,我们注意到它们的局部侵袭性生长模式,形成了 “进食干”,并能看到进食血管(41%)(图 5)。
图5。 宫颈癌IIA 期(T2aNoMo 宫颈癌IIA 期(T2aNoMo),中度分化腺癌,存在淋巴管侵犯。盆腔磁共振成像,肿瘤位于宫颈,并有一个向子宫内膜脱落的病灶:
a — 综合图像,从左到右,从上到下:T2 加权图像,T1FS 加权图像,对比度增强(动态对比度增强的动脉期),弥散加权图像,测量弥散系数图(MCD)。还标记了肿瘤(脱落灶,箭头)、肿瘤 “茎 ”区域和进食血管(虚线箭头)。在动态对比增强的动脉期,可确定肿瘤 “进食干 ”的子宫内膜基底层和血管的顺磁积聚情况;b — 矢状面,T2 加权图 像(左)和 T1FS+C 图像(右)。标记:原发肿瘤(箭头),子宫体中的脱落(星形),脱落部位的血管(虚线箭头);c — 手术材料的组织学检查,苏木精和伊红染色,×10;d — 免疫组化研究,p16 表达。
病理形态学研究结论:中度分化的宫颈内膜腺癌。肿瘤侵犯宫颈基质,深度达 1.3 cm(过渡区宫颈壁厚度的 2/3)。肿瘤侵犯子宫肌层(深度为 0.6 cm,占子宫体壁厚度的 1/3)和子宫内膜。宫颈的阴道部分由多层鳞状上皮覆盖。
讨论
在我们的研究中,宫颈腺癌和混合性腺鳞癌病变在确诊为 宫颈癌的患者中占 18%(123 例中有 22 例)。这些数据证实了国外研究人员(Z.F. Chan 等人,F. Islami 等人)和俄罗斯研究人员(O.G. Grigoruk 等人)[4, 10, 12]所指出的 腺癌发病率的相对增长。
我们认为,腺癌发病率的相对增加与缺乏明确的疾病征兆(在我们的研究中,48%的患者在妇科检查中没有可见的宫颈变化,核磁共振成像显示咽部外部完好无损)以及缺乏有效的筛查策略有 关。A. Castanon 等人基于人群的研究发现,现有的细胞学筛查在诊断癌前 腺癌(宫颈原位腺癌或高分化腺上皮内瘤变)方面效果不佳,但有助于在早期阶段(IA 期)发现它们。这是因为 腺癌主要在宫颈隐窝内的宫颈管内发育,因此这使得难以提取含有非典型细胞的物质[25]。F. Islami 等人的一项研究显示,由于 宫颈癌筛查工作的改进,腺癌原位癌和浸润癌有所增加,主要发生在年轻女性(35-54 岁)中 [12]。Z.F.Chan等人的研究以及D.F.Chan等人的研究也获得了类似的数据。Chan等人和D.H. Suh及合著者的研究中也获得了类似的数据[4, 26]。
说到癌前疾病,宫颈内膜腺体增生(包括非典型原位腺癌)是胃型宫颈内膜腺癌的前兆[27, 28]。在我们的研究中,50%的患者有宫颈疾病(慢性宫颈炎等)背景,1 例患者因重度发育不良(CIN III)多次宫颈锥切术,观察到原位非典型腺癌。10例患者出现子宫内膜异位症。
尽管磁共振成像在检测和评估宫颈癌患病率方面具有很高的信息价值,但在我们的研究中,有2例(9%)经组织学证实为腺癌的患者在多参数成像扫描中未发现肿瘤。我们认为这是由于肿瘤体积小及其沿宫颈管生长的扩散性质,以及该方法的技术局限性所致。
在比较磁共振成像数据和病理形态学检查时,我们获得了良好的结果:
- 磁共振成像评估宫颈基质浸润深度的总体准确率为 70%,灵敏度为 87.5%;
- 评估肿瘤扩散(根据 T 标准)的准确性为 72.3%,敏感性为 77.8%。
在我们的研究中,在诊断率低的病例(n=1)中,差异是由于肿瘤衰变导致 T2-WI 上的磁共振信号不均匀造成的,在测量肿瘤大小时没有考虑到这一点。
T2-WI信号不均匀,在测量肿瘤大小时没有考虑到这一点。在过度诊断的病例中(n=2),差异是由于在混合性腺肌病和粘膜下位置的子宫肌瘤背景下子宫明显变形造成的。
尽管 磁共振成像有很多优点,但国外的研究也表明,临床分期与手术发现之间经常存在差异,有低估疾病分期的趋势,分期越高,这种差异越明显。对于 腺癌而言,这种差异甚至更为明显[29, 30]。
除了对各种组织学形式的宫颈癌患病率的评估存在客观误差外,宫颈侵入性操作后或大肿瘤腐烂引起的并发炎症浸润也会导致过度诊断。宫颈阴道部(包括咽外口周围)潴留囊肿的积聚也会导致误诊,使得评估上皮覆盖层和宫颈下基质的结构变得困难[31]。
回到 腺癌脱落到子宫内膜的话题,我们注意到脱落灶在子宫内膜生长的局部侵袭性,以及一些 腺癌在宫颈峡部和宫颈管中三分之一(c/3)的局部生长,并形成 “进食干 ”和可见进食血管(41%)。这是第一次描述这个特性,以前的文章中没有进行过分析。我们认为,通过核磁共振成像观察到的肿瘤新血管生成情况表明,肿瘤生长具有侵袭性,淋巴管侵犯(LVI+)的可能性很高,淋巴结转移的可能性增加,预后不良。然而,由于观察的数量较少,且缺乏与病理形态学数据的比较(由于是回顾性数据分析),所发现的特征更多的是观察性质的,需要进一步的科学研究。
许多研究人员都注意到 腺癌能使癌细胞脱落到子宫内膜,他们用 “种子和土壤 ”理论来解释这一现象--部分癌细胞从原发肿瘤病灶脱落,迁移到子宫腔并植入子宫内膜[32]。我们认为,子宫肌层与子宫颈相比有更好的血液供应,而子宫颈的基质主要是纤维组织,这就解释了细胞植入后随之发育出进血血管以及脱落灶主要在子宫内生长的事实。
毫无疑问,与标准 磁共振成像模式相比,使用弥散加权图像和分析 ICD 地图可提高该方法的效率[33, 34]。F.Kuang 等人的研究表明,扩散系数 值是区分 宫颈癌与正常宫颈的可靠标志,诊断准确率高(扩散系数 的 宫颈癌值明显低于正常宫颈:0.81±0.13×10-3 mm2/sec vs. 1.41±0.10×10-3mm2/sec)。
扩散系数 值也可用于指示 宫颈癌的分化程度和组织学类型,尽管在数值上存在一些重叠。值得注意的是,扩散系数 值越高,肿瘤的分化程度越高[34, 35]。在我们的研究中,在选定的感兴趣区(ROI)测量的肿瘤平均 扩散系数 为 0.833×10-3 mm2/sec(min 440×10-3 mm2/sec,max 1282×10-3 mm2/sec),与文献数据基本吻合。
有证据表明,宫颈鳞状细胞癌和 腺癌的 扩散系数 值存在差异:鳞状细胞癌的 扩散系数 值明显较低[36]。
Y.-C.Lin等人的一项研究显示,在宫颈鳞状细胞癌和腺癌的情况下,扩散系数值明显较低[36]。Lin等人的研究表明,在形态不明确的情况下,肿瘤的扩散系数值可用于区分其组织学归属:子宫内膜癌的平均扩散系数值(0.766×10-3 mm2/sec)明显低于СС(0.969×10-3 mm2/sec)。还有人指出,子宫内膜癌的特点是肿瘤在宫颈中主要呈纵向生长,而 СС 的生长模式主要是椭圆形[37, 38]。E.V. Tarachkova等人研究了 腺癌与宫颈鳞状细胞癌之间的符号学差异。在 90 例经组织学验证的 宫颈癌患者中发现,与鳞状细胞癌相比,腺癌在 T2-WI 上的信号强度更高,异质性更小,脂肪组织的信号受到抑制[39]。
根据 磁共振成像对子宫腺癌进行鉴别诊断的关键点是原发肿瘤的定位。例如,在大多数情况下,伴有子宫内膜病变的子宫内膜腺癌和扩散到子宫颈的子宫内膜腺癌在信号特征上是无法区分的。而且,正如本研究所示,我们绝对不能仅仅依赖于对较大肿瘤体积的定位分析。
在我们的研究中,经组织学证实的宫颈内膜 腺癌病例中只有 65%(20 例中有 13 例)只位于宫颈。在 35% 的病例中(20 例中有 7 例),肿瘤与子宫内膜癌相似,在子宫腔和宫颈管内都发现了肿瘤块。在宫颈内膜腺癌病灶脱落到子宫内膜的病例中(20 例中有 3 例,占 15%),有 2 例患者子宫内膜的肿瘤种植大小超过了原发宫颈肿瘤的大 小(见图 5,d)。2009 年,Johns Hopkins University 的研究人员 A. Yemelyanova 等人也注意到了 腺癌增长的类似趋势。科学家们详细分析了 10 例子宫体和宫颈同时发生病变的 腺癌,得出的结论是,子宫内膜样腺癌往往在宫颈发生轻微病变的情况下最终成为 腺癌[40]。
目前,病理形态学和免疫组化研究是鉴别诊断复杂宫颈腺癌和子宫体癌的客观工具。同时,需要注意的是,即使是病理形态学和免疫组化研究,也不能对 100%的病例做出明确诊断,因为有些子宫内膜样腺癌很难与宫颈内膜 腺癌区分开来:后者的 腺癌有可能被 p16、雌激素和孕激素受体部分染色[17]。对 宫颈癌子宫内膜样腺癌的诊断应慎重。在子宫颈和子宫体的子宫内膜样腺癌中,免疫组织化学特征通常可能没有差异(41)。如果子宫体和宫颈同时发生病变,应排除子宫内膜腺癌和卵巢腺癌的播散型变异,并将临床和诊断数据联系起来,因为肿瘤的原发部位对治疗策略和化疗方案的选择至关重要。根据 IECC,“子宫内膜样宫颈腺癌”一词应与恶性程度低的子宫内膜样腺体肿瘤相对应,并通过伴发病变(鳞状细胞增生或子宫内膜异位症)来确认[41]。
因此,目前复杂宫颈和子宫颈腺癌的鉴别诊断应基于对患者的全面检查,包括病史资料、体格检查、形态学检查、免疫组化检查和 磁共振成像结果。
结论
由于肿瘤呈浸润性生长,肿瘤常位于宫颈管上部和宫颈粘膜峡部区域,宫颈内膜异位症在晚期才被诊断出来,这同样是由于在进行 腺癌检查时难以收集到足够的细胞学材料,以及在妇科检查时无法观察到宫颈的变化,因而无法及时发现肿瘤的存在。宫颈内膜 腺癌诊断较晚,导致发现时已是局部扩散的过程,子宫内膜经常直接或转移性病变,类似于原发性子宫内膜癌。
本研究表明,核磁共振成像是一种很好的工具,在检测子宫肿瘤病理方面具有很高的诊断信息率。通过 磁共振成像数据分析确定的 腺癌肿瘤生长的 4 种宏观结构类型表明,肿瘤生长具有局部侵袭性,子宫内膜脱落的发生率较高,并且还将有助于放射科医生构建描述性图片,包括经核实的 腺癌,从而更好地制定患者的治疗方案。
磁共振成像在检测小型 腺癌肿瘤方面存在局限性,这是因为肿瘤的生长主要是浸润性和扩散性的,而不会导致子宫增大或宫颈内膜信号特征发生变化。同时,根据 磁共振成像的数据,宫颈管的不均匀增大和增生使得怀疑肿瘤病变,并及时将妇女转诊至妇科医生成为可能。由于对原位 腺癌患者的管理缺乏明确的建议,因此 磁共振成像是监测这类患者的首选方法。应将体格检查(妇科检查)、仪器检查(磁共振成像)和形态学诊断方法结合起来,以确定子宫腺癌的主要特征。
ADDITIONAL INFORMATION
Funding source. This study was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work. I.B. Antonova — concept and design of the study, agreement on the final version of the text; S.P. Aksenova — writing the text of the article, analyzing the results, preparing illustrations, editing the manuscript; N.V. Nudnov — concept and design of the study, approval of the final version of the text; A.V. Krieger — writing the text of the article, analyzing the results, editing the manuscript.
作者简介
Irina B. Antonova
Russian Scientific Center of Roentgenoradiology
Email: Iran24@yandex.ru
ORCID iD: 0000-0003-2668-2110
SPIN 代码: 6247-3917
MD, Dr. Sci. (Medicine)
俄罗斯联邦, MoscowSvetlana P. Aksenova
Russian Scientific Center of Roentgenoradiology
编辑信件的主要联系方式.
Email: fabella@mail.ru
ORCID iD: 0000-0003-2552-5754
SPIN 代码: 4858-4627
MD, Cand. Sci. (Medicine)
俄罗斯联邦, MoscowNikolay V. Nudnov
Russian Scientific Center of Roentgenoradiology; Peoples’ Friendship University of Russia; Russian Medical Academy of Continuous Professional Education
Email: nvnudnov@rncrr.ru
ORCID iD: 0000-0001-5994-0468
SPIN 代码: 3018-2527
MD, Dr. Sci. (Medicine), Professor
俄罗斯联邦, Moscow; Moscow; MoscowAnna V. Kriger
Russian Scientific Center of Roentgenoradiology
Email: dr.akriger@gmail.com
ORCID iD: 0000-0001-6823-2658
SPIN 代码: 2338-6164
俄罗斯联邦, Moscow
参考
- Global health estimates: Leading causes of death. Cause-specific mortality, 2000–2019. World Health Organization; c2024. Available from: https://www.who.int/data/gho/data/themes/mortality-and-global-health-estimates/ghe-leading-causes-of-death
- Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209–249. doi: 10.3322/caac.21660
- Kaprin AD, Starinskii VV, Shakhzadova AO, editors. State of oncological care for the Russian population in 2021. Moscow: MNIOI im. P.A. Gertsena — filial FGBU “NMITs radiologii” Minzdrava Rossii; 2022. (In Russ).
- Chan ZF, Zhi KZ. Prevalence and attribution of high-risk HPV in different histological types of cervical cancer. Zhonghua Fu Chan Ke Za Zhi. 2019;54(5):293–300. doi: 10.3760/cma.j.issn.0529-567x.2019.05.002
- Li N, Franceschi S, Howell-Jones R, et al. Human papillomavirus type distribution in 30,848 invasive cervical cancers worldwide: Variation by geographical region, histological type and year of publication. Int J Cancer. 2011;128(4):927–935. doi: 10.1002/ijc.25396
- Nicolás I, Marimon L, Barnadas E, et al. HPV-negative tumors of the uterine cervix. Mod Pathol. 2019;32(8):1189–1196. doi: 10.1038/s41379-019-0249-1
- NCCN guidelines panel. Cervical Cancer. Version 1.2021 PA: National Comprehensive Cancer Network; c2024. Available from: https://www.nccn.org/guidelines/guidelines-detail?category=1&id=1426
- Cervical cancer. Clinical guidelines. ID 537. Approved by the Scientific and Practical Council of the Ministry of Health of the Russian Federation. 2020. Available from: https://cr.minzdrav.gov.ru/recomend/537_1 (In Russ).
- Stolnicu S, Barsan I, Hoang L, et al. International Endocervical Adenocarcinoma Criteria and Classification (IECC): A New Pathogenetic Classification for Invasive Adenocarcinomas of the Endocervix. Am J Surg Pathol. 2018;42(2):214–226. doi: 10.1097/PAS.0000000000000986
- Grigoruk OG, Moskvina TA, Tsoy DA, et al. Endocervical adenocarcinomas. Cytological, histological, and molecular diagnostics. Tumors of female reproductive system. 2022;18(2):109–118. doi: 10.17650/1994-4098-2022-18-2-109-118
- World Health Organization. Female Genital Tumors. In: WHO Classification of Tumours, 5th Edition, Volume 4. International Agency for Research on Cancer; 2020.
- Islami F, Fedewa SA, Jemal A. Trends in cervical cancer incidence rates byage, race/ethnicity, histological subtype, and stage at diagnosis in the United States. Preventive Medicine. 2019;123:316–323. doi: 10.1016/j.ypmed.2019.04.010
- Hu J, Zheng P, Zhu L. Comparison of clinical pathological characteristics in ovarian preserving patients with stage IB1 cervical adenocarcinoma and squamous cell carcinoma. Journal of Peking University (Health Sciences). 2016;48(5):783–787. doi: 10.3969/j.issn.1671-167X.2016.05.006
- Hu K, Wang W, Liu X, et al. Comparison of treatment outcomes between squamous cell carcinoma and adenocarcinoma of cervix after definitive radiotherapy or concurrent chemoradiotherapy. Radiat Oncol. 2018;13(1):249. doi: 10.1186/s13014-018-1197-5
- Fan Y, Wang M, Mu Y, et al. Ovarian metastasis in women with cervical carcinoma in stages IA to IIB. Medicine (Baltimore). 2020;99(31):e21146. doi: 10.1097/MD.0000000000021146
- Bhatla N, Aoki D, Sharma DN, et al. Cancer of the cervix uteri: 2021 update. Int J Gynaecol Obstet. 2021;155 Suppl. 1:28–44. doi: 10.1002/ijgo.13865
- Stewart CJR, Crum CP, McCluggage WG, et al. Guidelines to Aid in the Distinction of Endometrial and Endocervical Carcinomas, and the Distinction of Independent Primary Carcinomas of the Endometrium and Adnexa From Metastatic Spread Between These and Other Sites. Int J Gynecol Pathol. 2019;38 Suppl. 1(1 Suppl. 1):S75–S92. doi: 10.1097/PGP.0000000000000553
- Song J, Im S, Lee SH, Jang HJ. Deep Learning-Based Classification of Uterine Cervical and Endometrial Cancer Subtypes from Whole-Slide Histopathology Images. Diagnostics (Basel). 2022;12(11):2623. doi: 10.3390/diagnostics12112623
- Woo S, Atun R, Ward ZJ, et al. Diagnostic performance of conventional and advanced imaging modalities for assessing newly diagnosed cervical cancer: systematic review and meta-analysis. Eur Radiol. 2020;30(10):5560–5577. doi: 10.1007/s00330-020-06909-3
- Merz J, Bossart M, Bamberg F, et al. Revised FIGO Staging for Cervical Cancer — A New Role for MRI. Rofo. 2020;192(10):937–944. doi: 10.1055/a-1198-5729
- Rubtsova NA, Novikova EG, Sinitsyn VE. MRI opportunities in cervical cancer local staging preoperative evaluation. Obstetrics, Gynecology and Reproduction. 2012;6(3):6–13. EDN: PUVJZT
- Balcacer P, Shergill A, Litkouhi B. MRI of cervical cancer with a surgical perspective: staging, prognostic implications and pitfalls. Abdom Radiol (NY). 2019;44(7):2557–2571. doi: 10.1007/s00261-019-01984-7
- Woo S, Suh CH, Kim SY, et al. Magnetic resonance imaging for detection of parametrial invasion in cervical cancer: An updated systematic review and meta-analysis of the literature between 2012 and 2016. European Radiology. 2018;28(2):530–541. doi: 10.1007/s00330-017-4958-x
- Alt CD, Bharwani N, Danza FM, et al. ESUR Quick Guide to Female Pelvis Imaging. ESUR, 2019. Available from: https://www.researchgate.net/publication/334725882_ESUR_Quick_Guide_to_Female_Pelvis_Imaging
- Castanon A, Landy R, Sasieni PD. Is cervical screening preventing adenocarcinoma and adenosquamous carcinoma of the cervix. Int J Cancer. 2016;139(5):1040–1045 doi: 10.1002/ijc.30152
- Suh DH, Ha HI, Lee YJ, et al. Incidence and treatment outcomes of uterine cervical cancer in Korea 1999–2018 from the national cancer registry. J Gynecol Oncol. 2023;34(2):e39. doi: 10.3802/jgo.2023.34.e39
- Miyamoto T, Kobara H, Shiozawa T. Biology and management of lobular endocervical glandular hyperplasia. J Obstet Gynaecol Res. 2022;48(12):3056–3067. doi: 10.1111/jog.15441
- Kerwin CM, Markese M, Moroney MR, et al. Adenocarcinoma of the uterine cervix, gastric-type (GAS): a review of the literature focused on pathology and multimodality imaging. Abdom Radiol (NY). 2023;48(2):713–723. doi: 10.1007/s00261-022-03724-w
- Marnitz S, Tsunoda AT, Martus P, et al. Surgical versus clinical staging prior to primary chemoradiation in patients with cervical cancer FIGO stages IIB–IVA: oncologic results of a prospective randomized international multicenter (Uterus-11) intergroup study. Int J Gynecol Cancer. 2020;30(12):1855–1861. doi: 10.1136/ijgc-2020-001973
- Akhavan S, Mousavi A, Sheikh Hassani S, et al. Evaluation of Cervical Cancer Staging Based on Magnetic Resonance Imaging in Comparison with Surgical Staging. Int J Cancer Manag. 2023;16(1):e126966. doi: 10.5812/ijcm-126966
- Trukhacheva NG, Frolova IG, Kolomiets LA, et al. Assessment of the extent of cervical cancer spread using magnetic resonance imaging. Siberian journal of oncology. 2015;(2):64–70. EDN: TSLSAD
- Horn LC, Höhn AK, Stark S, et al. Endocervical adenocarcinoma in situ (AIS) with ovarian and pulmonary involvement: report of a case and review of the literature suggesting a “seed and soil hypothesis”. J Cancer Res Clin Oncol. 2019;145(8):2061–2069. doi: 10.1007/s00432-019-02966-4
- Mao L, Zhang X, Chen T, et al. High-resolution reduced field-of-view diffusion-weighted magnetic resonance imaging in the diagnosis of cervical cancer. Quant Imaging Med Surg. 2023;13(6):3464–3476. doi: 10.21037/qims-22-579
- Kuang F, Ren J, Zhong Q, et al. The value of apparent diffusion coefficient in the assessment of cervical cancer. Eur Radiol. 2013;23(4):1050–1058. doi: 10.1007/s00330-012-2681-1
- Wang M, Perucho JAU, Chan Q. Diffusion Kurtosis Imaging in the Assessment of Cervical Carcinoma. Acad Radiol. 2020;27(5):E94–E101. doi: 10.1016/j.acra.2019.06.022
- Monist M, Lewkowicz D, Piętak P, et al. Synchronously occurring endometrioid carcinomas of the uterine corpus and uterine cervix preceded by different precancerous lesions: A case study and a literature review. Pathol Res Pract. 2023;245:154452. doi: 10.1016/j.prp.2023.154452
- Lin YC, Lin G, Chen YR, et al. Role of magnetic resonance imaging and apparent diffusion coefficient at 3T in distinguishing between adenocarcinoma of the uterine cervix and endometrium. Chang Gung Med J. 2011;34(1):93–100.
- Gui B, Lupinelli M, Russo L, et al. MRI in uterine cancers with uncertain origin: Endometrial or cervical? Radiological point of view with review of the literature. European journal of radiology. 2022;153:110357. doi: 10.1016/j.ejrad.2022.110357
- Tarachkova EV, Shorikov MA, Panov VO, et al. Possibilities of multiparametric MRI in the differential diagnosis of histological types of cervical cancer in the preoperative period. Tumors of female reproductive system. 2016;12(2):60–69. doi: 10.17650/1994-4098-2016-12-2-60-69
- Yemelyanova A, Vang R, Seidman JD, Gravitt PE, Ronnett BM. Endocervical adenocarcinomas with prominent endometrial or endomyometrial involvement simulating primary endometrial carcinomas: utility of HPV DNA detection and immunohistochemical expression of p16 and hormone receptors to confirm the cervical origin of the corpus tumor. Am J Surg Pathol. 2009;33(6):914–924. doi: 10.1097/PAS.0b013e3181971fdd
- Jain P, Aggarwal A, Ghasi RG, et al. Role of MRI in diagnosing the primary site of origin in indeterminate cases of uterocervical carcinomas: a systematic review and meta-analysis. Br J Radiol. 2022;95(1129):20210428. doi: 10.1259/bjr.20210428
补充文件